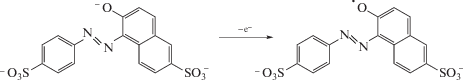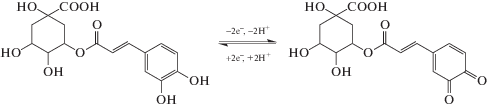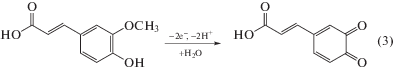Журнал аналитической химии, 2021, T. 76, № 3, стр. 268-278
Электрод на основе электрополимеризованного желтого “солнечного заката” для одновременного вольтамперометрического определения хлорогеновой и феруловой кислот
Г. К. Зиятдинова a, *, Е. В. Гусс a, Е. В. Морозова a, Г. К. Будников a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Ziyatdinovag@mail.ru
Поступила в редакцию 07.07.2020
После доработки 10.09.2020
Принята к публикации 14.09.2020
Аннотация
Разработан электрод на основе многостенных углеродных нанотрубок и электрополимеризованного желтого “солнечного заката” для одновременного вольтамперометрического определения хлорогеновой и феруловой кислот. Поли(желтый “солнечный закат”) получали потенциостатически в условиях хроноамперометрии. Варьирование рН фонового электролита, концентрации мономера и условий электролиза показало, что максимальная разность потенциалов окисления фенольных кислот (190 мВ) и высокие токи достигаются на покрытии, полученном в щелочной среде из 50 мкМ раствора мономера при потенциале 1.1 В в течение 30 с. Поли(желтый “солнечный закат”) состоит из сферических частиц и их агрегатов диаметром 26–75 нм, что приводит к увеличению эффективной площади поверхности электрода (44.0 ± 0.6 мм2 по сравнению с 26.1 ± 0.6 мм2 для стеклоуглеродного электрода, модифицированного углеродными нанотрубками). Данные спектроскопии электрохимического импеданса свидетельствуют об увеличении скорости переноса электрона на модифицированных электродах. На основе данных циклической вольтамперометрии установлено, что электроокисление фенольных кислот на модифицированном полимером электроде контролируется диффузией и протекает с участием двух электронов и двух протонов с образованием соответствующих о-хинонов. Диапазон определяемых содержаний составляет 0.10–4.0 мкМ для хлорогеновой кислоты и 0.5–4.0 мкМ для феруловой кислоты с пределами обнаружения 0.076 и 0.098 мкМ соответственно. Предложенный способ применен для определения кислот в кофе.
Фенольные кислоты – природные фенольные соединения, главными представителями которых являются гидроксибензойные и гидроксикоричные кислоты [1]. Они широко распространены в продуктах питания растительного происхождения. Так, гидроксикоричные кислоты являются основными фенольными кислотами кофе, яблок, голубики, винограда, а также зерновых продуктов (пшеничной, рисовой, овсяной муки) [1–3]. Исследования показывают, что употребление продуктов, богатых гидроксикоричными кислотами, благотворно влияет на здоровье человека, главным образом за счет проявляемых этими соединениями антиоксидантных и антибактериальных свойств [4, 5].
Среди гидроксикоричных кислот можно выделить хлорогеновую (5-кофеилхинную) и феруловую (3-метокси-4-гидроксикоричную) кислоты – основные фенольные антиоксиданты кофе [6]. Их количественное определение при совместном присутствии имеет значение для оценки антиоксидантных свойств кофе и поэтому представляет практический интерес.
Для одновременного определения гидроксикоричных кислот обычно применяют высокоэффективную жидкостную хроматографию с УФ-детектированием [7–9], в том числе в сочетании с предварительной твердофазной [10, 11] и жидкостной экстракцией [9], а также жидкостно-жидкостной микроэкстракцией [12]. Присутствие электроактивных групп в структуре хлорогеновой и феруловой кислот обусловливает их способность к окислению на электродной поверхности. Это позволило разработать ряд вольтамперометрических способов индивидуального определения этих кислот как на традиционных углеродсодержащих, так и химически модифицированных электродах, включая биосенсоры (табл. 1). В литературе, однако, не описано одновременное вольтамперометрическое определение хлорогеновой и феруловой кислот.
Таблица 1.
Вольтамперометрические способы определения хлорогеновой и феруловой кислот и их аналитические характеристики
| Электрод | Метод | ПрО, мкМ | Диапазон определяемых содержаний, мкМ | Лите-ратура |
|---|---|---|---|---|
| Хлорогеновая кислота | ||||
| Стержневой графитовый электрод | ДИВ | 0.0714 | 0.1–500 | [13] |
| СУЭ | ДИВ | 1.2 | 5–50 | [14] |
| Допированный бором алмазный электрод | АдКВВ | 0.14 | 0.71–11.3 | [15] |
| Активированный при –1.7 В допированный бором алмазный электрод | АдКВВ | 0.40 | 2.8–180 | [16] |
| МУНТ–додецилсульфат натрия/СУЭ | ДИВ | 0.21 | 1.0–1060 | [6] |
| МУНТ–карбоксиметилцеллюлоза/СУЭ | ЦВА | 0.043 | 0.40–194 | [17] |
| МУНТ/Печатный электрод | ДИВ | 0.34 | 0.48–44.6 | [18] |
| Графен/СУЭ | АдКВВ | 0.0044 | 0.014–0.71 | [19] |
| 1-Бутил-3-метилимидазолий гексафторфосфат–мезопористый углерод–УПЭ | КВВ | 0.010 | 0.020–2.5 | [20] |
| Поли(аминосульфоновая кислота)/СУЭ | ЦВА | 0.040 | 0.40–12 | [21] |
| Силоксан с молекулярными отпечатками/ МУНТ–винилтриметоксисилан/СУЭ | ДИВ | 0.032 | 0.08–500 | [22] |
| Лигнин/МУНТ–наночастицы CuO/СУЭ | ДИВ | 0.0125 | 5–50 | [23] |
| Лакказа/ГОвосс/наночастицы Pt/угольный печатный электрод | ХА | 2.67 | 2.91–26.47 | [24] |
| Полифенолоксидаза–наночастицы Ir–1-бутил-3-метилимидазолий гексафторфосфат–УПЭ | КВВ | 0.915 | 3.48–49.5 | [25] |
| Феруловая кислота | ||||
| Угольный электрод на бумажной основе | ДИВ | 5.0 | 25–720 | [26] |
| МУНТ–додецилсульфат натрия/СУЭ | ДИВ | 0.32 | 5.3–530 | [6] |
| ГО электровосстановленный/СУЭ | ДИВ | 0.0206 | 0.0849–38.9 | [27] |
| Графен/СУЭ | ДИВ | 0.2 | 0.5–50 | [28] |
| Хитозан/графитоподобный С3N4/СУЭ | ДИВ | 25.6 | 25.7–154 | [29] |
| Полидиаллилдиметиламмоний хлорид−графен/СУЭ | ДИВ | 0.0442 | 0.0895–52.9 | [30] |
| Полипиррол−МУНТ/СУЭ | АдКВВ | 1.17 | 3.32–25.9 | [31] |
| Дидодецилдиметиламмоний бромид–Нафион–УПЭ | ЦВА | 0.39 | 2.0–120 | [32] |
| н-Метил-3-бутилимидазолий бромид–NiO–ОУНТ–УПЭ | КВВ | 0.020 | 0.060–900 | [33] |
| Композит MgO/ОУНТ–1-бутил-3-метилимидазолий бис(трифторметилсульфонил)имид–УПЭ | ДИВ | 0.003 | 0.009–450 | [34] |
Обозначения: ПрО – предел обнаружения, СУЭ – стеклоуглеродный электрод, ГО – графен оксид, УПЭ – угольно-пастовый электрод, ДИВ – дифференциально-импульсная вольтамперометрия, ЦВА – циклическая вольтамперометрия, КВВ – квадратно-волновая вольтамперометрия, МУНТ – многостенные углеродные нанотрубки, ХА – хроноамперометрия, АдКВВ – адсорбционная квадратно-волновая вольтамперометрия, ОУНТ – одностенные углеродные нанотрубки.
В современной органической вольтамперометрии в качестве модификаторов электродной поверхности хорошо зарекомендовали себя электрополимеризованные покрытия на основе красителей различной природы [35, 36], в том числе в сочетании с углеродными наноматериалами. Такие покрытия обеспечивают высокую чувствительность и селективность определения целевых аналитов, включая структурно родственные антиоксиданты фенольного типа [37–40].
В настоящей работе для одновременного определения хлорогеновой и феруловой кислот предложен стеклоуглеродный электрод (СУЭ), модифицированный послойно многостенными углеродными нанотрубками (МУНТ) и электрополимеризованным синтетическим красителем желтым “солнечным закатом”.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы. Использовали желтый “солнечный закат”, кверцетин (95%, Sigma, Германия) и рутина тригидрат (97%, Alfa Aesar, Великобритания), стандартные 10.0 мМ растворы которых готовили по точной навеске растворением в 5.0 мл метанола х. ч. Для оценки мешающего влияния использовали аскорбиновую (99%), галловую (99%) и кофейную (98%) кислоты от Sigma (Германия). Их стандартные 1.0 мМ растворы готовили по точной навеске растворением в метаноле (для аскорбиновой кислоты в дистиллированной воде). Остальные реактивы были марки х. ч.
Модифицирование электрода. Использовали МУНТ (внешний диаметр 40–60 нм, внутренний диаметр 5–10 нм и длина 0.5–500 мкм) (Aldrich, Германия), гомогенную 0.5 мг/мл суспензию которых получали ультразвуковым диспергированием в 1%-ном растворе додецилсульфата натрия (Panreac, Испания) в течение 30 мин. На поверхность СУЭ наносили 4 мкл суспензии методом капельного испарения. Перед модификацией рабочую поверхность СУЭ обновляли механически, полируя оксидом алюминия с размером частиц 0.05 мкм. Затем электрод ополаскивали ацетоном и дистиллированной водой.
Электрополимеризацию желтого “солнечного заката” проводили хроноамперометрически после предварительного пятикратного сканирования фонового электролита. Условия получения полимерного покрытия (концентрация мономера, потенциал и время электролиза) варьировали.
Вольтамперометрические и хроноамперометрические измерения проводили на потенциостате/гальваностате Autolab PGSTAT 12 (Eco Chemie B.V., Нидерланды) с программным обеспечением NOVA 1.10.1.9 в трехэлектродной электрохимической ячейке объемом 10.0 мл. Использовали рабочий СУЭ (CH Instruments, Inc., США, площадь поверхности 7.07 мм2), СУЭ, модифицированный многостенными углеродными трубками (МУНТ/СУЭ) или СУЭ, модифицированный многостенными углеродными трубками и поли(желтым “солнечным закатом”) (поли(желтый “солнечный закат”)/МУНТ/СУЭ), насыщенный хлоридсеребряный электрод сравнения и вспомогательный платиновый электрод. Для расчетов в вольтамперометрии применяли коррекцию базовой линии по программе NOVA 1.10.1.9., что позволило точнее измерять параметры пиков. В электрохимическую ячейку вносили фоновый электролит и аликвоты растворов хлорогеновой и феруловой кислот (общий объем раствора в ячейке 5.0 мл) и регистрировали циклические вольтамперограммы в диапазоне от –0.4 до 0.9 В для хлорогеновой и от –0.2 до 1.1 В для феруловой кислот, а также дифференциально-импульсные вольтамперограммы в диапазоне от 0.0 до 0.8 В. Параметры импульса варьировали.
Для определения рН фонового электролита использовали рН-метр Эксперт-001 (ООО “Эконикс-Эксперт”, Россия).
Электрохимический импеданс измеряли на потенциостате/гальваностате Autolab PGSTAT 302N с модулем FRA32М (Eco Chemie B.V., Нидерланды) в присутствии 1.0 мМ K4[Fe(CN)6]/K3[Fe(CN)6] на фоне 0.1 М раствора KCl в диапазоне частот 10 кГц–0.04 Гц с амплитудой 5 мВ при потенциале поляризации 0.22 В. Потенциал рассчитывали как полусумму пиков окисления и восстановления редокс-пары [Fe(CN)6]3–/4–.
Сканирующая электронная микроскопия (СЭМ). Поверхность электродов характеризовали с помощью полевого эмиссионного электронного микроскопа высокого разрешения Merlin™ (Carl Zeiss, Германия) при ускоряющем напряжении 5 кВ и токе эмиссии 300 пА.
Пробоподготовка образцов. Кофе готовили по стандартной методике [6]. Растворимый кофе (2.000 ± 0.001 г) заливали 150 мл горячей воды. Кофе эспрессо готовили в кофемашине (10 г молотых кофейных зерен на 40 мл воды). Для вольтамперометрического определения фенольных кислот в электрохимическую ячейку вносили 5 мкл образца (10 мкл разбавленного в 5 раз эспрессо), фоновый электролит и регистрировали дифференциально-импульсные вольтамперограммы в диапазоне от 0.0 до 0.8 В при амплитуде импульса 50 мВ и времени импульса 50 мс и скорости изменения потенциала 10 мВ/с.
Статистическую обработку результатов проводили для 5 измерений при доверительной вероятности 0.95. Результаты представляли как X ± ΔX, где X – среднее значение и ΔX – доверительный интервал. Случайную погрешность определения оценивали по величине относительного стандартного отклонения (sr). Регрессионный анализ проводили в программе OriginPro 8.0 (OriginLab, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
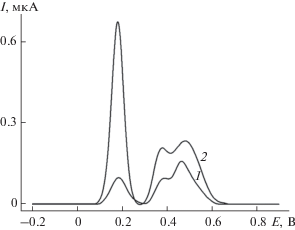
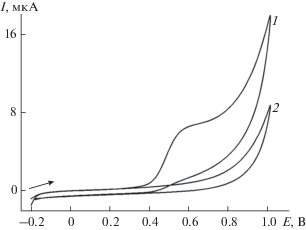
Изучено вольтамперометрическое поведение хлорогеновой и феруловой кислот на СУЭ и МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0 в условиях дифференциально-импульсной вольтамперометрии. Установлено, что при концентрации 10 мкМ на вольтамперограммах наблюдаются очень низкие токи окисления обоих аналитов (на уровне единиц наноампер). На МУНТ/СУЭ регистрируются четкие пики окисления при 0.186 В для хлорогеновой кислоты и при 0.372 и 0.469 В для феруловой кислоты (рис. 1, кривая 1). Токи окисления составляют менее 0.10 мкА, что свидетельствует о низкой чувствительности отклика. Для решения этой задачи предложен электрод, модифицированный электрополимеризованным красителем желтым “солнечным закатом”.
Рис. 1.
Дифференциально-импульсные вольтамперограммы с коррекцией базовой линии 10 мкМ смеси хлорогеновой и феруловой кислот на МУНТ/СУЭ (1) и поли(желтый “солнечный закат”)МУНТ/СУЭ (2) на фоне фосфатного буферного раствора с рН 7.0. Амплитуда импульса 50 мВ, время импульса 50 мс, скорость изменения потенциала 10 мВ/с.
Желтый “солнечный закат” необратимо окисляется на МУНТ/СУЭ при 0.550 В на фоне 0.1 M раствора NaOH (рис. 2, кривая 1) с образованием феноксильного радикала согласно схеме 1 [41, 42].
Схема 1 . Электроокисление желтого “солнечного заката”.
Рис. 2.
Циклическая вольтамперограмма 500 мкМ желтого “солнечного заката” (1) на МУНТ/СУЭ, на фоне 0.1 М NaOH (2). Скорость изменения потенциала 100 мВ/с.
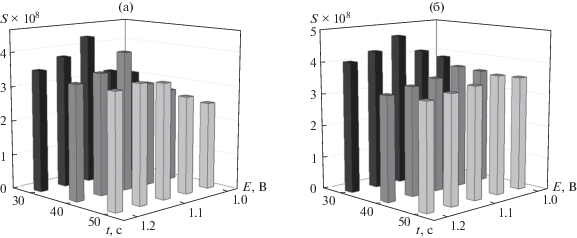
Электрополимеризацию красителя проводили в потенциостатическом режиме хроноамперометрически. Поскольку отклик целевых аналитов зависит от условий получения полимерного покрытия, оценено влияние параметров электролиза и концентрации мономера на отклик 10 мкМ смеси хлорогеновой и феруловой кислот. Варьирование концентрации мономера от 25 до 75 мкМ показало, что наилучшие характеристики наблюдаются при концентрации желтого “солнечного заката” 50 мкМ. Параметры электролиза (потенциал и время) оказывают влияние на отклик фенольных кислот. Учитывая раздвоенную форму пика окисления феруловой кислоты, в качестве контролируемого параметра рассматривали площадь пиков окисления фенольных кислот. Показано, что разность потенциалов окисления хлорогеновой и феруловой кислот практически не меняется при изменении условий электролиза и составляет 190 мВ. Площади пиков окисления кислот статистически достоверно изменяются (рис. 3) с ростом потенциала и времени электролиза, достигая максимума в случае электрополимеризации желтого “солнечного заката” при 1.10 В в течение 30 с. Дальнейшее увеличение времени и потенциала электролиза приводит к уменьшению площади пиков окисления хлорогеновой и феруловой кислот, что, вероятно, связано с ростом толщины полимерного покрытия.
Рис. 3.
Влияние параметров электролиза (потенциала и времени) желтого “солнечного заката” на площадь пиков окисления 10 мкМ смеси хлорогеновой (а) и феруловой (б) кислот по данным дифференциально-импульсной вольтамперометрии на фоне фосфатного буферного раствора с рН 7.0.
На дифференциально-импульсных вольтамперограммах смеси хлорогеновой и феруловой кислот на поли(желтый “солнечный закат”)/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0 наблюдаются четко выраженные пики окисления при 0.181, 0.376 и 0.498 В соответственно (рис. 1, кривая 2), токи которых статистически достоверно увеличиваются по сравнению с МУНТ/СУЭ (рис. 1, кривая 1). Это объясняется увеличением площади поверхности электрода с полимерным покрытием, что подтверждается данными циклической вольтамперометрии (для модифицированных электродов) и хроноамперометрии (для СУЭ) по окислению [Fe(CN)6]4–-ионов на фоне 0.1 М раствора KCl. Рассчитанная по уравнениям Рэндлса–Шевчика и Коттрелла эффективная площадь поверхности составляет 8.2 ± 0.3 мм2 для СУЭ, 26.1 ± 0.6 мм2 для МУНТ/СУЭ и 44.0 ± 0.6 мм2 для электрода, модифицированного полимером.
Для характеристики электродов использовали СЭМ и спектроскопию электрохимического импеданса. Данные СЭМ (рис. 4) подтверждают однородность покрытия электродной поверхности модификаторами и значительное увеличение шероховатости поверхности модифицированных электродов по сравнению с СУЭ. Поли(желтый “солнечный закат”) представляет собой равномерно распределенные шарообразные гранулы диаметром 26–75 нм (рис. 4в).
Рис. 4.
СЭМ-изображения поверхности СУЭ (а), МУНТ/СУЭ (б) и поли(желтый “солнечный закат”)/МУНТ/СУЭ (в).

Параметры электронного переноса оценивали методом спектроскопии электрохимического импеданса, используя для количественной характеристики эквивалентные ячейки Рэндлса (табл. 2). Для модифицированных электродов наблюдается значительное уменьшение сопротивления переносу заряда (Rct), что свидетельствует об увеличении скорости переноса электрона. Это хорошо согласуется с данными для других красителей [37–39].
Таблица 2.
Параметры электрохимического импеданса электродов (n = 5, P = 0.95)
| Электрод | Rs, Ом | Rct, кОм | Q, мкОм–1 | n | W, мкОм–1 |
|---|---|---|---|---|---|
| СУЭ | 245 ± 5 | 72 ± 3 | 3.7 ± 0.2 | 0.789 | – |
| МУНТ/СУЭ | 199 ± 3 | 12.1 ± 09 | 3.6 ± 0.1 | 0.775 | 230 ± 5 |
| Поли(желтый “солнечный закат”)/МУНТ/СУЭ | 99.0 ± 0.5 | 4.4 ± 0.2 | 3.8 ± 0.1 | 0.902 | 372 ± 5 |
Изучено электроокисление фенольных кислот на поли(желтый “солнечный закат”)/МУНТ/СУЭ. Варьирование рН фонового электролита от 5.0 до 8.0 показало, что потенциалы окисления обеих кислот линейно смещаются в область меньших значений по мере увеличения рН фонового электролита (уравнения (1) и (2) соответственно):
(1)
$\begin{gathered} E\left( {\text{В}} \right) = \left( {0.59 \pm 0.01} \right) - \left( {0.050 \pm 0.002} \right){\text{pH}}, \\ {{R}^{2}} = 0.9943, \\ \end{gathered} $(2)
$\begin{gathered} E\left( {\text{В}} \right) = \left( {0.792 \pm 0.009} \right) - \left( {0.057 \pm 0.001} \right){\text{pH}}, \\ {{R}^{2}} = 0.9964. \\ \end{gathered} $Зависимость потенциалов окисления от рН свидетельствует об участии протонов в электродной реакции. Полученные значения тангенсов углов наклона указывают на равное число протонов и электронов, участвующих в реакциях. Дальнейшие исследования проводили при физиологическом значении рН 7.0.
Для установления природы электрохимического процесса оценили влияние скорости изменения потенциала на токи окисления хлорогеновой и феруловой кислот. Показано, что окисление контролируется диффузией аналитов, что подтверждается линейной зависимостью токов окисления от V1/2 (уравнения (3) и (4) соответственно) и значениями тангенсов угла наклона зависимости ln Iп от lnV (уравнения (5) и (6) соответственно):
(3)
$\begin{gathered} {{I}_{{\text{п}}}}\left( {{\text{мкА}}} \right) = \left( {0.15 \pm 0.03} \right) + \\ + \,\,\left( {0.140 \pm 0.003} \right){{{v}}^{{1/2}}}\left( {{\text{мВ/с}}} \right),\,\,\,\,{{R}^{2}} = {\text{ }}0.9961, \\ \end{gathered} $(4)
$\begin{gathered} {{I}_{{\text{п}}}}\left( {{\text{мкА}}} \right) = \left( { - 0.04 \pm 0.01} \right) + \\ + \,\,\left( {0.047 \pm 0.001} \right){{{v}}^{{1/2}}}\left( {{\text{мВ/с}}} \right),\,\,\,\,{{R}^{2}} = {\text{ }}0.9950, \\ \end{gathered} $(5)
$\begin{gathered} \ln {{I}_{{\text{п}}}}\left( {{\text{мкA}}} \right) = \left( {1.44 \pm 0.02} \right) + \\ + \left( {0.434 \pm 0.006} \right)\ln {v}\left( {{\text{В/с}}} \right),\,\,\,\,{{R}^{2}} = {\text{ }}0.9984, \\ \end{gathered} $(6)
$\begin{gathered} \ln {{I}_{{\text{п}}}}\left( {{\text{мкA}}} \right) = \left( {0.50 \pm 0.02} \right) + \\ + \,\,\left( {0.588 \pm 0.007} \right)\ln {v}\left( {{\text{В/с}}} \right),\,\,\,{{R}^{2}} = {\text{ }}0.9992. \\ \end{gathered} $Разность потенциалов пиков окисления и восстановления и соотношение токов окисления свидетельствуют об обратимом окислении хлорогеновой кислоты. Феруловая кислота окисляется необратимо, что подтверждается значением коэффициента анодного переноса 0.59, рассчитанным из наклона зависимости Тафеля [43]. Число участвующих в реакции электронов рассчитывали согласно формуле ΔE1/2 = 56.5/n для обратимого процесса и ΔE1/2 = 47.7/αаn для необратимого [43]. Расчеты показали, что электроокисление хлорогеновой и феруловой кислот протекает с участием двух электронов с образованием соответствующих о-хинонов (схемы 2 и 3 соответственно), что согласуется с данными [6, 14, 44].
Схема 2 . Электроокисление хлорогеновой кислоты.
Схема 3 . Электроокисление феруловой кислоты.
Одновременное количественное определение хлорогеновой и феруловой кислот проводили методом дифференциально-импульсной вольтамперометрии. Варьирование амплитуды и времени импульса показало, что разрешение пиков наилучшее и токи окисления максимальны при амплитуде импульса 50 мВ и времени импульса 50 мс. При этом на вольтамперограммах смесей фенольных кислот наблюдаются четко выраженные пики окисления при 0.181 В для хлорогеновой и при 0.396 и 0.525 В для феруловой кислоты (рис. 5). Параметры градуировочных зависимостей и аналитические параметры представлены в табл. 3. Полученные характеристики превосходят описанные для индивидуального определения рассматриваемых кислот на других химически модифицированных электродах (табл. 1). Кроме того, предложенный электрод характеризуется более простой процедурой изготовления с применением доступных реагентов для получения полимерного покрытия.
Рис. 5.
Дифференциально-импульсные вольтамперограммы с коррекцией базовой линии эквимолярных смесей хлорогеновой и феруловой кислот (1 – 0.1, 2 – 0.25, 3 – 0.50, 4 – 0.75, 5 – 1.0, 6 – 2.5, 7 – 4.0 мкМ) на поли(желтый “солнечный закат”)/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0. Амплитуда импульса 50 мВ, время импульса 50 мс, скорость изменения потенциала 10 мВ/с.
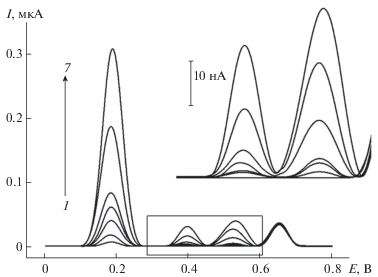
Таблица 3.
Аналитические характеристики и параметры градуировочных зависимостей фенольных кислот на поли(желтый “солнечный закат”)/МУНТ/СУЭ
| ПрО, мкМ | Диапазон определяемых содержаний, мкМ | I = a + bc | R2 | |
|---|---|---|---|---|
| a ± σ, мкА | b ± σ, мкА/мкМ | |||
| Хлорогеновая кислота | ||||
| 0.076 | 0.10–4.0 | –0.001 ± 0.002 | 0.079 ± 0.001 | 0.9988 |
| Феруловая кислота | ||||
| 0.098 | 0.5–4.0 | –0.0033 ± 0.0003 | 0.0092 ± 0.0001 | 0.9992 |
Варьирование концентрации одного из компонентов при более высоком фиксированном значении концентрации второго не приводит к наложению аналитических сигналов, а токи окисления обоих компонентов совпадают с таковыми для эквимолярных смесей. Это подтверждает, что окисление хлорогеновой и феруловой кислот протекает независимо и для их определения можно использовать градуировочные зависимости для эквимолярных смесей.
Выполнено одновременное определение фенольных кислот в модельных системах (табл. 4). Величина относительного стандартного отклонения не превышает 5%, а значения меры правильности свидетельствуют о высокой точности разработанного подхода.
Таблица 4.
Результаты одновременного определения фенольных кислот в модельных растворах на поли(желтый “солнечный закат”)/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0 (n = 5, P = 0.95)
| Введено, мкМ | Хлорогеновая кислота | Феруловая кислота | ||||
|---|---|---|---|---|---|---|
| найдено, мкМ | sr | R, % | найдено, мкМ | sr | R, % | |
| 0.10 | 0.100 ± 0.002 | 0.02 | 100 ± 2 | – | – | – |
| 0.50 | 0.501 ± 0.009 | 0.02 | 100 ± 2 | 0.50 ± 0.01 | 0.02 | 100 ± 2 |
| 0.75 | 0.75 ± 0.02 | 0.01 | 100 ± 3 | 0.76 ± 0.01 | 0.009 | 101 ± 1 |
| 1.0 | 1.01 ± 0.01 | 0.01 | 101 ± 1 | 1.01 ± 0.02 | 0.01 | 101 ± 1 |
| 2.5 | 2.49 ± 0.03 | 0.01 | 99.6 ± 0.9 | 2.50 ± 0.02 | 0.007 | 100.0 ± 0.8 |
| 4.0 | 4.01 ± 0.03 | 0.007 | 100.3 ± 0.8 | 4.01 ± 0.03 | 0.007 | 100.3 ± 0.8 |
Показана селективность отклика фенольных кислот в присутствии 1000-кратных избытков неорганических ионов (K+, Mg2+, Ca2+, ${\text{NO}}_{3}^{ - },$ Cl– и ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$), 100-кратных избытков глюкозы, рамнозы и сахарозы, арабиногалактана и аскорбиновой кислоты. Галловая кислота окисляется при 0.131 и 0.217 В только при концентрациях 5 мкМ и выше, что свидетельствует о низкой чувствительности ее отклика и отсутствии мешающего влияния. Кофейная кислота окисляется при потенциале окисления хлорогеновой кислоты, что приводит к пропорциональному увеличению тока окисления при 0.181 В в случае их смеси. Тем не менее в растительных объектах, в частности в кофе, содержание свободной кофейной кислоты невелико, так как она существует в виде кофеилхинных кислот, к числу которых относится и хлорогеновая.
Разработанный подход применен для определения хлорогеновой и феруловой кислот в кофе. На вольтамперограммах кофе регистрируются четко выраженные пики окисления рассматриваемых кислот, что подтверждается данными метода добавок (табл. 5). Степень открытия составляет 98–101%, что свидетельствует о высокой точности определения и об отсутствии матричных эффектов.
Таблица 5.
Степень открытия хлорогеновой и феруловой кислот в кофе по данным вольтамперометрии на поли(желтый “солнечный закат”)/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0 (n = 5, P = 0.95)
| Образец | Аналит | Введено, мкг | Расчетное значение, мкг | Найдено, мкг | R, % |
|---|---|---|---|---|---|
| Эспрессо | Хлорогеновая кислота | 0 | 4.55 ± 0.09 | ||
| 1.14 | 5.69 | 5.7 ± 0.1 | 100 ± 2 | ||
| 2.28 | 6.83 | 6.8 ± 0.1 | 99.6 ± 0.9 | ||
| Феруловая кислота | 0 | 0.74 ± 0.02 | |||
| 0.18 | 0.92 | 0.92 ± 0.04 | 100 ± 3 | ||
| 0.37 | 1.11 | 1.13 ± 0.05 | 100 ± 4 | ||
| Растворимый кофе | Хлорогеновая кислота | 0 | 4.9 ± 0.1 | ||
| 1.23 | 6.13 | 6.1 ± 0.1 | 100 ± 2 | ||
| 2.45 | 7.35 | 7.4 ± 0.2 | 101 ± 3 | ||
| Феруловая кислота | 0 | 1.8 ± 0.08 | |||
| 0.45 | 2.25 | 2.2 ± 0.1 | 98 ± 4 | ||
| 0.90 | 2.70 | 2.65 ± 0.08 | 98 ± 3 |
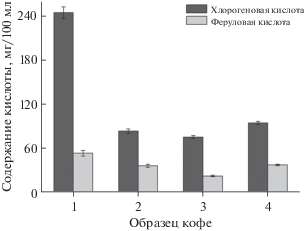
Результаты определения хлорогеновой и феруловой кислот в кофе представлены на рис. 6. Полученные содержания согласуются с данными [14]. Предложенный метод характеризуется высокими чувствительностью и точностью, а также простотой и доступностью, что позволяет применять его в анализе кофесодержащих напитков.
Рис. 6.
Результаты одновременного вольтамперометрического определения хлорогеновой и феруловой кислот в кофе (n = 5, P = 0.95).
Авторы выражают благодарность Ю.Н. Осину и А.М. Рогову (междисциплинарный центр “Аналитическая микроскопия” Казанского федерального университета) за СЭМ-исследования.
Работа выполнена при финансовой поддержке РФФИ (проект 18-33-00220-мол_а).
Список литературы
Зиятдинова Г.К., Будников Г.К. Природные фенольные антиоксиданты в биоаналитической химии: состояние проблемы и перспективы развития // Успехи химии. 2015. Т. 84. № 2. С. 194. (Ziyatdinova G.K., Budnikov H.C. Natural phenolic antioxidants in bioanalytical chemistry: State of the art and prospects of development // Russ. Chem. Rev. 2015. V. 84. № 2. P. 194.)
D’Archivio M., Filesi C., Di Benedetto R., Gargiulo R., Giovannini C., Masella R. Polyphenols, dietary sources and bioavailability // Ann. Ist. Super. Sanita. 2007. V. 43. № 4. P. 348.
Goleniowski M., Bonfill M., Cusido R., Palazón J. Phenolic acids / Natural Products / Eds. Ramawat K.G., Mérillon J.-M. Berlin, Heidelberg: Springer, 2013. P. 1951.
Alam M.A., Subhan N., Hossain H., Hossain M., Reza H.M., Rahman M.M., Ullah M.O. Hydroxycinnamic acid derivatives: A potential class of natural compounds for the management of lipid metabolism and obesity // Nutr. Metab. 2016. V. 13. Article 27.
Vinholes J., Silva B.M., Silva L.R. Hydroxycinnamic acids (HCAs): Structure, biological properties and health effects / Advances in Medicine and Biology. V. 88. Ch. 8. N.Y.: Nova Biomedical, 2015. P. 105.
Ziyatdinova G., Aytuganova I., Nizamova A., Budnikov H. Differential pulse voltammetric assay of coffee antioxidant capacity with MWNT-modified electrode // Food Anal. Methods. 2013. V. 6. № 6. P. 1629.
Urakova I.N., Pozharitskaya O.N., Shikov A.N., Kosman V.M., Makarov V.G. Comparison of high performance TLC and HPLC for separation and quantification of chlorogenic acid in green coffee bean extracts // J. Sep. Sci. 2008. V. 31. № 2. P. 237.
Shan Y., Jin X., Cheng Y., Yan W. Simultaneous determination of chlorogenic acids in green coffee bean extracts with effective relative response factors // Int. J. Food Prop. 2017. V. 20. № 9. P. 2028.
Jeszka-Skowron M., Zgoła-Grześkowiak A., Grześkowiak T. Analytical methods applied for the characterization and the determination of bioactive compounds in coffee // Eur. Food Res. Technol. 2015. V. 240. № 1. P. 19.
Suárez-Quiroz M.L., Campos A.A., Alfaro G.V., González-Ríos O., Villeneuve P., Figueroa-Espinoza M.C. Isolation of green coffee chlorogenic acids using activated carbon // J. Food Comp. Anal. 2014. V. 33. № 1. P. 55.
Köseoglu Yilmaz P., Kolak U. SPE-HPLC determination of chlorogenic and phenolic acids in coffee // J. Chromatogr. Sci. 2017. V. 55. № 7. P. 712.
Shalash M., Makahleh A., Salhimi S.M., Saad B. Vortex-assisted liquid−liquid−liquid microextraction followed by high performance liquid chromatography for the simultaneous determination of fourteen phenolic acids in honey, iced tea and canned coffee drinks // Talanta. 2017. V. 174. P. 428.
David I.G., Popa D.E., Buleandra M., Moldovan Z., Iorgulescu E.E., Badea I.A. Cheap pencil graphite electrodes for rapid voltammetric determination of chlorogenic acid in dietary supplements // Anal. Methods. 2016. V. 8. № 35. P. 6537.
Tomac I., Šeruga M. Electrochemical properties of chlorogenic acids and determination of their content in coffee using differential pulse voltammetry // Int. J. Electrochem. Sci. 2016. V. 11. № 4. P. 2854.
Yardim Y. Electrochemical behavior of chlorogenic acid at a boron-doped diamond electrode and estimation of the antioxidant capacity in the coffee samples based on its oxidation peak // J. Foog. Sci. 2012. V. 77. № 4. P. C408.
Alpar N., Yardım Y., Şentürk Z. Selective and simultaneous determination of total chlorogenic acids, vanillin and caffeine in foods and beverages by adsorptive stripping voltammetry using a cathodically pretreated boron-doped diamond electrode // Sens. Actuators B. 2018. V. 257. P. 398.
Takahashi S., Wada R., Muguruma H., Osakabe N. Analysis of chlorogenic acids in coffee with a multi-walled carbon nanotube electrode // Food Anal. Methods. 2020. https://doi.org/10.1007/s12161-020-01714-6
Ma X., Yang H., Xiong H., Li X., Gao J., Gao Y. Electrochemical behavior and determination of chlorogenic acid based on multi-walled carbon nanotubes modified screen-printed electrode // Sensors. 2016. V. 16. № 11. Article 1797. 10 p.
Yiğit A., Alpar N., Yardım Y., Çelebi M., Şentürk Z. A graphene-based electrochemical sensor for the individual, selective and simultaneous determination of total chlorogenic acids, vanillin and caffeine in food and beverage samples // Electroanalysis. 2018. V. 30. № 9. P. 2011.
Mohammadi N., Najafi M., Adeh N.B. Highly defective mesoporous carbon – ionic liquid paste electrode as sensitive voltammetric sensor for determination of chlorogenic acid in herbal extracts // Sens. Actuators B. 2017. V. 243. P. 838.
Chao M., Ma X. Voltammetric determination of chlorogenic acid in pharmaceutical products using poly(aminosulfonic acid) modified glassy carbon electrode // J. Food Drug Analysis. 2014. V. 22. № 4. P. 512.
Ribeiro C.M., Miguel E.M., Silva J.D.S., Silva C.B.D., Goulart M.O.F., Kubota L.T., Gonzaga F.B., Santos W.J.R., Lima P.R. Application of a nanostructured platform and imprinted sol-gel film for determination of chlorogenic acid in food samples // Talanta. 2016. V. 156–157. P. 119.
Chokkareddy R., Redhi G.G., Karthick T. A lignin polymer nanocomposite based electrochemical sensor for the sensitive detection of chlorogenic acid in coffee samples // Heliyon. 2019. V. 5. № 3. Article e01457.
Vasilescu I., Eremia S.A.V., Penu R., Albu C., Radoi A., Litescu S.C., Radu G.-L. Disposable dual sensor array for simultaneous determination of chlorogenic acid and caffeine from coffee // RSC Adv. 2015. V. 5. № 1. P. 261.
Fernandes S.C., Moccelini S.K., Scheeren C.W., Migowski P., Dupont J., Heller M., Micke G.A., Vieira I.C. Biosensor for chlorogenic acid based on an ionic liquid containing iridium nanoparticles and polyphenol oxidase // Talanta. 2009. V. 79. № 2. P. 222.
Tee-ngam P., Nunant N., Rattanarat P., Siangproh W., Chailapakul O. Simple and rapid determination of ferulic acid levels in food and cosmetic samples using paper-based platforms // Sensors. 2013. V. 13. № 10. P. 13 039.
Liu L., Gou Y., Gao X., Zhang P., Chen W., Feng S., Hu F., Li Y. Electrochemically reduced graphene oxide-based electrochemical sensor for the sensitive determination of ferulic acid in A. sinensis and biological samples // Mater. Sci. Eng. C. 2014. V. 42. P. 227.
Zhang Y., Liu Y., Yang Z., Yang Y., Pang P., Gao Y., Hu Q. Rapid electrochemical detection of ferulic acid based on a graphene modified glass carbon electrode // Anal. Methods. 2013. V. 5. № 16. P. 3834.
Jing L., Lin J., Fei Q., Tang H., Yang X., Sun C. Simultaneous quantitation of caffeic acid and ferulic acid based on graphite-like C3N4/chitosan modified film // Int. J. Electrochem. Sci. 2017. V. 12. № 9. P. 8504.
Liu L.-j., Gao X., Zhang P., Feng S.-l., Hu F.-d., Li Y.-d., Wang C.-m. Ultrasensitive detection of ferulic acid using poly(diallyldimethylammonium chloride) functionalized graphene-based electrochemical sensor // J. Anal. Methods: Chem. 2014. V. 2014. Article 424790. 9 p.
Abdel-Hamid R., Newair E.F. Voltammetric determination of ferulic acid using polypyrrole-multiwalled carbon nanotubes modified electrode with sample application // Nanomaterials. 2015. V. 5. № 4. P. 1704.
Luo L., Wang X., Li Q., Ding Y., Jia J., Deng D. Voltammetric determination of ferulic acid by didodecyldimethylammonium bromide/nafion composite film-modified carbon paste electrode // Anal. Sci. 2010. V. 26. № 8. P. 907.
Karimi-Maleh H., Farahmandfar R., Hosseinpour R., Alizadeh J., Abbaspourrad A. Determination of ferulic acid in the presence of butylated hydroxytoluene as two phenolic antioxidants using a highly conductive food nanostructure electrochemical sensor // Chem. Pap. 2019. V. 73. № 10. P. 2441.
Zabihpour T., Shahidi S.-A., Karimi-Maleh H., Ghorbani-HasanSaraei A. An ultrasensitive electroanalytical sensor based on MgO/SWCNTs-1-butyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide paste electrode for the determination of ferulic acid in the presence sulfite in food samples // Microchem. J. 2020. V. 154. Article 104572. 8 p.
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии и медицине. М.: Бином – Лаборатория знаний, 2010. 416 с.
Pauliukaite R., Ghica M.E., Barsan M.M., Brett C.M.A. Phenazines and polyphenazines in electrochemical sensors and biosensors // Anal. Lett. 2009. V. 43. № 10–11. P. 1588.
Ziyatdinova G., Guss E., Budnikov H. Amperometric sensor based on MWNT and electropolymerized carminic acid for the simultaneous quantification of TBHQ and BHA // J. Electroanal. Chem. 2020. V. 859. Article 113885. 8 p.
Гусс Е.В., Зиятдинова Г.К., Жупанова А.С., Будников Г.К. Вольтамперометрическое определение кверцетина и рутина при совместном присутствии на электроде, модифицированном политимолфталеином // Журн. аналит. химии. 2020. Т. 75. № 4. С. 348. (Guss E.V., Ziyatdinova G.K., Zhupanova A.S., Budnikov H.C. Voltammetric determination of quercetin and rutin in their simultaneous presence on an electrode modified with polythymolphthalein // J. Anal. Chem. 2020. V. 75. № 4. P. 526.)
Zhupanova A., Guss E., Ziyatdinova G., Budnikov H. Simultaneous voltammetric determination of flavanones using an electrode based on functionalized single-walled carbon nanotubes and polyaluminon // Anal. Lett. 2020. V. 53. № 13. P. 2170.
Ziyatdinova G., Guss E., Morozova E., Budnikov H., Davletshin R., Vorobev V., Osin Yu. Simultaneous voltammetric determination of gallic and ellagic acids in cognac and brandy using electrode modified with functionalized SWNT and poly(pyrocatechol violet) // Food Anal. Methods. 2019. V. 12. № 10. P. 2250.
Qiu X., Lu L., Leng J., Yu Y., Wang W., Jiang M., Bai L. An enhanced electrochemical platform based on graphene oxide and multi-walled carbon nanotubes nanocomposite for sensitive determination of sunset yellow and tartrazine // Food Chem. 2016. V. 190. P. 889.
Ahmad I., Murtaza S., Ahmed S. Electrochemical and photovoltaic study of sunset yellow and tartrazine dyes // Monatsh. Chem. 2015. V. 146. № 10. P. 1631.
Bard A.J., Faulkner L.R. Electrochemical Methods, Fundamentals and Applications. 2nd Ed. New York: John Wiley& Sons Inc., 2001. 850 p.
Trabelsi S.K., Tahar N.B., Trabelsi B., Abdelhedi R. Electrochemical oxidation of ferulic acid in aqueous solutions at gold oxide and lead dioxide electrodes // J. Appl. Electrochem. 2005. V. 35. № 10. P. 967.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии