Журнал аналитической химии, 2021, T. 76, № 4, стр. 359-368
Отношения стабильных изотопов 13С/12С и 15N/14N в образцах подмора медоносных пчел и в продуктах их жизнедеятельности
Д. А. Калашникова a, *, Г. В. Симонова a
a Институт мониторинга климатических и экологических систем Сибирского отделения Российской академии наук
634055 Томск, просп. Академический, 10/3, Россия
* E-mail: terrezaprk@mail.ru
Поступила в редакцию 27.08.2020
После доработки 23.10.2020
Принята к публикации 27.10.2020
Аннотация
Проведен анализ изотопного состава углерода (δ13С) и азота (δ15N) в образцах подмора медоносных пчел и в продуктах пчеловодства (мед, пыльцевая обножка, воск, прополис), приобретенных как на медовых ярмарках, так и непосредственно на пасеках в Томской области, а также для сравнения в Алтайском и Краснодарском краях, Калужской и Кемеровской областях. Цель исследования − выявление индикаторной способности соотношений стабильных изотопов углерода 13С/12C и азота 15N/14N при контроле экологического состояния территорий, охватывающих ареал обитания медоносных пчел, а также при контроле пищевых продуктов (мед, пыльцевая обножка). Изотопный анализ выполняли методом изотопной масс-спектрометрии с использованием изотопного масс-спектрометра DELTA V Advantage (Thermo Fisher Scientific, Германия).
В настоящее время стабильные изотопы находят широкое применение в исследовательских работах в большинстве областей науки [1]. Естественные вариации содержания стабильных изотопов очень информативны, они могут служить ценными нерадиоактивными источниками информации о том, как сегодня и в прошлом взаимодействовали объекты окружающей среды при климатических и экологических изменениях в экосистемах. Развитие методов мониторинга окружающей среды с использованием высокочувствительных биоиндикаторов в сочетании с изотопной масс-спектрометрией является актуальным направлением исследований.
Использование пчел и продуктов пчеловодства в качестве биоиндикаторов загрязнения окружающей среды при решении экологических проблем стало возможным после установления способности пчелосемей аккумулировать поллютанты в организме пчел-сборщиц [2]. Качество продукции жизнедеятельности пчел зависит от места расположения пасеки. Апимониторинг (оценка состояния окружающей среды с использованием медоносных пчел и продуктов пчеловодства) в нашей стране в последние два десятилетия осуществлялся в основном на загрязненность тяжелыми металлами в Московской, Рязанской, Новосибирской, Ростовской, Смоленской и Пермской областях, в Республике Башкортостан [3, 4]. В Томской области такие исследования не проводились.
В качестве индикаторов состояния экосистемы можно использовать изотопный состав азота (δ15N) и углерода (δ13C). Если величины δ15N и δ13C для растений-медоносов зависят от среды обитания, то и для пчел в разных местах обитания, и для продуктов их жизнедеятельности изотопные отношения должны различаться [5].
Основная цель настоящего исследования заключалась в анализе величин δ15N и δ13C в образцах подмора медоносных пчел и продуктах их жизнедеятельности (мед, пыльцевая обножка, воск, прополис) с целью выявления их индикаторной способности при мониторинге экологического состояния территорий, охватывающих ареал обитания медоносных пчел, а также при контроле пищевых продуктов (мед, пыльцевая обножка).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. В 2019 г. были отобраны образцы пыльцевой обножки, подмора пчел, воска, прополиса и меда как на медовых ярмарках, так и непосредственно на пасеках, располагающихся на территории Томской области. Для сравнения были приобретены образцы продуктов жизнедеятельности пчел из Алтайского и Краснодарского краев, Кемеровской и Калужской областей. Всего было собрано 26 образцов меда (14 чистых медов и 12 образцов меда в сотах), 16 образцов воска, 14 образцов пыльцевой обножки, 15 образцов прополиса и 16 образцов подмора пчел.
Методы исследования. Изотопный состав углерода и азота определяли методом изотопной масс-спектрометрии легких элементов [1] с использованием изотопного масс-спектрометра DELTA V Advantage, совмещенного с элементным анализатором Flash 2000 (Thermo Fisher Scientific, Германия), оснащенным окислительно-восстановительным реактором (приборы предоставлены центром коллективного пользования ТомЦКП СО РАН). Образцы подмора пчел очищали от пыльцы и высушивали при 70°С в течение 48 ч, а пробы воска, прополиса, меда и пыльцевой обножки выдерживали в эксикаторе 48 ч (осушитель пентаоксид фосфора). Экспериментально установили, что влажность меда не влияет на фракционирование изотопов углерода в меде. Образцы майского (раннего, весеннего с влажностью 21%) и июльского (летнего с влажностью 19%) медов выдерживали в эксикаторе в течение 6 дней. Изменение массы образцов составило менее 1%. Изотопный анализ углерода определяли на третьи и шестые сутки. Вариация величины δ13C на третьи и шестые сутки составила ±0.1‰, что находится в пределах погрешности измерений.
Все образцы измельчали, после чего навеску образца помещали в оловянные капсулы (олово высокой степени чистоты). Оптимальная масса навески образца для изотопного анализа углерода составляет 500−600 мкг, для изотопного анализа азота белковой фракции меда и пыльцевой обножки – 1000 мкг, для изотопного анализа азота подмора пчел – 200 мкг, прополиса – 5 мг. Запакованные в капсулы образцы загружали в автосамплер элементного анализатора Flash 2000. Капсула попадала в окислительный реактор, нагретый до 1020°С и заполненный Cr2O3 и гранулами Co3O4, сжигалась в потоке газа-носителя (гелий, 250 мл/мин) с одновременно поданным чистым кислородом (180 мл/мин). Полученные продукты окисления (CO2, NxOy) поступали в восстановительный реактор, где оксиды азота восстанавливались до N2. Для удаления воды использовали ловушку с перхлоратом магния. N2 и CO2 по капилляру попадали в масс-спектрометр DELTA V Advantage через систему газораспределния Conflo II. Изотопный состав δ измеряют в промилле (‰) и определяют по формуле:
Лабораторные рабочие газы сравнения CO2 и N2 калибровали по международному стандартному образцу МАГАТЭ IAEA-600 Caffeine с известной величиной отношения стабильных изотопов: δ13СVPDB = –27.771 ± 0.043‰ и ${{\delta }^{{{\text{15}}}}}{{{\text{N}}}_{{{\text{air}}{{{\text{N}}}_{{\text{2}}}}}}}$ = 1.0 ± 0.2‰. Воспроизводимость результатов изотопного анализа газов сравнения составляла ±0.02‰ для СО2 и ±0.05‰ для N2. Погрешность трех последовательных измерений анализируемых образцов не превышала для углерода ±0.2‰, а для азота ±0.6‰.
Для обнаружения подделки меда с помощью растительных сахаров, получаемых из растений типа C4, например путем добавления сиропа с высоким содержанием фруктозы, полученного в основном из кукурузы или сахарного тростника, можно использовать величину δ13С, так как диапазоны вариаций величины изотопного состава растений типов С3 и С4 существенно различаются (рис. 1). Ассоциация аналитической химии для обнаружения фальсификация меда сахарными сиропами в качестве официального приняла метод обнаружения с применением изотопной масс-спектрометрии [6]. Суть метода заключается в сравнении величин δ13C в меде и экстрагированной из него белковой фракции.
Рис. 1.
Гистограмма значений δ13C для растений типов C3 и C4 на основе более 1000 изотопных анализов. Светлая область показывает распределение δ13C образцов натурального меда из США [7].
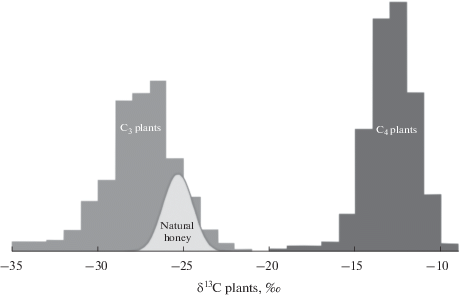
Так как пчелы собирают нектар обычно с С3-растений, натуральный мед имеет значение изотопного состава углерода примерно от –28 до –23‰ [7]. При разбавлении меда сиропом из сахарного тростника или кукурузы мед обогащается тяжелым изотопом углерода 13С (δ13C > –23‰), поэтому подлинность образцов меда с величиной δ13C выше –23‰ вызывает сомнения [8].
Изотопный состав белковой фракции меда не меняется при добавлении сахарного сиропа в мед, поэтому изотопный состав белковой фракции меда является “внутренним стандартом”. Отличие величины δ13C между медом и экстрагированной из него белковой фракцией более чем на 1‰ свидетельствует о фальсификации меда [9]. Белковую фракцию меда экстрагировали по методике, описанной в работе [10].
Для статистических расчетов использовали пакет “Анализ данных” для Microsoft Excel. Базовая статистика включала среднее значение (среднее арифметическое), стандартное отклонение (σ), минимум, максимум и размах выборки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
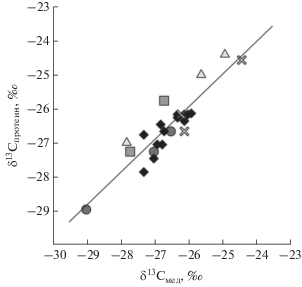
Изотопный состав углерода в образцах подмора медоносных пчел и в продуктах их жизнедеятельности. Первоначально проводили сравнительный анализ изотопного состава углерода в образцах меда и выделенной из него белковой фракции (протеине) с целью выявления поддельного меда, фальсифицируемого растительными сахарами. Величина δ13С образцов меда изменялась в диапазоне от –29.0 до –24.4‰, а величина δ13С протеина – от –28.9 до –24.3‰ (рис. 2). Получили линейную зависимость для образцов меда и выделенной из него белковой фракции: δ13Cпротеин = = 0.96δ13Cмед – 0.93, R2 = 0.82 (рис. 2). Все образцы меда оказались подлинными, величины δ13C всех образцов меда ниже –23‰; разница величин δ13C для меда и экстрагированной из него белковой фракции менее чем 1‰.
Рис. 2.
Изотопный состав углерода в образцах меда и экстрагированного из него протеина: ( ) – Алтайский край, (◆)– Томская область, (
) – Алтайский край, (◆)– Томская область, ( ) – Кемеровская область, (
) – Кемеровская область, ( ) – Калужская область, (
) – Калужская область, ( ) – Краснодарский край.
) – Краснодарский край.
В табл. 1 и 2 представлены результаты анализа изотопного состава углерода в образцах подмора медоносных пчел и в продуктах их жизнедеятельности.
Таблица 1.
Основная статистика величины δ13C (‰) в собранных образцах
| Объект исследования | Томская область | Все регионы | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| средн. | σ | мин. | макс. | диапазон | средн. | σ | мин. | макс. | диапазон | |
| Мёд | –26.5 | 0.3 | –26.8 | –26.1 | 0.7 | –26.6 | 1.0 | –29.0 | –24.9 | 4.1 |
| Мёд в сотах | –26.7 | 0.6 | –27.3 | –25.9 | 1.4 | –26.6 | 0.9 | –27.8 | –24.4 | 3.4 |
| Воск | –28.4 | 0.4 | –28.9 | –27.8 | 1.1 | –28.6 | 0.7 | –30.3 | –27.4 | 2.9 |
| Пыльцевая обножка | –27.4 | 1.2 | –28.8 | –25.1 | 3.7 | –27.5 | 1.6 | –31.2 | –25.1 | 6.1 |
| Прополис | –27.4 | 0.4 | –27.8 | –26.8 | 1.0 | –27.4 | 0.5 | –28.3 | –26.5 | 1.8 |
| Подмор пчел | –26.1 | 0.5 | –26.7 | –25.1 | 1.6 | –26.2 | 0.4 | –26.7 | –25.1 | 1.6 |
Таблица 2.
Величина δ13C (‰) в образцах подмора медоносных пчел и в продуктах их жизнедеятельности
| № п/п | Место отбора | Мёд | Мёд в сотах | Воск | Пыльцевая обножка | Прополис | Подмор пчел |
|---|---|---|---|---|---|---|---|
| Алтайский край | |||||||
| 1 | Красногорский район | –29.0 | –28.6 | –28.1 | –28.3 | –26.2 | |
| 2 | Красногорский район | –30.3 | –26.0 | ||||
| 3 | д. Захарово, Рубцовский район | –27.0 | –25.7 | ||||
| 4 | с. Краснощеково, Краснощековский район | –26.5 | –28.4 | –25.5 | –26.5 | –26.6 | |
| Томская область | |||||||
| 5 | с. Баткат, Шегарский район | –27.3 | –28.9 | –26.5 | –27.5 | –26.6 | |
| 6 | д. Тихомировка, Асиновский район | –26.7 | –28.2 | ||||
| 7 | д. Терсалгай, Кожевниковский район | –27.0 | –28.6 | –26.8 | |||
| 8 | г. Асино, Асиновский район | –27.3 | –28.8 | –25.1 | –26.4 | ||
| 9 | д. Романовка, Томский район | –26.8 | –26.9 | –27.9 | –27.2 | –27.2 | –25.9 |
| 10 | д. Романовка, Томский район | –26.0 | –28.4 | –28.4 | –27.8 | –26.1 | |
| 11 | с. Зырянское, Зырянский район | –26.8 | –27.7 | –27.1 | |||
| 12 | с. Новоархангельское, Томский район | –25.9 | –28.5 | –28.8 | –27.2 | ||
| 13 | п. Кандинка, Томский район | –28.2 | –26.7 | ||||
| 14 | д. Озёрное, Колпашевский район | –26.1 | –27.8 | –25.1 | |||
| 15 | д. Новониколаевка, Шегарский район | –26.3 | –27.8 | –27.3 | –27.5 | –26.0 | |
| 16 | п. Зырянка, Зырянский район | –26.3 | |||||
| Кемеровская область | |||||||
| 17 | п. Заозёрный, Юргинский район | –27.7 | –29.2 | –26.6 | –26.6 | ||
| 18 | п. Большой Керлегеш, Прокопьевский район | –26.7 | –28.2 | –25.7 | –28.1 | –26.2 | |
| Калужская область | |||||||
| 19 | Малоярославецкий район, Цимлянский заповедник | –27.8 | –27.8 | –29.8 | –27.9 | –26.8 | –26.4 |
| 20 | –24.9 | ||||||
| 21 | –25.6 | ||||||
| Краснодарский край | |||||||
| 22 | Туапсе | –24.4 | –27.4 | –27.1 | –27.2 | ||
| 23 | –26.1 | –31.2 | –27.8 | ||||
| 24 | –26.2 | –28.0 | –27.7 | –26.0 | |||
Подмор пчел – это мертвые тела насекомых, которые умерли естественным путем. В теле погибшего насекомого остаются все продукты его жизнедеятельности (белки, хитин и некоторые липиды).
Величина δ13С подмора пчел варьируется от –26.7 до –25.1‰. Среднее значение величины δ13С равно –26.2‰. Величина δ13C подмора пчел выше величины δ13C меда. Исключения составили образцы № 4 (с. Краснощеково Алтайского края), № 10 (д. Романовка Томской области) (табл. 2). Диапазон вариации величины δ13С подмора пчел согласно опубликованным данным лежит в диапазоне от –27.2 до –21.7‰ во Франции [11], а в Японии – от –27.4 до –23.9‰ [5].
Мед – продукт, производимый медоносными пчелами из нектара растений. Изотопное отношение углерода в растениях определяется процессом фотосинтеза с обогащением растения легким изотопом углерода 12С [12]. Степень обогащения зависит от пути ассимиляции углерода. В зависимости от пути фотосинтеза растения делятся на три основные группы: C3, C4 и CAM. Значение величины δ13С для растений в зависимости от их типа варьируется в разных диапазонах: для растений типа C3 между –22 и –33‰, для растений типа C4 между –10 и –20‰ (рис. 2), для CAM-растений между –11 и –13.5‰ [13].
Значения величины δ13C меда имеют тенденцию к увеличению с ростом количества солнечных дней и, следовательно, с увеличением средней температуры и уменьшением средней влажности [14].
Величина δ13C образцов меда Томской области варьируется в диапазоне от –27.3 до –25.9‰. Примерно в таком же диапазоне (от –27.7 до –26.7‰) изменяется величина δ13C образцов меда Кемеровской области. Средние значения величины δ13C образцов из районов с умеренно континентальным и средиземноморским климатом, таких как Калужская область (–26.5 или –25.3‰) и Краснодарский край (–25.6‰), выше, чем средние значения величины δ13C образцов меда из районов с континентальным климатом – Алтайский край (–27.5‰), Кемеровская область (‒27.2‰) и Томская область (–26.6‰).
Диапазон вариации величины δ13C всех проанализированных образцов меда − от –29 до ‒24.4‰. Изотопный анализ бразильского меда показал вариации величины δ13C (от –28.5 до ‒25.1‰) [15], итальянского (от –25.8 до –23.4‰) [16], словенского (от –27.4 до –23.4‰) [17], новозеландского меда (от –25.4 до –24.0‰) [18].
Пыльцевая обножка образуется при соединении цветочной пыльцы с нектаром и слюнными веществами пчел. Основными компонентами пыльцевой обножки являются углеводы (от 13 до 55%), сырые волокна (от 0.3 до 20%), белки (от 10 до 40%) и липиды (от 1 до 10%) [19]. Величина δ13С пыльцевой обножки варьируется от –31.2 до –25.1‰. Среднее значение величины δ13С равно –27.5‰. Максимальный разброс значения величины δ13С зафиксирован именно в пыльцевой обножке: Δδ13С = 6.1‰ для всех регионов, Δδ13С = = 3.7‰ для Томской области.
Пчелы собирают пыльцу с растений, а соотношения 13С/12C растений различаются для разных сред обитания из-за фракционирования изотопов углерода, что обусловлено географическим положением, климатом, а также антропогенным воздействием. Максимальное значение величины δ13С (–25.1‰) обнаружено для пыльцевой обножки образца № 8 (г. Асино Томской области). Предположительно, высокое значение величины δ13С можно объяснить тем, что растения в данной области находятся в угнетенных условиях (близость города, воздействие автотранспорта, использование синтетических удобрений на полях), т.е. при неблагоприятных условиях произрастания изотопный состав углерода растений обогащается тяжелым изотопом 13С. Минимальное значение величины δ13С (–31.2‰) зафиксировано для пыльцевой обножки, собранной пчелами во время цветения плюща (№ 23, табл. 2). Плющ – превосходный медонос, в Туапсинском районе цветeт в сентябре–октябре. Наше значение величины δ13С для плюща согласуется с данными (от –31.3 до ‒28.1‰), представленными в работе [20].
Величина δ13C пыльцевой обножки выше величины δ13C образцов лугового цветочного меда (№№ 1, 4, 5, 18, табл. 2) и ниже величины δ13C образцов лесного меда (№№ 9−12, 15, 22; табл. 2). Такое различие объясняется так называемым “эффектом лесного полога”. Концентрация 13С минимальна в приземном слое. Это связано с особенностями фотосинтеза растений в условиях затенения (лесной полог) и с фиксацией выделяемого почвой и лесной подстилкой СО2, обедненного изотопом 13С [21].
Воск производится пчелами для сооружения сот, в которых они проживают, хранят запасы мeда, выращивают потомство. На сегодняшний день известно более трехсот веществ, которые содержатся в воске. Величина δ13С всех образцов воска варьируется в пределах от –30.3 до –27.4‰. Среднее значение величины δ13С равно –28.6‰. Величина δ13C образцов воска ниже величины δ13C образцов меда и подмора пчел, за исключение образца № 1 (Красногорский район Алтайского края). Исследования новозеландских и немецких ученых показали, что диапазон значений величины δ13C новозеландских образцов воска изменяется в пределах от –23.2 до –26.8‰ [18], а немецких образцов – от –29.9 до –27.9‰ [22].
Прополис – вещество смолистого типа, производимое в процессе деятельности пчел, изготавливается пчелами на основе растительных элементов. Прополис не имеет единого состава. В процентном соотношении прополис включает: смолы и пыльцевой бальзам (50−60%); воск, добавляемый пчелами (30%); различные сочетания растительных веществ, обладающих индивидуальными свойствами (10%) [23]. Все это делает интерпретацию данных по прополису очень сложной. Величина δ13С всех исследуемых образцов прополиса варьируется от –28.3 до –26.5‰. Среднее значение величины δ13С равно –27.4‰, что более чем на 1‰ выше по сравнению с аналогичным значением для воска и ниже величин δ13C образцов меда. Исключения составили образцы № 1 (Алтайский край), № 7 (Томская область) и № 19 (Калужская область).
Сложный состав воска (из более чем трехсот веществ, содержащихся в воске, 75% составляют сложные жиры, велико также содержание свободных жирных кислот) и прополиса также является причиной различий в значениях δ13C и вызывает сложности при интерпретации данных изотопного состава. В биологических объектах фракционирование изотопов происходит не только за счет кинетического и магнитного изотопных эффектов, но и при других биохимических процессах (например, при дыхании, биосинтезе липидов). Как результат, одно и то же органическое вещество может иметь разное распределение изотопов внутри молекулы в зависимости от путей биосинтеза и условий среды [24, 25]. В работе [26] изучено распределение изотопов углерода между основными полимерами биомассы высших растений на примере структурных полимеров пшеницы (лигнин, гемицеллюлоза, целлюлоза, крахмал, белки, липиды). Крахмал и гемицеллюлоза оказались наиболее изотопно тяжелыми (–25.9 и –26.2‰ соответственно). Белки менее обогащены 13С (до –27.3‰), липиды и лигнин (–33.3 и ‒32.6‰) относятся к изотопно легким компонентам биомассы. Гетерогенность изотопного состава (от –33.3 до –25.9‰) биополимеров определяет изотопную неоднородность органов и частей растения. Таким образом, изотопная неоднородность может встречаться не только на уровне отдельных молекул, но и на уровне целых классов органических соединений.
Изотопный состав азота в образцах подмора медоносных пчел и в продуктах их жизнедеятельности. В табл. 3 и 4 представлены результаты определения изотопного состава азота в образцах подмора пчел и в продуктах их жизнедеятельности. Содержание азота в меде и воске очень мало, поэтому значения величины δ15N для воска не представлены, но о величине δ15N для меда можно судить по величине δ15N протеина.
Таблица 3.
Основная статистика величины δ15N (‰) в собранных образцах
| Объект исследования | Томская область | Все регионы | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| средн. | σ | мин. | макс. | диапазон | средн. | σ | мин. | макс. | диапазон | |
| Протеин | 4.2 | 0.8 | 2.8 | 5.1 | 2.3 | 4.2 | 1.8 | –0.7 | 8.3 | 9.0 |
| Прополис | 3.0 | 2.5 | 0.4 | 8.5 | 8.1 | 4.7 | 2.9 | 0.4 | 11.2 | 10.8 |
| Пыльцевая обножка | 5.2 | 1.9 | 2.3 | 7.2 | 4.9 | 3.8 | 2.6 | –2.8 | 7.2 | 10.0 |
| Подмор пчел | 6.5 | 1.9 | 4.7 | 9.8 | 5.1 | 6.2 | 1.7 | 4.1 | 9.8 | 5.7 |
Таблица 4.
Величина δ15N (‰) в образцах подмора пчел и в продуктах их жизнедеятельности
| № п/п | Место отбора | Протеин | Прополис | Пыльцевая обножка | Подмор пчел |
|---|---|---|---|---|---|
| Алтайский край | |||||
| 1 | Красногорский район | 8.3 | 8.0 | 2.7 | 7.9 |
| 2 | Красногорский район | ||||
| 3 | д. Захарово, Рубцовский район | 4.8 | |||
| 4 | с. Краснощеково, Краснощековский район | 4.8 | 7.0 | 3.2 | 6.7 |
| Томская область | |||||
| 5 | с. Баткат, Шегарский район | 4.6 | 2.8 | 4.1 | 6.1 |
| 6 | д. Тихомировка, Асиновский район | 3.8 | |||
| 7 | д. Терсалгай, Кожевниковский район | 5.1 | 1.4 | ||
| 8 | г. Асино, Асиновский район | 4.9 | 2.3 | 6.6 | |
| 9 | д. Романовка, Томский район | 5.0 | 1.9 | 6.9 | 5.5 |
| 10 | д. Романовка, Томский район | 3.2 | 3.0 | 6.2 | 8.1 |
| 11 | с. Зырянское, Зырянский район | 4.1 | 8.5 | 5.7 | |
| 12 | с. Новоархангельское, Томский район | 3.6 | 2.2 | 3.0 | |
| 13 | п. Кандинка, Томский район | 7.2 | 4.7 | ||
| 14 | д. Озёрное, Колпашевский район | 5.0 | 4.1 | 9.8 | |
| 15 | д. Новониколаевка, Шегарский район | 2.8 | 0.4 | 6.5 | 4.8 |
| 16 | п. Зырянка, Зырянский район | 4.6 | |||
| Кемеровская область | |||||
| 17 | п. Заозёрный, Юргинский район | 7.3 | 4.3 | 6.6 | |
| 18 | п. Большой Керлегеш, Прокопьевский район | 4.0 | 5.9 | 2.6 | 4.1 |
| Калужская область | |||||
| 19 | Малоярославецкий район, Цимлянский заповедник | 3.9 | 11.2 | 2.1 | 5.2 |
| 20 | 5.0 | ||||
| 21 | 2.9 | ||||
| Краснодарский край | |||||
| 22 | Туапсе | 4.1 | 4.1 | 4.1 | |
| 23 | –0.7 | 4.6 | –2.8 | ||
| 24 | 1.3 | 6.9 | 4.5 | ||
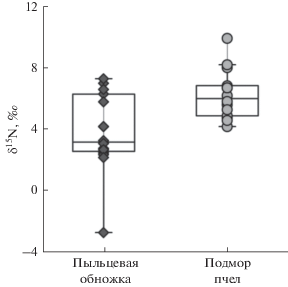
Среднее значение величины δ15N для пыльцевой обножки медоносных пчел составляет +3.8‰. Величина δ15N в образцах подмора пчел варьируется от +4.1 до +9.8‰. Диапазон вариации величины δ15N подмора пчел в целом сходен с опубликованными данными: величина δ15N пчел во Франции лежит в диапазоне от –4 до +10‰ [11], а в Японии – от –3.0 до+7.1‰ [5].
Средняя величина δ15N в образцах подмора пчел равна +6.2‰, что на 2.4‰ выше, чем в образцах пыльцевой обножки (рис. 3). Данная разница соответствует наибольшему трофическому уровню в цепочке “растение → пчела”, так как на каждом уровне метаболизма происходит увеличение концентрации 15N [27].
Азот – важный элемент питания растений. Они получают азот в виде аминокислот и белков из растворимых веществ верхнего слоя почвы, на котором произрастают. В связи с этим изотопный состав азота белковой фракции меда отражает почвенные условия района, где пчелы собирали мед (например, суглинистая почва лучше удерживает растворимые соединения азота, чем песчаная почва). Некоторые растения, например клевер и эспарцет, которые являются важными источниками монофлерных медов, симбиотически выделяют азот из воздуха. Следовательно, значения величины δ15N таких растений может быть около 0‰ [28].
Величина δ15N всех образцов протеина варьируется от –0.7 до +8.3‰. Среднее значение величины δ15N равно +4.2‰. Самый легкий изотопный состав азота (δ15N = –0.7‰) определен для образца меда из плюща (№ 23, табл. 4). Наибольшее значение величины δ15N определено для образца из Алтайского края (δ15N = +8.3‰), возможно, из-за обработки лугов удобрениями животного происхождения (навоз), в которых содержание 15N высокое [29]. Диапазон вариации значений величины δ15N протеина образцов бразильского меда составляет от +1 до +8‰ [15], итальянского − от –1 до +5.2‰ [16] и словенского − от –3.6 до +6.4‰ [17].
Величина δ15N всех образцов прополиса варьируется в достаточно широком диапазоне от +0.4 до +11.2‰. Среднее значение величины δ15N равно +4.7‰; это значение выше значения изотопного состава азота пыльцевой обножки и ниже величин δ15N образцов подмора пчел.
Наибольшие вариации изотопного состава азота характерны для пыльцевой обножки (табл. 3). Факторы, влияющие на изотопный состав азота в растении и пыльце, − это различный изотопный состав поглощаемых азотсодержащих соединений, который зависит как от типа соединения (нитраты, аммоний, органические компоненты), так и от локализации в почве; фракционирование изотопов в процессе поглощения и ассимиляции; микоризный статус растения [30]; климатические особенности [31]. Изотопный состав азота пыльцевой обножки медоносных пчел отражает наличие азотсодержащих веществ и почвенные условия в районе, где пчелы обитали. Например, в областях, подверженных высыханию, усиливается улетучивание аммиака (NH3) из почвы, что увеличивает концентрацию 15N, включенного в растительную ткань [32]. Значения величины δ15N значительно различаются в зависимости от вида растения. Примерами являются красный клевер − величина δ15N –0.27‰ (Trifolium pratense), бобы − +0.31‰ (Vicia faba), трава − +3.21‰ (смесь), кукурузный силос − +4.24‰ и рапс − +8.73‰ (Brassica napus) [33]. В нашем исследовании примером является пыльца плюща, собранная пчелами в Туапсинском районе в сентябре (№ 23, табл. 4), с величиной δ15N = = –2.75‰.
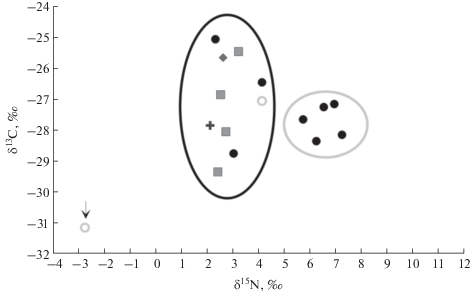
Из рис. 4 видно, что географическое положение не влияет на значения изотопного состава азота в пыльцевой обножке исследуемых образцов. Вариации значений δ15N в диапазоне от +2‰ до +4‰ характерны для всех исследуемых регионов, и они согласуются со значениями δ15N для травянистых растений Канады [34]. Для пяти образцов, отобранных в Томской области, зафиксировано более высокое содержание 15N, значения δ15N изменяются в пределах от +5.5 до +7.7‰. Однако величина δ13С для этих образцов имеет достаточно низкие значения от –28.6 до ‒27‰. На основании этого факта мы исключили предположение о влиянии локальных климатических факторов. В условиях высоких температур и нехватки воды усиливается выделение аммиака из почвы и увеличивается концентрация 15N, включенного в растительную ткань, а фракционирование изотопов углерода угнетается, что приводит к более высокому содержанию 13C в растительных продуктах. По-видимому, более высокое содержание 15N может быть связано либо с почвенными условиями и наличием азотсодержащих соединений в почве, либо с содержанием в кормовой базе пчел в основном растений-медоносов с высоким содержанием 15N (например, рапса).
* * *
Таким образом, изотопный состав углерода меда является географическим маркером происхождения меда. Высокие значения δ13C характерны для образцов меда европейской части России и черноморского региона. Значения величины δ13C меда из регионов Сибири более низкие. Аналогичная характеристика значений δ13C прослеживается и для воска. Сравнительный анализ изотопного состава углерода меда и выделенного из него протеина показал, что все образцы проанализированного меда являются подлинными. Установлено, что изотопные составы углерода пчел и продуктов их жизнедеятельности могут иметь значительные отличия. Это связано с тем, что отдельные биохимические фракции, индивидуальные соединения и даже фрагменты одного соединения имеют разный изотопный состав. Например, липиды показывают систематическую обогащенность изотопом 12С. Углеводы и белки обычно обеднены легким изотопом. Наши результаты еще раз подтвердили вывод о возможности существования изотопных эффектов не только на стадии фотосинтеза, но и при других биохимических процессах (дыхание, биосинтез липидов, углеводов, аминокислот). Анализ изотопного состава азота показал, что в тканях пчел среднее значение величины δ15N равно +6.2‰, что приблизительно на 1.7‰ выше, чем в образцах протеина и прополиса и на 2.4‰ выше, чем в образцах пыльцевой обножки, что соответствует наибольшему трофическому уровню в цепочке “растение → пчела”. Вариации значений δ15N пыльцевой обножки в диапазоне от +2 до+4‰ характерны для всех исследуемых регионов, они согласуются со значениями δ15N для травянистых растений. Однако для пяти образцов пыльцевой обножки, отобранных в Томской области, зафиксировано более высокое содержание 15N. Этот вопрос требует дополнительного исследования: для выявления ботанического происхождения и идентификации пыльцы основных таксонов необходимо провести мелиссопалинологический анализ, а для выявления азотсодержащих соединений в почвах – изотопный анализ азота почвенных образцов.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-34-90016.
Список литературы
Лебедев А.Т. Масс-спектрометрия для анализа объектов окружающей среды. М.: Техносфера, 2013. С. 632.
Кадиров Р.А. Пчелы как индикаторы загрязнения окружающей среды некоторыми поллютантами. Дис. … канд. биол. наук. М., 1999. 113 с.
Коркина В.И. Загрязнение тяжелыми металлами пыльцевой обножки, собранной медоносными пчелами на юге Западной Сибири // Сибирский вестник сельскохозяйственной науки. 2008. № 5. С. 154.
Петухов А.В., Уланова Т.С., Завгородняя И.С. Оценка экологической обстановки отдельных территорий Пермской области с помощью медоносных пчел / Вопросы апидологии: Сборник статей. Удмуртский государственный научно-исследовательский институт сельского хозяйства РАСХН. Ижевск, 2000. С. 76.
Taki H., Ikeda H., Nagamitsu T., Yasuda M., Sugiura S., Maeto K., Okabe K. Stable nitrogen and carbon isotope ratios in wild native honeybees: The influence of land use and climate // Biodivers. Conserv. 2017. V. 26. P. 3157.
AOAC. Official methods of analysis method 998.12: C‑4 plant sugars in honey. Internal standard stable carbon isotope ratio method. AOAC International, 1998.
Cerling T.E., Barnette J.E., Bowen G.J., Chesson L.A., Ehleringer J.R., Remien C.H., Shea P., Tipple B.J., West J.B. Forensic stable isotope biogeochemistry // Annu. Rev. Earth Planet. Sci. 2016. V. 44. P. 175.
Xiaoteng Z., Taylor M.P., Salouros H., Prasad S. Authenticity and geographic origin of global honeys determined using carbon isotope ratios and trace elements // Sci. Reports. 2018. V. 8. Article 14639.
White J.W., Winters K. Honey protein as internal standard for stable carbon isotope ratio detection of adulteration of honey // J. Assoc. Off. Anal. Chem. 1989. V. 72. P. 907.
Ветрова О.В., Калашникова Д.А., Мелков В.Н., Симонова Г.В. Выявление фальсификации меда сахарными сиропами методом масс-спектрометрии стабильных изотопов // Журн. аналит. химии. 2017. Т. 72. № 7. С. 645. (Vetrova O.V., Kalashnikova D. A., Melkov V. N., Simonova G. V. Detection of honey adulterations with sugar syrups by stable isotope mass spectrometry // J. Anal. Chem. 2017. V. 72. № 7. Р. 756.)
Rankovic A., Geslinc B., Perrard A., Barbillon A., Vaury V., Abbadie L., Dajoz I. Urbanization effects on wild bee carbon and nitrogen stable isotope ratios in the Paris region // Acta Oecol. 2020. V. 105. Article 103545.
Галимов Э.М. Природа биологического фракционирования изотопов. М.: Наука, 1981. С. 246.
Padovan G.J., Rodriques L.P., Leme I.A., Jong D.D., Marchini J.S. Presence of C4 sugars in honey samples detected by the carbon isotope ratio measured by IRMS // Eurasian J. Anal. Chem. 2007. V. 2. № 3. P. 134.
Jonasson S., Medrano H., Flexas J. Variation in leaf longevity of Pistacia lentiscus and its relationship to sex and drought stress inferred from leaf delta δ13C // Funct. Ecol. 1997. V. 11. № 3. P. 282.
Veiga S.J. Detecção de adulteração e determinação da origem geográfica de méis de abelhas sem ferrão do Brasil utilizando a razão isotópica do C, H, O e N. Thesis, 2017. 67 p.
Bontempo L., Camin F., Ziller L., Perini M., Nicolini G., Larcher R. Isotopic and elemental composition of selected types of Italian honey // Measurement. 2017. V. 98. P. 283.
Kropf U., Golob T., Nečemer M., Kump P., Korošec M., Bertoncelj J., Ogrinc N. Carbon and nitrogen natural stable isotopes in Slovene honey: Adulteration and botanical and geographical aspects // J. Agric. Food Chem. 2010. V. 58. P. 12794.
Rogers K.M. Eliminating false positive C4 sugar tests on New Zealand Manuka honey // Rapid Commun. Mass Spectrom. 2010. V. 24: P. 2370.
Pascoal A., Rodrigues S., Teixeira A., Feás X., Estevinho L.M. Biological activities of commercial bee pollens: Antimicrobial, antimutagenic, antioxidant and anti-inflammatory // Food Chem. Toxicol. 2014. V. 63. P. 233.
Raschi A., Miglietta F., Tognetti R., Gardingen P.V. Plant Responses to Elevated CO2: Evidence from Natural Springs. Cambridge University Press, Cambridge, UK, 1997. P. 286.
Merwe N.V.D., Medina E.T.G. The canopy effect, carbon isotope ratios and food webs in Amazonia // J. Archeol. Sci. 1991. V. 18. P. 249.
Bengsch E., Kettrup A., Stocker A., Rossmann A. Authentizitätsbestimmung von Gelee Royale und/oder seiner Komponenten durch (Multi) Isotopenanalyse. DE10344606A1. 2003. Date of publication 16.06.2011.
https://ferma.expert/pchely/pcheloprodukciya/pchelinye-soty/ (25.08.2020).
Abelson P.H., Hoering T.C. Carbon isotope fractionation in formation of amino acids by photosynthetic organisms // Proc. Natl. Acad. Sci. USA. 1961. V. 47. № 5. P. 623.
Кодина Л.А., Генералова В.Н. Внутримолекулярные и межмолекулярные изотопные эффекты на примере фенольных соединений и аминокислот природного происхождения / Рефераты докладов и сообщений IХ Менделеевского съезда по общей и прикладной химии. Алма-Ата. 1975. М.: Наука, 1975. Т. 1. С. 308.
Кодина Л.А. Распределение изотопов углерода в разных формах биогенного органического вещества I. Распределение изотопов углерода между основными полимерами биомассы высших растений // Геохимия. 2010. № 12. С. 1235.
Hyodo F. Use of stable carbon and nitrogen isotopes in insect trophic ecology // Entomol. Sci. 2015. V. 18. P. 295.
Schellenberg A., Chmielus S., Schlicht C., Camin F., Perini M., Bontempo L., Heinrich K., Kelly S. D., Rossmann A., Thomas F., Jamin E., Horacek M. Multielement stable isotope ratios (H, C, N, S) of honey from different European regions // Food Chem. 2010. V. 121. P. 770.
Bateman A.S., Kelly S.D. Fertilizer nitrogen isotope signatures // Isotopes Environ. Health Stud. 2007. V. 43. № 3. P. 237.
Макаров М.И. Изотопный состав азота в почвах и растениях: использование в экологических исследованиях (обзор) // Почвоведение. 2009. Т. 12. С. 1432.
Szpak P. Complexities of nitrogen isotope biogeochemistry in plant-soil systems: Implications for the study of ancient agricultural and animal management practices // Front. Plant Sci. 2014. V. 5. P. 288.
Nommik H., Pluth D.J., Larsson K., Mahendrappa M.K. Isotopic fractionation accompanying fertilizer nitrogen transformations in soil and trees of a Scots Pine ecosystem // Plant Soil. 1994. V. 158. P. 169.
Stocker A., Rossmann A., Kettrup A., Bengsch E. Detection of royal jelly adulteration using carbon and nitrogen stable isotope ratio analysis // Rapid Commun. Mass Spectrom. 2006. V. 20. № 2. P. 181.
Schwarz D.M. A stable isotope investigation of pollen from Pinery Provincial Park, Southwestern Ontario, Canada. Electronic Thesis and Dissertation Repository, 2016. No. 4254.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии