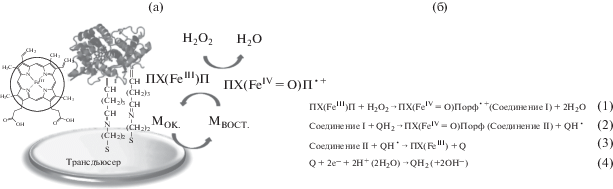Журнал аналитической химии, 2021, T. 76, № 4, стр. 350-358
Биосенсоры на основе пероксидазы хрена с различными типами нанотрансдъюсеров для определения пероксида водорода
К. Г. Николаев a, С. С. Ермаков b, Ю. Е. Ермоленко b, Д. В. Наволоцкая b, А. Оффенхойзер c, Ю. Г. Мурзина c, *
a Санкт-Петербургский национальный исследовательский университет информационных технологий,
механики и оптики
191002 Санкт-Петербург, ул. Ломоносова, 9, Россия
b Институт химии, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
c Institute of Biological Information Processing (IBI-3)
Forschungszentrum Jülich
52425 Jülich, Germany
* E-mail: y.mourzina@fz-juelich.de
Поступила в редакцию 15.09.2020
После доработки 21.10.2020
Принята к публикации 02.11.2020
Аннотация
Изучены методы in situ синтеза наноструктур золота на поверхности электродов и направленнoго электрохимического синтеза нанодендритов для создания биосенсоров на основе фермента пероксидазы хрена. Исследовано влияние наноструктурирования поверхности трансдъюсера и его последующей модификации на электроаналитические характеристики сенсоров для определения пероксида водорода. Использование данных методов позволяет существенно улучшить аналитические характеристики биосенсоров, такие как коэффициент чувствительности, предел обнаружения и стабильность в области микромолярных и субмикромолярных концентраций пероксида водорода. Для электродов, модифицированных с помощью метода in situ синтеза наноструктур с последующей обработкой реагентом Меервейна, а также для ультрамикроэлектродов, приготовленных методом направленного электрохимического синтеза, достигнуты низкие пределы обнаружения пероксида водорода 0.2 и 0.08 мкМ, а также высокие коэффициенты чувствительности 0.71 и 0.84 А М–1 см–2 соответственно.
После изобретения в 1962 г. первого электрохимического ферментного сенсора для определения глюкозы [1] ведутся работы по иммобилизации ферментов, а также организации прямого и медиаторного переноса [2–5] для создания электрохимических ферментных биосенсоров. Наряду с интересом к пероксиду водорода как к самостоятельному аналиту, возможность использования его аналитического сигнала для определения таких веществ, как глюкоза, лактат, ацетилхолин, моноамины, являющихся субстратами соответствующих оксидоредуктаз [4, 6], способствовало развитию электрохимических сенсоров. Кроме того, сенсоры на пероксид водорода могут применяться для оценки антиоксидантной активности, а также для определения широкого круга токсичных аминов и фенолов в целях экологического контроля и мониторинга. Диапазоны определяемых концентраций пероксида водорода варьируются в широких пределах, от субмикромолярных и микромолярных до молярных [7, 8].
В настоящее время продолжаются разработки и исследования биосенсоров, основанных на явлении биоэлектрокатализа с использованием фермента пероксидазы хрена. Предложено несколько способов конструкции ферментных электродов: 1) модификация поверхности электрода адсорбированным или ковалентно связанным ферментом, 2) модификация поверхности электрода проводящими редокс-полимерами, в которых молекулы пероксидазы физически или химически связаны, 3) использование модифицированных композитных электродов, в которых молекулы пероксидазы однородно распределены в смеси проводящих и изоляционных материалов (на основе угольно-пастовых электродов). Важным этапом являются серии работ, посвященных биосенсорам, основанным на ферменте пероксидазы, генетически модифицированном с целью повышения скорости прямого электронного переноса и стабильности электрода [2, 5].
Интересное направление в развитии биосенсоров – применение наноматериалов, в первую очередь, на основе металлов и углеродных материалов [9]. Применение наноматериалов в сочетании с биоэлектрокатализаторами позволило в ряде случаев реализовать схему прямого переноса в ферментных сенсорах, хотя данные работы сопряжены со множеством артефактов [10, 11]. Кроме того, использование трехмерного наноструктурирования поверхностей позволяет увеличить эффективную поверхность электрода при практически одинаковой геометрической поверхности и, следовательно, увеличить чувствительность на единицу геометрической поверхности, а также повысить стабильность иммобилизованного фермента.
Наши предыдущие работы посвящены синтезу наноструктур золота с использованием олеиламина в качестве восстановителя и стабилизирующего агента (ОА-Au НС), а также методам иммобилизации наноструктур на электроде и модификации поверхности для создания биосенсоров на основе пероксидазы [12–14]. В данной работе мы использовали следующие методы: 1) in situ синтез наноструктур непосредственно на поверхности электрода в сочетании с обработкой поверхности электрода реагентом Меервейна (активация поверхности) и 2) направленный электрохимический синтез нанодендритов в качестве ультрамикроэлектродов (УМЕ) для создания биосенсоров на основе пероксидазы.
Настоящая работа посвящена сравнению аналитических характеристик различных типов сенсоров на основе наноструктурированных транс-дъюсеров с целью изучения влияния способа наноструктурирования поверхности трансдъюсера на аналитические характеристики сенсоров (коэффициент чувствительности, предел обнаружения, диапазон определяемых концентраций, воспроизводимость и стабильность отклика).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и аппаратура. Использовали трехэлектродную электрохимическую ячейку и потенциостат AUTOLAB (PGSTAT 302, Нидерланды). Диаметр рабочего электрода в электрохимической ячейке для измерений с тонкопленочными электродами составлял 0.5 см. Объем ячейки для измерений УМЕ, полученных методом направленного электрохимического синтеза, составлял 100 мкл. Применяли хлоридсеребряный электрод сравнения Ag/AgCl (DRIREF-450, WPI), вспомогательным электродом являлся платиновый электрод.
Фермент пероксидаза хрена (тип VI-A) (ПХ), цистеамин, глутаровый альдегид, пероксид водорода, тетрахлорид золота(III) тригидрат и другие реактивы классификации ос. ч. приобретали у Sigma-Aldrich (США).
Наноструктурированные поверхности электродов анализировали методом сканирующей электронной микроскопии с использованием системы Magellan ™ XHR SEM.
Методы синтеза наноструктур. Золотые тонкопленочные электроды Si/SiO2 (1 мкм)/Ti (10 нм)/Au (400 нм), 11 мм × 11 мм (ТПЭ) для модификации наноструктурами золота in situ получали в чистой комнате класса ISO 5, как описано в работе [15]. Перед модификацией наноструктурами проводили химическую и электрохимическую очистку электродов, как описано в работе [12].
Модификацию предварительно очищенных электродов наноструктурами золота, стабилизированными олеиламином, проводили двумя способами: 1) адсорбцией заранее синтезированных наноструктур, как описано в работах [13, 14], 2) методом синтеза in situ путем помещения ТПЭ в колбу для синтеза по модифицированной методике, описанной в работах [16, 17]. В данной работе электроды для модификации in situ помещали в раствор для синтеза на 12 ч перед началом нагревания с обратным холодильником, что улучшало адгезию и стабильность наноструктур на поверхности тонких пленок. В колбу для синтеза с ТПЭ добавляли гомогенизированную смесь 35 мг тригидрата тетрахлорида золота, 400 мкл олеиламина и 40 мл толуола и оставляли на 12 ч. Далее смесь медленно нагревали до 105–110°С и выдерживали при этой температуре 35 мин, пока цвет раствора не становился слабо розовым, что свидетельствовало о начале образования наночастиц золота. После снижения температуры раствора до комнатной закрытый раствор оставляли на сутки, потом добавляли 25 мг аскорбиновой кислоты, что способствует образованию нанопроволок из наночастиц по механизму ориентированного присоединения наночастиц [18]. Раствор с электродами оставляли на сутки в темноте, при этом цвет раствора постепенно приобретал темно-фиолетовую окраску, после чего электроды промывали этанолом, водой и ацетоном.
В данной работе для удаления оболочки органических аминов на поверхности наноструктур с целью их последующего использования для иммобилизации фермента пероксидазы и электрохимических экспериментов использовали гексан и обработку в плазме кислорода (diener electronic), а также реагент Меервейна (тетрафторборат триэтилоксония, ${{[{{({\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{{\text{3}}}}{\text{O}}]}^{ + }}{\text{BF}}_{{\text{4}}}^{ - }$ в качестве окислителя [15, 19]. Модифицированные наночастицами золота электроды погружали в 0.1 М раствор реагента Меервейна в ацетонитриле на 10 мин, после чего промывали ацетонитрилом и водой.
Для синтеза наноструктурированных УМЭ использовали метод направленнго электрохимического синтеза нанодендритов из 0.01 М растворов тетрахлорида золота [20, 21].
Эффективную площадь поверхности электродов рассчитывали по пику восстановления оксидов золота из циклических вольтамперограмм в 0.1 М H2SO4 [20].
Иммобилизацию пероксидазы на поверхности электрода проводили методом ковалентного связывания фермента на поверхности тонкопленочных электродов, модифицированных наноструктурами золота, и наноструктурированных УМЭ. Для этого использовали метод хемосорбции тиольных групп цистеамина на поверхности золота, образующих самоорганизующиеся слои. Электроды, модифицированные наноструктурами золота, оставляли на 2 ч в 1 мМ растворе цистеамина в гексане при комнатной температуре; УМЭ оставляли на 30 мин в 1 мМ растворе цистеамина в гексане. Электроды промывали гексаном и 0.1 М фосфатным буферным раствором (ФБ) с pH 6.8. Далее проводили иммобилизацию гомобифункционального сшивающего реагента глутарового альдегида из его 2%-ного раствора в 0.1 М ФБ в течение 2 ч при комнатной температуре, затем электроды промывали ФБ. Далее электроды помещали в раствор пероксидазы с концентрацией 5 мг/мл и оставляли на 20 мин при 25°С, а потом еще на 12 ч в при 4°С. Электроды промывали 0.1 М ФБ (pH 6.5) и хранили при 4°С во влажной атмосфере. На рис. 1 приведена схема модифицированного электрода. Электрохимические измерения проводили в 0.1 M ФБ, который содержал 1 мM гидрохинона в качестве медиатора.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
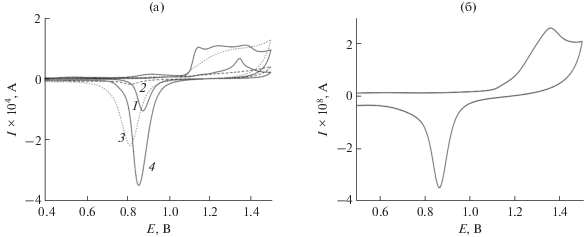
Микрофотографии наноструктур, использованных в данной работе для получения сенсоров на пероксид водорода, представлены на рис. 2а и 2б. Тонкопленочные электроды, модифицированные наноструктурами золота (ОА-Au НС) in situ, до и после обработки реагентом Меервейна показывают образование на поверхности структур двух типов: стабилизированных олеиламином наночастиц (ОА-Au НЧ) и ультратонких нанопроволок (ОА-Au НП). На рис. 2в представлен образец нанодендритного золотого УМЭ, полученного методом направленного электрохимического синтеза нанопроволок.
Рис. 2.
Микрофотографии наноструктур: (а) – поверхность тонкопленочного электрода, модифицированного наноструктурами золота in situ, без обработки поверхности; (б) – то же с обработкой поверхности реагентом Меервейна; (в) – нанодендритный золотой УМЭ, полученный методом направленного электрохимического синтеза, вставка показывает электрод с изоляцией и находящимися под слоем изолятора контактами.

Результаты электронной микроскопии свидетельствуют о том, что полученная методом in situ синтеза наноструктурированная поверхность сохраняется и после обработки реагентом Меервейна. Такая обработка приводит, с одной стороны, к частичной агрегации наноструктур, а с другой, – к удалению гидрофобной оболочки, что делает наноструктурированную поверхность доступной для дальнейшей модификации с целью получения электрохимических биосенсоров. В других экспериментах для удаления стабилизатора наноструктур с поверхности использовали очистку органическими растворителями и обработку в плазме кислорода, что привело к худшим результатам. Данные электронной микроскопии подтверждены результатами электрохимических измерений (рис. 3а), в которых определена эффективная площадь поверхности электродов при одинаковой геометрической площади, задаваемой электрохимической ячейкой. Эффективная площадь поверхности золотых электродов в зависимости от обработки поверхности составила 0.29 ± 0.01 см2 для немодифицированного ТПЭ, 0.88 ± 0.16 см2 для наноструктурированного электрода с обработкой поверхности после синтеза этанолом, водой и ацетоном, 1.4 ± 0.08 см2 при дополнительной обработке поверхности реагентом Меервейна и (0.1 ± 0.005) × × 10–3 см2 для УМЭ. Очевидно, что модификация наноструктурами и удаление органического стабилизатора наноструктур с поверхности электрода приводит к увеличению эффективной площади поверхности электрода.
Рис. 3.
Циклические вольтамперограммы, полученные для (а): 1 – золотого тонкопленочного электрода, 2 – золотого тонкопленочного электрода, модифицированного наноструктурами in situ, без обработки поверхности, 3 – электрода 2 с последующей обработкой поверхности этанолом и ацетоном, 4 – электрода 2 с последующей обработкой поверхности реагентом Меервейна; (б) – нанодендритного Au-ультрамикроэлектрода. 0.1 М H2SO4, 0.05 В/с.
Ковалентная иммобилизация ферментов на поверхности электрода улучшает стабильность и воспроизводимость модифицированных электродов по сравнению с адсорбцией. В связи с этим в данной работе пероксидазу иммобилизовали на электродах, как описано в “Экспериментальной части” в разделе “Иммобилизация пероксидазы на поверхности электрода” и показано на рис. 1.
Исследовали отклики сенсора на основе прямого электронного переноса и с участием медиатора. Однако стабильного и воспроизводимого прямого электронного переноса между каталитическим центром фермента и электродами не происходит, поэтому электрокаталитические свойства сенсора для определения пероксида водорода оценивали путем определения пероксида водорода в присутствии редокс-медиатора [7, 13]. Для электродов, модифицированных пероксидазой, зависимость тока восстановления медиатора от концентрации пероксида водорода иллюстрирует рис. 1, при этом зависимость линейна в условиях лимитирующей стадии массопереноса.
Для сравнения аналитических характеристик сенсоров использовали следующие параметры: предел обнаружения, коэффициент чувствительности, линейный диапазон определяемых концентраций, воспроизводимость и стабильность отклика сенсоров [22, 23]. Предел обнаружения находили в соответствии с рекомендациями ICH [22] как 3.3s/b, где s – стандартное отклонение измерений в фоновом растворе без пероксида водорода, b – наклон градуировочной зависимости в диапазоне низких концентраций.
На рис. 4 приведены примеры отклика сенсоров на изменение концентрации пероксида водорода (градуировочные кривые). Можно заметить, что для электродов с наноструктурированной поверхностью токи восстановления окисленного медиатора значительно выше по сравнению с модифицированным пероксидазой ТПЭ. Это можно объяснить большим количеством электроактивного фермента, иммобилизованного на наноструктурированных электродах по сравнению с ТПЭ. Соответственно коэффициенты чувствительности, найденные по наклону градуировочного графика в диапазоне линейной зависимости отклика сенсора от концентрации пероксида водорода, имеют более высокие значения от 0.22 до 0.84 A M–1 cm–2 для электродов с наноструктурированными поверхностями по сравнению с 0.06 A M–1 cm–2 для ТПЭ, модифицированного пероксидазой (табл. 1). Как видно из рис. 4 и табл. 1, сенсоры на основе пероксидазы, иммобилизованной на наноструктурированных электродах, демонстрируют гораздо лучшие характеристики чувствительности, более широкие диапазоны рабочих концентраций и более низкие пределы обнаружения. Наилучшие характеристики, наиболее низкие пределы обнаружения 0.2 и 0.08 мкМ, а также высокие коэффициенты чувствительности получены для модифицированных электродов с наноструктурами, синтезированными в настоящей работе непосредственно на поверхности электрода in situ с последующей обработкой реагентом Меервейна, и для УМЭ, приготовленных методом направленного электрохимического синтеза наноструктур, соответственно. Такие результаты можно объяснить большей стабильностью и более высокой плотностью наноструктур при их синтезе методом in situ, а также более эффективным удалением изолирующей оболочки стабилизатора, что позволило иммобилизовать большее количество электроактивного фермента на единицу площади. Теоретическая оценка максимальной чувствительности электорода составила 1 A M–1 cm–2 для диффузионного режима, когда ток лимитируется массопереносом H2O2 [7, 30]. Из табл. 1 видно, что полученные сенсоры на основе наноструктурированных поверхностей электродов обладают высокими коэффициентами чувствительности, сравнимыми с указанной теоретической оценкой.
Рис. 4.
(а) Примеры отклика сенсоров. c(H2O2), мМ: 1, 2 – 0; 3, 4 – 0.5. 1, 3 – Au ТПЭ/ПХ; 2, 4 – Au ТПЭ/in situ OA-Au НС с обработкой реагентом Меервейна/ПХ. 0.1 M фосфатный буферный раствор, pH 6.8, 0.05 В/с. (б) Градуировочные зависимости биосенсоров на основе ковалентно иммобилизованного фермента пероксидазы хрена: 1 – Au ТПЭ/ПХ, 2 – Au ТПЭ/Ц-НЧ (наночастицы, стабилизированные цитратом)/ПХ, 3 – Au ТПЭ/OA-НЧ/ПХ, 4 – Au ТПЭ/OA-НП/ПХ, 5 – Au ТПЭ/in situ Au OA-НС/ПХ с обработкой реагентом Меервейна. 0.1 M фосфатный буферный раствор, pH 6.8, 0.05 В/с. (в) Au-УМЕ/ПХ, на вставке изображена амперометрическаяю кривая. На кривых отмечены доверительные интервалы для P = 0.95, n = 5.
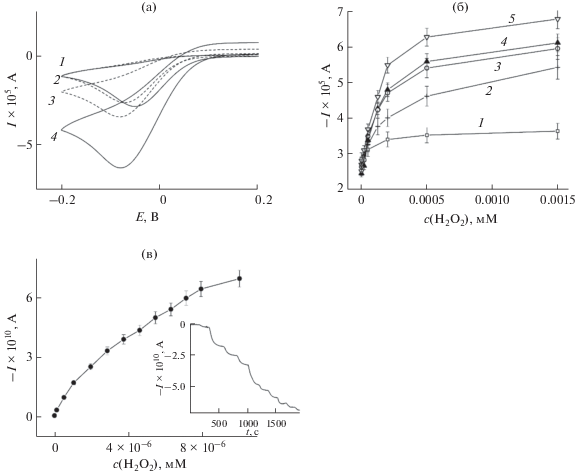
Таблица 1.
Характеристики электрохимических биосенсоров на основе пероксидазы с различными типами нанотрансдъюсеров для определения пероксида водорода
| Трансдъюсер/сенсорный элемент | Коэффициент чувствительности, А М–1 см–2 | Предел обнаружения, мкМ | Линейный диапазон, мкМ | Стабильность, %/метод детектирования | Литература |
|---|---|---|---|---|---|
| Тонкая пленка Au (400 нм)/пероксидаза | 0.13 (R2 = 0.9421)1 | 162, 3 | 18–210 | 824/ЦВ, –0.07 В | [13] |
| Наночастицы Au (стабилизирующий агент – олеиламин, 10–14 нм)/пероксидаза | 0.53 (R2 = 0.9595)1 | 82, 3 | 10–240 | 914/ЦВ, –0.07 В | [13] |
| Наночастицы Au (стабилизирующий агент – цитрат, 15–19 нм)/пероксидаза | 0.34 (R2 = 0.9224)1 | 102, 3 | 16–200 | 904/ЦВ, –0.07 В | [14] |
| Нанопроволоки Au (стабилизирующий агент – олеиламин, диаметр 2–5 нм, длина 1–5 мкм)/пероксидаза | 0.60 (R2 = 0.9632)1 | 52, 3 | 10–250 | 914/ЦВ, –0.07 В | [13] |
| Смешанные наноструктуры Au (синтез in situ, нанопроволоки диаметр 2–15 нм, длина 0.5–2 мкм; наночастицы 10–14 нм), активация реагентом Меервейна/пероксидаза | 0.71 (R2 = 0.9822) | 0.22, 3 | 0.14–200 | 924/ ЦВ, –0.07 В | Данная работа |
| Нанодендриты (100–1000 нм)/пероксидаза | 0.84 (R2 = 0.9758) 0.35 (R2 = 0.9753) |
0.082, 3 | 0.1–2 | 895/ А, –0.07 В | Данная работа |
| 2–10 | |||||
| Углеродное волокно/графен /гемоглобин | 1.4 | 2 | 8–214 | >1 мес/A, –0.5 В | [24] |
| Стеклоуглеродный электрод/ZnO, наночастицы Au, пероксидаза, нафион | – | 9 | 15–1100 | –/A, –0.3 В | [25] |
| Электрод Au/рекомбинантные формы пероксидазы | 1.5 | 0.01 | – | t1/2 = 72–96 ч/А, –0.05 В | [5, 26] |
| Стеклоуглеродный электрод/пероксидаза в электронопроводящем редокс-полимере с включением комплексов осмия(III/II) в качестве медиатора | – | – | 0.005–0.05 | –/А, 0 В | [27] |
| 1 | 0.1–100 | –/вращающийся дисковый электрод, 0 В | [28] | ||
| Смешанный оксид индия–олова/ Ag–C нанокомпозитный материал типа ядро–оболочка, пероксидаза | – | 0.2 | 0.5–140 | 92 (1 мес)/A, –0.3 В | [29] |
Обозначения: “–” – информация отсутствует, ЦВ – циклическая вольтамперометрия, А – амперометрия. 1В предыдущей работе была допущена расчетная ошибка, которая исправлена в данной работе. Для этих сенсоров приведены значения коэффициента чувствительности и диапазон концентраций, который может быть описан линейной зависимостью со значением коэффициента детерминации R2, близким к единице; 23.3s/b; 3относительное стандартное отклонение вблизи предела обнаружения составляет 9–12%; 4в % от отклика сенсора в 50 мкM H2O2 через 1 мес после изготовления по сравнению с новым сенсором; 5в % от отклика сенсора в 1 мкM H2O2 через 1 мес после изготовления.
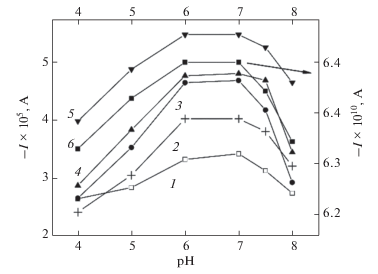
Влияние pH на отклик сенсора иллюстрирует рис. 5. Диапазон pH отражает оптимальные условия как для ферментативных, так и для электрохимических реакций на электродах с ковалентно иммобилизованными ферментами и может отклоняться от диапазона pH ферментативных реакций в растворах, найденных другими методами. Абсолютное значение тока восстановления возрастает с увеличением рН от 4.0 до ~7.0. Чуть более широкий интервал рН наблюдается для электродов на основе нанопроволок (рис. 5, кривые 4 и 5). Это может быть связано с тонкой многослойной структурой поверхности нанопроволочных электродов и эффектом зарядов и электрического поля двойного слоя на поверхностях нанопроволок, влияющих на протонирование функциональных групп молекул. При низких значениях pH отклик сенсора ухудшается, что может быть связано с денатурацией фермента. Поскольку максимальные абсолютные значения токов восстановления достигаются между pH 6.0 и 7.0, далее работали в этом интервале pH.
Рис. 5.
Зависимость отклика сенсоров от pH раствора: 1 – Au ТПЭ/ПХ, 2 – Au ТПЭ/Ц-Au НЧ/ПХ, 3 – Au ТПЭ/OA-Au НЧ/ПХ, 4 – Au ТПЭ/OA-Au НП/ПХ, 5 – Au ТПЭ/in situ OA-Au НС/ПХ с обработкой реагентом Меервейна в присутствии медиатора и 200 мкМ H2O2, 6 – Au-УМЕ/ПХ, в присутствии медиатора и 80 мкМ H2O2.
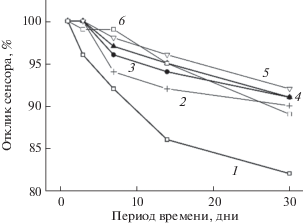
Воспроизводимость сенсоров оценивали с помощью измерений их отклика в 100 мкМ H2O2 и 2 мкМ H2O2 для Au-УМЕ/ПХ. Относительное стандартное отклонение пяти последовательных измерений для одного сенсора составило 3–6%. Результаты изучения долгосрочной стабильности сенсоров при хранении в ФБ при pH 6.5 и 4°C приведены на рис. 6 и в табл. 1.
Рис. 6.
Стабильность сенсоров (% от отклика сенсоров в 50 мкM растворе H2O2 по сравнению с первоначальным откликом): 1 – Au ТПЭ/ПХ, 2 – Au ТПЭ/Ц-Au НЧ/ ПХ, 3 – Au ТПЭ/OA-Au НЧ/ПХ, 4 – Au ТПЭ/OA-Au НП/ПХ, 5 – Au ТПЭ/in situ OA-Au НС/ПХ с обработкой реагентом Меервейна, 6 – Au-УМЕ/ПХ. pH 6.8.
Селективность биосенсоров изучали по отношению к ряду веществ с целью оценки их влияния на аналитический сигнал. Найдено, что определению 50 мкМ H2O2 не мешают равные концентрации допамина, мочевой кислоты, γ-аминомасляной кислоты, 2.5 мМ растворов глюкозы и фруктозы. Равные концентрации аскорбиновой кислоты вызывают уменьшение сигнала сенсоров до 6%, что можно объяснить реакцией аскорбиновой кислоты с пероксидом водорода и возможным восстановлением окисленной формы медиатора, QH• или Q, аскорбиновой кислотой.
Таким образом, биосенсоры на основе наноструктурированных электродов, модифицированных пероксидазой, демонстрируют более низкие пределы обнаружения, высокую чувствительность (табл. 1), а также более высокую долговременную стабильность по сравнению с модифицированным ТПЭ. Показано, что обработка поверхности наночастиц и ультратонких нанопроволок окислителем – реагентом Меервейна с последующей иммобилизацией фермента дополнительно улучшает свойства биосенсоров на основе пероксидазы. Лучшие характеристики биосенсоров на основе наноструктур можно объяснить, во-первых, увеличением эффективной площади поверхности и, как следствие, большим количеством иммобилизованного активного фермента на единицу геометрической поверхности. Во-вторых, наноструктуры обеспечивают благоприятную поверхность для сохранения биокаталитической активности ферментов. Сенсоры на основе пероксидазы, иммобилизованной на нанодендритных Au-УМЕ, позволяют достичь наиболее низких пределов обнаружения и высокой чувствительности при проведении измерений в амперометрическом режиме, демонстрируя при этом незначительно меньшую стабильность на протяжении 30 дней. Последнее, вероятно, связано с большей нестабильностью наноструктурных дендритов в структуре УМЕ.
Отметим, что значения пределов обнаружения около 10 нМ встречаются в нескольких работах, посвященных как биосенсорам на основе пероксидазы, так и нанозимам Fe3O4 и берлинской лазури [31–33]. Однако следует подчеркнуть, что приготовление растворов данных концентраций даже методом добавок более концентрированных растворов непосредственно в измерямый раствор может сопровождаться достаточно большой погрешностью, так как скорость реакции диспропорционирования пероксида водорода с образованием кислорода может увеличиться на несколько порядков в зависимости от присутствия малейших примесей, в том числе металлов из стенок стеклянной посуды. Более того, в ряде случаев может образовываться озон. Изменения концетраций кислорода или озона в таких случаях могут вносить вклад в отклик сенсора, приводя к понижению кажущегося предела обнаружения пероксида водорода.
* * *
Таким образом, предложены методы in situ синтеза наноструктур золота на поверхности электродов и направленного электрохимического синтеза нанодендритов в качестве ультрамикроэлектродов для создания биосенсоров на основе пероксидазы. Показано, что активации поверхности наноструктур золота с помощью реагента Меервейна позволяет увеличить эффективную площадь поверхности электродов для последующей иммобилизации пероксидазы. Разработаны электрохимические биосенсоры для определения пероксида водорода с пределами обнаружения 0.2 и 0.08 мкМ и коэффициентами чувствительности 0.71 и 0.84 А М–1 см–2 для электродов, модифицированных методом in situ синтеза наноструктур в сочетании с активацией их поверхности реагентом Меервейна, и для УМЭ, приготовленных методом направленного электрохимического синтеза, соответственно. Результаты изучения влияния на электроаналитические характеристики пероксидазных биосенсоров наноструктурирования поверхности трансдьюсера и его последующей модификации показали, что предложенные методы позволяют их улучшить.
Работа выполнена при финансовой поддержке гранта РНФ № 20-13-00143.
Список литературы
Clark L.C., Jr., Lyons C. Electrode systems for continuous monitoring in cardiovascular surgery // Ann. N.Y. Acad. Sci. 1962. V. 102. P. 29.
Ruzgas T., Lindgren A., Gorto L., Hecht H.-J., Reichelt J., Bilitewski U. Electrochemistry of peroxidases / Electroanalytical Methods for Biological Materials / Eds. Brajter-Toth A., Chambers J.Q. USA: Marcel Dekker, Inc., 2002. P. 233.
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Амперометрические биосенсоры / Модифицированные электроды для вольтамперометрии в химии, биологии и медицине. М.: Бином, 2012. 226 с.
Оленин А.Ю. Методы неферментативного определения пероксида водорода и связанных с ним активных форм кислорода // Журн. аналит. химии. 2017. V. 72. № 3. P. 195. (Olenin A.Yu. Methods of nonenzymatic determination of hydrogen peroxide and related reactive oxygen species // J. Anal. Chem. 2017. V. 72. № 3. P. 243.)
Преснова Г.В., Рубцова М.Ю., Егоров А.М. Электрохимические биосенсоры на основе пероксидазы хрена // Журн. Рос. хим. об-ва им Д.И. Менделеева. 2008. V. 52. № 2. P. 60.
Вохмянина Д.В., Карякина Е.Е., Андреев Е.А., Карякин А.А. Мультибиосенсор на основе берлинской лазури для одновременного определения глюкозы и лактата в тонкослойной проточно-инжекционной системе // Вестн. Моск. ун-та. Сер. Химия. 2018. V. 59. № 5. С. 337. (Vokhmyanina D.V., Karyakina E.E., Andreev E.A., Karyakin A.A. Prussian blue-based thin-layer flow-injection multibiosensor for simultaneous determination of glucose and lactate // Mosc. Univ. Chem. Bull. 2018. V. 73. № 5. P. 216.)
Ruzgas T., Csöregi E., Emnéus J., Gorton L., Marko-Varga G. Peroxidase-modified electrodes: Fundamentals and application // Anal. Chim. Acta. 1996. V. 330. № 2. P. 123.
Giorgio M., Trinei M., Migliaccio E., Pelicci P.G. Hydrogen peroxide: A metabolic by-product or a common mediator of ageing signals? // Nat. Rev. Mol. Cell Biol. 2007. V. 8. № 9. P. 722.
Brainina K., Stozhko N., Bukharinova M., Vikulova E. Nanomaterials: Electrochemical properties and application in sensors // Phys. Sci. Rev. 2018. V. 3. № 9. P. 20 188 050.
Bartlett P.N., Al-Lolage F.A. There is no evidence to support literature claims of direct electron transfer (DET) for native glucose oxidase (GOx) at carbon nanotubes or graphene // J. Electroanal. Chem. 2018. V. 819. P. 26.
Wilson G.S. Native glucose oxidase does not undergo direct electron transfer // Biosens. Bioelectron. 2016. V. 82. P. vii.
Koposova E., Kisner A., Shumilova G., Ermolenko Y., Offenhäusser A., Mourzina Y. Oleylamine-stabilized gold nanostructures for bioelectronic assembly. Direct electrochemistry of cytochrome C // J. Phys. Chem. C. 2013. V. 117. № 27. P. 13944.
Koposova E., Liu X., Kisner A., Ermolenko Y., Shumilova G., Offenhaeusser A., Mourzina Y. Bioelectrochemical systems with oleylamine-stabilized gold nanostructures and horseradish peroxidase for hydrogen peroxide sensor // Biosens. Bioelectron. 2014. V. 57. P. 54.
Koposova E., Shumilova G., Ermolenko Y., Kisner A., Offenhaeusser A., Mourzina Y. Direct electrochemistry of cyt c and hydrogen peroxide biosensing on oleylamine- and citrate-stabilized gold nanostructures // Sens. Actuators B. 2015. V. 207. P. 1045.
Nikolaev K., Ermakov S., Ermolenko Y., Averyaskina E., Offenhausser A., Mourzina Y. A novel bioelectrochemical interface based on in situ synthesis of gold nanostructures on electrode surfaces and surface activation by Meerwein’s salt. A bioelectrochemical sensor for glucose determination // Bioelectrochemistry. 2015. V. 105. P. 34.
Muratova I.S., Mikhelson K.N., Ermolenko Y., Offenhausser A., Mourzina Y. On “resistance overpotential” caused by a potential drop along the ultrathin high aspect ratio gold nanowire electrodes in cyclic voltammetry // J. Solid State Electrochem. 2016. V. 20. № 12. P. 3359.
Muratova I.S., Mikhelson K.N., Ermolenko Y.E., Offenhausser A., Mourzina Y. Chemiresistors based on ultrathin gold nanowires for sensing halides, pyridine and dopamine // Sens. Actuators B. 2016. V. 232. № P. 420.
Kisner A., Heggen M., Mayer D., Simon U., Offenhaeusser A., Mourzina Y. Probing the effect of surface chemistry on the electrical properties of ultrathin gold nanowire sensors // Nanoscale. 2014. V. 6. № 10. P. 5146.
Rosen E.L., Buonsanti R., Llordes A., Sawvel A.M., Milliron D.J., Helms B.A. Exceptionally mild reactive stripping of native ligands from nanocrystal surfaces by using Meerwein’s salt // Angew. Chem. Int. Ed. 2012. V. 51. № 3. P. 684.
Nikolaev K.G., Maybeck V., Neumann E., Ermakov S.S., Ermolenko Y.E., Offenhausser A., Mourzina Y.G. Bimetallic nanowire sensors for extracellular electrochemical hydrogen peroxide detection in HL-1 cell culture // J. Solid State Electrochem. 2018. V. 22. № 4. P. 1023.
Nikolaev K.G., Ermolenko Y.E., Offenhausser A., Ermakov S.S., Mourzina Y.G. Multisensor systems by electrochemical nanowire assembly for the analysis of aqueous solutions // Front. Chem. 2018. V. 6. № 256.
ICH Harmonized tripartite guideline. Validation of analytical procedures: Text and methodology. Q2(R1).
Currie L.A., Svehla G. Nomenclature for the presentation of results of chemical analysis (IUPAC Recommendations 1994) // Pure Appl. Chem. 1994. V. 66. № 3. P. 595.
Bai J., Wu L., Wang X., Zhang H.-M. Hemoglobin-graphene modified carbon fiber microelectrode for direct electrochemistry and electrochemical H2O2 sensing // Electrochim. Acta. 2015. V. 185. P. 142.
Xiang C., Zou Y., Sun L.-X., Xu F. Direct electrochemistry and enhanced electrocatalysis of horseradish peroxidase based on flowerlike ZnO–gold nanoparticle–Nafion nanocomposite // Sens. Actuators B. 2009. V. 136. № 1. P. 158.
Ferapontova E.E., Grigorenko V.G., Egorov A.M., Börchers T., Ruzgas T., Gorton L. Mediatorless biosensor for H2O2 based on recombinant forms of horseradish peroxidase directly adsorbed on polycrystalline gold // Biosens. Bioelectron. 2001. V. 16. № 3. P. 147.
Prasad A., Kumar A., Suzuki M., Kikuchi H., Sugai T., Kobayashi M., Pospíšil P., Tada M., Kasai S. Detection of hydrogen peroxide in Photosystem II (PSII) using catalytic amperometric biosensor // Front. Plant Science. 2015. V. 6. № 862.
Vreeke M., Maidan R., Heller A. Hydrogen peroxide and beta-nicotinamide adenine dinucleotide sensing amperometric electrodes based on electrical connection of horseradish peroxidase redox centers to electrodes through a three-dimensional electron relaying polymer network // Anal. Chem. 1992. V. 64. № 24. P. 3084.
Mao S., Long Y., Li W., Tu Y., Deng A. Core-shell structured Ag@C for direct electrochemistry and hydrogen peroxide biosensor applications // Biosens. Bioelectron. 2013. V. 48. P. 258.
Heller A. Electrical connection of enzyme redox centers to electrodes // J. Phys. Chem. 1992. V. 96. № 96. P. 3579.
Wie. H, Wang E. Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes // Chem. Soc. Rev. 2013. V. 42. P. 6060.
Karyakin A.A., Puganova E.A., Bolshakov I.A., Karyakina E.E. Electrochemical Sensor with Record Performance Characteristics // Angew. Chem. Int. Ed. 2007. V. 46. P. 7678.
Tolstoy V.P., Gulina L.B., Golubeva A.A., Ermakov S.S., Gurenko V.E., Navolotskaya, D.V., Vladimirova N.I., Koroleva A.V. Thin layers formed by the oriented 2D nanocrystals of birnessite-type manganese oxide as a new electrochemical platform for ultrasensitive nonenzymatic hydrogen peroxide detection // J. Solid State Electrochem. 2019. V. 23. P. 573.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии