Журнал аналитической химии, 2021, T. 76, № 6, стр. 483-495
Модифицированные ионными жидкостями магнитные наночастицы в анализе объектов окружающей среды
О. Б. Моходоева a, *, В. В. Максимова a, Р. Х. Дженлода a, В. М. Шкинев a
a Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: olga.mokhodoeva@mail.ru
Поступила в редакцию 29.12.2020
После доработки 15.01.2021
Принята к публикации 20.01.2021
Аннотация
Обзор посвящен анализу литературных данных по синтезу и использованию магнитных наночастиц, модифицированных ионными жидкостями, для выделения и определения различных веществ в объектах окружающей среды. Основное внимание уделено определению органических загрязнителей в природных водах, почвах и т.д. Отмечены основные тенденции развития методов магнитной твердофазной экстракции. Рассмотрены методы синтеза магнитных наночастиц, перспективных для создания новых способов пробоподготовки.
Развитие новых методов определения органических и неорганических веществ – важное направление в мониторинге состояния окружающей среды при решении глобальных экологических проблем. Создаваемые методы должны быть экспрессными, простыми, дешевыми и эффективными. Прямой анализ многих объектов окружающей среды в ряде случаев характеризуется неудовлетворительными метрологическими характеристиками, поэтому требуется предварительное выделение и концентрирование аналитов.
Ранее показано, что эффективность методов пробоподготовки увеличивается при комплексном использовании различных физических полей: гравитационного [1, 2], ультразвукового [3, 4], магнитного [5, 6].
Количество публикаций по использованию в анализе магнитного поля и соответственно специализированных магнитных наночастиц постоянно растет. Повышается также интерес к использованию магнитных наночастиц в сочетании с ионными жидкостями (рис. 1). Выбор ионных жидкостей для модификации магнитных частиц во многом определяется их уникальными свойствами, которые позволяют значительно увеличить эффективность методов пробоподготовки [7].
Рис. 1.
Количество публикаций по использованию магнитных наночастиц в методах разделения и концентрирования за 2000–2020 гг.: 1 – магнитные наночастицы; 2 – магнитные наночастицы в сочетании с ионными жидкостями (Web of Science).

Анализ литературных данных показывает, что число публикаций по применению магнитных частиц выросло за последние 10 лет в 4–5 раз, тогда как относительное увеличение числа публикаций по модифицированным ионными жидкостями магнитным наночастицам составило более 100. Это обусловлено особыми свойствами ионных жидкостей и магнитных наночастиц, важными для их использования в методах пробоподготовки, и свидетельствует о перспективности развития данного направления.
ИОННЫЕ ЖИДКОСТИ
Ионные жидкости – органические соли с температурой плавления ниже 100°С, состоящие из органического катиона и неорганического или органического аниона, – нашли широкое применение в сорбционных и экстракционных методах разделения и концентрирования веществ [8–10]. Свойства ионных жидкостей определяются сочетанием внутри- и внешнемолекулярных взаимодействий: кулоновских, π–π и ван-дер-ваальсовых взаимодействий, водородных связей, конформационной подвижности и полярности [11].
Первоначально ионные жидкости использовали в качестве альтернативных разбавителей в жидкостной экстракции благодаря их негорючести, пренебрежимо низкому давлению паров, относительно низкой токсичности, жидкому состоянию в широком интервале температур. Основные достижения и тенденции развития в области применения ионных жидкостей в методах жидкостно-жидкостной экстракции подробно рассмотрены в ряде обзоров [например, 12–14]. Одна из последних тенденций – использование ионных жидкостей в водных двухфазных экстракционных системах [15]. Однако наиболее широко в последние годы ионные жидкости применяют в сочетании с матрицами (носителями) различной природы в процессах твердофазной экстракции (ТФЭ): традиционной ТФЭ, твердофазной микроэкстракции (ТФМЭ), магнитной ТФЭ (МТФЭ), дисперсионной ТФЭ (ДТФЭ) и др. [16–18]. Благодаря высокой сольватирующей способности и наличию в составе катиона и/или аниона функционально-аналитических групп эффективно применение ионных жидкостей для выделения различных органических, органометаллических и неорганических веществ. Так, большое число работ посвящено концентрированию микроэлементов: цветных металлов, радионуклидов, редкоземельных элементов, металлов платиновой группы и др. [19–21]. С появлением ионных жидкостей нового типа возрос интерес к их применению в биохимии и медицине и соответственно к выделению различных биоорганических соединений. Этому способствовала разработка ионных жидкостей так называемого “третьего поколения”, обладающих наряду с уникальными физико-химическими свойствами биологической активностью, биосовместимостью, антимикробным и цитотоксическим действием [22].
Многочисленные исследования показали, что при нанесении ионных жидкостей на твердую подложку, волоконное покрытие для ТФМЭ, магнитного элемента для ТФЭ с перемешиванием (stir bar solid-phase extraction) и т.д. наиболее важно обеспечить механическую, химическую и термическую стабильность получаемых сорбционных материалов. К подходам, обеспечивающим надежное закрепление ионной жидкости на твердой матрице, относят золь–гель метод, модификацию поверхности носителя с дальнейшей химической прививкой ионной жидкости, а также электрополимеризацию [17].
В данном обзоре обсуждены способы комбинирования ионных жидкостей и магнитных носителей как на основе магнетита, так и с применением многослойных магнитных нанокомпозитов. Магнитным ионным жидкостям и феррофлюидам посвящено достаточно много обзорных работ [например, 23, 24], поэтому мы их рассматривать не будем.
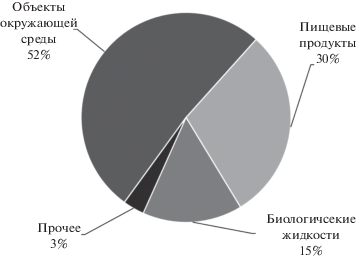
Проведенный в Scopus анализ публикаций по совместному использованию магнитных наночастиц и ионных жидкостей за последние пять лет (рис. 2) показал, что 15% работ посвящены выделению белков, ферментов, лекарственных препаратов из различных биологических жидкостей, около трети публикаций направлено на развитие методов анализа пищевых продуктов. В данном обзоре более подробно обсуждены примеры выделения веществ из природных вод, почв, донных отложений и других объектов окружающей среды, анализу которых посвящено более половины рассматриваемых публикаций.
Рис. 2.
Соотношение публикаций по совместному использованию магнитных наночастиц и ионных жидкостей для анализа различных объектов за период 2015–2020 гг.
В обзоре рассмотрены основные способы сочетания ионных жидкостей и магнитных наночастиц для осуществления МТФЭ – традиционного способа с использованием предварительно модифицированного ионной жидкостью магнитного носителя, а также дисперсионной МТФЭ, когда в экстракционную систему магнитные наночастицы и ионную жидкость (или ионную жидкость с экстрагентом) добавляют отдельно. Особенности этих двух методов будут рассмотрены ниже в соответствующих разделах.
МАГНИТНЫЕ НАНОЧАСТИЦЫ
Магнитные наночастицы со структурой ядро–оболочка широко применяют в бионанотехнологии, медицине и других областях. Их синтезу, стабилизации и использованию в качестве сорбционных материалов посвящен ряд работ [25–29].
Магнитные материалы могут проявлять различные виды магнетизма: ферромагнетизм, суперпарамагнетизм, диамагнетизм, антиферромагнетизм и ферримагнетизм [30, 31]. Ферромагнитные частицы обладают постоянным магнетизмом и сохраняют намагниченность даже после того, как снимают действие магнитного поля. Суперпарамагнитные частицы взаимодействуют с магнитным полем, но не сохраняют намагниченность после его удаления [32]. Из всего многообразия магнитных частиц чаще всего в качестве магнитного ядра используют оксиды железа – магнетит (Fe3O4) и маггемит (γ-Fe2O3).
Важной характеристикой, влияющей на эффективность магнитного сорбционного материала, является размер магнитных частиц. В методах МТФЭ активно используют магнитные наночастицы диаметром от 1 до 100 нм, поскольку развитая площадь поверхности наночастиц способствует образованию повышенного количества сорбционных центров, высокой скорости и эффективности сорбции.
К основным методам синтеза магнитных наночастиц относят метод соосаждения, гидротермальный синтез, сольвотермальный синтез, золь–гель метод, метод термического разложения, метод окисления, метод гидролиза, микроэмульсионный синтез и сонохимические методы [33]. Следует отметить, что магнитные наночастицы, полученные указанными выше способами, способны к агрегированию, а это, в свою очередь, приводит к ослаблению магнитных свойств и снижению сорбции за счет сокращения площади поверхности [30]. Кроме того, магнитные наночастицы могут подвергаться окислению.
Для преодоления этих ограничений, а также создания селективной оболочки необходима модификация поверхности магнитных наночастиц. Физическая модификация обусловлена адсорбцией стабилизирующего материала на поверхности частиц за счет гидрофобных и электростатических взаимодействий. Химическая модификация заключается в изменении поверхности магнитных наночастиц путем химических превращений.
Оболочка может состоять как из неорганических веществ (диоксида кремния, металлов и их оксидов, углеродных материалов), так и органических соединений (полимеров, поверхностно-автивных веществ) или гибридных материалов (металл-органических координационных полимеров) [34, 35]. Углеродные и другие пористые наноматериалы являются наиболее популярными типами оболочек, что обусловлено их структурой и способностью не только повышать устойчивость магнитных наночастиц и предотвращать их окисление, но также увеличивать удельную площадь поверхности [36].
В зависимости от природы используемой оболочки магнитные наночастицы могут быть функционализированы карбоксильными, гидроксильными, сульфоновыми, аминными, меркапто- и другими группами. Для создания селективных сорбентов и их применения в ТФЭ в последние годы стали активно применять ионные жидкости [37].
Модифицирование ионными жидкостями осуществляют, как правило, после покрытия магнитных наночастиц оболочкой с последующим выдерживанием в растворе ионной жидкости, промывкой и высушиванием. Возможен синтез ионной жидкости непосредственно на поверхности магнетита, в том числе с последующей полимеризацией. В некоторых случаях ионную жидкость используют в качестве линкера для прививки комплексообразующего агента. Также проводят модифицирование ионными жидкостями многослойных магнитных нанокомпозитов, полученных с использованием углеродных нанотрубок, оксида графена, наноцеллюлозы, хитозана и др.
Перспективен не только поиск стабилизирующих магнитные наночастицы веществ. Не менее важна разработка эффективных способов синтеза и модифицирования. В работах [38, 39] предложен способ получения магнитных наночастиц на границе раздела фаз в водно-полимерных системах, позволяющий проводить синтез магнетита, покрытие полимерной оболочкой и функционализацию поверхности ионной жидкостью в одну стадию.
ПРИМЕРЫ ВЫДЕЛЕНИЯ ВЕЩЕСТВ С ИСПОЛЬЗОВАНИЕМ СИСТЕМ НА ОСНОВЕ МАГНИТНЫХ НАНОЧАСТИЦ И ИОННЫХ ЖИДКОСТЕЙ
Новые технические решения, упрощающие пробоподготовку, необходимы для совершенствования методов анализа. Одной из тенденций последних лет является нанесение сорбционных покрытий на иглы микрошприца, стержня, капилляра, наконечник микродозатора, магнитный мешальник в методах твердофазной микроэкстракции. Описанию данного направления, в том числе с использованием ионных жидкостей посвящен ряд работ [например, 40]. Рассматриваемые нами сорбционные системы на основе магнитных наночастиц и ионных жидкостей используют в основном при осуществлении МТФЭ в традиционном и дисперсионном вариантах. В данном разделе представлены примеры выделения неорганических и органических веществ по публикациям последних пяти лет.
Магнитную твердофазную экстракцию отличают высокая степень извлечения, экспрессность, эффективное разделение твердой и жидкой фаз под действием внешнего магнитного поля, низкий расход растворителя. Магнитные наночастицы, модифицированные ионными жидкостями, в том числе многослойные магнитные нанокомпозиты, диспергируют в небольшом объеме растворителя для активации сорбционных центров, затем контактируют с анализируемым раствором и на следующем этапе с раствором элюента (рис. 3). Высокая дисперсность наночастиц способствует массопереносу через увеличенную поверхность контакта аналита с сорбентом и делает процесс экстракции более экономичным и эффективным [41]. Модификация поверхности стабилизирует наночастицы, предотвращает их окисление, увеличивает диспергируемость, экстракционную способность, селективность. МТФЭ позволяет избежать общих проблем твердофазной экстракции, связанных с особенностями подготовки сорбционной колонки, ее закупориванием, плохой воспроизводимостью результатов [42]. На эффективность экстракции влияют следующие параметры: состав сорбента, рН раствора, природа и концентрация высаливателя, время экстракции, интенсивность перемешивания, температура, условия десорбции аналита. Применение ультразвукового излучения в МТФЭ способствует увеличению количества активных сорбционных центров и интенсифицирует процесс массопереноса целевых аналитов на поверхность сорбента. МТФЭ легко сочетается с современными методами анализа: газовой и жидкостной хроматографией, атомно-эмиссионной и масс-спектрометрией с индуктивно связанной плазмой и др.
Метод используют для определения катионов металлов (Cd, Pb, Cu, Ag, Cr, Al, Cr и др.), некоторых анионов (нитрат- и нитрит-ионов) и, в большей мере, различных органических экотоксикантов (табл. 1). В подавляющем большинстве примеров в качестве анализируемых образцов выступают различные воды: природные, сточные, минеральные, водопроводные. Это свидетельствует о высоких требованиях, предъявляемых к мониторингу данных объектов, и необходимости предварительного концентрирования определяемых компонентов, несмотря на возможности современных инструментальных методов. Cелективное выделение аналитов проводят при анализе более сложных по матричному составу объектов, таких как почвы, донные отложения, ил [47, 55, 58].
Таблица 1.
Примеры магнитной твердофазной экстракции неорганических и органических соединений для их определения в объектах окружающей среды
| Обозначение сорбента | Используемые ионные жидкости (ИЖ) | Аналиты | Анализируемые образцы | Условия извлечения | Условия десорбции и метод определения | Литература |
|---|---|---|---|---|---|---|
| Fe3O4@IL | [A336]+[TS]– | Cd(II) | Водопроводная вода | V = 50 мл, m = 20 мг, pH 7 | 1 мл 0.1 М HNO3, ПААС | [43] |
| γ-Fe2O3@IL | 2-HEAS | Pb(II) | Промышленные воды | V = 50 мл, m = 16.2 мг, pH 6.5 | 0.1 М HNO3, ПААС | [44] |
| Fe3O4@SiO2@IL | [MTESPIm]+[Cl]– | Ag(I) | Сточные воды | V = 10 мл, m = 20 мг, pH 1 | 5 мл 0.6 М Thio, ОЭС−ИСП | [45] |
| Fe3O4@SiO2@IL | [MIm]+[PF6]– | Cr(VI) | Нефтезаводские сточные воды | V = 40 мл, m = 20 мг, pH 5.5 | 0.25 мл 2 М HNO3, АЭС−ИСП | [46] |
| Fe3O4@SiO2@PIL | Полимерная имидазолиевая ИЖ | Te(IV)/Te(VI) | Почвы, ил, речные, грунтовые воды | V = 50 мл, m = 3 мг, pH 1.5 | 0.5 мл 5 М HCl, АФС | [47] |
| Fe3O4@SiO2@PIL | Полимерная имидазолиевая ИЖ | Нитрат- и нитрит-анионы | Водопроводная и речные воды | V = 50 мл, m = 50 мг, pH 8 | 2 мл 0.005 М NaOH, ионная хроматография | [48] |
| Fe3O4@IL@β-CDCP | Полимерная пиридиниевая ИЖ | Mn(II)/Mn(VII) | Водопроводная и минеральная воды | V = 50 мл, m = 50 мг, pH 6 для Mn(VII), pH 10 для Mn(VII) + Mn(II) | 2 мл 1 М HCl, ОЭС−ИСП | [49] |
| Fe3O4@IL | [HMIm]+[PF6]– | Pd(II) | Дорожная пыль | V = 50 мл, m = 28 мг, pH 7.6, ДДТК | 1 мл ацетилацетона или этанола, ПААС | [50] |
| Fe3O4@SiO2@GO@IL | [НMIm]+[Cly]– | Al(III), Cr(III), Cu(II), Pb(II) | Озерная вода | V = 20 мл, m = 2 мг, pH 9 | 6 мл 0.1 М HCl, 35°С, ОЭС−ИСП | [51] |
| Fe3O4@GO@IL | [BMIm]+[Cys]– | Hg(II) | Речная, морская, минеральная воды | V = 10 мл, m = 10 мг, pH 9 | 0.1 мл 0.1 М HNO3 + 3% Thio, МХП−ААС | [52] |
| Fe3O4@IL | [C8MIm]+[PF6]– | Инсектициды | Речная вода | V = 10 мл, m = 90 мг, 30 мг | 0.5 мл ацетонитрила, ВЭЖХ | [53] |
| Fe3O4@PANI@IL | Дикатионная бензилимидазолиевая ИЖ | Полициклические ароматические углеводороды | Природные воды, донные отложения | V = 30 мл, m = 15 мг, 2% NaCl, pH 7 | 1.5 мл ацетонитрила, ГХ−МС | [54] |
| Fe3O4@О3Si(СH2)3CN@IL | [BTMPIm]+[Cl]– | Полициклические ароматические углеводороды | Донные отложения | V = 50 мл, m = 30 мг, pH 6 | 3 мл метанола + 1% HAc, ВЭЖХ | [55] |
| Fe3O4@SiO2@IL@MO | [C18MIm]+[Br]– | Полициклические ароматические углеводороды | Речная, сточная воды | V = 150 мл, m = 18 мг, pH 8, 35°C | 1.5 мл ацетонитрила, ВЭЖХ | [56] |
| Fe3O4@SiO2@PIL | Молекулярно-импрегнированная полимерная имидазолиевая ИЖ | Хлорфенолы | Морская вода | V = 10 мл, m = 10 мг | 10 мл метанол + + 2 ммоль/л NaOH, ВЭЖХ | [57] |
| Fe3O4@SiO2@IL | [MIm]+[PF6]- | Гербициды | Речная и сточные воды, почва | V = 40 мл, m = 70 мг, pH 3 | 75–150 мл ацетонитрила, ВЭЖХ | [58] |
| Fe3O4@SiO2@IL | DTSACl | Краситель реактивный желтый 15 | Сточные воды | V = 40 мл, m = 10 мг, pH 7 | 1 мл 6 г/л SDS, УФ-спектроскопия | [59] |
| Fe3O4@SiO2@IL | [VOIm]+[Br]– | Линейные алкилбензол-сульфонаты | Речная, прудовая воды | V = 200 мл, m = 60 мг, pH 7 | 0.7 мл метанола, ВЭЖХ | [60] |
| Fe3O4@SiO2@IL | [BMIm]+[Cl]– | Хлорфенолы | Речная, родниковая, водопроводная воды | V = 200 мл, m = 100 мг, pH 8 | 6 мл метанола, ВЭЖХ | [61] |
| Fe3O4@IL@β-CDCP | Полимерная пиридиниевая ИЖ | Краситель конго красный | Вода | V = 40 мл, m = 100 мг, pH 7 | 3 мл этанола, ВЭЖХ | [62] |
| Fe3O4@SiO2@PIL | Полимерная имидазолиевая ИЖ | Гербициды сульфонил-мочевины | Почва | V = 10 мл, m = 60 мг | 8 мл ацетонитрила, ВЭЖХ | [63] |
| Fe3O4@SiO2@ VMDB@PIL | Полимерная имидазолиевая ИЖ | Парабены, ароматические амины | Озерная, речная, водопроводная воды | V = 50 мл, m = 20 мг, pH 6–8 | 0.5 мл этанола, ВЭЖХ | [64] |
| Fe3O4@SiO2@PSS-PIL | Полимерная имидазолиевая ИЖ | Пестициды | Речная, озерная, водопроводная воды | V = 100 мл, m = 160 мг | 1 мл ацетонитрила, ВЭЖХ | [65] |
| Fe3O4@β-CD-TDI@IL | Полимерная имидазолиевая ИЖ | Парабены | Сточные воды | V = 25 мл, m = 25 мг, pH 7, 4% NaCl | 0.7 мл ацетонитрила, ВЭЖХ | [66] |
| Fe3O4@PIL | Полимерная имидазолиевая ИЖ | Пиретроиды | Речная вода | V = 25 мл, m = 30 мг, pH 7 | 2 мл метанола, ГХ−МС | [67] |
| Fe3O4@OA@PIL | Полимерная имидазолиевая ИЖ | Хлорорганические пестициды | Озерная вода | V = 10 мл, m = 100 мг | 4 мл ацетона + 10% HAc, ГХ | [68] |
| Fe3O4@PIL | Полимерная имидазолиевая ИЖ | Триазольные фунгициды | Речная, озерная, сточная воды | V = 50 мл, m = 20 мг, pH 6 | 0.5 мл этанола, ВЭЖХ | [69] |
| Fe3O4@GO@IL | [C7MIm]+[PF6]– | Соединения нитробензола | Речная, озерная, сточная воды | V = 10 мл, m = 3 мг | 0.3 мл метанола, ВЭЖХ | [70] |
| Fe3O4@MWCNTs@IL | [APIm]+[Cl]– | Триазольные фунгициды | Речная вода | V = 100 мл, m = 2 мг | 3 мл толуола, ГХ−МС | [71] |
| Fe3O4@MWCNT@ ZIF-8@IL |
[HMIm]+[PF6]– | Дихлордифенил- трихлорэтан | Водопроводная, речная, сточная воды | V = 10 мл, m = 4 мг, pH 7, 2% NaCl | 0.8 мл этилацетата, ГХ−МС | [72] |
| Fe3O4@MWCNTs@IL | [APIm]+[Cl]– | Гербициды | Грунтовые воды | V = 20 мл, m = 12.5 мг, pH 7 | 1.5 мл метанола + 0.1 М HCl, ВЭЖХ | [73] |
Обозначения: A336 – трикаприлметиламмоний; APIm – 1-(3-аминопропил)имидазолий; BTMPIm – 1-бензил-3-(триметоксисилилпропил)имидазолий; β-CDCP – β-полициклодекстрин; DTSACl – диметилоктадецил[3-(триметоксисилилпропил]аммония хлорид; GO – оксид графена; 2-HEAS – 2-гидроксиэтиламмония сульфонат; MO – метиловый оранжевый; MTESPIm – 1-метил-3-[(3-триметоксисилил)пропил]имидазолий; PANI – полианилин; PIL – полимерная ионная жидкость; PSS – полистиролсульфонат натрия; SDS – додецилсульфат натрия; TDI – толуол-2,4-диизоцианат; Thio – тиомочевина; VMDB – сополимер 1-винилбензил-3-метилимидазолия с дивинилбензолом; ZIF-8 – цеолитный имидазолатный каркас; АФС – атомно-флуоресцентная спектрометрия; АЭС−ИСП – атомно-эмиссионная спектрометрия с индуктивно связанной плазмой; ГХ – газовая хроматография; ГХ–МС – газовая хроматография с масс-спектрометрическим детектированием; ДДТК – диэтилдитиокарбамат натрия; МХП–ААС – атомно-абсорбционная спектрометрия с атомизацией методом холодного пара; ОЭС−ИСП – оптико-эмиссионная спектрометрия с индуктивно связанной плазмой; ПААС – атомно-абсорбционная спектрометрия с атомизацией в пламени.
За небольшим исключением экстракцию осуществляют из нейтральных растворов. В ряде случаев отмечено влияние ионной силы раствора на эффективность извлечения аналитов [54, 66, 72], а также температурного фактора [56].
В основном используют магнетит, полученный методом соосаждения и покрытый кремниевой или полимерной оболочкой. Одним из альтернативных направлений является создание магнитных углеродных материалов на основе углеродных нанотрубок или оксида графена [51, 52, 70–73]. Наночастицы модифицируют с использованием ионных жидкостей имидазолиевого, реже аммониевого и пиридиниевого типа. С целью создания более устойчивых сорбционных материалов, пригодных для использования в более широком диапазоне pH, проводят полимеризацию ионной жидкости на поверхности магнетита [47–49, 62–69]. При этом ионные жидкости могут выступать не только в качестве мономеров, но и сшивающих агентов [57].
Ионные жидкости позволяют не только увеличить селективность извлечения, но и придать используемым сорбционным материалам дополнительные ценные свойства. Так, молекулярно-импрегнированные полимеры (МИП) характеризуются низким сродством к полярным растворителям, особенно к водным средам [49]. Благодаря способности ионных жидкостей к электростатическим взаимодействиям, образованию водородных связей, высокой сольватирующей способности возможно создание модифицированных сорбентов на основе МИП с улучшенными кинетическими характеристиками. Разработаны модифицированные ионными жидкостями магнитные сорбенты с использованием полициклодекстрина [49, 62], 4-хлорфенола [57], 4,4'-дихлорбензгидрола в качестве темплата при создании МИП [66].
Элюирование микроэлементов проводят растворами кислот или комплексообразователя, органические соединения десорбируют небольшим объемом растворителя (метанола, этанола, ацетонитрила и т.д.). Для инструментального определения используют методы атомной спектроскопии для ионов металлов, методы ВЭЖХ и ГХ–МС для органических соединений.
Дисперсионная магнитная твердофазная экстракция (ДМТФЭ) по сути представляет собой дисперсионную жидкостно-жидкостную экстракцию, основанную на использовании микроэмульсии экстрагента, комбинированную с МТФЭ [74]. На первой стадии осуществляют экстракцию в трехкомпонентной системе: водный раствор аналита–экстрагент–диспергирующий агент [75]. На второй стадии в систему добавляют магнитные наночастицы для сорбции образовавшегося экстракта (рис. 4).
В данном обзоре в качестве диспергаторов рассмотрены ионные жидкости, которые, в свою очередь, благодаря способности к разнообразным взаимодействиям могут выступать одновременно экстрагентом и диспергатором, а также обеспечивать сорбцию экстракта на твердую фазу [76, 77]. Примеры представлены в табл. 2. Для более эффективного взаимодействия экстракта с поверхностью наночастиц в некоторых работах увеличивают гидрофобность ионной жидкости путем замены аниона в процессе экстракции [83–85]. Принципиальное отличие ДМТФЭ состоит в отсутствии необходимости предварительной модификации наночастиц. С одной стороны, это упрощает подготовку сорбента, но с другой, сокращает срок годности магнетита, склонного к окислению и агрегированию. Для предотвращения этих эффектов, так же как и в МТФЭ, используют частицы со структурой “ядро–оболочка” или нанокомпозиты, например магнетит с цитратной оболочкой [81], магнитные углеродные нанотрубки [82], микросферы с двойным кремниевым покрытием Fe3O4@nSiO2/mSiO2 (n – nonporous; m – mesoporous) [85].
Таблица 2.
Примеры дисперсионной магнитной твердофазной экстракции неорганических и органических соединений для их определения в объектах окружающей средыв
| Обозначение сорбента | Используемые ионные жидкости | Аналиты | Анализируемые образцы | Условия извлечения | Условия десорбции и метод определения | Литература |
|---|---|---|---|---|---|---|
| Fe3O4 | [BMIm]+[PF6]– | Pb(II) | Растения, сточные воды | V = 2 мл, m = 50 мг, pH 3, ПДК | 0.25 мл HNO3конц, ПААС | [78] |
| Fe3O4 | [BMIm]+[PF6]– | Cd(II) | Озерная, водопроводная, сточная воды | V = 10 мл, m = 30 мг, pH 6, ТАР | 0.5 мл HNO3конц, ПААС | [79] |
| Fe3O4 | [HMIm]+[PF6]– | Cu(II) | Речная, родниковая, водопроводная воды | V = 10 мл, m = 60 мг, pH 6, Triton X-100 | 0.3 мл 2 М HNO3, ЭТААС | [80] |
| Fe3O4@Cit | [EMIm]+[Tf2N]– | Co(II) | Водопроводная вода | V = 10 мл, m = 30 мг, pH 5, 5-BrPADAP, ЭДТА | 5 мл 1 М HCl или 0.5 мл ацетона, ПААС | [81] |
| Fe3O4@MWCNT | [A336]+[TS]– | Cr(III)/Cr(VI) | Речная, водопроводная, родниковая воды | V = 45 мл, m = 10 мг, pH 6 | 0.25 мл этанола, спектрофотометрия | [82] |
| Fe3O4 | [IE(Gua)2]+[Ph4B]– | Гербициды ауксина | Речная, озерная, прудовая воды | V = 15 мл, m = 30 мг, pH 11 | 0.05 мл ацетонитрила, ВЭЖХ | [83] |
| Fe3O4 | [P4448]+[N(CN)]– | Пиретроидные пестициды | Речная, озерная, прудовая, водопроводная воды | V = 10 мл, m = 30 мг, pH 11 | 0.05 мл ацетонитрила, ВЭЖХ | [84] |
| Fe3O4@nSiO2/mSiO2 | [HMIm]+[NTf2]– | Инсектициды | Озерная, речная воды | V = 8 мл, m = 3 мг | 0.16 мл ацетонитрила, ВЭЖХ | [85] |
Обозначения: A336 – трикаприлметиламмоний; 5-BrPADAP – (5-бром-2-пиридилазо)-5-диэтиламинофенол; Cit – цитрат; IE(Gua)2 – N,N-ди(2‑гуанидинилэтил); MWCNTs – многостенные углеродные нанотрубки; P4448 – трибутил-n-гексилфосфоний; Ph4B – тетрафенилборат натрия; ПДК – пирролидиндиокарбамат аммония; ТАР – 4-(2-тиазолилазо)резорцин; ЭТААС – атомно-абсорбционная спектрометрия с электротермической атомизацией.
Элюирование осуществляют, как правило, небольшим объемом раствора органического растворителя.
Другие способы. Дифильность молекул ионных жидкостей обусловливает возможность образования организованных мицеллярных систем. В ряде работ выделяют магнитную твердофазную экстракцию смешанными гемимицеллами, образованными ионными жидкостями (magnetic hemimicelle solid-phase extraction, MHMSPE) [86–89]. Гемимицеллы (полумицеллы) и/или адмицеллы (адсорбционные бислои) обеспечивают два типа механизмов извлечения аналитов: гидрофобные или цепно-цепные взаимодействия, обеспечиваемые углеводородной частью поверхностно-активного вещества (в данном случае, ионной жидкости), и электростатическое взаимодействие или образование водородной связи его полярными группами. На эффективность экстракции критическое влияние оказывают концентрация ионной жидкости и pH раствора.
В работе [90] описана дисперсионная экстракция фунгицидов с использованием магнитных шипучих таблеток (magnetic effervescent tablet-assisted ionic liquid dispersive liquid−liquid microextraction, META−IL−DLLME). Таблетки получают гомогенизацией смеси магнитных наночастиц, ионной жидкости и соли угольной кислоты с последующим прессованием. При контакте полученных таблеток с раствором аналита происходит активное выделение CO2, что приводит к перемешиванию системы и интенсификации процесса массопереноса. В META−IL−DLLME также преимущественно используют частицы Fe3O4, однако есть примеры получения наночастиц, отличных от магнетита, например, Fe3S4, синтезированных гидротермальным методом и характеризующихся более высокой пористостью и, следовательно, более развитой поверхностью [91]. Преимуществами метода являются экспрессность и отсутствие необходимости в дополнительном оборудовании, что позволяет использовать методику в полевых условиях.
* * *
Развитие методов магнитной ТФЭ, несомненно, является важным направлением в совершенствовании методов разделения и концентрирования. Использование модифицированных ионными жидкостями магнитных наночастиц, согласно представленным в данном обзоре примерам анализа вод, а также имеющимся в литературе многочисленным примерам анализа пищевых продуктов и биологических жидкостей, позволяет проводить селективное и быстрое выделение определяемых компонентов, обеспечивая улучшенные метрологические характеристики методов. Следует отметить отсутствие работ по созданию проточных систем для магнитной ТФЭ, что представляется перспективным для анализа больших объемов растворов и определения крайне низких содержаний аналитов, например радионуклидов в морской воде или ДНК патогенных микроорганизмов при организации предупредительных мероприятий по распространению инфекций. Кроме того, с точки зрения синтеза наночастиц, по нашему мнению, необходим поиск менее трудоемких и длительных способов их получения и модифицирования. Главным образом это касается многослойных магнитных нанокомпозитов, где каждая составляющая выполняет свою функцию, но при этом не всегда многостадийный синтез таких сорбентов целесообразен.
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 19-03-00551-а. Обзор способов магнитной твердофазной экстракции соответствует теме Государственного задания ГЕОХИ РАН 0137-2019-0020.
Список литературы
Fedotov P.S., Dzhenloda R.Kh., Dampilova B.V., Doroshkevich S.G., Karandashev V.K. Unexpected behavior of Zn, Cd, Cu, and Pb in soils contaminated by ore processing after 70 years of burial // Environ. Chem. Lett. 2018. V. 16. № 2. P. 637.
Fedotov P.S., Rogova O.B., Dzhenloda R.Kh., Karandashev V.K. Metal−organic complexes as a major sink for rare earth elements in soils // Environ. Chem. 2019. V. 16. № 5. P. 323.
Дженлода Р.Х, Шкинев В.М, Данилова Т.В, Темердашев З.А, Карандашев В.К, Спиваков Б.Я. Суспензионные колонки с удерживаемыми в ультразвуковом поле зернистыми сорбентами для выделения и определения редкоземельных элементов в винах // Журн. аналит. химии. 2015. Т. 70. № 12. С. 1264. (Dzhenloda R.Kh., Shkinev V.M., Danilova T.V., Temerdashev Z.A., Karandashev V.K., Spivakov B.Ya. Suspension columns with grain sorbents retained in an ultrasonic field for separation and determination of rare-earth elements in wines // J. Anal. Chem. 2015. V. 70. № 12. P. 1456.)
Spivakov B.Y., Shkinev V.M., Danilova T.V., Knyazkov N.N., Kurochkin V.E., Karandashev V.K. Suspension column for recovery and separation of substances using ultrasound-assisted retention of bead sorbents // Talanta. 2012. V. 102. P. 88.
Dzhenloda R.Kh., Petrov D.D., Shkinev V.M., Spivakov B.B. DNA recovery from environmental samples on suspension columns under a combined action of ultrasound and magnetic fields followed by polymerase chain reaction detection // Mendeleev Commun. 2017. V. 27. № 3. P. 302.
Rios A., Zougagh M. Recent advances in magnetic nanomaterials for improving analytical processes // Trends Anal. Chem. 2016. V. 84. P. 72.
Han D., Row K.H. Recent application of ionic liquids in separation technology // Molecules. 2010. V. 15. P. 2405.
Feng J., Loussala H.M, Han S., Ji X., Li C., Sun M. Recent advances of ionic liquids in sample preparation // Trends Anal. Chem. 2020. V. 125. P. 115833.
Nawała J., Dawidziuk B., Dziedzic D., Gordon D., Popiel S. Applications of ionic liquids in analytical chemistry with a particular emphasis on their use in solid-phase microextraction // Anal. Chim. Acta. 2018. V. 105. P. 18.
Ramos M., Jiménez A., Garrigós M.C. IL-based advanced techniques for the extraction of value-added compounds from natural sources and food by-products // Trends Anal. Chem. 2019. V. 119. P. 115616.
Thigpen A.S, Nestor S.T., O’Brien R.A., Minkowicz S., Sheng Y., Davis Jr. J.H., West K.N., Mirjafari A. Thioether-functionalized picolinium ionic liquids: synthesis, physical properties and computational studies // New J. Chem. 2017. V. 41. P. 1625.
Wang L.Y., Guo Q.J., Lee M.S. Recent advances in metal extraction improvement: Mixture systems consisting of ionic liquid and molecular extractant // Sep. Purif. Technol. 2019. V. 210. P. 292.
Плетнев И.В., Смирнова С.В., Шведене Н.В. Новые направления применения ионных жидкостей в аналитической химии. 1. Жидкостная экстракции // Журн. аналит. химии. 2019. Т. 74. № 7. С. 483. (Pletnev I.V., Smirnova S.V., Shvedene N.V. New directions in using ionic liquids in analytical chemistry. 1: Liquid−liquid extraction // J. Anal. Chem. 2020. V. 74. № 7. P. 625.)
Ventura S.P.M., e Silva F.A., Quental M.V., Mondal D., Freire M.G., Coutinho J.A.P. Ionic-liquid-mediated extraction and separation processes for bioactive compounds: Past, present, and future trends // Chem. Rev. 2017. V. 117. № 10. P. 6984.
Gras M., Papaiconomou N., Schaeffer N., Chainet E., Tedjar F., Coutinho J.A.P., Billard I. Novel ionic-liquid-based acidic aqueous biphasic systems for simultaneous leaching and extraction of metallic ions // Angew. Chem. Int. Ed. 2018. V. 57. № 6. P. 1563.
Maciel E.V.S., de Toffoli A.L., Neto E.S., Nazario C.E.D., Lanças F.M. Trends in analytical chemistry new materials in sample preparation : Recent advances and future trends // Trends Anal. Chem. 2019. V. 119. P. 115 633.
Yavir K., Konieczna K., Marcinkowski L., Kloskowski A. Ionic liquids in the microextraction techniques: The influence of ILs structure and properties // Trends Anal. Chem. 2020. V. 130. P. 115994.
Gutiérrez-Serpa A., Napolitano-Tabares P.I., Šulc J., Pacheco-Fernández, Pino V. Role of ionic liquids in composites in analytical sample preparation // Separations. 2020. V. 7. № 3. P. 37.
Myasoedova G.V., Molochnikova N.P., Mokhodoeva O.B., Myasoedov B.F. Application of ionic liquids for solid-phase extraction of trace elements // Anal. Sci. 2008. V. 24. P. 1351.
Моходоева О.Б., Мясоедова Г.В., Кубракова И.В., Никулин А.В., Артюшин О.И., Одинец И.Л. Новые твердофазные экстрагенты для концентрирования благородных металлов // Журн. аналит. химии. 2010. Т. 65. № 1. С. 15. (Mokhodoeva O.B., Myasoedova G.V., Kubrakova I.V., Nikulin A.V., Artyushin O.I., Odinets I.L. New solid extractants for preconcentrating noble metals // J. Anal. Chem. 2010. V. 65. № 1. P. 12.)
Guibal E., Vincent T., Jouannin C. Immobilization of extractants in biopolymer capsules for the synthesis of new resins: A focus on the encapsulation of tetraalkyl phosphonium ionic liquids // J. Mater. Chem. 2009. V. 19. № 45. P. 8515.
Egorova K.S., Ananikov V.P. Fundamental importance of ionic interactions in the liquid phase: A review of recent studies of ionic liquids in biomedical and pharmaceutical applications // J. Mol. Liq. 2018. V. 272. P. 271.
Zhu C., Varona M., Anderson J.L. Magnetic ionic liquids as solvents for RNA extraction and preservation // ACS Omega. 2020. V. 5. № 19. P. 11151.
Kabeer M., Hakami Y., Asif M., Alrefaei T., Sajid M. Modern solutions in magnetical analytical extractions of metals: A review // Trends Anal. Chem. 2020. V. 130. P. 115987.
Giakisikli G., Anthemidis A.N. Magnetic materials as sorbents for metal/metalloid preconcentration and/or separation. A review // Anal. Chim. Acta. 2013. V. 789. P. 1.
Егунова О.Р., Решетникова И.С., Казимирова К.О., Штыков С.Н. Магнитная твердофазная экстракция и флуориметрическое определение некоторых фторхинолонов // Журн. аналит. химии. 2020. Т. 75. № 1. С. 31. (Egunova O.R., Reshetnikova I.S., Kazimirova K.O., Shtykov S.N. Magnetic solid-phase extraction and fluorimetric determination of some fluoroquinolones // J. Anal. Chem. 2020. V. 75. № 1. P. 24.)
Егунова О.Р., Штыков С.Н. Концентрирование некоторых антибиотиков фторхинолонового ряда методом магнитной твердофазной экстракции на наночастицах магнетита // Сорбционные и хроматографические процессы. 2018. Т. 18. № 6. С. 825.
Егунова О.Р., Константинова Т.А., Штыков С.Н. Магнитные частицы магнетита в разделении и концентрировании // Изв. Саратовского ун-та. Новая серия. Серия: химия. Биология. Экология. 2014. Т. 14. № 4. С. 27.
Толмачева В.В., Апяри В.В., Кочук Е.В., Дмитриенко С.Г. Магнитные сорбенты на основе наночастиц оксидов железа для выделения и концентрирования органических соединений // Журн. аналит. химии. 2016. Т. 71. № 4. С. 339. (Tolmacheva V.V., Apyari V.V., Kochuk E.V., Dmitrienko S.G. Magnetic adsorbents based on iron oxide nanoparticles for the extraction and preconcentration of organic compounds // J. Anal. Chem. 2016. V. 71. № 4. P. 321.)
Lu A.-H., Salabas E.L., Schüth F. Magnetic nanoparticles: Synthesis, protection, functionalization, and application // Angew. Chem. Int. Ed. 2007. V. 46. № 8. P. 1222.
Yu M., Wang L., Hu L., Li Y., Luo D., Mei S. Recent applications of magnetic composites as extraction adsorbents for determination of environmental pollutants // Trends Anal. Chem. 2020. V. 119. P. 115611.
Abdelmonaim A., Kailasa S.K., Lee S.S., Rascón A.J., Ballesteros E., Zhang M., Kim K.-H. Review of nanomaterials as sorbents in solid-phase extraction for environmental samples // Trends Anal. Chem. 2018. V. 108. P. 347.
Aghaei E., Alorro R.D., Encila A.N., Yoo K. Magnetic adsorbents for the recovery of precious metals from leach solutions and wastewater // Metals. 2017. V. 7. № 12. P. 529.
Jiang H.-L., Li N., Cui L., Wang X., Zhao R.-S. Recent application of magnetic solid phase extraction for food safety analysis // Trends Anal. Chem. 2019. V. 120. P. 115632.
Ibarra I.S., Rodriguez J.A., Galán-Vidal C.A., Cepeda A., Miranda J.M. Magnetic solid phase extraction applied to food analysis // J. Chem. 2015. V. 2015. P. 1.
Safarik I., Horska K., Pospiskova K., Safarikova M. Magnetic techniques for the detection and determination of xenobiotics and cells in water // Anal. Bioanal. Chem. 2012. V. 404. P. 1257.
Li W.-K, Shi Y.-P. Recent advances and applications of carbon nanotubes based composites in magnetic solid-phase extraction // Trends Anal. Chem. 2019. V. 118. P. 652.
Siyuan D., Ning T., Yu J., Chen P., Yu H., Wang J., Yang H., Zhu S. Recent Advances and applications of magnetic nanomaterials in environmental sample analysis // Trends Anal. Chem. 2020. V. 126. P. 115864.
Shkinev V.M., Zakhodyaeva Y.A., Dzhenloda R.K., Mo-khodoeva O.B., Voshkin A.A. // Synthesis of magnetic iron oxide nanoparticles at the interface of the polyethylene glycol–ammonium sulfate–water extraction system // Mendeleev Commun. 2017. V. 27. № 5. P. 485.
Mokhodoeva O., Shkinev V., Maksimova V., Dzhenloda R., Spivakov B. Recovery of platinum group metals using magnetic nanoparticles modified with ionic liquids // Sep. Purif. Technol. 2020. V. 248. P. 117049.
Зайцев В.Н., Зуй М.Ф. Твердофазное микроэкстракционное концентрирование // Журн. аналит. химии. 2014. Т. 69. № 8. С. 1. (Zaitsev V.N., Zui M.F. Preconcentration by solid-phase microextraction // J. Anal. Chem. 2014. V. 69. № 8. P. 715.)
Hemmati M., Rajabi M., Asghari A. Magnetic nanoparticle based solid-phase extraction of heavy metal ions: A review on recent advances // Microchim. Acta. 2018. V. 185. P. 160.
Mehdinia A., Shegefti S., Shemirani F. A novel nanomagnetic task specific ionic liquid as a selective sorbent for the trace determination of cadmium in water and fruit samples // Talanta. 2015. V. 144. P. 1266.
Khani R., Sobhani S., Beyki M.H. Highly selective and efficient removal of lead with magnetic nano-adsorbent: Multivariate optimization, isotherm and thermodynamic studies // J. Colloid Interface Sci. 2016. V. 466. P. 198.
Aderibigbe A.D., Crane R.A., Lees M.R., Clark A.J. Selective uptake of Ag(I) from aqueous solutions using ionic liquid-modified iron oxide nanoparticles // J. Nanopart. Res. 2020. V. 22. P. 1.
Yamini Y., Seidi S., Latifeh F. Ionic liquid-modified silica-coated magnetic nanoparticles: promising anion-exchange sorbent for extraction of Cr(VI) // Int. J. Environ. Anal. Chem. 2017. V. 97. P. 1223.
Llaver M., Casado-Carmona F.A., Lucena R., Cárdenas S., Wuilloud R.G. Ultra-trace tellurium preconcentration and speciation analysis in environmental samples with a novel magnetic polymeric ionic liquid nanocomposite and magnetic dispersive micro-solid phase extraction with flow-injection hydride generation atomic fluorescence spectrometry detection // Spectrochim. Acta B. 2019. V. 162. P. 105705.
Aflatouni F., Soleimani M. Preparation of a new polymerized ionic liquid-modified magnetic nano adsorbent for the extraction and preconcentration of nitrate and nitrite anions from environmental water samples // Chromatographia. 2018. V. 81. P. 1475.
Chen S., Qin X., Gu W., Zhu X. Speciation analysis of Mn(II)/Mn(VII) using Fe3O4@ionic liquids-β-cyclodextrin polymer magnetic solid phase extraction coupled with ICP−OES // Talanta. 2016. V. 161. P. 325.
Bayat M., Shemirani F., Beyki M.H., Farahani M.D. Ionic liquid-modified Fe3O4 nanoparticle combined with central composite design for rapid preconcentration and determination of palladium ions // Desalin. Water Treat. 2015. V. 56. P. 814.
Gu W., Zhu X. Nanoparticles of type Fe3O4−SiO2−graphene oxide and coated with an amino acid-derived ionic liquid for extraction of Al(III), Cr(III), Cu(II), Pb(II) prior to their determination by ICP−OES // Microchim. Acta. 2017. V. 184. P. 4279.
Nasrollahpour A., Moradi S.M.J., Moradi S.E. Dispersive solid phase micro-extraction of mercury(II) from environmental water and vegetable samples with ionic liquid modified graphene oxide nanoparticles // J. Serbian Chem. Soc. 2017. V. 82. P. 551.
Peng B., Zhang J., Lu R., Zhang S., Zhou W., Gao H. Dispersive micro-solid phase extraction based on self-assembling, ionic liquid-coated magnetic particles for the determination of clofentezine and chlorfenapyr in environmental water samples // Analyst. 2013. V. 138. P. 6834.
Shahriman M.S., Ramachandran M.R., Zain N.N.M., Mohamad S., Manan N.S.A., Yaman S.M. Polyaniline-dicationic ionic liquid coated with magnetic nanoparticles composite for magnetic solid phase extraction of polycyclic aromatic hydrocarbons in environmental samples // Talanta. 2018. V. 178. P. 211.
Bakhshaei S., Kamboh M.A., Nodeh H.R., Zain S.M., Rozi M.S.K., Mohamad S., Mohialdeen I.A.M. Magnetic solid phase extraction of polycyclic aromatic hydrocarbons and chlorophenols based on cyano-ionic liquid functionalized magnetic nanoparticles and their determination by HPLC-DAD // RSC Adv. 2016. V. 6. P. 77047.
Liu X., Lu X., Huang Y., Liu C., Zhao S. Fe3O4@ionic liquid@methyl orange nanoparticles as a novel nano-adsorbent for magnetic solid-phase extraction of polycyclic aromatic hydrocarbons in environmental water samples // Talanta. 2014. V. 119. P. 341.
Ma W., Row K.H. Solid-phase extraction of chlorophenols in seawater using a magnetic ionic liquid molecularly imprinted polymer with incorporated silicon dioxide as a sorbent // J. Chromatogr. A. 2018. V. 1559. P. 78.
Latifeh F., Yamini Y., Seidi S. Ionic liquid-modified silica-coated magnetic nanoparticles: promising adsorbents for ultra-fast extraction of paraquat from aqueous solution // Environ. Sci. Pollut. Res. 2016. V. 23. P. 4411.
Golmohammadi F., Hazrati M., Safari M. Removal of reactive yellow 15 from water sample using a magnetite nanoparticles coated with covalently immobilized dimethyl octadecyl[3-(trimethoxysilylpropyl)]ammonium chloride ionic liquid // Microchem. J. 2019. V. 144. P. 64.
Lu J., Ye F., Huang X., Wei L., Yao D., Li S., Ouyang M., Lai H. Ionic-liquid-modified magnetic nanoparticles as a solid-phase extraction adsorbent coupled with high-performance liquid chromatography for the determination of linear alkylbenzene sulfonates in water samples // J. Sep. Sci. 2017. V. 40. P. 1133.
Yang F., Shen R., Long Y., Sun X., Tang F., Cai Q., Yao S. Magnetic microsphere confined ionic liquid as a novel sorbent for the determination of chlorophenols in environmental water samples by liquid chromatography // J. Environ. Monit. 2011. V. 13. P. 440.
Qin X., Bakheet A.A.A., Zhu X. Fe3O4@ionic liquid-β-cyclodextrin polymer magnetic solid phase extraction coupled with HPLC for the separation/analysis of congo red // J. Iran. Chem. Soc. 2017. V. 14. P. 2017.
Yang L., Su P., Chen X., Zhang R., Yang Y. Microwave-assisted synthesis of poly(ionic liquid)-coated magnetic nanoparticles for the extraction of sulfonylurea herbicides from soil for HPLC // Anal. Methods. 2015. V. 7. P. 3246.
Liu C., Liao Y., Huang X. Fabrication of polymeric ionic liquid-modified magnetic adsorbent for extraction of apolar and polar pollutants in complicated samples // Talanta. 2017. V. 172. P. 23.
He L., Cui W., Wang Y., Zhao W., Xiang G., Jiang X., Mao P., He J., Zhang S. Polymeric ionic liquid based on magnetic materials fabricated through layer-by-layer assembly as adsorbents for extraction of pesticides // J. Chromatogr. A. 2017. V. 1522. P. 9.
Yusoff M.M., Raoov M., Yahaya N., Salleh N.M. An ionic liquid loaded magnetically confined polymeric mesoporous adsorbent for extraction of parabens from environmental and cosmetic samples // RSC Adv. 2017. V. 7. P. 35832.
Wang T., Zhang R., Gong Z., Su P., Yang Y. Poly (ionic liquids) functionalized magnetic nanoparticles as efficient adsorbent for determination of pyrethroids from environmental water samples by GC−MS // ChemistrySelect. 2020. V. 5. P. 91.
Qiao F., Gao M., Yan H. Molecularly imprinted ionic liquid magnetic microspheres for the rapid isolation of organochlorine pesticides in environmental water // J. Sep. Sci. 2016. V. 39. P. 1310.
Liu C., Liao Y., Huang X. Extraction of triazole fungicides in environmental waters utilizing poly (ionic liquid)-functionalized magnetic adsorbent // J. Chromatogr. A. 2017. V. 1524. P.13.
Cao X., Shen L., Ye X., Zhang F., Chen J., Mo W. Ultrasound-assisted magnetic solid-phase extraction based ionic liquid-coated Fe3O4@graphene for the determination of nitrobenzene compounds in environmental water samples // Analyst. 2014. V. 139. P. 1938.
Chen F., Song Z., Nie J., Yu G., Li Z., Lee M. Ionic liquid-based carbon nanotube coated magnetic nanoparticles as adsorbent for the magnetic solid phase extraction of triazole fungicides from environmental water // RSC Adv. 2016. V. 6. P. 81877.
Huang X., Liu Y., Liu H., Liu G., Xu X., Li L., Lv J., Liu Z., Zhou W., Xu D. Magnetic solid-phase extraction of dichlorodiphenyltrichloroethane and its metabolites from environmental water samples using ionic liquid modified magnetic multiwalled carbon nanotube/Zeolitic Imidazolate Framework-8 as sorbent // Molecules. 2019. V. 24. P. 2758.
Luo M., Liu D., Zhao L., Han J., Liang Y., Wang P., Zhou Z. A novel magnetic ionic liquid modified carbon nanotube for the simultaneous determination of aryloxyphenoxy-propionate herbicides and their metabolites in water // Anal. Chim. Acta. 2014. V. 852. P. 88.
Du W., Yao L., Bian J., Liu Y., Wang X., Zhang J., Pang L. Ionic liquid-based air-assisted liquid–liquid microextraction combined with dispersive micro-solid phase extraction for the preconcentration of copper in water samples // Anal. Methods. 2018. V. 10. № 25. P. 3032.
Дмитриенко С.Г., Апяри В.В., Толмачева В.В., Горбуновa М.В. Дисперсионная жидкостно-жидкостная микроэкстракция органических соединений. Обзор обзоров // Журн. аналит. химии. 2020. Т. 75. № 10. С. 867. (Dmitrienko S.G., Apyari V.V., Tolmacheva V.V., Gorbunova M.V. Dispersive liquid−liquid microextraction of organic compounds: An overview of reviews // J. Anal. Chem. 2020. V. 75. № 10. P. 1237.)
Rykowska I., Ziemblinska J., Nowak I. Modern approaches in dispersive liquid−liquid microextraction (DLLME) based on ionic liquids: A review // J. Mol. Liq. 2018. V. 259. P. 319.
Sajid M., Nazal M.K., Ihsanullah I. Novel materials for dispersive (micro) solid-phase extraction of polycyclic aromatic hydrocarbons in environmental water samples: A review // Anal. Chim. Acta. 2021. V. 1141. P. 246.
Yilmaz E., Soylak M. Ionic liquid-linked dual magnetic microextraction of lead(II) from environmental samples prior to its micro-sampling flame atomic absorption spectrometric determination // Talanta. 2013. V. 116. P. 882.
Khan S., Kazi T.G., Soylak M. Rapid ionic liquid-based ultrasound assisted dual magnetic microextraction to preconcentrate and separate cadmium-4-(2-thiazolylazo)-resorcinol complex from environmental and biological samples // Spectrochim. Acta A. 2014. V. 123. P. 194.
Du W., Yao L., Bian J., Liu Y., Wang X., Zhang J., Pang L. Ionic liquid-based air-assisted liquid−liquid microextraction combined with dispersive micro-solid phase extraction for the preconcentration of copper in water samples // Anal. Methods. 2018. V. 10. P. 3032.
Filik H., Avan A.A. Ionic liquid based dispersive liquid-liquid microextraction combined with magnetic-based dispersive micro-solid-phase extraction for determination of trace cobalt in water samples by FAAS // Curr. Anal. Chem. 2017. V. 13. P. 456.
Tarigh G.D., Bakhtiari M., Shemirani F. Green chemicals-assisted dispersive magnetic solid-phase extraction: a prospect for speciation of Cr (III)/Cr (VI) in environmental water samples // Int. J. Environ. Anal. Chem. 2020. P. 1.
Fan C., Yang J., Liang Y., Dong H., Zhang W., Tang G., Cao Y. Effective tuning guanidinium ionic liquid as greener solvent for fast and sensitive determination of auxin herbicides // Microchem. J. 2019. V. 144. P. 73.
Fan C., Liang Y., Dong H., Ding G., Zhang W., Tang G., Yang J., Kong D., Wang D., Cao Y. In-situ ionic liquid dispersive liquid-liquid microextraction using a new anion-exchange reagent combined Fe3O4 magnetic nanoparticles for determination of pyrethroid pesticides in water samples // Anal. Chim. Acta. 2017. V. 975. P. 20.
Zhang Y., Yang X., Wang J., Zhou W., Lu R., Gao H., Zhang S. In situ solvent formation microextraction combined with magnetic dispersive micro-solid-phase extraction for the determination of benzoylurea insecticides in water samples // J. Sep. Sci. 2017. V. 40. P. 442.
Liu W., Zha J., Meng X., Wu J., Sun C., Qiu P., Fizir M., He H. Efficient removal and trace determination of chlorophenols from water using mixed hemi-/ad-micelle ionic liquid-coated magnetic graphene oxide and the adsorption mechanism // Anal. Methods. 2017. V. 9. P. 4581.
Liu W., Fizir M., Hu F., Li A., Hui X., Zha J., He H. Mixed hemimicelle solid-phase extraction based on magnetic halloysite nanotubes and ionic liquids for the determination and extraction of azo dyes in environmental water samples // J. Chromatogr. A. 2018. V. 1551. P. 10.
Kazemi E., Shabani A.M.H., Dadfarnia S., Abbasi A., Vaziri M.R.R., Behjat A. Development of a novel mixed hemimicelles dispersive micro solid phase extraction using 1-hexadecyl-3-methylimidazolium bromide coated magnetic graphene for the separation and preconcentration of fluoxetine in different matrices before its determination by fiber optic linear array spectrophotometry and mode-mismatched thermal lens spectroscopy // Anal. Chim. Acta. 2016. V. 905. P. 85.
Parham H., Saeed S. Ultrasound-assisted solid phase extraction of nitro- and chloro-(phenols) using magnetic iron oxide nanoparticles and Aliquat 336 ionic liquid // J. Chromatogr. A. 2014. V. 1336. P. 34.
Yang M., Wu X., Jia Y., Xi X., Yang X., Lu R., Zhang S., Gao H., Zhou W. Use of magnetic effervescent tablet-assisted ionic liquid dispersive liquid–liquid microextraction to extract fungicides from environmental waters with the aid of experimental design methodology // Anal. Chim. Acta. 2016. V. 906. P. 118.
Li Y., Hu J., Liu W., Jin L., Zhou P., Zhang Y., Zhang B., Dahlgren R.A., Wang X., Zhou Y. Magnetic effervescent tablet-assisted ionic liquid-based dispersive liquid−liquid microextraction of polybrominated diphenyl ethers in liquid matrix samples // Talanta. 2019. V. 195. P. 785.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии




