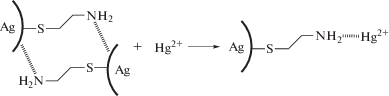Журнал аналитической химии, 2021, T. 76, № 6, стр. 530-537
Спектрофотометрическое определение ионов Hg2+ с использованием золей наночастиц серебра, модифицированных цистеамином
А. Ю. Оленин a, b, *, А. С. Коротков a
a Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
b Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: olan@petrol.chem.msu.ru
Поступила в редакцию 14.09.2020
После доработки 13.01.2021
Принята к публикации 18.01.2021
Аннотация
Восстановлением нитрата серебра борогидридом натрия в присутствии бромида цетилтриметиламмония получены устойчивые золи наночастиц серебра. Последующая их обработка гидрохлоридом цистеамина приводит к химическому модифицированию поверхности. Как исходные, так и модифицированные золи использованы для определения ионов Hg2+ в водной среде. Значения предела обнаружения аналита, интервал линейности аналитического сигнала для исходных золей серебра ниже по сравнению с модифицированными цистеамином аналогами.
В последние 15–20 лет сформировалось и активно развивается направление аналитической химии, в основе которого лежат процессы, происходящие в области размеров частиц порядка единиц–десятков нанометров. В научной литературе даже появился соответствующий термин “наноаналитика” [1]. В наноразмерном состоянии могут существовать вещества самой различной природы: металлы, оксиды и халькогениды, углеродные материалы, полимеры. Металлические наночастицы (главным образом золотые и серебряные) находят довольно широкое применение в классическом химическом и биохимическом анализе [2–11], процессах пробоподготовки к нему [12, 13].
Существенную, если не ключевую роль в процессах взаимодействия нанообъекта с аналитом играет химическая композиция поверхности наночастиц. Ее химическое модифицирование в ряде случаев позволяет улучшить аналитические характеристики метода. Наличие внешних функциональных групп за счет комплексообразования позволяет повысить селективность сорбции катионов. Этот эффект использован для определения ионов Ba2+ [14], Al3+ [15], Cr3+ [16], Cu2+ [17, 18], Fe3+ [19]. Изменения в спектрах поглощения, происходящие при этом, могут быть использованы для качественного и количественного определения тиолсодержащих веществ, таких как цистеин [20–24] или цистеамин [24–28]. Описаны [29–38] методики определения ионов Hg2+ с использованием золей наночастиц серебра. Объединение этих направлений может, во-первых, дать новую информацию о природе аналитического сигнала и, во-вторых, улучшить характеристики метода, связанные с его воспроизводимостью.
И химическое модифицирование поверхности наночастиц серебра, и их взаимодействие с ионами Hg2+ приводит к изменению спектров поглощения и соответственно характеристик аналитического сигнала.
Основная цель настоящей работы – выявление влияния каждого из факторов на спектральные свойства, параметры аналитических методик, описывающие воспроизводимость анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реагенты. Использовали следующие реагенты: нитрат серебра (98%, Реахим, Россия), бромид цетилтриметиламмония (99.5%, Helicon Chemical Company США), борогидрид натрия (99%, Acros Organics, Бельгия), гидрохлорид цистеамина (98%, Fluka, США). Реакции восстановления нитрата серебра, последующего химического модифицирования поверхности металлических наночастиц проводили в ультразвуковой ванне ПСБ-2855-05м (рабочий объемом 1.5 л, частота 35 кГц, акустическая мощность 100 Вт). Для спектрофотометрических исследований использовали спектрофотометр Jenway 6310 с кварцевой кюветой объемом 4 мл, толщиной слоя 1 см, диапазон длин волн 320–1000 нм. Образцом сравнения во всех случаях служила дистиллированная вода. Гидродинамический размер наночастиц определяли с использованием анализатора Zetasizer Nano ZS (Malvern; Германия).
Получение исходных наночастиц серебра. 34 мг (0.2 ммоль) нитрата серебра и 87 мг (0.24 ммоль) бромида цетилтриметиламмония растворяли в 4 мл дистиллированной воды, после чего полученную массу, содержащую золь бромида серебра, подвергали воздействию ультразвука в течение 10 мин. Затем при непрерывной ультразвуковой обработке в течение 10 мин с использованием микродозатора по каплям (объем капли 10 мкл) добавляли 1 мл свежеприготовленного раствора, содержащего 7.6 мг (0.2 ммоль) борогидрида натрия. При этом цвет системы изменялся от светло-кремового до коричневого. По окончании введения восстановителя полученный коллоид дополнительно выдерживали в ультразвуковой ванне в течение 20 мин.
Спектрофотометрические характеристики определяли с использованием полученных образцов золя, разбавленного дистиллированной водой в 300 раз.
Химическое модифицирование поверхности золей наночастиц серебра цистеамином. Непосредственно перед началом химического модифицирования золя наночастиц серебра готовили 0.01 М раствор гидрохлорида цистеамина. Затем методом последовательных разбавлений из него получали серию растворов гидрохлорида цистеамина с концентрациями 1 × 10–3, 1 × 10–4, 1 × 10–5, 1 × 10–6 и 1 × 10–7 М.
Химическое модифицирование проводили путем смешения 2.7 мл раствора гидрохлорида цистеамина и 0.3 мл разбавленного в три раза исходного золя наночастиц серебра с последующим выдерживанием полученной системы в ульразвуковом поле в течение 10 мин. Концентрация модификатора поверхности наночастиц в реакционных смесях составляла 9 × 10–3, 9 × 10–4, 9 × × 10–5, 9 × 10–6, 9 × 10–7 и 9 × 10–8 М.
Спектрофотометрические характеристики определяли для полученных образцов золей, разбавленных в 10 раз дистиллированной водой.
Определение ионов Hg2+ с использованием золей наночастиц серебра. Непосредственно перед использованием для приготовления стандартных образцов исходный 0.44 М раствор Hg(NO3)2 разбавляли дистиллированной водой в 50 раз. Далее последовательным разбавлением полученного раствора в два раза готовили серию растворов Hg(NO3)2 с концентрациями 9 × 10–5, 4.4 × 10–5, 2.2 × 10–5, 1.1 × 10–5, 5.5 × 10–6, 2.75 × × 10–6, 1.38 × 10–6 М.
К 2.7 мл раствора, содержащего нитрат ртути, добавляли 0.3 мл золя наночастиц серебра, модифицированных цистеамином, либо 0.3 мл исходного золя наночастиц, разбавленного дистиллированной водой в 30 раз. Спектрофотометрические характеристики полученных объектов определяли без дополнительного разбавления.
Для определения метрологических характеристик метода для каждого значения концентрации ионов ртути независимо пять раз регистрировали спектр поглощения. За аналитический сигнал принимали среднюю оптическую плотность, а за дисперсию – стандартное отклонение по пяти независимым измерениям. Все аналитические процедуры для исходных и модифицированных цистеамином наночастиц серебра проводили аналогично.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Химическое модифицирование поверхности гидрозолей наночастиц серебра. Восстановление нитрата серебра борогидридом натрия в присутствии бромида цетилтриметиламмония приводит к формированию устойчивых золей наночастиц, имеющих по данным динамического лазерного светорассеяния средний гидродинамический диаметр около 9 нм и максимум полосы светопоглощения при 401 нм. При введении в них водных растворов цистеамина наблюдается ярко выраженный пороговый концентрационный эффект изменения спектральных свойств (рис. 1). При достижении концентрации гидрохлорида цистеамина в исходной реакционной среде ~1 мкМ вид спектров поглощения резко изменяется. Наряду с основной полосой при 400 нм появляется дополнительная полоса поглощения в области 450–600 нм. По мере увеличения концентрации модификатора интенсивность коротковолновой полосы снижается, а длинноволновой растет.
Рис. 1.
Спектры поглощения исходного (1) и химически модифицированных цистеамином (2–7) золей наночастиц серебра. Концентрация гидрохлорида цистеамина в исходной смеси, М: 2 – 9 × 10–8, 3 – 9 × 10–7, 4 – 9 × 10–6, 5 – 9 × 10–5, 6 – 9 × 10–4, 7 – 9 × 10–3.

Огибающая линия спектра может быть представлена в виде линейной комбинации двух компонентов: коротковолнового и длинноволнового (рис. 2). Понимая, что “голой” поверхности наночастиц в конденсированной среде не существует, исходный золь условно будем считать немодифицированным. Его спектр поглощения примем за эталон, которому соответствует только коротковолновое поглощение в области 400 нм. Зависимость интенсивности поглощения от длины волны может быть выражена в виде функции, содержащей четыре параметра: положение максимума (λmax), его интенсивность (ΔA), ширину на половине высоты (σ) и базовую линию (А0) (рис. 2, кривая 1). Далее, считая вклад длинноволнового поглощения в области 320–400 нм незначительным и пренебрегая им, значения параметров λmax1, ΔA1, σ1 и А0(1) подберем таким образом, чтобы обеспечить аппроксимацию коротковолновой полосы спектров, представленных на рис. 1. Затем из огибающей линии спектра вычтем коротковолновую составляющую. В результате получим набор спектров, включающих только длинноволновую полосу поглощения. Полученные результаты представлены на рис. 3.
Рис. 2.
Схема разложения огибающей линии спектра на компоненты: 1 – эталонный спектр, содержащий коротковолновую полосу поглощения; 2 – полоса длинноволнового поглощения.
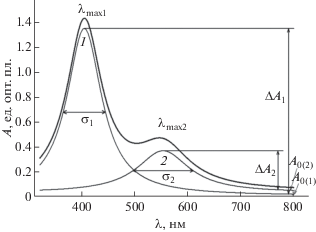
Рис. 3.
Спектры длинноволновых полос поглощения золей наночастиц серебра, модифицированных цистеамином. Концентрация гидрохлорида цистеамина в исходной смеси, М: 1 – 9 × 10–8, 2 – 9 × 10–7, 3 – 9 × 10–6, 4 – 9 × 10–5, 5 – 9 × 10–4, 6 – 9 × 10–3.

Интенсивность поглощения длинноволновой полосы (ΔA) существенным образом изменяется в зависимости от концентрации цистеамина. Ее максимальное значение фиксируется в области 10 мкМ. В отличие от интенсивности максимума поглощения (λmax), ширина полосы на половине высоты (σ) также коррелирует с концентрацией модификатора (рис. 4). Эта зависимость хорошо апроксимируется линейной функцией в полулогарифмических координатах. Подобный алгоритм может быть использован для группового качественного и полуколичественного определения водорастворимых серосодержащих соединений, таких как цистеин, цистеамин, цистамин и им подобных.
Рис. 4.
Зависимости положения максимума (λmax) и ширины полосы на половине высоты (σ) длинноволнового поглощения золя наночастиц серебра от логарифма концентрации гидрохлорида цистеамина.

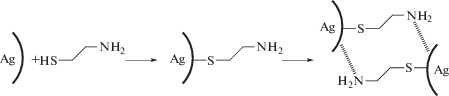
Наиболее вероятно, наблюдаемые эффекты можно объяснить сочетанием двух процессов: химического модифицирования поверхности и формирования агломератов серебряных наночастиц. Химическое модифицирование цистеамином происходит за счет необратимого связывания тиольной группы цистеамина с поверхностью наночастицы серебра. Вместе с тем наличие электронной пары у атома азота в аминогруппе цистеамина способствует образованию комплексов с поверхностными атомами других наночастиц (схема 1 ).
Схема 1 . Процессы, происходящие при химическом модифицировании цистеамином наночастиц серебра.
При достижении критического значения концентрации цистеамина на поверхности наночастиц наличие агломератов начинает сказываться на спектральных свойствах золей. В литературе имеются многочисленные описания процесса агрегации наночастиц серебра и связанной с ним трансформации спектров поглощения. В ансамбле наночастиц, находящихся на достаточно близком расстоянии друг от друга, кроме основной (около 400 нм) в спектре присутствует дополнительная длинноволновая полоса поглощения с максимумом в области 520–560 нм [39–43]. В отличие от основной полосы, она не столь характеристична, к тому же в ряде случаев изменяется во времени.
По данным динамического лазерного светорассеяния средний размер наночастиц изменяется от 9 для исходных до 21 нм для модифицированных. При химическом модифицировании наночастиц серебра в описанных выше условиях спектральные характеристики резко изменяются при достижении концентрации модификатора порогового значения в области единиц микромоль на литр. Концентрации цистеамина 1 мкМ соответствует молярное соотношение Ag : S~9 : 2. Модифицированию подвергаются только поверхностные атомы. Оценочные данные для частиц размером единицы нанометров дают долю поверхностных атомов серебра примерно 10–20%. С этой поправкой соотношение Ag(s) : S изменяется и составляет ~(0.5–1) : 1.
Опредление ионов Hg2+ с использованием золей наночастиц серебра. В основе методик определения ионов Hg2+ с использованием наночастиц серебра лежит использование изменения интенсивности полосы поверхностного плазмонного резонанса при построении градуировочных зависимостей [29–38]. Градуировочные зависимости могут быть построены двумя способами: по изменению интенсивности поглощения или площади пика (рис. 5). Для спектрофотометрии первый метод является традиционным, второй для нее менее характерен. Поскольку форма пика существенно не изменяется, то и его площадь пропорциональна содержанию наночастиц, и в этом случае должно соблюдаться соотношение Бугера–Ламберта–Бера.
Ионы ртути способны разрушать наночастицы серебра за счет образования гальванической пары с ними.
В ходе реакции на поверхности наночастиц серебра возможно формирование слоя амальгамы [29–32]. Наличие слоя модификатора может влиять на скорость реакции, но не сказывается на конечном результате.
Для исследования влияния химической композиции поверхностного слоя наночастиц на аналитические характеристики метода использовали исходный и модифицированный цистеамином образцы золя. Концентрация цистеамина при химическом модифицировании золей наночастиц серебра существенным образом сказывается на спектральных свойствах. Для нивелирования влияния этого фактора выбрали образец с максимально возможным содержанием цистеамина в поверхностном слое, не вызывающим радикальных изменений. Таким требования соответствует золь, модифицированный раствором гидрохлорида цистеамина с концентрацией 0.1 мкМ.
Исходный и модифицированный цистеамином золи наночастиц серебра использовали для определения ионов Hg2+. Для этого в раствор, содержащий аналит, вводили фиксированный объем золя, регистрировали спектр поглощения и сравнивали его характеристики с аналогичным для исходного образца, приготовленного на основе дистиллированной воды. Результаты представлены на рис. 6.
Рис. 6.
Спектры поглощения исходного (а) и модифицированного цистеамином (б) золей наночастиц серебра, полученные при разбавлении их дистиллированной водой (1) и водными растворами нитрата ртути (2–7). Концентрация ионов Hg2+, М: 2 – 2.2 × 10–6, 3 – 4.3 × 10–6, 4 – 8.6 × 10–6, 5 – 1.7 × 10–5, 6 – 3.4 × 10–5, 7 – 6.9 × 10–5.
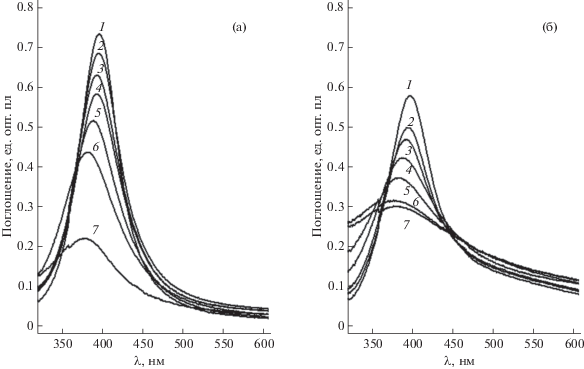
Поведение исходного и модифицированного золей аналогично. По мере увеличения содержания ионов Hg2+ происходит снижение интенсивности полосы поглощения ППР. Одновременно наблюдаются уширение, асимметризация пика со смещением его максимума в коротковолновую область. Никаких дополнительных полос поглощения при этом не возникает.
Градуировочные зависимости, полученные с использованием двух подходов, для исходных и модифицированных наночастиц серебра приведены в табл. 1. Модифицирование наночастиц серебра расширяет область линейности градуировочной зависимости, но одновременно повышает предел обнаружения и дисперсию значений нескольких независимых определений. Метод расчета аналитического сигнала практически не сказывается на воспроизводимости параметров анализа.
Таблица 1.
Аналитические характеристики методов определения ионов Hg2+ с использованием золей наночастиц серебра
| Метод расчета | Область линейности, мкМ | Предел обнаружения, мкМ | sr, % (n = 5) | y = ax + b | r | |
|---|---|---|---|---|---|---|
| a | b | |||||
| Исходный золь наночастиц серебра | ||||||
| По высоте | 2–70 | 0.3 | 19.5 | 0.0036 ± 0.0006 | 0.039 ± 0.019 | 0.950 |
| По площади | 2–70 | 0.2 | 18.9 | 0.33 ± 0.05 | 3.6 ± 1.5 | 0.962 |
| Золь наночастиц серебра, модифицированный цистеамином | ||||||
| По высоте | 8–300 | 0.9 | 9.7 | 0.00060 ± 0.00005 | 0.103 ± 0.006 | 0.988 |
| По площади | 8–300 | 0.7 | 11.9 | 0.056 ± 0.007 | 5.0 ± 0.9 | 0.971 |
Улучшение характеристик метода при использовании наночастиц, модифицированных цистеамином, можно объяснить координацией ионов Hg2+ по внешним аминогруппам (схема 2 ).
Схема 2 . Взаимодействие ионов Hg2+ с золем серебра, модифицированным цистеамином.
Кроме того, такая координация, скорее всего, препятствует агломерации и разрушает уже существующие ассоциаты (схема 3 ).
Схема 3 . Разрушение ассоциатов модифицированных наночастиц серебра под действием ионов Hg2+.
Комплексообразование ионов Hg2+ с аминогруппами способствует их концентрированию из раствора в непосредственной близости от поверхности наночастиц. В то же время слой модификатора не оказывает защитного воздействия в отношении гальванической реакции с участием ионов ртути и наночастиц серебра.
* * *
Таким образом, можно заключить, что обработка водных золей наночастиц серебра растворами гидрохлорида цистеамина приводит к химическому модифицированию поверхности. Объективным отражением этого процесса может служить изменение спектральных свойств. Наряду с коротковолновой полосой в области 400 нм появляется дополнительная полоса поглощения в длинноволновой области. Положение максимума и ширина этой полосы коррелируют с концентрацией гидрохлорида цистеамина в исходной реакционной смеси. Как исходные, так и химически модифицированные цистеамином золи наночастиц серебра могут быть использованы для определения ионов Hg2+ в водной среде. При этом метрологические характеристики метода, связанные с воспроизводимостью, для модифицированных золей выше, чем для исходных.
Список литературы
Nanoanalytics. Nanoobjects and Nanotechnologies in Analytical Chemistry / Ed. Shtykov S., Berlin: De Gruyter, 2018. 446 p.
Штыков С.Н., Русанова Т.Ю. Наноматериалы и нанотехнологии в химических и биохимических сенсорах: возможности и области применения // Рос. хим. журн. 2008. Т. 52. № 2. С. 92.
Апяри В.В., Дмитриенко С.Г., Горбунова М.В., Фурлетов А.А., Золотов Ю.А. Наночастицы золота и серебра в методах оптической молекулярной абсорбционной спектроскопии // Журн. аналит. химии. 2019. Т. 74. № 1. С. 26. (Apyari V.V., Dmitrienko S.G., Gorbunova M.V., Furletov A.A., Zolotov Yu.A. Gold and silver nanoparticles in optical molecular absorption spectroscopy // J. Anal. Chem. 2019. V. 74. № 1. P. 21.)
Терентьева E.A., Апяри В.В., Кочук Е.В., Дмитриенко С.Г., Золотов Ю.А. Применение наночастиц серебра в спектрофотометрии // Журн. аналит. химии. 2017. Т. 72. № 11. С. 978. (Terenteva E.A., Apyari V.V., Kochuk E.V., Dmitrienko S.G., Zolotov Yu.A. Use of silver nanoparticles in spectrophotometry // J. Anal. Chem. 2017. V. 72. № 11. P. 1138.)
Khlebtsov N.G., Melnikov A.G., Dykman L.A., Bogatyrev V.A. Optical properties and biomedical applications of nanostructures based on gold and silver bioconjugates // NATO Sci. Ser. II. 2004. V. 161. P. 265.
Dykman L.A., Khlebtsov N.G. Gold nanoparticles in biology and medicine: Recent advances and prospects // Acta Naturae. 2011. V. 3. № 2. P. 34.
Оленин А.Ю., Лисичкин Г.В. Поверхностно-модифицированные оксидные наночастицы. Получение и применение // Журн. общ. химии. 2019. Т. 89. № 7. С. 1101. (Olenin A.Yu., Lisichkin G.V. Surface-modifi ed oxide nanoparticles: Synthesis and application // Russ. J. Gen. Chem. 2019. V. 89. № 7. P. 1451.)
Оленин А.Ю. Химически модифицированные наночастицы золота и серебра в спектрометрическом анализе // Журн. аналит. химии. 2019. Т. 74. № 4. С. 254. (Olenin A.Yu. Chemically modified silver and gold nanoparticles in spectrometric analysis // J. Anal. Chem. 2019. V. 74. № 4. P. 355.)
Willard D.M. Nanoparticles in bioanalytics // Anal. Bioanal. Chem. 2003. V. 376. № 2. P. 284.
Penn S.G., Hey L., Natan M.J. Nanoparticles for bioanalysis // Curr. Opin. Chem. Biol. 2003. V. 7. № 5. P. 609.
Chen Y., Xianyu Y., Jiang X. Surface modification of gold nanoparticles with small molecules for biochemical analysis // Acc. Chem. Res. 2017. V. 50. № 2. P. 310.
Dastafkan K., Khajeh M., Ghaffari-Moghaddam M., Bohlooli M. Silver nanoparticles for separation and preconcentration processes // Trends Anal. Chem. 2015. V. 64. P. 118.
Mahgoub H.A. Nanoparticles used for extraction of polycyclic aromatic hydrocarbons // J. Chem. 2019. V. 2019. Art. 4816849.
Bamdad F., Khorram F., Samet M., Bamdad K., Sangi M.R., Allahbakhshi F. Spectrophotometric determination of L-cysteine by using polyvinylpyrrolidone-stabilized silver nanoparticles in the presence of barium ions // Spectrochim. Acta A. 2016. V. 161. P. 52.
Yang N., Gao Y., Zhang Y., Shen Z., Wu A. A new rapid colorimetric detection method of Al3+ with high sensitivity and excellent selectivity based on a new mechanism of aggregation of smaller etched silver nanoparticles // Talanta. 2014. V. 122. P. 272.
Ravindran A., Mani V., Chandrasekaran N., Mukherjee A. Selective colorimetric sensing of cysteine in aqueous solutions using silver nanoparticles in the presence of Cr3+ // Talanta. 2011. V. 85. № 1. P. 533.
Dou Y., Yang X., Liu Z., Zhu S. Homocysteine-functionalized silver nanoparticles for selective sensing of Cu2+ ions and Lidocaine hydrochloride // Coll. Surf. A. 2013. V. 423. P. 20.
Ratnarathorn N., Chailapakul O., Henry C.S., Dungchai W. Simple silver nanoparticle colorimetric sensing for copper by paper-based devices // Talanta. 2012. V. 99. P. 552.
Gao X., Lu Y., He S., Li X., Chen W. Colorimetric detection of iron ions(III) based on the highly sensitive plasmonic response of the N-acetyl-L-cysteine-stabilized silver nanoparticles // Anal. Chim. Acta. 2015. V. 879. P. 118.
Naqvi S., Anwer H., Ahmed S.W., Siddiqui A., Shah M.R., Khaliq S., Ahmed A., Ali S.A. Synthesis and characterization of maltol capped silver nanoparticles and their potential application as an antimicrobial agent and colorimetric sensor for cysteine // Spectrochim. Acta A. 2020. V. 229. Art. 118002.
Varghese M.V., Dhumal R.S., Patil S.S., Paradkar A.R., Khanna P.K. Synthesis and in vitro antimycobacterial studies of cysteine capped silver nano-particles // Synth. React. Inorg. Metal-Org. Nano-Met. Chem. 2009. V. 39. P. 554.
Borase H.P., Patil C.D., Salunkhe R.B., Suryawanshi R.K., Kim B.S., Bapat V.A., Patil S.V. Bio-functionalized silver nanoparticles: A novel colorimetric probe for cysteine detection // Appl. Biochem. Biotechnol. 2015. V. 175. № 7. P. 3479.
Elfassy E., Mastai Y., Salomon A. Cysteine sensing by plasmons of silver nanocubes // J. Solid State Chem. 2016. V. 241. P. 110.
Thomas A., Sivasankaran U., Kumar K.G. Biothiols induced colour change of silver nanoparticles: A colorimetric sensing strategy // Spectrochim. Acta A. 2018. V. 188. P. 113.
Apyari V.V., Dmitrienko S.G., Arkhipova V.V., Atnagulov A.G., Zolotov Yu.A. Determination of cysteamine using label-free gold nanoparticles // Anal. Methods. 2012. V. 4. № 10. P. 3193.
Diamai S., Negi D.P.S. Cysteine-stabilized silver nanoparticles as a colorimetric probe for the selective detection of cysteamine // Spectrochim. Acta A. 2019. V. 215. P. 203.
Oliva J.M., de la Rosa J.M.R., Sayagués M.J., Sánchez-Alcázar J.A., Merkling P.J., Zaderenko A.P. Solvent-assisted in situ synthesis of cysteamine-capped silver nanoparticles // Adv. Nat. Sci. Nanosci. Nanotechnol. 2018. V. 9. № 1. Art. 015001.
Telli F.C., Demir B., Barlas F.B., Guler E., Timur S., Salman Y. Novel glyconanoconjugates: Synthesis, characterization and bioapplications // RSC Adv. 2016. V. 6. № 106. P. 105806.
Zhan L., Yang T., Zhen S.J., Huang C.Z. Cytosine triphosphate-capped silver nanoparticles as a platform for visual and colorimetric determination of mercury(II) and chromium(III) // Microchim. Acta. 2017. V. 184. № 9. P. 3171.
Mi F.-L., Wu S.-J., Zhong W.-Q., Huang C.-Y. Preparation of a silver nanoparticle-based dual-functional sensor using a complexation–reduction method // Phys. Chem. Chem. Phys. 2015. V. 17. № 33. P. 21243.
Sengan M., Veeramuthu D., Veerappan A. Photosynthesis of silver nanoparticles using Durio zibethinus aqueous extract and its application in catalytic reduction of nitroaromatics, degradation of hazardous dyes and selective colorimetric sensing of mercury ions // Mater. Res. Bull. 2018. V. 100. P. 386.
Фурлетов А. А., Апяри В.В., Гаршев А.В., Дмитриенко С.Г., Золотов Ю.А. Треугольные нанопластинки серебра в качестве спектрофотометрического реагента для определения ртути(II) // Журн. аналит. химии. 2017. Т. 72. № 12. С. 1059. (Furletov A.A., Apyari V.V., Garshev A.V., Dmitrienko S.G., Zolotov Yu.A. Triangular silver nanoplates as a spectrophotometric reagent for the determination of mercury(II) // J. Anal. Chem. 2017. V. 72. № 12. P. 1203.)
Farhadi K., Forough M., Molaei R., Hajizadeh S., Rafipour A. Highly selective Hg2+ colorimetric sensor using green synthesized and unmodified silver nanoparticles // Sens. Actuators B. 2012. V. 161. № 1. P. 880.
Shen Z., Luo Y., Wang Q., Wang X., Sun R. High-value utilization of lignin to synthesize Ag nanoparticles with detection capacity for Hg2+ // ACS Appl. Mater. Interfaces. 2014. V. 6. № 18. P. 16147.
Bothra H., Solanki J.N., Sahoo S.K. Functionalized silver nanoparticles as chemosensor for pH, Hg2+ and Fe3+ in aqueous medium // Sens. Actuators B. 2013. V. 188. P. 937.
Kraithong S., Sirirak J., Soisuwan K., Wanichacheva N., Swanglap P. Enhancing sensitivity of novel Hg2+ fluorescent sensor via plasmonic enhancement of silver nanoparticles // Sens. Actuators B. 2018. V. 258. P. 694.
Choudhary M.K., Garg S., Kaur A., Kataria J., Sharma S. Green biomimetic silver nanoparticles as invigorated colorimetric probe for Hg2+ ions: A cleaner approach towards recognition of heavy metal ions in aqueous medi // Mater. Chem. Phys. 2020. V. 240. Art. 122164.
Anbazhagan V., Ahmed K.B.A., Janani S. Synthesis of catalytically active silver nanoparticles using lipidderived signaling molecule, N-steroylethanolamine: Promising antibacterial agent and selective colorimetric sensor for mercury ion // Sens. Actuators B. 2014. V. 200. P. 92.
Choudhury R., Misra T.K. Gluconate stabilized silver nanoparticles as a colorimetric sensor for Pb2+ // Coll. Surf. A. 2018. V. 545. P. 179.
Angelescu D.G., Vasilescu M., Anastasescu M., Baratoiu R., Donescu D., Teodorescu V.S. Synthesis and association of Ag(0) nanoparticles in aqueous Pluronic F127 triblock copolymer solutions // Coll. Surf. A. 2012. V. 394. P. 57.
Misra T.K., Liu C.-Y. Surface-functionalization of spherical silver nanoparticles with macrocyclic polyammonium cations and their potential for sensing phosphates // J. Nanopart. Res. 2009. V. 11. № 5. P. 1053.
Csete M., Szalai A., Csapó E., Tóth L., Somogyi A., Dékány I. Collective plasmonic resonances on arrays of cysteine-functionalized silver nanoparticle aggregates // J. Phys. Chem. C. 2014. V. 118. № 31. P. 17940.
Li H., Li F., Han C., Cui Z., Xie G., Zhang A. Highly sensitive and selective tryptophan colorimetric sensor based on 4,4-bipyridine-functionalized silver nanoparticles // Sens. Actuators B. 2010. V. 145. № 1. P. 194.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии