Журнал аналитической химии, 2021, T. 76, № 6, стр. 538-542
Взаимодействие в системе Ti(IV)–2,2',3,4-тетрагидрокси-3'-нитро-5'-сульфоазобензол-катионные поверхностно-активные вещества
А. Дж. Рагимова a, *, В. И. Марданова b, Г. Р. Мугалова b, А. М. Магеррамов b, Х. Д. Нагиев b, Ф. М. Чырагов b
a Газахский филиал Бакинского государственного университета
Az 3500 Газах, ул. Гейдар Алиев, 208, Азербайджан
b Бакинский государственный университет, химический факультет
Az 1148 Баку, ул. З. Халилова, 23, Азербайджан
* E-mail: vusala_chem@mail.ru
Поступила в редакцию 16.09.2020
После доработки 27.10.2020
Принята к публикации 20.11.2020
Аннотация
Исследовано комплексообразование титана(IV) с 2,2',3,4-тетрагидрокси-3'-нитро-5'-сульфоазобензолом (R) в присутствии катионных поверхностно-активных веществ (КПАВ) хлорида цетилпиридиния (ЦПCl), бромида цетилпиридиния (ЦПBr) и бромида цетилтриметиламмония (ЦТМАBr). Установлено, что в присутствии катионных поверхностно-активных веществ образуются смешанолигандные комплексы с соотношением компонентов ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$ : H4R– : КПАВ = 1 : 2 : 2. Установлены оптимальные значения рН образования комплексов: 4.5 для ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2 и 3.5 для смешанолигандных комплексов (${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2, ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПBr)2, ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2). Исследовано также влияние времени, температуры и концентрации реагирующих компонентов на образование смешанолигандных комплексов. Закон Бера соблюдается в интервале концентраций ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2, ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2, ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПBr)2, ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2 0.10–1.8, 0.10–1.92, 0.10–1.92, 0.08–1.92 соответственно. Изучено влияние посторонних ионов и маскирующих веществ на определение титана(IV) в виде смешанолигандных комплексов. Разработана методика спектрофотометрического определения микроколичеств титана в морском песке, взятом на берегу Каспийского моря около посeлка Туркан.
Металлический титан хорошо известен своей превосходной коррозионной стойкостью, способной противостоять воздействию разбавленной серной кислоты и соляной кислоты или даже влажного хлора. Титан такой же прочный, как сталь, но намного легче; он тяжелее алюминия и вдвое прочнее его. Эти свойства делают титан высокоустойчивым к обычным видам усталости металла. Приблизительно 95% произведенного титана потребляется в виде диоксида титана. Титановые сплавы в основном используют в производстве самолетов и ракет, где важны легкость, прочность и способность выдерживать экстремальные температуры. Титан применяют в медицине для изготовления протезов тазобедренного и коленных суставов, зубных имплантатов и в челюстно-лицевой хирургии. Титан существует в природе в виде титана(IV) – наиболее стабильном и обычном состоянии окисления. Отсюда следует важность мониторинга концентрации титана(IV) в различных объектах. Атомная абсорбционная спектрометрия с атомизацией в пламени и в графитовой печи и спектрофотометрические методы обеспечивают точное и быстрое определение титана(IV) в различных естественных и искусственных объектах [1–9]. Известно, что в присутствии катионных поверхностно-активных веществ аналитические характеристики комплексов улучшаются [10, 11].
В представленной работе спектрофотометрическим методом исследовано комплексообразование титана(IV) с 2,2',3,4-тетрагидрокси-3'-нитро-5'-сульфоазобензолом (H5R) в присутствии и в отсутствие катионных поверхностно-активных веществ – хлорида цетилпиридиния (ЦПCl), бромида цетилпиридиния (ЦПBr), бромида цетил-триметиламмония (ЦТMABr) и разработана высокоселективная методика определения микроколичеств титана в морском песке, взятом на берегу Каспийского моря около поселка Туркан.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы и реагенты. 2,2',3,4-Тетрагидрокси-3'-нитро-5'-сульфоазобензол (H5R) синтезировали по известной методике [12]. Для идентификации синтезированного реагента использовали элементный анализ, ИК- и ЯМР-спектроскопию. Структурная формула реагента представлена ниже:
Реагент представляет собой красное кристаллическое веществo, хорошо растворимое в воде. Использовали его 0.001 М водный раствор.
Стандартный 0.1 М раствор Ti(IV) готовили растворением рассчитанной навески металлического титана по методике [13]. Рабочие 5.0 × 10–4 М растворы получали разбавлением исходного дистиллированный водой перед употреблением.
В работе использовали 0.01 М растворы катионных поверхностно-активных веществ (КПАВ), которые готовили растворением 0.3395 г ЦПCl, 0.3845 г ЦПBr и 0.3646 г ЦТMABr в водно-этанольной смеси (7 : 3, по объему) в колбе емк. 100 мл. Растворы посторонних ионов и маскирующих веществ готовили по методике [13]. Все использованные реагенты имели квалификацию не ниже ч. д. а. Для создания необходимой кислотности использовали фиксанал HCl (pH 0–2) и ацетатно-аммиачные буферные растворы (рН 3–11).
Аппаратура. Спектрофотометрические измерения в УФ- и видимой областях спектра проводили на спектрофотометре Lambda-40 с компьютерным обеспечением и на фотоэлектроколориметре КФК-2 в кюветах толщиной 1.0 см. Кислотность растворов измеряли с помощь рН-метра рН-121 со стеклянным электродом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
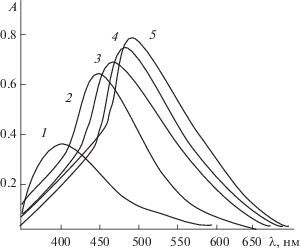
Спектрофотометрическое исследование комплексообразования в системе ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$–H4R––КПАВ. Ранее показано [10], что в кислой среде при рН 0–4.5 реагент в основном находится в форме H4R−, которая имеет максимальное светопоглощение при 405 нм. В этих условиях реагент с титаном(IV) образует окрашенный комплекс с максимальным светопоглощением при 465 нм. В присутствии КПАВ образуются смешанолигандные комплексы, при этом наблюдается батохромный сдвиг по сравнению со спектром бинарного комплекса. Максимальное светопоглощение комплексов ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$–H4R––ЦПСl, ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$–H4R––ЦПBr и ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$–H4R––ЦТМАBr наблюдается при 472, 476 и 480 нм соответственно (рис. 1).
Рис. 1.
Спектры светопоглощения комплексов титана(IV): 1 – H4R–, 2 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2 (pHорт 4.5), 3 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2 (pHорт 3.5), 4 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПBr)2 (pHорт 3.5), 5 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2 (pHорт 3.5). cTi = = 2.0 × 10–5 М, cR = 8.0 × 10–5 М, cКПАВ = 4.0 × 10–4 М, спектрофотометр Lambda-40, l = 1.0 см.
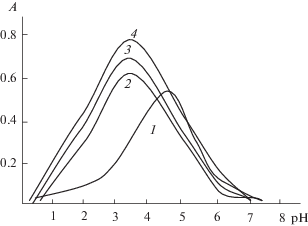
Изучение зависимости оптической плотности от рН среды показало, что в системе ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$–H4R––КПАВ максимальный выход смешанолигандных комплексов сдвигается в более кислую среду. Оптимальное значение рН (рНопт) образования всех смешанолигандных комплексов составило 3.5 (рис. 2).
Рис. 2.
Влияние рН на светопоглощение комплексов титана(IV): 1 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2 (λопт = 465 нм), 2 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2 (λопт = 472 нм), 3 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПBr)2 (λопт = 476 нм), 4 – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2 (λопт = 480 нм). cTi = = 2.0 × 10–5 М, cR = 8.0 × 10–5 М, cКПАВ = 4.0 × 10–4 М, спектрофотометр Lambda-40, l = 1.0 см, относительно раствора контрольного опыта.
В дальнейшем для установления оптимальных условий образования смешанолигандных комплексов изучили влияние концентраций реагирующих веществ. Найдено, что выход всех смешанолигандных комплексов максимален при концентрациях 8.0 × 10–5 М реагента и 4.0 × 10–5 М КПАВ.
Влияние времени и температуры. Исследовали зависимости образования и устойчивости комплексов в растворе от времени и температуры. Установлено, что все комплексы образуются после смешивания растворов компонентов мгновенно, образующиеся комплексы отличаются устойчивостью. Так, комплекс ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$–H4R– устойчив в течение менее двух часов и при нагревании до 50°С, а смешанолигандные комплексы устойчивы в течение более суток и при нагревании до 80°С.
Состав комплексов. Соотношение компонентов в составе образующихся окрашенных комплексов устанавливали методами изомолярных серий, относительного выхода Старика-Барбанеля и сдвига равновесия [14]. Результаты всех методов показали, что соотношение компонентов в комплексе ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{\text{2}}}$–H4R– равно 1 : 2, а в смешанолигандных комплексах ${\text{Ti}}({\text{OH}})_{{\text{2}}}^{{{\text{2}} + }}$–H4R––КПАВ 1 : 2 : 2. Для выяснения химизма комплексообразования в системе Ti(OH)22+–H4R- в присутствии и в отсутствие КПАВ применили метод Астахова [15]. Установили, что реакционноспособной формой реагента в условиях комплексообразования Ti(IV) в присутствии и в отсутствие КПАВ являются H4R– и H3R2– соответственно. Учитывая константы гидролиза ионов Ti(IV) [16] и форму существования реагента в оптимальных условиях, можно предложить следующую схему комплексообразования.
Методом пересечения кривых определили константы устойчивости комплексов титана [16]. Установили, что смешанолигандные комплексы более устойчивы по сравнению с бинарными: lg β[${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2] = 8.52 ± 0.04; lg β[${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2] = 10.83 ± 0.05; lg β[${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПBr)2] = 10.92 ± 0.04; lg β[${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2] = 11.08 ± 0.06. Зависимости оптической плотности от концентрации титана(IV) линейны в диапазонах 0.1–1.8 мкг/мл Ti(IV) для комплекса ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2, 0.1–1.9 мкг/мл – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2 и ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПBr)2, 0.08–1.92 мкг/мл – ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2 соответственно (табл. 1).
Таблица 1.
Основные спектрофотометрические характеристики комплексов титана(IV)
| Комплекс | рНопт | λмах, нм | Соотношение компонентов |
εмах × 10−4 | Диапазон линейности, мкг/мл |
|---|---|---|---|---|---|
| ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2 | 4.5 | 465 | 1 : 2 | 2.80 ± 0.04 | 0.10–1.8 |
| ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2 | 3.5 | 472 | 1 : 2 : 2 | 3.10 ± 0.03 | 0.10–1.92 |
| ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПBr)2 | 3.5 | 476 | 1 : 2 : 2 | 3.28 ± 0.04 | 0.10–1.92 |
| ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2 | 3.5 | 480 | 1 : 2 : 2 | 3.39 ± 0.01 | 0.08–1.92 |
Молярные коэффициенты светопоглощения комплексов ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2, ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦПСl)2, ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2‒)2(ЦПBr)2 и ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2‒)2(ЦТМАBr)2 (при λопт = 465, 472, 476, 480 нм соответственно) равны 2.80 × 104, 3.10 × 104, 3.28 × 104 и 3.39 × 104 соответственно.
Изучили влияние посторонних ионов и маскирующих веществ на определение Ti(IV) в виде бинарного и смешанолигандного комплексов. Установлено, что в присутствии КПАВ избирательность реакции значительно увеличивается. Определению Ti(IV) в виде смешанолигандных комплексов не мешают более чем 1000-кратные избытки ионов Co(II), Mn(II), Ni(II), Cr(III), Cd(II) и др. (табл. 2).
Таблица 2.
Допустимое соотношение по массе посторонних веществ к титану(IV) при его определении в виде ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(КПАВ)2 (погрешность 5%)
| Ион или вещество | H4R– | H4R––ЦПСl | H4R––ЦПBr | H4R––ЦТМАBr | 5-Бром-2-гидрокси-3-метоксибензальдегид-п-гидроксибензоил гидразин [8] |
|---|---|---|---|---|---|
| Na(I) | 6000 | Не мешает | Не мешает | Не мешает | |
| K(I) | 10 000 | Не мешает | Не мешает | Не мешает | |
| Mg(II) | 214 | 835 | 1030 | 1250 | |
| Ca(II) | 1000 | 1200 | 1200 | 1270 | |
| Ba(II) | 1220 | 1300 | 1310 | 1390 | 5842 |
| Zn(II) | 1000 | 1000 | 1100 | 1210 | 600 |
| Cd(II) | 100 | 110 | 115 | 170 | 82 |
| Mn(II) | 1000 | 1100 | 1100 | 1210 | 50 |
| Ni(II) | 1000 | 1120 | 1110 | 1215 | 5 |
| Co(II) | 530 | 825 | 840 | 890 | 12 |
| Fe(III) | 1 | 116 | 140 | 278 | |
| Сr(III) | 1500 | 1680 | 1705 | 1780 | 8 |
| Mo(VI) | 1 | 1 | 2 | 2.5 | 59 |
| W(VI) | 1 | 1 | 1.5 | 1.5 | 8 |
| Pb(IV) | 185 | 300 | 230 | 330 | 9 |
| Bi(III) | 200 | 315 | 310 | 355 | 18 |
| Cu(II) | 952 | 1050 | 1040 | 1080 | 63 |
| V(V) | 13 | 25 | 30 | 45 | 5 |
| ЭДТА | 20 | 30 | 35 | 40 | 50 |
| Мочевина | 535 | 500 | 520 | 540 | |
| Тиомочевина | 2000 | 2000 | 2000 | 2010 | |
| Лимонная кислота | 40 | 40 | 45 | 50 | |
| Винная кислота | 45 | 200 | 200 | 200 |
Разработанная методика спектрофотометрического определения титана в виде смешанолигандного комплекса ${\text{Ti}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{{{\text{2}} + }}$(H3R2–)2(ЦТМАBr)2 апробирована при анализе морского песка, взятого на берегу Каспийского моря около поселка Туркан.
Методика анализа. Навеску образца песка массой 2.0 г помещают в графитовую чашку и при нагревании расплавляют в смеси 5.0 г тетрабората натрия и 10.0 мл конц. H2SO4. Полученный остаток растворяют в 15 мл 9.0 М НСl и нерастворимую часть отделяют фильтрованием. Фильтрат помещают в колбу емк. 100 мл, разбавляют до метки дистиллированной водой и тщательно перемешивают. Аликвоту (1.0–4.0 мл) этого раствора переносят в мерную колбу емк. 25 мл, приливают 4.0 мл 0.001 М раствора реагента и 2.0 мл 0.01 М раствора бромида цетилтриметиламмония и разбавляют до метки ацетатно-аммиачным буферным раствором с рН 3.5. Измеряют оптическую плотность растворов на спектрофотометре КФК-2 при 490 нм в кюветах толщиной 1.0 см относительно аналогично приготовленного раствора контрольного опыта. Содержание титана находят по предварительно построенному градуировочному графику. Результаты анализа показали, что морской песок содержит 0.780 ± 0.045% титана, что соответствует данным определения титана с хромотроповой кислотой [17].
Список литературы
Madhavi D., Saritha B., Giri A., Sreenivasulu Reddy T. Direct spectrophotometric determination of titanium(IV) with 5-bromo-2hydroxy-3-methoxybenzaldehyde-p-hydroxybenzoic hydrazine // J. Chem. Pharm. Res. 2008. V. 6. № 6. P. 1145.
Mitsuru H., Shinichiro K., Shota M., Mamiko A., Takako Y., Yoshikazu F. Spectrophotometric determination of titanium with o-carboxyphenylfluorone in cationic micellar media, and its equilibrium and kinetic studies // Talanta. 2011. V. 85. P. 2339.
Lakshmi N.S., Young K.S., Sung O.B. Spectrophotometric determination of titanium(IV) by using 3,4-dihydroxybenzaldehydeisonicotinoylhydrazone (3,4-DHBINH) as a chromogenic agent // Chem. Sci. Trans. 2012. V. 1. № 1. P. 171.
Rabin K.M., Tarafder P.K. Extractive spectrophotometric determination of titanium in silicate rocks, soils and columbite–tantalite minerals // Microchim. Acta. 2004. V. 148. № 3. P. 327.
Zavvar Mousavi H., Pourreza N. Catalytic spectrophotometric determination of titanium (IV) using methylene blue-ascorbic acid redox reaction // J. Chin. Chem. Soc. 2008. V. 55. № 4. P. 750.
Mastoi G.M., Khuhawar M.Y, Kulsoom A., Moina A., Saba N., Humaira K., Arfana M., Zuhra M. Development of new spectrophotometric determination of titanium in homeopathic pharmacy using Ponceau S as a reagent // J. Pharm. Pharmacol. 2011. V. 5. № 8. P. 1179.
Vinnakota S., Aluru Raghavendra G.P., Kakarla R.K., Vahi S., Lakshmana Rao K.R. A new spectrophotometric method for the determination of trace amounts of titanium(IV) // J. Phys. Chem. Technol. 2010. V. 8. № 1. P. 15.
Madhavi D., Saritha B., Giri A., Sreenivasulu T.R. Direct spectrophotometric determination of titanium(IV) with 5-bromo-2hydroxy-3-methoxybenzaldehyde-p-hydroxybenzoic hydrazine // J. Chem. Pharm. Res. 2014. V. 6. № 6. P. 1145.
Xianfeng Du, Youlong Xu., Li Qin, Xiangfei Lu., Qiong L., Yang B. Simple and rapid spectrophotometric determination of titanium on etched aluminum foils // Am. J. Anal. Chem. 2014. № 5. P. 149.
Нагиев Х.Д. Закономерности образования и аналитическое пременение разнолигандных комплексов азосоединений на основе пирогаллола и триарилметановых красителей с некоторыми металлами. Автореф. дис. … докт. хим. наук. Баку, 2011. 56 с.
Гаджиева С.Р., Махмудов К.Т., Чырагов Ф.М. Исследование взаимодействия в системе медь(II)-3-(2-гидрокси-3-сульфо-5-нитрофенилазо)пентадион-2,4-катионные поверхностно-активные вещества // Журн. аналит. химии. 2006. Т. 61. № 7. С. 690.
Бородкин В.Ф. Химия красителей. M.: Химия, 1981. 248 с.
Коростелев П.П. Приготовление растворов для химико-аналитических работ. М.: Наука, 1964. 261 с.
Булатов М.И., Калинкин И.П. Практикум по фотометрическим и спектрофотометрическим методам анализа. Л: Химия, 1972. 407 с.
Астахов К.В., Вериницин В.Б., Зимин В.И., Зверкова А.А. Спектрофотометрическое изучение комплексооразования некоторых редкоземельных элементов с нитрилоуксусной кислотой // Журн. неорг. химии. 1961. Т. 6. С. 2069.
Назаренко В.А., Антонович В.П., Невская Э.М. Гидролиз металлических ионов в разбавленных растворах. М.: Атомиздат, 1979. 192 с.
Упор Э., Мохаи М., Новак Д. Фотометрические методы определения следов неорганических соединений. М.: Мир, 1985. 359 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии



