Журнал аналитической химии, 2021, T. 76, № 7, стр. 579-592
Поликапиллярные системы в аналитической химии
Н. А. Бурмистрова a, *, П. С. Пиденко a, К. Ю. Пресняков a, Д. Д. Дрозд a, Ю. С. Скибина b, С. А. Пиденко a, И. Ю. Горячева a
a Саратовский государственный университет им. Н.Г. Чернышевского, Институт химии
410012 Саратов, ул. Астраханская, 83, Россия
b ООО НПП “Нанострукутрная Технология Стекла”
410033 Саратов, просп. 50 лет Октября, 101, Россия
* E-mail: naburmistrova@mail.ru
Поступила в редакцию 19.10.2020
После доработки 02.12.2020
Принята к публикации 08.12.2020
Аннотация
Рассмотрено современное состояние научных и практических результатов применения поликапиллярных систем (ПС) в различных областях аналитической химии. Поликапиллярные сисиемы состоят из матрицы единичных капилляров, которые могут иметь различную геометрию и размеры (10 нм–n × 102 мкм). Их изготавливают из различных материалов как на основе кремнезема и силикатных стекол, так и органических полимеров. Рассмотрены основные виды ПС, способы их производства, достижения и перспективы их использования в различных областях аналитической химии. Особое внимание уделено применению микроструктурных оптических волокон в хемо- и биосенсорах.
Миниатюризация аналитических устройств, анализ микропроб, объединение циклов разделения, концентрирования и определения, наряду с совершенствованием характеристик анализа, является одной из актуальных задач современной аналитической химии. Поликапиллярные (капиллярные мультиканальные) системы (ПС), обладающие рядом уникальных свойств, – один из возможных инструментов решения перечисленных задач.
В настоящее время ПС активно изучают и используют при разработке систем хранения водорода [1], телекоммуникации [2], в качестве оптических фильтров [3], переключателей [4] и др. Отдельного рассмотрения заслуживает применение поликапиллярных линз в рентгеновской оптике [5]. Интерес к применению ПС в решении задач аналитической химии обусловлен значительным увеличением удельной площади поверхности сорбирующих и сенсорных элементов, что открывает возможность увеличения интенсивности аналитического отклика и эффективности разделения, снижения объeма анализируемых проб до микро- и нанолитров [6, 7]. Особое место среди ПС занимают микроструктурные оптические волокна (МОВ), отличающиеся особенностями архитектуры сборки капилляров и возможностью реализации различных механизмов прохождения света [8, 9]. Уникальными свойствами МОВ являются высокая чувствительность спектров пропускания волокон к изменению свойств среды, их заполняющей; к изменению геометрических размеров внутренних полостей; способность к передаче сигнала с малыми потерями; устойчивость к электромагнитным и радиочастотным помехам; небольшой размер; гибкость [10, 11].
Возможность использования для изготовления ПС широкого круга материалов как на основе кремнезема и силикатных стекол [12–14], так и органических полимеров [15–17] открывает возможности выбора ПС с учетом поставленной задачи. Доступность ПС на российском рынке [13] также является немаловажным фактором.
Важно отметить, что основная масса работ, связанных с аналитическим применением МОВ, выполнена разработчиками волокон и специалистами по оптике, а не химиками-аналитиками. В связи с этим аналитическая часть работ зачастую страдает отсутствием важных аналитических характеристик, детального описания методик либо определения аналитических параметров. В то же время за последние годы интерес к применению ПС существенно возрос. В данном обзоре рассмотрены аналитические работы в этой области за последние пять лет. Описаны основные виды перспективных ПС, методы их получения, модификации и подходы к использованию в аналитических целях, в том числе в оптических сенсорных элементах на основе МОВ, хроматографии и рентгеновских методах анализа. Литература за предшествующий период обобщена в обзорах [6–11].
ВИДЫ ПОЛИКАПИЛЛЯРНЫХ СИСТЕМ
Общее название “поликапиллярные системы” объединяет огромное разнообразие структур различной геометрии, собранных из единичных капилляров. Диаметр капилляров может варьироваться от десятков нанометров до сотен микрон, их количество в массиве может достигать десятков миллионов, а длина отдельных видов структур, на которой сохраняются их свойства, – сотен метров.
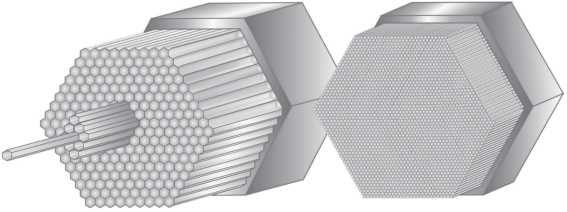
Важнейшим фактором, определяющим свойства ПС, является их геометрическая структура. Поликапилляры представляют собой набор собранных в единую структуру капилляров, сохраняющих свойства отдельных элементов (рис. 1). Такие наборы могут быть интегрированы в удобные держатели, что позволяет расширить область их применения в аналитических целях, например, при разделении и концентрировании ДНК и РНК [18].
Отдельную группу ПС представляют собой поликапиллярные фокусирующие элементы для рентгеновской оптики (оптики Кумахова), предназначенные для управления потоком излучения рентгеновского диапазона [5]. Единичные капилляры в таких ПС имеют особую форму, а количество структурных единиц может достигать сотен тысяч единиц.
Особым видом ПС являются МОВ, называемые также фотонно-кристаллическими волноводами (ФКВ). Данные системы впервые были предложены и изучены Филипом Расселом в 1995–1997 гг. [19–21]. В структуре МОВ отдельные элементы выполняют различные функции, что приводит к проявлению уникальных волноводных свойств. Варьирование геометрических характеристик и положения капилляров дает возможность управлять оптическими свойствами МОВ [8, 10].
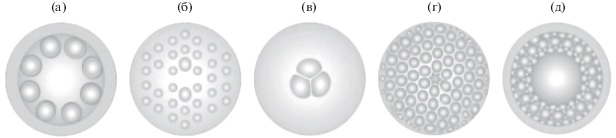
Архитектура МОВ характеризуется наличием упорядоченной оболочки из множества капилляров, проходящих по всей длине волокна и окружающих сердцевину. Эти микроскопические воздушные каналы окружают сердцевину МОВ, выполняющую роль волноведущего дефекта. Сердцевина МОВ может быть выполнена как в виде твeрдого сердечника (ТС) – сплошного ядра (МОВ ТС) [13, 15], так и представлять собой воздушный канал (полую сердцевину, ПС), сформированный стенками капилляров оболочки (МОВ ПС) [12–14]. Некоторые виды МОВ представлены на рис. 2.
Рис. 2.
Поперечное сечение коммерчески доступных микроструктурных оптических волокон: с полой трубной решеткой (а), с двойной сердцевиной (б), с подвешенной сердцевиной (в), фотонно-кристаллические волноводы (д), с полой сердцевиной (д).
Изменение положения спектральных полос в спектрах пропускания МОВ при заполнении их структуры анализируемой средой определяется особенностями волноведущего механизма волокна [22]. В МОВ ТС, к которым относятся в том числе МОВ с “подвешенным” сердечником [23], механизм основан на явлении полного внутреннего отражения, при этом взаимодействие излучения, проходящего через сердечник и капилляры, происходит благодаря эффекту затухающего поля [16]. В случае МОВ ПС возможна реализация нескольких механизмов распространения излучения в зависимости от архитектуры волокна [24]. Если период структурной оболочки МОВ ПС равен либо меньше длины волны излучения, то возможен механизм, обусловленный формированием фотонно-запрещенных зон, или конструктивная интерференция рассеянного излучения. В случае если период структурной оболочки существенно больше длины волны распространяющегося излучения, реализуются механизмы формирования спектра эталона Фабри-Перо [25]. При этом длина волны излучения, соответствующая минимуму в спектре пропускания МОВ ПС, соответствует резонансным модам оболочки волновода. Третьим случаем является Брэгговское отражение от периодической структуры оболочки МОВ и антирезонансное отражение от слоя с высоким показателем преломления [26].
МОВ ПС с большим периодом решетки, характеризующиеся антирезонансным распространением излучения, наиболее перспективны при разработке сенсорных устройств ввиду большого (более 100 мкм) диаметра полой сердцевины и более эффективного взаимодействия излучения с анализируемой средой непосредственно в объеме полого центрального дефекта волокна.
ПРОИЗВОДСТВО ПОЛИКАПИЛЛЯРНЫХ СИСТЕМ
В настоящее время известны и используются несколько основных способов изготовления ПС из оксида кремния или силикатных стекол. Способ изготовления кругло-симметричных заготовок включает этапы получения волоконной заготовки и вытягивания волокна микроскопического масштаба с сохранением архитектуры поперечного сечения с использованием высокотемпературной печи [22, 27]. Заготовки получают парофазным осаждением, позволяющим изготавливать образцы с очень низким уровнем содержания примесей и точно контролировать степень легирования. Для производства оптического волокна из несимметричных заготовок применяют методы обработки круглых заготовок, например механическое сверление или фрезерование [28], лазерное бурение [29]. Возможными способами изготовления МОВ из оксида кремния являются экструзия [30], золь–гель литьe [31], литьe под давлением [32].
Распространенным методом производства МОВ из неорганических и полимерных материалов является ручная укладка полых и сплошных структурных элементов в пакет и многократная их перетяжка в вертикальных вытяжных башнях, так называемый метод “stack-and-draw” [17, 27].
Поликапиллярные системы из органических полимерных материалов изготавливают при более низких температурах по сравнению со стеклянными ввиду возможности достижения благоприятного баланса между поверхностным натяжением и вязкостью при низких температурах вытяжки ПС. Это дает возможность значительно уменьшить вероятность схлопывания структурных капиллярных отверстий и, как следствие, позволяет предотвратить их дальнейшее разрушение, приводящее к значительному ухудшению свойств ПС. При этом можно реализовать большое разнообразие структурных модификаций при значительно меньшем температурном воздействии [33]. В качестве материалов для изготовления ПС применяют также оптически прозрачные полимеры, такие как полиметилметакрилат, сополимеры перфторированных диоксоланов, полистирол, поликарбонат [17, 33–35].
Поликапиллярные системы из органических полимерных материалов в перспективе коммерчески более выгодны по сравнению с традиционными стеклянными волокнами [34]. Кроме того, МОВ из органических полимерных материалов обладают рядом преимуществ, к которым можно отнести более высокую гибкость, низкий показатель модуля Юнга, высокие пределы упругой деформации и высокую вязкость, по сравнению с традиционными МОВ из неорганических материалов [10]. В то же время потери сигнала в МОВ из органических полимеров значительно больше, чем в стеклянных, что затрудняет их использование для определения следовых концентраций [17].
Особенности технологии производства поликапиллярных оптических элементов для рентгеновской оптики подробно описаны в работе [36].
ПРИМЕНЕНИЕ ПОЛИКАПИЛЛЯРНЫХ СИСТЕМ В АНАЛИТИЧЕСКОЙ ХИМИИ
Интерес к ПС в аналитической химии связан с возможностью их использования в качестве твердой подложки с высокоразвитой поверхностью при разработке разделительных и сенсорных элементов. Использование уникальных свойств МОВ как преобразователей и трансдьюсеров оптического сигнала приводят к многофункциональности платформ на их основе. Важными преимуществами систем на основе ПС является возможность миниатюризации устройств, интеграции в оптические схемы и использования микрообъемов образца для анализа.
Важным направлением является использование рентгеновских оптических элементов в аналитических приборах, которое рассмотрено отдельно.
Оптические сенсоры на основе микроструктурных оптических волокон. При создании оптических сенсорных систем особый интерес в качестве ПС представляют МОВ, применение которых основано на детектировании: (1) изменений в спектрах пропускания волокон вследствие поглощения или отражения излучения, изменения показателя преломления, оптико-термических эффектов и рассеяния на частицах анализируемой среды; (2) люминесценции анализируемых объектов или меток в объеме/на поверхности МОВ; (3) сигнала комбинационного рассеяния (КР) либо гигантского комбинационного рассеяния (ГКР). Общая хронология развития подходов к применению МОВ и подобных им структур для создания сенсорных систем описана в обзоре [37].
Сенсоры на основе регистрации изменений в спектрах пропускания МОВ различных видов нашли широкое применение при анализе физических параметров, таких как температура [35, 38], влажность [39], давление [40] и др. [17].
Наиболее перспективно при создании газовых и жидкостных хемо- и биосенсоров прямое измерение изменения показателя преломления среды и вызванной им трансформации спектра пропускания МОВ [41–43]. Применение полимерных МОВ с подвешенной сердцевиной при анализе жидкостей рассмотрено на примере смесей глицерин–вода и позволяет определять показатель преломления в диапазоне значений 1.4269–1.4361 RIU [42]. Предложенный [43] микропроточный интерферометр Маха-Цендера на основе многомодального МОВ апробирован при анализе растворов сахарозы и характеризуется высоким разрешением (3.1–7.5) × 10–5 RIU в диапазоне от 1.333 до 1.370 RIU. Интерферометр Саньяка на основе МОВ использован для сенсорного определения до 120 г/л глюкозы с пределом обнаружения 0.76 мг/дл [44].
Подходы к разработке хемосенсоров на основе МОВ для определения газообразных, легколетучих органических веществ и анализа растворов, а также влияние различных факторов на трансформацию спектров пропускания волокон подробно обсуждены в работах [16, 45–48]. Примеры сенсоров на основе МОВ приведенные в табл. 1, показывают, что разработанные системы характеризуются малым временем отклика, высокой чувствительностью и низкими пределами обнаружения. Перспективным направлением является разработка сенсоров на основе МОВ для определения биомолекул [9, 16]. В то же время их практическое применение ограничено, что связано со сложностью интерпретации аналитического сигнала из-за возможности одновременного влияния показателя преломления, оптической плотности среды и геометрических размеров внутренних полостей. В связи с этим важной задачей является разработка подходов к интерпретации данных спектров пропускания МОВ, имеющих аналитическую значимость. Нами показана возможность использования методов хемометрической обработки спектров пропускания МОВ для определения индивидуальных белков (бычий сыворочный альбумин, овальбумин, иммуноглобин G) в двойных и тройных смесях и в образцах сыворотки крови овцы [60].
Таблица 1.
Примеры хемосенсоров на основе микроструктурных оптических волокон
|
Аналитиче-ский сигнал |
Определяемое вещество |
Тип МОВ |
Модификация |
ДОК (ПрО); чувствительность |
Время отклика |
Лите-ратура |
|
Спектр пропускания |
С2Н2 (г) |
МОВ ПС |
– |
0–1.6 % (30 ppb) |
1 с |
[49] |
|
МОВ ПС |
– |
(398 ppm) |
50 с |
[50] |
||
|
СН4 (г) |
МОВ ПС |
– |
0–1000 ppm (8.7 ppm) |
10.1 с |
[51] |
|
|
ФКВ-БПР |
Криптофан A-6Me на поверхности поликомпозитной пленки (ПАК-УНТ/ППА) |
0–3.5% (0.18%); 1.078 нм/% |
– |
[52] |
||
|
Криптофан А, нано-пленка фторсилоксана |
0–3.5% (0.16%); 0.514 nm/% |
[53] |
||||
|
NH3 (г) |
ФКВ-ИМЦ |
Нанокомпозит ПАНИ/SnO2 |
(8.1 ppt) |
7 с |
[54] |
|
|
H2S (г) |
ФКВ-ИМЦ |
Пленка графена |
0–45 ppm; 0.03143 нм/ppm |
60 с |
[55] |
|
|
СН2О (г) |
ФКВ ПС, ФКВ-ИМЦ |
УНТ |
0–15 ppm;1.2 нм/10 ррm |
120 с |
[56] |
|
|
С6Н6 (г) |
УНТ/СdO |
0–15 ppm; 0.8 нм/10 ррm |
||||
|
Одновременное определение СН4 и Н2 (г) |
ФКВ-ППР |
Au/пленки Pd/WO3 и rриптофан А во фторсилоксане |
–; 1.99 и 0.19 нм/% |
– |
[57] |
|
|
С2Н5ОН (водн.) |
МОВ БР-ППР |
Au |
0–80%; 0.09 нм/% (200 нм/RIU) |
– |
[58] |
|
|
Au/оксид графена |
0–80%; (500 нм/RIU) |
– | ||||
|
Глюкоза (водн.) |
ФКВ-ИС |
– |
0–120 г/л; (0.76 мг/дл) |
– |
[44] |
|
|
МОВ ТС- ППР |
Ag нанопроволока (90 нм, 30 мкм, 1000 ppm) |
10–60 г/л; (44.25 мг/дл); 5.9445 × 10–3 нм/RIU |
– |
[59] |
||
|
БСА, Овальбумин (водн.) |
МОВ ПС |
– |
10-3–10 мг/мл (БСА – 0.1, овальбумин 0.8 мкг/мл) |
[60] |
||
|
КР |
Моксифлоксацин (водн.) |
МОВ ПС |
– |
2 мкМ–1 мМ (1.7 мкM); 35.9 a.u./мкМ |
– |
[61] |
|
ГКР |
Лейкозные клетки |
МОВ ПС |
НЧ Ag в растворе |
310–25000 клеток/мл (300 клеток/мл) |
[62] |
|
|
Сиаловая кислота |
МОВ ПС |
НЧ Au |
(2 фМ) |
[63] |
||
|
Люминесценция |
Cl– (водн.) |
МОВ SC |
Золь–гель мембрана (ТЕОС−С2Н5ОН)/люцигинин |
0.1–0.5 М |
10 с |
[64] |
|
Li+ (ацетонитрил) |
МОВ SC |
АПТЕС/спиропиран конденсированный с 1-азо-15-краун-5 |
100 нМ–10 мкМ |
2 мин |
[65] |
|
|
Zn2+ (ацетонитрил) |
МОВ EC |
Липосомы/спиропиран конденсированный с бис(2-пиридилметил)амином |
10 мкМ |
– |
[66] |
|
|
МОВ SC |
0.8–1.3 мкМ |
|||||
|
Al3+(водн.) |
МОВ EC |
ПАА/люмогалион |
1 мМ |
15 мин |
[67] |
|
|
NO (водн.) |
МОВ EC |
Карбоксиэтилсиланетриол/ квантовые точки (CdTe/CdS) |
10–11–10-4 М (10–11 М); 0.34 отн.ед./lgc(M) |
50 с |
[68] |
|
|
2,4,6-ТНТ (г) |
ФКВ ПС |
POSS/аллил-тетрафенилэтилен |
до 8 ppb (0.340 ppb); 0.309 отн.ед./ppb |
130 с |
[69] |
|
|
2,4-ДНТ (г) |
0–350 ppb |
160 с |
||||
|
2,6-ДНТ (г) |
0–700 ppb |
180 с |
Используемые сокращения: БСА – бычий сывороточный альбумин; ТНТ – тринитротолуол; ДНТ – динитротолуол; ДОК – диапазон определяемых концентраций; ПрО – предел обнаружения; ПС – полая сердцевина; ФКВ – фотонно-кристаллическое волокно; БПР – большой период решетки; ИМЦ – интерферометр Маха-Цендера; ИС – интерферометр Саньяка; БР – брэгговская решeтка; SC – подвешенная сердцевина; EC – exposed-core; КИ – конусный интерферометр; ППР – поверхностный плазмонный резонанс; ПАК – полиакриловая кислота; УНТ – углеродные нанотрубки; ППА – полипропиленамин; ПАНИ – полианилин; НЧ – наночастицы; ТЕОС – тетраэтоксисилан; АПТЕС – 3-аминопропилтриэтоксисилан; ПАА – полиаллиламин гидрохлорид; POSS – полиэдральный олигомерный силсесквиоксан.
Модификация МОВ органическими полимерами, неорганическими наночастицами и гибридными материалами позволяет повысить чувствительность и селективность сенсорных систем [70, 71]. При этом высокая чувствительность МОВ к толщине модифицирующего слоя и его показателю преломления позволяет контролировать процесс модификации волокна.
Отдельного рассмотрения заслуживает возможность использования МОВ для генерации сигнала поверхностного плазмонного резонанса (ППР) как на поверхности волокон, так и в заполняющем растворе, приводящего к существенному усилению аналитического сигнала и достижению высоких чувствительности (n × 103 нм/RIU) и разрешающей способности (n × 10–5 RIU) [72–74]. Принципы функционирования ППР сенсоров на основе различных видов МОВ, подходы к теоретическому предсказанию их свойств, а также достоинства и недостатки использования различных типов волокон подробно обсуждаются в работах [73, 74].
Определенный интерес представляет использование МОВ при конструировании хемосенсоров на основе КР и ГКР [61–63, 75–77]. Основной проблемой при разработке сенсоров на основе ППР и ГКР является создание гомогенных активных слоев вследствие сложной геометрии поверхности МОВ [77].
Особенности свойств МОВ как транcдьюсера и коллектора оптического сигнала обусловливают интерес к детектированию люминесценции в качестве аналитического сигнала [7, 78]. При этом возможно детектирование эмиссии флуорофоров, находящихся и в объеме, и на поверхности МОВ [68–73]. Показана возможность высокочувствительного определения неорганических ионов в водных растворах [64, 67] и ацетонитриле [65, 66], основанного на тушении флуоресценции органических красителей, иммобилизованных на внутренней поверхности МОВ. Использование МОВ позволило снизить предел обнаружения оксида азота(II), генерируемого в растворе S-нитрозо-N-ацетилпеницилламином, на 2–3 порядка по сравнению с известными электрохимическими сенсорами [68].
Использование люминесцентных квантовых точек (КТ), характеризующихся высокой фотостабильностью и узкими полосами испускания, более перспективно по сравнению с органическими красителями. Некоторые особенности использования КТ в МОВ, в частности, возможность “красного” смещения максимума фотолюминесценции КТ в МОВ ПС, возникающего при определенной спектральной суперпозиции фотолюминесценции КТ и спектра пропускания волокна, изучены в работе [79].
Определение Zn2+ в жидкости, забранной из лeгких и носоглотки мыши [66], при использовании МОВ с частично вскрытой сердцевиной и МОВ с подвешенной сердцевиной показало высокую правильность результатов, подтверждeнную сходимостью с результатами традиционных методов. При этом необходимый объем пробы при использовании МОВ составляет ~20 нл, что существенно меньше по сравнению с методом на основе флуозина-3 (20 мкл) и масс-спектрометрии с индуктивно связанной плазмой (2 мл). Приведенные результаты указывают на перспективность использования МОВ при in situ и in vivo биоанализе. На примере измерения флуоресценции раствора родамина В на уровне 10 нМ в работе [80] показано, что эффективность использования МОВ с подвешенной сердцевиной выше по сравнению с многомодовыми оптическими волокнами.
Сенсор для определения следовых количеств взрывчатых веществ на основе тушения флуоресценции пленки, сформированной включением аллилтетрафенилэтилена в полиэдральный олигомерный силсесквиоксан (POSS-V8/NOA13685) на внутренней поверхности МОВ ПС, предложен в работе [69]. Данные о влиянии показателя преломления и толщины чувствительной пленки на тушение флуоресценции показали хорошее совпадение экспериментальных и теоретически рассчитанных данных.
Особого внимания заслуживают оптические биосенсоры на основе МОВ, нашедшие применение как при определении биомолекул (ДНК, белки и антитела), так и низкомолекулярных соединений (табл. 2). Направленная функционализация поверхности волокна открывает возможность интегрирования в МОВ известных подходов анализа специфичных взаимодействий между белками-мишенями и принципов комплементарности.
Таблица 2.
Примеры биосенсоров на основе микроструктурных оптических волокон
| Аналитический сигнал | Определяемое вещество | Тип МОВ | Модификация | ДОК (ПрО); чувствительность | Время отклика | Лите-ратура |
|---|---|---|---|---|---|---|
| Спектр пропускания | Стрептавидин | МОВ ЕС | (ПАА-ПСС)2/биотин | 0.2 мг/мл; –3.137 нм/RIU | – | [81] |
| ДНК | МОВ ИС | Поли-L-лизин/ ss ДНК | 100 пМ–1 мкМ (75 пМ); 13 488 нм/RIU | 60 мин | [82] | |
| ssДНК | МОВ КИ | АПТЕС/карбоксилированный оксид графена | 10–12–10–6 М (4 пМ); ~0.7 нм/lgМ | – | [83] | |
| ssДНК | МОВ БПР | Поли-L-лизин/олигонуклеотидные последовательности | 0.06–0.5 мкМ (209 нМ); 62 нм/RIU | 5 мин | [84] | |
| О,О-диметил-О-(4-нитрофенил)тиофосфат (паратионметил) | МОВ ИМЦ | АПТЕС/глутаровый альдегид/ацетилхолинэстераза | 2 нМ–50 мкМ (0.24 нМ); 2100 нм/RIU | 20 мин | [85] | |
| Геномная ДНК | МОВ БР-ППР | АПТЕС/пептидо-нуклеиновая кислота/ Au НЧ-олигонуклеотид | 30 нг/мл | 50 мин | [86] | |
| Гликопротеины (водн.) | МОВ БР-ППР | Au пленка (50 нм), функционализированная фенилбороновой кислотой | (15.56 нМ); 2.867 dB/ (мг/мл) | 240 c | [87] | |
| IgG человека | МОВ ТС-ППР | Au/11-меркаптоундекановая кислота/ белок А/ овечьи античеловеческие IgG | 0.3–50 мкг/мл (0.3 мкг/мл); 1888 нм/RIU | – | [88] | |
| Au/меркаптоэтиламин/оксид графена/белокА/ овечьи античеловеческие IgG | 0.01–50 мкг/мл (0.01 мкг/мл); 4650 нм/RIU | – | ||||
| Люминесценция | Антиген (кроличьи IgG) | МОВ ТС | АПТЕС/глутаровый альдегид/ антитела (goat antirabbit IgG)-вторичные антитела, меченные флуоресцентной меткой (AF488 IgG) | 500 нг/мл | – | [89] |
| ГКР | Лейкозные клетки | МОВ ПС | НЧ Ag в растворе | 310–25000 клеток/мл (300 клеток/мл) | – | [90] |
| Сиаловая кислота, меченная 4-(дигидроксиборофенил)ацетилен | МОВ ПС | НЧ Au в растворе | (2 фМ) | – | [91] | |
| Белки клетки, модифицированные при окислении липидов гидропероксидом кумола | МОВ ТС | НЧ Au в растворе | 5–150 мкМ окислителя | – | [92] |
Используемые сокращения: ДОК – диапазон определяемых концентраций; ПрО – предел обнаружения; EC – exposed-core; ИС – интерферометр Саньяка; КИ – конусный интерферометр; БПР – большой период решетки; ИМЦ – интерферометр Маха-Цендера; БР – брэгговская решeтка; ТС – твердая сердцевина; ППР – поверхностный плазмонный резонанс; ПАА – полиаллиламин гидрохлорид; ПСС – полистиролсульфонат натрия; АПТЕС – 3-аминопропилтриэтоксисилан; НЧ – наночастицы.
Биосенсоры без использования меток предложены для определения как высокомолекулярных, так и низкомолекулярных соединений и основаны на чувствительности МОВ к избирательной адсорбции целевых биомолекул на функционализированной поверхности, приводящей к изменению положения полос в спектре пропускания волокна [81–87, 93]. Предварительная модификация поверхности волокон с использованием поли-L-лизина, оксида графена, полиэлектролитов, кремнийорганических соединений позволяет увеличить эффективность сенсорных систем данного типа. Разработанные биосенсоры на основе МОВ характеризуются аналитическими характеристиками, не уступающими известным биосенсорам, и имеют ряд преимуществ. Платформа на основе контроля взаимодействия биотин–авидин на функционализированной внутренней поверхности МОВ [81] может быть применена для разработки биосенсоров на основе различных пар рецептор–мишень, таких как клетки, белки клеточной поверхности, ферменты, антитела и олигонуклеотиды. В ряде работ предложены МОВ-сенсоры для определения последовательностей ДНК [82–84, 86, 94, 95]. Интерферометр Саньяка на основе МОВ использован для специфического определения гибридизации одноцепоцечной ДНК с высокой чувствительностью [82]. Модификация поверхности МОВ карбоксилированным оксидом графена, способным к π–π-взаимодействию с молекулами ДНК, позволила работать в широком диапазоне pH (4.3–8.5), что перспективно для in situ определения одноцепочечных ДНК в организме человека [83]. Модификация МОВ с брегговской решеткой пептидо-нуклеиновой кислотой в сочетании с ППР на покрытых стрептавидином наночастицах золота положена в основу высокоселективного метода определения геномной ДНК в присутствии значительного избытка (до 99%) нецелевых молекул ДНК без использования реакции амплификации [86]. Иммуносенсор на основе ППР в ФКВ ТС, модифицированном протеином А, предложен для обнаружения человеческого IgG [88]. Показано, что дополнительная модификация волокна оксидом графена позволяет усилить эффективность ППР слоя золота в ФКВ и увеличить чувствительность определения, а также снизить предел обнаружения в 30 раз [88]. Сравнение характеристик ряда сенсоров на примере определения фосфорорганического инсектицида паратион-метила показало высокую конкурентоспособность оптоволоконных сенсоров на основе МОВ со структурой интерферометра Маха-Цендера, характеризующихся низкими пределами обнаружения, низкой себестоимостью, простотой использования и портативностью [85]. Следует отметить работы, направленные на поиск путей снижения сложности процессов изготовления биосенсоров на основе МОВ, существенно ограничивающей область их применения [94, 95].
Возможность усиления люминесцентного и ГКР-сигнала показывает перспективность применения МОВ как высокочувствительного сенсорного инструмента при решении задач клинической диагностики и профилактики заболеваний человека. На примере иммуноферментного анализа на основе неконкурентного сэндвич-метода показана возможность 8-кратного усиления интенсивности флуоресцентной метки антивидовых антител в МОВ со структурой Фабри-Перо резонатора [89]. МОВ различных типов могут применяться для ГКР-сенсорного определения как немеченных [90], так и меченых биомолекул [91, 92]. Использование МОВ ПС позволило существенно (в ~2700 раз) усилить сигнал ГКР лейкозных клеток на наночастицах серебра и предложить подход к разработке надежной, быстрой и портативной платформы, не требующей использования антител для их обнаружения [90]. Усиление ГКР-сигнала наночастиц золота в МОВ ТС позволило обнаруживать и количественно определять среднее содержание специфического биомаркера (сиаловой кислоты, связанной с 4-(дигидроксиборофенил)ацетиленом) на единичной раковой клетке [91] и контролировать модификацию белков при пероксидном окислении липидов [92]. Существенным достоинством предложенных подходов является отсутствие сложной процедуры пробоподготовки исследуемых образцов.
Поликапиллярные системы в хроматографии и системах разделения. Идея перспективности использования массива капилляров меньшей длины вместо одной капиллярной колонки в газовой хроматографии (ГХ) была впервые высказана М. Голаем и впоследствии развита А. Яником в конце 70-х годов 20 века; в 2001 г. появилась первая работа по использованию поликапилляров (ПК) в хроматографии [96]. Отдельно следует упомянуть значимость и приоритет работ российских исследователей в развитии ГХ с использованием ПК [97]. История создания и развития отечественных поликапиллярных хроматографических колонок и хроматографов на их основе подробное рассмотрена в работах [98–100].
Поликапилляры, используемые в хроматографии, представляют собой массив открытых идентичных капиллярных колонок, удерживаемых вместе [101, 102]. Наиболее изученными являются поликапиллярные хроматографические колонки из неорганических полимеров, что обусловлено их более высокими механической стабильностью и устойчивостью к набуханию или усадке в среде неводных растворителей по сравнению с колонками из органических полимеров [103]. Следует отметить, что изготовление поликапиллярных колонок на основе неорганических стекол – более сложный процесс, требующий бóльших затрат времени по сравнению с подготовкой аналогичных колонок на основе органических полимеров [103]. В общем случае разработка хроматографических колонок на основе ПК основана на возможности формирования различных типов стационарных фаз внутри капилляров. В зависимости от структуры капилляров применяют различные технологии нанесения покрытия. Например, статические или динамические методы нанесения покрытий для круглых капиллярных колонок невозможно использовать для прямоугольных колонок [104]. В настоящее время поликапиллярные хроматографические колонки нашли применение в портативных газовых хроматографах, например, для определения следовых количеств взрывчатых веществ [105, 106].
В жидкостной хроматографии (ЖХ) используют открытые трубчатые капилляры [107], в которых слой стационарной фазы на поверхности может быть сформирован за счет физической адсорбции или образования ковалентных связей. Это дает возможность осуществлять последующую прививку или рост слоя стационарной фазы [108]. При этом в случае открытых капиллярных систем с пористым слоем поверхность модифицируют слоем пористого полимера с применением in situ полимеризации в поликапиллярных колонках, инициируемой фотооблучением или термическим способом, а также нанесением заранее синтезированных полимерных структур [109]. Одним из возможных направлений совершенствования качества хроматографических колонок на основе ПК является синтез в них монолитных структур, непосредственно нанесенных на стенки капилляров [110–112]. В этом случае хроматографические ПК-колонки являются стационарными фазами, скорость разделения в которых в 5–10 раз выше, чем в колонках, заполненных дисперсными средами [110]. К их преимуществам относятся высокая удельная площадь поверхности; пониженное сопротивление массопереноса, позволяющее достигать более высоких скоростей разделения и отделять такие большие молекулы, как белки и нуклеиновые кислоты с высокой скоростью за небольшой промежуток времени [113]. Преимущества и недостатки подобных систем подробно обсуждаются в работах [112, 114]. В то же время до сих пор в ЖХ поликапиллярные хроматографические колонки использовали лишь в немногочисленных экспериментальных работах. Основной проблемой в работе с ПК в ЖХ – вероятноять неравномерного распределения диаметров капилляров по длине колонки. Массивы капилляров для обеспечения возможности конкуренции с насадочными колонками должны иметь отклонения диаметра не более 0.5% от среднего значения. Существенные отклонения скорости потока для каждого канала способствуют уширению хроматографических пиков. В настоящее время использование оптимизированного процесса вытягивания ПК методом “stack-and-draw” рассматривается как один из путей минимизации подобных отклонений [101].
Таким образом, ПК имеют все шансы занять свою нишу в развитии экспресс-методов ГХ. В то же время развитие подходов к применению ПК в ЖХ связано с определенными трудностями, связанными с получением индивидуальных капилляров микронного размера и с разработкой новых, в первую очередь, монолитных стационарных фаз.
К числу редких, но имеющих большой потенциал направлений, можно отнести использование ПК в качестве подложки для создания высокоэффективных экстракторов биополимеров с использованием разнообразных активных слоев, иммобилизованных на внутреннюю поверхность ПС.
В работе [115] представлен рентгенофлуоресцентный анализатор с системой концентрирования на основе ПС с помещенным внутрь капилляров селективным сорбентом ДЭТАТА. Показана эффективность такого подхода при анализе многокомпонентных растворов, содержащих Cu, Ni, Zn, Fe, Mn.
Описан [18] метод эффективной экстракции нуклеиновых кислот, белков и пептидов с использованием моно- и полислоeв полианилина, синтезированных на внутренней поверхности стеклянных ПК. Метод позволяет существенно ускорить процесс выделения ДНК (10 мин по сравнению с 2–3 ч в стандартном методе экстракции) и повысить количественный выход ДНК и чистоту продукта. Подобный подход в сочетании с молекулярным импринтингом применен [116] для определения пероксидазы хрена. Полученные данные позволяют рассматривать ПС в качестве перспективной платформы для синтеза 2D молекулярно импринтированных полимеров.
Поликапиллярная оптика. Одной из важных областей применения ПС является рентгеновская оптика – научное направление, созданное на основе открытий М.А. Кумахова [117–120], предложившего использовать особым образом организованные поликапиллярные структуры для управления потоком рентгеновского излучения. Рентгеновские линзы Кумахова позволяют существенно расширить возможности современных аналитических методов. Выгодными отличиями оптики Кумахова являются большой угол захвата излучения от источника излучения, возможность управления площадью сфокусированного излучения в диапазоне от единиц до сотен микрометров, возможность получения широких параллельных пучков и т.д. [121]. В результате использования линз Кумахова плотность потока рентгеновского излучения можно увеличить в сотни раз, соответственно снизив мощность источника на 2–3 порядка до величин единиц ватт.
Использование поликапиллярной оптики имеет большое значение для развития аналитических методов [5]. На основе линз и полулинз Кумахова созданы различные приборы, в частности, разнообразные рентгенофлуоресцентные спектрометры и прецизионные рентгеновские дифрактометры, использующие метод параллельного пучка Дебая-Шеррера [121–123].
Поликапиллярные оптические элементы и их использование в аналитических целях постоянно совершенствуются. Описано [124] увеличение интенсивности сигнала более чем в 5 раз при использовании поликапиллярной фокусирующей линзы по сравнению с конической монокапиллярной рентгеновской линзой в рентгенофлуоресцентном спектрометре. Показана [125] эффективность использования поляризационной схемы на основе поликапиллярной оптики и алмазного кристаллического поляризатора. Предложенный подход эффективен для подавления фона рассеянного излучения при измерении спектров рентгеновской флуоресценции. В работе [126] предложена новая схема измерения с высоким энергетическим разрешением. Коэффициент усиления рентгеновского излучения при использовании поликапиллярной линзы в диапазоне энергий 0.5–5.5 кэВ составил от 1.5 до 3.0.
Предложенная установка позволяет обнаруживать кислород с энергией 0.525 кэВ. Аналитические характеристики экспериментальной установки “Радужный рентген” (RXR) подробно обсуждаются в работе [127]. В установке использованы поликапиллярные линзы в конфокальной геометрии, что позволяет исследовать образцы размером от нескольких миллиметров до полуметра и массой до нескольких десятков килограммов. Основным преимуществом предложенной установки является система детектирования с двумя спектрометрами для раздельной работы при высоких и низких энергиях рентгеновского излучения. Конфокальная геометрия в сочетании с 3-осевой системой точного позиционирования делает возможным получение элементарных 3D томографических данных. Успешное использование аналогичного подхода в анализе археологических объектов описано в работе [128], при этом применение поликапиллярной оптики как в источнике, так и в детекторе позволило улучшить отношение сигнал/шум, что крайне важно для количественного анализа. Предложенная установка для 2D/3D рентгеновской микровизуализации использует два детектора в диапазоне от 800 эВ до 25 кэВ, работающих в конфокальном режиме с источником, соединенным с поликапиллярной линзой.
В работе [129] описан прототип системы визуализации флуоресцентной рентгеновской томографии с использованием поликапиллярной фокусирующей оптики. Схема обеспечивает высокую плотность потока при размере фокусного пятна 2.6 мм на расстоянии от источника до изоцентра 3 см, что более чем в 10 раз выше по сравнению со схемами с традиционной коллимацией, при этом значительно сокращается время интегрирования сигнала.
Возможно проведение прямого рентгенофлуоресцентного микроанализа с предварительным концентрированием пробы на сорбенте с использованием поликапиллярной рентгеновской оптики [130]. Авторами достигнуты высокие аналитические характеристики на примере сорбентов ДЭТАТА и SAC8 в модельных растворах, содержащих Mn, Fe, Co, Ni, Cu и Zn, при концентрациях выше 0.2 мг/л.
Для повышения точности анализа наноразмерных материалов предложен энергодисперсионный спектрометр со сверхпроводящим датчиком перехода края (TES), установленным на сканирующем просвечивающем электронном микроскопе [131]. Вследствие значительных геометрических размеров TES-датчиков и наличия магнитного поля, создаваемого линзой микроскопа, авторы используют поликапиллярную оптику для сбора и передачи рентгеновского излучения на детектор.
Большое разнообразие задач, которые могут быть решены с использованием рентгеновской оптики и постоянное совершенствование технологии производства поликапиллярных оптических элементов позволяют надеяться на успешное развитие данной области.
* * *
Таким образом, за последние пять лет существенно расширены области применения поликапиллярных систем при решении задач аналитической химии. Достижения в области производства ПС различных типов из неорганических и органических полимеров, накопленные теоретические и экспериментальные знания о влиянии структуры ПС на их оптические свойства, предложенные подходы к интеграции ПС-элементов в сенсорные и хроматографические устройства, а также в рентгеновские анализаторы различных типов позволили реализовать высокоэффективные аналитические системы. Интеграция известных подходов к модификации и функционализации поверхности ПС обеспечила существенное снижение пределов обнаружения и повышение чувствительности хемо- и биосенсорных определений широкого круга соединений. Значительная удельная площадь поверхности разделительных и сенсорных элементов открывает возможность увеличения интенсивности аналитического отклика и эффективности разделения. Возможность создания малоинвазивных инструментов пробоотбора и значительного снижения объeма анализируемых проб является важным преимуществом при использовании ПС при исследовании биосистем, в том числе в клинической практике.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-29-08033).
Список литературы
Fateev V.N., Alexeeva O.K., Korobtsev S.V., Seregina E.A., Fateeva T.V., Grigorev A.S., Aliyev A.S. Problems of accumulation and storage of hydrogen // Chemical Problems. 2018. № 4. P. 453.
Chung K.M., Dong L., Lu C., Tam H.Y. Novel fiber Bragg grating fabrication system for long gratings with independent apodization and with local phase and wavelength control // Opt. Express. 2011. V. 19. P. 12 664.
Arjmand M., Talebzadeh R. Optical filter based on photonic crystal resonant cavity // Optoelectron. Adv. Mater. Rapid Commun. 2015. V. 9. P. 32.
Fasihi K. High-contrast all-optical controllable switching and routing in nonlinear photonic crystals // J. Light. Technol. 2014. V. 32. P. 3126.
Золотов Ю.А. Рентгеновская оптика М.А. Кумахова // Журн. аналит. химии. 2008. Т. 63. № 3. С. 229.
Currivan S., Upadhyay N., Paull B. Multi-channel capillaries and photonic crystal fibres for separation sciences // Trends Anal. Chem. 2018. V. 102. P. 322.
Pidenko S.A., Burmistrova N.A., Shuvalov A.A., Chibrova A.A., Skibina Y.S., Goryacheva I.Y. Microstructured optical fiber-based luminescent biosensing: Is there any light at the end of the tunnel? – A review // Anal. Chim. Acta. 2018. V. 1019. P. 14.
Скибина Ю.С., Тучин В.В., Белоглазов В.И., Штайн-майер Г., Бетге Й.Л., Веделль Р., Лангхофф Н. Фотонно-кристаллические волноводы в биомедицинских исследованиях // Квантовая электроника. 2011. Т. 41. № 4. С. 284.
Villatoro J., Zubia J. New perspectives in photonic crystal fibre sensors // Opt. Laser Technol. 2016. V. 78. P. 67.
Pinto A.M.R., Lopez-Amo M. Photonic crystal fibers for sensing applications // J. Sensors. 2012. V. 2012. ID 598 178.
Fan X., White I.M. Optofluidic microsystems for chemical and biological analysis // Nat. Photonics. 2011. V. 5. № 10. P. 591.
http://www.nktphotonics.com (08.12.2020).
https://nano-glass.ru/ (08.12.2020).
https://www.photonics-bretagne.com/ (08.12.2020).
Broadway C., Min R., Leal-Junior A.G., Marques C., Caucheteur C. Toward commercial polymer fiber bragg grating sensors: Review and applications // J. Light. Technol. 2019. V. 37. P. 2605.
Calcerrada M., García-Ruiz C., González-Herráez M. Chemical and biochemical sensing applications of microstructured optical fiber-based systems // Laser Photonics Rev. 2015. V. 9. № 6. P. 604.
Talataisong W., Ismaeel R., Beresna M., Brambilla G. Suspended-core microstructured polymer optical fibers and potential applications in sensing // Sensors. 2019. V. 19. № 16. P. 3449.
Скибина Ю.С., Белоглазов В.И., Тучин В.В., Капустин Д.В., Простякова А.И. Многоканальный наконечник для экстракции нуклеиновых кислот, белков и пептидов. Патент на изобретение RU 2547597 C1. Заявка № 2013143783/10 от 27.09.2013, опубл. 10.04.2015.
Knight J.C., Birks T.A., Russell P.S.J., Atkin D.M. All-silica single-mode optical fiber with photonic crystal cladding // Opt. Lett. 1996. V. 21. № 19. P. 1547.
Russell P. Photonic crystal fibers // Science. 2003. Vol. 299. № 5605. P. 358-362.
Russell P.S.J. Photonic-crystal fibers // J. Light. Technol. 2006. V. 24. № 12. P. 4729.
Lægsgaard J., Bjarklev A. Microstructured optical fibers – Fundamentals and applications // J. Am. Ceram. Soc. 2006. V. 89. № 1. P. 2.
Bravo M., Pinto A.M.R., Lopez-Amo M., Kobelke J., Schuster K. High precision micro-displacement fiber sensor through a suspended-core Sagnac interferometer // Opt. Lett. 2012. V. 37. № 2. P. 202.
Petersen C.R., Møller U., Kubat I., Zhou B., Dupont S., Ramsay J., Benson T., Sujecki S., Abdel-Moneim N., Tang Z., Furniss D., Seddon A., Bang O. Mid-infrared supercontinuum covering the 1.4–13.3 μm molecular fingerprint region using ultra-high NA chalcogenide step-index fibre // Nature Photon. 2014. V. 8. P. 830.
Vienne G., Xu Y., Jakobsen C., Deyerl H.-J., Jensen J.B., Sørensen T., Hansen T.P., Huang Y., Terrel M., Lee R.K., Mortensen N.A., Broeng J., Simonsen H., Bjarklev A., Yariv A. Ultra-large bandwidth hollow-core guiding in all-silica Bragg fibers with nano-supports // Opt. Express. 2004. V. 12. P. 3500.
Cerqueira S., Jr., Luan F., Cordeiro C.M.B., George F.K., Knight J.C. Hybrid photonic crystal fiber // Opt. Express. 2006. V. 14. P. 926.
Bjarklev A., Broeng J., Bjarklev A. Fabrication of photonic crystal fibres / Photonic Crystal Fibres. Boston, MA: Springer, 2003. P. 115.
Zhang P. Zhang J., Yang P., Dai S., Wang X., Zhang W. Fabrication of chalcogenide glass photonic crystal fibers with mechanical drilling // Opt. Fiber Technol. 2015. V. 26. P. 176.
Becker M., Werner M., Fitzau O., Esser D., Kobelke J., Loren, A., Schwuchow A., Rothhardt M., Schuster K., Hoffmann D., Bartelt H. Laser-drilled free-form silica fiber performs for microstructured optical fibers // Opt. Fiber Technol. 2013. V. 19. № 5. P. 482.
Ebendorff-Heidepriem H., Monro T.M. Analysis of glass flow during extrusion of optical fiber preforms // Opt. Mater. Express. 2012. V. 2. № 3. P. 304.
El Hamzaoui H., Bigot L., Bouwmans G., Razdobreev I., Bouazaoui M., Capoen B. From molecular precursors in solution to microstructured optical fiber: A sol−gel polymeric route // Opt. Mater. Express. 2011. V. 1. № 2. P. 234.
Coulombier Q., Brilland L., Houizot P., Nguyen T. N., Chartier T., Renversez G., Monteville A., Fatome J., Smektala F., Pain T., Orain H., Sangleboeuf J.-C., Trolès J. Fabrication of low losses chalcogenide photonic crystal fibers by molding process // Proc. SPIE. Optical Components and Materials VII. 2010. V. 7598. P. 75980O.
Van Eijkelenborg M.A., Argyros A., Barton G., Bassett I.M., Fellew M., Henry G., Issa N.A., Large M.C.J., Manos S., Padden W., Poladian L., Zagari J. Recent progress in microstructured polymer optical fibre fabrication and characterization // Opt. Fiber Technol. 2003. V. 9. № 4. P. 199.
Zubia J., Arrue J. Plastic Optical fibers: An introduction to their technological processes and applications // Opt. Fiber Technol. 2001. V. 7. P. 101.
Fasano A., Woyessa G., Stajanca P., Markos C., Stefani A., Nielsen K., Rasmussen H.K., Krebber K., Bang O. Fabrication and characterization of polycarbonate microstructured polymer optical fibers for high-temperature-resistant fiber Bragg grating strain sensors // Opt. Mater. Express. 2016. V. 6. P. 649.
Beloglazov V.I., Skibina N.B., Chainikov M.V., Langhoff N., Bjeoumikhov A., Bjeoumikhova Z., Tuchin V.V., Skibina Yu.S., Wedel R. Technology of manufacturing policapillary optics for X-ray engineering // J. X-Ray Sci. Technol. 2005. V. 13. № 4. P. 178.
Islam M., Ali M.M., Lai M.H., Lim K.S., Ahmad H. Chronology of Fabry-Perot interferometer fiber-optic sensors and their applications: A review // Sensors. 2014. V. 14. № 4. P. 7451.
Warren-Smith S.C., Schartner E.P., Nguyen L.V., Otten D.E., Yu Z., Lancaster D.G., Ebendorff-Heidepriem H. Microstructured optical fiber high-temperature sensors / Applied Industrial Optics: Spectroscopy, Imaging and Metrology. Optical Society of America, 2019. P. T3A-2.
Liu X., Jiang M., Sui Q., Geng X. Optical fibre Fabry–Perot relative humidity sensor based on HCPCF and chitosan film // J. Mod. Opt. 2016. V. 63. № 17. P. 1668.
Yang X., Zhao Q., Qi X., Long Q., Yu W., Yuan L. In-fiber integrated gas pressure sensor based on a hollow optical fiber with two cores // Sens. Actuators A: Phys. 2018. V. 272. P. 23.
Zhao Y., Li X. G., Cai L., Yang Y. Refractive index sensing based on photonic crystal fiber interferometer structure with up-tapered joints // Sens. Actuators B: Chem. 2015. V. 221. P. 406.
Martan T., Nemecek T., Komanec M., Ahmad R., Zvanovec S. Refractometric detection of liquids using tapered optical fiber and suspended core microstructured fiber: a comparison of methods // Appl. Opt. 2017. V. 56. № 9. P. 2388.
Chen C., Wu W., Wang J. All-fiber microfluidic multimode Mach–Zehnder interferometers as high sensitivity refractive index sensors // Microsyst. Technol. 2017. V. 23. P. 429.
An G., Li S., An Y., Wang H., Zhang X. Glucose sensor realized with photonic crystal fiber-based Sagnac interferometer // Opt. Commun. 2017. V. 405. P. 143.
Wang X.D., Wolfbeis O.S. Fiber-optic chemical sensors and biosensors (2015–2019) // Anal. Chem. 2019. V. 92. № 1. P. 397.
Rifat A.A., Ahmed K., Asaduzzaman S., Paul B.K., Ahmed R. Development of photonic crystal fiber-based gas/chemical sensors / Computational Photonic Sensors. Cham, Switzerland: Springer, 2019. P. 287.
Asaduzzaman S., Ahmed K. Proposal of a gas sensor with high sensitivity, birefringence and nonlinearity for air pollution monitoring // Sens. Bio-Sens. Res. 2016. V. 10. P. 20.
Lopez-Torres D., Elosua C., Arregui F.J. Optical fiber sensors based on microstructured optical fibers to detect gases and volatile organic compounds – A review // Sensors. 2020. V. 20. № 9. P. 2555.
Jin W., Cao Y., Yang F., Ho H.L. Ultra-sensitive all-fibre photothermal spectroscopy with large dynamic range // Nat. Commun. 2015. V. 6. № 1. P. 1.
Zhang H., Duan L., Shi W., Sheng Q., Lu Y., Yao J. Dual-point automatic switching intracavity-absorption photonic crystal fiber gas sensor based on mode competition // Sens. Actuators B: Chem. 2017. V. 247. P. 124.
He Q., Dang P., Liu Z., Zheng C., Wang Y. TDLAS–WMS based near-infrared methane sensor system using hollow-core photonic crystal fiber as gas-chamber // Optical and Quantum Electronics. 2017. V. 49. № 3. P. 115.
Yang J., Che X., Shen R., Wang C., Li X., Chen W. High-sensitivity photonic crystal fiber long-period grating methane sensor with cryptophane-A-6Me absorbed on a PAA-CNTs/PAH nanofilm // Opt. Express. 2017. V. 25. № 17. P. 20258.
Yang J., Zhou L., Che X., Huang J., Li X., Chen W. Photonic crystal fiber methane sensor based on modal interference with an ultraviolet curable fluoro-siloxane nano-film incorporating cryptophane A // Sens. Actuators B: Chem. 2016. V. 235. P. 717.
Shrivastav A.M., Sharma G., Rathore A.S., Jha R. Hypersensitive and selective interferometric nose for ultratrace ammonia detection with fast response utilizing PANI@ SnO2 nanocomposite // ACS Photonics. 2018. V. 5. № 11. P. 4402.
Feng X., Feng W., Tao C., Deng D., Qin X., Chen R. Hydrogen sulfide gas sensor based on graphene-coated tapered photonic crystal fiber interferometer // Sens. Actuators B: Chem. 2017. V. 247. P. 540.
Wang J., Yang J., Zou D., Yang J., Qiao G., Wang H., Wang R. Tailor-made photonic crystal fiber sensor for the selective detection of formaldehyde and benzene // Opt. Fiber Technol. 2019. V. 52. P. 101941.
Liu H., Wang M., Wang Q., Li H., Ding Y., Zhu C. Simultaneous measurement of hydrogen and methane based on PCF-SPR structure with compound film-coated side-holes // Opt. Fiber Technol. 2018. V. 45. P. 1.
Arasu P.T., Noor A.S.M., Shabaneh A.A., Yaacob M.H., Lim H.N., Mahdi M.A. Fiber Bragg grating assisted surface plasmon resonance sensor with graphene oxide sensing layer // Opt. Commun. 2016. V. 380. P. 260.
Yang X.C., Lu Y., Wang M.T., Yao J.Q. A photonic crystal fiber glucose sensor filled with silver nanowires // Opt. Commun. 2016. V. 359. P. 279.
Burmistrova N.A., Pidenko P.S. Pidenko S.A., Skibina Y.S., Monakhova Y.B. Simultaneous determination of proteins in microstructured optical fibers supported by chemometric tools // Anal. Bioanal. Chem. 2019. V. 411. P. 7055.
Yan D., Popp J., Pletz M.W., Frosch T. Highly sensitive broadband Raman sensing of antibiotics in step-index hollow-core photonic crystal fibers // ACS Photonics. 2017. V. 4. № 1. P. 138.
Khetani A., Momenpour A., Alarcon E.I., Anis H. Hollow core photonic crystal fiber for monitoring leukemia cells using surface enhanced Raman scattering (SERS) // Biomed. Opt. Express. 2015. V. 6. № 11. P. 4599.
Gong T., Cui Y., Goh D., Voon K.K., Shum P.P., Humbert G., Auguste J.-L., Dinh X-Q., Yong K.-T., Olivo M. Highly sensitive SERS detection and quantification of sialic acid on single cell using photonic-crystal fiber with gold nanoparticles // Biosens. Bioelectron. 2015. V. 64. P. 227.
Ding L., Li Z., Ding Q., Shen X., Yuan Y., Huang J. Microstructured optical fiber based chloride ion sensing method for concrete health monitoring // Sens. Actuators B: Chem. 2018. V. 260. P. 763.
Heng S., Nguyen M.-C., Kostecki R., Monro T.M., Abell A.D. Nanoliter-scale, regenerable ion sensor: sensing with a surface functionalized microstructured optical fibre // RSC Advances. 2013. V. 3. № 22. P. 8308.
Heng S., McDevitt C.A., Kostecki R., Morey J.R., Eijkelkamp B.A., Ebendorff-Heidepriem H., Monro T., Abell A.D. Microstructured optical fiber-based biosensors: Reversible and nanoliter-scale measurement of zinc ions // ACS Appl. Mater. Interfaces. 2016. V. 8. № 20. P. 12 727.
Bachhuka A., Heng S., Vasilev K., Kostecki R., Abell A., Ebendorff-Heidepriem H. Surface functionalization of exposed core glass optical fiber for metal ion sensing // Sensors. 2019. V. 19. P. 1829.
Ding L., Ruan Y., Li T., Huang J., Warren-Smith S.C., Ebendorff-Heidepriem H., Monro T.M. Nitric oxide optical fiber sensor based on exposed core fibers and CdTe/CdS quantum dots // Sens. Actuators B: Chem. 2018. V. 273. P. 9.
Yang J., Shen R., Yan P., Liu Y., Li X., Zhang P., Chen W. Fluorescence sensor for volatile trace explosives based on a hollow core photonic crystal fiber // Sens. Actuators B: Chem. 2020. V. 306. P. 127585.
Shukla S.K., Kushwaha C.S., Guner T., Demir M.M. Chemically modified optical fibers in advanced technology: An overview // Opt. Laser Technol. 2019. V. 115. P. 404.
Pawar D., Kale S.N. A review on nanomaterial-modified optical fiber sensors for gases, vapors and ions // Microchim. Acta. 2019. V. 186. № 4. P. 253.
Hu D.J.J., Ho H.P. Recent advances in plasmonic photonic crystal fibers: design, fabrication and applications // Adv. Opt. Photonics. 2017. V. 9. № 2. P. 257.
Zhao Y., Deng Z.Q., Li J. Photonic crystal fiber based surface plasmon resonance chemical sensors // Sens. Actuators B: Chem. 2014. V. 202. P. 557.
Rifat A.A., Ahmed R., Yetisen A.K., Butt H., Sabouri A., Mahdiraji G. A., Yun S.H., Adikan F.M. Photonic crystal fiber based plasmonic sensors // Sens. Actuators B: Chem. 2017. V. 243. P. 311.
Dinish U.S., Beffara F., Humbert G., Auguste J.L., Olivo M. SERS-active photonic crystal fiber probe: Towards next generation liquid biopsy sensor with ultra high sensitivity // J. Biophotonics. 2019. P. e201900027.
Markin A.V., Markina N.E., Goryacheva I.Y. Raman spectroscopy based analysis inside photonic-crystal fibers // Trends Anal. Chem. 2017. V. 201788. P. 185.
Ermatov T., Skibina J.S., Tuchin V.V., Gorin D.A. Functionalized microstructured optical fibers: Materials, methods, applications // Materials. 2020. V. 13. № 4. P. 921.
Calcerrada M., Cunningham B.T., Zhang M., Zhuo Y., Kwon L., Race C. Recent advances in biosensing with photonic crystal surfaces: A review // IEEE Sens. J. 2016. V. 16. P. 3349.
Chibrova A.A., Shuvalov A.A., Skibina Y.S., Pidenko P.S., Pidenko S.A., Burmistrova N.A., Goryacheva I. The red shift of the semiconductor quantum dots luminescence maximum in the hollow core photonic crystal fibers // Opt. Mater. 2017. V. 73. P. 423.
Schartner E.P., Tsiminis G., Henderson M.R., Warren-Smith S.C., Monro T.M. Quantification of the fluorescence sensing performance of microstructured optical fibers compared to multi-mode fiber tips // Opt. Express. 2016. V. 24. P. 18541.
Li X., Nguyen L.V., Zhao Y., Ebendorff-Heidepriem H., Warren-Smith S.C. High-sensitivity Sagnac-interferometer biosensor based on exposed core microstructured optical fiber // Sens. Actuators B: Chem. 2018. V. 269. P. 103.
Gao S., Sun L. P., Li J., Jin L., Ran Y., Huang Y., Guan B.O. High-sensitivity DNA biosensor based on microfiber Sagnac interferometer // Opt. Express. 2017. V. 25. № 12. P. 13305.
Huang Y., Yu B., Guo T., Guan B.O. Ultrasensitive and in situ DNA detection in various pH environments based on a microfiber with a graphene oxide linking layer // RSC Advances 2017. V. 7. № 22. P. 13177.
Moreira L., Pereira L., Jorge P., Gouveia C., Martins-Lopes P., Fernandes J.R. Biosensor for label-free DNA quantification based on functionalized LPGs // Biosens. Bioelectron. 2016. V. 84. P. 30.
Arjmand M., Saghafifar H., Alijanianzadeh M., Soltanolkotabi M. A sensitive tapered-fiber optic biosensor for the label-free detection of organophosphate pesticides // Sens. Actuators B: Chem. 2017. V. 249. P. 523.
Bertucci A., Manicardi A., Candiani A., Giannetti S., Cucinotta A., Spoto G., Konstantaki M., Pissadakis S., Selleri S., Corradini R. Detection of unamplified genomic DNA by a PNA-based microstructured optical fiber (MOF) Bragg-grating optofluidic system // Biosens. Bioelectron. 2015. V. 63. P. 248.
Zhang Y., Wang F., Qian S., Liu Z., Wang Q., Gu Y., Wu Z., Jing Z., Sun C., Peng W. A novel fiber optic surface plasmon resonance biosensors with special boronic acid derivative to detect glycoprotein // Sensors. 2017. V. 17. P. 2259.
Wang Q., Wang B. Sensitivity enhanced SPR immunosensor based on graphene oxide and SPA co-modified photonic crystal fiber // Opt. Laser Technol. 2018. V. 107. P. 210.
Hsieh M.C., Chiu Y.H., Lin S.F., Chang J.Y., Chang C.O., Chiang H.K. Amplification of the signal intensity of fluorescence-based fiber-optic biosensors using a Fabry-Perot resonator structure // Sensors. 2015. V. 15. P. 3565.
Khetani A., Momenpour A., Alarcon E. I., Anis H. Hollow core photonic crystal fiber for monitoring leukemia cells using surface enhanced Raman scattering (SERS) // Biomed. Opt. Express // 2015. V. 6. P. 4599.
Gong T., Cui Y., Goh D., Voon K.K., Shum P.P., Humbert G., Auguste J.-L., Dinh X.-Q., Yong K.-T., Olivo M. Highly sensitive SERS detection and quantification of sialic acid on single cell using photonic-crystal fiber with gold nanoparticles // Biosens. Bioelectron. 2015. V. 64. P. 227.
Gong T., Zhang N., Kong K.V., Goh D., Ying C., Auguste J.L., Shum P.P., Wei L., Humbert G., Yong K.-T., Olivo M. Rapid SERS monitoring of lipid-peroxidation-derived protein modifications in cells using photonic crystal fiber sensor // J. Biophotonics. 2016. V. 9. P. 32.
Barozzi M., Manicardi A., Vannucci A., Candiani A., Sozzi M., Konstantaki M Pissadakis S., Corradini R., Selleri S., Cucinotta A. Optical fiber sensors for label-free DNA detection // J. Light. Technol. 2017. V. 35. № 16. P. 3461.
Sun D., Guo T., Guan B.-O. Label-free detection of DNA hybridization using a reflective microfiber bragg grating biosensor with self-assembly technique // J. Light. Technol. 2017. V. 35. P. 3354.
Sun Q., Luo H., Luo H., Lai M., Liu D., Zhang L. Multimode microfiber interferometer for dual-parameters sensing assisted by Fresnel reflection // Opt. Express. 2015. V. 23. P. 12777.
Mametov R., Ratiu, I. A., Monedeiro F., Ligor T., Buszewski B. Evolution and evaluation of GC columns // Crit. Rev. Anal. Chem. 2019. P. 1.
Łobiński R., Sidelnikov V., Patrushev Y., Rodriguez I., Wasik A. Multicapillary column gas chromatography with element-selective detection // Trends Anal. Chem. 1999. V. 18. P. 449.
Сидельников В.Н. Поликапиллярные колонки. от первых опытов до наших дней. Часть 1 // Лаборатория и производство. 2019. Т. 3. № 7. С. 114.
Сидельников В.Н. Поликапиллярные колонки: от первых опытов до наших дней. Часть 2 // Лаборатория и производство. 2019. Т. 4. № 8. С. 148.
Москвин Л.Н., Родинков О.В. От жидкостно-газовой хроматографии к хроматомембранному массообменному процессу // Журн. аналит. химии. 2019. Т. 74. № 10. С. 729.
Daley A.B., Wright R.D., Oleschuk R.D. Parallel, fluorous open-tubular chromatography using microstructured fibers // Anal. Chim. Acta. 2011. V. 690. P. 253.
Sidelnikov V.N., Patrushev Y.V., Belov Y.P. Sol-gel multicapillary columns for gas-solid chromatography // J. Chromatogr. A. 2006. V. 1101. P.315.
Knob R., Kulsing C., Boysen R.I., Macka M., Hearn M.T. Surface-area expansion with monolithic open tubular columns // Trends Anal. Chem. 2015. V. 67. P. 16.
Shakeel H., Agah M. Self-patterned gold-electroplated multicapillary gas separation columns with MPG stationary phases // J. Microelectromech. Syst. 2013. V. 22. № 1. P. 62.
Балдин М.Н., Грузнов В.М. Портативный газовый хроматограф с воздухом в качестве газа-носителя для определения следов взрывчатых веществ // Журн. аналит. химии. 2013. Т. 68. № 11. С. 1117.
Грузнов В.М., Балдин М.Н., Прямов М.В., Максимов Е.М. Определение концентрации паров взрывчатых веществ с дистанционным автоматизированным отбором проб при контроле объектов // Журн. аналит. химии. 2017. Т. 72. № 11. С. 1000.
Найда О.О., Руденко Б.А., Хамизов Р.Х., Кумахов М.А. Поликапиллярные (многоканальные) хроматографические колонки в жидкостной хроматографии // Журн. аналит. химии. 2009. Т. 64. № 7. С. 740.
Lam S.C., Rodriguez E.S., Haddad P.R., Paull B. Recent advances in open tubular capillary liquid chromatography // Analyst. 2019. V. 144. № 11. P. 3464.
Tarongoy F.M., Haddad P.R., Boysen R.I., Hearn M.T., Quirino J.P. Open tubular-capillary electrochromatography: Developments and applications from 2013 to 2015 // Electrophoresis. 2016. V. 37. № 1. P. 66.
Ladisch M., Zhang L. Fiber-based monolithic columns for liquid chromatography // Anal. Bioanal. Chem. 2016. V. 408. P. 6871.
Кучеренко Е.В., Канатьева А.Ю., Курганов А.А., Борисов Р.С., Пирогов А.В. Монолитные сорбенты с ковалентно связанной матрицей для тонкослойной хроматографии в сочетании с масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией // Сорбционные и хроматографические процессы. 2019. Т. 19. № 6. С. 645.
Ширяева В.Е., Попова Т.П., Королев А.А., Канатьева А.Ю., Курганов А.А. Стационарная фаза на основе сверхсшитого полистирола для капиллярной газовой хроматографии // Журн. физ. химии. 2020. Т. 94. № 9. С. 1405.
Svec F., Lv Y. Advances and recent trends in the field of monolithic columns for chromatography // Anal. Chem. 2015. V. 87. № 1. P. 250.
Патрушев Ю.В., Николаева О.А., Сидельников В.Н. Исследование нагрузки поликапилярных колонок для хроматографии // Журн. аналит. химии. 2010. Т. 65. № 11. С. 1155.
Хамизов Р.Х., Груздева А.Н., Токмачев М.Г., Цизин Г.И., Тихонов Н.А., Кумахов М.А. Высокочувствительный рентгенофлуоресцентный анализ растворов с использованием сорбционной накопительной микросистемы // Журн. аналит. химии. 2009. Т. 64. № 9. С. 939.
Pidenko P.S., Pidenko S.A., Skibina Y.S., Zacharevich A.M., Drozd D.D., Goryacheva I.Y., Burmistrova N.A. Molecularly imprinted polyaniline for detection of horseradish peroxidase // Anal. Bioanal. Chem. 2020. V. 412. P. 6509.
Кумахов М.А. Способ изготовления поликапиллярной жесткой волоконно-оптической структуры или элемента и устройство для управления рентгеновским и другими видами излучения. Патент на изобретение RU 2096353. Заявка № 94006882/03 от 28.02.1994, опубл. 20.11.1997.
Kumakhov M.A. Capillary optics and their use in X-ray analysis // X-ray Spectrom. 2000. V. 29. P. 343.
Кумахов М.А. Устройство для формирования направленного пучка рентгеновского излучения. Патент на изобретение RU 2 348 996. Заявка № 2007134840/06 от 19.09.2007, опубл. 10.03.2009.
MacDonald C.A., Gibson W.M. Applications and advances in polycapillary optics // X-Ray Spectrom. 2003. V. 32. № 3. P. 258.
Болотоков А., Зайцев Д., Лютцау А., Щербаков А. Поликапиллярная оптика Кумахова и аналитические приборы на ее основе // Аналитика. 2012. № 4(5). С. 14.
Кумахов А.А., Болотоков А.А. Рентгеновские поликапиллярные линзы и их использование в материаловедении // Горный информационно-аналитический бюллетень (научно-технический журн.). 2014. № 10. С. 356.
Николаев В.И., Чижова Е.В. Развитие и перспективы трехмерного рентгенофлуоресцентного микроанализа (аналитический обзор) // Научное приборостроение. 2011. Т. 21. №. 2. С. 3.
Sun X., Zhang X., Wang Y., Shao S., Li Y., Peng S., Liu Z., Sun T. Performance of assembled X-ray optics consisted of a polycapillary X-ray optics and a monocapillary X-ray optics for micro X-ray fluorescence spectrometry // Spectrochim. Acta B. 2020. V. 165. P. 105 770.
Turyanskiy A.G., Gizha S.S., Senkov V.M., Stanishevskiy Y.M. The energy dispersive scheme of X-ray fluorescence analysis with a crystal polarizer and polycapillary optics // X-Ray Spectrom. 20017. V. 46. № 6. P. 548.
Käyhkö M., Laitinen M., Arstila K., Maasilta I.J., Sajavaara T. A new beamline for energy-dispersive high-resolution PIXE analysis using polycapillary optics // Nucl. Instrum. Meth. B. 2019. V. 447. P. 59.
Hampai D., Cherepennikov Y.M., Liedl A., Cappuccio G., Capitolo E., Iannarelli M., Azzuttia C., Gladkikhe Yu.P., Marcelli A., Dabagov S.B. Polycapillary based μXRF station for 3D colour tomography // J. Instrum. 2018. V. 13. P. C04024.
Guglielmotti V., Hampai D., Micheli L., Mazzuca C., Redi M., Gasbarri E., Dabagov S.B. Application of polycapillary optics to x-ray fluorescence for advanced spectroscopy and microscopy studies // Proc. SPIE. Advances in X-Ray. 2020. V. 11491. P. 114910D.
Vernekohl D., Ahmad M., Dai X., Zhao W., Cheng K., Xing L. Reduced acquisition time for L-shell X-ray fluorescence computed tomography using polycapillary X-ray optics // Medical Physics. 2019. V. 46. P. 5696.
Болотоков А.А., Груздева А.Н., Хамизов Р.Х., Кумахов М.А. О возможности рентгенофлуоресцентного микроанализа растворов с предварительным концентрированием // Журн. аналит. химии. 2014. Т. 69. № 8. С. 801.
Takano A., Maehata K., Iyomoto N., Hara T., Mitsuda K., Yamasaki N., Tanaka K. Characterization of polycapillary optics installed in an analytical electron microscope / JPS Conf. Proc. International Symposium on Radiation Detectors and Their Uses (ISRD2016). 2016. V. 11. P. 030003.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии