Журнал аналитической химии, 2021, T. 76, № 7, стр. 593-602
ТВЕРДОФАЗНО-ФЛУОРИМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ХИНОЛОНОВ НА ЦЕЛЛЮЛОЗНОЙ БУМАГЕ И В ТОНКОМ СЛОЕ СИЛИКАГЕЛЯ В ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ С ИСПОЛЬЗОВАНИЕМ СМАРТФОНА
В. Г. Амелин a, b, *, З. А. Ч. Шаока a, Д. С. Большаков b
a Владимирский государственный университет имени Александра Григорьевича
и Николая Григорьевича Столетовых
600000 Владимир, ул. Горького, 87, Россия
b Федеральный центр охраны здоровья животных
600901 Владимир, мкр. Юрьевец, Россия
* E-mail: amelinvg@mail.ru
Поступила в редакцию 20.01.2021
После доработки 25.01.2021
Принята к публикации 15.02.2021
Аннотация
Предложен простой и доступный способ определения антибиотиков хинолонового ряда с использованием цифровой цветометрии твердофазной флуоресценции. Изучены собственная флуоресценция 17 хинолонов и сенсибилизированная хинолонами флуоресценция европия на целлюлозной бумаге (ЦБ) и тонком слое силикагеля. При облучении ультрафиолетовым светом (365 нм) нанесенных на матрицу растворов хинолонов наблюдается синяя (ЦБ, высокоэффективная тонкослойная хроматография (ВЭТСХ)) и розовая (ЦБ–Eu, ВЭТСХ–Eu) флуоресценция. Измерение интенсивности флуоресценции на поверхности матриц осуществляли с помощью смартфона. В качестве аналитического сигнала (Ar) использовали значения цветометрических параметров в системе RGB: Ar = $\sqrt {{{{({{{\text{R}}}_{0}} - {{{\text{R}}}_{{\text{x}}}})}}^{2}} + {{{({{{\text{G}}}_{0}} - {{{\text{G}}}_{{\text{x}}}})}}^{2}} + {{{({{{\text{B}}}_{0}} - {{{\text{B}}}_{{\text{x}}}})}}^{2}}} .$ Пределы обнаружения и определения составили 0.2–4 и 0.6–12 мкг/мл соответственно для всех рассматриваемых аналитов. Диапазоны определяемых содержаний – 0.6–500 мкг/мл. Предложена методика определения фторхинолонов в лекарственных препаратах. Относительное стандартное отклонение результатов анализа не превышает 0.05.
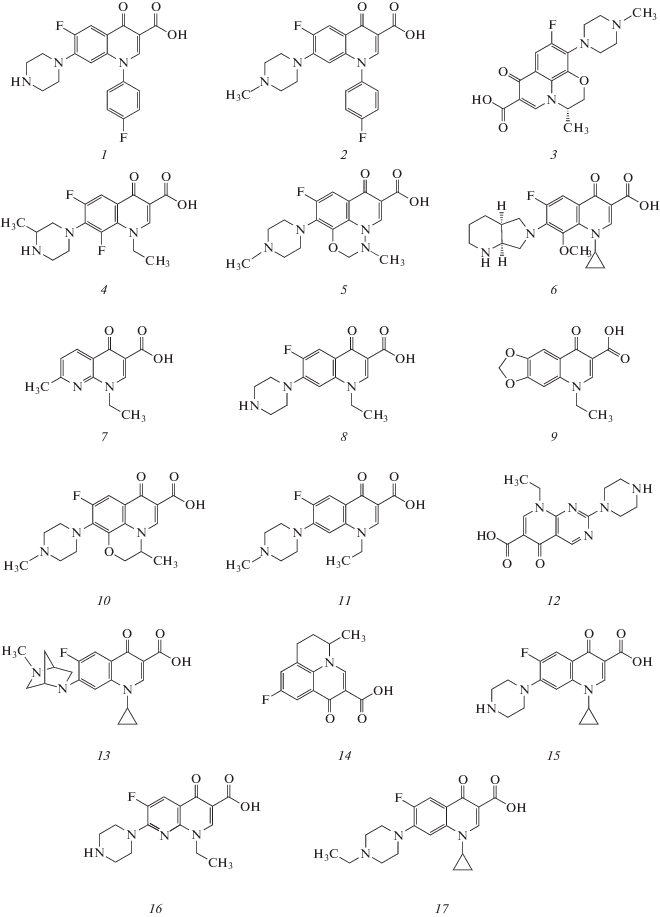
Хинолоны (рис. 1) – это антимикробные средства, которые отличаются мощным бактерицидным действием: они полностью блокируют активность ферментов болезнетворных микроорганизмов. У бактерий не обнаружены механизмы, которые могли бы инактивировать действие хинолонов, поэтому устойчивость к этой группе лекарств формируется гораздо медленнее. Все производные хинолона делятся на нефторированные препараты и фторхинолоны. Данные классы принципиально различаются по структуре, эффективности, а также показаниям к применению. Известно четыре поколения зарегистрированных в Российской Федерации антибактериальных производных хинолона. Основные представители I поколения хинолонов: налидиксовая, оксолиновая и пипемидовая кислоты. Фторхинолоны относят к II–IV поколениям [1].
Рис. 1.
Структурные формулы сарафлоксацина (1), дифлоксацина (2), левофлоксацина (3), ломефлоксацина (4), марбофлоксацина (5), моксифлоксацина (6), налидиксовой кислоты (7), норфлоксацина (8), оксолиновой кислоты (9), офлоксацина (10), пефлоксацина (11), пипемидовой кислоты (12), данофлоксацина (13), флумеквина (14), ципрофлоксацина (15), эноксацина (16), энрофлоксацина (17).
Для подтверждения качества готовых лекарственных препаратов и определения хинолонов в биологических жидкостях предложено использовать спектрофотометрические методы анализа. Так, определение энрофлоксацина и пефлоксацина основано на экстракции хлороформом их ионных пар с бромфеноловым синим и метиловым оранжевым [2]. Градуировочная характеристика линейна в диапазоне концентраций 2–18 мкг/мл с бромфеноловым синим и 1–40 мкг/мл с метиловым оранжевым. Методику применяли для анализа лекарственных препаратов “Энроксил” и “Пефлацин”. Предложена методика определения гатифлоксацина в фармацевтических субстанциях и лекарственных препаратах, основанная на экстракции хлороформом ионных пар гатифлоксацина с бромкрезоловым зеленым, бромкрезоловым пурпурным, бромфеноловым синим и бромтимоловым синим [3]. Закон Бера выполняется в диапазоне концентраций 2–16 мкг/мл.
Молекулы антибиотиков хинолонового ряда имеют плоское строение (рис. 1), они способны флуоресцировать при облучении УФ-светом, причем в мицеллах додецилсульфата интенсивность флуоресценции в 2–3 раза выше [4, 5]. Кроме того, хинолоны образуют комплексы с ионами металлов, в частности с европием(III), тербием(III), иттрием(III). В случае ионов лантаноидов это приводит к сенсибилизированной хинолонами флуоресценции [6–11]. Сенсибилизированная гареноксацином флуоресценция тербия используется для определения фторхинолона в моче и плазме крови в диапазоне концентраций 0.06–0.6 мкг/мл [6]. Проведение реакции в мицеллах додецилсульфата натрия приводит к повышению чувствительности определения гареноксацина в три раза и смещению длины волны флуоресценции с 421 до 546 нм (λвозб = 282 нм).
Быстрое определение гатифлоксацина в биологических жидкостях и лекарственных препаратах основано на сенсибилизированной флуоресценции европия в мицеллах додецилбензолсульфоната [7]. Длина волны возбуждения 338 нм, эмиссии – 617 нм. Предел обнаружения гатифлоксацина 1 пМ, диапазон определяемых содержаний составил 10–80 пМ. Для определения ципрофлоксацина и энрофлоксацина в таблетках и сыворотке крови использована сенсибилизированная флуоресценция европия в присутствии 1,10-фенантролина и мицелл додецилбензолсульфоната с пределом обнаружения фторхинолонов 0.23 мкМ [8].
В работе [9] рассмотрена твердофазная сенсибилизированная ципрофлоксацином и норфлоксацином флуоресценция тербия(III) на цеолите. Измерение флуоресценции при 545 нм (λвозб = = 365 нм) проводили после отделения сорбата и его высушивания. Предел обнаружения составил 1 мкг/мл при анализе мочи и плазмы крови. Для определения пипемидовой кислоты в моче и фармацевтической субстанции использовали сенсибилизированную флуоресценцию европия. В этанольном растворе предел обнаружения в фармацевтической субстанции составил 0.002 и 0.1 мкг/мл в моче [10].
В работе [11] предложена методика одновременного определения ципрофлоксацина и тетрациклина в образцах биологических жидкостей (сыворотки крови и мочи). Ионы лантаноидов иммобилизовали путем адсорбции на бумажных полосках, которые предварительно обрабатывали сахарозой для удаления воды. При определении ципрофлоксацина использовали сенсибилизированную флуоресценцию тербия (λфл = 545 нм, λвозб = 284 нм), для определения тетрациклина сенсибилизированную флуоресценцию европия (λфл = 615 нм, λвозб = 395 нм). Градуировочные зависимости линейны в диапазоне 0.03–1.5 мкг/мл для ципрофлоксацина и 0.03–2.5 мкг/мл для тетрациклина. Пределы обнаружения ципрофлоксацина и тетрациклина составили 9 и 11 нг/мл соответственно, степень извлечения аналитов из образцов биологических жидкостей 88–109%.
Сенсибилизированную гатифлоксацином флуоресценцию иттрия(III) использовали для определения фторхинолона в фармацевтических субстанциях и биологических жидкостях в диапазоне 0.04–1 мкг/мл с пределом обнаружения 0.003 мкг/мл [12].
В рассмотренных выше работах для регистрации аналитического сигнала использовали спектрофлуориметры, что не позволяет обеспечить экспресс-определение действующих веществ антибактериальных препаратов. Альтернативой является использование простых и доступных экспресс-методов анализа. Одним из направлений в данной области является цифровая цветометрия, которую все чаще используют для решения различных проблем аналитического контроля [13–15]. Данную группу методов отличают простота аппаратурного оформления, возможность использования в качестве цветорегистрирующих устройств цифровой фото-, видео- и оптической офисной техники. Значительный потенциал развития цветометрии обусловлен разработкой современных смартфонов и специализированного программного обеспечения [16, 17]. Достижения последних лет позволяют сделать лабораторные исследования более мобильными и экспрессными.
Цель данной работы состояла в разработке способа определения антибиотиков хинолонового ряда по их собственной флуоресценции и сенсибилизированной хинолонами флуоресценции европия на целлюлозной бумаге и в тонком слое силикагеля с использованием смартфона в качестве цветорегистрирующего устройства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура. Для изучения оптических и цветометрических характеристик в качестве цветорегистрирующего устройства использовали iPhone VI и iPhone X (Apple, США), оснащенный специализированным программным обеспечением “RG-Ber”. Возбуждение флуоресценции проводили с помощью источника монохроматического излучения с длиной волны 365 нм “Jialitte F114 5W 365NM UV” (Shenzhen Jialite Technology Co., Китай), детектора банкнот “Dors 60 SYS-033278/277” (DORS, Китай) и осветителя люминесцентного диагностического “Лампа Вуда ОЛДД-01” (Россия).
Применяли аналитические весы “Pioneer PA 214С” специального класса точности с пределом взвешивания 0.1 мг (Ohaus Corporation, USA), дозаторы “Proline Biohit” 1-канальные механические переменного объема 2–20, 100–1000, 1000–5000 мкл (Biohit, Финляндия), политетрафторэтиленовые мембранные фильтры 25 мм с диаметром пор 0.20 мкм (Pall Corporation, США), полистирольные планшеты для иммуноферментного анализа.
Материалы. Использовали целлюлозную бумагу (ЦБ) для хроматографии “Whatman 17 Chr” (Cytiva, США), пластины для высокоэффективной тонкослойной хроматографии (ВЭТСХ) “HPTLC Silica gel 60” (Merck, Германия).
Реактивы. В работе использовали стандартные образцы хинолонов (сарафлоксацина, дифлоксацина, левофлоксацина, ломефлоксацина, марбофлоксацина, моксифлоксацина, налидиксовой кислоты, норфлоксацина, оксолиновой кислоты, офлоксацина, пефлоксацина, пипемидовой кислоты, данофлоксацина, флумеквина, ципрофлоксацина, эноксацина, энрофлоксацина) (98–100%, Sigma-Aldrich, США). Исходные стандартные растворы (1 мг/мл) готовили растворением точной навески препаратов в метаноле. Рабочие растворы готовили разбавлением исходных деионизированной водой (15–18 МОм см, ОСТ 11 029.003-80).
Применяли метанол (Fisher Scientific UK, Великобритания), соляную кислоту х. ч. (АО “БСК”, Россия), тетраборат натрия (Sigma-Aldrich, США), 6-водный хлорид европия(III) EuCl3⋅6H2O (Sigma-Aldrich, США).
Подготовка матриц для сенсибилизированной флуоресценции европия (ЦБ–Eu, ВЭТСХ–Eu). Бумагу для хроматографии “Whatman 17 Chr” или пластину ВЭТСХ погружали в 0.001 М раствор хлорида европия на 1–2 мин, вынимали и сушили в потоке теплого воздуха с помощью тепловентилятора. После высыхания матрицу помещали в 0.2%-ный раствор тетрабората натрия на 1–2 мин и сушили.
Построение градуировочной зависимости. Использовали стандартные растворы хинолонов концентрацией 1 мг/мл, приготовленные растворением точных навесок в метаноле. Рабочие растворы c концентрациями 500, 250, 125, …1, 0 мкг/мл готовили последовательным разбавлением исходного раствора деионизированной водой в полистирольном планшете для иммуноферментного анализа. Полученные таким образом растворы объемом 5 мкл наносили на матрицу с помощью механического дозатора. После высыхания пятна облучали монохроматическим УФ-излучением (365 нм) и измеряли смартфоном цветометрические характеристики. Аналитический сигнал (Ar) в системе RGB рассчитывали по формуле:
Определение хинолонов в лекарственных препаратах. Одну таблетку лекарственного препарата помещали в колбу емк. 100 мл, приливали 1 мл 1 М HCl и объем в колбе доводили до метки деионизированной водой, перемешивали до полного растворения таблетки. Отбирали 1 мл полученного раствора и разбавляли деионизированной водой в колбе емк. 25 мл, перемешивали и фильтровали через мембранный фильтр 0.20 мкм. Отбирали 5 мкл полученного раствора и наносили на ЦБ или пластину ВЭТСХ. После высыхания пятна облучали УФ-светом (365 нм) и измеряли смартфоном цветометрические характеристики, по уравнению градуировочной зависимости рассчитывали содержание хинолонов в таблетке с учетом разбавления пробы. Жидкие лекарственные препараты перед анализом разбавляли деионизированной водой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Хинолоны на поверхности целлюлозной бумаги (ЦБ, ЦБ–Eu) и силикагеля (ВЭТСХ, ВЭТСХ–Eu) проявляют флуоресцирующие свойства. При облучении УФ-светом (365 нм) наблюдается преимущественно синяя, бирюзовая (ЦБ, ВЭТСХ) флуоресценция и красная, розовая (ЦБ–Eu, ВЭТСХ–Eu) при использовании матриц, пропитанных солью европия и тетраборатом натрия (табл. 1, рис. 2). Слабый аналитический сигнал на ЦБ наблюдали для налидиксовой, оксолиновой, пипемидовой кислот, флумеквина и марбофлоксацина.
Таблица 1.
Аналитические характеристики определения хинолонов на различных матрицах
| Аналит | Матрица | Цвет флуоресценции | смин, мкг/мл | сн, мкг/мл | ДОС, мкг/мл | Уравнение градуировочной зависимости | R2 |
|---|---|---|---|---|---|---|---|
| Налидиксовая кислота | ЦБ | – | – | – | – | – | – |
| ЦБ–Еu |  |
2 | 6 | 6–500 | Ar = 5.355ln(с) + 12.565 | 0.9831 | |
| ВЭТСХ | 1 | 3 | 3–125 | Ar = 7.9886ln(с) + 18.761 | 0.9970 | ||
| ВЭТСХ–Eu | 1 | 3 | 3–500 | Ar = 4.8616ln(c) + 6.5316 | 0.9832 | ||
| Оксолиновая кислота | ЦБ | – | – | – | – | – | – |
| ЦБ–Еu |  |
1 | 3 | 1–125 | Ar = 9.2387ln(с) + 12.522 | 0.9869 | |
| ВЭТСХ | 2 | 6 | 6–125 | Ar = 3.3466ln(с) + 9.7861 | 0.9898 | ||
| ВЭТСХ–Eu | 0.5 | 2 | 2–125 | Ar = 17.898ln(c) + 15.508 | 0.9892 | ||
| Пипемидовая кислота | ЦБ | – | – | – | – | – | – |
| ЦБ–Еu |  |
2 | 6 | 6–500 | Ar = 4.7611ln(с) + 11.419 | 0.9879 | |
| ВЭТСХ | 0.7 | 2 | 2–125 | Ar = 7.7124ln(с) + 25.053 | 0.9837 | ||
| ТСХ–Eu | 0.3 | 1 | 1–500 | Ar = 33.202ln(c) + 8.0121 | 0.9811 | ||
| Флумеквин | ЦБ | – | – | – | – | – | – |
| ЦБ–Еu |  |
1 | 3 | 3–500 | Ar = 12.737ln(с) + 12.069 | 0.9860 | |
| ВЭТСХ | 2 | 6 | 6–60 | Ar = 8.2212ln(с) + 21.421 | 0.9979 | ||
| ВЭТСХ–Eu | 2 | 6 | 6–64 | Ar = 4.7998ln(c) + 8.0412 | 0.9846 | ||
| Пефлоксацин | ЦБ |  |
4 | 12 | 12–500 | Ar = 4.2503ln(с) + 5.5958 | 0.9947 |
| ЦБ–Еu | 0.8 | 2 | 2–500 | Ar = 22.427ln(с) + 8.5871 | 0.9845 | ||
| ВЭТСХ | 0.6 | 2 | 2–125 | Ar = 12.656ln(с) + 23.991 | 0.9860 | ||
| ВЭТСХ–Eu | 0.6 | 2 | 2–125 | Ar = 13.455ln(c) + 13.977 | 0.9875 | ||
| Офлоксацин | ЦБ |  |
2 | 7 | 7–125 | Ar = 6.4149ln(с) + 5.8516 | 0.9924 |
| ЦБ–Еu |  |
0.7 | 2 | 2–500 | Ar = 30.425ln(с) + 11.227 | 0.9813 | |
| ВЭТСХ | 0.6 | 2 | 2–125 | Ar = 12.277ln(с) + 27.167 | 0.9975 | ||
| ВЭТСХ–Eu | 0.3 | 1 | 1–125 | Ar = 41.103ln(c) + 20.421 | 0.9822 | ||
| Данофлоксацин | ЦБ |  |
0.5 | 2 | 2–500 | Ar = 33.467ln(с) + 12.772 | 0.9835 |
| ЦБ–Еu | 0.4 | 1 | 1–125 | Ar = 45.541ln(с) + 17.398 | 0.9839 | ||
| ВЭТСХ | 0.7 | 2 | 2–250 | Ar = 12.207ln(с) + 18.379 | 0.9881 | ||
| ВЭТСХ–Eu | 0.2 | 0.6 | 0.6–250 | Ar = 47.456ln(c) + 16.503 | 0.9813 | ||
| Энрофлоксацин | ЦБ |  |
3 | 10 | 10–500 | Ar = 5.8417ln(с) + 5.2708 | 0.9801 |
| ЦБ–Еu | 0.9 | 3 | 3–125 | Ar = 17.721ln(с) + 14.932 | 0.9807 | ||
| ВЭТСХ | 0.5 | 2 | 2–32 | Ar = 13.904ln(с) + 25.181 | 0.9888 | ||
| ВЭТСХ–Eu | 0.3 | 1.3 | 1.3–250 | Ar = 39.216ln(c) – 3.7572 | 0.9843 | ||
| Сарафлоксацин | ЦБ |  |
3 | 10 | 10–250 | Ar = 5.1729ln(с) + 6.1873 | 0.9907 |
| ЦБ–Еu | 0.9 | 2 | 2–500 | Ar = 19.312ln(с) + 7.2941 | 0.9804 | ||
| ВЭТСХ | 0.5 | 2 | 2–120 | Ar = 17.933ln(с) + 26.633 | 0.9817 | ||
| ВЭТСХ–Eu | 0.3 | 1 | 1–500 | Ar = 37.725ln(c) + 8.3770 | 0.9861 | ||
| Марбофлоксацин | ЦБ | – | – | – | – | – | – |
| ЦБ–Еu |  |
1 | 3 | 3–125 | Ar = 8.7021ln(с) + 6.7722 | 0.9863 | |
| ВЭТСХ | 0.7 | 2 | 2–16 | Ar = 9.6016ln(с) + 16.651 | 0.9820 | ||
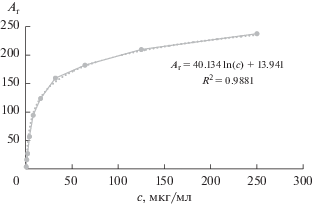
| ВЭТСХ–Eu | 0.3 | 0.6 | 0.6–250 | Ar = 40.134ln(c) + 13.941 | 0.9881 | ||
| Левофлоксацин | ЦБ |  |
1 | 3 | 3–125 | Ar = 17.610ln(с) + 16.612 | 0.9879 |
| ЦБ–Еu | 0.4 | 1 | 1–125 | Ar = 37.701ln(c) + 24.777 | 0.9818 | ||
| ВЭТСХ | 0.4 | 1 | 1–120 | Ar = 29.701ln(с) + 41.948 | 0.9879 | ||
| ВЭТСХ–Eu | 0.2 | 0.6 | 0.6–500 | Ar = 46.812ln(c) + 5.9361 | 0.9825 | ||
| Ломефлоксацин | ЦБ |  |
4 | 12 | 12–500 | Ar = 4.5304ln(с) + 5.5159 | 0.9822 |
| ЦБ–Еu | 1 | 3 | 3–125 | Ar = 9.8910ln(с) + 15.371 | 0.9937 | ||
| ВЭТСХ | 0.8 | 2 | 2–120 | Ar = 8.6097ln(с) + 18.832 | 0.9966 | ||
| ВЭТСХ–Eu | 0.5 | 2 | 2–250 | Ar = 17.763ln(c) + 11.326 | 0.9881 | ||
| Дифлоксацин | ЦБ |  |
– | – | – | – | – |
| ЦБ–Еu | 1 | 3 | 3–500 | Ar = 12.024ln(с) + 7.6680 | 0.9826 | ||
| ВЭТСХ | 0.6 | 2 | 2–120 | Ar = 11.791ln(с) + 21.968 | 0.9790 | ||
| ВЭТСХ–Eu | 0.4 | 1.4 | 1.4–125 | Ar = 26.299ln(c) – 3.1751 | 0.9852 | ||
| Ципрофлоксацин | ЦБ |  |
1 | 3 | 3–500 | Ar = 21.259ln(с) + 8.2473 | 0.9811 |
| ЦБ–Еu | 2 | 6 | 6–125 | Ar = 7.568ln(с) + 9.6310 | 0.9871 | ||
| ВЭТСХ | 0.4 | 1 | 1–120 | Ar = 16.361ln(с) + 22.666 | 0.9708 | ||
| ВЭТСХ–Eu | 0.4 | 1.3 | 1.3–500 | Ar = 32.659ln(c) – 2.4735 | 0.9829 | ||
| Норфлоксацин | ЦБ |  |
1 | 4 | 4–500 | Ar = 11.157ln(с) + 5.5710 | 0.9829 |
| ЦБ–Еu | 1 | 3 | 3–125 | Ar = 9.6290ln(с) + 6.8030 | 0.9868 | ||
| ВЭТСХ | 0.9 | 3 | 3–120 | Ar = 8.3726ln(с) + 22.005 | 0.9942 | ||
| ВЭТСХ–Eu | 0.3 | 1 | 1–500 | Ar = 30.894ln(c) + 11.407 | 0.9782 | ||
| Эноксацин | ЦБ |  |
1 | 4 | 4–500 | Ar = 15.268ln(с) + 12.419 | 0.9939 |
| ЦБ–Еu | 0.6 | 2 | 2–250 | Ar = 27.774ln(с) + 27.857 | 0.9847 | ||
| ВЭТСХ | 1 | 3 | 3–60 | Ar = 5.5714ln(с) + 19.081 | 0.9859 | ||
| ВЭТСХ–Eu | 0.2 | 0.6 | 0.6–64 | Ar = 46.208ln(c) + 30.557 | 0.9851 | ||
| Моксифлоксацин | ЦБ |  |
0.6 | 2 | 2–500 | Ar = 37.571ln(с) + 9.5319 | 0.9806 |
| ЦБ–Еu | 0.3 | 1 | 1–125 | Ar = 39.37ln(с) + 21.585 | 0.9826 | ||
| ВЭТСХ | 0.4 | 1 | 1–120 | Ar = 12.026ln(с) + 27.831 | 0.9877 | ||
| ВЭТСХ–Eu |  |
0.4 | 1.5 | 1.5–250 | Ar = 65.105ln(c) – 20.151 | 0.9826 |
Для получения матриц ЦБ–Eu, ВЭТСХ–Eu изучали влияние на аналитический сигнал концентрации пропиточных растворов европия (0.0001–0.01 М) и тетрабората натрия (0–1%). Установлено, что максимальное значение Аr наблюдается при использовании 0.001 М раствора хлорида европия для пропитки матриц. В отсутствие тетрабората натрия при нанесении растворов хинолонов на ЦБ и ВЭТСХ наблюдали розовое флуоресцирующее кольцо по краям пятна. Использование повторной пропитки матриц раствором тетрабората натрия (оптимально 0.2%-ный раствор) привело к равномерному окрашиванию флуоресцирующего пятна, что, вероятно, связано с образованием и закреплением в порах ЦБ и ВЭТСХ гидроксида европия.
Предел обнаружения (смин) и предел определения (сн) рассчитывали по формулам 3.3s/k и 10s/k соответственно (s – стандартное отклонение аналитического сигнала для холостого опыта, k – тангенс угла наклона градуировочной зависимости на линейном участке). Стандартное отклонение для Ar холостого опыта на бумаге равно 1.5 и для ВЭТСХ 0.5 (n = 15). Как видно из табл. 1, чувствительность определения антибиотиков хинолонового ряда повышается в 2–5 раз при использовании сенсибилизированной флуоресценции как на бумаге, так и пластинах ВЭТСХ. Градуировочные зависимости построены в полулогарифмических координатах с коэффициентами корреляции ≥0.98. В качестве примера табл. 2 и рис. 3 иллюстрируют расчет аналитического сигнала и вид градуировочной зависимости для марбофлоксацина.
Таблица 2.
Цветометрические характеристики марбофлоксацина на пластинах ВЭТСХ–Eu
| Концентрация марбофлоксацина, мкг/мл | Значение цветового канала/то же c вычетом холостой пробы | Аналитический сигнал | ||
|---|---|---|---|---|
| Rх/R0 – Rx | Gх/G0 – Gx | Bх/B0 – Bx | Ar = 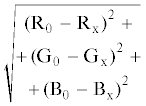 |
|
| 0 | 44/0 | 49/0 | 58/0 | – |
| 0.5 | 45/–1 | 52/–3 | 60/–2 | 4 |
| 1 | 53/–9 | 58/–9 | 68/–10 | 16 |
| 2 | 63/–19 | 62/–13 | 72/–14 | 27 |
| 4 | 92/–48 | 70/–21 | 80/–22 | 57 |
| 8 | 120/–76 | 88/–39 | 98/–40 | 94 |
| 16 | 147/–103 | 90/–41 | 113/–55 | 124 |
| 32 | 180/–136 | 105/–56 | 120/–62 | 160 |
| 64 | 205/–161 | 110/–61 | 118/–60 | 182 |
| 125 | 229/–185 | 110/–61 | 136/–78 | 210 |
| 250 | 253/–209 | 137/–88 | 129/–71 | 238 |
| 500 | 255/–211 | 139/–90 | 131/–73 | 241 |
При выбранных параметрах твердофазно-флуориметрического определения хинолонов как по собственной флуоресценции, так и сенсибилизированной флуоресценции европия оценили качество готовых лекарственных препаратов медицинского (Ципрофлоксацин, Левофлоксацин, Ципролет, Вигамокс, Флоксал) и ветеринарного (Байтрил) назначения. Установлено, что использование различных матриц незначительно влияет на воспроизводимость результатов анализа лекарственных препаратов: относительное стандартное отклонение во всех случаях не превышало 0.08. В табл. 3 представлены результаты определения хинолонов в лекарственных препаратах с использованием в качестве матрицы ВЭТСХ–Eu. Результаты аналаза подтверждают соответствие содержания действующих веществ лекарственных препаратов заявленному производителем на упаковке. Относительное стандартное отклонение результатов анализа не превышает 0.05. Продолжительность анализа 10–15 мин.
Таблица 3.
Результаты определения хинолонов в лекарственных препаратах (n = 3, Р = 0.95)
| Наименование препарата (действующее вещество) | Найдено | sr |
|---|---|---|
| Ципрофлоксацин (ципрофлоксацин, 500 мг) | 507 ± 10 | 0.008 |
| Левофлоксацин (левофлоксацин, 250 мг) |
258 ± 7 | 0.01 |
| Ципролет (ципрофлоксацин, 500 мг) |
504 ± 9 | 0.007 |
| Вигамокс (моксифлоксацин, 0.5%) |
0.49 ± 0.02 | 0.02 |
| Флоксал (офлоксацин, 3 мг/мл) |
2.9 ± 0.2 | 0.03 |
| Байтрил (энрофлоксацин, 5%) |
4.8 ± 0.6 | 0.05 |
Список литературы
Машковский М.Д. Лекарственные средства: пособие для врачей. М.: Новая волна, 2010. 1216 с.
Mostafa S., El-Sadek M., Alla E. A. Spectrophotometric determination of enrofloxacin and pefloxacin through ion-pair complex formation // Pharm. Biomed. Anal. 2002. V. 28. P. 173.
Amin A.S., Gouda A.A.E., El-Sheikh R., Zahran F. Spectrophotometric determination of gatifloxacin in pure form and in pharmaceutical formulation // Spectrochim. Acta A. 2007. V. 67. P. 1306.
Gonzalez J.A.O., Mochon M.C., de la Rosa F.J.B. Spectrofluorimetric determination of levofloxacin in tablets, human urine and serum // Talanta. 2000. V. 52. P. 1149.
Ocana J.A., Barragan F.J., Callejon M. Fluorescence and terbium-sensitised luminescence determination of garenoxacin in human urine and serum // Talanta. 2004. V. 63. P. 691.
Ocana J.A., Barragan F.J., Callejon M. Spectrofluorimetric and micelle-enhanced spectrofluorimetric determination of gatifloxacin in human urine and serum // J. Pharm. Biomed. Anal. 2005. V. 37. P. 327.
Guo C., Dong P., Chu Z., Wang L., Jiang W. Rapid determination of gatifloxacin in biological samples and pharmaceutical products using europium-sensitized fluorescence spectrophotometry // Luminescence. 2008. V. 23. P. 7.
Штыков С.Н., Смирнова Т.Д., Былинкин Ю.Г., Калашникова Н.В., Жемеричкин Д.А. Определение ципрофлоксацина и энрофлоксацина методом сенсибилизированной флуоресценции европия в присутствии второго лиганда и мицелл анионных ПАВ // Журн. аналит. химии. 2007. Т. 62. № 2. С. 153. (Shtykov S.N., Smirnova T.D., Bylinkin Y.G., Kalashnikova N.V., Zhemerichkin D.A. Determination of ciprofloxacin and enrofloxacin by the sensitized fluorescence of europium in the presence of the second ligand and micelles of anionic surfactants // J. Anal. Chem. 2007. V. 62. № 2. P. 136.)
Beltyukova S.,Teslyuk O., Egorova A., Tselik E. Solid-phase luminescence determination of ciprofloxacin and norfloxacin in biological fluids // J. Floresc. 2002. V. 12. № 2. P. 269.
Egorova A., Beltyukova S.,Teslyuk O. Fluorimetric determination of pipemidinic acid using the europium chelate // J. Pharm. Biomed. Anal. 1999. V. 21. P. 585.
Rodriguez-Diaz R.C., Aguilar-Caballos M.P., Gomez-Hens A. Simultaneous determination of ciprofloxacin and tetracycline in biological fluids based on dual-lanthanide sensitized luminescence using dry reagent chemical technology // Anal. Chim. Acta. 2003. V. 494. P. 55.
Zhu X., Gong A., Yu S. Fluorescence probe enhanced spectrofluorimetric method for the determination of gatifloxacin in pharmaceutical formulations and biological fluids // Spectrochim. Acta A. 2008. V. 69. P. 478.
Моногарова О.В., Осколок К.В., Апяри В.В. Цветометрия в химическом анализе // Журн. аналит. химии. 2018. Т. 73. № 11. С. 857.
Апяри В.В., Горбунова М.В., Исаченко А.И., Дмитриенко С.Г., Золотов Ю.А. Использование бытовых цветорегистрирующих устройств в количественном химическом анализе // Журн. аналит. химии. 2017. Т. 72. № 11. С. 963.
Иванов В.М., Кузнецова О.В. Химическая цветометрия: возможности метода, области применения и перспективы // Успехи химии. 2001. Т. 70. № 5. С. 411.
Huang X., Xu D., Chen J., Liu J., Li Y., Song J., Ma X., Guo J. Smartphone-based analytical biosensors // Analyst. 2018. V. 143. P. 5339.
Rezazadeh M., Seidi Sh., Lid M., Pedersen-Bjergaard S., Yamini Y. The modern role of smartphones in analytical chemistry // Trends Anal. Chem. 2019. V. 118. P. 548.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии