Журнал аналитической химии, 2021, T. 76, № 8, стр. 730-735
Селективное электроокисление свинца из бинарного электролитического осадка свинец–платина
Н. А. Колпакова a, *, А. В. Егошина a
a Национальный исследовательский Томский политехнический университет,
Инженерная школа природных ресурсов
634050 Томск, просп. Ленина, 30, Россия
* E-mail: nak@tpu.ru
Поступила в редакцию 23.02.2021
После доработки 18.03.2021
Принята к публикации 28.03.2021
Аннотация
Исследовано электроокисление компонентов из различных фазовых структур, полученных путем совместного электроосаждения свинца и платины на поверхность графитового электрода (ГЭ). Электроосаждение компонентов осадка на поверхность ГЭ проводили в режиме in situ. Сделано предположение о составе фазовых структур на поверхности ГЭ. С использованием термодинамической теории сплавов рассчитана теплота смешения компонентов бинарного сплава свинец–платина. Cмещение равновесного потенциала свинца при его селективном электроокислении из бинарного электролитического осадка свинец–платина оценивали в приближении теории регулярных растворов. Показано, что равновесный потенциал свинца в сплаве с платиной зависит от состава интерметаллического соединения (ИМС). После электроконцентрирования на поверхности ГЭ находятся фазы свинца, платины и ИМС PtPb. Равновесный потенциал системы Pb2+/PbPt составляет –0.35 В. Селективное электроокисление свинца из ИМС PtPb наблюдается при потенциале –0.3 В. Показана возможность определения ионов платины(II, IV) методом инверсионной вольтамперометрии по пику селективного электроокисления свинца из интерметаллического соединения с платиной при потенциале –0.3 В.
Платина и сплавы на ее основе находят широкое применение в качестве катализаторов и в ювелирной промышленности [1]. Важное значение имеют данные о взаимодействии платины со свинцом в твердой фазе при пробирном купелировании металлов платиновой группы в свинцовый королек [2] и при определении платины методом инверсионной вольтамперометрии (ИВ). Известно [3], что процесс электроокисления электролитического осадка платины протекает при потенциалах более положительных, чем 1 В и перекрывается процессом выделения кислорода из воды. Определение платины методом ИВ возможно после ее электроосаждения в сплав с неблагородным компонентом [4]. На вольт-амперной кривой имеются анодные пики, обусловленные селективным электроокислением неблагородного компонента из сплава с платиной, ток которых пропорционален содержанию ионов платины(II, IV) в растворе.
В работе [5] показана возможность определения ионов платины(II, IV) методом ИВ после ее электрооконцентрирования на поверхность графитового электрода (ГЭ) совместно со свинцом. Однако природа аналитического сигнала, зависящего от концентрации ионов платины(II, IV), не выяснена.
Известно, что при осаждении двух и более металлов на поверхность ГЭ вольт-амперная кривая анодного окисления осадка может в значительной степени отличаться от вольт-амперных кривых электроокисления индивидуальных компонентов. Взаимодействие компонентов в электролитическом осадке может приводить к смещению потенциалов пиков, их исчезновению, появлению дополнительных анодных пиков [6]. Фазовый состав продуктов взаимодействия компонентов на стадии электролиза достаточно разнообразен. На поверхности электрода могут образовываться механические смеси, твердые растворы переменного состава или интерметаллические соединения (ИМС). Электроокисление компонентов сплава может происходить как равномерно, так и селективно или псевдоселективно [7]. Решение вопроса о механизме электроокисления компонентов бинарного сплава осложняется тем, что для изучения фазового состава электролитического осадка невозможно использовать рентгенофазовый анализ или электронографию ввиду малых количеств образующегося на электроде вещества. Как правило, электролитические осадки имеют размеры 4–100 нм. Для выяснения характера протекающих в каждом случае процессов адсорбции и фазообразования при формировании на электроде бинарного электролитического осадка можно использовать метод ИВ. Описаны [8, 9] процессы селективного электроокисления неблагородного компонента из бинарных электролитических осадков висмут–платина и индий–платина. Показано, что бинарные электролитические осадки платина–металл образуют на поверхности графитового электрода ИМС. Образование на электроде бинарного сплава приводит к смещению как равновесного потенциала системы, так и потенциалов пиков электроокисления компонентов, входящих в сплав.
Цель данной работы – изучение процесса селективного электроокисления свинца из наноразмерного электролитического осадка платина–свинец методом ИВ и оценка природы анодных пиков на вольт-амперной кривой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали вольтамперометрический анализатор ТА-4 с трехэлектродной ячейкой (ООО “ТомьАналит”, Томск). Рабочим электродом служил ГЭ, импрегнированный парафином и полиэтиленом низкого давления, подготовленный по методике [10]; вспомогательным электродом и электродом сравнения служили насыщенные хлоридсеребряные электроды (х. с. э.), заполненные 1 М раствором KCl. Деаэрирование растворов не проводили. Перемешивание раствора в процессе электролиза предусмотрено анализатором и осуществлялось автоматически путем вибрации рабочего электрода на протяжении всего эксперимента.
Основные растворы, используемые для оценки содержания свинца и платины в растворе, готовили в 1 М HCl разбавлением государственных стандартных образцов (Красноярск, Россия).
Электроосаждение бинарного осадка свинец–платина на поверхность импрегнированного полиэтиленом ГЭ проводили в режиме in situ при потенциале –1.0 В в течение 60 с из 1 М растворов HCl, содержащих ионы свинца(II) и платины(IV). Электроокисление осадков проводили при линейном изменении потенциала (V = 60 мВ/с) в области потенциалов от –0.6 до –0.2 В. Поверхность ГЭ очищали электрохимически при потенциале 1 В.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
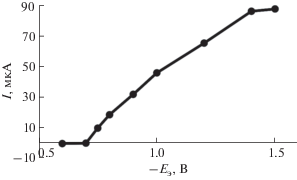
На рис 1 приведены вольт-амперные кривые электроокисления свинца, осажденного на поверхность ГЭ при различных концентрациях ионов свинца(II) в растворе. Как видно, потенциал пика электроокисления свинца в данных условиях наблюдается при потенциале –0.55 ± 0.03 В. На рис. 2 приведена зависимость тока пика электроокисления свинца от потенциала электроконцентрирования. Видно, что предельный диффузионный ток электровосстановления ионов свинца(II) в хлоридных средах наблюдается при потенциале электролиза –1.5 В.
Рис. 1.
Анодные вольт-амперные кривые свинца. Условия: 1 М HCl, Еэ = –1 В, τэ = 120 с, $v$ = 60 В/с, сPb(II), мг/л: 1 – 20, 2 – 40, 3 – 60.
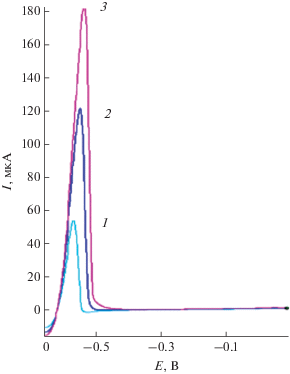
Рис. 2.
Зависимость тока анодного пика свинца от потенциала электролиза. Условия: 1 М HCl, сPb(II) = = 20 мг/л, τэ = 120 с, $v$= 0.06 В/с.
При введении в раствор ионов платины(IV) на поверхности ГЭ, кроме свинца, появляется осадок бинарного сплава свинец–платина, что приводит к резкому смещению потенциала выделения водорода на платине [11]. Большие количества водорода блокируют поверхность электрода, препятствуя электроосаждению осадка свинец–платина. Зафиксировать вольт-амперную кривую электроокисления свинца не удается. В связи с этим для электроосаждения бинарного осадка свинец–платина выбрали режим недонапряжения. В этом случае осадок свинец–платина осаждается при потенциале минус 1 В.
На рис. 3 приведены вольт-амперные кривые электроокисления осадков свинец–платина с поверхности ГЭ, полученных после электроосаждения сплава свинец–платина при различных концентрациях ионов платины(IV) и постоянной концентрации ионов свинца(II) в растворе. Как видно, при электроокислении бинарного осадка свинец–платина на анодной вольт-амперной кривой наблюдается пик электроокисления свинца с поверхности ГЭ (Епа = –0.55 В), дополнительные пики при потенциалах –0.3 и +0.3 В. Пик при потенциале –0.3 В в литературе не описан. Форма максимума в области потенциалов от 0.0 до 0.3 В говорит о вероятности протекания процесса электроокисления адсорбционных молекул водорода на осадке платины [3].
Рис. 3.
Вольт-амперные кривые электроокисления бинарной системы свинец–платина в 1 М HCl при Еэ = –1 В: 1 – 60 мг/л Pb(II) + 0.4 мг/л Pt(IV); 2 – 60 мг/л Pb(II) + 0.6 мг/л Pt(IV); 3 – 60 мг/л Pb(II) + + 0.8 мг/л Pt(IV); 4 – 60 мг/л Pb(II) + 1.0 мг/л Pt(IV).
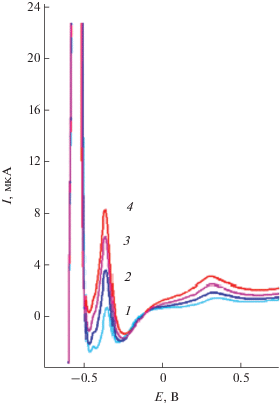
Согласно стандартным электродным потенциалам ($E_{{{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{{\text{o}}} = - 0.35\,\,{\text{B}};$ $E_{{{{{\text{PtCl}}_{{\text{4}}}^{{{\text{2}} - }}} \mathord{\left/ {\vphantom {{{\text{PtCl}}_{{\text{4}}}^{{{\text{2}} - }}} {{\text{Pt}}}}} \right. \kern-0em} {{\text{Pt}}}}}}^{{\text{o}}} = 0.51\,\,{\text{B}}$) при потенциале электролиза –1 В первой на поверхность ГЭ осаждается платина, так как перенапряжение для ее электроконцентрирования меньше. Электроосаждение свинца может происходить как на поверхность ГЭ, так и на поверхность платины, осажденной на ГЭ с образованием бинарного сплава.
При изучении электроокисления электролитического осадка свинец–платина установлено, что площадь под анодным пиком при потенциале –0.3 В зависит как от концентрации ионов платины(IV, II), так и от концентрации ионов свинца(II) в растворе (рис. 4). Как видно из рис. 4, с увеличением концентрации ионов платины(IV, II) при постоянной концентрации ионов свинца(II) в растворе площадь под анодным пиком при потенциале –0.3 В увеличивается, а площадь под пиком электроокисления свинца с поверхности ГЭ при потенциале –0.55 В уменьшается (рис. 5). Увеличение площади под пиком электроокисления при потенциале –0.3 В происходит до полного исчезновения пика электроокисления осадка свинца с поверхности ГЭ.
Рис. 4.
Зависимость площади под анодным пиком при потенциале 0.3 В в системе Pt–Pb от концентрации ионов ${\text{PtCl}}_{6}^{{2 - }}$ при концентрациях ионов Pb(II) в растворе, М: 1 – 9.4 × 10–6, 2 – 1.8 × 10–5.
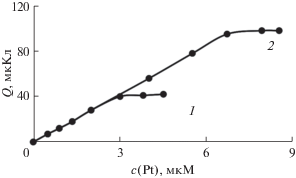
Рис. 5.
Зависимость площади под анодным пиком электроокисления свинца с поверхности графитового электрода от концентрации ионов ${\text{PtCl}}_{6}^{{2 - }}$ в растворе. Содержание ионов Pb(II), М: 1 – 9.4 × 10–6, 2 – 1.8 × 10–5.
Известно, что электроокисление компонентов бинарного сплава может происходить равномерно или селективно [7]. Кулонометрические исследования позволили установить, что в условиях постоянства количества свинца и переменного количества платины в осадке суммарное количество электричества под всеми пиками, зависящими от концентрации свинца, остается постоянным. Изменяется лишь соотношение величин парциальных вкладов пиков в общее количество электричества, затрачиваемое на электроокисление различных фазовых структур, в которые входит свинец, образованных на поверхности электрода на стадии предварительного электролиза. Это возможно, если пик на вольт-амперной кривой при потенциале –0.3 В обусловлен селективным электроокислением свинца из устойчивых фазовых соединений с платиной.
Согласно фазовой диаграмме платина и свинец могут образовывать между собой следующие ИМС: Pb4Pt, PbPt, PbPt3 [12]. Для установления фазовой структуры, из которой происходит селективное электроокисление свинца при потенциале –0.3 В, мы использовали термодинамический подход, позволяющий рассчитать равновесный потенциал сплава свинец–платина в приближении теории регулярных растворов [13].
Термин “регулярный раствор” введен Гильденбрандом для характеристики систем, в которых наблюдается статистически беспорядочное распределение компонентов с энтропией смешения, равной идеальной энтропии [14]. В таких растворах межатомное взаимодействие компонентов, следствием которого является $\Delta {{\bar {H}}_{{{\text{см}}}}} \ne 0,$ не изменяет расположения атомов в сплаве, поэтому $\Delta {{\bar {S}}_{{{\text{см}}}}}$ = 0. Для регулярных растворов $\left| {\Delta {{{\bar {H}}}_{{{\text{см}}}}}} \right|$ = = $T\left| {\Delta {{S}_{{{\text{см}}}}}} \right|$ и, следовательно, $\Delta {{\bar {G}}_{{{\text{см}}}}} \cong \Delta {{H}_{{{\text{см}}}}}.$ Модель регулярных растворов часто используется для описания термодинамического поведения компонентов в сплавах.
Для установления фазового состава осадка, образующегося на поверхности платиновых центров, рассчитали смещение равновесного потенциала системы Pb2+/PbPt для различных по составу ИМС свинец–платина по соотношению:
(1)
$\Delta {{E}_{{\text{р}}}} = {{E}_{{\text{р}}}} - E_{{\text{р}}}^{{{\text{сп}}}} = \frac{{RT}}{{zF}}\ln {{X}_{i}} - \frac{{{{{(1 - {{X}_{i}})}}^{2}}}}{{zF}}\Delta {{Н}_{{{\text{см}}}}},$(2)
$\Delta {{Н}_{{{\text{см}}}}} = {{z}_{{{\text{Pb}}}}}{{n}_{{{\text{Pb}}}}}\frac{{{{r}_{{^{{{\text{Pb}}}}}}}}}{{{{r}_{{{\text{Pt}}}}}}}\left[ {{{\varepsilon }_{{{\text{Pb}} - {\text{Pt}}}}} - \frac{{{{\varepsilon }_{{{\text{Pt}} - {\text{Pt}}}}}}}{2}} \right] - {{z}_{{{\text{Pb}}}}}{{n}_{{{\text{Pb}}}}}\frac{{{{\varepsilon }_{{{\text{Pb}} - {\text{Pb}}}}}}}{2},$(3)
${{\varepsilon }_{{{\text{Pt--Pt}}}}} = {{Q}_{{{\text{субл}}}}}{\text{/}}6 = 93.33{\text{ кДж/моль}}{\text{.\;}}$Как известно, теплоты смешения при образовании сплавов равносильны образованию ковалентной связи между металлами [18], поэтому энергию связи свинец–платина с учетом ионности связи рассчитывали по уравнению Полинга [19]:
(4)
$\begin{gathered} {{\varepsilon }_{{{\text{Pb--Pt}}}}} = 0.5\left( {{{\varepsilon }_{{{\text{Pb--Pb}}}}} + {{\varepsilon }_{{{\text{Pt--Pt}}}}}} \right) + \\ + \,\,100{{\left( {{{\chi }_{{{\text{Pb}}}}}--{\text{ }}{{\chi }_{{{\text{Pt}}}}}} \right)}^{2}}--6.5{{\left( {{{\chi }_{{{\text{Pb}}}}}--{{\chi }_{{{\text{Pt}}}}}} \right)}^{4}}, \\ \end{gathered} $Стандартный равновесный потенциал пары Pb2+/Pb равен –0.346 В относительно х. с. э. [20], откуда равновесный потенциал системы ${{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}$ при концентрации ионов свинца 3.38 × 10–6 М равен:
Равновесные потенциалы электрода Pb2+/Pb–Pt при разных содержаниях платины в составе ИМС свинец–платина рассчитывали по формуле:
(5)
$Е_{{{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} {{\text{Pb}}x{\text{Pt}}y}}} \right. \kern-0em} {{\text{Pb}}x{\text{Pt}}y}}}}^{{\text{p}}} = Е_{{{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{{\text{р}}} - \Delta E.$Мольные доли свинца в различных по составу ИМС с платиной равны: 0.8 в Pb4Pt, 0.66 в Pb2Pt, 0.5 в PbPt и 0.2 в PbPt4. Рассчитанная по уравнению (4) энергия связи платина–свинец равна 96.75 кДж/моль. Ниже приведены рассчитанные по уравнению (4) теплоты смешения компонентов для различных ИМС свинца с платиной:
По формуле (1) рассчитали значения смещения равновесных потенциалов электроокисления свинца из ИМС с платиной, а затем по формуле (5) – равновесные потенциалы электроокисления свинца из ИМС с платиной. Значения смещения равновесного потенциала системы Pb2+/PbPt и равновесные потенциалы селективного электроокисления свинца из различных по составу ИМС приведены в табл. 1.
Таблица 1.
Значения смещения равновесного потенциала системы Pb2+/PbPt и равновесные потенциалы селективного электроокисления свинца из различных по составу интерметаллических соединений
| Состав ИМС | Число атомов nPb | ∆Eрасч, В | Ерасч, В |
|---|---|---|---|
| Pb4Pt | 4 | –0.06 | –0.38 |
| Pb2Pt | 2 | –0.13 | –0.31 |
| PbPt | 1 | –0.09 | –0.35 |
| PbPt4 | 1 | –0.24 | –0.20 |
Наиболее близко к наблюдаемому на анодной вольт-амперной кривой пику селективного электроокисления свинца находится пик при –0.3 В из ИМС PbPt. Полученные данные позволили рекомендовать аналитический сигнал селективного электроокисления свинца из ИМС PbPt, наблюдаемый при потенциале –0.3 В, для определения содержания ионов платины(II, IV) методом ИВ.
Градуировочная зависимость для определения ионов платины(II, IV) по пику селективного электроокисления свинца из ИМС PbPt описывается уравнением I = 0.15cPt – 0.08 (R2 = 0.9942).
Для получения статистически значимых значений аналитического сигнала при определении ионов платины(II, IV) методом ИВ предложено поддерживать соотношение сPb : cPt не меньшее, чем 4 : 1, а также следующие условия эксперимента: фоновый электролит – 1 М HCl, потенциал электролиза –1 В, скорость изменения потенциала 0.06 В/с.
Нижнюю границу определяемых содержаний платины по пику селективного электроокисления свинца оценивали по 3σ-критерию по уравнению [21]:
Авторы планируют в будущем получить результаты определения платины в минеральном сырье по пикам селективного электроокисления свинца из бинарного сплава свинец–платина.
Список литературы
Энциклопедия электронного портала “Академик”. dic.akademic.ru/ dic.nsf/ru-wiki/812247 (20.02.2021).
Золотов Ю.А., Варшал Г.М., Иванов B.M. Аналитическая химия металлов платиновой группы. М.: Едиториал УРСС, 2003. С. 592.
Мансуров Г.Н., Петрий О.А. Электрохимия тонких металлических пленок. Монография. М.: МГОУ, 2011. С. 351.
Колпакова Н.А., Борисова Н.В., Невоструев В.А. Природа положительного анодного пика тока на вольтамперной кривой в инверсионной вольтамперометрии бинарных систем платина–металл // Журн. аналит. химии. 2001. № 8. С. 835.
Колпакова Н.А., Шифрис Б.С., Швец Л.А., Кропоткина С.В. Определение платиновых металлов и золота методом инверсионной вольтамперометрии // Журн. аналит. химии. 1991. Т. 46. № 10. С. 1910.
Гамбург Ю.Д. Электрохимическая кристаллизация металлов и сплавов. М.: Янус-К, 1997. С. 384.
Маршаков И.К., Введенский А.В., Кондрашин В.Ю., Боков Г.А. Анодное растворение и селективная коррозия сплавов. Воронеж: Воронежский ун-т, 1988. С. 205.
Shekhovtsova N.S., Glyzina T.S., Romanenko S.V., Kolpakova N.A. Estimation of the composition of electrolytically prepared intermetallic bismuth–platinum deposits // J. Solid State Electrochem. 2012. V. 16. № 7. P. 2419.
Ustinova E.M., Gorchakov E.V., Kolpakova N.A. Anodic stripping determination of Pt(IV) based on the anodic oxidation of In from electrochemically deposited Pt−In alloy phases // J. Solid State Electrochem. 2012. V. 16. № 7. P. 2455.
Брайнина Х.З., Нейман Е.Я. Инверсионные электроаналитические методы. М.: Химия, 1988. С. 260.
Езерская Н.А., Киселева И.Н. Каталитические полярографические токи ионов водорода в растворах платиновых металлов и их применение для определения микроконцентраций этих элементов // Журн. аналит. химии. 1984. Т. 39. № 9. С. 1541.
Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.: Наука, 1979. Т. 4. 576 с.
Андреев Ю.А. Электрохимия металлов и сплавов. М.: Высшее образование и Наука, 2016. С. 314.
Козин Л.Ф., Нигметова Р.Ш., Дергачева М.Б. Термодинамика бинарных амальгамных систем. Алма-Ата: Наука Каз. ССР, 1977. 343 с.
Краткая химическая энциклопедия. М.: Советская энциклопедия, 1963. Т. 4. 1182 с.
Энергия разрыва химических связей. Потенциалы ионизации и сродство к электрону / Под ред. Кондратьева В.Н. М.: Наука, 1974. 351 с.
Бокрис Дж., Комуэл Б. Современные проблемы электрохимии / Пер. с англ. под ред. Колотыркина Я.М. М.: Мир, 1971. 450 с.
Лесник А.Г. Модели межатомного взаимодействия в статистической теории сплавов. М.: Физматгиз, 1962. 100 с.
Полинг Л., Полинг П. Химия. М.: Мир, 1978. 683 с.
Сухотин А.М. Справочник по электрохимии. Л.: Химия, 1981. С. 488.
Смагунова А.Н., Карпукова О.М. Методы математической статистики в аналитической химии. Ростов-на-Дону: Феникс, 2012. С. 348.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


