Журнал аналитической химии, 2021, T. 76, № 8, стр. 723-729
Оценка возможности дифференцирования гистологического типа и локализации опухоли у пациентов с раком легких по составу выдыхаемого воздуха
Э. М. Гашимова a, *, А. З. Темердашев a, В. А. Порханов b, И. С. Поляков b, Д. В. Перунов b, А. К. Осипова a, Е. В. Дмитриева a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
b Научно-исследовательский институт – Краевая клиническая больница № 1 им. С.В. Очаповского
350086 Краснодар, ул. 1 Мая, 167, Россия
* E-mail: elina.gashimova@yandex.ru
Поступила в редакцию 15.03.2021
После доработки 25.03.2021
Принята к публикации 25.03.2021
Аннотация
В клинической практике анализ выдыхаемого воздуха является перспективным подходом к диагностике рака легких ввиду возможности экспрессного и неинвазивного отбора проб. В данной работе проведен анализ выдыхаемого воздуха 80 пациентов с раком легких в целях выявления различий в профилях летучих органических соединений у больных с разным гистологическим типом и локализацией рака с использованием метода газовой хромато-масс-спектрометрии. Выявлены некоторые летучие органические соединения и их соотношения, содержания которых статистически значимо отличаются в пробах с различной локализацией и гистологическим типом.
На сегодняшний день рак легких является наиболее распространенным и агрессивным видом онкологии и остается основной причиной летальных исходов среди подобных заболеваний [1]. Эффективность лечения во многом зависит от гистологического типа заболевания, которые разделяют на две группы: мелкоклеточный и немелкоклеточный рак легких. Самым опасным считается мелкоклеточный рак, так как опухоль наиболее агрессивна и отличается быстрым распространением и метастазированием в другие органы. На долю немелкоклеточных опухолей различных морфологических типов приходится 80% случаев, среди которых наиболее распространены аденокарцинома и плоскоклеточный рак. В случае раннего выявления немелкоклеточных опухолей возможно проведение хирургического лечения, а мелкоклеточные опухоли являются неоперабельными [2, 3].
Как оперативное, так и другие типы лечения наиболее эффективны при выявлении заболевания на ранних стадиях. В настоящее время далеко не всегда удается диагностировать рак легких на ранних стадиях, так как диагностика онкологии легких – весьма сложная задача, которая в большинстве случаев не обходится без биопсии, сложной инвазивной процедуры, зачастую сопряженной с определенными рисками для пациента. Вследствие этого внимание многих исследователей сосредоточено на разработке альтернативных способов диагностики рака легких, основанных на выявлении специфичных для заболевания биомаркеров. В качестве объектов исследования зачастую используют кровь, слюну [4, 5], конденсат выдыхаемого воздуха [6], выдыхаемый воздух [7, 8]. Наиболее интересным объектом является непосредственно выдыхаемый воздух, так как процедура его отбора удобна и проста, а матрица содержит значительно меньше матричных компонентов. В его состав входит ряд макрокомпонентов, таких как пары воды, азот, углекислый газ, кислород и т.д., а также следовые количества различных летучих органических соединений (ЛОС) как экзогенного, так и эндогенного происхождения [9]. На сегодняшний день опубликовано большое количество работ, направленных на выявление специфических маркеров рака легких среди ЛОС из выдыхаемого воздуха с использованием различных аналитических методов [10], среди которых “золотым стандартом” остается газовая хромато-масс-спектрометрия (ГХ–МС). Как правило, концентрации летучих органических соединений в выдыхаемом воздухе слишком малы для осуществления анализа без стадии предварительного многократного концентрирования. Для концентрирования чаще всего применяют сорбционные трубки [11, 12] или волокна для твердофазной микроэкстракции [11, 13, 14], что дает возможность получить наиболее полную информацию о количественном и качественном составе пробы. Следует отметить, что получаемые результаты напрямую зависят от типа используемых сорбентов, поэтому необходима предварительная оптимизация условий концентрирования и выбора потенциальных аналитов.
В литературе описан ряд сенсорных систем, предназначенных для диагностики рака легких по выдыхаемому воздуху. Для диагностики рака легких применяли колориметрическую сенсорную систему [15], систему сенсоров на основе пьезокварцевых микровесов [16], различных металлоксидных полупроводниковых сенсоров [17], сенсоров из нанопроволок, где для максимизации сигнала сенсорная система подвергалась облучению УФ-излучением [18], систему на основе хемирезистивных датчиков с различными покрытиями [19], а также более сложные сенсорные системы, в состав которых входит несколько типов датчиков [20].
Возможность дифференцировать рак легких от других респираторных заболеваний продемонстрирована с применением спектроскопии ионной подвижности совместно с мультикапиллярной колонкой [21]. В работе [22] представлены результаты применения протонной масс-спектрометрии для дифференцирования групп пациентов с аденокарциномой, плоскоклеточным раком и здоровых людей.
На данный момент опубликовано множество работ, где с помощью различных аналитических методов удается с высокой точностью дифференцировать пациентов с раком легких и здоровых людей [23–26], однако до сих пор не выявлен устойчивый перечень маркеров, повторяющихся в различных исследованиях, и не предложено единой методологии проведения анализа в целях выявления самого факта наличия онкологического заболевания и установления его типа и локализации.
В данном исследовании представлены результаты применения метода ГХ–МС для анализа выдыхаемого воздуха пациентов с онкологией легких наиболее распространенных гистологических типов: аденокарцинома, плоскоклеточный и мелкоклеточный рак. Целью работы являлось изучение профилей ЛОС из выдыхаемого воздуха и классификация проб по гистологическому типу и локализации опухоли с использованием потенциальных веществ-кандидатов и их соотношений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследуемые образцы получали от 80 пациентов с подтвержденным онкологическим заболеванием, проходящих лечение в НИИ ККБ № 1 им. С.В. Очаповского (Краснодар). Диагноз был подтвержден гистологически: у 40 пациентов – аденокарцинома, у 31 пациента – плоскоклеточный рак, у 9 пациентов – мелкоклеточный рак. У 40 пациентов опухоль находилась в центральной части легкого, у остальных 40 – в периферической. Информированное согласие было получено от всех участников исследования. Проведение клинического исследования одобрено локальным этическим комитетом (протокол № 122 заседания локального этического комитета НИИ ККБ им. С.В. Очаповского министерства здравоохранения Краснодарского края от 19.12.2019 г.).
Материалы и методы. Использовали стандартные образцы метанола, этанола, бензола, толуола, ацетонитрила, н-гексана (>95%, Sigma-Aldrich, США), диэтиловый эфир (>95%, Acros Organics, Бельгия), ацетон, бутанол-1, бутанол-2, пропанол-2 х. ч. (Вектон, Россия), этилацетат, бутилацетат х. ч. (Компонент-реактив, Россия).
Приборы и оборудование. Отбор проб осуществляли с использованием лавсановых ПП-1-5,0 (OOO НПФ “ЭКАН”, Россия) и тедларовых (Supelco, Bellefonte, PA, США) пробоотборных пакетов объемом 5 л, которые перед использованием пятикратно кондиционировали азотом. Перед отбором проб добровольцы минимум в течение 10 мин находились в спокойном состоянии без физических нагрузок в вентилируемом помещении, после чего участникам исследования предлагали заполнить пробоотборный пакет путем нескольких глубоких вдохов и выдохов с целью обеспечения полноты обновления альвеолярного воздуха, затем они делали глубокий вдох, задерживали воздух на 10 с и совершали глубокий выдох в пакет для отбора проб, повторяя процедуру до заполнения пакета. Для минимизации влияния посторонних факторов отбор проб проводили натощак. Полученные образцы хранили в пробоотборных пакетах при комнатной температуре в течение не более 6 ч после заполнения пакета. Влияние экзогенных компонентов, находящихся в окружающем воздухе, учитывали путем отбора пробы окружающего воздуха перед началом пробоотбора. Концентрирование образцов проводили с применением сорбционных трубок, наполненных сорбентом Тenax TA (35/60 меш), (ЗАО СКБ “Хроматэк”, Россия). Для этого часть пробы объемом 0.5 л, предварительно отобранной в пробоотборный пакет, пропускали со скоростью 200 мл/мин через сорбционную трубку с помощью аспиратора ПВ-2 (ЗАО СКБ “Хроматэк”, Россия).
Газохроматографический анализ с масс-спектрометрическим детектированием проводили с применением системы, состоящей из двухстадийного термодесорбера ТДС-1 (ЗАО СКБ “Хроматэк”, Россия) и газового хроматографа Хроматэк-Кристалл 5000.2, соединенного с квадрупольным масс-спектрометрическим детектором Хроматэк МСД, оснащенного источником электронной ионизации. Для разделения применяли капиллярную колонку Supelco Supel-Q PLOT (30 м × 0.32 мм). Условия концентрирования и анализа проб оптимизированы ранее [27]. Для управления и обработки полученных данных использовaли программное обеспечение “Хроматэк Аналитик” (ЗАО СКБ “Хроматэк”, Россия). Условия разделения и детектирования приведены в табл. 1.
Таблица 1.
Условия анализа проб выдыхаемого воздуха методом газовой хромато-масс-спектрометрии с термодесорбцией
| Параметр | Значение | ||||
|---|---|---|---|---|---|
| Термодесорбер | |||||
| Газ-носитель | Гелий | ||||
| Температура крана, °С | 150 | ||||
| Температура переходной линии, °С | 180 | ||||
| Температура десорбции, °С | 250 | ||||
| Начальная температура ловушки, °С | –10 | ||||
| Конечная температура ловушки, °С | 250 | ||||
| Время десорбции, мин | 5 | ||||
| Хромато-масс-спектрометр | |||||
| Газ-носитель | Гелий | ||||
| Температура инжектора, °C | 250 | ||||
| Деление потоком | 1 : 10 | ||||
| Температура источника ионизации, °C | 200 | ||||
| Температура переходной линии, °C | 250 | ||||
| Режим сканирования | Сканирование полного ионного тока | ||||
| Диапазон сканирования масс, Да | 33–220 | ||||
| Энергия ионизации, эВ | 70 | ||||
| Температурная программа: | |||||
| скорость нагрева, °С/мин | 0 | 10 | 6 | 4 | |
| t, °С | 50 | 150 | 220 | 250 | |
| время, мин | 0 | 0 | 7 | 0 | |
| скорость потока газа-носителя, мл/мин | 1.30 | ||||
В случае отсутствия стандартных образцов компоненты, присутствующие в пробах, идентифицировали путем сопоставления полученных масс-спектров с библиотечными (NIST 17). Удовлетворительным признавали результат, при котором фактор подобия спектра превышал 85%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты работ разных авторов по выявлению комбинации биомаркеров в профилях ЛОС из выдыхаемого воздуха пациентов с раком легких и здоровых людей имеют ряд значимых отличий, которые могут быть обусловлены как разностью подходов к отбору и анализу образцов, так и разночтениями в интерпретации данных. Таким образом, между результатами, представленными различными исследовательскими группами, корреляция отсутствует [28]. Отличия могут быть обусловлены тем, что в разных исследованиях анализируются разные по составу выборки, прежде всего, среди пациентов, что может вносить значительную неопределенность. Представляет интерес изучение профилей ЛОС из выдыхаемого воздуха пациентов с раком легких различных гистологических типов и выявление признаков, характерных для конкретного гистологического типа заболевания.
Опухоль может быть локализована в центральной части легкого, в частности в крупных и сегментарных бронхах, а также в периферических отделах легочной ткани. Симптоматика и лечение опухоли в зависимости от локализации существенно отличаются: поражение мелкого бронха обычно не вызывает кашель и других проявлений, характерных для центрального рака, с чем связаны трудности своевременной диагностики [29]. Возможно, опухоль, локализованная в периферических отделах легочной ткани, меньше влияет на профиль ЛОС из выдыхаемого воздуха в связи с отдаленностью новообразования от дыхательных путей, поэтому одной из задач настоящего исследования являлось изучение профилей ЛОС онкобольных в зависимости от локализации опухоли.
В качестве параметров для выявления наиболее характерных отличий в профилях ЛОС выдыхаемого воздуха пациентов с раком легких разных гистологических типов и разной локализации опухоли рассматривали как индивидуальные компоненты, так и их соотношения. Использование абсолютных величин концентраций тех или иных индивидуальных веществ может привести к большому количеству ложных результатов, так как подобный подход не позволяет учесть вариативность результатов, обусловленную возможными особенностями метаболизма и состоянием хромато-масс-спектрометрической системы, в то время как использование соотношений между компонентами позволит существенно снизить подобную вариативность.
Полученные данные обрабатывали статистически. Нормальность распределения данных проверяли с помощью теста Колмогорова–Смирнова. Поскольку данные не подчиняются нормальному закону распределения, для выявления статистически значимых отличий относительно локализации опухоли применяли тест Манна–Уитни, а в случае гистологического типа – тест Крускала–Уоллиса.
В рассматриваемый массив данных входили площади пиков ЛОС и их соотношения. В качестве знаменателя использовали только компоненты, наиболее часто встречающиеся в пробах (более 86%): ацетон, ацетонитрил, изопрен, бутанон-2, 1-метилтиопропан, аллилметилсульфид, 1-метилтиопропен, диметилсульфид, диметилдисульфид, пентанон-2, бутандион-2,3 и их соотношения между собой. В табл. 2 представлены соединения и соотношения, площади пиков которых статистически значимо отличались в группах онкобольных с разной локализацией опухоли (p-уровень <0.05). Как видно, единственным компонентом, статистически значимо отличающимся в группах пациентов с разной локализацией опухоли, является пентанол-1. В нашей предыдущей работе [30] наблюдали статистически значимые отличия площадей пиков пентанола-1 в группах больных раком легких и здоровых людей. В исследовании [31] отмечено, что пентанол-1 найден только у здоровых курильщиков и онкобольных. В настоящей работе для ряда соотношений наблюдаются статистически значимые различия в зависимости от локализации опухоли. Среди составляющих соотношений также присутствуют кетоны (бутанон-2, пентанон-2, бутандион-2,3), альдегиды (бутаналь) и серосодержащие (диметилдисульфид) ЛОС. Отмечено [32], что серосодержащие соединения вырабатываются полостью рта. Различия в концентрациях кетонов [31–34] и альдегидов [30, 35] в выдыхаемом воздухе пациентов с раком легких и здоровых людей неоднократно зафиксированы различными исследователями. Состав выдыхаемого воздуха относительно локализации опухоли ранее не изучали, поэтому полученные результаты необходимо подтвердить с использованием более широкой выборки добровольцев из всех групп.
Таблица 2.
Соединения и их соотношения, статистически значимо отличающиеся в группах онкобольных с разной локализацией опухоли (тест Манна–Уитни)
| Соединение/соотношение | p-Уровень |
|---|---|
| Пентанол-1 | 0.035 |
| Бутанон-2/пентанон-2 | 0.040 |
| Диметилдисульфид/бутандион-2,3 | 0.017 |
| Пентанол-1/бутандион-2,3 | 0.005 |
| Бутаналь/бутандион-2,3 | 0.022 |
В работе [36] обнаружено, что концентрации бутанола-1 и 3-гидроксибутанона-2 значительно выше в случае аденокарциномы, чем при плоскоклеточном раке, но другие исследователи не нашли статистически значимых различий в профилях ЛОС больных различными гистологическими типами опухоли [37]. В работе [22] представлены результаты применения протонной масс-спектрометрии, где выявлен ряд ионов, характерных для дифференцирования групп пациентов с аденокарциномой, плоскоклеточным раком и здоровых людей. Мы провели сравнение профилей ЛОС пациентов с аденокарциномой, плоскоклеточным и мелкоклеточным раком. На рис. 1 представлены хроматограммы проб выдыхаемого воздуха пациентов с раком легких разных гистологических типов, полученные в режиме регистрации полного ионного тока.
Рис. 1.
Хроматограммы проб выдыхаемого воздуха больных раком легких разных гистологических типов: (а) – мелкоклеточный рак, (б) – аденокарцинома, (в) – плоскоклеточный рак; в случаях (а) и (в) опухоль локализована в центральной части легкого, в случае (б) – в периферической части легкого: 1 – изобутан, 2 – этанол, 3 – ацетонитрил, 4 –ацетон, 5 – пропанол-2, 6 – диметилсульфид, 7 – этиловый эфир, 8 – изопрен, 9 – бутаналь, 10 – бутандион-2,3, 11 – бутанон-2, 11 – диметилкарбонат, 12 – этилацетат, 13 – 2-метилпентан, 14 – гексан, 15 – бутанол-1, 16 – бензол, 17 –пентанон-2, 18 – алилметилсульфид, 19 –1-метилтиопропан, 20 – 1-метилтиопропен, 21 – гептан, 22 – пентанол-1, 23 – толуол, 24 – фурфураль, 25 – гексаналь, 26 – бутилацетат, 27 – N,N-диметилацетамид, 28 – этилбензол, 29 – o‑ксилол, 30 – м-ксилол + п-ксилол, 31 – гептаналь, 32 – фенол, 33 – бензальгегид, 34 –2-пентилфуран, 35 – октаналь, 36 – 2-этилгексанол-1, 37 – ундекан, 38 – лимонен, 39 – додекан, 40 – нонаналь, 41 – тридекан.
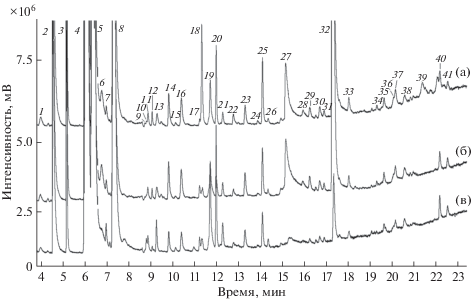
Статистически значимых различий относительно гистологического типа не наблюдали для индивидуальных ЛОС, однако они выявлены для некоторых соотношений, преимущественно серосодержащих соединений (табл. 3). Полученные результаты могут быть обусловлены небольшим числом участников исследования, отнесенных к группам с каждым из рассматриваемых гистологических типов, и свидетельствуют о необходимости расширения выборки с целью подтверждения или опровержения представленной гипотезы.
Таблица 3.
Соединения и их соотношения, статистически значимо отличающиеся в группах онкобольных с разным гистологическим типом (тест Крускала–У-оллиса)
| Соотношение | p-Уровень |
|---|---|
| 1-Метилтиопропан/диметилдисульфид | 0.0485 |
| 1-Метилтиопропен/диметилдисульфид | 0.0494 |
| Ундекан/алилметилсульфид | 0.0424 |
Подход, предполагающий рассмотрение в качестве параметров не индивидуальных соединений, а их соотношений, применен нами ранее при анализе выдыхаемого воздуха методом газовой хроматографии с пламенно-ионизационным детектором [27]. Были рассмотрены 14 компонентов выдыхаемого воздуха и выявлены соотношения, значения которых статистически значимо отличались при анализе больных и здоровых людей. Однако среди соединений и соотношений, отличающихся в группах больных и здоровых людей, не выявлено ни одного соотношения, отличающегося в группах с разной локализацией опухоли или с разным гистологическим типом. Стоит отметить, что в разных работах анализировали разные группы людей, в частности, основную группу пациентов предыдущего исследования составляли больные мелкоклеточным раком легких, а в данной работе – аденокарциномой. Кроме того, в настоящей работе применяли более чувствительный прибор (газовый хроматограф с масс-спектрометрическим детектированием), что позволяет рассматривать более широкий спектр соединений и соответственно их соотношений. Представляет интерес рассмотрение данной задачи на большем массиве данных, а также сопоставление полученных результатов с результатами анализа группы здоровых людей.
Исследования проводились в рамках выполнения проекта № FZEN-2020-0022 Минобрнауки РФ и при финансовой поддержке РФФИ, проект № 20-33-90033, с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета, уникальный идентификатор RFMEFI59317X0008.
Список литературы
Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2020 // CA – Cancer J. Clin. 2020. V. 70. № 1. P. 7.
Davidson M.R., Gazdar A.F., Clarke B.E. The pivotal role of pathology in the management of lung cancer // J. Thorac. Dis. 2013. V. 5. № S5. P. 463.
Chen Z., Fillmore C.M., Hammerman P.S., Kim C.F., Wong K. Non-small-cell lung cancers: A heterogeneous set of diseases // Nat. Rev. Cancer. 2014. V. 14. № 8. P. 535.
Chu G.C.W., Lazare K., Sullivan F. Serum and blood based biomarkers for lung cancer screening: A systematic review // BMC Cancer. 2018. V. 18. № 1. https://doi.org/10.1186/s12885-018-4024-3
Sun Y., Liu S., Qiao Z., Shang Z., Xia Z., Niu X., Qian L., Zhang Y., Fan L., Cao C., Xiao H. Systematic comparison of exosomal proteomes from human saliva and serum for the detection of lung cancer // Anal. Chim. Acta. 2017. V. 982. P. 84.
Ma L., Muscat J., Sinha R., Sun D., Xiu G. Proteomics of exhaled breath condensate in lung cancer and controls using data-independent acquisition (DIA): A pilot study // J. Breath Res. 2021. V. 15. https://doi.org/10.1088/1752-7163/abd07e
Marzorati D., Mainardi L., Sedda G., Gasparri R., Spaggiari L., Cerveri P. A review of exhaled breath key role in lung cancer diagnosis // J. Breath Res. 2019. V. 13. № 3. https://doi.org/10.1088/1752-7163/ab0684
Hua Q., Zhu Y., Liu H. Detection of volatile organic compounds in exhaled breath to screen lung cancer: A systematic review // Future Oncol. 2018. V. 14. № 16. P. 1647.
Xu M., Tang Z., Duan Y., Liu Y. GC-based techniques for breath analysis: Current status, challenges and prospects // Crit. Rev. Anal. Chem. 2016. V. 46. № 4. P. 291.
Ганеев А.А., Губаль А.Р., Лукьянов Г.Н., Арсеньев А.И., Барчук А.A., Джагацпанян И.Э., Горбунов И.С., Рассадина А.А., Немец В.М., Нефедов А.О., Коротецкий Б.А., Соловьев Н.Д., Iakovleva E., Иваненко Н.Б., Кононов А.С., Sillanpaa M., Seegerh Th. Анализ выдыхаемого воздуха как способ диагностики рака легких на ранних стадиях: возможности и проблемы // Успехи химии. 2018. Т. 87. № 9. С. 904. (Ganeev A., Gubal A., Lukyanov G., Arseniev A., Barchuk A., Jahatspanian I., Gorbunov I., Rassadina A., Nemets V., Nefedov A., Korotetsky B., Solovyev N., Iakovleva E., Ivanenko N., Kononov A., Sillanpaa M., Seeger Th. Analysis of exhaled air for early-stage diagnosis of lung cancer: opportunities and challenges // Russ. Chem. Rev. 2018. V. 87. № 9. P. 904.)
Wang M., Sheng J., Wu Q., Zou Y., Hu Y., Ying K., Wan H., Wang P. Confounding effect of benign pulmonary diseases in selecting volatile organic compounds as markers of lung cancer // J. Breath Res. 2018. V. 12. № 4. https://doi.org/10.1088/1752-7163/aad9cc
Phillips M., Gleeson K., Hughes J.M.B., Greenberg J., Cataneo R.N., Baker L., McVay W.P. Volatile organic compounds in breath as markers of lung cancer: a cross-sectional study // Early Report. 1999. V. 353. № 9168. P. 1930.
Rudnickaa J., Kowalkowskia T., Buszewski B. Searching for selected VOCs in human breath samples as potential markers of lung cancer // Lung Cancer. 2019. V. 135. P. 123.
Filipiak W., Filipiak A., Sponring A., Schmid T., Zelger B., Ager C., Klodzinska E., Denz H., Pizzini A., Lucciarini P., Jamnig H., Troppmair J., Amann A. Comparative analyses of volatile organic compounds (VOCs) from patients, tumors and transformed cell lines for the validation of lung cancer-derived breath markers // J. Breath Res. 2014. V. 8. № 2. https://doi.org/10.1088/1752-7155/8/2/027111
Mazzone P.J., Wang X.F., Xu Y., Mekhail T., Beukemann M.C., Na J., Kemling J.W., Suslick K.S., Sasidhar M. Exhaled breath analysis with a colorimetric sensor array for the identification and characterization of lung cancer // J. Thorac. Oncol. 2012. V. 7. № 1. P. 137.
Capuano R., Santonico M., Pennazza G., Ghezzi S., Martinelli E., Roscioni C., Lucantoni G., Galluccio G., Paolesse R., Natale C.D., D’Amico A. The lung cancer breath signature: a comparative analysis of exhaled breath and air sampled from inside the lungs // Sci. Rep. 2015. V. 5. https://doi.org/10.1038/srep16491
Chang J., Lee D., Ban S., Oh J., Jung M.Y., Kim S., Park S., Persaud K., Jheon S. Analysis of volatile organic compounds in exhaled breath for lung cancer diagnosis using a sensor system // Sens. Actuators B: Chem. 2018. V. 255. № 1. P. 800.
Saidi T., Moufid M., Beleño-Saenz K.J., Welearegay T.G., Bari N.E., Jaimes-Mogollon A.L., Ionescu R., Bourkadi J.E., Benamor J., Ftouh M. E., Bouchikhi B. Non-invasive prediction of lung cancer histological types through exhaled breath analysis by UV-irradiated electronic nose and GC/QTOF/MS // Sens. Actuators B: Chem. 2020. V. 311. https://doi.org/10.1016/j.snb.2020.127932
Nardi-Agmon I., Abud-Hawa M., Liran O., Gai-Mor N., Ilouze M., Onn A., Bar J., Shlomi D., Haick H., Peled N. Exhaled breath analysis for monitoring response to treatment in advanced lung cancer // J. Thorac. Oncol. 2016. V. 11. № 6. P. 827.
Li W., Liu H., Xie D., He Z., Pi X. Lung cancer screening based on type-different sensor arrays // Sci. Rep. 2017. V. 7. № 1. https://doi.org/10.1038/s41598-017-02154-9
Janssens E., Lamote K., Meerbeeck J.V., Brusselmans L. Breath analysis by ion mobility spectrometry allows to discriminate COPD from lung cancer patients // Eur. Respir. J. 2018. V. 52. № 62. https://doi.org/10.1183/13993003.congress-2018.PA1759
Sun Y., Chen Y., Sun C., Liu H., Wang Y., Jiang X. Analysis of volatile organic compounds from patients and cell lines for the validation of lung cancer biomarkers by proton-transfer-reaction mass spectrometry // J. Anal. Methods. 2019. V. 11. № 25. P. 3188.
Phillips M., Altorki N., Austin J.H., Cameron R.B., Cataneo R.N., Greenberg J., Kloss R., Maxfield R.A., Munawar M.I., Pass H.I., Rashid A., Rom W.N., Schmitt P. Prediction of lung cancer using volatile biomarkers in breath // Cancer Biomark. 2007. V. 3. № 2. P. 95.
Buszewski B., Ligor T., Jezierski T., Wenda-Piesik A., Walczak M., Rudnicka J. Identification of volatile lung cancer markers by gas chromatography–mass spectrometry: Comparison with discrimination by canines // Anal. Bioanal. Chem. 2012. V. 404. № 1. P. 141.
Sakumura Y., Koyama Y., Tokutake H., Hida T., Sato K., Itoh T., Akamatsu T., Shin W. Diagnosis by volatile organic compounds in exhaled breath from lung cancer patients using support vector machine algorithm // Sensors. 2017. V. 17. № 287. https://doi.org/10.3390/s17020287
Song G., Qin T., Liu H., Xu G.B., Pan Y.Y., Xiong F.X., Gu K.S., Sun G.P., Chen Z.D. Quantitative breath analysis of volatile organic compounds of lung cancer patients // Lung Cancer. 2010. V. 67. № 2. P. 227.
Gashimova E., Temerdashev A., Porkhanov V., Polyakov I., Perunov D., Azaryan A., Dmitrieva E. Investigation of different approaches for exhaled breath and tumor tissue analyses to identify lung cancer biomarkers // Helyion. 2020. V. 6. № 6. https://doi.org/10.1016/j.heliyon.2020.e04224
Smith D., Spanel P. Pitfalls in the analysis of volatile breath biomarkers: Suggested solutions and SIFT–MS quantification of single metabolites // J. Breath Res. 2015. V. 9. № 2. https://doi.org/10.1088/1752-7155/9/2/022001
Акопов А. Cовременные подходы к классификации рака легкого // Врач. 2011. № 12. С. 7.
Гашимова Э.М., Темердашев А.З., Порханов В.А., Поляков И.С., Перунов Д.В., Азарян А.А., Дмитриева Е.В. Оценка возможности газохроматографического определения летучих органических соединений в выдыхаемом воздухе для неинвазивной диагностики рака легких // Журн. аналит. химии. 2019. Т. 74. № 5. С. 365.
Ulanowska A., Kowalkowski T., Trawińska E., Buszewski B. The application of statistical methods using VOCs to identify patients with lung cancer // J. Breath Res. 2011. V. 5. № 4. https://doi.org/10.1088/1752-7155/5/4/046008
Ligor M., Ligor T., Bajtarevic A., Ager C., Pienz M., Klieber M., Denz H., Fiegl M., Hilbe W., Weiss W., Lukas P., Jamnig H., Hackl M., Buszewski B., Miekisch W., Schubert J., Amann A. Determination of volatile organic compounds in exhaled breath of patients with lung cancer using solid phase microextraction and gas chromatography mass spectrometry // J. Clin. Chem. Lab. Med. 2009. V. 47. № 5. P. 550.
Bajtarevic A., Ager C., Pienz M., Klieber M., Schwar K., Ligor M., Ligor T., Filipiak W., Denz H., Fieg M., Hilbe W., Weiss W., Lukas P., Jamnig H., Hack M., Haidenberger A., Buszewski B., Miekisch W., Schubert J., Amann A. Noninvasive detection of lung cancer by analysis of exhaled breath // BMC Cancer. 2009. V. 9 № 348. https://doi.org/10.1186/1471-2407-9-348
Fu X., Li M., Knipp R.J., Nantz M.H., Bousamra M. Noninvasive detection of lung cancer using exhaled breath // Cancer Med. 2014 V. 3. № 1. P. 174.
Poli D., Goldoni M., Corradi M., Acampa O., Carbognani P., Internullo E., Casalini A., Mutti A. Determination of aldehydes in exhaled breath of patients with lung cancer by means of on-fiber-derivatisation SPME-GH/MS // J. Chromatogr. B. 2010. V. 878. № 27. P. 2643.
Song G., Qin T., Liu H., Xu G.B., Pan Y.-Y., Xiong F.X., Gu K.S., Sun G.P., Chen Z.-D. Quantitative breath analysis of volatile organic compounds of lung cancer patients // Lung Cancer. 2010. V.67. № 2. P. 227.
Ligor T., Pater L., Buszewski B. Application of an artificial neural network model for selection of potential lung cancer biomarkers // J. Breath Res. 2015. V. 9. № 2. https://doi.org/10.1088/1752-7155/9/2/027106
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


