Журнал аналитической химии, 2021, T. 76, № 9, стр. 859-864
Экстракционное вымораживание с центрифугированием – новая технология пробоподготовки в химическом анализе на примере органических оснований
a Сочинский государственный университет, инженерно-экологический факультет
354000 Сочи, ул. Пластунская, 94, Россия
b Научно-исследовательский центр курортологии и реабилитации, филиал “Северо-Кавказского федерального научно-клинического центра Федерального медико-биологического агентства”
354000 Сочи, ул. Несебрская, 22, Россия
* E-mail: vic-bekhterev@yandex.ru
Поступила в редакцию 24.03.2021
После доработки 21.04.2021
Принята к публикации 21.04.2021
Аннотация
Изучено влияние рН на эффективность извлечения органических оснований и линдана из водных растворов экстракционным вымораживанием в ацетонитрил в условиях центрифугирования. Продемонстрированы технологические возможности и преимущества такого способа пробоподготовки при определении органических веществ в водосодержащих средах. В комбинации с газовой хроматографией одностадийное экстракционное вымораживание в режиме центрифугирования пробы обеспечивает минимальные пределы обнаружения в 10 мл питьевой воды, мг/л: анилина 0.1, дифениламина 0.05, кофеина 0.015 и линдана 0.001. Разработанная технология экстракции проста и выполняется в одну стадию. Продолжительность пробоподготовки не превышает 30 мин, расход экстрагента менее 1 мл.
Несмотря на очевидный прогресс в развитии инструментальных методов анализа, определение растворенных органических соединений в водных средах часто связано с необходимостью использования предварительной сепарации и концентрирования. Это особенно актуально в случае низких концентраций растворенных полярных ионогенных веществ. Традиционные жидкостная, твердофазная и газовая экстракция, а также их различные варианты [1–4] основаны на принципе извлечения целевых веществ из одной фазы в другую через границу раздела. Все перечисленные выше способы экстракции предполагают контакт несмешивающихся водной фазы и экстрагента, в качестве которого могут быть использованы нерастворимая в воде органическая жидкость, сорбент или газ. Предложенный в 2005 г. метод экстракционного вымораживания (ЭВ) основан на другом подходе [5, 6]. В данном способе экстракция сочетается с вымораживанием: происходит низкотемпературное извлечение целевых компонентов за счет распределения растворенных веществ между жидкой фазой (предварительно добавленный незамерзающий водорастворимый растворитель) и образующейся во время замораживания твердой фазой льда. Граница раздела фаз появляется в исходно гомогенной смеси экстрагента с водным раствором в результате охлаждения, когда образуется лед. Экстракционное вымораживание в режиме воздействия поля центробежных сил (ЭВЦ) позволяет значительно увеличить степень концентрирования аналитов в экстракте, упростить процедуру, сократить продолжительность этапа пробоподготовки и материальные затраты [7–9].
Способ ЭВЦ позволяет применять гидрофильные, водорастворимые экстрагенты без дополнительной химической модификации пробы (без высаливания). В отличие от твердофазной и жидкостной экстракции, он дает возможность напрямую без каких-либо дополнительных операций (без фильтрования) извлекать целевые вещества из сильно загрязненных дисперсных систем. Получаемые экстракты практически не содержат воды и могут быть сразу проанализированы методом газовой хроматографии. За счет значительного снижения химического фона эндогенных соэкстрагирующихся веществ при ЭВЦ-подготовке биологических проб улучшаются условия газохроматографической (ГХ) с масс-спектрометрическим детектированием идентификации и уменьшается загрязнение МС-детектора. Метод способствует улучшению условий труда, так как наряду с минимизацией количества реактивов значительно уменьшается летучесть растворителей и аналитов. Достоинства способа ЭВЦ иллюстрируют разработанные схемы анализа и методики определения ряда органических соединений в биологических и иных объектах [5–16].
К настоящему времени на основе экспериментальных результатов созданы теоретические основы метода. Предложенная модель базируется на подобии процессов ЭВ и адсорбции [6, 10]. Предполагается, что при охлаждении смеси водного раствора с экстрагентом молекулы аналита выталкиваются на поверхность образующихся кристаллов воды и десорбируются в объем незамерзающей органической жидкой фазы экстрагента. Одновременно протекает и обратный процесс: молекулы аналита сорбируются поверхностью кристаллов льда.
Линейная зависимость концентрации аналита сорг в экстракте от величины mo/Vэкстр, где mo – масса аналита в исходной пробе, а Vэкстр – объем экстрагента, которую предполагает модель экстракции с ЭВ, подтверждена большим массивом экспериментальных результатов [6, 9, 10, 14, 16]. Угловой коэффициент *Kравн этой зависимости фактически является индивидуальным адсорбционным параметром аналита, зависящим от его физико-химических свойств и природы экстрагента. Величина *Kравн характеризует эффективность извлечения аналита и по сути является коэффициентом распределения аналита между незамерзающим экстрагентом (жидкая фаза) и поверхностью льда (твердая фаза), поскольку пропорционален константе адсорбционно-десорбционного равновесия Kравн. Эту величину используют для характеристики эффективности ЭВЦ.
Установлено, например, что в гомологическом ряду одноосновных карбоновых кислот С2–С8 коэффициент распределения *Kравн растет с увеличением длины молекулы кислоты [9, 16] и с увеличением гидрофобности аналита подобно известной для них зависимости Ганча–Лео. Существенному возрастанию *Kравн, а следовательно, и повышению эффективности экстракции способствует также проведение процесса в условиях действия поля центробежных сил [7–9]. Показано, что при использовании ацетонитрила в качестве экстрагента величина *Kравн практически равна степени извлечения R (R = mэкстр/mo, где mэкстр – это масса аналита в экстракте), поскольку содержание воды в экстракте не превышает 4% [9, 14, 17]. Одноосновные карбоновые кислоты С4–С8 извлекаются из водного раствора полностью даже при соотношении объемов воды и ацетонитрила 10 : 0.4 [9].
Управление избирательностью (селективностью) метода ЭВ основано на выборе экстрагента [16] и условий осуществления процедуры, например рН [14, 16].
В настоящей работе изучено влияние рН на эффективность ЭВ некоторых органических оснований, а также линдана, из водных растворов в режиме действия центробежных сил (ЭВЦ). Исследование корреляций и установление закономерностей экстракции актуально для выявления возможностей технологии и оптимизации процедуры пробоподготовки. Это важно также для прогнозирования поведения экстракционных систем расчетными методами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Использовали анилин (ХромЛаб, Россия), дифениламин (ЛенРеактив, Россия), линдан (гамма-1,2,3,4,5,6-гексахлорциклогексан) (ОПТИМУМ, Россия), ацетонитрил марки “Сорт 0” (ООО “НПК Криохром”, Россия). Все применяемые реактивы были аналитической чистоты.
Аппаратура. Для приготовления модельных и стандартных растворов органических веществ, определения массы получаемого экстракта использовали аналитические весы ЛВ-210-А (ЗАО “Сартогосм”, С.-Петербург, Россия) с погрешностью взвешивания, не превышающей 0.5 мг. Получаемые экстракты и стандартные смеси исследовали методом газовой хроматографии на хроматографах “Кристаллюкс-4000М” с термоионным (ГХ-ТИД), пламенно-ионизационным (ГХ-ПИД) и электронно-захватным (ГХ-ЭЗД) детекторами отечественного производства и капиллярной колонкой ZB-5 длиной 30 м, внутренним диаметром 0.32 мм (Phenomenex, США).
Методика эксперимента. Процедура проведения экстракционного вымораживания в условиях одновременного центрифугирования детально описана в работах [7–9]. Исследуемые образцы модельных водных растворов аналитов готовили добавлением к определенному объему воды в стеклянной виале емк. 12 мл при заданном значении рН необходимого количества стандартного раствора аналита в ацетонитриле. Затем добавляли требуемое количество ацетонитрила, используемого в качестве экстрагента. Объем растворителя, вносимый со стандартным раствором аналита, учитывали в расчетах при обработке результатов ЭВЦ. Регулировали рН добавлением растворов серной кислоты и гидроксида натрия. Флакон герметично закрывали завинчивающейся пробкой. Перемешивали и помещали в ротор криоэкстрактора ЭВЦ-2 (ООО “НПФ “Мета-хром”, Россия) для вымораживания водной части образца. Условия проведения процедуры ЭВЦ: температура минус 29 ± 2°С, скорость вращения ротора 4000 об/мин (центробежное ускорение 1650 g), продолжительность процедуры 25 мин. После этапа ЭВЦ верхний, жидкий ацетонитрильный слой отделяли декантацией, взвешивали и подвергали ГХ-анализу.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее на примере одноосновных карбоновых кислот С2–С8 установлено, что эффективность экстракции падает при переходе от кислой среды к щелочной. Например, при изменении рН от 3 до 10–12 степень концентрирования уксусной кислоты сорг/сo во время ЭВ снижается в 150 раз [16]. Данный факт можно объяснить с позиции роста степени ионизации карбоновых кислот при смещении в щелочную область, что согласно модели приводит к увеличению их сорбции на поверхности кристаллов льда из жидкой органической фазы (экстракт). Лед выступает в роли полярного сорбента в соответствии с физико-химическими свойствами молекулы воды. Этот результат вполне закономерен как с точки зрения теории адсорбции, так и по аналогии с жидкостной хроматографией на полярных сорбентах [18]. Кроме того, в данном случае в процессе ЭВ поверхность льда дополнительно модифицирована щелочью.
Как видно из рис. 1, 2, при ЭВЦ органических оснований, аминов ситуация выглядит иным образом. Углы наклона линейных графиков, т.е. коэффициенты распределения *Kравн анилина и дифениламина между объемом жидкой фазы экстракта и поверхностью образующегося в результате ЭВЦ льда, при переходе из кислой среды в щелочную постепенно растут. Следовательно, увеличивается и эффективность экстракции. Аналогично анилин и дифениламин ведут себя и при жидкостной экстракции из воды [19]. Это согласуется с представлениями о закономерностях экстракции органических оснований из водных сред [20].
Рис. 1.
Зависимость концентрации анилина в экстракте сорг от его исходной массы mo в воде и объема ацетонитрила Vэкстр в результате экстракционного вымораживания в режиме воздействия поля центробежных сил при разных значениях рН. Мольная доля ацетонитрила в воде 0.027.
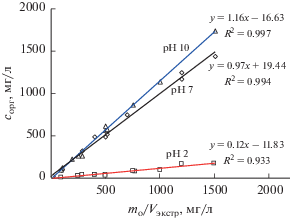
Рис. 2.
Зависимость концентрации дифениламина в экстракте сорг от его исходной массы mo в воде и объема ацетонитрила Vэкстр в результате экстракционного вымораживания в режиме воздействия поля центробежных сил при разных значениях рН. Мольная доля ацетонитрила в воде 0.027.
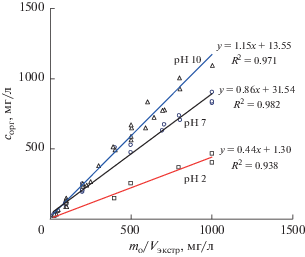
Вместе с тем, если при рН 10 анилин и дифениламин с учетом погрешности эксперимента имеют практически одинаковые значения *Kравн, то эффективность их извлечения ацетонитрилом из кислой среды заметно отличается. Коэффициент распределения из кислой среды дифениламина равен 0.44, что значительно больше, чем для анилина. Следовательно, в этом случае при рН 2 дифениламин лучше экстрагируется из воды, чем анилин, значение *Kравн которого достигает лишь 0.12. Данный факт можно объяснить с точки зрения общей тенденции роста эффективности ЭВЦ органических соединений с ростом гидрофобности [6, 9]. Действительно, более гидрофобным в этом случае является дифениламин, поскольку его параметр lgPо-в составляет 3.4 и существенно больше, чем в случае анилина 0.9 [21]. На меньшую гидрофобность аналина также указывает его более высокая растворимость в воде [21].
Величина рН может влиять на эффективность экстракции аналита из воды в процессе ЭВ не напрямую в зависимости от степени ионизации его молекулы, а за счет изменения структуры льда. Такой вывод сделан на основании изучения закономерности ЭВЦ кофеина из водных растворов. Кофеин обладает основными свойствами, хотя и менее выраженными, чем анилин и дифениламин, поскольку имеет в молекуле три аминных атома азота. Установлено, что, коэффициент распределения кофеина *Kравн достигает максимального значения при рН 7 [14]. Из щелочной и кислой сред при прочих равных условиях методом ЭВЦ кофеин извлекался хуже, чем из нейтральной. Иными словами, сорбционные свойства поверхности льда, полученного в нейтральной среде (рН 7) выражены слабее. Данный эффект не зависит от исходного соотношения объемов экстрагента ацетонитрила и водного раствора.
Дополнительным аргументом в пользу справедливости сделанного вывода могут быть результаты аналогичного исследования эффективности ЭВЦ линдана (гамма-гексахлорциклогексан) из воды. Его молекула не имеет ионогенных групп, поэтому можно было ожидать отсутствия влияния рН на эффективность его ЭВЦ из воды в ацетонитрил. Однако, как следует из сравнения зависимостей сорг от mo/Vэкстр (рис. 3), максимальная эффективность ЭВЦ линдана из воды в ацетонитрил достигается при рН 7 подобно кофеину.
Рис. 3.
Зависимость концентрации линдана в экстракте сорг от его исходной массы mo в воде и объема ацетонитрила Vэкстр в результате экстракционного вымораживания в режиме воздействия поля центробежных сил при разных значениях рН. Мольная доля ацетонитрила в воде 0.027.
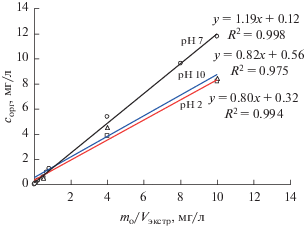
Обращает на себя внимание еще один интересный экспериментальный факт. Как видно из рис. 3, коэффициенты распределения линдана *Kравн (углы наклона линейных зависимостей), в отличие от всех других протестированных аналитов, в кислой и щелочной средах практически совпадают. По-видимому, это обусловлено его молекулярным строением, а именно, отсутствием кислотных и основных свойств.
Ранее показано [14], что величина *Kравн ≥ 1 свидетельствует о полном извлечении аналита в процессе ЭВЦ из воды в ацетонитрил и заметной его поверхностной активности на границе раздела воздух–экстракт. В таком случае можно сделать вывод, что линдан при рН 7, а также анилин и дифениламин при рН 10 полностью извлекаются в процессе ЭВЦ из воды уже при соотношении объемов воды и экстрагента 9.72 : 0.78 (мольная доля ацетонитрила в воде 0.027).
В табл. 1 представлены данные о пределах определения изученных аналитов в водопроводной воде в результате одноразовой процедуры ЭВЦ в качестве метода пробоподготовки. Из таблицы следует, что метод ЭВЦ обеспечивает быстрое (время пробоподготовки не превышает 25 мин) определение указанных аналитов в воде на уровне предельных норм, действующих в Российской Федерации на настоящий момент. Для исследования требуется малое количество образца (не более 10 мл) и экстрагента (0.5–0.8 мл). Кроме того, одностадийная пробоподготовка без каких-либо дополнительных манипуляций с экстрактом снижает погрешность определения аналитов. После 25 мин ЭВЦ-пробоподготовки остается только лишь декантировать экстракт с поверхности льда. С учетом перечисленных выше достоинств рассматриваемого способа экстракции есть все основания полагать, что он в ближайшее время будет востребован в качестве метода пробоподготовки при контроле различных органических веществ в воде, почве, донных отложениях и биологических объектах. На рис. 4 представлены фотографии, сделанные при пробоподготовке различных объектов анализа.
Таблица 1.
Определение аналитов в водных растворах методом экстракционного вымораживания в условиях центрифугирования образца (ЭВЦ) в комбинации с газовой хроматографией
| Аналит | Метод детектирования | Соотношение вода : ацетонитрил (по объему) | Масса экстракта, г | Предел определения в воде cн вод, мг/л | ПДК в воде, мг/л [22] |
|---|---|---|---|---|---|
| Анилин | ГХ-ТИД | 10 : 0.4 (рН 10) | 0.024 ± 0.003 | 0.1 | 0.1 |
| Дифениламин | ГХ-ПИД | 10 : 0.5 (рН 10) | 0.052 ± 0.004 | 0.05 | 0.05 |
| Кофеин | ГХ-ТИД | 9.72 : 0.78 (рН 7) | 0.07 ± 0.01 | 0.015 | – |
| Линдан | ГХ-ЭЗД | 9.72 : 0.78 (рН 7) | 0.058 ± 0.005 | 0.001 | 0.02 |
Рис. 4.
Фотографии анализируемых образцов после этапа экстракционного вымораживания в режиме воздействия поля центробежных сил.
Важно также, что, в отличие от жидкостно-жидкостной экстракции, при анализе водных растворов на этапе пробоподготовки методом ЭВЦ с использованием ацетонитрила не требуется тщательного перемешивания смеси водного раствора и экстрагента, поскольку ацетонитрил неограниченно растворим в воде при комнатной температуре.
Экспериментально установленные пределы определения аналитов в воде (табл. 1) в случае необходимости можно дополнительно снизить путем выполнения процедуры ЭВЦ-пробоподготовки одновременно нескольких проб исследуемого объекта (в роторе криоэкстрактора ЭВЦ-2 восемь посадочных мест). После процедуры пробоподготовки следует объединить полученные экстракты, при этом контролируя их массу взвешиванием, и сконцентрировать путем упаривания. Продолжительность анализа существенно не возрастет, поскольку объем экстракта (масса) составляет менее 1 мл (см. табл. 1).
* * *
Таким образом, на примере нескольких органических оснований и линдана получены новые данные об экстракционном вымораживании органических веществ из водных растворов в условиях центрифугирования образца. Подтверждено, что предложенный новый метод экстракции обладает высокой эффективностью извлечения. Показано, что изменение рН среды влияет на эффективность экстракционного вымораживания. В целом для относительно сильных оснований эффективность экстракции изменяется в соответствии с известной для жидкостной экстракции и сорбции закономерностью, возрастая при переходе в щелочную среду. Вместе с тем экспериментально установлено, что в случае неионогенных аналитов, таких как линдан, и слабых оснований на эффективность экстракции могут влиять особенности формирования твердой фазы льда. Закономерности экстракционного вымораживания из водных растворов кофеина и линдана объяснены в рамках выдвинутой ранее теоретической модели. Благодаря высокой эффективности экстракции, сокращению числа стадий и затрат времени, количества реагентов, метод ЭВЦ перспективен для внедрения в качестве предварительного этапа подготовки пробы в химическом анализе. Кроме того, компактность созданного на его основе криоэкстрактора ЭВЦ-2 и малый расход экстрагента позволят применять такой аппарат в передвижных мобильных лабораториях при мониторинге загрязнения окружающей среды.
Часть исследований проведена с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Koning S., Janssen H.-G., Brinkman U.A.Th. Modern methods of sample preparation for GC analysis // Chromatographia Supplement. 2009. V. 69. P. 33.
Raynie D.E. Modern extraction techniques // Anal. Chem. 2010. V. 82. № 12. P. 4911.
Ballesteros-Gomez A., Rubio S. Recent advances in environmental analysis // Anal. Chem. 2011. V. 83. P. 4579.
Цизин Г.И. Развитие методов концентрирования микрокомпонентов в России (1991–2010 гг.) // Журн. аналит. химии. 2011. Т. 66. № 11. С. 1135. (Tsysin G.I. Method of the preconcentration of trace components: Development in Russia (1991–2010) // J. Anal. Chem. 2011. V. 66. № 11. P. 1020.)
Бехтерев В.Н. Способ извлечения органических веществ из водных сред экстракцией в сочетании с вымораживанием. Патент на изобретение № 2303476 РФ // Б. и. 2007. № 21. Приоритет 27.04.2005.
Bekhterev V.N. Extractive freezing-out in the analysis of organic compounds in the aqueous media // Mendeleev Commun. 2007. V. 17. P. 241.
Бехтерев В.Н. Способ извлечения органических веществ из водных сред экстракционным вымораживанием в поле центробежных сил. Патент на изобретение № 2564999 РФ // Б. и. 2015. № 28. Приоритет 14.04.2014.
Bekhterev V.N. A method of recovery of organic substances from aqueous media by freeze-out extraction under the action of a centrifugal force. Patent EP3357873 // European Patent Bulletin. 2019. № 45. P. 940. Priority date 28.09.2015.
Бехтерев В.Н. Экстракционное вымораживание одноосновных карбоновых кислот из воды в ацетонитрил в условиях действия центробежных сил // Журн. физ. химии. 2016. Т. 90. С. 1558. (Bekhterev V.N. Freeze-out extraction of monocarboxylic acids from water into acetonitrile under the action of centrifugal forces // Russ. J. Phys. Chem. A. 2016. V. 90. P. 2055.)
Бехтерев В.Н. Выделение фенолов из воды экстракционным вымораживанием // Журн. аналит. химии. 2008. Т. 63. № 10. С. 1045. (Bekhterev V.N. Recovery of phenols from water by extraction freezing // J. Anal. Chem. 2008. V. 63. № 10. P. 950.)
Бехтерев В.Н., Гаврилова С.Н., Кошкарева Е.В., Шипанов И.Н. Газохроматографическое определение пировалерона в моче методом экстракционного вымораживания в сочетании с центрифугированием // Судебно-медицинская экспертиза. 2017. Т. 60. № 3. С. 27.
Бехтерев В.Н., Гаврилова С.Н., Шипанов И.Н. Применение экстракционного вымораживания на этапе предварительной подготовки биопроб в ГХ−МС химико-токсикологическом анализе // Судебно-медицинская экспертиза. 2019. Т. 62. № 6. С. 53. (Bekhterev V.N., Gavrilova S.N., Shipanov I.N. The use of extractive freezing-out at the stage of preliminary preparation of bioprobes in GC−MS chemico-toxicological analysis // Sudebno-Meditsinskaya Ekspertisa. 2019. V. 62. № 6. P. 53.)
Bekhterev V.N., Malyarovskaya V.I. Rapid HPLC method of scopoletine determination in Weigela leaves based on one-step sample preparation by extractive freezing-out // Mendeleev Commun. 2019. V. 29. P. 592.
Бехтерев В.Н. Экстракционное вымораживание кофеина из водных растворов в условиях действия поля центробежных сил // Журн. аналит. химии. 2020. Т. 75. № 9. С. 771. (Bekhterev V.N. Extractive freezing-out of caffeine from aqueous solutions in a centrifugal force field // J. Anal. Chem. 2020. V. 75. № 9. P. 1103.)
Темердашев З.А., Червонная Т.А., Мусорина Т.Н., Бехтерев В.Н. Пробоподготовка почв и донных отложений с использованием техники экстракционного вымораживания при хроматомасс-спектрометрическом определении ПАУ // Аналитика и контроль. 2020. Т. 24. № 4. С. 287. (Temerdashev Z.A., Chervonnaya T.A., Musorina T.N., Bekhterev V.N. Sample preparation of soils and bottom sediments for gas chromatography–mass spectrometry determination of PAHs // Analitika i kontrol’ [Analytics and Control]. 2020. V. 24. P. 287.)
Бехтерев В.Н. Закономерности поведения растворенных органических веществ в условиях экстракционного вымораживания // Журн. аналит. химии. 2011. Т. 66. № 6. С. 608. (Bekhterev V.N. Trends in the behavior of dissolved organic substances under the conditions of freeze extraction // J. Anal. Chem. 2011. V. 66. № 6. P. 591.)
Schneider G.M. Aqueous solutions at pressures up to 2 GPa: gas–gas equilibria, closed loops, high-pressure immiscibility, salt effects and related phenomena // Phys. Chem. Chem. Phys. 2002. V. 4. P. 845.
Dmitrienko S.G., Zolotov Yu.A. Polyurethane foams in chemical analysis: Sorption of various substances and its analytical applications // Russ. Chem. Rev. 2002. V. 71. № 2. P. 159.
Wenshuai C., Xinyan Z., Wei L., Weidong Z., Zhiyong Z., Zhongqi R. Extraction of aniline from wastewater: Equilibria, model, and fitting of apparent extraction equilibrium constants // RSC Adv. 2016. V. 6. P. 6125.
Коренман И.М. Экстракция в анализе органических веществ. М.: Химия. 1977. 200 с.
Berthod A., Carda-Broch S. Determination of liquid–liquid partition coefficients by separation methods // J. Chromatogr. A. 2004. V. 1037. P. 3.
Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. Гигиенические нормативы ГН 2.1.5.1315-03.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


