Журнал аналитической химии, 2022, T. 77, № 1, стр. 28-38
Обнаружение следовых количеств взрывчатых веществ в присутствии молочной кислоты методом спектрометрии ионной подвижности
Т. И. Буряков a, *, И. А. Буряков a, **
a Научно-исследовательский технологический институт им. А.П. Александрова
188540 Ленинградская обл., Сосновый Бор, Копорское шоссе, 72, Россия
* E-mail: buryakovti@gmail.com
** E-mail: buryakovia@gmail.com
Поступила в редакцию 07.05.2021
После доработки 03.06.2021
Принята к публикации 03.06.2021
- EDN: XSYQDU
- DOI: 10.31857/S0044450221120033
Аннотация
Исследовано влияние потожировых отложений отпечатка пальца на эффективность обнаружения следовых количеств гексогена, динитронафталина, 2,4-динитротолуола, пентаэритриттетранитрата, тетрила, 1,3,5-тринитробензола, тринитрорезорцина, 2,4,6-тринитротолуола и 2,4,6-тринитрофенола методом спектрометрии ионной подвижности с ионизацией при атмосферном давлении в отрицательной моде в воздушной среде. Основным компонентом отпечатка, который может оказывать это влияние, является молочная (2-гидроксипропановая) кислота. Показано, что наличие в пробе молочной кислоты или отпечатка пальца заметно не влияет на эффективность регистрации тетрила; изменяет качественный состав ионов пентаэритриттетранитрата и гексогена, вызывая появление в спектре интенсивных пиков, предположительно, аддукт-ионов этих веществ с молекулами молочной кислоты; сильно уменьшает эффективность образования ионов других взрывчатых веществ. Пределы обнаружения следовых количеств гексогена, динитронафталина, 2,4-динитротолуола, пентаэритриттетранитрата, тетрила, 1,3,5-тринитробензола, тринитрорезорцина и 2,4,6-тринитротолуола равны 1, 2.5, 3, 4, 0.7, 5, 20 и 0.5 нг, а этих же веществ в присутствии отпечатка пальца с обильными потожировыми отложениями – равны 0.5, 2000, 1 × 105, 2, 0.7, 5000, 300 и 100 нг соответственно. Предел обнаружения ТНФ равен 30 нг, а в присутствии отпечатка пальца не установлен.
Наиболее простыми, чувствительными и широко распространенными методами обнаружения взрывчатых веществ (ВВ) являются методы, использующие ионизацию при атмосферном давлении (ИАД) в отрицательной моде с последующими разделением и идентификацией ионов с помощью спектрометрии ионной подвижности, спектрометрии приращения ионной подвижности или масс-спектрометрии [1–5]. В настоящее время спектрометрия ионной подвижности (СИП) является одной из самых эффективных технологий оперативного обнаружения и идентификации следов ВВ. Эта технология включает: отбор и термодесорбцию потенциально содержащей следы ВВ конденсированной пробы в газообразное состояние, ионизацию газообразной пробы, разделение образующихся ионов по скорости их движения в газе под действием электрического поля, регистрацию разделенных ионов в виде совокупности пиков – спектра.
Формирование ионов газообразной пробы при ИАД происходит в две стадии. На первой стадии происходит образование реактант-ионов из атомов и молекул газовой матрицы, на второй – образование ионов десорбированных веществ за счет ион-молекулярных реакций реактант-ионов с молекулами этих веществ. В работах [6, 7] описаны типичные механизмы образования реактант-ионов в отрицательной моде ИАД на основе коронного разряда:
(2)
${\text{NO}}_{{\text{2}}}^{ - } + {\text{M}} \to {{{\text{[M}} + {\text{NO}}{}_{{\text{2}}}{\text{]}}}^{ - }},$(3)
${\text{NO}}_{{\text{3}}}^{ - } + {\text{M}} \to {{{\text{[M}} + {\text{NO}}{}_{{\text{3}}}{\text{]}}}^{ - }},$(4)
${\text{M}} + {{{\text{e}}}^{ - }} \to {\text{N}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{[M}} - {\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{]}}}^{ - }},$При наличии в газообразной пробе нескольких веществ с высокой концентрацией возможно их взаимное влияние в процессе ионообразования. Это проявляется, например, при анализе отпечатка пальца (ОП) человека с потожировыми отложениями (ПЖО), имевшего контакт с зарядом взрывчатого вещества. Основным компонентом ПЖО, который может воздействовать на обнаружение взрывчатых веществ, является молочная (2-гидроксипропановая) кислота (МК). Например, показано [4], что при ионизации в коронном разряде паров гексогена в воздухе при некоторой концентрации МК вместо образования ионов ${{{\text{[M}} + {\text{NO}}{}_{{\text{2}}}{\text{]}}}^{ - }}$ вследствие реакции (2) молекулы этого ВВ образуют аддукт-ионы в реакциях электрофильного присоединения ионов молочной кислоты:
(5)
${\text{M}} + {{{\text{[MK}} - {\text{H]}}}^{ - }} \to {{{\text{[M}} + {\text{MK}} - {\text{H]}}}^{ - }}.$Эффективность образования тех или иных типов ионов зависит от концентрации паров молочной кислоты. В отсутствие паров МК доминирующим типом ионов в масс-спектре являлся [M + NO2]–, а при концентрации МК выше 1 млн–1 – [M + МК – H]–. Максимальное значение интенсивности тока ионов [M + МК–H]–, достигающее насыщения при концентрации МК выше 15 млн–1, было в несколько раз выше максимального значения интенсивности тока ионов [M + NO2]–, регистрируемого в отсутствие паров МК. Причем с ростом концентрации паров МК интенсивность ионов [M + NO2]– уменьшалась вплоть до двух порядков. На основе полученных в работе [4] результатов сделан общий вывод о том, что МК модифицирует качественный состав ионов гексогена. В то же время обнаружено [7], что присутствие МК может подавлять образование ионов некоторых ВВ, например этиленгликольдинитрата, вступая в конкурирующие реакции с реактант-ионами.
В СИП разделение образовавшихся ионов по типам проводят в дрейфовой камере, представляющей собой полость, образованную системой электродов, поддерживающих внутри полости однородное электрическое поле E (рис. 1). Полость продувается потоком дрейфового газа. На входном торце полости перпендикулярно оси расположен сеточный ионный затвор. Ввод ионов в пространство дрейфа осуществляют импульсно открытием затвора. Под действием поля ионы приобретают скорость, пропорциональную их подвижности, дрейфуют и разделяются на пакеты. Регистрируют величину ионного тока в зависимости от времени дрейфа, I(td) – спектр. Начало отсчета времени – момент открытия затвора, конец отсчета времени – момент, когда последний пакет ионов покинул пространство дрейфа. Тип ионов характеризует величина, определяемая как среднее время дрейфа пакета ионов i-го типа через пространство дрейфа:
(6)
${{t}_{{di}}} = {{{{l}_{d}}} \mathord{\left/ {\vphantom {{{{l}_{d}}} {\left( {{{K}_{i}}E} \right)}}} \right. \kern-0em} {\left( {{{K}_{i}}E} \right)}} = {{l_{d}^{2}} \mathord{\left/ {\vphantom {{l_{d}^{2}} {\left( {{{K}_{i}}U} \right)}}} \right. \kern-0em} {\left( {{{K}_{i}}U} \right)}},$(7)
${{K}_{{0i}}} = {{K}_{i}}({{273.15} \mathord{\left/ {\vphantom {{273.15} T}} \right. \kern-0em} T})({P \mathord{\left/ {\vphantom {P {760}}} \right. \kern-0em} {760}}),$Рис. 1.
Схема спектрометра ионной подвижности: 1 – термодесорбер, 2 – салфетка с конденсированной пробой, 3 – узел ионизации на основе импульсного коронного разряда, 4 – ионный затвор, 5 – электроды, 6 – изоляторы, 7 – коллектор ионов, 8 – электрометр.

Рис. 2.
Фрагменты спектров смеси веществ, десорбируемых с поверхности салфетки: смесь ВВ (а), смесь ВВ и МК (б). Массы, нг: ДНТ – 20, ТНТ – 20, тетрил – 10, гексоген – 10, ПЭТН – 40, МК – 78.4. Ионы веществ: 1 – окружающий воздух (реактант-ионы), 2 – ДНТ, 3 – МК, 4 – ТНТ, 5 – тетрил, 6 – гексоген, 7 – ПЭТН.
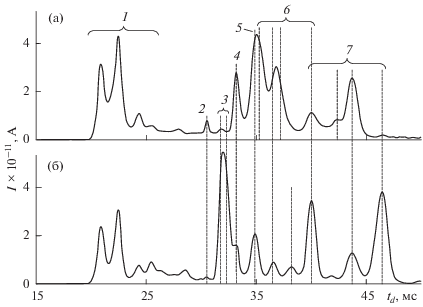
Рис. 3.
Зависимости амплитуды от времени Ai (t) ионных пиков [M + NO2]– гексогена (1), [M – H]– МК (2), [M – H]– ТНТ (3), [M – NO2]– тетрила (4), ТНР (5), [M – H]– ДНТ (6) и [M + NO3]– ПЭТН (7) при десорбции с поверхности салфеток следовых количеств индивидуальных веществ массами 2, 2, 0.5, 1, 5, 1 и 3 нг соответственно, а также пиков гексогена [M + + МК – H]– (8) или тетрила [M – NO2]– (9) массой 1 нг при их десорбции с поверхности салфетки одновременно с отпечатком пальца.

В табл. 1 приведены опубликованные значения приведенных коэффициентов подвижности K0i или времен дрейфа tdi, отношений массы к заряду m/z и предполагаемые типы ионов средне- и малолетучих ВВ – 2,4-динитротолуола (ДНТ), 1,3,5-тринитробензола (ТНБ), 2,4,6-тринитротолуола (ТНТ), N‑метил-N,2,4,6-тетранитроанилина (тетрил), пентаэритриттетранитрата (ПЭТН), циклотриметилентринитрамина (гексоген), а также молочной кислоты (МК), образующихся в воздухе в отрицательной моде ИАД [4, 7–12]. Представленные данные свидетельствуют о том, что присутствие молочной кислоты может существенно влиять на качественный состав ионов, ионизационную эффективность их регистрации, чувствительность и пределы обнаружения следовых количеств взрывчатых веществ.
Таблица 1.
Приведенные коэффициенты подвижности K0i или времена дрейфа tdi ионов взрывчатых веществ и молочной кислоты, отношения массы к заряду m/z и предполагаемые типы ионов, образующиеся в воздушной среде в коронном разряде
| Вещества | K0, см2/(В с) (td, мс) | m/z, а. е. м. | Тип иона | Ссылки |
|---|---|---|---|---|
| Гексоген + МК | 46 | ${\text{NO}}_{2}^{ - }$ | [4] | |
| 89 | [МК– H]– | |||
| 268 | [M + NO2]– | |||
| 311 | [M + МК – H]– | |||
| ДНТ | 1.68 | 181 | [M – H]– | [6] |
| ТНТ | 1.54 | 226 | [M – H]– | |
| Гексоген | 1.42 | 268 | [M + NO2]– | |
| ПЭТН | 1.18 | 378 | [M + NO3]– | |
| МК | 89 | [МК – H]– | [7] | |
| 122 | [МК + O2]– | |||
| 152 | [МК + NO3]– | |||
| 179 | [2МК – H]– | |||
| ТНТ | 1.449 | 226 | [M – H]– | |
| Тетрил | 1.371 | 241 | [M – NO2]– | |
| Гексоген | 1.361 | 267 | [M – H + NO2]– | |
| 0.955 | 488 | [2(M – H) + NO2]– | ||
| ПЭТН | 1.229 | 316 | М– | |
| 1.152 | 361 | [M – H + NO2]– | ||
| 1.114 | 378 | [M + NO3]– | ||
| 0.7896 | 692 | [2(M – H) + NO3]– | ||
| ТНТ | 1.56 | 226 | [M – H]– | [8] |
| Тетрил | 1.47 | 241 | [M – NO2]– | |
| 1.29 | 349 | [M + NO3]– | ||
| Гексоген | 1.46 | 268 | [M + NO2]– | |
| 1.42 | 284 | [M + NO3]– | ||
| ПЭТН | 1.17 | 378 | [M + NO3]– | |
| ТНТ | (30.5) | 226 | [M – H]– | [9] |
| (31) | 227 | M– | ||
| Гексоген | (33) | 268 | [M + NO2]– | |
| (33.5) | 267 | [M – H + NO2]– | ||
| (34.5) | 282 | [M + N2O2]– | ||
| (36) | 299 | [M + N2O2 + OH]– | ||
| ПЭТН | (36.5) | 315 | [M – H]– | |
| (38) | 362 | [M + NO2]– | ||
| (38.5) | 361 | [M – H + NO2]– | ||
| (40) | 378 | [M + NO3]– | ||
| Гексоген + МК | 62 | ${\text{NO}}_{3}^{ - }$ | [10] | |
| 89 | [МК – H]– | |||
| 284 | [M + NO3]– | |||
| 311 | [M + МК – H]– | |||
| МК | 1.524 | [11] | ||
| ТНТ | 1.478 | |||
| ТНТ | 1.54 | [12] | ||
| ДНТ | 1.68 | |||
| ТНБ | 1.69 |
Цель настоящей работы – определение влияния следовых количеств молочной (2-гидроксипропановой) кислоты, являющейся одним из основных компонентов потожировых отложений человека, в том числе отпечатков пальца, на эффективность обнаружения следовых количеств средне- и малолетучих ВВ – гексогена, динитронафталина (ДНН), ДНТ, ПЭТН, тетрила, ТНБ, тринитрорезорцина (ТНР), ТНТ и 2,4,6-тринитрофенола (ТНФ) методом спектрометрии ионной подвижности c отрицательной модой ИАД.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Использовали растворы гексогена (CAS 121-82-4), ПЭТН (CAS 78-11-5), тетрила (CAS 479-45-8) и ТНТ (CAS 118-96-7) в ацетоне с концентрацией (1.0 ± 0.1) × 10–3 г/мл (ГосНИИ “Кристалл”, Россия); растворы ДНН (смесь изомеров 1,5-ДНН (CAS 605-71-0) и 1,8-ДНН (CAS 602-38-0)), ДНТ (CAS 121-14-2), ТНБ (CAS 99-35-4), ТНР (CAS 82-71-3) и ТНФ (CAS 88-89-1) в ацетоне с концентрацией (1.0 ± 0.1) × × 10–2 г/мл (РХТУ им. Д.И. Менделеева, Москва); молочную кислоту 80% (CAS 50-21-5) (Hugestone Enterprise Co., Ltd., Китай); ацетон для хроматографии 99.85% (CAS 67-64-1) (Компонент-Реактив, Россия). В день проведения экспериментов из исходных растворов готовили растворы в ацетоне следующих концентраций, г/мл: 1 × 10–4, 1 × × 10–5, 1 × 10–6, 1 × 10–7.
Аппаратура. Весы лабораторные XS 205 DU (Mettler Toledo, Швейцария) с дискретностью 1 × × 10–5 г. Для нанесения растворов на салфетку использовали микрошприц М-10Н (10 ± 0.1 мкл) (Агат, Россия). Салфетка для нанесения конденсированной пробы – фольга алюминиевая толщиной 14 мкм. Спектрометр ионной подвижности Кербер-Т (Атомпромкомплекс, Россия), схема которого показана на рис. 1, описан в работах [11, 13–16]. Параметры СИП: температура термодесорбера 180°С; источник ионизации на основе импульсного коронного разряда с частотой 10 Гц; газ-носитель – лабораторный воздух (объемная скорость 5 см3/с, 180°С); длина ld = 12 см; напряжение U = 3 кВ; дрейфовый газ – осушенный воздух (объемная скорость 10 см3/с), температура дрейфового газа 100°С; чувствительность усилителя 15 фА/(ед. АЦП); уровень шумов электрометрической системы регистрации 0.375 пА (3СКО (среднеквадратическое отклонение) – 25 ед. АЦП); уровни срабатывания сигнала “тревога” для ТНТ, тетрила и гексогена la = 4.5 пА, для ПЭТН la = 6 пА, для ДНН, ДНТ, ТНБ, ТНР и ТНФ la = 15 пА.
Методика эксперимента. В лабораторных условиях (температура 24–25°С, относительная влажность 25–40%, давление 1000–1017 гПа) с помощью микрошприца растворы ВВ и МК наносили на поверхность салфетки в виде пятна диаметром 4 мм, которое при анализе располагалось вблизи входного отверстия СИП. В экспериментах со смесями веществ сначала наносили раствор МК, затем растворы ВВ; в экспериментах с отпечатками пальца – сначала отпечаток, затем раствор ВВ в виде пятна диаметром 4 мм. После нанесения проб ожидали 20–30 с для испарения ацетона, затем салфетку помещали в термодесорбер СИП. Регистрировали местоположения ионных пиков на спектре (tdi) и зависимости амплитуды этих пиков (ионный ток) от времени Ai(t). Для определения ионизационной эффективности регистрации ВВ в присутствии или в отсутствие следовых количеств МК или отпечатка пальца зарегистрированные зависимости амплитуд соответствующих ионных пиков Ai(t) интегрировали по времени и полученные значения зарядов (qi) нормировали на нанесенные массы веществ (mi). Предел обнаружения ВВ в присутствии или при отсутствии следовых количеств МК или отпечатка пальца определяли как превышение амплитуды какого-либо из ионных пиков данного ВВ над соответствующим уровнем срабатывания сигнала “тревога” la.
Как показали эксперименты, перед проведением обнаружения следового количества МК на неиспользуемой ранее алюминиевой салфетке необходимо было ее “тренировать” посредством многократного нанесения и термодесорбции проб, содержащих исследуемую массу МК.
Массы отпечатков пальца руки определяли с помощью лабораторных весов. Для обеспечения максимального воздействия на эффективность регистрации ВВ использовали отпечатки с обильными потожировыми отложениями. Масса таких отпечатков в несколько раз превышала массу отпечатков со среднестатистическими потожировыми отложениями.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2 для примера приведены фрагменты спектров смеси веществ, десорбируемых с поверхности салфетки: а) смесь ВВ, б) смесь ВВ и МК. Нанесенные на салфетку пробы содержали ТНТ, ДНТ, тетрил, гексоген, ПЭТН и МК массами 20, 20, 10, 10, 40 и 78.4 нг соответственно. Из сравнения спектров рис. 2а и 2б следует, что присутствие в пробе МК приводит к существенному уменьшению амплитуды ионных пиков ТНТ и ДНТ, исчезновению одних и появлению других ионных пиков гексогена и ПЭТН, а для пика тетрила ни по местоположению, ни по амплитуде заметных изменений не наблюдается. Спектр, аналогичный приведенному на рис. 2б, регистрировали при нанесении на салфетку тех же ВВ и отпечатка пальца с обильными ПЖО. Основными отличиями спектра при десорбции пробы с отпечатком пальца являются наличие пиков большой амплитуды, совпадающих по tdi с пиками МК, и сильное падение амплитуд пиков ТНТ и ДНТ.
Из спектров чистых гексогена, ДНН, ДНТ, ПЭТН, тетрила, ТНБ, ТНР, ТНТ и ТНФ или смесей этих ВВ с МК (или отпечатком пальца) определили времена дрейфа ионных пиков tdi, присущих этим ВВ и МК. Значения tdi представлены в табл. 2. В этой же таблице приведены значения отношений времени дрейфа ионных пиков ВВ и МК к времени дрейфа пика ТНТ tdi/td ТНТ, полученные в настоящей работе и в работах [9, 11], значения отношения приведенных коэффициентов подвижности K0 ТНТ/K0i, рассчитанные на основе данных работ [6–8, 12], указаны предполагаемые типы ионов. Кроме того, в табл. 2 даны времена дрейфа пиков td (ОП), регистрируемых в спектре при десорбции с поверхности салфетки отпечатка пальца, и значения td(ОП)/td ТНТ.
Таблица 2.
Время дрейфа ионных пиков tdi, значение отношения времен дрейфа tdi/tdТНТ (данные настоящей работы и работ [9, 11]), значение отношения приведенных коэффициентов подвижности K0ТНТ/K0i (данные [6–8, 12]), предполагаемые типы ионов, ионизационная эффективность регистрации веществ ei
| Вещества | tdi, мс | tdi/tdТНТ | K0 ТНТ/K0i | Тип иона | ei, Кл/моль | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| эксп. | [9] | [11] | [6] | [7] | [8] | [12] | ||||
| ТНТ | 33.18 | – | [M – H]– | 11 | ||||||
| ТНТ + ОП | ~10–1 | |||||||||
| ДНТ | 30.57 | 0.921 | 0.917 | 0.917 | [M – H]– | 3.8 | ||||
| ДНТ + ОП | ≤10–3 | |||||||||
| МК | 31.78 | 0.958 | 0.970 | [MК – H]– | 2.8 | |||||
| 32.31 | 0.974 | |||||||||
| ОП | 31.83 | 0.960 | – | – | ||||||
| 32.28 | 0.973 | |||||||||
| Тетрил | 34.85 | 1.050 | 1.057 | 1.061 | [M – NO2]– | 7.7 | ||||
| Тетрил + ОП | 34.95 | 1.053 | 5.2 | |||||||
| Гексоген | 35.27 | 1.064 | 1.082 | 1.085 | 1.068 | [M + NO2]– | 5.9 | |||
| 1.098 | 1.065 | [M – H + NO2]– | ||||||||
| 36.35 | 1.096 | 1.106 | [M + NO3]– | 2.9 | ||||||
| 37.45 | 1.129 | 1.131 | [M + N2O2]– | 1.3 | ||||||
| Гексоген + ОП | 39.72* | 1.197 | [M + МК – H]– | 14.6 | ||||||
| ПЭТН | 39.67 | 1.196 | 1.197 | [M – H]– | 0.6 | |||||
| 42.06 | 1.268 | 1.246 | [M + NO2]– | 0.7 | ||||||
| 1.262 | 1.258 | [M – H + NO2]– | ||||||||
| 43.51 | 1.311 | 1.311 | 1.305 | 1.301 | [M + NO3]– | 1.7 | ||||
| ПЭТН + ОП | 46.36* | 1.397 | [M + МК – H]– | 1.6 | ||||||
| ТНБ | 30.18 | 0.910 | 0.911 | 3.4 | ||||||
| 32.36** | 0.975 | 2.1 | ||||||||
| ТНБ + ОП | 30.13 | 0.908 | ~10–2 | |||||||
| 35.57* | 1.072 | ~10–2 | ||||||||
| 39.06* | 1.177 | ~10–2 | ||||||||
| ДНН | 34.25 | 1.032 | 4.6 | |||||||
| 35.38 | 1.066 | < 1 | ||||||||
| ДНН + ОП | 34.33 | 1.035 | ~10–1 | |||||||
| 35.33 | 1.065 | ~10–2 | ||||||||
| 36.56* | 1.102 | ~10–1 | ||||||||
| ТНР | 33.46 | 1.008 | 1.9 | |||||||
| 33.89 | 1.021 | 0.4 | ||||||||
| ТНР + ОП | 33.46 | 1.008 | ~10–1 | |||||||
| 33.85 | 1.020 | ~10–2 | ||||||||
| ТНФ | 32.74** | 0.987 | 1.8 | |||||||
Использование tdТНТ и K0 ТНТ в качестве реперных и нормировочных величин дает некоторые преимущества. Во-первых, становится возможным сопоставлять данные как по коэффициентам подвижности, так и по временам дрейфа, поскольку из уравнений (6), (7) следует:
(8)
${{{{t}_{{di}}}} \mathord{\left/ {\vphantom {{{{t}_{{di}}}} {{{t}_{{dj}}}}}} \right. \kern-0em} {{{t}_{{dj}}}}}{{ = {{K}_{{0j}}}} \mathord{\left/ {\vphantom {{ = {{K}_{{0j}}}} {{{K}_{{0i}}}}}} \right. \kern-0em} {{{K}_{{0i}}}}} = {{{{K}_{j}}} \mathord{\left/ {\vphantom {{{{K}_{j}}} {{{K}_{i}}}}} \right. \kern-0em} {{{K}_{i}}}}.$Во-вторых, исключается влияние некоторых конструктивных особенностей (в частности, ld и U, см. ур. (6)) различных СИП и повышается воспроизводимость экспериментальных данных при межлабораторном сравнении. Например, для ионов [ТНТ–H]– и [ПЭТН+NO3]– значения приведенного коэффициента подвижности равны K0i = 1.449 и 1.114 [7], 1.56 и 1.17 [8] (табл. 1), т.е. отличаются для ионов ТНТ на 7.7%, для ионов ПЭТН на 5%. В то же время соотношения K0[ТНТ – H]–/K0[ПЭТН + NO3]– равны 1.3 [7] и 1.333 [8], а из данных [9] – td[ПЭТН + NO3]–/td[ТНТ – – H]– = 1.31, т.е. отличия не превышают 2.3%.
Ниже перечислены основные выводы по качественному составу ионов, которые можно сделать из данных табл. 2:
– при анализе пробы, содержащей только МК, в спектре появляются по крайней мере два пика с подвижностью выше, чем подвижность ионов [M – H]– ТНТ (td МК1/tdТНТ = 0.958, td МК2/td ТНТ = = 0.974);
– времена дрейфа ионных пиков td МК1, td МК2, регистрируемых при десорбции с салфетки МК, совпадают с временами дрейфа ионных пиков, регистрируемых при десорбции с салфетки отпечатка пальца;
– значения tdi/tdТНТ для взрывчатых веществ, полученные в настоящей работе, хорошо согласуются с соответствующими значениями из опубликованных работ, в том числе и с соотношениями K0ТНТ/K0i (отличия в среднем не превышают 1%);
– при анализе конденсированной пробы, содержащей МК (либо ОП) и ДНТ, тетрил, ТНТ, ТНР или ТНФ, состав ионов, образуемых этими ВВ, не меняется;
– разрешающая способность используемого СИП не обеспечивает раздельную регистрацию пиков td ТНБ = 32.36 мс или td ТНФ = 32.74 мс и интенсивных пиков с td МК1 = 31.78 и td МК2 = 32.31 мс МК или отпечатка пальца;
– при анализе конденсированной пробы, содержащей МК (либо ОП) и гексоген, ДНН, ПЭТН или ТНБ, в спектре появляются пики предположительно аддукт-ионов с tdi большими, чем у наблюдаемых без МК (или ОП) пиков; для гексогена и ПЭТН это, вероятно, ионы [M + МК – H]–;
– tdгекс пика аддукт-иона [M + МК – H]– совпадает с td ПЭТН иона [M – H]–.
Следует отметить, что разрешающая способность используемого СИП не позволила отделить ионы [M + NO2]– от [M – H + NO2]– гексогена или ПЭТН. Поэтому далее по тексту этот ионный пик фигурирует как [M + NO2]– + [M – H + NO2]– с указанием tdi, хотя в работе [9] пики этих ионов имели индивидуальные значения tdi (см. табл. 2).
Количественным параметром, характеризующим ионизационную эффективность регистрации веществ, испаряемых из конденсированной пробы, является интеграл зависимости амплитуды их ионных пиков от времени, отнесенный к массе этих веществ mi в пробе:
(9)
${{e}_{i}} = {{\int {{{A}_{i}}(t)dt} } \mathord{\left/ {\vphantom {{\int {{{A}_{i}}(t)dt} } {{{m}_{i}}}}} \right. \kern-0em} {{{m}_{i}}}} = {{{{q}_{i}}} \mathord{\left/ {\vphantom {{{{q}_{i}}} {{{m}_{i}}}}} \right. \kern-0em} {{{m}_{i}}}}.$На рис. 3 в качестве примера приведены зависимости амплитуды от времени Ai(t) ионных пиков [M + + NO2]– гексогена, [M – H]– МК, [M – H]– ТНТ, [M – NO2]– тетрила, ТНР, [M – H]– ДНТ и [M + + NO3]– ПЭТН при десорбции с поверхности салфеток следовых количеств индивидуальных веществ массами 2, 2, 0.5, 1, 5, 1 или 3 нг соответственно, а также пиков гексогена [M + МК – H]– или тетрила [M – NO2]– массой 1 нг при их десорбции с поверхности салфетки одновременно с отпечатком пальца. Зависимости AДНН(t) и AТНБ(t) подобны зависимости AТНТ(t), а AТНФ(t) – AГекс(t).
Как видно из рис. 3, следовые количества ВВ и МК массами mi ~ 1 нг почти полностью десорбируются с поверхности алюминиевой салфетки примерно за 7–20 с, за исключением ТНР. Максимумы амплитуд пиков наблюдаются при t ≤ 1 с. Наличие в пробе отпечатка пальца с ПЖО смещает зависимости Ai(t) ВВ (при их малой массе) в сторону большего времени с максимумом при t ≈ 5 с и почти полной десорбцией за 20–30 с, за исключением ТНР. Возможно, это связано с затрудненной термодесорбцией взрывчатых веществ из массива потожировых отложений отпечатка пальца и существенным увеличением теплоемкости салфетки с отпечатком пальца.
Из зависимостей Ai (t) определили ионизационные эффективности ei для каждого типа ионов гексогена, ДНН, ДНТ, МК, тетрила, ПЭТН, ТНБ, ТНР, ТНТ или ТНФ при десорбции с поверхности салфеток следовых количеств этих веществ массами mi = 2, 1, 1, 1, 1, 2, 2, 5, 0.5 или 20 нг соответственно. Значения этих ионизационных эффективностей ei приведены в последнем столбце табл. 2. В этом же столбце даны значения ei для ионов, регистрируемых при десорбции с салфетки отпечатка пальца с обильными ПЖО (масса отпечатка 30–50 мкг) и следовых количеств гексогена, ДНН, ДНТ, ПЭТН, тетрила, ТНБ, ТНР или ТНТ массами mi = 1, 2000, 10000, 2, 2, 2000, 200 или 100 нг соответственно. Разрешающая способность используемого СИП не позволила определить eТНФ в присутствии отпечатка пальца. Наибольшее значение eТНТ = 11 Кл/моль получено для ионов [M – H]– при десорбции 0.5 нг чистого ТНТ. В то же время, чтобы зарегистрировать зависимость AТНТ + ОП (t) и определить значение ei для этих же ионов при одновременной десорбции ТНТ и отпечатка с обильными ПЖО, потребовалось увеличить массу пробы ТНТ до 100 нг, т.е. в 200 раз. Соответственно, ионизационная эффективность регистрации следовых количеств ТНТ с отпечатком с обильными ПЖО регистрировалась на уровне eТНТ + ОП ~ 0.1 Кл/моль. Подобное влияние обильных ПЖО определили и для других ВВ: eТНР/eТНР + ОП ~ 10, eДНН/eДНН + ОП ~ 102, eТНБ/eТНБ + ОП ~ 103. Максимальное же падение величины ei, достигавшее 104 раз и более, вызывало наличие отпечатка с обильными ПЖО при регистрации ДНТ. В присутствии отпечатка пальца величина ei аддукт-ионов ДНН (36.56 мс) и ТНБ (35.57 и 39.06 мс) не превышала ei основных типов ионов этих ВВ. Для тетрила, гексогена и ПЭТН наличие или отсутствие в пробе отпечатка с обильными ПЖО почти не влияло на величину ei, однако для гексогена и ПЭТН кардинальным образом изменяло типы ионов.
Следует также отметить, что указанные в табл. 2 значения эффективностей ei регистрируются лишь в линейной области динамического диапазона СИП “Кербер-Т”, ограниченной величиной ионного тока ≈1 × 10–11 А. С увеличением массы ВВ в пробе отклик СИП становится нелинейным и значения эффективностей ei уменьшаются. Обеспечивающие линейный отклик граничные значения масс гексогена, ДНН, ДНТ, ПЭТН, тетрила, ТНБ, ТНР, ТНТ и ТНФ в пробе примерно равны 4, 2.5, 3, 10, 3, 5, 20, 2 и 30 нг соответственно.
Возможные потери при вводе термодесорбированной пробы вследствие конвекции и диффузии могут составлять 50% и более. Потери ионов при разделении и электрометрической регистрации оценивают в ~90% [17]. На основе этих величин можно оценить эффективность ионизации исследуемых веществ в камере ионизации, равную ef ~ ei /(0.5 × 0.1). Например, используя eТНТ = = 11 Кл/моль, получаем значение ef (ТНТ) ~220 Кл/моль, что хорошо согласуется с приведенными в литературе данными 400 Кл/моль [18] и 240 Кл/моль [3].
Чтобы определить механизмы воздействия отпечатка пальца на ei исследуемых ВВ, провели эксперименты по определению зарядов qi, формируемых различными ионами при варьировании в пробе следовых количеств молочной кислоты. На рис. 4 представлены зависимости зарядов qi ионов ВВ при десорбции с поверхности салфеток следовых количеств ДНН, ТНБ, тетрил, ТНТ, ДНТ, ТНР, гексоген и ПЭТН массами 2.5, 5, 1, 0.5, 3, 20, 1 и 2 нг соответственно, равными уровням срабатывания сигнала “тревога” для этих ВВ (линейный диапазон), от массы также присутствующей на поверхности молочной кислоты mМК. Массу МК варьировали от 1 до 160 нг. Данные по ТНФ не приведены, так как разрешающая способность СИП не позволяла разделить его пик и пики МК. Из рис. 4 видно, что присутствие в пробе МК массой mМК ≤ 2 нг заметно не влияет на заряд ионов каких-либо ВВ. При дальнейшем увеличении mМК происходит резкое падение заряда ионов ДНН, ДНТ, ТНБ, ТНР и ТНТ. Это можно объяснить тем, что при малой mМК сигналы СИП находятся в линейной области динамического диапазона и МК, и ВВ не влияют друг на друга, тогда как при повышенной mМК молекулы МК конкурируют в ион-молекулярных реакциях (см. уравнение (1)) с молекулами указанных ВВ, понижая эффективность образования их ионов. В частности, увеличение в пробе mМК с 2 до 8 нг уменьшает величину заряда qДНТ ионов [M–H]– примерно в 10 раз, а с 5 до 15 нг – уменьшает величину заряда qТНТ ионов [M – H]– примерно в 3–5 раз.
Рис. 4.
Зависимости зарядов qi ионов ВВ при десорбции с поверхности салфеток проб ДНН, ТНБ, тетрил, ТНТ, ДНТ, ТНР, гексоген и ПЭТН массами 2.5, 5, 1, 0.5, 3, 20, 1, 2 нг соответственно от массы молочной кислоты mМК, также присутствующей на поверхности. Обозначения: ДНН – пунктирная линия 1; ТНБ – штрихпунктирная линия 2; [M–NO2]– тетрила – тонкая точечная линия 3; [M – H]– ТНТ – жирная сплошная линия 4; [M – H]– ДНТ – жирная штрихпунктирная линия 5; ТНР – точечная линия 6; [M + МК – H]– гексогена – сплошная линия 7; [M + МК – H]– ПЭТН – пунктирная линия 8; [M + NO2]– + [M – H + NO2]–, [M + NO3]–, [M + N2O2]– гексогена – сплошные линии 9, сверху вниз; [M + NO3]–, [M + NO2]– + [M – H + NO2]–, [M–H]– ПЭТН – пунктирные линии 10, сверху вниз.

При регистрации других ВВ наблюдаются иные виды зависимости зарядов qi от mМК. Так при десорбции 1 нг тетрила наличие в пробе МК в диапазоне масс 1–160 нг практически не влияет на заряд qтетрил ионов [M – NO2]– данного ВВ. При десорбции малых масс ПЭТН (2 нг) или гексогена (1 нг) увеличение массы МК в пробе до mМК ≤ 40 нг приводит к падению зарядов qi ионов [M + N2O2]–, [M + NO3]–, [M + NO2]– + [M–H + NO2]– гексогена (кривые 9) или ионов [M + NO3]–, [M + + NO2]– + [M – H + NO2]– и [M – H]– ПЭТН (кривые 10) и росту заряда qi аддукт-ионов [M + + МК – H]– этих веществ (кривые 7 и 8 соответственно). При дальнейшем увеличении массы МК в пробе (по крайней мере, до 160 нг) зависимости qi(mМК) для ионов [M + МК – H]– ПЭТН или гексогена достигали уровня насыщения. Таким образом, сравнение данных, полученных при регистрации ВВ в присутствии МК (рис. 4), с данными, полученными при регистрации ВВ в присутствии ОП (табл. 2), подтверждает, что именно МК, входящая в состав отпечатка пальца, оказывает влияние на качественный состав ионов и ионизационную эффективность регистрации исследуемых ВВ.
Из экспериментов следует, что ионы ТНТ и МК конкурируют друг с другом. Увеличение в пробе mМК при сохранении mТНТ приводит к уменьшению заряда qТНТ ионного пика ТНТ и наоборот. При определенных соотношениях в пробе mТНТ и mМК наблюдается равенство величин qТНТ = qМК. Такие равенства зарегистрированы при следующих массах ТНТ и МК в пробе, нг: 2 и 10, 5 и 20, 15 и 40, 70 и 200. Линия тренда для указанных соотношений имеет вид mТНТ = $0.{\text{147}}m_{{{\text{МК}}}}^{{{\text{1}}.{\text{185}}}}.$ Определены также массы ТНТ, численно равные mТНТ ≈ 0.7–1.2 и 0.2–0.4 мкг, которые наносили на фрагменты отпечатков пальца (диаметр 4 мм) с обильными и со среднестатистическими ПЖО соответственно. Они вызывали равенство зарядов ТНТ и фрагмента отпечатка qТНТ = qфОП. Подстановка значений mТНТ ≈ 0.7–1.2 и 0.2–0.4 мкг в уравнение линии тренда позволила определить содержащиеся в указанных фрагментах массы молочной кислоты, примерно равные mМК ≈ 0.4–0.8 и 0.2–0.27 мкг соответственно. С учетом того, что фрагмент отпечатка диаметром 4 мм (площадь ≈0.13 см2) составляет 10% от полной площади отпечатка пальца (~1.5 см2), содержание молочной кислоты в отпечатках с обильными и со среднестатистическими ПЖО можно оценить значениями 4–8 и 2–2.7 мкг соответственно. С помощью лабораторных весов определили массы отпечатка пальца с обильными и среднестатистическими ПЖО, примерно равные 30–50 и 8–15 мкг соответственно. Следовательно, содержание МК в отпечатке с обильными ПЖО составляет немногим более 10%. Это хорошо согласуется с данными работ [19, 20], в которых предложен состав искусственного латентного отпечатка пальца с долей МК, равной 11%. В свою очередь, полученная масса среднестатистических ПЖО согласуется с данными работы [21], в которой указано, что масса отпечатка пальца обычно не превышает 10 мкг.
Очевидно, что влияние молочной кислоты на ионизационную эффективность регистрации ВВ будет оказывать влияние и на предел обнаружения (ПО), являющийся основным параметром, характеризующим обнаружительную способность устройства. На рис. 5 для СИП “Кербер-Т” представлены экспериментальные зависимости пределов обнаружения Li следовых количеств ТНФ, ТНР, ДНТ, ТНБ, ДНН, ТНТ, ПЭТН, тетрила и гексогена от массы присутствующей в пробе молочной кислоты mМК, а также значения ПО при наличии в пробе отпечатка пальца с обильными ПЖО. В отсутствие МК при указанных уровнях срабатывания сигнала “тревога” СИП “Кербер-Т” (см. “Экспериментальную часть”) пределы обнаружения ТНФ, ТНР, ДНТ, ТНБ, ДНН, ТНТ, ПЭТН, тетрила и гексогена равны Li = 30, 20, 3, 5, 2.5, 0.5, 4, 0.7 и 1 нг соответственно. Эти значения сопоставимы с пределами обнаружения других СИП, например RA4100 (Excellims, Acton, MA, США) [22], равными 10, 10, 0.5 и 0.1 нг для ДНТ, ТНТ, ПЭТН и гексогена соответственно. Из рис. 5 видно, что присутствие в пробе МК или отпечатка пальца с ПЖО не влияет на ПО следовых количеств тетрила, слабо влияет на ПО гексогена и ПЭТН (вызывает их некоторое уменьшение), и сильно влияет на ПО других ВВ. С увеличением массы МК в пробе пределы обнаружения ТНР, ДНТ, ТНБ, ДНН и ТНТ повышаются (т.е. чувствительность падает), достигая максимальных значений в присутствии отпечатка пальца с обильными ПЖО. Численные значения ПО ТНР, ДНТ, ТНБ, ДНН, ТНТ, ПЭТН, тетрила и гексогена в присутствии отпечатка с обильными ПЖО примерно равны Li = 300, 1 × 105, 5000, 2000, 100, 2, 0.7 и 0.5 нг соответственно. Предел обнаружения ТНФ в присутствии МК или отпечатка пальца не установлен, так как разрешающая способность используемого СИП не позволяла отделить его пик от пиков МК.
Рис. 5.
Зависимости пределов обнаружения Li СИП “Кербер-Т” следовых количеств ТНФ (1), ТНР (2), ДНТ (3), ТНБ (4), ДНН (5), ТНТ (6), ПЭТН (7), тетрила (8) и гексогена (9) от массы присутствующей в пробе МК, а также значения пределов обнаружения при наличии в пробе отпечатка пальца с обильными потожировыми отложениями (10).

* * *
Таким образом, именно молочная кислота является тем компонентом отпечатка пальца, который влияет на эффективность обнаружения гексогена, ДНН, ДНТ, ПЭТН, тетрила, ТНБ, ТНР, ТНТ и ТНФ методом спектрометрии ионной подвижности с ионизацией при атмосферном давлении в отрицательной моде в воздушной среде. При анализе пробы, содержащей молочную кислоту (или отпечаток пальца) и гексоген или ПЭТН, в спектре появляются интенсивные пики, предположительно, аддукт-ионов [M + МК–H]–. Аддукт-ионы появляются также и при анализе пробы, содержащей отпечаток пальца и ДНН или ТНБ. Качественный состав ионов ДНТ, тетрила, ТНР и ТНТ не меняется. Присутствие в пробе молочной кислоты (или отпечатка пальца) заметно не влияет на ионизационную эффективность ei гексогена, ПЭТН и тетрила, но сильно влияет на этот параметр для ДНН, ДНТ, ТНБ, ТНР и ТНТ. По мере увеличения в пробе массы МК ионизационная эффективность ei ДНН, ДНТ, ТНБ, ТНР и ТНТ снижается и при наличии реального отпечатка пальца с обильными потожировыми отложениями может уменьшаться в ~102, ≥104, ~103, ~10 и ~102 раз соответственно. Пределы обнаружения следовых количеств гексогена, ДНН, ДНТ, ПЭТН, тетрила, ТНБ, ТНР и ТНТ равны 1, 2.5, 3, 4, 0.7, 5, 20 и 0.5 нг, а этих же ВВ, но в присутствии отпечатка пальца с обильными потожировыми отложениями, примерно равны 0.5, 2000, 1 × 105, 2, 0.7, 5000, 300 или 100 нг соответственно. Предел обнаружения ТНФ равен 30 нг, а в присутствии отпечатка пальца не установлен.
Список литературы
Ewing R.G., Atkinson D.A., Eiceman G.A., Ewing G.J. A critical review of ion mobility spectrometry for the detection of explosives and explosive related compounds // Talanta. 2001. V. 54. № 3. P. 515.
Ewing R.G., Waltman M.J. Mechanisms for negative reactant ion formation in an atmospheric pressure corona discharge // Int. J. Ion Mobility Spectrom. 2009. V. 12. № 2. P. 65.
Буряков И.А. Обнаружение взрывчатых веществ методом спектрометрии ионной подвижности // Журн. аналит. химии. 2011. Т. 66. № 8. С. 788. (Buryakov I.A. Detection of explosives by ion mobility spectrometry // J. Anal. Chem. 2011. V. 66. № 8. P. 674.)
Takada Y. Mass spectrometry in homeland security / Mass Spectrometry Handbook / Ed. Lee M.S. Hoboken, NJ: John Wiley & Sons, 2012. P. 477.
Usmanov D.T., Chen L.C., Yu Z., Yamabe S., Sakaki S., Hiraoka K. Atmospheric pressure chemical ionization of explosives using alternating current corona discharge ion source // J. Mass Spectrom. 2015. V. 50. № 4. P. 651.
Kozole J., Levine L.A., Tomlinson-Phillips J., Stairs J.R. Gas phase ion chemistry of an ion mobility spectrometry based explosive trace detector elucidated by tandem mass spectrometry // Talanta. 2015. V. 140. P. 10.
Riebe D. Experimental and theoretical investigations of molecular ions by spectroscopy as well as ion mobility and mass spectrometry. Diss. … Dr. rer. nat. Potsdam: Universität Potsdam, 2016. 143 p.
Waltman M.J. Atmospheric pressure chemical ionization sources used in the detection of explosives by ion mobility spectrometry. Diss. … PhD. New Mexico: New Mexico Tech., 2010. 81 p.
Филипенко А.А. Исследование влияния условий ионизации на масс-селективные распределения подвижности ионов тротила, пентрита и гексогена методом спектрометрии ионной подвижности/тандемной масс-спектрометрии. Дис. … канд. техн. наук. М.: Национальный исследовательский ядерный университет “МИФИ”, 2011. 178 с.
Shelley J.T., Wiley J.S., Hieftje G.M. Ultrasensitive ambient mass spectrometric analysis with a pin-to-capillary flowing atmospheric-pressure afterglow source // Anal. Chem. 2011. V. 83. № 14. P. 5741.
Головин А.В. Спектрометр ионной подвижности с источником ионизации на основе импульсного коронного разряда. Дис. … канд. техн. наук. М.: Национальный исследовательский ядерный университет “МИФИ”, 2010. 196 с.
Kanu A.B., Hill H.H., Jr. Identity confirmation of drugs and explosives in ion mobility spectrometry using a secondary drift gas // Talanta. 2007. V. 73. P. 692.
Golovin A.V., Vasilyev V.K., Ivanov I.A., Belyakov V.V., Gromov E.A., Malkin E.K., Matusko M.A., Pershenkov V.S. Bipolar ion mobility spectrometer // Sensors and Systems. 2018. № 2. P. 4.
Pershenkov V., Belyakov V., Shaltaeva Y., Malkin E., Golovin A., Ivanov I., Vasilyev V., Matusko M., Gromov E. Fast Switching of the polarity of dual mode ion mobility spectrometer / Proc. 31th Int. Conf. Microelectronics. Nis, Serbia. 16–18 September 2019. P. 333.
Vasil'ev V.K., Belyakov V.V., Pershekov V.S., Shurenkov V.V., Nikitin A.M., Varlamov N.V. Calibration methods for ion mobility spectrometer // Sensors and Systems. 2011. № 6. P. 12.
Громов Е.А. Система регистрации и управления спектрометрическим каналом двухполярного спектрометра ионной подвижности. Дис. … канд. техн. наук. Москва: Национальный исследовательский ядерный университет “МИФИ”, 2018. 160 с.
Hill H.H., Siems W.F., Louis R.H.St., McMinn D.G. Ion mobility spectrometry // Anal. Chem. 1990. V. 62. № 23. P. 1201A.
Lawless P.A. Trace gas field instrumentation van and explosive detection research / Final Report AD A 043251. Research Triangle Institute, NC, USA. March 1977. 187 p.
Connatser R.M., DePaoli G., Gardner C., Lewis L. Latent print detection by MacroRaman imaging / Report 2005-DD-R-094. 2010. P. 34.
Connatser R.M., Prokes S.M., Glembocki O.J., Schuler R.L., Gardner C.W., Lewis S.A., Lewis L.A. Toward surface-enhanced Raman imaging of latent fingerprints // J. Forensic Sci. 2010. V. 55. № 6. P. 1462.
Scruton B., Robins B.W., Blott B.H. The deposition of fingerprint films // J. Phys. D: Appl. Phys. 1975. V. 8. № 6. P. 714.
Lee J., Park S., Cho S.G., Goh E.M., Lee S., Koh S.-S., Kim J. Analysis of explosives using corona discharge ionization combined with ion mobility spectrometry-mass spectrometry // Talanta. 2014. V. 120. P. 64.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


