Журнал аналитической химии, 2022, T. 77, № 11, стр. 1052-1058
Контроль условий полноты минерализации (пробоподготовки) проб мхов-биомониторов при определении в них тяжелых металлов, поступающих при трансграничном переносе из атмосферного воздуха
Е. С. Попова a, *, С. В. Моржухина a, А. С. Илюшкина a, Б. К. Зуев b, А. М. Моржухин a, Н. М. Омарова c
a Университет “Дубна”
141980 Московская обл., Дубна, ул. Университетская, 19, Россия
b Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
c Евразийский Национальный Университет им. Л.Н. Гумилева
Астана, Казахстан
* E-mail: espopova18@gmail.com
Поступила в редакцию 28.12.2021
После доработки 12.02.2022
Принята к публикации 14.02.2022
- EDN: BVQZPQ
- DOI: 10.31857/S0044450222110081
Аннотация
Работа посвящена подбору условий пробоподготовки мхов-биомониторов с использованием системы микроволнового разложения для определения в них тяжелых металлов, поступающих при трансграничном переносе из атмосферного воздуха. Полноту минерализации контролировали с помощью метода термоокислительной спектроскопии – окситермографии. Металлы определяли методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой. Правильность выполнения анализа контролировали с использованием образца сравнения мха Standard Reference Material M2.
При анализе проб образцов объектов окружающей среды спектральными и электрохимическими методами особую трудность представляет определение следовых количеств веществ, что обусловлено значительным влиянием на них матричного состава пробы [1].
В настоящее время активно развиваются методы оценки загрязнения атмосферного воздуха тяжелыми металлами и другими токсичными элементами, основанные на использовании мхов в качестве биомонитров [2–5]. Мхи аккумулируют тяжелые металлы и другие вещества непосредственно из воздуха, они не имеют корневой системы, тем самым вклад других источников чаще всего ограничен [6, 7]. Исследования загрязнения атмосферного воздуха тяжелыми металлами с использованием мхов-биомониторов реализуются Европейскими странами в рамках Конвенции ООН о трансграничном переносе воздуха на большие расстояния с 1970-х годов [8, 9].
При использовании метода атомно-эмиссионной спектрометрии для определения тяжелых металлов в сложных растительных образцах пробоподготовка является процедурой, лимитирующей длительность и трудоемкость аналитического цикла. Правильно подобранные условия пробоподготовки позволяют определить низкие концентрации элементов в исследуемой пробе [10]. Анализ литературных данных и проведенных экспериментальных исследований позволил выделить несколько основных способов подготовки мхов (табл. 1). Из данных табл. 1 очевидно, что наиболее эффективный и экспрессный способ минерализации органического вещества во мхах-биомониторах − использование системы микроволнового разложения.
Таблица 1.
Методы минерализации мхов-биомонитров
| Метод | Краткая характеристика метода | Недостатки | Литература |
|---|---|---|---|
| Способ “сухой” минерализации | Процессы протекают при высокой температуре, хорошо переводятся в раствор не только растворимые в воде соединения, но и нерастворимые | Длительная процедура, трудно контролировать температуру непосредственно в тигле и существует вероятность улетучивания некоторых металлов | [11] |
| Кислотное разложение при повышенной температуре при атмосферном давлении | Широко используется в практике минерализации мхов, за счет простоты с применением смесей на основе кислот и пероксида водорода | Многостадийная и длительная процедура с использованием большого количества реактивов, не всегда сохраняются легколетучие компоненты | [12–14] |
| Микроволновой нагрев проб различных объектов для определения их микроэлементного состава | Происходит при высоких температурах и давлениях, развивающихся внутри закрытых сосудов, что приводит к увеличению скорости реакций, а также позволяет устранить неконтролируемые потери следов элементов в виде легколетучих молекулярных соединений | Возможно выделение газообразных продуктов окисления, сопровождающееся резким увеличением давления, небольшие навески образов (до 2 г) | [15–18] |
В литературе приведены неполные и противоречивые данные по микроволновому разложению мхов, поэтому требуется подобрать условия минерализации с обязательным контролем полноты деструкции органического вещества в подготовленных пробах для последующего анализа методом атомно-эмиссионной спектрометрии (АЭС-ИСП) с индуктивно связанной плазмой [1, 19]. Следует убедиться, что растительные фрагменты, аккумулирующие тяжелые металлы, разрушены, и все тяжелые металлы полностью извлечены и переведены в раствор. Кроме того, при определении элементов методом АЭС-ИСП в пробах, содержащих органическое вещество, существует вероятность осаждения углерода на узлах системы ввода пробы, вследствие чего подача анализируемой пробы в плазму может частично или полностью прекратиться, что приведет к уменьшению интенсивности аналитического сигнала и неправильным результатам измерения [20]. Особенно важно, чтобы минерализации проб была полной, при анализе большого количества образцов.
Для установления наличия органического вещества в пробе в процессе пробоподготовки можно использовать приборы, основанные на различных вариантах окисления: растворами сильных окислителей, высокотемпературном, окислении УФ- и ИК-излучением. К таким приборам, например, относится элементный анализатор углерода, водорода и азота (CHN-анализатор), однако его использование для анализа жидких проб, содержащих едкие химические реактивы, затруднено.
В настоящем исследовании предлагается контролировать наличие органических веществ в процессе разложения проб мхов методом термоокислительной спектроскопии – окситермографии, разрабатываемым в ГЕОХИ РАН при участии Государственного университета “Дубна” [21, 22].
Метод имеет ряд преимуществ по сравнению с другими методами:
– экспрессность анализа (не более 10 мин для одного определения);
– малый объем пробы (5–10 мкл);
– отсутствие необходимости использовать реагенты (только кислород воздуха);
– отсутствие химически вредных отходов, требующих утилизации.
Цель настоящей работы – оптимизация условий пробоподготовки проб мхов-биомониторов с использованием метода термоокислительной спектроскопии – окситермографии для определения тяжелых металлов, аккумулируемых из атмосферного воздуха.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования служили мхи-биомониторы. Рассматривали следующие виды мхов: Philonotis marchica, Hylocomium splendens, Homalothecium philippeanum, которые признаны хорошими аккумуляторами тяжелых металлов и других соединений [6]. Отобрали шесть проб мха Philonotis marchica (пробы №№ 1–6), четыре пробы Hylocomium splendens (пробы №№ 7–10) и пять проб Homalothecium philippeanum (пробы №№ 11–15).
Образцы мхов-биомониторов в районе п. Боровое Акмолинской области Республики Казахстан собирала студентка Евразийского Национального университета имени Л.Н. Гумилева Махамбет А.Ж. [23]. Пробоотбор проводился в рамках программы ООН по воздуху Европы в соответствии с инструкцией [24].
Каждый вид мха обладает индивидуальными особенностями строения, которые влияют на его аккумулирующую способность и определяют условия проведения пробоподготовки.
Для пробоподготовки использовали высокоэффективную систему для микроволнового разложения, экстракции и синтеза MASTER (MDS-10) (Sineo, Китай), работающую на частоте 2.45 МГц с выходной мощностью микроволнового излучения до 1700 Вт. Программное обеспечение данной системы микроволнового разложения позволяет задавать либо температуру, мощность и время, либо давление, мощность и время. Разложение проводили в высокопрочных тефлоновых сосудах объемом 100 мл (14 сосудов + 1 контрольный).
Для минерализации проб применяли 67%-ную HNO3 ос. ч., 30%-ный H2O2 “экстра” и 40%-ную HF ч. Температура разложения составляла ~200°C. Полноту минерализации проб контролировали методом окситермографии. Метод основан на программированном высокотемпературном окислении органического вещества в потоке атмосферного воздуха и количественном определении молекулярного кислорода, затраченного на это окисление. При этом измеряется окисляемость анализируемого образца [21, 22].
В качестве окислительной среды использовали чистый атмосферный воздух. Жидкую пробу объемом 10 мкл дозировали в кварцевую лодочку. Лодочка последовательно, двухступенчато входила в реактор: сначала в его низкотемпературную зону (Т ≈ 100°С), затем в высокотемпературную (Т = 750°С). Конструкция реактора позволяла проводить отгонку легколетучих жидких фракций в низкотемпературной зоне. Кислород воздуха в высокотемпературной зоне реактора взаимодействовал с жидкой пробой в лодочке. При наличии органического вещества в пробе происходило его окисление, на которое расходовался кислород. Датчик кислорода, находящийся в потоке воздуха, выходящего из высокотемпературной зоны реактора, регистрировал уменьшение содержания кислорода в потоке. В качестве датчика кислорода используется твердоэлектролитный детектор, работающий в диффузионно-потенциометрическом токовом режиме [25]. Информация с датчика кислорода с помощью специально созданного электронного блока и программного обеспечения выводится на экран компьютера в виде зависимости концентрации кислорода (отн. ед. в мВ) от времени. Использование двухступенчатого нагрева пробы позволяет избавиться от мешающего влияния паров воды на стабильность газового потока и получить один пик, характеризующий потребление кислорода, затраченного на окисление органических веществ в пробе.
В приборе заложен алгоритм нахождения базовой линии (исходное содержание кислорода), вычисления площади пика потребления кислорода и расчета химического потребления кислорода по этой площади при условии полного окисления органического вещества и регистрации количества кислорода, затраченного на это окисление.
Для определения содержания тяжелых металлов в минерализованных пробах использовали оптический эмиссионный спектрометр ICPE-9000 (Shimadzu, Япония) с автодозатором ASC-6100F (Shimadzu, Япония). Спектрометр с эшелле-дифракционной решеткой 79 штрихов/мм с диапазоном длин волн 167–800 нм. CCD детектор 1.024 × 1.024 пикселей. Возможности определения: 71 элемент.
Для построения градуировочного графика использовали стандарт на 23 элемента в 2%-ной HNO3 (Merck KGaA, Германия), представляющий собой стандартный раствор с концентрацией 1000 мг/л элементов Ag, Al, B, Ba, Bi, Ca, Cd, Co, Cr, Cu, Fe, Ga, In, K, Li, Mg, Mn, Na, Ni, Pb, Sr, Tl, Zn. Этот же стандарт использовали для получения количественных характеристик методом добавки. Для разбавления градуировочных и анализируемых растворов использовали 0.1 н HNO3 ос. ч., приготовленную на деионизованной воде. Перед определением элементного состава методом АЭС-ИСП анализируемые пробы разбавляли в 10 и 100 раз. Для получения деионизованной воды использовали MilliPAK Gamma gold Millipore.
Для контроля правильности процедуры пробоподготовки и результатов определения тяжелых металлов во мхах использовали образец сравнения мха Standard Reference Material M2 [8].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мхи имеют различное строение, при этом процедура пробоподготовки должна гарантировать полное разложения всех образцов мхов. Задача первого этапа исследования – выбор реагентов для минерализации. Предварительно выбрали условия разложения проб мхов: массу навески и соотношение реагентов. Исследовали три режима разложения с использованием разных реагентов (табл. 2). Время разложения изменяли в диапазоне от 20 до 40 мин. Оказалось, что режим 1 (табл. 2) с использованием плавиковой кислоты реализовать сложно, поскольку при анализе проб методом АЭС-ИСП требуется применять специальную систему ввода пробы, позволяющую работать с плавиковой кислотой. В связи с этим для разложения мхов выбрали режимы 2 и 3 (табл. 2). Полноту разложения проб мхов в указанных режимах проверяли методом термоокислительной спектроскопии – окситермографии. Для определения органического вещества в жидких пробах использовали установку, описанную в работе [25]. Опираясь на результаты исследования [23], режим 3 выбрали в качестве оптимального, при этом достигнуто полное разложение образцов мхов-биомониторов.
Таблица 2.
Режимы микроволнового разложения
| № | Масса навески, г | Время, мин | Давление, МПа | Используемые реактивы |
|---|---|---|---|---|
| 1 | 0.5 | 20–40 | 1.2 | 2 мл H2O2 конц, 5 мл HNO3 конц, 1 мл HFконц |
| 2 | 0.2 | 20–40 | 1.2 | 1 мл H2O2 конц, 5 мл HNO3 конц |
| 3 | 0.5 | 20–40 | 2.0 | 2 мл H2O2 конц, 7 мл HNO3 конц |
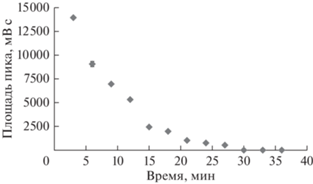
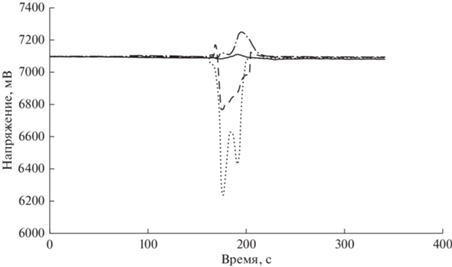
Для оптимизации времени, необходимого для полного разложения органического вещества в любом виде мха, проводили следующий эксперимент. Выбрали вид мха Philonotis marchica (проба № 1), имеющий наиболее сложное для минерализации строение слоевища. В соответствии с условиями режима 3 (табл. 2) готовили растворы в закрытых тефлоновых сосудах, содержащих навески мха. Микроволновое разложения мха проводили, помещая сосуды на фиксированное время в микроволновую печь. Время микроволнового разложения каждой следующей пробы последовательно увеличивали на 3 мин. Общее время микроволнового разложения составило 36 мин. Таким образом подготовили 12 образцов, отличающихся продолжительностью минерализации. Эти пробы анализировали методом окситермографии на наличие в них органического вещества после минерализации в соответствии с режимом 3 (табл. 2). На рис. 1 показаны окситермограммы проб № 1 (время минерализации 3 мин), № 5 (время минерализации 15 мин), № 10 (время минерализации 30 мин) и холостой пробы. В качестве фоновой линии приняли аналитический сигнал холостой пробы − растворителя, использующегося при минерализации (в данном случае конц. HNO3). Отрицательные пики указывают на наличие органической матрицы в исследуемых образцах, на окисление которой затрачивается кислород. Положительные пики характеризуют выделение кислорода при термическом разложении азотной кислоты.
Рис. 1.
Окситермограмма пробы №1 (3 мин), № 10 (30 мин) и холостой пробы (до минерализации). (─) – холостая проба (до минерализации), (- - -) – проба № 5 (15 мин), (⋅ ⋅ ⋅ ) – проба № 1 (3 мин), (─ ⋅ ─) – проба № 10 (30 мин).
При помощи программного обеспечения окситермографа вычислили площади отрицательных пиков, характеризующие потребление кислорода на окисление органического вещества для 12 анализируемых проб. На основании полученных данных построили кривую зависимости площади пика от времени разложения исследуемых образцов (рис. 2). Из данных рис. 2 можно сделать вывод, что после 30 мин разложения достигается полная минерализация пробы. Данный эксперимент подтверждает, что оптимальное время разложения исследуемых образцов составляет 30 мин.
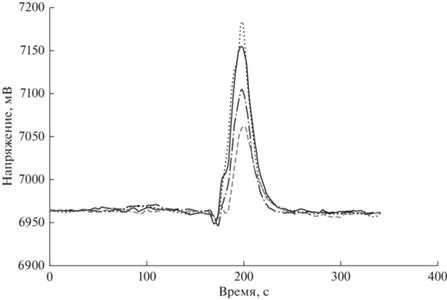
Перед переходом к анализу проб методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой оценили правильность подобранных условий пробоподготовки для различных видов мхов. Для этого исследовали полноту минерализации 15 проб мхов, различающихся по строению и аккумулирующей способности, методом окситермографии: Philonotis marchica (проба № 1), Hylocomium splendens (проба № 7), Homalothecium philippeanum (проба № 11). Разложение проб проводили в режиме 3 (табл. 2). Время минерализации составило 30 мин. На рис. 3 представлены окситермограммы некоторых проанализированных образцов мхов, исходя из которых можно сделать вывод о том, что в пробах отсутствует органическая матрица и условия минерализации оптимальны и подходят для всех видов мхов.
Рис. 3.
Окситермограммы исследуемых образцов мхов. (⋅ ⋅ ⋅) – холостая проба (после минерализации), (─) – проба № 7, (─ ⋅ ─) – проба № 1, (- - -) – проба № 11.
Для контроля полноты извлечения тяжелых металлов проанализировали образец сравнения мха (Standard Reference Material M2) [8] методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой с построением градуировочного графика (табл. 3). Образец сравнения также разлагали с использованием микроволновой системы в режиме 3 (табл. 2), время минерализации – 30 мин. Погрешности измерений рассчитывали в соответствии с рекомендациями [26]. Результаты анализа образца сравнения мха демонстрируют правильность полученных результатов.
Таблица 3.
Сопоставление результатов анализа (проверка правильности) стандарта (Standard Reference Material M2 [8])
| Элемент | св стандарте, мг/кг [8] | сэксп, мг/кг |
|---|---|---|
| Al | 178 ± 23 | 190 ± 25 |
| B | 16.1 ± 3.5 | 17.3 ± 3.8 |
| Ba | 17.6 ± 2.3 | 19.8 ± 2.6 |
| Ca | 1910 ± 325 | 1586 ± 270 |
| Cu | 68.7 ± 8.9 | 67.5 ± 8.8 |
| Fe | 262 ± 29 | 198 ± 22 |
| K | 6980 ± 910 | 5570 ± 730 |
| Mg | 826 ± 107 | 823 ± 107 |
| Mn | 342 ± 44 | 356 ± 46 |
| Na | 166 ± 22 | 167 ± 22 |
| Ni | 16.3 ± 2.1 | 20.1 ± 2.6 |
| Pb | 6.37 ± 0.77 | 8.16 ± 0.98 |
| Sr | 5.31 ± 1.17 | 5.5 ± 1.21 |
| Zn | 36.1 ± 6.1 | 36.8 ± 6.2 |
Металлы в растворе после разложения определяли методом добавок к реальным пробам мха (пробы № 1 и № 7) (табл. 4). В качестве добавки использовали мульти-стандарт Merck KGaA. Как видно из табл. 4, значения, полученные с использованием метода добавок, хорошо соотносятся с ожидаемыми значениями.
Таблица 4.
Определение концентрации добавки в образце мха (проба № 1)
| Элемент | сдобавки расч, мг/л | сдобавки эксп, мг/л |
|---|---|---|
| Cu | 0.150 | 0.157 |
| Zn | 0.150 | 0.153 |
| Pb | 0.150 | 0.149 |
| Cr | 0.150 | 0.147 |
| Ni | 0.150 | 0.156 |
Результаты определения тяжелых металлов в исследуемых пробах мхов методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой представлены в табл. 5.
Таблица 5.
Содержание (мг/кг) тяжелых металлов во мхах-биомониторах
| № пробы | Co | Cu | Fe | Ni | Mn | Pb | Sr | Zn |
|---|---|---|---|---|---|---|---|---|
| 1 | <ПО | 3.00 ± 0.57 | 940 ± 100 | <ПО | 314 ± 50 | 7.93 ± 1.11 | 15.9 ± 2.2 | 42.2 ± 7.6 |
| 2 | 0.51 ± 0.15 | 7.44 ± 1.41 | 2180 ± 240 | <ПО | 73.8 ± 11.8 | 16.9 ± 2.4 | 26.4 ± 3.7 | 36.8 ± 6.6 |
| 3 | 1.12 ± 0.32 | 11.7 ± 2.2 | 3860 ± 420 | <ПО | 208 ± 33 | 15.6 ± 2.2 | 23.1 ± 3.2 | 88.6 ± 16.0 |
| 4 | 0.31 ± 0.09 | 3.47 ± 0.66 | 1120 ± 120 | <ПО | 21.0 ± 3.4 | 6.84 ± 0.96 | 6.19 ± 0.87 | 19.0 ± 3.4 |
| 5 | <ПО | 3.05 ± 0.58 | 1390 ± 150 | <ПО | 207 ± 33 | 7.62 ± 1.07 | 13.2 ± 1.8 | 31.3 ± 5.6 |
| 6 | <ПО | 4.27 ± 0.81 | 1010 ± 110 | <ПО | 115 ± 18 | 2.93 ± 0.41 | 16.1 ± 2.2 | 28.1 ± 5.0 |
| 7 | 2.53 ± 0.73 | 9.75 ± 1.85 | 14700 ± 1600 | 26.8 ± 7.2 | 201 ± 32 | 9.84 ± 1.38 | 77.9 ± 10.9 | 190 ± 34 |
| 8 | 3.65 ± 1.06 | 11.2 ± 2.1 | 23200 ± 2600 | 5.64 ± 1.52 | 275 ± 44 | 14.1 ± 2.0 | 81.8 ± 11.4 | 46.7 ± 8.4 |
| 9 | 6.21 ± 1.80 | 18.0 ± 3.4 | 35300 ± 3900 | 26.5 ± 7.2 | 443 ± 71 | 22.9 ± 3.2 | 70.2 ± 9.8 | 176 ± 32 |
| 10 | 2.51 ± 0.73 | 11.4 ±2.2 | 14600 ± 1600 | <ПО | 228 ± 36 | 11.0 ± 1.5 | 83.4 ± 11.7 | 13.8 ± 2.5 |
| 11 | 3.86 ± 1.12 | 14.6 ±2.8 | 23100 ± 2500 | 0.11 ± 0.03 | 327 ± 52 | 15.9 ± 2.2 | 88.6 ± 12.4 | 25.6 ± 4.6 |
| 12 | 3.71 ± 1.08 | 13.5 ± 2.6 | 21700 ± 2400 | 13.3 ± 3.6 | 319 ± 51 | 14.9 ± 2.1 | 91.8 ± 12.8 | 120 ± 22 |
| 13 | 4.08 ± 1.18 | 14.9 ± 2.8 | 16600 ±1800 | 1.79 ± 0.48 | 231 ± 37 | 12.4 ± 1.7 | 90.9 ± 12.7 | 11.9 ± 2.1 |
| 14 | 4.09 ± 1.19 | 18.0 ± 3.4 | 24000 ± 2600 | 29.3 ± 7.9 | 349 ± 56 | 16.4 ± 2.3 | 92.0 ± 12.9 | 222 ± 40 |
| 15 | 4.40 ± 1.28 | 17.9 ± 3.4 | 35400 ± 3900 | 62.8 ± 17.0 | 340 ± 54 | 16.5 ± 2.3 | 94.7 ± 13.2 | 251 ± 45 |
Список литературы
Землянкина А.С., Коркина Д.А., Гринштейн И.Л. Комплексный подход к элементному анализу пробы с неизвестным составом // Заводск. лаборатория. Диагностика материалов. 2014. Т. 80. № 11. С. 19.
Fernández J.A., Boquete M.T., Caballero A., Aboal J.R. A critical review of protocols for moss biomonitoring of atmospheric deposition: sampling and sample preparation // Sci. Total Environ. 2015. P. 132.
Большунова Т.С., Рихванов Л.П., Барановская Н.В. К вопросу о выборе фоновых концентраций химических элементов в лишайниках-эпифитах // Изв. Томского политехн. ун-та. 2015. Т. 326. № 9. С. 33.
Lazo P., Steinnes E., Qarri F., Allajbeu S., Kane S., Stafilov T., Frontasyeva M., Harmens H. Origin and spatial distribution of metals in moss samples in Albania: A hotspot of heavy metal contamination in Europe // Chemosphere. 2018. V. 190. P. 337.
Schröder W., Nickel S., Schrönrock S., Meyer M., Wosniok W., Harmens H., Frontasyeva M., Alber R., Aleksiayenak Y., Barandovski L., Carballeira A., Danielsson H., Temmerman L., Godzik B., Jeran Z., Karlsson G., Lazo P., Leblond S., Lindroos A.-J., Liiv S., Magnússon S., Maňkovská B., Abaigar J., Piispanen J., Poikolainen J., Popescu I., Qarri F., Santamaria J., Skudnik M., Spiric Z., Stafilov T., Steinnes E., Stihi C., Thöni L., Uggerud H., Zechmeister H. Spatially valid data of atmospheric deposition of heavy metals and nitrogen derived by moss surveys for pollution risk assessments of ecosystems // Environ. Sci. Pollut. Res. 2016. V. 23. № 11. P. 10457.
Berg T., Steinnes E. Use of mosses (Hylocomium splendens and Pleurozium schreberi) as biomonitors of heavy metal deposition: From relative to absolute deposition values // Environ. Pollut. 1997. V. 98. № 1. P. 61.
Рогова Н.С., Рыжакова Н.К., Борисенко А.Л., Меркулов В.Г. Изучение аккумуляционных свойств мхов, используемых при мониторинге загрязнения атмосферы // Оптика атмосферы и океана. 2011. Т. 24. № 1. С. 79.
Steinnes E., Rühling A., Lippo H., Mäkinen A. Reference materials for large-scale metal deposition surveys // Accreditation Qual. Assur. 1997. V. 2. № 5. P. 243.
Steinnes E., Berg T., Uggerud H.T. Three decades of atmospheric metal deposition in Norway as evident from analysis of moss samples // Sci. Total Environ. 2011. V. 412. P. 351.
Лапко Е.Ю., Лапко И.В. Особенности методических подходов к разработке способов пробоподготовки объектов окружающей среды // Вестник Костромского гос. ун-та. 2014. Т. 20. С. 14.
Карпов Ю.А., Савостин А.П., Глинская И.В. Методы пробоотбора и пробоподготовки. М.: Бином. Лаборатория знаний, 2003. Т. 243. С. 12.
Lazo P., Kucuku M. Analysis of mercurial preservatives in different vaccines by cold vapor atomic absorption spectrophotometry // J. Anal. Sci. Technol. 2012. V. 3. № 1. P. 121.
Bettiol C., Stievano L., Bertelle M., Delfino F. Evaluation of microwave-assisted acid extraction procedures for the determination of metal content and potential bioavailability in sediments // Appl. Geochem. 2008. V. 23. № 5. P. 1140.
Di Palma A., Capozzi F., Spagnuolo V., Giordano S. Atmospheric particulate matter intercepted by moss-bags: relations to moss trace element uptake and land use // Chemosphere. 2017. V. 176. P. 361.
Кубракова И.В. Микроволновое излучение в аналитической химии. Возможности и перспективы использования // Успехи химии. 2002. Т. 71. № 4. С. 327.
Sastre J., Sahuquillo A., Vidal M., Rauret G. Determination of Cd, Cu, Pb and Zn in environmental samples: microwave-assisted total digestion versus aqua regia and nitric acid extraction // Anal. Chim. Acta. 2002. V. 462. № 1. P. 59.
Карпов Ю.А., Орлова В.А. Современные методы автоклавной пробоподготовки в химическом анализе веществ и материалов // Заводск. лаборатория. Диагностика материалов. 2007. Т. 73. № 1. С. 4.
Dołęgowska S. Measurement uncertainty from physical sample preparation of moss samples: Estimation of mechanical cleaning vs. rinsing // Ecol. Indic. 2017. V. 76. P. 64.
Тютюнник О.А., Гецина М.Л., Торопченова Е.С., Кубракова И.В. Микроволновая пробоподготовка природных объектов к атомно-абсорбционному определению ртути и других токсичных элементов // Журн. аналит. химии. 2013. Т. 68. № 5. С. 420.
Коркина Д.А., Делятинчук Н.Н., Гринштейн И.Л. Прямое определение примесных элементов в органических жидкостях методом атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой // Лаборатория и производство. Нефтехимия и энергетика. 2018. № 2. С. 118.
Зуев Б.К. Способ и устройство для определения концентрации органических веществ в жидкой пробе. Патент РФ № 2166753. Приоритет от 12.05.1998.
Зуев Б.К. Способ окситермографии. Патент РФ № 2411509. Приоритет от 15.01.2010.
Попова Е.С., Махамбет А.Ж., Моржухина С.В., Фронтасьева М.В., Омарова Н.М., Зуев Б.К., Александрова Е.О., Пеункова Е.С., Моржухин А.М., Нуркасимова М.У., Никольская Д.В. Определение содержания тяжелых металлов и ПАУ в пробах мхов–биомониторов с территории южного Казахстана // Вестник Межд. ун-та природы, общества и человека “Дубна”. Серия “Естественные и инженерные науки”. 2016. № 4 (36). С. 45.
Frontasyeva M., Harmens H. Monitoring of atmospheric deposition of heavy metals, nitrogen and POPs in Europe using bryophytes. United nations economic commission for Europe Convention on long-range transboundary air pollution. 2015. P. 26.
Зуев Б.К., Филоненко В.Г., Нестерович Д.С., Поликарпова Р.Д. Определение гиалуроновой кислоты в водных растворах с использованием воздуха в качестве окислителя // Журн. аналит. химии. 2018. Т. 73. № 10. С. 763.
Методика количественного химического анализа. Определение металлов в питьевой, минеральной, природной, сточной воде и в атмосферных осадках методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой с помощью спектрометра ICPE-9000. M-02-1109-08. СПб, 2009.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии