Журнал аналитической химии, 2022, T. 77, № 11, стр. 1040-1051
Газохроматомасс-спектрометрическое определение фенольных соединений в водных экстрактах Hypericum Perforatum L. С использованием твердофазной аналитической дериватизации
З. А. Темердашев a, *, Е. А. Виницкая a, В. В. Коробкова a
a Кубанский государственный университет, факультет химии и высоких технологий
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: temza@kubsu.ru
Поступила в редакцию 21.03.2022
После доработки 31.03.2022
Принята к публикации 31.03.2022
- EDN: NJEBLW
- DOI: 10.31857/S0044450222110123
Аннотация
Показана возможность газохроматографического определения и идентификации фенольных соединений в водных экстрактах зверобоя продырявленного (Hypericum perforatum L.) с использованием твердофазной аналитической дериватизации при подготовке проб к анализу и масс-спектрометрического детектирования. Дано сравнение результатов определения фенольных соединений с применением общепринятой аналитической дериватизации в растворе и твердофазной аналитической дериватизации в водных экстрактах зверобоя продырявленного. Установлено, что получение дериватов на сорбенте сокращает продолжительность пробоподготовки, позволяет снизить объем экстракта и расширить перечень определяемых компонентов. Установлены оптимальные условия сорбции фенольных веществ из водных экстрактов на сорбенте Strata C18-E, а также твердофазной аналитической дериватизации с N,O-бис(триметилсилил)трифторацетамидом. Определены газохроматомасс-спектрометрические характеристики для идентификации соединений в водном экстракте зверобоя продырявленного. Полученная удовлетворительная сходимость данных с результатами идентификации соединений методом ВЭЖХ-ДМД с применением стандартных веществ позволила заключить, что твердофазная аналитическая дериватизация фенольных соединений сопоставима по аналитическим возможностям с дериватизацией в растворе.
Фенольные соединения, входящие в состав водных экстрактов зверобоя продырявленного (Hypericum perforatum L.), обладают противовоспалительной, антиоксидантной и антимикробной активностью [1], что обусловливает интерес к ним со стороны косметологических и фармацевтических производств. Эти свойства в сочетании со специфическими вкусоароматическими параметрами стали причиной их распространения в пищевой промышленности [2, 3].
Изучение компонентного состава лекарственных растений начинается с извлечения искомых соединений в жидкую форму подходящим растворителем с помощью различных техник экстракции (ультразвуковая и микроволновая экстракция, извлечение при повышенных температуре и давлении и т.д.) [4]. Для определения фенольных соединений в экстрактах зверобоя продырявленного на сегодняшний день применяют хроматографические методы анализа, а именно: высокоэффективную жидкостную хроматографию (ВЭЖХ) с различными вариантами детектирования и газовую хроматомасс-спектрометрию (ГХ-МС) [5]. С другой стороны, ВЭЖХ не всегда позволяет достоверно идентифицировать и определять компоненты. Газовая хроматомасс-спектрометрия дает возможность в основном решать такого рода задачи, появляется возможность расширить спектр идентифицируемых и определяемых компонентов благодаря не только стандартным образцам, но и возможности применения библиотек масс-спектров в сочетании с параметрами удерживания [1]. Ряд фенольных соединений, входящих в состав экстрактов растительного сырья, являются нелетучими, а фенольные кислоты деградируют при температурах выше 200°С [6], в связи с чем для их определения требуется предварительная дериватизация, усложняющая подготовку проб к анализу. Поскольку фенольные соединения являются полярными соединениями, их ГХ-МС-определение возможно после экстракции с последующей дериватизацией ацилирующими, алкилирующими или силилирующими агентами.
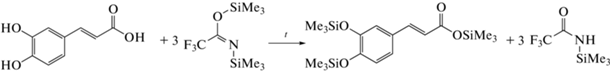
Механизм силилирования фенольных соединений включает замену активного водорода (в группах −ОН, −СООН, −NH, −NH2) на триметилсилильную группу –Si(CH3)3 [7, 8]. В соответствии с механизмом нуклеофильного замещения SN2 силилирование протекает тем успешнее, чем легче отщепляется уходящая группа. Для силилирования фенольных веществ чаще всего применяют N,O-бис(триметилсилил)трифторацетамид (БСТФА) или N-метил-N-(триметилсилил)трифторацетамид [9], обладающий легко отщепляемой трифторацетамидной уходящей группой и взаимодействующий с большим количеством функциональных групп с высокими выходами продуктов [8]. В качестве примера на схеме 1 представлена реакция дериватизации кофейной кислоты с использованием БСТФА:
Схема 1 . Силилирование кофейной кислоты N,O-бис(триметилсилил)трифторацетамидом (БСТФА).
Уменьшение объема образца и оптимизация времени пробоподготовки могут быть достигнуты за счет применения гибридных техник подготовки проб, например твердофазной аналитической дериватизации [10, 11]. Твердофазная экстракция способствует экспрессному извлечению аналита при значительном снижении объема экстракта и легко поддается автоматизации [12]. Аналитическая дериватизация обеспечивает селективность, повышение чувствительности определения и хроматографическое разделение аналитов [13]. При твердофазной аналитической дериватизации процессы экстракции и дериватизации протекают на твердой фазе или на границе раздела твердой и жидкой фаз [10]. Данный подход широко применяется для обнаружения жирных кислот, фенолов, аминов и др. [11]. Подход, представленный в работах [10, 11], может обеспечить эффективное применение твердофазной аналитической дериватизации фенольных соединений, входящих в состав растительных материалов.
Цель данной работы − газохроматомасс-спектрометрическое определение и идентификация фенольных соединений в водных экстрактах зверобоя продырявленного (Hypericum perforatum L.) с применением техники твердофазной аналитической дериватизации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растительный материал. Объектом исследования была трава зверобоя продырявленного (Hypericum perforatum L.) (“Травы Кавказа”, Краснодарский край, г. Горячий Ключ, 58 м над уровнем моря). Перед исследованием растительного материала сырье предварительно измельчали до размера частиц 0.5–1.0 мкм с учетом рекомендации Фармакопейной статьи [14].
Реактивы и стандартные образцы. Для приготовления растворов использовали деионизованную воду с удельным сопротивлением 18.2 МОм/см (25°С), полученную с помощью установки Milli-Q-UV (Millipore, Франция), ацетонитрил (HPLC-S, Biosolve BV, Нидерланды), муравьиную кислоту (85%, ЛенРеактив, Россия), стандартную смесь н-алканов С10–С40 (Sigma-Aldrich, Германия). Соединения идентифицировали с применением стандартных образцов протокатеховой, 3-О-хлорогеновой, 5-О-хлорогеновой кислот, (–)-эпикатехина, рутина, гиперозида, изокверцитрина, кверцитрина и кверцетина (Sigma-Aldrich, Германия). Дериватизацию компонентов осуществляли N,O-бис(триметилсилил)трифторацетамидом (Sigma-Aldrich, Германия).
Экстракцию фенольных соединений из зверобоя продырявленного проводили с использованием микроволновой системы ETHOS EX (Milestone, Италия). Навеску сухой измельченной пробы 0.5 г помещали в ячейку-экстрактор, куда добавляли 25 мл деионизованной воды. Экстракцию проводили в течение 30 мин при мощности микроволнового излучения 300 Вт и температуре 75°С [15]. Полученный экстракт фильтровали через вату в мерную колбу емк. 25 мл и доводили до метки экстрагентом. Перед ВЭЖХ-анализом экстракт дополнительно пропускали через фильтр с диаметром пор 45 мкм (Millipore, Франция).
Твердофазная аналитическая дериватизация фенольных соединений зверобоя продырявленного. Сорбент для твердофазной экстракции Strata C18-E (масса 100 мг, размер частиц 55 мкм, диаметр пор 7 нм) (Phenomenex, США) предварительно кондиционировали деионизованной водой и ацетонитрилом, далее сорбировали целевые компоненты из водного экстракта, после чего тщательно сушили в токе азота. Стадию промывки сорбента после сорбции компонентов исключили во избежание возможной потери целевых соединений на этой стадии. Затем на сорбент наносили 100 мкл БСТФА с последующей инкубацией в твердотельном нагревателе Fisher Scientific isotemp 2001-1FS (Fisher Scientific, США). После дериватизации полученные производные элюировали 200 мкл ацетонитрила. Перед ГХ-МС-определением собранный элюат разбавляли ацетонитрилом в пять раз во избежание перегрузки детектора.
Оборудование и условия определения фенольных соединений в экстрактах зверобоя продырявленного хроматографическими методами. Для ВЭ-ЖХ-определения фенольных соединений использовали хроматограф LC 20 Prominence (Shi-madzu, Япония), включающий дегазатор DGU-20A5, насос LC20AD, автоматический дозатор SIL-20A, термостат колонок CTO-20AC, спектрофотометрический детектор с диодной матрицей (ДМД) SPD-M20A. Разделение компонентов осуществляли на колонке Luna C18 100 Å, 250 × 2.0 мм, 5 мкм (Phenomenex, США) с предколонкой C18 4 × 2.0 мм, 5 мкм (Phenomenex, США), температура термостатирования колонки 40°С, диапазон сканирования диодной матрицы 190–800 нм. В качестве подвижной фазы для разделения компонентов использовали ацетонитрил и воду с добавкой 0.1%-ной муравьиной кислоты. Более подробно методики определения фенольных соединений обсуждены в работе [15]. Данные обрабатывали в программной среде LCMS Solution (Shimadzu, Япония).
Газохроматографический анализ экстрактов зверобоя продырявленного проводили на хроматографе Shimadzu GC-2010 с масс-спектрометрическим детектором GCMS-QP2010 Plus. Для разделения аналитов использовали кварцевую капиллярную колонку HP-ULTRA 1 (50 м × 0.20 мм, 0.33 мкм) (Agilent Technologies, США) в режиме программируемого нагрева колонки: 100°C (0−3 мин), линейный подъем температуры до 300°C со скоростью 9 град/мин (3−26 мин) и выдерживание при данной температуре в течение 25 мин. Объем вводимой пробы 1 мкл. Режим ввода – с делением потока 1 : 5. Температура термостата колонки – 100°С, инжектора – 280°С. В качестве газа-носителя использовали гелий марки А (НИИ КМ, Россия), линейная скорость потока 25.1 см/мин. Оптимизированные параметры работы масс-спектрометра: температура ионного источника 200°С, температура интерфейса 280°С, напряжение на детекторе 1.3 кВ, режим сканирования SCAN, скорость сканирования масс-спектра 2000 а.е.м./с, диапазон сканируемых масс 34–900 m/z. Полученные производные фенольных соединений идентифицировали сопоставлением полученных масс-спектров со спектрами, имеющимися в базах данных NIST05 и WILEY8.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследования водных экстрактов зверобоя продырявленного методом ВЭЖХ-ДМД подтвердили наличие в них протокатеховой, 5-О-кофеилхинной и 3-О-кофеилхинной кислот, (–)-эпикатехина, рутина, гиперозида, изокверцитрина, кверцитрина и кверцетина (рис. 1). Соединения в водных экстрактах зверобоя продырявленного идентифицировали с помощью стандартных образцов, метрологические характеристики ВЭЖХ-определения аналитов приведены в табл. 1.
Рис. 1.
Хроматограммы исходного (а) и пропущенного через сорбент Strata C18-E (б) водного экстракта зверобоя продырявленного: 1 – протокатеховая кислота; 2 – 5-О-кофеилхинная кислота; 3 – 3-О-кофеилхинная кислота; 4 – (-)-эпикатехин; 5 – рутин; 6 – гиперозид; 7 – изокверцитрин; 8 – кверцитрин; 9 – кверцетин.
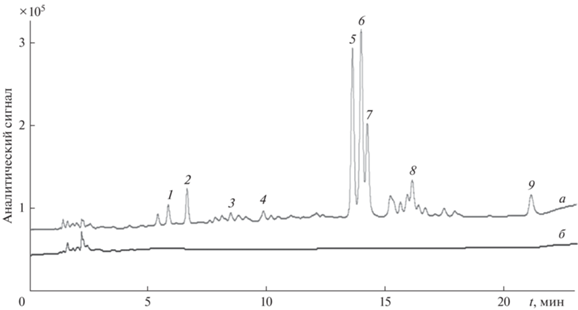
Таблица 1.
Метрологические характеристики ВЭЖХ-определения фенольных соединений в экстрактах зверобоя продырявленного (n = 6, sr ≤ 0.05)
| Соединение | Диапазон определяемых концентраций, мкг/мл | сн, мкг/мл | смин, мкг/мл |
|---|---|---|---|
| Протокатеховая кислота | 0.8−100 | 0.78 | 0.13 |
| 5-О-Кофеилхинная кислота | 0.5−100 | 0.49 | 0.10 |
| 3-О-Кофеилхинная кислота | 0.6−100 | 0.60 | 0.10 |
| (-)-Эпикатехин | 0.5−100 | 0.49 | 0.07 |
| Рутин | 0.4−200 | 0.43 | 0.10 |
| Гиперозид | 0.7−100 | 0.73 | 0.10 |
| Изокверцитрин | 0.3−100 | 0.34 | 0.07 |
| Кверцитрин | 0.3−100 | 0.32 | 0.10 |
| Кверцетин | 1.2−100 | 1.2 | 0.20 |
Для твердофазного извлечения фенольных соединений из экстрактов растительных матриц часто используют сорбенты на основе октадецилсиликагеля [16–18]. Оптимальный объем водного экстракта зверобоя продырявленного, обеспечивающий концентрирование и извлечение компонентов сорбентом Strata C18-E, составил 0.1 мл. Контроль содержания фенольных соединений в элюате проводили с помощью системы ВЭЖХ-ДМД. Целевые фенольные соединения в пропущенных через сорбент элюатах не наблюдали, что свидетельствовало об отсутствии “проскока” аналитов и возможности использования сорбента Strata C18-E для сорбционного концентрирования компонентов (рис. 1).
Оптимизация времени и температуры инкубации сорбента Strata C18-Е. Авторами работ [10, 11, 19] показана возможность силилирования различных классов соединений с использованием техники твердофазной аналитической дериватизации. В качестве основных факторов, обеспечивающих успешную дериватизацию, отмечены отсутствие влаги в реакционной смеси, температура и продолжительность инкубации сорбента. Отсутствие влаги на сорбенте Strata C18-E после сорбции аналитов из водного экстракта зверобоя продырявленного обеспечивали путем пропускания через него потока азота в течение фиксированного времени.
Влияние температуры на дериватизацию фенольных соединений изучали в диапазоне 40–70°С с шагом в 10°С (рис. 2). Для фенольных и коричных кислот дериватизация протекала успешно при 40°С. Тем не менее из данных табл. 1 и рис. 2 следует, что для подавляющего числа триметилсилильных (ТМС) производных фенольных соединений, в том числе кумароилхинных (3-О-, 4-О- и 5‑О-кумароилхинная) и кофеилхинных (3-О- и 5‑О-кофеилхинная) кислот, оптимальным для проведения реакции является температурный диапазон 50–60°С. В этих условиях интенсивность сигналов перечисленных выше компонентов стабильна. Для пара-гидроксибензойной, феруловой кислот и флавоноидов инкубация сорбента при 60°С также оказалась оптимальной. Для представителей жирных кислот (производные пальмитиновой и стеариновой кислот) приемлемой оказалась более высокая температура (70°С), при этом наблюдали резкое возрастание интенсивности сигнала их ТМС-производных (рис. 2). Дальнейшее повышение температуры дериватизации ограничивал материал корпуса патронов для твердофазной экстракции.
Рис. 2.
Зависимость площади пиков компонентов водного экстракта зверобоя продырявленного от температуры инкубации сорбента: 1 – транс-4-О-кумароилхинная кислота, 5 ТМС; 2 – транс-3-О-кумароилхинная кислота, 5 ТМС; 3 – транс-5-О-кофеилхинная кислота, 6 ТМС; 4 − транс-3-О-кофеилхинная кислота, 6 ТМС; 5 – феруловая кислота, ТМС; 6 – бензойная кислота, ТМС; 7 – пара-гидроксибензойная кислота, 2 ТМС; 8 – кофейная кислота, ТМС; 9 – пальмитиновая кислота, ТМС; 10 – эпикатехин, 5 ТМС; 11 – стеариновая кислота, ТМС.

Дериватизация компонентов в растворе позволяет работать и при более высоких температурах, но с дальнейшим ее повышением не исключена деградация аналитов. Аналитическую дериватизацию компонентов водного экстракта зверобоя продырявленного проводили с учетом рекомендаций [20] по дериватизации фенольных соединений экстракта тысячелистника обыкновенного, содержащего в своем составе ряд гликозидов флавоноидов, фенольных и коричных кислот. Дериватизацию ацетонитрильного элюата, полученного после пропускания экстракта зверобоя продырявленного через сорбент Диапак С18, проводили при 70°С [20]. По степени извлечения фенольных соединений из экстрактов лекарственных растений сорбенты Диапак С18 и Strata C18-E сопоставимы, что следует из экспериментальных данных и литературы [16, 21, 22]. Степени извлечения ряда фенольных кислот (протокатеховая и хлорогеновые кислоты) сорбентами Диапак С18 и Strata C18-Е составили 25−30% и 35−40%, а флавоноидов (рутина, гиперозида, (–)-эпикатехина и др.) − 90−100% и 80−100% соответственно [16]. Дериватизация в растворе позволила обнаружить ТМС-производные ß-резорциловой, ванилиновой и сиринговой кислот, не регистрируемые ВЭЖХ-ДМД, а также соединения, отнесенные по данным библиотек к спиртам – треитолу, рибитолу и ксилитолу. По-видимому, это связано с присутствием в составе сорбента Диапак С18 в отличие от Strata C18-Е свободных силанольных групп, способствующих извлечению и концентрированию этих соединений из раствора. Перечень присутствующих в составе элюатов производных перечисленных выше соединений представлен в табл. 2. В элюатах не обнаружили производные кумароилхинных и кофеилхинных кислот, кроме 6 ТМС 3-О-кофеилхинной кислоты. Вероятнее всего, это связано с неподходящими условиями сорбции данных компонентов на Диапак С18.
Таблица 2.
Компонентный состав извлечений после дериватизации в растворе и твердофазной аналитической дериватизации водного экстракта зверобоя продырявленного
| Соединение | Дериватизация в растворе |
Твердофазная аналитическая дериватизация | |
|---|---|---|---|
| экстракт с рН 5 | экстракт с рН 2 | ||
| Галловая кислота, 3 ТМС | – | + | + |
| β-L-Арабинопираноза, 4 ТМС | – | – | + |
| Рамноза, 4 ТМС | – | – | + |
| D-Рибофураноза, 4 ТМС | – | – | + |
| γ-Резорциловая кислота, 3 ТМС | – | – | + |
| Флороглюцинол, 3 ТМС | – | - | + |
| Салициловая кислота, 2 ТМС | – | – | + |
| Бензойная кислота, ТМС | – | – | + |
| Треитол, 4 ТМС | + | – | – |
| пара-Гидроксибензойная кислота, 2 ТМС | + | + | + |
| β-Резорциловая кислота, 3 ТМС | + | – | – |
| Рибитол, 5 ТМС | + | – | – |
| Ксилитол, 5 ТМС | + | – | – |
| Ванилиновая кислота, 2 ТМС | + | – | – |
| Глюконовая кислота, 6 ТМС | – | + | – |
| Протокатеховая кислота, ТМС | + | + | + |
| D-Фруктоза, 5 ТМС | + | + | + |
| D-Ксилофураноза, 4 ТМС | + | + | + |
| Метил-α-D-глюкофуранозид, 4 ТМС | + | – | – |
| Сиринговая кислота, 2 ТМС | + | – | – |
| D-Глюкопираноза, 5 ТМС | + | + | – |
| D-Маннитол, 6 ТМС | + | – | – |
| Пальмитиновая кислота, ТМС | + | + | + |
| Кофейная кислота, ТМС | + | + | + |
| Стеариновая кислота, ТМС | + | + | – |
| Эпикатехин, 5 ТМС | + | + | + |
| транс-3-О-Кофеилхинная кислота, 6 ТМС | + | – | + |
| транс-5-О-Кумароилхинная кислота, 5 ТМС | – | + | – |
| транс-4-О-Кумароилхинная кислота, 5 ТМС | – | + | + |
| Арабинофураноза, 4 ТМС | – | + | – |
| ß-D-Галактофураноза, 5 ТМС | – | + | – |
| Кверцетин, 5 ТМС | – | – | + |
| транс-5-О-Кофеилхинная кислота, 6 ТМС | – | – | + |
| транс-3-О-Кумароилхинная кислота, 5 ТМС | – | – | + |
| Феруловая кислота, 2 ТМС | – | – | + |
| D-Галактоза, 5 ТМС | – | – | + |
| Пирогаллолкарбоновая кислота, 4 ТМС | – | – | + |
| α-Рамноза, 4 ТМС | – | – | + |
За исключением производных кумароилхинных и кофеихинных кислот, инкубация целевых соединений при 70°С показала сопоставимый с полученным при оптимальной температуре для того или иного аналита результат, поэтому дальнейшие исследования проводили при этой температуре.
Поиск оптимальной продолжительности инкубации сорбента Strata C18-Е с БСТФА при твердофазной аналитической дериватизации компонентов осуществляли в диапазоне 5–40 мин. Зависимости концентрации производных соединений от времени инкубации сорбента оказалась различными (рис. 3). Интенсивности сигнала производных 5-О- и 4-О-кумароилхинных кислот не зависят от продолжительности инкубации сорбента. Выход соединений максимален при инкубации сорбента в течение 5 мин. Выходы ТМС-производных β-D-галактофуранозы и β-L-арабинофуранозы оптимальны при 10 и 15 мин инкубирования соответственно (табл. 3). Наибольшую концентрацию ТМС-производного кофейной кислоты в элюате наблюдали при инкубации сорбента в течение 10 мин, затем происходило постепенное снижение его содержания. Такой характер зависимости, возможно, обусловлен протекающими под действием температуры процессами деструкции соединения и его производных во времени. Для соединений, принадлежащих к классам жирных кислот и флавоноидов, эффективнее более продолжительная инкубация сорбента. Так, концентрации производных пальмитиновой и стеариновой кислот, а также эпикатехина возрастали вплоть до 25 мин инкубации, после чего наблюдали незначительное их уменьшение. Концентрации ТМС протокатеховой и 2 ТМС пара-гидроксибензойной кислот максимальны при инкубации сорбента Strata C18-Е в термостате в течение 30 мин.
Рис. 3.
Зависимость площади пиков компонентов водного экстракта зверобоя продырявленного от времени инкубации сорбента: 1 – пара-гидроксибензойная кислота, 2 ТМС; 2 – протокатеховая кислота, ТМС; 3 – D-фруктоза, 5 ТМС; 4 – D-глюкопираноза, 5 ТМС; 5 – пальмитиновая кислота, ТМС; 6 – кофейная кислота, ТМС; 7 – стеариновая кислота, ТМС; 8 – эпикатехин, 5 ТМС; 9 – транс-5-О-кумароилхинная кислота, 5 ТМС; 10 – транс-4-О-кумароилхинная кислота, 5 ТМС; 11 – β-L-арабинофураноза, 4 ТМС; 12 – ß-D-галактофураноза, 5 ТМС.
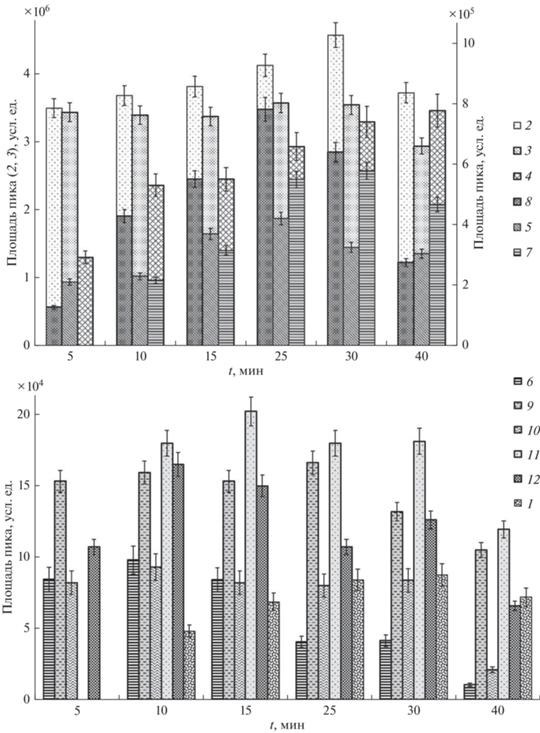
Таблица 3.
Влияние времени инкубации сорбента Strata C18-Е на качественный состав производных соединений водного экстракта зверобоя
| Соединение | Время инкубации, мин | |||||
|---|---|---|---|---|---|---|
| 5 | 10 | 15 | 25 | 30 | 40 | |
| пара-Гидроксибензойная кислота, 2 ТМС | – | + | + | + | + | + |
| Протокатеховая кислота, ТМС | + | + | + | + | + | + |
| D-Фруктоза, 5 ТМС | + | + | + | + | + | + |
| D-Глюкопираноза, 5 ТМС | + | + | + | + | + | + |
| Пальмитиновая кислота, ТМС | + | + | + | + | + | + |
| Кофейная кислота, ТМС | + | + | + | + | + | + |
| Стеариновая кислота, ТМС | – | + | + | + | + | + |
| Эпикатехин, 5 ТМС | + | + | + | + | + | + |
| транс-5-О-Кумароилхинная кислота, 5 ТМС | + | + | + | + | + | + |
| транс-4-О-Кумароилхинная кислота, 5 ТМС | + | + | + | + | + | + |
| β-L-Арабинопираноза, 4 ТМС | - | + | + | + | + | + |
| β-D-Галактофураноза, 5 ТМС | + | + | + | + | + | + |
Полученные данные (табл. 3, рис. 3) позволили заключить, что для качественной оценки компонентного состава водных экстрактов зверобоя продырявленного достаточно инкубирования сорбента в течение 15 мин. При более продолжительной инкубации сорбента качественный состав элюатов оставался неизменным.
Особенности дериватизации водного экстракта зверобоя при различных значениях рН. Снижение рН водного экстракта зверобоя продырявленного изменяет значение емкости сорбента Strata C18-E по отношению к фенольным соединениям за счет перехода аналитов в молекулярную форму [16]. Сравнение компонентного состава элюатов с сорбента Strata C18-E проводили путем нанесения на него 0.1 мл водного экстракта зверобоя при рН 2 и 5 (табл. 2, рис. 4). В элюате, полученном при нанесении водного экстракта зверобоя продырявленного с рН 2, обнаружили 3 ТМС флороглюцинол, 2 ТМС салициловую и ТМС феруловую кислоты, которые не были идентифицированы в элюатах водного экстракта зверобоя с рН 5. Отметим, что, при ВЭЖХ-ДМД-анализе флороглюцинол и его производные не зарегистрированы в водных экстрактах зверобоя. Полученный в данном случае результат, вероятно, связан с эффектом концентрирования данного соединения на сорбенте Strata C18-E.
Рис. 4.
Хроматограмма элюата, полученного после пропускания 0.1 мл водного экстракта зверобоя продырявленного с рН 2 (а) и рН 5 (б) через сорбент Strata C18-E: 1 – бензойная кислота, ТМС; 2 – салициловая кислота, 2 ТМС; 3 – пара-гидроксибензойная кислота, ТМС; 4 – флороглюцинол, 3 ТМС; 5 – γ-резорциловая кислота, 3 ТМС; 6 – β-L-арабинопираноза, 4 ТМС; 7 – рамноза, 4 ТМС; 8 – D-рибофураноза, 4 ТМС; 9 – протокатеховая кислота, ТМС; 10 – D-фруктоза, 5 ТМС; 11 – D-ксилофураноза, 4 ТМС; 12 – галловая кислота, 3 ТМС; 13 – пирогаллолкарбоновая кислота, 4 ТМС; 14 – α-рамноза, 4 ТМС; 15 – пальмитиновая кислота, ТМС; 16 – глюконовая кислота, 6 ТМС; 17 – феруловая кислота, 2 ТМС; 18 – кофейная кислота, ТМС; 19 – эпикатехин, 5 ТМС; 20 – транс-4-О-кумароилхинная кислота, 5 ТМС; 21 – транс-3-О-кумароилхинная кислота, 5 ТМС; 22 – транс-5-О-кофеилхинная кислота, 6 ТМС; 23 – кверцетин, 5 ТМС; 24 – транс-3-О-кофеилхинная кислота, 6 ТМС.
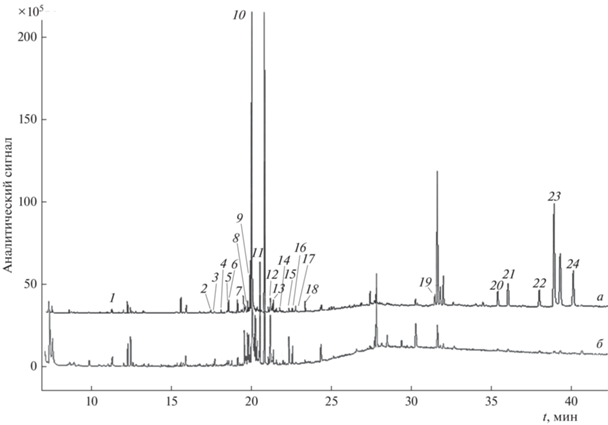
В сравнении с экстрактом с рН 5, при рН 2 регистрировали 5 ТМС 3-О- и 4-О-кумароилхинные кислоты и 6 ТМС 3-О- и 5-О-кофеилхинные кислоты с более выраженными хроматографическими пиками. Данный факт, по-видимому, связан с большей устойчивостью данных соединений в кислой среде.
По данным ВЭЖХ-ДМД-анализа водного экстракта зверобоя продырявленного выявили значительное количество флавонолгликозидов, преимущественно являющихся гликозидами кверцетина [5, 15]. В этих же условиях на ГХ-МС хроматограммах должен регистрироваться 5 ТМС кверцетин, который не был обнаружен после дериватизации компонентов экстракта в растворе, а также при твердофазной аналитической дериватизации экстракта с рН 5. Однако данный компонент обнаружили на хроматограммах элюатов экстрактов зверобоя с рН 2 (рис. 4). Полученный результат связан с изменением сорбционных свойств кверцетина и его гликозидов при переходе к их молекулярным формам. Вероятно, под воздействием высоких температур протекала деградация гликозидов (рутина, гиперозида и изокверцитрина) с образованием свободного кверцетина и остатка сахара, которые в дальнейшем подверглись силилированию. Тем не менее данное предположение носит предварительный характер и требует дальнейшего изучения.
Исходя из сказанного выше, заключили, что изменение рН экстракта с 5 до 2 расширяет композиционный профиль водных экстрактов зверобоя продырявленного за счет перевода фенольных соединений в их молекулярную форму.
Идентификацию анализируемых соединений в элюатах проводили сопоставлением их времен удерживания, линейных индексов удерживания и масс-спектральных характеристик с данными литературы [9] и библиотек NIST05 и WILEY8. В табл. 4 представлены линейные индексы удерживания (ИУ) целевых соединений, рассчитанные относительно стандартной смеси н-алканов. Как видно, ИУ компонентов, присутствующих в библиотеках данных, не согласуются с нашими экспериментальными данными, что, по-видимому, связано с иными условиями их определения.
Таблица 4.
Хроматомасс-спектрометрические параметры фенольных соединений, обнаруженных в водном экстракте зверобоя продырявленного (n = 3)
| Соединение | tR, мин | ИУ* | ИУ** | [M]+ | m/z (интенсивность) |
|---|---|---|---|---|---|
| пара-Гидроксибензойная кислота, 2 ТМС | 17.425 | 1467 | 1503 ± 2 | 282 | 193 (20), 207 (7), 223 (98), 267 (100), 282 (25) |
| Флороглюцинол, 3 ТМС | 17.629 | 1574 | 1618 ± 2 | 342 | 73 (100), 342 (67), 327 (61), 253 (13) |
| γ-Резорциловая кислота, 2 ТМС | 18.985 | – | 1621 ± 2 | 370 | 73 (100), 193 (18), 249 (23), 355 (66) |
| Протокатеховая кислота, ТМС | 19.885 | 1765 | 1795 ± 3 | 370 | 370 (52), 355 (34), 281 (11), 266 (8), 223 (15), 193 (100) |
| Галловая кислота, 3 ТМС | 21.466 | 2063 | 2064 ± 3 | 458 | 281 (100), 458 (66), 443 (32) |
| Феруловая кислота, 2 ТМС | 22.726 | 1863 | 1915 ± 3 | 338 | 73 (100), 219 (27), 249 (58), 279 (17), 308 (54), 323 (53), 338 (63) |
| Кофейная кислота, ТМС | 23.315 | 1972 | 1936 ± 3 | 396 | 396 (41), 381 (15), 307 (6), 249 (11), 219 (100) |
| Эпикатехин, 5 ТМС | 31.568 | 2228 | 2372 ± 5 | 650 | 368 (100), 650 (13), 561 (3) |
| транс-4-O-Кумароилхинная кислота, 5 ТМС | 35.352 | – | 2510 ± 4 | 698 | 219 (100), 255 (47), 401 (21) 698 (15) |
| транс-3-O-Кумароилхинная кислота, 5 ТМС | 35.983 | – | 2528 ± 4 | 698 | 219 (100), 255 (44), 345 (81) |
| транс-5-O-Кофеилхинная кислота, 6 ТМС | 37.940 | – | 2583 ± 4 | 786 | 219 (30), 307 (42), 345 (100), 397 (11), 786 (10) |
| Кверцетин, 5 ТМС | 38.859 | – | 2609 ± 4 | 662 | 73 (43), 575 (100), 487 (17), 207 (12), 662 (10) |
| транс-3-O-Кофеилхинная кислота, 6 ТМС | 40.061 | – | 2654 ± 4 | 786 | 255 (28), 307 (100), 345 (95), 447 (38), 396 (14), 786 (10) |
Для уточнения сопоставленных соединений рассмотрели полученные МС-спектры производных соединений (рис. 5). На спектрах отмечены ионы [M]+, [M−104]+, [M−89]+ и [M−15]+, соответствующие молекулярному иону, иону триметилсилилового эфира и одной метильной группы [(OSi(CH3)3) + СН3], расщеплению фрагмента триметилсилилового эфира (OSi(CH3)3) и отщеплению метильной группы [23]. На спектрах всех изучаемых соединений наблюдали пик с m/z 73 (Si(CH3)3) и триплет в области молекулярного иона, вероятно, обусловленный наличием у кремния изотопов 29Si и 30Si. Для производных кофейной и протокатеховой кислот наблюдали фрагменты [M−147]+ и [M−177]+. Исходя из этого, для искомых соединений обозначили характеристичные m/z, позволяющие использовать их не только для качественной характеристики, но и для количественной оценки (табл. 4). Например, для кофейной кислоты это m/z 396, 381, 307, 292, 249 и 219; протокатеховой кислоты – m/z 370, 355, 281, 266, 223 и 193; флороглюцинола − m/z 342, 327, 253, а эпикатехина – m/z 650, 561 и 368 (рис. 5).
* * *
Таким образом, твердофазная аналитическая дериватизация фенольных соединений сопоставима с дериватизацией в растворе, имеет свои недостатки и преимущества. Данный способ позволил сократить пробоподготовку образцов перед газохроматомасс-спектрометрическим определением, значительно уменьшил расход экстракта, а также обеспечил концентрирование соединений. Предложенный подход применим для идентификации фенольных и иных соединений в водных экстрактах зверобоя продырявленного. Сочетание классической аналитической дериватизации и твердофазной экстракции с ГХ-МС-детектированием позволило расширить спектр идентифицированных компонентов в водных экстрактах зверобоя продырявленного. Предпочтительные условия твердофазной аналитической дериватизации фенольных соединений с помощью БСТ-ФА − инкубация сорбента Strata C18-E при 70°С в течение 30 мин. Полученные результаты удовлетворительно согласуются с ВЭЖХ-ДМД-данными о соединениях, содержащихся в водном экстракте зверобоя продырявленного и идентифицированных с применением стандартных веществ.
Исследования проводили при финансовой поддержке РФФИ (проект № 20-33-90045) с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Ajila C.M., Brar S.K., Verma M., Tyagi R.D., Godbout S., Valero J.R. Extraction and analysis of polyphenols: Recent trends // Crit. Rev. Biotechnol. 2011. V. 31. P. 227.
Chaiyana W., Charoensup W., Sriyab S., Punyoyai C., Neimkhum W. Herbal extracts as potential antioxidant, anti-aging, anti-inflammatory, and whitening cosmeceutical ingredients // Chem. Biodiversity. 2021. V. 18.
Yeasmen N., Orsat V. Green extraction and characterization of leaves phenolic compounds: A comprehensive review // Crit. Rev. Food Sci. Nutr. 2021. P. 1.
Avato P., Guglielmi C. Determination of major constituents in St. John’s Wort under different extraction conditions // Pharm. Biol. 2004. V. 42. P. 83.
Caccia S. Main active components of St. John’s Wort (Hypericum perforatum L.) extracts: Current analytical procedures for pharmacokinetics and concentration-response studies // Curr. Pharm. Anal. 2006. V. 2. P. 59.
Fiamegos Y.C., Nanos C.G., Vervoort J., Stalikas C.D. Analytical procedure for the in-vial derivatization − extraction of phenolic acids and flavonoids in methanolic and aqueous plant extracts followed by gas chromatography with mass-selective detection // J. Chromatogr. A. 2004. V. 1041. P. 11.
Pan L., Pawliszyn J. Derivatization/solid-phase microextraction: New approach to polar analytes // Anal. Chem. 1997. V. 69. P. 196.
Orata F. Derivatization reactions and reagents for gas chromatography analysis / Advanced Gas Chromatography − Progress in Agricultural, Biomedical and Industrial Applications. InTech, 2012. P. 83.
Rohloff J. Analysis of phenolic and cyclic compounds in plants using derivatization techniques in combination with GC-MS-based metabolite profiling // Molecules. 2015. V. 20. P. 3431.
Atapattu S.N., Rosenfeld J.M. Solid phase analytical derivatization as a sample preparation method // J. Chromatogr. A. 2013. V. 1296. P. 204.
Atapattu S.N., Rosenfeld J.M. Solid phase analytical derivatization of anthropogenic and natural phenolic estrogen mimics with pentafluoropyridine for gas chromatography – mass spectrometry // J. Chromatogr. A. 2011. V. 1218. P. 9135.
Poole C.F., Poole S.K. Principles and practice of solid-phase extraction / Comprehensive Sampling and Sample Preparation. Academic Press, 2012. P. 273.
Smith R.M. Before the injection – Modern methods of sample preparation for separation techniques // J. Chromatogr. A. 2003. V. 1000. P. 3.
Государственная Фармакопея Российской Федерации. Москва, 2018. Изд. 14. Т. 4. С. 6074.
Милевская В.В., Статкус М.А., Темердашев З.А., Киселева Н.В., Бутыльская Т.С., Шилько Е.А. Экс-тракция и определение биологически активных компонентов зверобоя и препаратов на его основе // Журн. аналит. химии. 2016. Т. 71. № 7. С. 768. (Milevskaya V.V., Statkus M.A., Temerda-shev Z.A., Kiseleva N.V., Butyl’skaya T.S., Shil’ko E.A. Extraction and determination of biologically active components of St. John’s wort and its pharmaceutical preparations // J. Anal. Chem. 2016. V. 71. № 7. P. 741.)
Темердашев З.А., Виницкая Е.А., Милевская В.В., Киселева Н.В. Твердофазное концентрирование фенольных соединений из водных экстрактов лекарственных растений семейств Зверобойные и Яснотковые на сорбентах различной природы // Аналитика и контроль. 2020. Т. 24. № 2. С. 86.
Andrade-Eiroa A., Canle M., Leroy-Cancellieri V., Cerda V. Solid-phase extraction of organic compounds: A critical review (Part I) // Trends Anal. Chem. 2016. V. 80. P. 641.
Zeng H., Liu Z., Zhao S., Shu Y., Song Y. Preparation and quantification of the total phenolic products in citrus fruit using solid-phase extraction coupled with high-performance liquid chromatography with diode array and UV detection // J. Sep. Sci. 2016. V. 39. № 19. P. 3806.
Farajzadeh M.A., Nouri N., Khorram P. Derivatization and microextraction methods for determination of organic compounds by gas chromatography // Trends Anal. Chem. 2014. V. 55. P. 14.
Верниковская Н.А., Темердашев З.А. Идентификация и хроматографическое определение фенольных соединений в тысячелистнике обыкновенном // Аналитика и Контроль. 2012. Т. 16. С. 188.
Темердашев З.А., Милевская В.В., Киселева Н.В., Верниковская Н.А., Коробков В.А. Сорбционно-хроматографическое определение галловой, кофейной кислот, рутина и эпикатехина в лекарственных растениях // Аналитика и контроль. 2013. Т. 17. № 2. С. 211.
Дейнека В.И., Михеев А.Ю., Олейниц Е.Ю., Дейнека Л.А. Очистка хлорогеновых кислот методом твердофазной экстракции // Сорбционные и хроматографические процессы. 2018. Т. 18. № 4. С. 488.
Schummer C., Delhomme O., Appenzeller B., Wennig R., Millet M. Comparison of MTBSTFA and BSTFA in derivatization reactions of polar compounds prior to GC/MS analysis // Talanta. 2009. V. 77. P. 1473.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии