Журнал аналитической химии, 2022, T. 77, № 12, стр. 1102-1111
Определение аминоспиртов в виде силильных производных с тремя дериватизирующими реагентами методом газовой хроматографии с масс-спектрометрическим детектированием
И. В. Новикова a, Р. И. Новиков a, Ж. В. Смирнова a, С. С. Алексенко a, *, В. Б. Кондратьев a
a Государственный научно-исследовательский институт органической химии и технологии (ГосНИИОХТ)
111024 Москва, шоссе Энтузиастов, 23, Россия
* E-mail: dir@gosniiokht.ru
Поступила в редакцию 25.11.2021
После доработки 09.12.2021
Принята к публикации 09.12.2021
- EDN: EKNCDI
- DOI: 10.31857/S0044450222120131
Аннотация
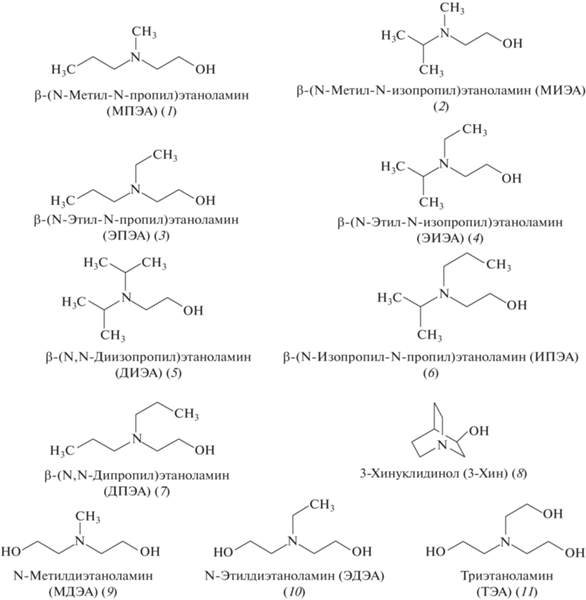
Разработаны подходы к разделению и идентификации одиннадцати β-аминоспиртов – маркеров азотсодержащих токсичных химикатов (V-газов, азотистых ипритов и BZ) методом газовой хроматографии с масс-спектрометрическим детектированием в виде триметил-(ТМС) и трет-бутилдифенилсилильных производных. Оптимизированы условия совместного силилирования β-аминоспиртов реагентами 1,1,1,3,3,3-гексаметилдисилазаном (ГМДС), N,O-бис(триметилсилил)трифторацетамидом (БСТФА) и трет-бутилдифенилхлорсиланом (ТБДФС). Для дериватизации β-аминоспиртов реагент ТБДФС предложен впервые. Показано, что оптимальными для обеспечения протекания дериватизации смеси всех β-аминоспиртов с ГДМС являются температура 40°С и время реакции 15 мин, с БСТФА − 60°С и 30 мин, с ТБДФС – 80°С и 45 мин. При этом в случае ГМДС необходимо введение активирующей добавки 0.02% иода, а для ТБДФС N-метилимидазола в соотношении 1 : 2. Реакционная способность β-аминоспиртов по отношению к силилирующим реагентам уменьшается в ряду N,N-диалкиламиноэтанолы – N-алкилдиэтаноламины – триэтаноламин – 3-хинуклидинол. Разделение структурных изомеров метилпропил- и метилизопропилэтаноламина возможно только в виде ТБДФС-производных на неподвижной фазе средней полярности (VF–1701 MS). Пределы обнаружения β-аминоспиртов в виде ТМС-производных лежат в интервале 0.05–0.5 мкг/мл, а ТБДФС-производных – 0.2–0.8 мкг/мл. Полученные результаты позволяют до-стоверно идентифицировать β-аминоспирты в смеси в концентрациях >1 мкг/мл.
В Приложение по химикатам Конвенции о запрещении разработки, производства, накопления и применения химического оружия и о его уничтожении (далее – Конвенция) [1] включены β-аминоспирты (рис. 1), которые являются прекурсорами и продуктами трансформации азотсодержащих токсичных химикатов (ТХ). Они способны сохраняться в окружающей среде в неизменном виде продолжительное время и выступают в качестве маркеров ТХ – V-газов, азотистых ипритов и BZ. Задача определения β-аминоспиртов возникает при проведении химико-аналитических исследований по выявлению и расследованию случаев нелегальной деятельности в области производства, применения и хранения ТХ. Кроме того, аминоспирты широко используются в производстве моющих средств, эмульгаторов, косметических и лекарственных препаратов, в качестве поглотителей кислых газов, что обусловливает необходимость контроля их содержания в производственном процессе, при утилизации продукции, а также в объектах окружающей среды.
Рис. 1.
Структурные формулы β-аминоспиртов – прекурсоров и продуктов деструкции азотсодержащих токсичных химикатов.
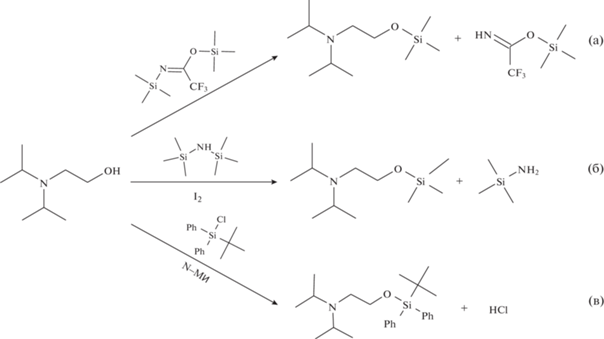
Высокая полярность, термолабильность и низкие значения молекулярных масс затрудняют определение микроколичеств β-аминоспиртов методами высокоэффективной жидкостной хроматографии и особенно газовой хроматографии с масс-спектрометрическим детектированием (ГХ-МС). Один их путей решения проблемы состоит в дериватизации аминоспиртов, которая позволит перевести их в производные, обладающие достаточной летучестью, термической стабильностью и характеристичными направлениями фрагментации молекулярных ионов, однозначно соответствующими исходному соединению при идентификации масс-спектрометрическим детектором [2]. При этом выбранная реакция должна быть проста в экспериментальном исполнении, характеризоваться быстротой протекания и высокой селективностью. Различные способы дериватизации ТХ и продуктов их деструкции представлены в обзорах [3–5]. Для химической модификации β-аминоспиртов в большинстве случаев применяют реакции силилирования [6–18] и реже – ацилирования [16, 19–22]. При этом, по мнению авторов, эти две группы реакций представляют собой равноправные направления и имеют свои достоинства и недостатки. Несмотря на распространенность процедуры силилирования при определении β-аминоспиртов методом ГХ, возможности силилирующих реагентов недостаточно изучены. Так, N,O-бис(триметилсилил)трифторацетамид (БСТФА), часто используемый для дериватизации продуктов трансформации ТХ, содержащих ОН- и СООН-группы, во всех известных случаях применяют для некоторых β-аминоспиртов (от одного до шести соединений) Приложения по химикатам Конвенции, что ограничивает возможности химико-аналитического контроля. Определяемые концентрации β-аминоспиртов, как правило, находятся на уровне 0.050–0.50 мкг/мл при сканировании при полном ионном токе [6]. Триметилсилильные (ТМС) производные с помощью БСТФА получают при температуре от 25°С [12] до 70°С [6], времени термостатирования – от 15 мин [12] до 60 мин [17]. В рекомендованных процедурах по стратегии проведения анализа для обнаружения ТХ в объектах окружающей среды дериватизацию полярных продуктов трансформации ТХ с помощью БСТФА предложено проводить в среде ацетонитрила при 60°С в течение 30 мин [23]. В качестве растворителей используют ацетонитрил [6, 9, 13, 17], хлороформ [12] и дихлорметан [18]. Несмотря на то, что дихлорметан является одним из наиболее распространённых растворителей, используемых для извлечения ТХ, их прекурсоров и продуктов деструкции в экологическом анализе, существуют данные о его взаимодействии с аминами [24, 25] и 3-хинуклидинолом [26] при комнатной температуре, что может ограничивать его использование в качестве экстрагента.
Дериватизация другим ТМС-реагентом – 1,1,1,3,3,3-гексаметилдисилазаном (ГМДС) к настоящему времени описана только для четырех исследуемых β-аминоспиртов: β-(N,N-диизопропил)этаноламина (ДИЭА), N-этилдиэтаноламина (ЭДЭА), триэтаноламина (ТЭА) и 3-хинуклидинола (3-Хин). При этом реакцию проводят как в дихлорметане при 40°С в присутствии иода [15], так и в ацетонитриле при 70°С без добавления катализатора [7]. С целью получения силильных производных с высокими значениями индексов удерживания в качестве реагентов могут служить хлорсиланы с объемными радикалами, например фенильными, трет-бутильными и др. Описаны способы дериватизации N-метил-N-(трет-бутилдиметилсилил)трифторацетамидом N-метилдиэтаноламина (МДЭА), ДИЭА, ЭДЭА и ТЭА [10, 12]. При этом отмечается сложность получения трет-бутилдиметилсилильного производного 3-Хин вследствие стерических затруднений. Другой реагент с объемным заместителем – диметилфенилхлорсилан – использовали для силилирования некоторых диалкилэтаноламинов и алкилдиэтаноламинов [14]. Отмечается, что реакцию проводили в присутствии N-метилимидазола без нагревания. Перспективным силилирующим реагентом является трет-бутилдифенилхлорсилан (ТБДФС), однако сведения по дериватизации им β-аминоспиртов в литературе отсутствуют.
Несмотря на большое число публикаций и, казалось бы, достаточную изученность вопроса силилирования β-аминоспиртов, в упомянутых работах не описана возможность групповой дериватизации с использованием силилирующих реагентов и не оптимизированы условия определения всех контролируемых β-аминоспиртов при их совместном присутствии. Актуальность разработки такого способа связана с проблемой надежной идентификации любого из возможных продуктов трансформации азотсодержащих ТХ в ходе одного определения на уровне ≥1 мг/л. Решение данной задачи связано с необходимостью подбора реагента, оптимизации условий проведения дериватизации смеси одиннадцати β-аминоспиртов, их последующего разделения и идентификации методом ГХ-МС.
Цель настоящей работы − изучение возможности определения группы β-аминоспиртов в виде триметил- и трет-бутилдифенилсилильных производных и выбор оптимальных условий дериватизации и ГХ-детектирования, позволяющих идентифицировать максимальное число соединений в ходе одного определения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы и реактивы. В работе использовали ДИЭА, МДЭА, ЭДЭА, ТЭА, 3-Хин (Aldrich, США); β-(N-изопропил-N-пропил)этаноламин (ИПЭА), β-(N,N-дипропил)этаноламин (ДПЭА), β-(N-этил-N-изопропил)этаноламин (ЭИЭА), β‑(N-этил-N-пропил)этаноламин (ЭПЭА), β‑(N-метил-N-изопропил)этаноламин (МИЭА), β-(N-метил-N-пропил)этаноламин (МПЭА) синтезировали по стандартным методикам, описанным в работах [27, 28]. Для подтверждения структуры и определения чистоты синтезированных соединений использовали метод ЯМР-спектроскопии. Применяли следующие растворители: ацетонитрил, N-метилимидазол, пиридин (Aldrich, США), иод кристаллический ч. д. а. В качестве силилирующих реагентов использовали БСТФА, ГМДС, ТБДФС (Aldrich, США).
Приготовление растворов. Исходные растворы β-аминоспиртов (1.0 мг/мл) готовили растворением точной навески в ацетонитриле. Рабочий раствор смеси β-аминоспиртов с концентрацией каждого компонента 10 мкг/мл готовили путем смешивания и последовательного разбавления исходных растворов. Исходный раствор иода (1.0 мг/мл) готовили растворением 10 мг иода в 10 мл ацетонитрила с последующим разбавлением ацетонитрилом для получения серии растворов с концентрациями 10, 50, 100, 250 и 500 мкг/мл. Растворы хранили при 4°С.
Дериватизация. К 0.5 мл рабочего раствора, содержащего смесь одиннадцати β-аминоспиртов, добавляли 50 мкл силилирующего реагента. В случае проведения реакции с ГМДС или ТБДФС вносили раствор иода или N-метилимидазол соответственно. Растворы встряхивали и помещали в термостат. Условия проведения реакций (температура, время термостатирования, количество введенных реагентов) указаны ниже в разделе “Результаты и их обсуждение”. Схема реакций получения силиловых эфиров на примере N,N-диизопропилэтаноламина представлена на рис. 2.
Оборудование и условия определения. Использовали газовый хроматограф 7890 А в сочетании с моноквадрупольным масс-спектрометрическим детектором 5975 С (Agilent Technology, США). Хроматографическое разделение проводили на кварцевой капиллярной колонке HP-5MS (30 м × × 0.25 мм × 0.25 мкм) и VF-1701 MS (30 м × 0.25 мм × × 1.0 мкм). Объем вводимой пробы для всех измерений составлял 1 мкл. Температура испарителя 260°С, ввод пробы с делением потока 1/10, расход газа-носителя гелия 1.0 мл/мин, температура интерфейса 280°С. Программа градиентного изменения температуры для производных аминоспиртов с реагентами БСТФА и ГМДС: 50°С с последующим подъемом со скоростью 10°С/мин до 135°С, далее подъем со скоростью 15°С/мин до 210°С, подъем со скоростью 25°С/мин до 280°С (2 мин); продолжительность анализа 18.3 мин. Для разделения смеси ТБДФС-производных аминоспиртов использовали следующий градиент нагрева термостата колонки: 150°С с последующим подъемом со скоростью 10°С/мин до 280°С (1 мин), далее подъем со скоростью 20°С/мин до 290°С (30 мин); продолжительность анализа 44.5 мин.
Масс-спектрометрическое детектирование проводили в режиме электронной ионизации, энергия ионизации 70 эВ, температура источника ионов 230°С, диапазон сканируемых масс от 33 до 550 m/z, в случае ТБДФС от 50 до 900 m/z. Экспериментальные данные регистрировали и обрабатывали с помощью программного пакета ChemStation (Agilent Technology, США). При оптимизации условий определения относительную площадь пика соединения рассчитывали как отношение площади i-ого производного пика в j-ом эксперименте к максимальной площади пика i-ого производного в рамках всего эксперимента однопараметрической оптимизации.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
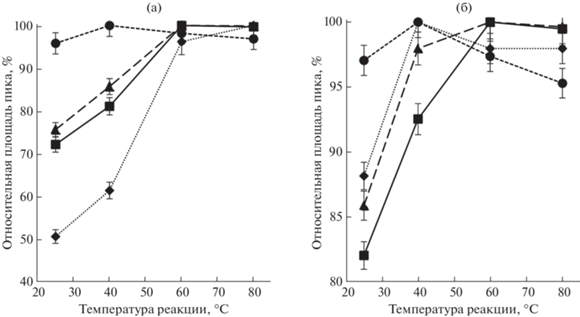
Триметилсилильные производные β-аминоспиртов. Для выбора оптимальных условий реакции совместного получения одиннадцати триметилсилильных производных β-аминоспиртов с БСТФА в среде ацетонитрила изучили влияние ряда факторов на площади хроматографических пиков. Влияние температуры на выход продуктов реакции дериватизации рассматривали в интервале 25–80°C при термостатировании реакционной смеси в течение 30 мин. Как видно из рис. 3а, повышение температуры в большей степени приводит к увеличению площадей пиков 3-Хин, группы алкилдиэтаноламинов (АДЭА) и ТЭА, достигая максимального значения при 60°С. Подобная зависимость может быть связана со стерическими затруднениями и большими энергозатратами реакции БСТФА при получении дериватов с 3-Хин, β-аминоспиртами с двумя гидроксогруппами и ТЭА, в отличие от процесса получения монозамещенных диалкилэтаноламинов (ДАЭА).
Рис. 3.
Влияние температуры на величины площадей пиков производных β-аминоспиртов (а) с БСТФА и (б) с ГМДС (n = 3, Р = 0.95). (⚫) – ДАЭА-ТМС (1–7), (◆) – 3-Хин-ТМС (8), (▲) – АДЭА-(ТМС)2 (9, 10), (◼) – ТЭА-(ТМС)3 (11). Номера 1–11 исходных соединений β-аминоспиртов см. рис. 1.
Для оптимизации значений использовали также статистический показатель Dn [29–31], который рассчитывали по формуле:
где Dn – общая относительная площадь пиков продуктов реакции, %; di – отношение площади пика i-ого производного в j-ом эксперименте к максимальной площади пика i-ого производного в рамках всего эксперимента однопараметрической оптимизации; n – количество соединений в смеси.Данный коэффициент позволяет выбрать такое значение оптимизируемого параметра, при котором наибольшее число дериватов имеют максимальную площадь пика. Чем выше значение данного показателя, тем предпочтительнее условия реакции [29]. Значения коэффициента Dn, рассчитанные по результатам силилирования реагентом БСТФА для температур в диапазоне 25–80°C, показали, что при 25°С Dn составил 86%, при 40°С − 92%, а при 60°С и выше − 98–99%. Дальнейшие эксперименты с БСТФА проводили при температуре реакции 60°С.
Влияние времени реакции дериватизации на площади пиков производных β-аминоспиртов оценивали для диапазона 15–60 мин. Найдено, что Dn при проведении дериватизации БСТФА в течение 15 мин составляет 93%, а в течение 30 мин и более – 98–99%. Лимитирующим являлся только процесс образования ТМС-производного с 3‑Хин, который требовал более длительного нагревания.
Таким образом, оптимальными условиями силилирования одиннадцати β-аминоспиртов реагентом БСТФА являются температура реакции 60°С, продолжительность термостатирования 30 мин. Хроматограмма смеси, полученная в этих условиях, представлена на рис. 4а. Идентификацию каждого компонента проводили по временам удерживания производных индивидуальных соединений и их масс-спектрам. Структурные изомеры, образованные МПЭА и МИЭА, в виде производных с БСТФА не разделяются.
Рис. 4.
Хроматограммы смесей ТМС-эфиров β-аминоспиртов (с = 10 мкг/мл) после дериватизации реагентами (а) БСТФА, (б) ГМДС без добавки иода, (в) ГМДС с добавкой иода. 1 – МПЭА-ТМС, 2 – МИЭА-ТМС, 3 –ЭИЭА-ТМС, 4 – ЭПЭА-ТМС, 5 – ДИЭА-ТМС, 6 – ИПЭА-ТМС, 7 – ДПЭА-ТМС, 8 – 3-Хин-ТМС, 9 – МДЭА-(ТМС)2, 10 – ЭД-ЭА-(ТМС)2, 11 – ТЭА-(ТМС)3, 12 – МПЭА, 13 – МИЭА, 14 – ЭИЭА, 15 – ЭПЭА, 16 – ДИЭА, ИПЭА, 17 – ДПЭА, 18 – МДЭА, 19 – 3-Хин, 20 – ЭДЭА, 21 – ТЭА-(ТМС)2.
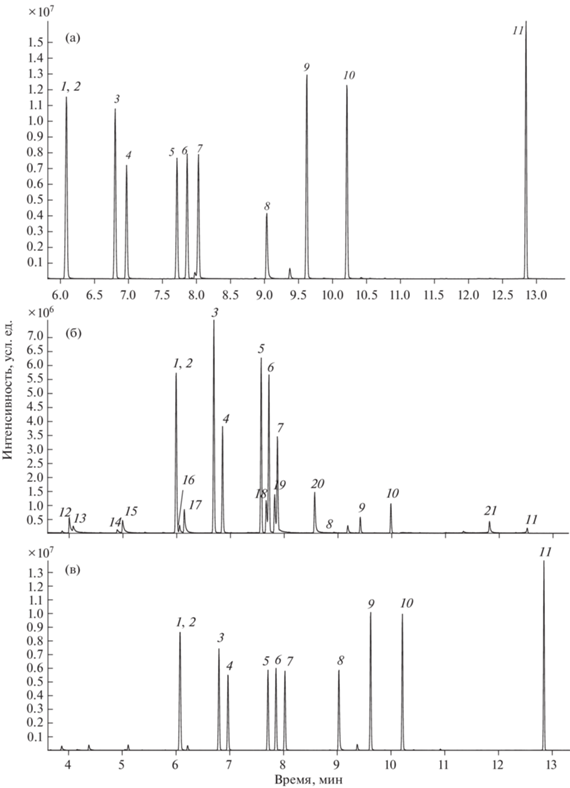
В случае реакции с ГМДС условия, оптимальные для реакции с БСТФА, не приводят к полной конверсии β-аминоспиртов в соответствующие триметилсилиловые эфиры. Так, на хроматограмме смеси (рис. 4б) наряду с пиками полностью замещенных ТМС-дериватов детектируются непрореагировавшие или частично замещенные β-аминоспирты в виде несимметричных затянутых пиков. Интенсивность пиков ТМС-производных, полученных по реакции с ГМДС, по сравнению с таковыми для БСТФА значительно ниже, особенно для 3-Хин и производных группы АДЭА.
Известно, что повысить реакционную способность реагента ГМДС позволяет добавление триметилхлорсилана, сульфоновых кислот, хлорида цинка, иода. Действительно, введение в реакционную смесь иода в диапазоне концентраций 0.0004–0.04% привело к резкому изменению хроматограммы (рис. 4в). Как видно из рис. 5а, выход одиннадцати производных ГМДС с полным замещением гидроксильных на ТМС-группы максимален при концентрации иода в смеси ≥0.01%. При этом кратность увеличения площадей пиков составила для группы производных ДАЭА 2–4 раза, МДЭА, ЭДЭА и ТЭА 71, 130 и 350 раз соответственно, а 3-хинуклидинола > 4 × 106 раз по сравнению со значениями без добавки иода.
Рис. 5.
Зависимости площадей пиков производных β-аминоспиртов (с = 10 мкг/мл) после дериватизации (а) реагентом ГМДС от содержания иода; (б) реагентом ТБДФС от содержания N-метилимидазола в реакционной смеси объемом 0.5 мл (n = 3, Р = 0.95). Условия: (а) 80°С, время реакции 30 мин; (б) 80°С, время реакции 45 мин. (а): (⚫) – ДАЭА-ТМС (1–7), (◆) – 3-Хин-ТМС (8), (▲) – АДЭА-(ТМС)2 (9, 10), (◼) – ТЭА-(ТМС)3 (11); (б): (⚫) – ДАЭА-ТБДФ, (◆) – 3-Хин-ТБДФ, (▲) – АДЭА-(ТБДФ)2.

Предположительно механизм активирующего действия иода может быть связан с взаимодействием с ГМДС и образованием следовых количеств HI или триметилиодсилана, которые катализируют дальнейший процесс силилирования. С другой стороны, иод может способствовать поляризации связи Si–N в молекуле реагента и тем самым увеличивать его реакционную способность [15, 32].
Зависимости площадей хроматографических пиков производных β-аминоспиртов при дериватизации реагентом ГМДС от температуры представлены на рис. 3б. При выборе оптимальных значений температуры (в диапазоне 20–80°С) и времени проведения реакции (15–60 мин) пользовались расчетным показателем Dn. Результаты показали, что с ГМДС дериватизация протекает полностью уже при 40°С (Dn = 99%). При этом требуется меньшее время термостатирования для завершения силилирования по сравнению с реагентом БСТФА. Так, значение Dn для времени реакции, начиная с 15 мин и более, составило 98–99%.
Стоит отметить, что, помимо более мягких условий проведения реакции, достоинством применения ГМДС является образование в качестве побочного продукта аммиака, легко удаляющегося из реакционной среды и не оказывающего влияние на элюирование других компонентов смеси при ГХ-определении. Это отличает данный реагент от БСТФА, для которого регистрируются различные артефакты при проведении реакции силилирования и последующем хроматографировании смеси [33]. Однако, как и в случае БСТФА, структурные изомеры МПЭА и МИЭА с ГМДС не разделяются (рис. 4в).
Производные β-аминоспиртов с трет-бутилдифенилхлорсиланом. Увеличение объема молекулы за счет введения ароматических структур и/или разветвленного алкильного радикала при атоме кремния, как правило, приводит к затруднению процесса силилирования. Предварительные результаты показали, что реакция дериватизации N-алкилдиэтаноламинов и 3-хинуклидинола с реагентом ТБДФС не идет даже при нагревании до 80°С. Для получения производных всех β-аминоспиртов в реакционную смесь вводили добавку N-метилимидазола. Зависимости площадей пиков ТБДФС-производных β-аминоспиртов от количества органического основания в реакционной смеси представлены на рис. 5б. Так, внесение N-метилимидазола в объемном соотношении к реагенту 0.5 : 1 недостаточно для активации процесса, а при соотношении 2 : 1 и выше реакция протекает с наибольшим выходом производных. Авторы работы [14] считают, что взаимодействие спирта с алкилхлорсиланами может ускоряться имидазолами за счет образования реакционноспособного промежуточного комплекса азотистого основания с реагентом. Кроме того, действие N-метилимидазола может сводиться и к связыванию выделяющегося продукта реакции хлороводорода, а также способствовать диссоциации силилируемого соединения.
При выборе времени термостатирования реакционной смеси (в диапазоне 30–85 мин) с помощью показателя Dn установили, что при проведении реакции в течение 30 мин, значение Dn составило 86%. Увеличение времени нагрева в интервале 45–85 мин не повлияло на количество получаемых производных (Dn = 96–97%).
На рис. 6 представлена хроматограмма смеси продуктов реакции β-аминоспиртов с ТБДФС. Отсутствие пика N,N,N-трис[(2-трет-бутилдифенилсилилокси)этил]амина (производное ТЭА) может быть обусловлено низкой летучестью деривата и/или его необратимой сорбцией на колонке.
Рис. 6.
Хроматограмма смеси трет-бутилдифенилсилиловых эфиров β-аминоспиртов (80°С, 45 мин). Условия: колонка HP-5 MS, колонка VF-1701 MS (вставка). Обозначения пиков производных, соответствующих исходным β-аминоспиртам, см. рис. 1.
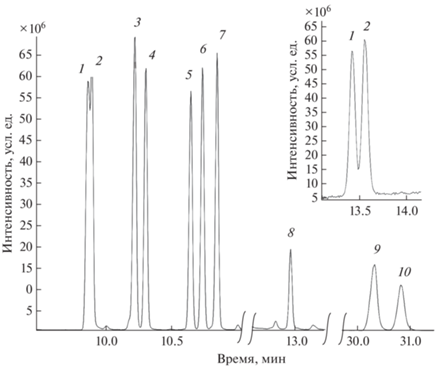
Для разделения изомеров производных МПЭА и МИЭА использовали колонку с более полярной неподвижной фазой (VF-1701 MS) по сравнению с НР-5MS, при этом удалось получить приемлемые результаты для пары МПЭА–МИЭА только в случае производных МПЭА-ТБДФС и МИЭА-ТБДФС (рис. 6). Силильные производные МП-ЭА-ТМС и МИЭА-ТМС на колонке VF-1701 MS не разделяются.
Пределы обнаружения детектируемых компонентов при отношении сигнал/шум, равном трем, для ТМС-производных составили 0.1–0.2 мкг/мл в случае N,N-диалкилэтаноламинов, 0.05–0.08 мкг/мл для N-алкилдиэтаноламинов и ТЭА и 0.5 мкг/мл для 3-хинуклидинола. Пределы обнаружения для ТБДФС-производных составили 0.2–0.4 мкг/мл в случае N,N-диалкилэтаноламинов, 0.6 мкг/мл для N-алкилдиэтаноламинов (ТЭА не хроматографируется) и 0.8 мкг/мл для 3‑хинуклидинола.
* * *
Таким образом, реагенты БСТФА, ГМДС, ТБДФС обеспечивают эффективное и количественное силилирование одиннадцати β-аминоспиртов, относящихся к Спискам Приложения по химикатам Конвенции, что является быстрым и удобным способом получения производных для хромато-масс-спектрометрического определения на уровне 1 мкг/мл. Оптимизированы температуры и времена реакций с использованием расчетного показателя Dn. Показано, что при дериватизации реагентами ГМДС, и ТБДФС необходимо добавление активирующих добавок иода и N-метилимидазола соответственно. Разделение десяти ТМС- и ТБДФС-производных β-аминоспиртов достигается на колонке с неполярной фазой НР-5MS. Структурные изомеры МПЭА и МИЭА разделяются только в виде производных МПЭА-ТБДФС и МИЭА-ТБДФС на неподвижной фазе средней полярности VF-1701 MS.
Список литературы
Convention on the Prohibition of the Development, Stockpiling and Use of Chemical Weapons and on their Destruction. Technical Secretariat of the Organization for Prohibition of Chemical Weapons. The Hague, 1997. http://www.opcw.org (22.05.2020).
Zenkevich I.G. Derivatization of analytes in chromatography: general aspects / Encyclopedia of Chromatography / Ed. Cazes J. New York: Taylor & Francis, 2010. V. 1. P. 562.
Black R.M., Muir B. Derivatisation reactions in the chromatographic analysis of chemical warfare agents and their degradation products // J. Chromatogr. A. 2003. V. 1000. P. 253.
Valdez C.A., Leif R.N., Hok S., Hart B.R. Analysis of chemical warfare agents by gas chromatography-mass spectrometry: Methods for their direct detection and derivatization approaches for the analysis of their degradation products // Rev. Anal. Chem. 2018. V. 37. № 1. https://doi.org/10.1515/revac-2017-0007
Witkiewicz Z., Neffe S., Sliwka E., Quagliano J. Analysis of the precursors, simulants and degradation products of chemical warfare agents // Crit. Rev. Anal. Chem. 2018. V. 48. № 5. P. 337. https://doi.org/10.1080/10408347.2018.1439366
Kanaujia P.K., Tak V., Pardasani D., Gupta A.K., Dubey D.K. Application of cation-exchange solid-phase extraction for the analysis of amino alcohols from water and human plasma for verification of Chemical Weapons Convention // J. Chromatogr. A. 2008. V. 1185. P. 167.
Singh V., Garg P., Chinthakindi S., Tak V., Dubey D.K. Extraction and derivatization of chemical weapons convention relevant aminoalcohols on magnetic cation-exchange resins // J. Chromatogr. A. 2014. V. 1329. P. 10.
Byrd G.D., Paule R.C., Sander L.C., Sniegoski L.T., Bausum H.T. Determination of 3-quinuclidinyl benzilate (QNB) and its major metabolites in urine by isotope dilution gas chromatography/mass spectrometry // J. Anal. Toxicol. 1992. V. 16. P. 182.
Kenar L., Alp O. Determination of nitrogen mustard hydrolysis products in rat urine samples using GC–MS // J. Chromatogr. Sci. 2011. V. 49. P. 361.
Ohsawa I., Seto Y. Determination of nitrogen mustard hydrolysis products, ethanolamines by gas chromatography–mass spectrometry after tert-butyldimethyl-silyl derivatization // J. Chromatogr. A. 2006. V. 1122. P. 242.
Новикова И.В., Смирнова Ж.В., Новиков Р.И., Курыгина Л.П. Определение β-аминоспиртов в почве методом газовой хромато-масс-спектрометрии // Химия и технология органических веществ. 2020. № 2. С. 57.
Lee H.S.N., Sng M.T., Basheer C., Lee H.K. Determination of basic degradation products of chemical warfare agents in water using hollow fibre-protected liquid-phase microextraction with in-situ derivatisation followed by gas chromatography–mass spectrometry // J. Chromatogr. A. 2008. V. 1196–1197. P. 125.
Kenar L., Alp O. Comparison of organic solvents used for the determination of mustard gas hydrolysis products in urine samples using gas chromatography-mass spectrometry // Anal. Lett. 2010. V. 43. P. 417.
Valdez C.A., Leif R.N., Hart B.R. Rapid and mild silylation of β-amino alcohols at room temperature mediated by N-methylimidazole for enhanced detectability by gas chromatography/electron ionization mass spectrometry // Rapid Commun. Mass Spectrom. 2014. V. 28. P. 2217.
Chinthakindi S., Purohit A., Singh V., Dubey D.K., Pardsani D. On-matrix derivatization extraction of chemical weapons convention relevant alcohols from soil // J. Chromatogr. A. 2013. V. 1311. P. 170.
Garg P., Purohit A., Tak V.K., Dubey D.K. Enhanced detectability of fluorinated derivatives of N,N-dialkylaminoalcohols and precursors of nitrogen mustards by gas chromatography coupled to Fourier transform infrared spectroscopy analysis for verification of chemical weapons convention // J. Chromatogr. A. 2009. V. 1216. P. 7906.
Chinthakindi S., Purohit A., Singh V., Tak V., Dubey D.K., Pardasani D. Magnetic graphene – polystyrene sulfonic acid nano composite: A dispersive cation exchange sorbent for the enrichment of aminoalcohols and ethanolamines from environmental aqueous samples // J. Chromatogr. A. 2015. V. 1423. P. 54. https://doi.org/10.1016/j.chroma.2015.10.087
Chandra B., Roy S.K., Shaik M., Waghmare C., Palit M. Mass spectral studies of silyl derivatives of partially hydrolyzed products of nitrogen mustards: Important markers of nitrogen mustard exposure // Rapid Commun. Mass Spectrom. 2020. V. 34. № 3. https://doi.org/10.1002/rcm.8586
Новикова И.В., Смирнова Ж.В., Петрунин В.А. Новиков Р.И., Курыгина Л.П. Перфторацилирование β-аминоспиртов для их анализа методом газовой хромато-масс-спектрометрии // Химия и технология органических веществ. 2019. № 3. С. 55.
Mazumder A., Kumar A., Purohit A.K., Dubey D.K. Application of high performance liquid chromatography coupled to on-line solid-phase extraction-nuclear magnetic resonance spectroscopy for the analysis of degradation products of V-class nerve agents and nitrogen mustards // J. Chromatogr. A. 2010. V. 1217. P. 2887.
Palit M., Mallard G. Dispersive derivatization liquid–liquid extraction of degradation products/precursors of mustards and V-agents from aqueous samples // J. Chromatogr. A. 2011. V. 1218. P. 5393.
Chandra B., Roy K.S., Shaik M., Waghmare C., Palit M. Mass spectral fragmentation of perfluoroacyl derivatives of half nitrogen mustards for their detection by gas chromatography/mass spectrometry // Rapid Commun. Mass Spectrom. 2020. V. 34. https://doi.org/10.1002/rcm.8777
Recommended operating procedures for analysis in the verification of chemical disarmament / Ed. Vanninen P. The Ministry for Foreign Affairs of Finland, University of Helsinki, 2017. 809 p. http://www.helsinki.fi/verifin/bluebook (12.12.2019)
Rudine A.B., Walter M.G., Wamser C.C. Reaction of dichloromethane with pyridine derivatives under ambient conditions // J. Org. Chem. 2010. V. 75. P. 4292.
Nevstad G.O., Songstad J. Solvent properties of dichloromethane. II. The reactivity of dichloromethane toward amines // Acta Chem. Scandinav. B. 1984. V. 38. P. 469.
Кондратьев В.А., Юдина И.А., Куткин А.В., Новикова И.В., Новиков Р.И., Смирнова Ж.В. Препаративный метод синтеза галогенидов 1-(галогенметил)-(±)-3-хинуклидинолов // Журн. общ. химии. 2016. Т. 86. № 9. С. 1573. (Kondrat’ev V.A., Yudina I.A., Kutkin A.V., Novikova I.V., Novikov R.I., Smirnova Zh.V. Preparative method of synthesis of 1-(halomethyl)-(±)-3-quinuclidinol halides // Russ. J. Gen. Chem. 2016. V. 86. № 9. P. 2135.)
Hartman W.W. β-Diethylaminoethyl alcohol // Org. Synth. 1934. V. 14. P. 28.
Kalszyner A., Galun A.B. N-methylation of amino alcohols and amino mercaptans // J. Org. Chem. 1961. V. 26. № 9. P. 3536.
Байгильдиев Т.М., Вокуев М.Ф., Орешкин Д.В., Браун А.В., Годовиков И.А., Рыбальченко И.В., Родин И.А. n-Метоксифенацилбромид – универсальный реагент для определения алкилфосфоновых и алкилметилфосфоновых кислот методами высокоэффективной жидкостной и газовой хроматографии с масс-спектрометрическим детектированием // Масс-спектрометрия. 2019. Т. 16. № 3. С. 180. (Baygildiev T.M., Vokuev M.F., Oreshkin D.V., Braun A.V., Godovikov I.A., Rybalchenko I.V., Rodin I.A. p-Methoxyphenacyl bromide as a versatile reagent for the determination of alkylphosphonic and alkylmethylphosphonic acids by high-performance liquid and gas chromatography with mass spectrometric detection // J. Anal. Chem. 2020. V. 75. № 13. P. 1708.)
Laric Z.R. Design of Experiments in Chemical Engineering. A practical guide. Weinheim: John Wiley & Sons, 2004. P. 157.
Sarvin B., Fedorova E., Shpigun O., Titova M., Nikitin M., Kochkin D., Rodin I., Stavrianidi A. LC-MS determination of steroidal glycosides from Dioscorea deltoidea Wall cell suspension culture: Optimization of pre-LC-MS procedure parameters by Latin Square design // J. Chromatogr. B. 2018. V. 1080. P. 64.
Karimi B., Golshani B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions // J. Org. Chem. 2000. V. 65. P. 7228.
Little J.L. Artifacts in trimethylsilyl derivatization reactions and ways to avoid them // J. Chromatogr. A. 1999. V. 844. № 1–2. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии