Журнал аналитической химии, 2022, T. 77, № 2, стр. 164-175
Полиэлектролитные комплексы полиэтиленимин–ДНК в составе вольтамперометрических сенсоров для регистрации повреждений ДНК
А. Н. Маланина a, *, Ю. И. Кузин a, А. Н. Иванов a, Г. К. Зиятдинова a, Д. Н. Шурпик a, И. И. Стойков a, Г. А. Евтюгин a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: malanast@mail.ru
Поступила в редакцию 20.06.2021
После доработки 26.08.2021
Принята к публикации 26.08.2021
- EDN: GIKMCT
- DOI: 10.31857/S0044450222020104
Аннотация
Разработан вольтамперометрический ДНК-сенсор на основе полиэлектролитных комплексов полиэтиленимина и ДНК, получаемых путем самосборки из растворов компонентов на стеклоуглеродном электроде. С помощью циклической вольтамперометрии исследованы условия получения и характеристики проницаемости комплекса для низкомолекулярных редокс-индикаторов, различающихся по механизму взаимодействия с ДНК (метиленовый синий и метиленовый зеленый). Формирование полиэлектролитного комплекса независимо подтверждено измерением поверхностного плазмонного резонанса. Токи пика окисления-восстановления метиленового синего и метиленового зеленого по-разному менялись в зависимости от числа слоев комплекса и природы внешнего слоя, что обусловлено различными механизмами связывания индикаторов молекулами ДНК и варьированием плотности сборки полиэлектролитов комплекса. Увеличение концентрации полиионов с 0.1 до 10 мкг/мл подавляло влияние заряда внешнего слоя на токи индикаторов. Полиэлектролитные покрытия опробованы для регистрации специфических взаимодействий ДНК, включая интеркалирование противораковым препаратом доксорубицином, термическую и химическую денатурацию ДНК. Показано, что введение в состав слоя декакарбоксилированного пиллар[5]арена повышает чувствительность сигнала метиленового синего к термической денатурации ДНК. Сравнение изменения токов пика метиленового синего и метиленового зеленого позволяет различать механизм повреждения ДНК и отдельно учитывать вклад рассмотренных химических и физических повреждающих факторов. Разработанный ДНК-сенсор позволяет полуколичественно оценивать протекторное действие антиоксидантов, снижающих влияние активных форм кислорода на ДНК в составе биосенсора.
Современный этап развития электрохимических биосенсоров характеризуется особым вниманием к совершенствованию подходов к сборке чувствительного слоя для ускорения отклика, повышения его селективности и чувствительности в отношении аналитов, востребованных, прежде всего, в медицине и фармацевтике [1–3]. Одним из актуальных направлений модификации поверхности электрохимических сенсоров является сборка полиэлектролитных комплексов (ПЭК), состоящих из высокомолекулярных соединений, включающих способные к ионизации или заряженные функциональные группы. В зависимости от заряда функциональных групп полиэлектролиты подразделяют на катионные (полиаллиламин гидрохлорид, полиэтиленимин (ПЭИ), полидиаллилдиметиламмоний хлорид) и анионные (полистиролсульфонат, поливинилсульфат, полиметакриловая кислота, нафион, ДНК). Благодаря электростатическим взаимодействиям заряженные молекулы полиэлектролитов могут участвовать в послойной сборке ПЭК на твердой подложке, включая поверхность электрода – преобразователя сигнала сенсора и биосенсора. Благодаря легкости реализации процессов самосборки и возможностям управления ими путем выбора соответствующих полиэлектролитов формирование ПЭК получило широкое распространение при создании современных сенсоров [4]. При этом успех модификации электрода зависит от большого числа экспериментальных факторов – это длина полимерной молекулы полиэлектролита, ее жесткость, число заряженных центров, ионная сила раствора и др. [5]. Тем не менее простота методики формирования ПЭК путем последовательного капельного нанесения разноименно заряженных полиэлектролитов и возможность контроля толщины покрытий по числу стадий добавления компонентов слоя, проницаемость ПЭК для низкомолекулярных ионов, включая электрохимические активные индикаторы, а также совместимость с протоколами нековалентной иммобилизации биокомпонента биосенсоров обусловливают большой интерес к таким методам создания электрохимических сенсоров и биосенсоров. Материалы на основе ПЭК применяли в составе сенсоров для определения ионов металлов [6–8], аминокислот [9], биомаркеров онкологических заболеваний [10], раковых клеток [11], полициклических ароматических углеводородов [12], а также при создании антикоррозионных покрытий [13]. При необходимости ПЭК могут включать относительно некрупные молекулы и даже наночастицы, такие как комплекс меди(II) с тетрасульфонатным производным фталоцианина [14], наночастицы золота [15] и платины [16], ионы ферроциния [17]. Полиэлектролитные комплексы хорошо зарекомендовали себя в составе биосенсоров на основе ДНК [18–20] и ферментов [21–24]. Кроме того, ПЭК используют для иммобилизации бактерий [25]. Полиэтиленимин – аморфный органический полимер с жесткой структурой, включающей полярные аминогруппы и гидрофобные виниловые фрагменты, – нашел применение в составе электрохимических и оптических сенсоров как носитель рецепторных и вспомогательных молекул [26–31].
ДНК-сенсоры привлекают медиков, фармацевтов, экологов и биотехнологов благодаря актуальности регистрации химических и физических факторов, влияющих на структуру биополимера и проявление его биохимических функций. Это же касается синтетических аналогов ДНК – аптамеров, структура которых устанавливается, исходя из селективности связывания биомолекул [32, 33]. Собственные электрохимические сигналы двухцепочечных молекул ДНК нашли применение в работе ДНК-сенсоров, однако они проявляют необходимую чувствительность к аналитам при использовании относительно коротких фрагментов нуклеиновых кислот [34]. Высокомолекулярные молекулы ДНК малоактивны на электродах в силу стерических ограничений при окислении азотистых оснований. Регистрация биоспецифических взаимодействий с участием таких молекул возможна в основном косвенным путем, например, по сигналам интеркалятора валирубицина, меняющего свою активность при реакции с двухцепочечными молекулами ДНК из тимуса теленка и молок лосося [35]. В подобного рода биосенсорах важное значение имеет сохранение нативной структуры ДНК и ее вовлеченность в цепь переноса электрона. Это открывает перспективы применения таких биосенсоров для регистрации повреждения ДНК под действием химических и физических факторов, а также для регистрации гибридизации комплементарных последовательностей ДНК, сопровождающейся перестройкой конфигурации молекул в составе поверхностного слоя биосенсора [36]. Иммобилизация ДНК в ПЭК в этой связи является актуальным направлением, позволяющим рассчитывать на улучшение аналитических и операционных характеристик таких биосенсоров [37].
Данная работа посвящена вольтамперометрическому исследованию формирования на поверхности стеклоуглеродного электрода (СУЭ) ПЭК на основе ПЭИ и нативной двухцепочечной ДНК из молок лосося. Рассмотрены различия во взаимодействии диффузионно свободных редокс-индикаторов (метиленовый синий и метиленовый зеленый) с молекулами ДНК и влияние таких различий на их вольт-амперный отклик. Впервые предложено включение в состав ПЭК декакарбоксилированного пиллар[5]арена P[5]A-(COOH)10 как одного из анионных компонентов комплекса и оценено влияние данного компонента на регистрацию повреждений ДНК и протекторного действия антиоксидантов чая, а также на определение доксорубицина, противоракового препарата цитостатического действия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
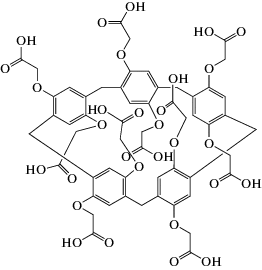
Реагенты. Использовали двухцепочечную ДНК из молок лосося (средняя молекулярная масса 4.6 кДа) (Fluka, Германия), доксорубицина гидрохлорид, метиленовый синий (МС) и метиленовый зеленый (МЗ), ПЭИ (средняя молекулярная масса 10 кДа) и 11-меркаптоундекановую кислоту (МУК) (Sigma-Aldrich, Германия). Макроцикл P[5]A-(COOH)10 (схема 1 ) синтезирован на кафедре органической химии КФУ. Все реагенты использовали без дополнительной очистки.
Схема 1 . Структурная формула декакарбоксили- рованного пиллар [5]арена.
Вольтамперометрические измерения проводили в 0.05 М ацетатном буферном растворе с pH 4.54 в присутствии 0.1 мМ МЗ или МС в режиме постояннотоковой вольтамперометрии с помощью потенциостата-гальваностата AUTOLAB PGSTAT 302N (Metrohm Autolab, Нидерланды). В качестве рабочих электродов использовали СУЭ, изготовленные из стеклоуглеродных стержней СУ2000 диаметром 1.7 мм (НИИГрафит, Москва) в изолирующем корпусе из политетрафторэтилена, снабженном стальным токосъемником на резьбовом соединении. Противоэлектродом служил платиновый электрод, электродом сравнения – хлоридсеребряный электрод Ag/AgCl/3.0 М KCl (Metrohm AG, Херисау, Швейцария). Измерения проводили в нетермостатируемой трехэлектродной ячейке объемом 5 мл. Данные обрабатывали с помощью программного продукта GPES (Metrohm Autolab, Нидерланды).
Измерение поверхностного плазмонного резонанса (ППР). Сигналом служило изменение резонансного угла падения лазерного излучения (670 нм), выраженное в миллиградусах (мград, m°) и измеренное с помощью анализатора поверхностного плазмонного резонанса AUTOLAB ESPRIT (Metrohm Autolab, Нидерланды). Динамический диапазон регистрации сигнала ППР составлял 4000 m°. Сенсором служил стеклянный диск (марка стекла BK-7) диаметром 25 мм с золотым покрытием толщиной 48 нм, который помещали на полуцилиндрическую призму в слайдере оптического блока анализатора. Измерительную ячейку объемом 120 мкл фиксировали поверх стеклянного сенсора со стороны золотого покрытия, рабочая площадь электрода ограничивалась отверстием ячейки на стороне контакта с сенсором и составляла 5 мм2.
Модификация стеклоуглеродного электрода. Электрод механически полировали, промывали водой и этанолом и закрепляли в штативе рабочей поверхностью вверх. После этого на рабочую поверхность наносили 2 мкл ПЭИ в ацетатном буферном растворе (100 нг/мл), электрод закрывали пластиковой пробиркой для предотвращения высыхания на 6 мин, далее промывали дистиллированной водой. Процедуру повторяли, чередуя нанесение ПЭИ и ДНК (100 нг/мл). В некоторых случаях вместо ДНК в ПЭК аналогичным образом вводили P[5]A-(COOH)10 (2 мкл 10 мкМ раствора на электрод).
Оценка повреждения ДНК и защитного эффекта компонентов чая. Для термической денатурации 1 мг/мл раствор нативной ДНК нагревали в течение 30 мин при 90°С в твердотельном термостате с последующим переносом и охлаждением в ледяной воде в течение 5 мин. Полученный раствор немедленно использовали для иммобилизации ДНК в составе биосенсора. При изучении действия противоракового препарата доксорубицина ДНК-сенсор инкубировали в 5 мкМ растворе интеркалятора в воде в течение 20 мин, после чего регистрировали циклические вольтамперограммы (ЦВА) в растворе МС или МЗ. Окисление ДНК проводили в растворе состава 0.4 мМ CuSO4 и 14.3 мМ H2O2 в течение 1 ч. После этого раствор окисленной ДНК использовали для формирования ПЭК на электроде. При изучении защитного действия образцы пакетированного черного чая без добавок, доступные в торговой сети, заваривали в соответствии с рекомендациями производителя, охлаждали до комнатной температуры, разбавляли ацетатным буферным раствором (5, 10 и 15 об. %) и добавляли к раствору ДНК на стадии ее окисления. После этого измеряли сигнал ДНК-сенсора по МС или МЗ, как описано выше.
Оценку интегральной антиоксидантной емкости чая проводили кулонометрически по реакции с электрогенерированным бромом на анализаторе Эксперт-006 (ООО “Эконикс-Эксперт”, Россия) [38]. Электрогенерацию брома осуществляли из 0.2 М раствора KBr в 0.1 М H2SO4 (20 мл, аликвота чая 50 мкл) на платиновом электроде при постоянной силе тока 5.0 мА в ячейке с разделенными электродными пространствами. В качестве катода использовали платиновую проволоку. Конечную точку титрования определяли биамперометрически с платиновыми электродами (ΔЕ = 200 мВ). Интегральную антиоксидантную емкость чая выражали как количество электричества, затраченное на титрование, в пересчете на 100 мл образца.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика образования полиэлектролитного комплекса полиэтиленимин–ДНК путем измерения поверхностного плазмонного резонанса. Анализ поверхностного плазмонного резонанса является высокочувствительным оптическим методом, вариантом эллипсометрии, который позволяет с высокой чувствительностью характеризовать процессы на границе раздела двух оптически прозрачных сред (стеклянных призм) с нанесенным на одну из них тонким слоем золота. Помимо количественной характеристики различных биохимических взаимодействий, его применяют также для мониторинга сборки ПЭК [39]. Суть метода заключается в измерении угла полного внутреннего отражения. В присутствии тонкого слоя золота часть энергии электромагнитного излучения поглощается в пленке металла, вызывая образование так называемых плазмонов – синхронно перемещающихся в пленке металла пакетов свободных электронов с идентичными макрохарактеристиками. При достижении условия образования плазмонов рассеяние электромагнитной энергии в пленке скачкообразно возрастает, т.е. наблюдается резонансное поглощение излучения. Резонансный угол регистрируется как узкая полоса поглощения в окне детектора отраженного излучения. Любые процессы на границе раздела фаз меняют условия полного отражения и величину резонансного угла.
Для подтверждения формирования ПЭК проводили эксперименты по сборке покрытий ПЭИ–ДНК на поверхности золотой пленки сенсора. Предварительно поверхность золота обрабатывали 10 мМ спиртовым раствором МУК для формирования отрицательно заряженного монослоя как основы сборки ПЭК. В дальнейшем значение сигнала ППР для золота, покрытого МУК, принимали нулевой точкой отсчета изменения резонансного угла (рис. 1). Для формирования ПЭК через проточную ячейку с сенсором последовательно прокачивали растворы ПЭИ и ДНК. Непрореагировавшие компоненты удаляли промывкой буферном раствором (см. “Экспериментальную часть”). Полученные сенсограммы (рис. 2) демонстрируют увеличение сигнала с ростом числа слоев полиэлектролитов, что отвечает формированию и накоплению ПЭК. Для больших концентраций полиэлектролитов можно заметить формирование “ступеней” с незначительным изменением сигнала (рис. 1а). Это связано с частичным уходом молекул полииона из внешнего слоя ПЭК при его погружении в раствор противоположно заряженного полиэлектролита в результате конкурентных взаимодействий с противоионами на поверхности сенсора и в растворе. Для меньших концентраций полиэлектролитов такая картина наблюдается лишь для первых трех бислоев ПЭИ–ДНК (рис. 1б). По-видимому, в этом случае из состава комплекса удаляется ПЭИ, в отличие от ПЭК, соответствующего высоким концентрациям полиэлектролитов. Однако поскольку при последовательном увеличении общего числа слоев продолжают наблюдаться изменения резонансного угла, полной отмывки материала с поверхности сенсора не происходит.
Рис. 1.
Зависимость сигнала поверхностного плазмонного резонанса от числа слоев полиэтиленимина и ДНК для концентрации полиэлектролитов 0.1 (а) и 0.1 мг/мл (б). Стрелками обозначена последовательность нанесения слоев: 1 – 11-меркаптоундекановая кислота, 2 – полиэтиленимин, 3 – ДНК.

Рис. 2.
Циклические вольтамперограммы 0.01, 0.05, 0.1, 0.5 и 1.0 мМ метиленового синего (а, б) и метиленового зеленого (в, г), полученные на стеклоуглеродном электроде, модифицированном полиэтиленимином (а, в) и (полиэтиленимин–ДНК)3 (б, г), в 0.05 М ацетатном буферном растворе с pH 4.54.

Вольтамперометрическое исследование формирования полиэлектролитного комплекса полиэтиленимин–ДНК. Для контроля процессов сборки ПЭК на поверхности СУЭ использовали два диффузионно свободных редокс-индикатора: метиленовый синий и метиленовый зеленый. Оба соединения относятся к классу фенотиазинов и участвуют в электродной реакции с переносом двух электронов и одного протона водорода. Метиленовый синий способен интеркалировать двухцепочечную ДНК. Включение в состав биополимера меняет его активность в электродных реакциях [40], что позволяет использовать МС для мониторинга процессов гибридизации ДНК и фрагментов аптамеров [41]. Метиленовый зеленый из-за наличия в фенотиазиновом ядре нитрогруппы такой способностью не обладает и взаимодействует с молекулами ДНК в основном электростатически по бороздкам двухцепочечной молекулы ДНК. По этой причине МЗ чаще используют как медиатор электронного переноса в составе ферментативных биосенсоров [42, 43].
Для вольтамперометрического изучения ПЭК на поверхности СУЭ регистрировали ЦВА на модифицированных электродах при различных концентрациях МС и МЗ (рис. 2, 3). При переходе от одно- (ПЭИ) к шестислойным (ПЭИ-ДНК)3 покрытиям для МС наблюдали значительный сдвиг тока пика восстановления (рис. 3а, 3б), что связано с электростатическим отталкиванием редокс-индикатора от положительно заряженного слоя поликатиона. Аккумуляция отрицательно заряженных молекул ДНК в составе модифицирующего слоя приводила к накоплению МС у поверхности СУЭ. В результате на ЦВА наблюдали уменьшение разности потенциалов и увеличение токов пиков красителя. Для МЗ значительных изменений указанных параметров при переходе к (ПЭИ-ДНК)3 не наблюдали (рис. 3в, 3г). Таким образом, дополнительного концентрирования редокс-индикатора, установленного в случае МС, в случае МЗ не происходит. Более того, разность потенциалов пиков МЗ на ЦВА при увеличении числа слоев полиионов в ПЭК возрастала, что свидетельствует о торможении переноса электрона через слой ПЭК. Интересно, что положение пиков окисления МЗ и МС сохраняется независимо от состава покрытия СУЭ. Вероятно, это связано с образованием в катодной реакции незаряженной восстановленной формы красителя, которая в меньшей степени испытывает притяжение и отталкивание со стороны полиионов.
Рис. 3.
Концентрационные зависимости токов пиков окисления (а, в) и восстановления (б, г) метиленового синего (а, б) и метиленового зеленого (в, г) на стеклоуглеродном электроде, модифицированном полиэлектролитными комплексами различного состава. Приведены средние значения и доверительные интервалы, рассчитанные для трех индивидуальных ДНК-сенсоров.

Варьирование концентраций МС и МЗ показало следующие различия в поведении этих редокс-индикаторов в зависимости от заряда внешнего слоя ПЭК (присутствия в нем ПЭИ или ДНК) (рис. 4). В экспериментах с МС токи пиков окисления/восстановления росли с увеличением числа слоев ПЭК (рис. 4а, 4б). Для МЗ токи пика были стабильны и несколько снижались в том же ряду (рис. 4в, 4г). Другое заметное различие – зависимость токов пиков окисления/восстановления МС и МЗ от наличия шестого слоя ДНК в составе ПЭК. Для всех исследуемых концентраций МС токи пика резко увеличиваются на СУЭ, модифицированном (ПЭИ-ДНК)3, тогда как для МЗ происходит, по-видимому, смывание шестого слоя при увеличении концентрации редокс-индикатора до 1 мМ и стабилизация токов на уровне, зарегистрированном на пятислойном ПЭК. Наиболее вероятно, это объясняется нарушением стабильности комплекса в результате нековалентного взаимодействия молекул МЗ с ДНК по бороздкам двойной спирали. Такое взаимодействие частично компенсирует отрицательный заряд биомолекулы, уменьшая электростатическое связывание между слоями ПЭИ и ДНК. Для МС регистрируемые токи пика возрастают с увеличением концентрации красителя до 1 мМ. Вероятно, интеркалированная ДНК более прочно связывается с ПЭИ за счет увеличения доступности центров связывания из-за повышения объема биомолекулы в результате интеркалирования и стерического разделения зарядов рибозофосфатных групп остова.
Рис. 4.
Зависимости токов окисления (а, в) и восстановления (б, г) метиленового синего (а, б) и метиленового зеленого (в, г) от числа слоев полиэлектролитов в полиэлектролитном комплексе. 0.05 М ацетатный буферный раствор с рН 4.54. Приведены средние значения и доверительные интервалы, рассчитанные для трех индивидуальных ДНК-сенсоров.

Для более детального рассмотрения выявленных закономерностей необходимо обратиться к зависимостям тока от числа слоев для постоянной концентрации редокс-индикатора. Для первых двух слоев (нанесение ПЭИ и ДНК) происходит незначительное изменение токов пика МЗ вследствие взаимной диффузии компонентов, но уже с третьего слоя (покрытие ПЭИ–ДНК–ПЭИ) токи снижаются в результате отталкивания молекул редокс-индикатора от положительно заряженных молекул ПЭИ и в связи с продолжающимся процессом уплотнения слоев ПЭК. Затем снова следует рост токов пика, обусловленный электростатическим притяжением между молекулами МЗ и отрицательно заряженными молекулами ДНК (покрытие ПЭИ–ДНК–ПЭИ–ДНК). В случае МС нековалентное взаимодействие с ДНК реализуется в том числе за счет интеркаляции красителя между азотистыми основаниями. При этом изменяется занимаемый молекулой ДНК объем. Она деформируется, что увеличивает доступность отрицательных зарядов рибозофосфатных групп остова ДНК для электростатических взаимодействий с ПЭИ и редокс-индикатором. Относительные изменения тока в случае МС имеют менее выраженный характер, но “пилообразная” форма зависимости сохраняется. Также подтвердилась отмеченная ранее тенденция увеличения токов пика МС при переходе от одно- к шестислойным покрытиям.
При увеличении концентрации используемых полиэлектролитов до 10 мкг/мл тенденция к общему снижению токов МЗ с ростом числа слоев в покрытии сохраняется. Однако стоит отметить, что зависимость уже не имеет “пилообразной” формы и для МЗ, и для МС. Это можно объяснить усиленной внутренней диффузией слоев ПЭК друг относительно друга, при которой влияние заряда внешнего слоя частично нивелируется.
Для подтверждения перспективности изученных ПЭК в составе биосенсора были провели эксперименты с интеркалированием ДНК, а та-кже с ее химическим и термическим повреждением.
Доксорубицин – цитостатический противораковый препарат, интеркалирующий ДНК и нарушающий тем самым процессы роста, развития и деления раковых клеток. Для изучения его влияния на характеристики биосенсора использовали ПЭК состава (ПЭИ–ДНК)3. Биосенсор инкубировали в 5 мкМ растворе доксорубицина в течение 20 мин, после чего промывали и переносили в ацетатный буферный раствор с 0.1 мМ МС или МЗ. Токи пиков окисления и восстановления редокс-индикаторов сопоставлены на рис. 5а, 5б. Как видно, после интеркалирования токи окисления/восстановления редокс-индикаторов снижаются. Причиной может быть преобладающий вклад уплотнения сформированного покрытия после интеркаляции ДНК. Выше отмечено, что в процессе интеркаляции изменяется конфигурация биомолекулы и отрицательные заряды на её поверхности становятся более доступными, поэтому появляется возможность взаимной диффузии слоев, что вызывает пространственные затруднения для подхода индикатора к поверхности электрода. К тому же в условиях эксперимента молекулы доксорубицина заряжены положительно за счет протонирования аминогруппы, что компенсирует отрицательный заряд фосфатных групп ДНК, снижая притяжение положительно заряженных молекул фенотиазиновых индикаторов.
Рис. 5.
Токи пиков окисления (а, в) и восстановления (б, г) метиленового синего и метиленового зеленого для покрытий (полиэтиленимин-ДНК)3, содержащих нативную (1), интеркалированную доксорубицином (2) и термически денатурированную ДНК (3). Приведены средние значения и доверительные интервалы, рассчитанные для трех индивидуальных ДНК-сенсоров.

Термическую денатурацию ДНК проводили при 90°С в течение 30 мин. При такой обработке молекулы двухцепочечной ДНК частично дегибридизируются из-за разрыва водородных связей и нарушения стэкинга между азотистыми основаниями, удерживающими двойную спираль нативных молекул биополимера. После резкого охлаждения раствор денатурированной ДНК использовали для формирования шестислойного ПЭК. Полученные токи пиков МС и МЗ на вольтамперограммах сравнивали с аналогичными характеристиками для молекул нативной ДНК (рис. 5б, 5в). Как видно, изменения токов пиков редокс-индикаторов имеют направление, противоположное наблюдаемому в экспериментах с доксорубицином. Молекулы денатурированной ДНК несут отрицательные заряды, более доступные для электростатических взаимодействий по причине большей гибкости одноцепочечной ДНК. Как следствие, значительное количество отрицательных зарядов ДНК остается нескомпенсированным, поэтому электростатическое притяжение положительно заряженных молекул медиатора к ПЭК увеличивается несмотря на уплотнение слоя.
Поскольку дискриминация сигнала определяется изменением электростатических взаимодействий в ПЭК, представляло интерес ввести в состав поверхностного слоя дополнительные модификаторы с высокой плотностью отрицательного заряда. Для этого выбрали декакарбоксилированное производное пиллар[5]арена (схема 1 ). Его введение в состав шестислойного ПЭК (ПЭИ–ДНК)3 в качестве четвертого слоя вдвое увеличило разность сигналов МС, отвечающих нативной и термически денатурированной ДНК. Эффект проявляется независимо от положения макроцикла в ПЭК, однако разница токов пика выше для пилларарена, занимающего место внутри слоя (четвертая позиция). Это облегчает различение образцов нативной и поврежденной ДНК и позволяет отдельно учесть влияние интеркалирования и повреждения структуры ДНК.
Окислительное повреждение ДНК выполняли смесью Cu2+/H2O2 в течение часа [44]. После этого раствор окисленной ДНК использовали для формирования многослойных покрытий на поверхности СУЭ. Предварительные эксперименты показали максимальную разницу между нативной и окисленной ДНК при использовании в качестве индикатора МС и при нанесении на СУЭ шестислойного ПЭК. Такую конфигурацию биосенсора использовали для дальнейших экспериментов. Установили снижение сигнала МС при переходе от нативной к окисленной ДНК. Химическое окисление молекул ДНК сопровождается не только окислением азотистых оснований, но и раскручиванием биомолекулы и обрывами цепей [45]. Эти изменения негативно сказываются на интеркаляционном накоплении МС и создают дополнительные диффузионные затруднения переноса МС в результате уплотнения ПЭК, включающего фрагментированные биомолекулы. Интересно, что добавление экстракта чая, содержащего антиоксиданты, способствует защите молекул ДНК от активных форм кислорода. Сигнал МС растет с увеличением объема добавляемого экстракта и снижается при его разбавлении (рис. 6). Изменения тока МС коррелируют с оценкой антиоксидантных свойств чая с помощью кулонометрического титрования электрогенерированным бромом. Результаты двух методов приведены в табл. 1. Хотя полной корреляции не наблюдается, можно говорить о синхронности изменения показателей при анализе образцов чая с различным содержанием антиоксидантов. Таким образом, разработанные ДНК-сенсоры на основе ПЭК могут в перспективе найти применение в контроле защитного действия антиоксидантов в чае и продуктах питания.
Рис. 6.
Зависимости токов пиков окисления (а) и восстановления (б) 0.1 мМ раствора метиленового синего на стеклоуглеродном электроде, модифицированном (полиэтиленимин-ДНК)3, при предварительном окислении ДНК смесью 0.4 мМ CuSO4 и 14.3 мМ H2O2 от объема добавляемой в окислительную смесь аликвоты экстракта пяти образцов (1–5) пакетированного черного чая.

Таблица 1.
Сравнение данных кулонометрического титрования экстрактов чая и сигнала 0.1 мМ метиленового синего ДНК-сенсора на основе полиэлектролитного комплекса (полиэтиленимин-ДНК)3 при использовании в качестве источника активных форм кислорода смеси 0.4 мМ CuSO4 и 14.3 мМ H2O2
| Образец | Интегральная антиоксидантная емкость, Кл/100 мл | Ток пика окисления МС при аликвоте экстракта чая 0.05 мл |
|---|---|---|
| 1 | 308 ± 9 | 2.62 ± 0.13 |
| 2 | 594 ± 6 | 2.89 ± 0.11 |
| 3 | 420 ± 9 | 2.73 ± 0.11 |
| 4 | 446 ± 7 | 2.68 ± 0.16 |
| 5 | 412 ± 8 | 2.67 ± 0.18 |
Работа выполнена при поддержке Российского научного фонда (проект 17-13-01208).
Список литературы
Huo B., Hu Y., Gao Z., Li G. Recent advances on functional nucleic acid-based biosensors for detection of food contaminants // Talanta. 2021. V. 222. P. 121565. https://doi.org/10.1016/j.talanta.2020.121565
Miao J., Du K., Li X., Xu X., Dong X., Fang J., Cao W., Wei Q. Ratiometric electrochemical immunosensor for the detection of procalcitonin based on the ratios of SiO2-Fc–COOH–Au and UiO-66-TB complexes // Biosens. Bioelectron. 2021. V. 171. P. 112713. https://doi.org/10.1016/j.bios.2020.112713
Alvarez-Malmagro J., García-Molina G., De Lacey A.L. Electrochemical biosensors based on membrane-bound enzymes in biomimetic configurations // Sensors. 2020. V. 20. № 12. P. 3393. https://doi.org/10.3390/s20123393
Škugor Rončević I., Krivić D., Buljac M., Vladislavić N., Buzuk M. Polyelectrolytes assembly: a powerful tool for electrochemical sensing application // Sensors. 2020. V. 20. № 11. P. 3211. https://doi.org/10.3390/s20113211
Volodkin D., Von Klitzing R. Competing mechanisms in polyelectrolyte multilayer formation and swelling: Polycation-polyanion pairing vs. polyelectrolyte-ion pairing // Curr. Opin. Colloid Interface Sci. 2014. V. 19. № 1. P. 25. https://doi.org/10.1016/j.cocis.2014.01.001
Gutiérrez-Pineda E., Andreozzi P., Diamanti E., Anguiano R., Ziolo R.F., Moya S.E., José Rodríguez-Presa M., Gervasi C.A. Effects of valinomycin doping on the electrical and structural properties of planar lipid bilayers supported on polyelectrolyte multilayers // Bioelectrochemistry. 2021. V. 138. P. 107688. https://doi.org/10.1016/j.bioelechem.2020.107688
Han S., Yamamoto S., Polyravas A.G., Malliaras G.G. Microfabricated ion-selective transistors with fast and super-nernstian response // Adv. Mater. 2020. V. 32 № 48. P. 2004790. https://doi.org/10.1002/adma.202004790
Nikolaev K.G., Kalmykov E.V., Shavronskaya D.O., Nikitina A.A., Stekolshchikova A.A., Kosareva E.A., Zenkin A.A., Pantiukhin I.S., Orlova O.Y., Skalny A.V., Skorb E.V. ElectroSens platform with a polyelectrolyte-based carbon fiber sensor for point-of-care analysis of Zn in blood and urine // ACS Omega. 2020. V. 5. № 30. P. 18987. https://doi.org/10.1021/acsomega.0c02279
Яркаева Ю.А., Дубровский Д.И., Зильберг Р.А., Майстренко В.Н., Корнилов В.М. Вольтамперометрический сенсор на основе композита 3,4,9,10-перилентетракарбоновой кислоты для распознавания и определения энантиомеров тирозина // Журн. аналит. химии. 2020. Т. 75. № 12. С. 1108. (Yar-kaeva Yu.A., Dubrovskii D.I., Zil’berg R.A., Maistrenko V.N., Kornilov V.M. A voltammetric sensor based on a 3,4,9,10-perylenetetracarboxylic acid composite for the recognition and determination of tyrosine enantiomers // J. Anal. Chem. 2020 V. 75 № 12. P. 1537. https://doi.org/10.1134/S106193482011014310.1134/S1061934820110143)https://doi.org/10.31857/S0044450220110146
Zhong H., Zhao C., Chen J., Chen M., Luo T., Tang W., Liu J. Electrochemical immunosensor with surface-confined probe for sensitive and reagentless detection of breast cancer biomarker // RSC Adv. 2020. V. 10. № 38. P. 22291. https://doi.org/10.1039/d0ra01192d
Wang J., Wang X., Tang H., Gao Z., He S., Li J., Han S. Ultrasensitive electrochemical detection of tumor cells based on multiple layer CdS quantum dots-functionalized polystyrene microspheres and graphene oxide – Polyaniline composite // Biosens. Bioelectron. 2018. V. 100. P. 1. https://doi.org/10.1016/j.bios.2017.07.077
Pang Y., Huang Y., Li W., Feng L., Shen X. Conjugated Polyelectrolyte/Graphene multilayer films for simultaneous electrochemical sensing of three monohydroxylated polycyclic aromatic hydrocarbons // ACS Appl. Nano Mater. 2019. V. 2. № 12. P. 7785. https://doi.org/10.1021/acsanm.9b01821
Udoh I.I., Shi H., Liu F., Han E.H. Microcontainer-based waterborne epoxy coatings for AA2024-T3: Effect of nature and number of polyelectrolyte multilayers on active protection performance // Mater. Chem. Phys. 2020. V. 241. P. 122404. https://doi.org/10.1016/j.matchemphys.2019.122404
Shaik M., Rao V., Gupta M., Pandey P. Layer-by-layer self-assembling copper tetrasulfonated phthalocyanine on carbon nanotube modified glassy carbon electrode for electro-oxidation of 2-mercaptoethanol // Thin Solid Films. 2012. V. 526. P. 256. https://doi.org/10.1016/j.tsf.2012.10.121
Zanardi C., Terzi F., Zanfrognini B., Pigani L., Seeber R., Lukkari J., Ääritalo T. Effective catalytic electrode system based on polyviologen and Au nanoparticles multilayer // Sens. Actuators B: Chem. 2010. V. 144. № 1. P. 92. https://doi.org/10.1016/j.snb.2009.10.041
dos Santos M., Wrobel E., dos Santos V., Quináia S., Fujiwara S., Garcia J., Pessôa C.A., Scheffer E.W., Wohnrath K. Development of an electrochemical sensor based on LbL films of Pt nanoparticles and humic acid // J. Electrochem. Soc. 2016. V. 163. № 9. P. B499. https://doi.org/10.1149/2.1001609jes
Mathi S., Gupta P., Kumar R., Nagarale R., Sharma A. Ferrocenium ion confinement in polyelectrolyte for electrochemical nitric oxide sensor // ChemistrySelect. 2019. V. 4. № 13. P. 3833. https://doi.org/10.1002/slct.201803674
Kim G.J., Yoon K.J., Kim I.S., Kim K.O. Characterization of nano-structured poly(ε-caprolactone) membranes with DNA-doped polypyrrole via sonication-induced layer-by-layer assembly // Text. Res. J. 2019. V 89. № 7. P. 1267. https://doi.org/10.1177/0040517518767154
Bronder T., Poghossian A., Scheja S., Wu C., Keusgen M., Mewes D., Schöning M.J. DNA immobilization and hybridization detection by the intrinsic molecular charge using capacitive field-effect sensors modified with a charged weak polyelectrolyte layer // ACS Appl. Mater. Interfaces. 2015. V. 7. № 36. P. 20068. https://doi.org/10.1021/acsami.5b05146
Yoshida K., Kashimura Y., Kamijo T., Ono T., Dairaku T., Sato T., Kashiwagi Y., Sato K. Decomposition of glucose-sensitive layer-by-layer films using hemin, DNA, and glucose oxidase // Polymers. 2020. V. 12. № 2. P. 319. https://doi.org/10.3390/polym12020319
Salem S.R., Sullivan J.L., Topham P.D., Tighe B.J. Supramolecular host–guest carrier based on maltose-modified hyperbranched polymer and polyelectrolyte multilayers: Toward stable and reusable glucose biosensor // Polymer Bulletin. 2020. V. 77. № 6. P. 3143. https://doi.org/10.1007/s00289-019-02902-z
Lee S.W., Kang T.H., Lee S.K., Lee K.Y., Yi H. Hydrodynamic layer-by-layer assembly of transferable enzymatic conductive nanonetworks for enzyme-sticker-based contact printing of electrochemical biosensors // ACS Appl. Mater. Interfaces. 2018. V. 10. № 42. P. 36267. https://doi.org/10.1021/acsami.8b13070
Berninger T., Bliem C., Piccinini E., Azzaroni O., Knoll W. Cascading reaction of arginase and urease on a graphene-based FET for ultrasensitive, real-time detection of arginine // Biosens. Bioelectron. 2018. V. 115. P. 104. https://doi.org/10.1016/j.bios.2018.05.027
Salvo-Comino C., García-Hernández C., García-Cabezón C., Rodríguez-Méndez M.L. Discrimination of milks with a multisensor system based on layer-by-layer films // Sensors. 2018. V. 18. № 8. P. 2716. https://doi.org/10.3390/s18082716
Gammoudi I., Mathelié-Guinlet M., Benabdallah Z., Moroté F., Kahli H., Beven L., Kalfat R, Othmane A, Delville M.H, Grauby-Heywang C., Dejous C., Cohen-Bouhacina T. Revisiting of the physico-chemical properties of polyelectrolyte multilayers for a fine tuning of the immobilization of bacteria or nanoparticles // Thin Solid Films. 2020. V. 713 P. 138345. https://doi.org/10.1016/j.tsf.2020.138345
Yang D., Yang H., Guo X., Zhang H., Jiao C., Xiao W., Guo P., Wang Q., He D. Robust polyethylenimine electrolyte for high performance and thermally stable atomic switch memristors // Adv. Funct. Mater. 2020. V. 30. № 50. P. 2004514. https://doi.org/10.1002/adfm.202004514
Wang Q., Cheng X., Li H., Yu F., Wang Q., Yu M., Liu D., Xia, J. A novel DNA quantum dots/aptamer-modified gold nanoparticles probe for detection of Salmonella typhimurium by fluorescent immunoassay // Mater. Today Commun. 2020. V. 25. P. 101428. https://doi.org/10.1016/j.mtcomm.2020.101428
Zhang S., Li K.B., Pan Y., Han D.M. Ultrasensitive detection of ochratoxin A based on biomimetic nanochannel and catalytic hairpin assembly signal amplification // Talanta. 2020. V. 220. P. 121420. https://doi.org/10.1016/j.talanta.2020.121420
Ghanei-Motlagh M., Hosseinifar A. A novel amperometric hydrogen peroxide sensor based on gold nanoparticles supported on Fe3O4@polyethyleneimine // Int. J. Environ. Anal. Chem. 2020. V. 100. № 5. P. 591. https://doi.org/10.1080/03067319.2019.1637859
Zhou T., Su Z., Wang X., Luo M., Tu Y., Yan J. Fluorescence detections of hydrogen peroxide and glucose with polyethyleneimine-capped silver nanoclusters // Spectrochim. Acta A. 2021. V. 244. P. 118881. https://doi.org/10.1016/j.saa.2020.118881
Park J.J., Kim Y., Lee C., Kook J.-W., Kim D., Kim J.-H., Hwang K.-S., Lee J.-Y. Colorimetric visualization using polymeric core-shell nanoparticles: Enhanced sensitivity for formaldehyde gas sensors // Polymers. 2020. V. 12. № 5. P. 998. https://doi.org/10.3390/polym12050998
Oberhaus F.V., Frense D., Beckmann D. Immobilization techniques for aptamers on gold electrodes for the electrochemical detection of proteins: A review // Biosensors. 2020. V. 10. № 5. P. 45. https://doi.org/10.3390/bios10050045
Prante M., Segal E., Scheper T., Bahnemann J., Walter J. Aptasensors for point-of-care detection of small molecules // Biosensors. 2020. V. 10. № 9. P. 108. https://doi.org/10.3390/bios10090108
Zhang L., Luo K., Li D., Zhang Y., Zeng Y., Li J. Chiral molecular imprinted sensor for highly selective determination of D-carnitine in enantiomers via dsDNA-assisted conformation immobilization // Anal. Chim. Acta. 2020. V. 1136. P. 82. https://doi.org/10.1016/j.aca.2020.08.046
Ibrahim M., Ibrahim H., Almandil N.B., Sayed M.A., Kawde A.N., Aldaqdouq Y. A novel platform based on Au–CeO2@MWCNT functionalized glassy carbon microspheres for voltammetric sensing of valrubicin as bladder anticancer drug and its interaction with DNA // Electroanalysis. 2020. V. 32. № 10. P. 2146. https://doi.org/10.1002/elan.202060125
Shu Q., Liao F., Hong N., Cheng L., Lin Y., Cui H., Su J., Ma G., Wei G., Zhong Y., Xiong J., Fan H. A novel DNA sensor of homogeneous electrochemical signal amplification strategy // Microchem. J. 2020. V. 156. P. 105223. https://doi.org/10.1016/j.microc.2020.104777
Bronder T.S., Jessing M.P., Poghossian A., Keusgen M., Schöning M.J. Detection of PCR-amplified tuberculosis DNA fragments with polyelectrolyte-modified field-effect sensors // Anal. Chem. 2018. V. 90. № 12. P. 7747. https://doi.org/10.1021/acs.analchem.8b01807
Низамова А.М., Зиятдинова Г.К., Будников Г.К. Электрогенерированный бром – кулонометрический реагент для оценки биодоступности полифенолов // Журн. аналит. химии. 2011. Т. 66. № 3. С. 308. (Nizamova A.M., Ziyatdinova G.K., Budnikov H.C. Electrogenerated bromine as a coulometric reagent for the estimation of the bioavailability of polyphenols // J. Anal. Chem. 2011. V. 66. № 3. P. 301. )https://doi.org/10.1134/S1061934811010114
Ivanov A.N., Kuzin Y.I., Evtugyn G.A. SPR sensor based on polyelectrolyte complexes with DNA inclusion // Sens. Actuators B: Chem. 2019. V. 281. P. 574. https://doi.org/10.1016/j.snb.2018.10.156
Weng C., Li X., Lu Q., Yang W., Wang J., Yan X., Li B., Sakran M., Hong J., Zhu W., Zhou X. A label-free electrochemical biosensor based on magnetic biocomposites with DNAzyme and hybridization chain reaction dual signal amplification for the determination of Pb2+ // Microchim. Acta. 2020. V. 187. № 10. P. 1. https://doi.org/10.1007/s00604-020-04548-5
Su S., Ma J., Xu Y., Pan H., Zhu D., Chao J., Weng L., Wang L. Electrochemical analysis of target-induced hairpin-mediated aptamer sensors // ACS Appl. Mater. Interfaces. 2020. V. 12. № 42. P. 48133. https://doi.org/10.1021/acsami.0c12897
Song Y., Shen Y., Gong C., Chen J., Xu M., Wang L., Wang L. A novel glucose biosensor based on Tb@mesoporous metal-organic frameworks/carbon nanotube nanocomposites // ChemElectroChem. 2017. V. 4. № 6. P. 1457. https://doi.org/10.1002/celc.201600895
da Silva W., Queiroz A.C., Brett C.M. Nanostructured poly(phenazine)/Fe2O3 nanoparticle film modified electrodes formed by electropolymerization in ethaline—deep eutectic solvent. Microscopic and electrochemical characterization // Electrochim. Acta. 2020. V. 347. P. 136284. https://doi.org/10.1016/j.electacta.2020.136284
Stoewe R., Prütz W.A. Copper-catalyzed DNA damage by ascorbate and hydrogen peroxide: Kinetics and yield // Free Radic. Biol. Med. 1987. V. 3. № 2. P. 97. https://doi.org/10.1016/S0891-5849(87)80003-5
Breen A.P., Murphy J.A. Reactions of oxyl radicals with DNA // Free Radic. Biol. Med. 1995. V. 18. № 6. P. 1033. https://doi.org/10.1016/0891-5849(94)00209-3
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии