Журнал аналитической химии, 2022, T. 77, № 2, стр. 176-187
Перфторсульфокатионообменные мембраны с функционализированными углеродными нанотрубками в потенциометрических сенсорах для анализа фармацевтических препаратов никотиновой кислоты
А. В. Паршина a, *, Е. Ю. Сафронова b, Т. С. Колганова a, Г. З. Хабтемариам a, О. В. Бобрешова a
a Воронежский государственный университет
394018 Воронеж, Университетская пл., 1, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
* E-mail: parshina_ann@mail.ru
Поступила в редакцию 01.06.2021
После доработки 24.07.2021
Принята к публикации 23.08.2021
- EDN: OURLJL
- DOI: 10.31857/S0044450222020116
Аннотация
Перфторированные сульфокатионообменные мембраны МФ-4СК, модифицированные углеродными нанотрубками (УНТ) с карбоксильными и сульфогруппами, исследованы в качестве материалов потенциометрических перекрестно чувствительных сенсоров для определения никотиновой кислоты в растворах фармацевтических препаратов. Установлено влияние концентрации УНТ и протонодонорных свойств их поверхности на равновесные и транспортные свойства мембран и характеристики сенсоров. Влияние мешающих ионов гидроксония на отклик сенсоров в растворах никотиновой кислоты снижается при использовании образцов мембран, содержащих 0.5 и 1.0 мас. % УНТ-${\text{SO}}_{3}^{ - }.$ Для данных образцов предел обнаружения ионов никотиновой кислоты в водных растворах составил 1.0 × 10–5 М, а относительная погрешность и значение sr при определении никотиновой кислоты в таблетках – 0.8–1.3 и 5% соответственно. Наилучшие характеристики определения действующего и вспомогательного веществ в инъекциях никотиновой кислоты достигнуты при использовании системы ПД-сенсоров на основе мембран, содержащих 1.0 мас. % УНТ-COO– и 1.5 мас. % УНТ-${\text{SO}}_{3}^{ - }.$ Относительная погрешность и значение sr при определении никотиновой кислоты в инъекциях составили 3 и 0.9% соответственно.
Никотиновая кислота входит в состав препаратов, применяемых при атеросклерозе [1, 2]. В фармакопее для анализа препаратов никотиновой кислоты рекомендованы титриметрические, спектрофотометрические, ВЭЖХ-методики и микробиологический тест с использованием микроорганизмов Lactobacillus plantarum. Для определения никотиновой кислоты в препаратах со сложной матрицей и физиологических жидкостях разработаны масс-спектрометрические методики [3] в сочетании с экстракционным [4, 5] и хроматографическим [5] концентрированием и разделением, а также методики ВЭЖХ с электрохимическим детектированием [6]. Большое внимание уделено определению никотиновой кислоты в фармацевтических и физиологических средах с использованием вольтамперометрических сенсоров [7–12] (табл. 1). Для повышения величины и разрешения пика окисления аналита в них используют различные электроды и модификаторы (графитовую пасту с восстановленным оксидом графена и полимером с молекулярными отпечатками [7]; композит на основе углеродных нанотрубок (УНТ) и TiO2, легированного лантаном [8]; пасту на основе графита и 5,10,15,20-тетракис(4-метоксифенил)-21H,23H-порфина кобальта(II) [9]; золото [10], в том числе покрытое монослоем меркаптоуксусной кислоты [11]; стеклоуглерод, модифицированный УНТ [12]). Большинство описанных сенсоров характеризуется низкими пределами обнаружения и значениями рабочих концентраций (табл. 1), что позволяет снижать влияние мешающих компонентов посредством многократного разбавления объекта анализа. В то же время подготовка проб требует особого внимания. Кроме того, высокая воспроизводимость результатов для данных сенсоров достигается при условии специальной подготовки материала сенсора перед каждым измерением или после небольшой серии измерений [7–12] (табл. 1).
Таблица 1.
Электрохимические сенсоры для определения никотиновой кислоты в модельных растворах, фармацевтических и физиологических средах
| Объект | Метод; состав сенсора | c, M/сmin*, M | Правильность, %/sr*, % | Проведение анализа | Литература |
|---|---|---|---|---|---|
| Плазма | Дифференциальная импульсная вольтамперометрия; графитовый пастовый электрод, оксид графена, молекулярно импринтированный полимер | 1.0 × 10–9–0.2 × × 10–6/8.0 × 10–9 | 92.5–94.5/– | Косвенный метод определения; механическая очистка поверхности электрода после каждого измерения | [7] |
| Моча | 96.3–98.0/– | ||||
| Таблетки (Sobhan Pharma, Иран) | 95.3–102.8/– | ||||
| Моча | Циклическая вольтамперометрия; пастовый электрод: смесь парафина и УНТ/La–TiO2 | 1.0 × 10–6–1.2 × × 10–4/2.7 × 10–7 | 101.8/2.6 | Рабочий диапазон рН 7.0–10.0; механическая полировка и очистка поверхности электрода перед каждым измерением |
[8] |
| Поливитаминные сиропы | Дифференциальная импульсная вольтамперометрия; графитовый пастовый микроэлектрод, Nafion, комплекс порфирин–Со | 1.00 × 10–7–1.00 × × 10–4/3.03 × 10–8 | 94.2–105.1/ 0.74–1.21 | Рабочее значение pH 3.9; периодическая механическая полировка и очистка поверхности электрода | [9] |
| Таблетки (Xiangfan Pharmaceutical Com., Китай) | Циклическая вольтамперометрия; поликристаллический Au-электрод | 2.7 × 10–6–2.4 × × 10–3/0.27 × 10–6 | 92.6–101.8/– | Рабочее значение pH 5.0; механическая, ультразвуковая и электрохимическая (1.0 М H2SO4) полировка и очистка поверхности электрода перед каждым измерением | [10] |
| Модельные растворы | Циклическая вольтамперометрия; Au-электрод, монослой меркаптоуксусной кислоты | 0.45 × 10–6–0.8 × × 10–3/0.14 × 10–6 | –/2.0 | Рабочее значение pH 7.4; электрохимическая очистка поверхности электрода в 1.0 М H2SO4 после 80 измерений | [11] |
| Модельные растворы | Циклическая вольтамперометрия; стеклоуглеродный электрод, пленка многостенных УНТ | 2 × 10–7–4 × × 10–5/8 × 10–8 | –/5.4 | Рабочее значение pH 6.5; электрохимическая очистка поверхности электрода в фосфатном буфере (pH 6.5) после каждого измерения | [12] |
| Таблетки | 99.2–102.2/– | ||||
| Модельные растворы | Прямая потенциометрия; графитовый электрод, ПВХ-мембрана с ионной парой протонированный аналит/анион борорганического соединения | 1.00 × 10–6–0.01/ 0.70 × 10–6 | –/– | Рабочий диапазон рН 3.00–3.50 | [13] |
Для анализа фармацевтических препаратов с относительно высоким содержанием действующих веществ и не слишком сложным компонентным составом перспективно применение потенциометрических сенсоров. Однако возможности разработки новых материалов для потенциометрических сенсоров не так разнообразны, как для вольтамперометрических. Для определения никотиновой кислоты описан твердоконтактный потенциометрический сенсор на основе графитового электрода и пластифицированной поливинилхлоридной мембраны с ионной парой катиона аналита и аниона борорганического соединения [13]. Диапазон определяемых концентраций и предел обнаружения никотиновой кислоты с помощью этого сенсора составляют 1.0 × 10–6–1.0 × × 10–2 и 0.70 × 10–6 М соответственно (табл. 1). Характеристики сенсора установлены только для случая анализа модельных растворов.
Возможность миниатюризации, простота эксплуатации и хранения обусловливают преимущественный интерес к твердоконтактным потенциометрическим сенсорам по сравнению с сенсорами с внутренним раствором сравнения [14]. Однако в работах [15–18] показана возможность улучшения аналитических характеристик потенциометрических сенсоров с внутренним раствором посредством увеличения расстояния между границами ионообменной мембраны с раствором сравнения и исследуемым раствором. Это позволяет минимизировать трансмембранный перенос ионов, поэтому откликом сенсора является потенциал Доннана (ПД) [16, 17]. Кроме того, оригинальная конструкция ПД-сенсоров устраняет ряд эксплуатационных проблем и позволяет использовать гибридные ионообменные материалы [16–18]. Для определения органических амфолитов перспективно применение в ПД-сенсорах перфторированных сульфокатионообменных мембран типа Nafion®, содержащих наночастицы допантов различной природы [16–18]. Модификация мембран не столько обеспечивает повышение селективности ПД-сенсоров к аналитам, сколько позволяет варьировать их перекрестную чувствительность посредством изменения условий сорбции определяемых и мешающих ионов. Дополнительными сорбционными центрами для аналитов могут выступать фрагменты расположенных в порах мембраны допантов. Кроме того, совокупное действие электростатических, осмотических и упругих сил, обусловленное присутствием допанта в порах или матрице мембраны, позволяет варьировать ее проницаемость для ионов с разнымы знаками заряда и размерами. В работах [17, 19] отмечено положительное влияние на характеристики ПД-сенсоров введения УНТ в перфторированные сульфосодержащие мембраны. Следует заметить, что углеродные наноматериалы широко используются в различных электрохимических устройствах благодаря высоким проводимости и площади поверхности, их сорбционным и другим свойствам [20–22]. Таким образом, можно предположить, что для определения никотиновой кислоты целесообразно использование в качестве допанта для перфторированных сульфокатонообменных мембран УНТ с функционализированной поверхностью (с карбоксильными и сульфогруппами), поскольку они способны к электростатическим и гидрофобным взаимодействиям с аналитом и существенно влияют на микроструктуру гибридной мембраны.
Цель настоящей работы – разработка перекрестно чувствительных ПД-сенсоров на основе перфторированных сульфосодержащих мембран МФ-4СК (российский аналог Nafion®), поверхностно модифицированных УНТ, для анализа фармацевтических препаратов никотиновой кислоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и материалы. Использовали 10%-ный (по массе) раствор перфторсульфополимера МФ-4СК в литиевой форме в диметилформамиде (ДМФА) (ОАО “Пластполимер”, Россия; эквивалентная масса EW = 1100); многостенные УНТ Таунит S12 (ООО “НаноТехЦентр”, Россия; внешний диаметр 20–40 нм, внутренний диаметр 5–10 нм, длина до 10 мкм, получены каталитическим пиролизом-CVD углеводородов на Ni/Mg катализаторе); азотная кислота ос. ч., >70% HNO3 (Химмед, Россия); п-толуолсульфоновая кислота (97.5%; Acros, Бельгия); D-глюкоза (гидратированная форма, Merck, Германия); этанол (95%; Ферейн, Россия); соляная кислота ос. ч., 35–38% HCl (Химмед, Россия); хлорид калия х. ч. (Химмед, Россия); гидрокарбонат натрия стандарт-титр (НПО “РЕАГЕНТ”, Россия); 3-пиридинкарбоновая кислота (никотиновая кислота, ≥99%, Sigma-Aldrich, США); таблетки “Никотиновая кислота” (ОАО “Фармстандарт-Уфимский витаминный завод”, Россия); раствор для инъекций “Никотиновая кислота БУФУС” (Renewal, “ПФК Обновление”, Россия); вода деионизованная (сопротивление 18.2 МОм).
Получение гибридных мембран. Углеродные нанотрубки с функционализированной поверхностью получали путем обработки коммерческих УНТ по методикам, описанным в работах [23, 24]. Карбоксилирование УНТ проводили обработкой 30%-ной HNO3 при 90°С в течение 1 ч [23]. Сульфирование УНТ проводили в гидротермальных условиях в присутствии п-толуолсульфоновой кислоты и D-глюкозы при 180°С в течение 24 ч [23, 24]. Полученные дисперсии центрифугировали, промывали деионизованной водой до нейтральной реакции среды, промывали этанолом и сушили при 110°С в течение 12 ч. Полученные образцы обозначали как УНТ-COO–, УНТ-${\text{SO}}_{3}^{ - }.$ Ионообменную емкость (ИОЕ) образцов устанавливали титриметрически, ее значения составили 0.17 мг-экв/г для УНТ-COO– и 0.27 мг-экв/г для УНТ-${\text{SO}}_{3}^{ - }.$
На основе раствора перфторсульфополимера и функционализированных УНТ получали мембраны, объемно модифицированные по всей площади образца, и мембраны с градиентным распределением допанта по площади образца (объемно модифицирована только половина полоски мембраны). Первые использовали для исследования равновесных и транспортных свойств, вторые – для организации ПД-сенсоров. В качестве образцов сравнения получали немодифицированные мембраны.
Мембраны МФ-4СК/УНТ-COO– и МФ‑4СК/УНТ-${\text{SO}}_{3}^{ - }$ получали отливкой из раствора полимера, смешанного с навеской предварительно подготовленных УНТ-COO- и УНТ-${\text{SO}}_{3}^{ - }$ для получения образцов с 0.5, 1.0, 1.5 мас. % допанта. Для формирования материалов, объемно модифицированных по всей площади, 15 мл полученной смеси подвергали обработке в заполненной водой ультразвуковой (УЗ) ванне RK-100 (Bandelin electronic, Германия; частота 35 кГц) в течение 2 ч, не допуская нагревания раствора полимера до температуры выше 50°С. Мощность УЗ оценивали калориметрическим методом, она составила 4.0 Вт. Полученную однородную взвесь из раствора полимера и допанта выливали на стеклянную поверхность и удаляли растворитель путем сушки при 60°С (12 ч), 80°С (1 ч), 100°С (1 ч), 120°С (1 ч), 80°С (4 ч). На заключительным этапе образцы подвергали горячему прессованию под давлением 5 МПа при 110°С в течение 3 мин для обеспечения лучшей прочности.
Образцы с градиентным распределением допанта по площади получали с помощью специальной ячейки, одновременно выливая с одной стороны раствор полимера без УЗ-обработки, а с другой – раствор полимера с допантом после УЗ-обработки. Ширина размытой зоны при переходе от модифицированной части к немодифицированной не превышала 5 мм для образцов длиной 6 см. Ее наличие не препятствовало использованию мембран в ПД-сенсорах, так как в процессе измерения мембрана длиной 6 см погружается в исследуемый раствор и раствор сравнения только концами на глубину ~3 мм, а состав в объеме мембраны не изменяется. Отсутствие допанта в части мембраны, контактирующей с раствором сравнения, обеспечивает близость составов раствора сравнения и раствора внутри мембраны, а также нивелирует ПД на границе раствор сравнения/мембрана.
Для приведения к стандартным условиям образцы мембран кондиционировали по методике, описанной в работе [17], а затем переводили в K+-форму и хранили в гидратированном виде в деионизованной воде. В ПД-сенсорах использовали мембраны в K+-форме для снижения влияния продуктов диссоциации воды на величину и стабильность отклика, а также для обеспечения полноты процесса “регенерации” мембран после контакта с растворами аналитов. Между сериями повторных (~100) измерений мембраны сначала выдерживали в 0.1 М растворе KCl в течение 30 мин при постоянном перемешивании, затем помещали в деионизированную воду для хранения до последующих измерений. Для “регенерации” после длительного использования (до трех месяцев) мембраны выдерживали в 2 М растворе KCl в течение 72 ч и промывали деионизованной водой.
Следует отметить, что в полученных материалах функциональные группы ковалентно связаны с матрицей полимера или УНТ, а УНТ не вымываются из мембраны после длительного использования. Согласно данным просвечивающей электронной микроскопии, размер УНТ в матрице мембран варьируется от 7 до 35 нм [23].
Методы и оборудование. ИК-спектры мембран в сухом состоянии регистрировали на ИК-спектрометре Nicolet iS5 (Thermo Scientific, США) с преобразованием Фурье с приставкой НПВО (кристалл алмаза).
Плотность растворов полимера, в том числе содержащих допант, определяли до и после УЗ-обработки с помощью портативного плотномера Densito (Mettler Toledo, Швейцария) при (25.0 ± ± 0.1)°C. Вязкость растворов определяли непосредственно после обработки, а также через несколько дней с помощью вибрационного вискозиметра SV-1A (A&D, Япония) при (25.0 ± 0.1)°C. Значение динамической вязкости (η, мПа⋅с) рассчитывали как отношение вязкости к плотности раствора. Калибровку проводили по двум точкам с помощью стандартов вязкости Brookfield (США) 5 и 10 мПа ⋅ с.
Для определения ИОЕ (мг-экв/г) навеску УНТ или мембраны в сухом состоянии массой ~0.3 г выдерживали в 50 мл 0.1 М раствора NaCl (VNaCl, л) в течение 12 ч при постоянном перемешивании. Затем раствор NaCl с УНТ титровали 0.05 М раствором NaOH. Раствор соли отделяли от мембраны и титровали 0.05 М раствором NaOH. Рассчитывали ИОЕ (мг-экв/г) как отношение массы ионообменных групп к массе сухого катионита.
Влагосодержание (ω(H2O), мас. %) мембран определяли по разнице массы сухого и гидратированного образца. Термический анализ образцов проводили с использованием термовесов Netzsch-TG 209 F1 (Германия) в платиновых тиглях в атмосфере аргона в диапазоне температур от 25 до 150°С.
Ионную и электронную проводимость мембран определяли при 30°С в контакте с деионизованной водой. Измерения проводили с помощью моста переменного тока Elins E-1500 (Россия) в диапазоне частот 10 Гц–3 МГц на симметричных ячейках углерод/мембрана/углерод с активной площадью поверхности 1 см2. Величину электронной проводимости находили из сопротивления при постоянном токе. Электронная проводимость всех образцов оказалась пренебрежимо малой (менее 1% от общей проводимости). Величину ионной проводимости (σ, Ом–1 см–1) рассчитывали из сопротивления, найденного по отсечке на оси активных сопротивлений годографа импеданса. Погрешность определения величины удельной проводимости составляла менее 10%.
Для определения диффузионной проницаемости образец помещали в ячейку между двух камер, объем каждой из которых составлял 32 см3. В од-ной камере находился 0.5 М раствор KCl, в другой – 0.02 М раствор KCl. С помощью кондуктометра Эксперт-002 (ООО “Эконикс-эксперт”, Россия) измеряли величину удельной электрической проводимости раствора в камере, в которой изначально находился 0.02 М раствор KCl. Диффузионную проницаемость (P, см2/с) для мембран рассчитывали по формуле (1). Погрешность определения величины диффузионной проницаемости составляла 1%.
где V – объем раствора (32 см3); l – толщина мембраны, см; Δc – градиент концентрации, мМ; t – время, с; S – активная площадь мембраны (4.9 см2).Схема ячейки для оценки откликов системы ПД-сенсоров на основе мембран разного состава подробно описана в работе [16]. Мембраны не являются жестко закрепленными в корпусе сенсоров, а соединяют раствор сравнения и исследуемый раствор подобно мостикам, поэтому отсутствуют проблемы, связанные с транспортировкой, хранением, заменой раствора сравнения и обслуживанием мембраны. Мембраны концом модифицированной части погружали в общий корпус с исследуемым раствором, а противоположным (немодифицированным) концом – в отдельные секции с раствором сравнения (1 М KCl). Напряжение электрохимических цепей (Ag|AgCl, 1 M KCl|мембрана|исследуемый раствор|нас. KCl, AgCl|Ag), включающих мембраны разного состава, измеряли с помощью хлоридсеребряных электродов ЭСр-10103 (ООО “Эконикс-эксперт”, Россия), подключенных к многоканальному потенциометру. Одновременно измеряли рН исследуемого раствора стеклянным электродом ЭС‑10301/4 (ООО “Эконикс-эксперт”, Россия).
Хронопотенциометрически установлено, что уже через несколько секунд после контакта ПД-сенсора с исследуемым раствором разброс значений отклика не превышал разброс значений при дублировании эксперимента, а его последующее изменение не превышало 13 мВ/ч. Для оценки предела обнаружения (сmin, М) и ширины диапазона концентраций, в котором наблюдается линейная зависимость отклика от логарифма концентрации аналита, определяли значения отклика ПД-сенсоров в деионизованной воде и растворах никотиновой кислоты в диапазоне концентраций 1.0 × 10–7–0.1 М. За предел обнаружения принимали заданное значение концентрации никотиновой кислоты, при котором среднее значение отклика в растворе превышало значение отклика в фоновом растворе не менее чем на утроенное стандартное отклонение отклика в фоновом растворе.
Градуировочные зависимости получали не для всего линейного диапазона, а для участка, выбранного с учетом состава таблеток и растворов для инъекций никотиновой кислоты. Вследствие отличия матричного состава лекарственных форм для их анализа получали разные градуировочные уравнения. Градуировку выполняли методом многомерного регрессионного анализа в растворах никотиновой кислоты с концентрацией от 1.0 × 10–4 до 0.1 М (рН 3.42–4.74) (уравнение (2)), а также в растворах, содержащих никотиновую кислоту и NaHCO3 с концентрациями компонентов от 1.0 × 10–4 до 0.01 М (рН 3.69–5.82) (уравнение (3)). В исследуемых растворах никотиновая кислота находится преимущественно в форме цвиттер-ионов (NA±) (рKa(–COOH) = 2.08, рKb(≡NH+) = 4.82). Кроме того, неорганические катионы, присутствующие в градуировочных растворах и объектах анализа, участвуют в формировании отклика ПД-сенсоров. Градуировочные уравнения (2), (3) учитывали влияние определяемых (NA±, Na+) и мешающих ионов (H3O+) на отклик ПД-сенсоров.
(2)
$\Delta {{{{\varphi }}}_{{\text{D}}}} = {{b}_{0}} + {{b}_{1}}{\text{pNA}} + {{b}_{2}}{\text{pH}},$(3)
$\Delta {{{{\varphi }}}_{{\text{D}}}} = {{b}_{0}} + {{b}_{1}}{\text{pNA}} + {{b}_{2}}{\text{pH}} + {{b}_{3}}{\text{pNa}},$Дисперсию воспроизводимости отклика ПД‑сенсора ($s_{{{\text{восп}}}}^{2},$ мВ2) находили как среднее значение дисперсии отклика для матрицы градуировочных растворов. Значения разности между экспериментальными значениями откликов ПД‑сенсоров и значениями откликов, полученными по уравнению регрессии, являлись оценками систематических погрешностей уравнений (ε, мВ). Корреляцию между значениями отрицательного десятичного логарифма молярной концентрации ионов в градуировочных растворах (для оценки обусловленности уравнений), а также между откликами пар ПД-сенсоров (для оценки возможности объединения их в массив) оценивали по r-критерию.
Для определения концентраций аналитов в растворах фармацевтических препаратов находили корни градуировочного уравнения (2) или корни системы градуировочных уравнений (3) для выбранных перекрестно чувствительных ПД‑сенсоров. Экспериментальными данными для расчета концентраций являлись значения откликов ПД-сенсоров и рН в объекте анализа. Для оценки правильности установленную концентрацию аналита сравнивали с заявленной производителем, а также с найденной стандартным методом. Для оценки воспроизводимости определения аналитов рассчитывали относительное стандартное отклонение (sr, %).
Согласно рекомендациям Государственной Фармакопеи РФ в качестве стандартного метода определения никотиновой кислоты в препаратах использовали спектрофотомерию. Анализ выполняли с помощью спектрофотометра Shimadzu UV-1800 (Япония) при λmax = 260 нм. Для градуировки готовили растворы никотиновой кислоты в 0.1 М HCl. Зависимость оптической плотности (А) растворов от концентрации никотиновой кислоты описывается линейным уравнением (4) в диапазоне от 1.0 × 10–5 до 5.0 × 10–4 М:
В одной таблетке препарата “Никотиновая кислота” содержится 50 мг никотиновой кислоты, а также нерастворимые и/или недиссоциированные в воде вспомогательные вещества (2.010 мг кальция стеарата, 47.503 мг крахмала кукурузного, 98.477 мг сахарозы, 2.010 мг талька). Для потенциометрического анализа одну таблетку препарата растворяли в деионизованной воде для получения 100 мл раствора. Для спектрофотометрического анализа одну таблетку препарата растворяли в 0.1 М HCl для получения 250 мл раствора, а затем разбавляли его в 10 раз 0.1 М HCl.
Раствор для инъекций “Никотиновая кислота БУФУС” (Россия) содержит 10 мг/мл (0.081 М) никотиновой кислоты (действующее вещество), а также NaHCO3 (вспомогательное вещество для коррекции pH) и воду очищенную. Растворы для инъекций для потенциометрического анализа готовили разбавлением в 50 раз деионизованной водой, а для спектрофотометрического анализа – разбавлением в 1000 раз 0.1 М раствором HCl.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Свойства гибридных мембран. Структура перфторированных сульфокатионообменных мембран сформирована гидрофобной матрицей и гидрофильными порами, связанными между собой каналами. Вдоль внутренней поверхности пор располагаются фиксированные сульфогруппы. Углеродные нанотрубки имеют гидрофобную природу, поэтому преимущественно располагаются в гидрофобной матрице мембран, а функционализация поверхности УНТ гидрофильными группами способствует частичному их расположению в порах [17]. При описании свойств гибридных мембран МФ-4СК/УНТ-COO– и МФ-4СК/УНТ-${\text{SO}}_{3}^{ - }$ нужно принимать во внимание изменение состава и морфологии полимера в растворе вследствие его УЗ-обработки. В ходе УЗ-обработки существенно уменьшается вязкость раствора полимера: от η = 86.1 мПа · с для исходного раствора до 45.8 мПа · с для раствора полимера после УЗ-обработки без допанта и до 55–60 мПа · с для растворов после УЗ-обработки в присутствии допантов. В работе [25] показано, что УЗ-обработка спиртовых растворов Nafion® также приводит к существенному уменьшению их вязкости. Это происходит в результате деагломерации макромолекул в растворах и из-за уменьшения средней молекулярной массы полимера. Последнее связано с разрывом C–C связей основной цепочки и более подробно описано в работе [25].
По данным ИК-спектроскопии (рис. 1) в результате модификации положение основных линий мембран МФ-4СК не меняется. В спектрах как исходной, так и модифицированных мембран присутствуют линии, соответствующие асимметричным и симметричным колебаниям групп CF2 основных цепочек (1207 и 1148 см–1), деформационным колебаниям групп CF2 (624 см–1), симметричным колебаниям эфирных групп C–O–C в боковых цепочках (980 см–1), симметричным валентным колебаниям сульфогрупп (1056 см–1). При этом в ИК-спектрах гибридных мембран появляется полоса в области валентных колебаний групп C=O карбоновых кислот (ν ~ 1740 см–1, см. вставку), что свидетельствует о наличии некоторого количества карбоксильных групп в модифицированных образцах. Карбоксильные группы могут появляться, как при УЗ-обработке раствора полимера в местах отрыва боковых и разрыва основных цепочек [25], так и на поверхности УНТ при их предподготовке [23].
Рис. 1.
Фрагменты ИК-спектров мембран МФ-4СК (1), МФ-4СК/1.5 мас. % УНТ-COO– (2) и МФ‑4СК/1.5 мас. % УНТ-${\text{SO}}_{3}^{ - }$ (3) в сухом состоянии.

Ионообменная емкость мембран незначительно понижается от 0.90 мг-экв/г для исходной мембраны до 0.82–0.85 мг-экв/г для гибридных. Собственная ИОЕ УНТ-COO– и УНТ-${\text{SO}}_{3}^{ - }$ существенно ниже, чем перфторсульфополимера. Уменьшение ИОЕ гибридных мембран связано с уменьшением доли ионпроводящего полимера в гибридной мембране, а также с тем, что при УЗ-обработке происходит отрыв некоторого количества функциональных сульфогрупп мембраны, что приводит к снижению ИОЕ материалов.
В результате модификации УНТ влагосодержание мембран несколько увеличивается по сравнению с исходной мембраной МФ-4СК, несмотря на гидрофобную природу допанта (табл. 2). Наиболее вероятно, что это является следствием УЗ-воздействия на раствор полимера. Деагломерация и уменьшение длины макромолекул способствуют более выгодному укладыванию полимерных цепей в процессе формирования мембран. В результате этого формируется более разветвленная система пор и каналов, и размер таких пор может быть больше, чем в мембране, полученной из необработанного раствора. Кроме того, сульфирование поверхности допанта позволяет добиться дополнительного увеличения влагосодержания мембран, которое достигает наибольших значений для образца МФ-4СК/0.5 мас. % УНТ-${\text{SO}}_{3}^{ - }.$
Таблица 2.
Влагосодержание материалов на основе мембраны МФ-4СК в K+-форме в контакте с водой
| Допант | ω(допант), мас. % | ω(H2O), мас. % |
|---|---|---|
| – | – | 11.6 ± 0.2 |
| УНТ-COO– | 0.5 | 13.9 ± 0.1 |
| 1.0 | 12.1 ± 0.1 | |
| 1.5 | 12.2 ± 0.2 | |
| УНТ-${\text{SO}}_{3}^{ - }$ | 0.5 | 14.1 ± 0.1 |
| 1.0 | 13.9 ± 0.3 | |
| 1.5 | 12.3 ± 0.2 |
Ионная проводимость мембран меняется в зависимости от типа допанта и его количества (рис. 2a). При внедрении 0.5 мас. % УНТ-COO– и УНТ-${\text{SO}}_{3}^{ - }$ проводимость мембраны увеличивается на 15 и 35% соответственно по сравнению с немодифицированным образцом МФ-4СК. При увеличении концентрации УНТ-COO– до 1.0 и 1.5% проводимость становится меньше, чем для исходной мембраны. Увеличение концентрации УНТ-${\text{SO}}_{3}^{ - }$ также приводит к постепенному снижению проводимости, однако ее значения превышают таковые для исходной мембраны.
Рис. 2.
Ионная проводимость при 30°С (а) и диффузионная проницаемость 0.5 М раствора KCl (б) для мембран МФ-4СК, МФ-4СК/УНТ-COO– и МФ‑4СК/УНТ-${\text{SO}}_{3}^{ - }$ в K+-форме.

Диффузионная проницаемость мембран практически не меняется при внедрении 0.5 мас. % УНТ-COO– и УНТ-${\text{SO}}_{3}^{ - }$ (рис. 2б) и возрастает при увеличении количества допанта по сравнению с проницаемостью исходной мембраны МФ-4СК. При этом для образцов МФ-4СК/УНТ-COO– наблюдается монотонный рост диффузионной проницаемости с увеличением концентрации допанта, а для образцов МФ-4СК/УНТ-${\text{SO}}_{3}^{ - }$ максимум достигается при 1.0 мас. % допанта. Видимо, присутствие в порах допанта с фукциональными группами, одноименно заряженными с группами на стенках пор мембраны, способствует расширению пор, однако при достижении определенной концентрации является препятствием для транспорта анионов и незаряженных частиц. Также нельзя исключить повышение жесткости матрицы с увеличением концентрации в ней УНТ, что препятствует расширению пор и гидратации мембран.
Учитывая результаты исследования равновесных и транспортных свойств мембран, можно заключить, что локализация УНТ-${\text{SO}}_{3}^{ - }$ в порах мембран более вероятна, чем УНТ-COO–. Вследствие этого они могут участвовать в сорбции воды и переносе катионов. При этом изменение размеров внутрипорового пространства мембран происходит немонотонно в зависимости от концентрации и типа функциональных групп на поверхности допанта.
Характеристики ПД-сенсоров на основе гибридных мембран. Для исходной мембраны МФ-4СК и модифицированных образцов диапазон концентраций, в котором наблюдается линейная зависимость отклика ПД-сенсоров от логарифма концентрации никотиновой кислоты, составил 1.0 × 10–6–0.1 М. Значения коэффициентов градуировочных уравнений ПД-сенсоров в растворах ни-котиновой кислоты определяли на участке ли-нейного диапазона от 1.0 × 10–4 до 0.1 М (рН 3.45–4.30) (рис. 3). ПД-сенсоры на основе исходной и гибридных мембран характеризуются высокой чувствительностью к никотиновой кислоте (27.4–35.4 мВ/рс, рис. 3). Это обусловлено тем, что цвиттер-ионы никотиновой кислоты, поступая в мембрану посредством необменной сорбции, переходят в катионную форму за счет протонирования аминогруппы в пиридиновом цикле. Это становится возможным из-за более низкого значения рН внутрипорового раствора (на ~2 единицы [26]) вследствие вытеснения ионов гидроксила из фазы катионообменной мембраны (доннановское исключение).
Рис. 3.
Зависимость чувствительности ПД-сенсоров на основе мембран МФ-4СК/УНТ-COO– (а) и МФ‑4СК/УНТ-${\text{SO}}_{3}^{ - }$ (б) к ионам никотиновой кислоты (NA±) и H3O+ в водных растворах (1.0 × 10–4–0.1 М, рН 3.45–4.30).
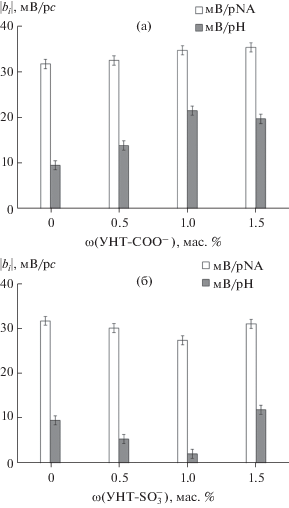
Увеличение влагосодержания и диффузионной проницаемости мембран при введении УНТ‑COO– способствует поглощению цвиттер-ионов никотиновой кислоты из исследуемого раствора, что приводит к увеличению чувствительности ПД-сенсоров к ним (рис. 3а). Учитывая некоторое снижение ИОЕ модифицированных образцов, рост чувствительности ПД-сенсоров к ионам никотиновой кислоты также может свидетельствовать о влиянии на ее концентрацию в мембране гидрофобных взаимодействий между пиридиновым циклом и поверхностью УНТ. Однако одновременно с этим повышается чувствительность ПД-сенсоров к мешающим ионам гидроксония (рис. 3а). Возможно, встраивание катионов никотиновой кислоты в двойной электрический слой, сформированный сульфогруппами мембраны и катионами K+ (исходные мембраны находятся в K+-форме), приводит к удалению друг от друга фиксированных групп и дополнительному расширению пор. В результате доступность сульфогрупп для ионов гидроксония повышается.
Чувствительность ПД-сенсоров на основе мембран, содержащих УНТ-${\text{SO}}_{3}^{ - },$ соизмерима или несколько ниже, чем при использовании немодифицированного образца (рис. 3б). Видимо, из-за присутствия в порах мембран наночастиц УНТ‑${\text{SO}}_{3}^{ - }$ возникают стерические ограничения для дополнительной сорбции объемных цвиттер-ионов никотиновой кислоты. В то же время поступившие в мембрану частицы аналита могут взаимодействовать с сульфогруппами полимера и допанта, исключая ионы гидроксония из ионного обмена. При концентрации УНТ-${\text{SO}}_{3}^{ - }$ 0.5 и 1.0 мас. % чувствительность ПД-сенсоров к ионам гидроксония снижается до 5.4 и 2.1 мВ/рс (рис. 3б), что позволяет использовать данные образцы для определения никотиновой кислоты без коррекции рН объекта анализа. Предел обнаружения никотиновой кислоты с помощью ПД-сенсоров на их основе составил 1.0 × 10–5 М.
Для анализа препаратов, содержащих никотиновую кислоту и NaHCO3, выполняли градуировку ПД-сенсоров в растворах соответствующих компонентов с концентрациями от 1.0 × 10–4 до 0.1 М (рН 3.75–5.83). Коэффициенты градуировочных уравнений, разброс экспериментальных значений откликов ПД-сенсоров относительно значений откликов, полученных по градуировочным уравнениям, а также дисперсия воспроизводимости отклика представлены в табл. 3. Для исходного образца МФ-4СК чувствительность ПД‑сенсоров к ионам Na+ ниже, чем к ионам никотиновой кислоты и дополнительно снижается при введении функционализированных УНТ (табл. 3). Это обусловлено высоким сродством аминогруппы никотиновой кислоты к сульфогруппам мембраны и является дополнительным подтверждением эффективности взаимодействия ионов никотиновой кислоты с сорбционными центрами полимера и допанта. Более высокие значения рН и присутствие ионов Na+ в многокомпонентных растворах приводит к снижению чувствительности ПД-сенсоров к ионам гидроксония по сравнению с таковой в индивидуальных растворах никотиновой кислоты (рис. 3, табл. 3). Общие тенденции изменения перекрестной чувствительности ПД-сенсоров к ионам никотиновой кислоты и гидроксония в исследованных индивидуальных и многокомпонентных растворах сходны, но во втором случае менее выражены (рис. 3, табл. 3). Наименьшая корреляция откликов ПД-сенсоров наблюдалась при использовании мембран МФ-4СК, содержащих 1.0 мас. % УНТ-COO– и УНТ-${\text{SO}}_{3}^{ - },$ поэтому их выбрали для организации мультисенсорной системы.
Таблица 3.
Характеристики градуировочных уравнений ПД-сенсоров в растворах, содержащих никотиновую кислоту и NaHCO3 (1.0 × 10–4–0.01 М, рН 3.75–5.83)
| Допант | ω(допант), мас. % | Уравнение | ε, мВ | $s_{{{\text{воспр}}}}^{2}$, мВ2 |
|---|---|---|---|---|
| – | – | ΔφD = –47.7 – 20.74pNA – 0.29pH – 13.88pNa | 0.02–5 | 6 |
| УНТ-COO– | 0.5 | ΔφD = –46.6 – 20.40pNA – 0.59pH – 14.01pNa | 0.05–6 | 5 |
| 1.0 | ΔφD = –65.5 – 23.07pNA + 2.3pH – 11.41pNa | 0.15–6 | 4 | |
| 1.5 | ΔφD = –61.9 – 22.36pNA + 1.78pH – 12.73pNa | 0.7–7 | 5 | |
| УНТ-${\text{SO}}_{3}^{ - }$ | 0.5 | ΔφD = –57.2 – 21.71pNA + 0.81pH – 12.66pNa | 0.3–6 | 3 |
| 1.0 | ΔφD = –55.2 – 22.67pNA + 0.77pH – 12.37pNa | 0.5–7 | 4 | |
| 1.5 | ΔφD = –57.12 – 21.35pNA + 0.48pH – 12.63pNa | 0.3–6 | 4 |
Анализ фармацевтических препаратов. Согласно заявленному производителем составу препарата “Никотиновая кислота”, растворы для потенциометрического анализа, полученные растворением одной таблетки в 100 мл деионизованной воды, содержали 0.41 × 10–2 М никотиновой кислоты при рН 3.801 ± 0.009, а для спектрофотометрического – 1.6 × 10–4 M (одна таблетка на 2.5 л раствора в 0.1 М HCl). В табл. 4 представлены результаты определения ионов никотиновой кислоты в исследуемых растворах (с, М) и ее рассчитанные содержания в одной таблетке препарата (с, мг) обоими методами, а также результаты оценки правильности определения. Относительное стандартное отклонение результатов определения никотиновой кислоты с помощью ПД-сенсоров на основе мембран МФ-4СК, содержащих 0.5 и 1.0 мас. % УНТ-${\text{SO}}_{3}^{ - },$ составило 5%, а относительная погрешность определения (относительно состава, заявленного производителем) – 0.8 и 1.3% (табл. 4). При этом погрешность определения никотиновой кислоты с помощью ПД-сенсоров на основе данных образцов относительно концентрации, найденной спектрофотометрически, составила 3 и 1.3% (табл. 4).
Таблица 4.
Результаты определения ионов никотиновой кислоты (NA±) и Na+ в препарате “Никотиновая кислота” (таблетки) с помощью ПД-сенсоров на основе мембран МФ-4СК, содержащих 0.5 и 1.0 мас. % УНТ-${\text{SO}}_{3}^{ - }$
| Характеристика | Спектрофотометрия | МФ-4СК/0.5 мас. % УНТ-${\text{SO}}_{3}^{ - }$ | МФ-4СК/1.0 мас. % УНТ-${\text{SO}}_{3}^{ - }$ |
|---|---|---|---|
| c(NA±), M (раствор препарата) |
(1.667 ± 0.005) × 10–4 | (0.40 ± 0.02) × 10–2 | (0.41 ± 0.02) × 10–2 |
| с(NA±), мг (препарат, 1 таблетка) |
51.29 ± 0.16 | 50 ± 2 | 51 ± 2 |
| sr(NA±), % | 0.5 | 5 | 5 |
| Отн. погрешность, % | 3 | 0.8 | 1.3 |
При разбавлении препарата “Никотиновая кислота БУФУС” (раствор для инъекций) в 50 и 1000 раз для потенциометрического и спектрофотометрического анализа соответственно теоретическая концентрация никотиновой кислоты в растворах составляет 0.16 × 10–2 М (рН 5.66 ± 0.02) и 0.81 × 10–4 М. В табл. 5 представлены значения концентрации действующего и вспомогательного веществ, найденные с помощью двух массивов ПД-сенсоров (на основе мембран, содержащих 1.0 мас. % УНТ-COO– и 0.5 мас. % УНТ-${\text{SO}}_{3}^{ - },$ и мембран, содержащих 1.0 мас. % УНТ-COO– и 1.5 мас. % УНТ-${\text{SO}}_{3}^{ - }$), а также концентрация никотиновой кислоты, установленная спектрофотометрически. Относительное стандартное отклонение определения ионов никотиновой кислоты с помощью данных массивов ПД-сенсоров составило 1.1 и 0.9%, а ионов Na+ – 1.2 и 1.0%. Для выбранных пар мембран относительная погрешность потенциометрического определения действующего вещества составила 5 и 3% относительно теоретической (табл. 5), а для результатов определения по стандартной методике она составила 13 и 11% соответственно (табл. 5).
Таблица 5.
Результаты определения ионов никотиновой кислоты (NA±) и Na+ в препарате “Никотиновая кислота БУФУС” (раствор для инъекций)
| Характеристика | Спектрофотометрия | Массив ПД-сенсоров на основе мембран МФ-4СК | |
|---|---|---|---|
| 1.0 мас. % УНТ-COO–, 0.5 мас. % УНТ-${\text{SO}}_{3}^{ - }$ |
1.0 мас. % УНТ-COO–, 1.5 мас. % УНТ-${\text{SO}}_{3}^{ - }$ | ||
| c(NA±), M (раствор препарата) | (0.887 ± 0.006) × 10–4 | (0.1548 ± 0.0017) × 10–2 | (0.1583 ± 0.0011) × 10–2 |
| c(Na+), M (раствор препарата) | – | (0.1760 ± 0.0017) × 10–2 | (0.1697 ± 0.0014) × 10–2 |
| c(NA±), мг/мл (препарат) | 10.92 ± 0.07 | 9.531 ± 0.008 | 9.742 ± 0.006 |
| c(NaHCO3), мг/мл (препарат) | – | 7.392 ± 0.006 | 7.126 ± 0.005 |
| sr(NA±), % | 0.8 | 1.1 | 0.9 |
| sr(Na+), % | – | 1.2 | 1.0 |
| Отн. погрешность, % | 9 | 5 | 3 |
Таким образом, достигнутые показатели правильности и воспроизводимости результатов определения никотиновой кислоты в фармацевтических препаратах с помощью ПД-сенсоров на основе мембран МФ-4СК с функционализированными УНТ находятся в тех же диапазонах, что и для известных вольтамперометрических сенсоров [7, 9, 10, 12] (табл. 1). Сравнение характеристик ПД-сенсоров с описанным в работе [13] потенциометрическим сенсором осложнено отсутствием для него оценки правильности и воспроизводимости результатов определения никотиновой кислоты. Рабочий диапазон рН для большинства описанных сенсоров [8, 11, 13] существенно отличается от рН растворов препаратов никотиновой кислоты, поэтому необходима корректировка рН объекта анализа. Градуировка ПД-сенсоров учитывает влияние на их отклик ионов гидроксония и позволяет определять катионы Na+. Кроме того, предложенный способ не требует специальной подготовки материалов сенсоров к анализу и их градуировочные характеристики не претерпевают значимых изменений в течение длительного периода.
По сравнению с методиками, рекомендованными в фармакопейных статьях для анализа фармацевтических препаратов никотиновой кислоты, предложенные сенсоры характеризуются небольшой продолжительностью анализа, позволяют выполнять совместное определение действующего и вспомогательного веществ без дополнительных реагентов и при невысокой степени разбавлении препарата.
Исследование выполнено при финансовой поддержке гранта Президента Российской Федерации, грант № МД-5732.2021.1.3.
Список литературы
Lukasova M., Hanson J., Tunaru S., Offermanns S. Nicotinic acid (niacin): new lipid-independent mechanisms of action and therapeutic potentials // Trends Pharmacol. Sci. 2011. V. 32. № 12. P. 700.
Sinthupoom N., Prachayasittikul V., Prachayasittikul S., Ruchirawat S., Prachayasittikul V. Nicotinic acid and derivatives as multifunctional pharmacophores for medical applications // Eur. Food Res. Technol. 2015. V. 240. № 1. P. 1.
Shin H., Kim B., Lee J. Investigation of isotope dilution mass spectrometric (ID-MS) method to determine niacin in infant formula, breakfast cereals and multivitamins // Food Chem. 2013. V. 138. № 2–3. P. 1109.
Shrivas K., Patel D.K. Quantitative determination of nicotinic acid in micro liter volume of urine sample by drop-to-drop solvent microextraction coupled to matrix assisted laser desorption/ionization mass spectrometry // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2011. V. 78. № 1. P. 253.
Inamadugu J.K., Damaramadugu R., Mullangi R., Ponneri V. Simultaneous determination of niacin and its metabolites – nicotinamide, nicotinuric acid and N‑methyl-2-pyridone-5-carboxamide – In human plasma by LC-MS/MS and its application to a human pharmacokinetic study // Biomed. Chromatogr. 2010. V. 24. № 10. P. 1059.
Wang L.-H. Determination of nicotinic acid and metabolites in urine, cosmetics, and pharmaceuticals by high-performance liquid chromatography with novel electrochemical detection // Anal. Lett. 2016. V. 49. № 10. P. 1467.
Alizadeh T., Amjadi S. Indirect voltammetric determination of nicotinic acid by using a graphite paste electrode modified with reduced graphene oxide and a molecularly imprinted polymer // Microchim. Acta. 2017. V. 184. № 8. P. 2687.
Wu J., Liu H., Lin Z. Electrochemical performance of a carbon nanotube/La-doped TiO2 nanocomposite and its use for preparation of an electrochemical nicotinic acid sensor // Sensors. 2008. V. 8. № 11. P. 7085.
Negut C.C., Stefanov C., Gugoasa L.A.D., van Staden J. (Koos) F. Rapidly renewable graphite paste electrode modified with 5,10,15,20-tetrakis(4-methoxyphenyl)-21H,23H-porphine cobalt(II) for electrochemical determination of nicotinic acid // J. Electroanal. Chem. 2020. V. 863. Article 114063.
Wang X., Yang N., Wan Q. Cyclic voltammetric response of nicotinic acid and nicotinamide on a polycrystalline gold electrode // Electrochim. Acta. 2006. V. 52. № 1. P. 361.
Yang N., Wang X. Thin self-assembled monolayer for voltammetrically monitoring nicotinic acid in food // Colloids Surf. B: Biointerfaces. 2008. V. 61. № 2. P. 277.
Ли Ж.-Я., Ван Ю.Ч., Лиу Ж.Р. Электрохимическое поведение и вольтамперометрическое определение метола с применением электрода, модифицированного многостенными углеродными нанотрубками // Электрохимия. 2006. V. 42. № 1. P. 31 (Lü S. Voltammetric determination of nicotinic acid by glassy-carbon electrode modified with multiwall carbon nanotubes // Russ. J. Electrochem. 2006. V. 42. № 2. P. 163.)
Stoica A.-I., Kleber C., Viñas C., Teixidor F. Ion selective electrodes for protonable nitrogen containing analytes: Metallacarboranes as active membrane components // Electrochim. Acta. 2013. V. 113. P. 94.
Cuartero M., Crespo G.A. All-solid-state potentiometric sensors: A new wave for in situ aquatic research // Curr. Opin. Electrochem. 2018. V. 10. P. 98.
Safronova E., Safronov D., Lysova A., Parshina A., Bobreshova O., Pourcelly G., Yaroslavtsev A. Sensitivity of potentiometric sensors based on Nafion®-type membranes and effect of the membranes mechanical, thermal, and hydrothermal treatments on the on their properties // Sens. Actuators B: Chem. 2017. V. 240. P. 1016.
Safronova E., Parshina A., Kolganova T., Bobreshova O., Pourcelly G., Yaroslavtsev A. Potentiometric sensors arrays based on perfluorinated membranes and silica nanoparticles with surface modified by proton-acceptor groups, for the determination of aspartic and glutamic amino acids anions and potassium cations // J. Electroanal. Chem. 2018. V. 816. P. 21.
Safronova E., Parshina A., Kolganova T., Yelnikova A., Bobreshova O., Pourcelly G., Yaroslavtsev A. Potentiometric multisensory system based on perfluorosulfonic acid membranes and carbon nanotubes for sulfacetamide determination in pharmaceuticals // J. Electroanal. Chem. 2020. V. 873. P. 114435.
Титова Т.С., Юрова П.А., Колганова Т.С., Стенина И.А., Паршина А.В., Бобрешова О.В., Ярославцев А.Б. Потенциометрические сенсоры на основе мембран Nafion, модифицированных PEDOT, для определения прокаина, лидокаина и бупивакаина в водных растворах и фармацевтических препаратах // Журн. аналит. химии. 2020. Т. 75. № 8. С. 750. (Titova T.S., Yurova P.A., Kolganova T.S., Stenina I.A., Parshina A.V., Bobreshova O.V., Yaroslavtsev A.B. Potentiometric sensors based on nafion membranes modified by PEDOT for determining procaine, lidocaine, and bupivacaine in aqueous solutions and pharmaceuticals // J. Anal. Chem. 2020. V. 75. № 8. Р. 1072.)
Паршина А.В., Титова Т.С., Евдокимова Д.Д., Бобрешова О.В., Сафронова Е.Ю., Прихно И.А., Ярославцев А.Б. Гибридные материалы на основе мембран МФ-4СК и углеродных нанотрубок: транспортные свойства и характеристики ПД-сенсоров в растворах гидрофобных аминокислот // Мембраны и мембранные технологии. 2019. Т. 9. № 4. С. 256. (Parshina A.V., Titova T.S., Evdokimova D.D., Bobreshova O.V., Safronova E.Y., Prikhno I.A., Yaroslavtsev A.B. Hybrid materials based on MF-4SC membranes and carbon nanotubes: Transport properties and characteristics of DP-sensors in hydrophobic amino acid solutions // Membr. Membr. Technol. 2019. V. 1. P. 220.)
Beitollahi H., Movahedifar F., Tajik S., Jahani S. A review on the effects of introducing CNTs in the modification process of electrochemical sensors // Electroanalysis. 2019. V. 31. № 7. P. 1195.
Вольфкович Ю.М. Емкостная деионизация воды (обзор) // Электрохимия. 2020. Т. 56. С. 20. (Volfkovich Yu.M. Capacitive deionization of water (a review) // Russ. J. Electrochem. 2020. V. 56. P. 18.)
Yaroslavtsev A.B., Stenina I.A. Carbon coating of electrode materials for lithium-ion batteries // Surface Innovations. 2021. V. 9. P. 92
Prikhno I.A., Safronova E.Y., Yaroslavtsev A.B. Hybrid materials based on perfluorosulfonic acid membrane and functionalized carbon nanotubes: Synthesis, investigation and transport properties // Int. J. Hydrogen Energy. 2016. V. 41. № 34. P. 15585.
Fu Q., Gao B., Dou H., Hao L., Lu X., Sun K., Jiang J., Zhang X. Novel non-covalent sulfonated multiwalled carbon nanotubes from p-toluenesulfonic acid/glucose doped polypyrrole for electrochemical capacitors // Synth. Met. 2011. V. 161. № 5-6. P. 373.
Safronova E.Y., Pourcelly G., Yaroslavtsev A.B. The transformation and degradation of Nafion® solutions under ultrasonic treatment. The effect on transport and mechanical properties of the resultant membranes // Polym. Degrad. Stab. 2020. V. 178. P. 109229.
Сарапулова В.В., Клевцова А.В., Письменская Н.Д. Электростатические взаимодействия ионообменных материалов с антоцианами в процессах их сорбционного и электродиализного извлечения из жидких сред // Мембраны и мембранные технологии. 2020. Т. 10. № 4. С. 281. (Sarapulova V.V., Klevtsova A.V., Pismenskaya N.D. Electrostatic interactions of ion-exchange materials with anthocyanins in the processes of their sorption and electrodialysis extraction from liquid media // Memb. Memb. Technol. 2020. V. 2. P. 272.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


