Журнал аналитической химии, 2022, T. 77, № 2, стр. 129-149
Электрохимические сенсоры для одновременного определения фенольных антиоксидантов
Г. К. Зиятдинова a, *, А. С. Жупанова a, Г. К. Будников a
a Химический институт им. А.М. Бутлерова, Казанский федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Ziyatdinovag@mail.ru
Поступила в редакцию 01.06.2021
После доработки 13.07.2021
Принята к публикации 23.08.2021
- EDN: DBCXIS
- DOI: 10.31857/S004445022202013X
Аннотация
Рассмотрены электрохимические сенсоры для одновременного определения природных или синтетических фенольных антиоксидантов, их аналитические характеристики, достоинства и недостатки. Данные систематизированы по типу чувствительного слоя сенсора, дающего отклик на целевые аналиты, включая углеродные наноматериалы, наночастицы оксидов металлов, полимерные покрытия и их различные сочетания. Уделено внимание способам получения рассматриваемых сенсоров, обсуждены их преимущества и недостатки. В заключении рассмотрены направления дальнейшего развития электроанализа структурно родственных фенольных антиоксидантов.
Определение структурно родственных органических соединений, в том числе и изомеров, при совместном присутствии является актуальной задачей современной аналитической химии. С одной стороны, структурно родственные соединения могут проявлять отличающиеся свойства, например биологическую активность. С другой стороны, селективное определение таких соединений необходимо для установления химического состава объектов исследования, контроля их качества и оценки биологической активности с целью дальнейшего практического применения.
Среди широкого круга биологически активных веществ следует выделить антиоксиданты, которые играют ключевую роль в системе антиоксидантной защиты живых организмов от вредного воздействия свободных радикалов и развития так называемого окислительного стресса [1]. Наиболее многочисленной является группа низкомолекулярных антиоксидантов, включающая большое число структурно родственных соединений, среди которых только фенольных антиоксидантов насчитывается более 10 тысяч соединений [2]. Именно эта группа антиоксидантов привлекает интерес ученых в течение последних 20 лет [3]. Классификация природных фенольных антиоксидантов по биогенетическому принципу (рис. 1) в зависимости от числа фенольных колец в их структуре и типов фрагментов, соединяющих эти кольца, включает пять основных классов: фенольные кислоты (производные бензойной и коричной кислот), флавоноиды, танины (гидролизуемые и конденсированные), стильбены и лигнаны [3]. Все они являются вторичными метаболитами растительного происхождения [4], что обусловливает их структурное подобие, а следовательно, и сходство проявляемых химических свойств. Тем не менее для различных типов растительного сырья характерен свой набор классов фенольных антиоксидантов и их отдельных представителей, что приводит к огромному разнообразию этих соединений в природе.
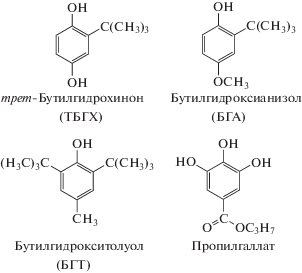
Другая группа фенольных антиоксидантов представлена синтетическими пространственно-затрудненными фенолами (схема 1 ), которые обычно применяют в качестве стабилизаторов продуктов питания, а также растительных и технических масел для предотвращения их окисления [5]. Содержание таких антиоксидантов строго регламентировано и требует контроля, поскольку при высоких концентрациях они могут оказывать дозозависимое токсическое действие, включая карциногенез [6].
Таким образом, селективное определение природных или синтетических фенольных антиоксидантов является актуальной задачей, для решения которой традиционно применяют хроматографические и электрофоретические методы c различными вариантами детектирования [3, 7–12].
Схема 1 . Синтетические пространственно- затрудненные фенолы.
Фенольные антиоксиданты достаточно легко вступают в реакции переноса электрона, что лежит в основе их антиоксидантного действия. Для их определения хорошо зарекомендовали себя методы электроанализа, характеризующиеся высокой чувствительностью, быстротой проведения измерений и относительно невысокой стоимостью анализа, а также возможностью миниатюризации, что делает их весьма привлекательными для решения подобного рода задач [3, 13, 14]. Вместе с тем существенный недостаток электрохимических методов – низкая селективность определения структурно родственных аналитов при совместном присутствии в объектах сложного состава. Во многом это одна из причин ограниченного применения методов электроанализа на практике. Эту проблему удается успешно решать за счет активного развития электрохимических сенсоров.
В настоящее время для одновременного определения фенольных антиоксидантов предложены различные электрохимические сенсоры на основе химически модифицированных электродов. Иммобилизация модификатора на поверхности сенсора изменяет его характеристики (обеспечивает увеличение скорости переноса электрона, концентрирование аналитов, уменьшение влияния матричных эффектов) [15], что открывает новые возможности в определении структурно родственных соединений, в том числе фенольных антиоксидантов. Однако число работ, посвященных одновременному определению фенольных антиоксидантов, невелико по сравнению с данными по определению индивидуальных соединений этой группы.
В настоящем обзоре обобщены литературные данные по электрохимическим сенсорам для одновременного определения природных или синтетических фенольных антиоксидантов и обсуждены их аналитические характеристики, достоинства и недостатки. Сочетание электрохимических сенсоров с хемометрической обработкой данных для одновременного определения фенольных антиоксидантов в данном сообщении не рассматривается.
ОДНОВРЕМЕННОЕ ОПРЕДЕЛЕНИЕ ПРИРОДНЫХ ФЕНОЛЬНЫХ АНТИОКСИДАНТОВ
Для структурно родственных фенольных антиоксидантов, как правило, не удается достичь электрохимического разрешения пиков или ступеней окисления при использовании традиционных углеродистых электродов. Это обусловлено близкими значениями энергии высшей занятой орбитали, с которой отрывается первый электрон на потенциалопределяющей стадии окисления. Тем не менее для представителей различных классов природных фенолов в ряде случаев удается наблюдать четкое разделение сигналов окисления, но число таких примеров ограничено. Так, возможно одновременное определение лютеолина и 3-гидроксифлавона на стержневом графитовом электроде в условиях квадратно-волновой анодной адсорбционной инверсионной вольтамперометрии в среде буферного раствора Бриттона–Робинсона с рН 3.0, содержащего 0.5 М ${\text{ClO}}_{4}^{ - }.$ Разность потенциалов окисления аналитов составляет 243 мВ, что свидетельствует об их независимом окислении. Диапазоны определяемых концентраций составляют 49.0–195 нМ для лютеолина и 117–1130 нМ для 3-гидроксифлавона с пределами обнаружения 1.34 и 5.15 нМ соответственно [16]. Показано, что кверцетин оказывает мешающее влияние при определении лютеолина. Данный подход протестирован на образцах биологических жидкостей с искусственно внесенными аналитами.
Дифференциально-импульсная вольтамперометрия на стеклоуглеродном электроде (СУЭ) позволяет определять кверцетин и лютеолин при совместном присутствии. Разность потенциалов окисления составляет 110 мВ на фоне фосфатного буферного раствора с рН 5.0, содержащего 78% метанола. Градуировочные зависимости линейны в диапазонах 0.0079–3.96 и 3.95–14.85 мкМ для кверцетина и 0.0065–3.26 и 3.26–12.25 мкМ для лютеолина. Пределы обнаружения составляют 2.2 и 1.8 нМ для кверцетина и лютеолина соответственно [17]. Проведено определение кверцетина и лютеолина в белом чае и мате.
Для одновременного определения общего содержания хлорогеновых кислот и ванилина в присутствии кофеина предложен допированный бором алмазный электрод после активации в катодной области потенциалов. В условиях квадратно-волновой адсорбционной инверсионной вольтамперометрии (время накопления 60 с при открытой цепи) на фоне 0.1 М HNO3 потенциалы окисления составляют 0.68 и 1.15 В для хлорогеновой кислоты и ванилина соответственно. Диапазоны определяемых содержаний равны 2.8–170 и 3.3–330 мкМ для хлорогеновой кислоты и ванилина соответственно с пределами обнаружения 0.40 и 0.38 мкМ. Метод апробирован на растворимом кофе с ванилью [18].
Для повышения селективности отклика в современном электроанализе активно применяют химически модифицированные электроды. Подбор подходящего модификатора позволяет управлять аналитическим сигналом определяемых соединений, его селективностью и чувствительностью. Для одновременного определения фенольных антиоксидантов в качестве модификаторов поверхности сенсоров применяют углеродные наноматериалы, наночастицы оксидов металлов, полимерные покрытия различной природы, поверхностно-активные вещества и их различные сочетания.
Сенсоры на основе углеродных наноматериалов. Углеродные наноматериалы (нанотрубки, графен, нановолокна) нашли широкое применение при создании электрохимических сенсоров. Высокая электропроводность, химическая инертность, большое соотношение краевых и базисных плоскостей, большая площадь эффективной поверхности сенсора за счет высокой степени шероховатости, а также возможность функционализации поверхности наноматериала обеспечивают более высокую чувствительность отклика на аналит при низкой концентрации или в сложной матрице, более низкие пределы обнаружения и быстрый перенос электрона по сравнению с традиционными углеродными материалами (стеклоуглеродом, угольной пастой, графитом), т.е. улучшение аналитических характеристик определения целевых аналитов, в том числе и антиоксидантов [19].
Электрохимические сенсоры на основе углеродных наноматериалов различных типов позволяют одновременно определять природные фенольные антиоксиданты: фенольные кислоты, ароматические альдегиды, ванилин и гваякол, флавоноиды. Соответствующие аналитические характеристики обобщены в табл. 1.
Таблица 1.
Электрохимические сенсоры на основе углеродных наноматериалов для одновременного определения природных фенольных антиоксидантов и их аналитические характеристики
| Сенсор | Режим | Аналит | Eа, В; Ек, В* |
Фоновый электролит | ПрО, мкМ | Диапазон определяемых содержаний, мкМ | Литера-тура |
|---|---|---|---|---|---|---|---|
| Восстановленный оксид графена | |||||||
| Электровосстанов- ленный оксид графена/СУЭ | КВВ | Галловая кислота | 0.545 | Буферный раствор Бриттона−Робинсона с рН 2.1 | 30.8 | 20–144 | [20] |
| Протокатеховая кислота | 0.635 | 10.2 | 20–166 | ||||
| Наночешуйки графена/СУЭ | ДИВ | Гваякол | 0.320 | Фосфатный буферный раствор с рН 7.0, содержащий 0.1 М KCl | 0.72 × 10–3 | 0.001–460 | [21] |
| Ванилин | 0.480 | 0.12 × 10–3 | 0.002–470 | ||||
| Нанолисты графена/СУЭ | АдКВВ | Гваякол | 0.428 | Фосфатный буферный раствор с рН 7.0 | 0.0050 | 0.02–10.5 | [22] |
| Ванилин | 0.596 | 0.0045 | 0.02–2.5 | ||||
| Графен/СУЭ | АдКВВ | Хлорогеновая кислота | 0.53 | Фосфатный буферный раствор с рН 2.5 | 0.0044 | 0.014–0.71 | [23] |
| Ванилин | 0.83 | 0.50 | 3.3–210 | ||||
| Углеродные нанотрубки | |||||||
| МУНТ-УПЭ | РДИВ | Кверцетин | 0.155 | Буферный раствор Бриттона−Робинсона с рН 7.0 | 0.02 | 0.05–5.0 | [24] |
| Рутин | 0.295* | 0.04 | 0.1–10 | ||||
| МУНТ-УПЭ | АдДИВ | Галловая кислота | 0.580 | Буферный раствор Бриттона−Робинсона с рН 2.0 | 0.27 | 2.50–7.50 | [25] |
| Эллаговая кислота | 0.770 | 0.21 × 10–3 | 0.005–0.025 | ||||
| МУНТ-УПЭ | АдДИВ | Эллаговая кислота | 0.59 | Буферный раствор Бриттона−Робинсона с рН 2.0 | 0.21 × 10–3 | 0.0075–0.021 | [26] |
| Танин | 0.48 | 0.67 × 10–3 | 0.0075–0.0275 | ||||
| МУНТ-моносукци- нил-β-ЦД/СУЭ | КВВ | Кверцетин | 0.23 | Фосфатный буферный раствор с рН 7.2 | – | 1.5–7.5 | [27] |
| Рутин | 0.34 | – | 1.5–7.5 | ||||
| Другие углеродные наноматериалы | |||||||
| Оксид графита-BMIMPF6/СУЭ | КВВ | Кверцетин | 0.12* | Буферный раствор Бриттона−Робинсона с рН 3.29 | 0.03 | 0.04–0.1 | [28] |
| Рутин | 0.51* | 0.01 | 0.03–1 | ||||
| Графитоподобный C3N4-хитозан/СУЭ | ДИВ | Кофейная кислота | 0.30 | Ацетатный буферный раствор с рН 4.5 | 1.96 | 5.55–166 | [29] |
| Феруловая кислота | 0.51 | 25.6 | 25.7–154 | ||||
Обозначения: ПрО – предел обнаружения, СУЭ – стеклоуглеродный электрод, КВВ – квадратно-волновая вольтамперометрия, ДИВ – дифференциально-импульсная вольтамперометрия, АдКВВ – адсорбционная квадратно-волновая вольтамперометрия, МУНТ – многостенные углеродные нанотрубки, УПЭ – угольно-пастовый электрод, РДИВ – реверсивная дифференциально-импульсная вольтамперометрия, β-ЦД – β-циклодекстрин, BMIMPF6 – 1-бутил-3-метилимидазолий гексафторфосфат.
Создан ряд вольтамперометрических сенсоров на основе восстановленного оксида графена для одновременного определения природных фенольных антиоксидантов различных классов. Обычно оксид графена восстанавливают химическим способом с помощью боргидрида натрия, гидразина или сероводорода [30, 31], проявляющих токсичные свойства. В последнее время для химического восстановления оксида графена используют “зеленые восстановители”, например аскорбиновую или кофейную кислоты, танин и даже экстракты растительного сырья (зеленый чай, экстракты грибов, морковный сок и т.д.) [31]. Описано получение восстановленного оксида графена с применением поверхностно-активных веществ (ПАВ) [21]. Полученный восстановленный оксид графена диспергируют в подходящем растворителе и наносят на поверхность сенсоров методом капельного испарения. Основными недостатками метода химического восстановления являются трудоемкость процедуры (более суток), использование различных дополнительных реагентов, что может приводить к загрязнению наноматериала, а также необходимость термической обработки.
Представляет практический интерес электрохимическое восстановление оксида графена, которое проводят в потенциодинамическом [20] или потенциостатическом [32] режимах. Дисперсию оксида графена наносят на электрод и 15-кратно циклируют потенциал в катодной области от 0 до –1.0 В при скорости сканирования 50 мВ/с [20] или накладывают на электрод потенциал –1.2 В в течение 200 с [32]. При этом исключается использование дополнительных реагентов, в том числе токсичных, значительно упрощается процесс и сокращается трудоемкость процедуры получения наноматериала.
Сенсор на основе электровосстановленного оксида графена предложен для одновременного определения галловой и протокатеховой кислот [20]. Разность потенциалов их окисления составляет 90 мВ, что не позволяет достичь полного разрешения пиков окисления и сказывается на полученных аналитических характеристиках фенольных кислот. Показана селективность отклика сенсора в присутствии лимонной, винной, аскорбиновой и щавелевой кислот, а также глюкозы. Однако не рассматривается возможное мешающее влияние других фенольных антиоксидантов, содержащихся в анализируемом соке манго.
Для одновременного определения ванилина и гваякола описаны сенсоры на основе химически восстановленного оксида графена [21, 22]. Идентичность электроактивного фрагмента в их структуре обусловливает одинаковый процесс окисления при близких потенциалах [21] (схема 2 ).
Схема 2 . Электроокисление гваякола и ванилина.
Восстановление оксида графена в присутствии цетилтриметиламмония бромида в среде ледяной уксусной кислоты в сочетании с ультразвуковой и длительной термообработкой позволяет получить наночешуйки графена [21]. Сенсор на основе этого наноматериала дает отклики на гваякол и ванилин при совместном присутствии, разность потенциалов окисления которых в дифференциально-импульсном режиме регистрации сигнала достигает 160 мВ. Преимуществом предложенного сенсора является высокая чувствительность (пределы обнаружения составляют доли нМ) и селективность отклика в присутствии широкого круга неорганических ионов, углеводов, фенолов, аминофенолов, карбоновых кислот, аминокислот, синтетических и природных фенольных антиоксидантов [21]. Восстановление оксида графена с помощью галлата натрия в диметилформамиде с ультразвуковой обработкой в течение трех часов приводит к образованию нанолистов графена [22]. Сенсор, полученный методом капельного нанесения образовавшейся дисперсии на поверхность СУЭ, обеспечивает значительное улучшение вольт-амперных характеристик гваякола и ванилина за счет реализации π–π стэкинга графена и галлата натрия и образования водородных связей между гидроксильными группами фенолов и гидроксильными и карбоксильной группами галлата натрия. Разность потенциалов окисления гваякола и ванилина составляет 168 мВ, что позволяет проводить их одновременное определение. Полученные аналитические характеристики гваякола и ванилина уступают таковым для сенсора на основе наночешуек графена [21] в области низких концентраций, несмотря на использование предварительного концентрирования аналитов в течение 2 мин при потенциале открытой цепи. Сенсор демонстрирует селективность отклика на целевые аналиты в присутствии неорганических ионов (Ca2+, Na+, K+, Zn2+, Mg2+, Fe3+, Al3+, Cu2+, ${\text{NH}}_{4}^{ + },$ и ${\text{SO}}_{4}^{{2 - }}$), углеводов (глюкозы, лактозы, мальтозы), лимонной, аскорбиновой и винной кислот, мочевины, аденина и гуанина [22].
Одновременное определение хлорогеновой кислоты и ванилина в кофе с ванилью успешно выполнено с помощью сенсора на основе графена, полученного восстановлением оксида графена с помощью гидразина гидрата кипячением при 100°С в течение 24 ч [23]. Использован режим адсорбционной квадратно-волновой вольтамперометрии (30 с накопления при потенциале открытой цепи), обеспечивающей разность потенциалов окисления хлорогеновой кислоты и ванилина 300 мВ и повышение чувствительности определения. Однако сопоставление аналитических характеристик с полученными на допированном бором алмазном электроде [18] показывает улучшение лишь для хлорогеновой кислоты. Кроме того, установлено, что феруловая, галловая и кофейная кислоты оказывают мешающее влияние при определении хлорогеновой кислоты, что не позволяет проводить ее селективное определение в реальных объектах, например в кофе [23].
Таким образом, сенсоры на основе восстановленного оксида графена нашли применение при определении фенольных кислот, гваякола и ванилина.
Различные типы углеродных нанотрубок активно используют в составе электрохимических сенсоров на природные фенольные антиоксиданты. Для их одновременного определения описаны сенсоры на основе многостенных углеродных нанотрубок (МУНТ), обеспечивающих значительное повышение чувствительности отклика за счет увеличения электроактивной площади сенсоров, электрокаталитических свойств МУНТ, а в ряде случаев – адсорбционного концентрирования аналитов на поверхности сенсоров. Для изготовления сенсоров используют два подхода: включение МУНТ в состав угольной пасты [24–26] или нанесение суспензий нанотрубок на электродную поверхность методом капельного испарения [27]. В последнем случае для предотвращения агрегации наноматериала обычно применяют либо предварительную функционализацию, либо диспергирующие агенты (ПАВ, полиэлектролиты) [19].
Представляет интерес сенсор на основе МУНТ в составе угольной пасты, функционирующий в условиях в условиях реверсивной дифференциально-импульсной вольтамперометрии для одновременного определения кверцетина и рутина [24]. Рутин является гликозидом кверцетина и окисляется обычно при близких потенциалах. Показано, что окисление кверцетина протекает по двум ступеням, и вторая ступень перекрывается с пиком окисления рутина, что не позволяет проводить их совместное определение. Однако пики восстановления окисленных форм рутина и кверцетина не перекрываются, что может быть использовано для количественного определения. Чувствительность определения кверцетина и рутина составила 4.90 и 2.43 мкА/мкМ соответственно. Сенсор апробирован на образцах сыворотки крови и мочи. Показано, что компоненты мочи адсорбируются на поверхности сенсора вместе с аналитами, что приводит к заметному снижению их отклика [24].
Показана возможность одновременного определения галловой кислоты и ее димера лактонного типа – эллаговой кислоты – с помощью сенсора на основе МУНТ [25]. Установлено, что окисление эллаговой кислоты контролируется адсорбцией, что объясняет более высокую чувствительность отклика сенсора, позволяющую определять эллаговую кислоту на наномолярном уровне. Описано аналитическое применение предложенного сенсора для индивидуального определения кислот. Аналогичный подход продемонстрирован на примере одновременного определения эллаговой кислоты и танина [26]. В обоих случаях не рассматривается селективность отклика предложенных сенсоров на целевые аналиты.
Разработан СУЭ, модифицированный МУНТ и моносукцинил-β-циклодекстрином, для определения кверцетина и рутина [27]. Сенсор обеспечивает разность потенциалов пиков окисления 110 мВ, что достигается за счет включения моносукцинил-β-циклодекстрина как допанта в состав чувствительного слоя. Это обеспечивает дополнительную стабилизацию за счет нековалентных взаимодействий (водородных связей, электростатических и Ван-дер-Ваальсовых взаимодействий), а также создает стерические затруднения для включения рутина, имеющего в структуре дигликозидный остаток, в полость β-циклодекстрина.
При одновременном определении кверцетина и рутина вольтамперометрические сенсоры обычно дают более чувствительный отклик на кверцетин, что обусловлено стерическими факторами (присутствием гликозидного остатка в структуре рутина). Исключение составляет сенсор на основе оксида графита и ионной жидкости 1-бутил-3-метилимидазолий гексафторфосфата [28], отклик которого на рутин статистически достоверно выше, чем на кверцетин. Использование пиков восстановления флавоноидов позволяет увеличить разность их потенциалов до 390 мВ.
Графитоподобный нитрид углерода является достаточно новым углеродным двумерным материалом, сходным по структуре с графеном [29]. Он представляет собой слоистую структуру, обеспечивающую электронный перенос между слоями. Сенсор на основе этого материала в сочетании с хитозаном показал отклик на кофейную и феруловую кислоты. Основными недостатками сенсора являются мешающее влияние других фенольных соединений, особенно кверцетина, а также низкая чувствительность по отношению к феруловой кислоте, что не позволяет осуществлять ее прямое определение в реальных образцах.
Таким образом, сенсоры на основе углеродных наноматериалов позволяют одновременно определять некоторые фенольные антиоксиданты при совместном присутствии, однако их аналитические характеристики могут быть улучшены. Понизить пределы обнаружения и расширить диапазоны линейности отклика сенсоров можно только при использовании адсорбционного режима, что значительно увеличивает время измерения. Кроме того, при анализе реальных объектов возможно накопление других компонентов пробы и, следовательно, искажение результатов анализа. Другим недостатком таких сенсоров является недостаточная селективность отклика в присутствии структурно родственных соединений, что заметно ограничивает их практическое применение.
Сенсоры на основе наночастиц оксидов металлов. Сенсоры на основе электродов, модифицированных наночастицами оксидов металлов, не получили широкого применения для одновременного определения природных фенольных антиоксидантов. Это обусловлено недостаточной селективностью этих материалов, что не позволяет получить хорошо разрешенные аналитические сигналы на вольтамперограммах. Для электрохимически активных наночастиц (Co3O4, NiO) характерен каталитический отклик, поэтому в присутствии структурно родственных соединений обычно получают интегральный отклик на все аналиты рассматриваемого типа. Наночастицы оксидов металлов в высших степенях окисления (Fe3O4, TiO2, ZrO2, SnO2, CeO2 и т.д.) не проявляют собственную электрохимическую активность в анодной области потенциалов, что позволяет регистрировать собственный отклик фенольных аниоксидантов на вольтамперометраммах. Такие наночастицы обеспечивают увеличение эффективной площади поверхности сенсоров, повышают проводимость и скорость переноса электрона, поэтому для одновременного определения соединений с идентичным строением электроактивного фрагмента такие сенсоры неприменимы. Тем не менее описано несколько примеров таких сенсоров для определения природных фенольных антиоксидантов различных классов, имеющих существенные отличия в структуре.
Угольно-пастовый электрод (УПЭ) с включенными наночастицами Fe3O4 предложен для одновременного определения синаповой и сиреневой кислот и рутина [33]. На дифференциально-импульсных вольтамперограммах в среде ацетатного буферного раствора с рН 4.8 регистрируются пики окисления рутина, синаповой и сиреневой кислот при 0.37, 0.42 и 0.55 В соответственно, форма которых позволяет проводить количественное определение аналитов, хотя полное разрешение пиков не достигается. Диапазоны определяемых содержаний составляют 0.3–3.0 мкМ для рутина, 0.9–8.0 мкМ для синаповой кислоты и 1.0–9.1 мкМ для сиреневой кислоты с пределами обнаружения 0.08, 0.22 и 0.26 мкМ соответственно. Сенсор апробирован на образцах белого и красного виноградного вина с внесенными аналитами.
Для одновременного определения хризина и байкалеина – основных флавоноидов ороксилума индийского (Oroxylum indicum) предложен вольтамперометрический сенсор на основе УПЭ с включенными частицами Ta2O5 и хитозаном. На вольтамперограммах с линейной разверткой потенциала наблюдают хорошо разрешенные пики окисления хризина и байкалеина (рис. 2а). Байкалеин окисляется по двум ступеням при –0.082 и 0.529 В, а хризин при 0.764 В. Токи окисления линейно связаны с концентрацией аналитов в диапазоне 0.08–4 мкМ, а пределы обнаружения равны 0.03 и 0.05 мкМ для хризина и байкалеина соответственно. Установлено, что 100-кратные избытки Al3+, Zn2+, Fe3+, ${\text{NO}}_{3}^{ - },$ ${\text{SO}}_{4}^{{2 - }},$ L-гистидина, глицина, глюкозы, крахмала, сахарозы, мочевины, лимонной кислоты, 10-кратные избытки Ca2+ и Cu2+ не оказывают мешающее влияние. В присутствии 5-кратных избытков аскорбиновой и мочевой кислот наблюдается снижение или увеличение токов окисления байкалеина и хризина более чем на 5% [34]. Результаты определения байкалеина и хризина в ороксилуме индийском хорошо согласуются с данными хроматографии, что подтверждает отсутствие мешающего влияния матричных компонентов образца.
Рис. 2.
(a): Вольтамперограммы с линейной разверткой потенциала хризина и байкалеина при совместном присутствии на угольно-пастовом электроде, модифицированном частицами Ta2O5 и хитозаном на фоне 0.1 М фосфатного буферного раствор рН 8.5. Адаптировано из работы [34] с разрешения Elsevier. (б): Дифференциально-импульсные вольтамперограммы байкалеина и байкалина при совместном присутствии на угольно-пастовом электроде, модифицированном композитом Ta2O5−Nb2O5 с хитозаном на фоне 0.1 М фосфатного буферного раствор рН 7.4. Адаптировано из работы [35] с разрешения Elsevier.

Включение в состав угольной пасты частиц Ta2O5 и Nb2O5 в хитозане позволяет проводить одновременное вольтамперометрическое определение байкалина и его агликона байкалеина [35] (рис. 2б). Аналитические характеристики байкалеина сопоставимы с таковыми для сенсора [34]. Диапазон определяемых содержаний составляет 0.08–8 мкМ для обоих аналитов, а пределы обнаружения равны 0.03 мкМ для байкалина и 0.05 мкМ для байкалеина. Сенсор позволяет определять аналиты в ходе in vivo гидролиза байкалина, а также в препарате китайской медицины на основе корневищ шлемника (Scutellariae).
Сенсор на основе гибридных наночастиц Fe3O4@ZnO типа ядро–оболочка показал чувствительный отклик на кверцетин и рутин при совместном присутствии [36]. В дифференциально-импульсном режиме в среде фосфатного буферного раствора с рН 7.0 регистрируются хорошо разрешенные пики окисления кверцетина и рутина при 0.15 и 0.27 В соответственно. Показано, что окисление флавоноидов протекает независимо. Отклик сенсора линеен в диапазонах 0.29–64.7 мкМ для кверцетина и 0.099–99 мкМ для рутина с пределами обнаружения 0.14 и 0.07 мкМ соответственно. Сенсор обеспечивает селективность отклика в присутствии неорганических ионов, мочевой, аскорбиновой и фолиевой кислот. Хлорогеновая кислота оказывает мешающее влияние. Описано практическое применение сенсора для анализа образцов лекарственного растительного сырья (бурачника лекарственного, ромашки и спаржи аптечной, дубровника, эстрагона и мяты болотной).
Сенсоры на основе полимерных покрытий. Полимерные покрытия активно используют в электрохимических сенсорах на антиоксиданты различной природы. Чаще всего применяют электрополимеризацию подходящих мономеров в условиях потенциодинамического электролиза. Контроль условий электрополимеризации in situ позволяет управлять толщиной, проводимостью и стабильностью полимерного покрытия [37]. В зависимости от природы мономера можно получать как проводящие, так и непроводящие покрытия. Такие электроды отличаются простотой изготовления, воспроизводимостью и однородностью поверхности.
Разработаны чувствительные и селективные сенсоры на основе полифурфураля для одновременного определения природных фенольных антиоксидантов. Пленка полифурфураля содержит большое число активных центров и характеризуется высокой стабильностью. Она проявляет электрокаталитический эффект при окислении фенольных гидроксильных групп [38, 39]. Электрополимеризацию фурфураля проводили из его 0.01 М раствора в среде 0.06 М перхлората натрия в 0.06 М растворе NaOH пятикратным циклированием потенциала от 0.5 до 2.3 В со скоростью 100 мВ/с. Сенсор позволяет одновременно определять мирицетин и рутин в режиме квадратно-волновой вольтамперометрии на фоне буферного раствора Бриттона-Робинсона с рН 6.0, содержащего 0.5% этанола. Разность потенциалов окисления аналитов составляет 164 мВ. Диапазоны определяемых содержаний равны 0.05–10 мкМ для мирицетина и 0.001–10 мкМ рутина с пределами обнаружения 10 и 0.025 нМ соответственно [38]. Показано, что отклик сенсора в присутствии неорганических ионов, лимонной, винной, щавелевой и аскорбиновой кислот, цистина, глюкозы и допамина меняется статистически незначимо. Сенсор протестирован на образцах апельсинового сока. В условиях дифференциально-импульсной вольтамперометрии в среде фосфатного буферного раствора с рН 6.0 сенсор можно использовать для определения кверцетина и ресвератрола при совместном присутствии [39]. Градуировочные зависимости для определения ресвератрола и кверцетина линейны в интервалах 0.8–8 и 0.8–12 мкМ соответственно. Пределы обнаружения составляют 0.4 мкМ для ресвератрола и 0.3 мкМ для кверцетина. К недостаткам сенсора можно отнести отсутствие данных о селективности его отклика на ресвератрол и кверцетин, а также об апробации на реальных объектах.
Другой подход к созданию электрохимических сенсоров на основе полимерных покрытий состоит в использовании природных полимеров – полисахаридов, в структуре которых присутствует большое число гидроксильных и карбонильных групп, что обусловливает их высокое сродство к фенольным соединениям [40]. Угольно-пастовый с включенным очищенным гуммиарабиком предложен для определения рутина и кверцетина при совместном присутствии [41]. Показано, что модификация поверхности электрода приводит к 2.8- и 3.3-кратному росту токов окисления кверцетина и рутина соответственно за счет увеличения реальной площади электрода и ее гидрофильности. Кроме того, ОН-группы в структуре гуммиарабика могут взаимодействовать с ОН-группами флавоноидов, обеспечивая их удерживание на электроде. Количественное определение кверцетина и рутина проводят в условиях квадратно-волновой вольтамперометрии на фоне фосфатного буферного раствора с рН 6.0 в диапазоне 0.099–1.090 мкМ для обоих аналитов. Пределы обнаружения составили 0.029 и 0.058 мкМ для кверцетина и рутина соответственно. Разработанный сенсор применен для прямого определения кверцетина и рутина в свежих фруктах, а также в образцах мочи. Преимуществом сенсора является его стабильность при хранении при комнатной температуре.
Основным недостатком рассмотренных электрохимических сенсоров для одновременного определения природных фенольных антиоксидантов является недостаточная селективность отклика на целевые аналиты в присутствии структурно родственных соединений. Кроме того, в ряде случаев аналитические характеристики могут быть существенно улучшены. Для достижения этих целей созданы вольтамперометрические сенсоры на основе различных сочетаний модификаторов, композитов и гибридных покрытий.
Сенсоры на основе сочетаний модификаторов. Создание электрохимических сенсоров на основе комбинаций различных модификаторов электродной поверхности позволяет сочетать преимущества отдельных сомодификаторов, обеспечивая синергетический эффект. При этом важную роль играет природа аналитов, для определения которых планируется использовать созданные сенсоры.
Для одновременного определения природных фенольных антиоксидантов различных классов предложен ряд сенсоров на основе сочетаний углеродных наноматериалов, наночастиц металлов и их оксидов, полимерных покрытий (табл. 2). Такой подход к созданию сенсоров обеспечивает хорошо разрешенные вольтамперометрические сигналы фенольных антиоксидантов одного класса [42–44, 54, 59], агликонов и их гликозидов [46, 48, 55] и даже изомеров [45, 48] (рис. 3). Кроме того, высокая чувствительность отклика сенсоров на целевые аналиты позволяет исключить адсорбционные режимы в квадратно-волновой и дифференциально-импульсной вольтамперометрии, что сокращает время измерения и снижает влияние матричных эффектов при анализе реальных объектов.
Таблица 2.
Аналитические характеристики одновременного вольтамперометрического определения природных фенольных антиоксидантов с помощью сенсоров на основе сочетаний модификаторов
| Сенсор | Метод | Аналит | ПрО, мкМ | Диапазон определяемых содержаний, мкМ | Объект анализа | Литература |
|---|---|---|---|---|---|---|
| Цетилпиридиний бромид/УНВ/СУЭ | ДИВ | Сиреневый альдегид | 0.53 | 2.5–30 | Модельные растворы | [42] |
| Ванилин | 1.17 | 5.0–40 | ||||
| Наноцветки MnO2–оксид графена/СУЭ | ДИВ | Гваякол | 0.0013 | 0.03–30 | Продукты питания | [43] |
| Ванилин | 0.0015 | 0.03–8 | ||||
| Наночастицы ZrO2/Co3O4/Восстановленный оксид графена/Допированный фтором SnO2 | ДИВ | Галловая кислота | 1.56 × 10–3 | (6.24–477.68) × 10–3 | Зеленый и черный чай, черный и красный рис, фруктовые соки | [44] |
| Кофейная кислота | 0.62 × 10–3 | (2.48–524.90) × 10–3 | ||||
| Протокатеховая кислота | 1.35× 10–3 | (5.40–424.96) × 10–3 | ||||
| Наночастицы Ag–2-аминоэтантиол функционализированный оксид графена/СУЭ | КВВ | Кверцетин | 0.033 | 0.010–5.0 | Виноградное вино | [45] |
| Морин | 0.0033 | 0.010–5.0 | ||||
| Наночастицы Au–п-аминотиофенол функционализированные МУНТ/СУЭ | КВВ | Кверцетин | 0.33 × 10–3 | 0.0010–0.050 | Апельсиновый и яблочный соки | [46] |
| Рутин | 0.33 × 10–3 | 0.0010–0.050 | ||||
| Наночастицы Au–Ag/МУНТ–сульфонат функционализированный графен/СУЭ | ДИВ | Магниферин | 0.017 | 0.05–500 | Корневища анемаррены асфоделовидной | [47] |
| Икариин | 0.017 | 0.05–100 | ||||
| Наночастицы Ru–каликс[4]амидокраун-5 функционализированный восстановленный оксид графена/СУЭ | КВВ | Кверцетин | 0.020 × 10–3 | (0.10–10) × 10–3 | Виноградное вино | [48] |
| Рутин | 0.020 × 10–3 | (0.10–10) × 10–3 | ||||
| Морин | 0.020 × 10–3 | (0.10–10) × 10–3 | ||||
| Наночастицы Pt@Восстановленный оксид графена@МУНТ/СУЭ | ДИВ | Мирицетин | 0.01 | 0.05–50 | Апельсиновый сок с искусственно добавленными аналитами | [49] |
| Рутин | 0.005 | 0.05–50 | ||||
| Наночастицы Pt/политионин/ карбоксилированные МУНТ/СУЭ | ДИВ | Мирицетин | 0.003 | 0.01–15 | [50] | |
| Рутин | 0.0017 | 0.01–15 | ||||
| Наночастицы Pt/поли(о-фенилендиамин)/СУЭ | ДИВ | Протокатеховая кислота | 0.7 | 1–35 | Мелисса лекарственная | [51] |
| Розмариновая кислота | 0.7 | 2–10 | ||||
| Поли(пирокатехиновый фиолетовый)/ОУНТф /СУЭ | ДИВ | Галловая кислота | 0.12 | 0.75–10, 10–100 | Коньяки и бренди | [52] |
| Эллаговая кислота | 0.11 | 0.75–7.5, 7.5–100 | ||||
| Поли(желтый “солнечный закат”)/МУНТ/СУЭ | ДИВ | Хлорогеновая кислота | 0.076 | 0.10–4.0 | Кофе | [53] |
| Феруловая кислота | 0.098 | 0.5–4.0 | ||||
| Полиалюминон/ОУНТф /СУЭ | ДИВ | Гесперидин | 0.029 | 0.1–2.5, 2.5–25 | Апельсиновые и грейпфрутовые соки | [54] |
| Нарингин | 0.020 | 0.1–2.5, 2.5–25 | ||||
| Политимолфталеин/УНВ/СУЭ | ДИВ | Кверцетин | 0.0073 | 0.025–1.0 | Липы Tilia L. цветки и лук репчатый | [55] |
| Рутин | 0.0047 | 0.025–1.0 | ||||
| Поли(5-амино-2-меркапто-1,3,4-тиадиазол)/допированные азотом углеродные сферические частицы/СУЭ | ДИВ | Галловая кислота | 0.82 | 5–128 | Виноградный сок | [56] |
| Кофейная кислота | 0.30 | 5–128 | ||||
| Частицы гидрогеля поли(N-изопропилакриламид-акриловой кислоты)/МУНТ/СУЭ | ДИВ | Лютеолин | 14.5 × 10–6 | 0.0001–5 | Томаты | [57] |
| Байкалеин | 44.4 × 10–6 | 0.005–35 | ||||
| Тиолированный β-ЦД–наночастицы Au@перилен-3,4,9,10-тетракарбоновая кислота–одностенные углеродные наногорны/СУЭ | ДИВ | Мирицетин | 0.0038 | 0.01–10 | Сыворотка крови | [58] |
| Рутин | 0.0044 | 0.01–10 | ||||
| Композит из углеродной сажи–слоистых структур WS2–наночастиц Au, покрытых катехином/УПЭ печатный | ДИВ | Кофейная кислота | 0.10 | 0.3–112 | Продукты питания | [59] |
| Синаповая кислота | 0.40 | 1.2–125 | ||||
| п-Кумаровая кислота | 0.40 | 1.3–125 |
Рис. 3.
(а): Дифференциально-импульсные вольтамперограммы с коррекцией базовой линии 1.0 мкМ смеси хлорогеновой и феруловой кислот на стеклоуглеродном электроде, модифицированном многостенными углеродными нанотрубками и поли(желтым “солнечным закатом”) на фоне фосфатного буферного раствора рН 7.0. (б): Дифференциально-импульсные вольтамперограммы с коррекцией базовой линии 0.10 мкМ смеси кверцетина и рутина на стеклоуглеродном электроде, модифицированном углеродными нановолокнами и политимолфталеином на фоне фосфатного буферного раствора рН 7.5.

Для изготовления рассматриваемых сенсоров обычно применяют метод капельного испарения на поверхность СУЭ или печатных электродов. При этом возможно послойное нанесение сомодификаторов [42, 47, 50–57], каждый из которых предварительно получен химически [45, 47, 57] или электрохимически [50–56], на соответствующую подложку. Преимуществом электрохимического способа получения покрытий является простота, высокая воспроизводимость электродной поверхности и меньшая трудоемкость изготовления сенсоров. Альтернативный подход заключается в предварительном химическом синтезе необходимого нанокомпозита или гибридного материала [43–46, 48, 49, 57–59], что обычно реализуется в несколько этапов (рис. 4), каждый из которых может занимать до суток и более, а также включает стадии отмывания и высушивания отдельных компонентов (от нескольких часов до суток). В целом подход предполагает расход большого числа реагентов и необходимость контроля структуры получающихся наноматериалов на каждой из стадий. Полученные гибридные наноструктуры или композиты диспергируют в подходящем растворителе и также наносят на поверхность сенсора методом капельного испарения, в том числе многократного [59]. В ряде случаев такой подход к созданию сенсоров оправдан, поскольку полученный модификатор обеспечивает высокую чувствительность и селективность отклика сенсора, например, на галловую кофейную и протокатеховую кислоты при совместном присутствии [44] или изомеры морин и кверцетин [45].
Рис. 4.
Схематическая диаграмма синтеза нанокомпозита наночастиц Au/п-МУНТ. Адаптировано из работы [46] с разрешения Elsevier. ЭКД-пАТФ – 1-этил-3-(3-диметиламинопропил)карбодиимид – п-аминотиофенол.
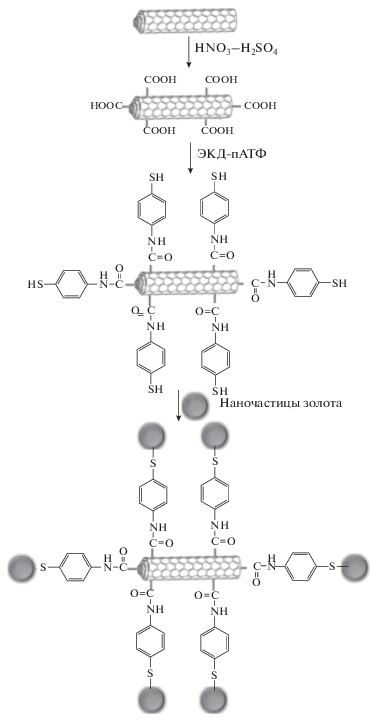
Самым распространенным является использование различных углеродных наноматериалов в качестве подложки для иммобилизации других модификаторов. Возможность достаточно простой и разнообразной функционализации углеродных наноматериалов позволяет получать композитные покрытия с наночастицами металлов, например золота [46], серебра [45], рутения [48] и платины [49], и оксидов металлов [43, 44]. С другой стороны, присутствие углеродных наноматериалов обеспечивает высокую проводимость и шероховатость поверхности, что способствует увеличению количества сомодификатора на поверхности сенсора и его равномерному распределению. Так, например, использование углеродных нанотрубок для последующего электрохимического получения непроводящих полимеров на основе красителей и индикаторов (алюминона [53], желтого солнечного заката [54] и тимолфталеина [55]) способствует стабилизации полимерной пленки и обеспечивает достаточную скорость электронного переноса и проводимость электрода. Следует отметить, что отклик целевых аналитов зависит от условий получения полимерного покрытия (фонового электролита, концентрации мономера, а также потенциала и времени электролиза для потенциостатического режима и электрохимического окна, числа циклов и скорости сканирования потенциала для потенциодинамического режима) [52–55]. При этом в качестве контролируемых параметров используют разность потенциалов и токи окисления рассматриваемых пар аналитов.
Оригинальный сенсор на основе наногибридного материала, состоящего из тиолированного β-циклодекстрина, наночастиц золота и одностенных углеродных наногорнов, функционализированных перилен-3,4,9,10-тетракарбоновой кислотой (рис. 5), дает возможность одновременного определения мирицетина и рутина [58]. Функционализированные углеродные наногорны характеризуются высокой площадью поверхности и проводимостью, а β-циклодекстрин за счет способности к супрамолекулярному распознаванию образует комплексы включения с мирицетином и рутином, что приводит к их концентрированию на электродной поверхности и статистически значимому увеличению токов окисления по сравнению с сенсором на основе наночастиц золота и одностенных углеродных наногорнов, функционализированных перилен-3,4,9,10-тетракарбоновой кислотой.
Рис. 5.
Схематическое изображение наногибрида β-ЦД-Au@ПТКК-ОУНГ для одновременного электрохимического определения мирицетина и рутина. Адаптировано из работы [58] с разрешения Elsevier.

Сенсор на основе композита из углеродной сажи, слоистых структур WS2 и покрытых катехином наночастиц золота проявляет уникальную долгосрочную стабильность [59]. Отклик сенсора на кофейную, синаповую и п-кумаровую кислоты при совместном присутствии снижается на 5% при хранении в течение двух месяцев и остается практически неизменным в течение последующих четырех месяцев, что является достижением для электрохимических сенсоров. Кроме того, сенсор позволяет проводить до 15 последовательных измерений без пассивации поверхности (снижение токов окисления кофейной, синаповой и п-кумаровой кислот не превышает 2, 3 и 3% соответственно). Для некоторых из рассмотренных сенсоров отклик стабилен в течение от 2 недель [47, 58] до 2 месяцев [44, 48].
Несмотря на низкие пределы обнаружения и возможность одновременного определения фенольных кислот и флавоноидов на уровне нМ, для ряда сенсоров рассмотрено мешающее влияние лишь типичных соединений (неорганических ионов, углеводов, органических кислот, в том числе мочевой и аскорбиновой) [49, 50, 56, 57, 59] или вовсе отсутствуют данные по селективности отклика [42, 45]. Учитывая, что реальные объекты содержат различные типы окисляющихся при близких значениях потенциалов фенольных антиоксидантов, необходима информация об их возможном мешающем влиянии. Использование метода добавок не дает сведения о селективности отклика, так как в этом случае может регистрироваться интегральный сигнал, который пропорционален количеству введенного фенольного антиоксиданта. Кроме того, некоторые сенсоры апробированы на образцах, в которых не содержатся целевые аналиты. Например, описано определение мирицетина и рутина в апельсиновом соке [49, 50], основными фенольными антиоксидантами которого являются флаваноны, в частности гесперидин [60].
Для ряда сенсоров установлена селективность в присутствии структурно родственных фенольных антиоксидантов [44, 46, 47, 51–55, 58], что является их преимуществом по сравнению с аналогами. Так, сенсор на основе п-аминотиофенол функционализированных МУНТ и наночастиц золота дает селективный отклик на кверцетин и рутин в присутствии других флавоноидов (нарингина, гесперидина, нарингенина и кемпферола) [46]. Показано, что сиреневый альдегид и ванилин не мешают определению галловой и эллаговой кислот в коньяках и бренди на СУЭ, модифицированном одностенными углеродными нанотрубками, функционализированными полиаминобензолсульфоновой кислотой, и поли(пирокатехиновым фиолетовым) [52]. Достижением можно считать селективность отклика сенсора на основе нанокомпозита восстановленного оксида графена с наночастицами Co3O4 и ZrO2 на галловую, кофейную и протокатеховую кислоты в присутствии 1500-кратных избытков ванилина, 2,5-дигидроксибензойной, синаповой, п-кумаровой и ванилиновой кислот, 1000-кратных избытков п-гидроксибензойной кислоты, витаминов B1 и B2, 500-кратных избытков морина гидрата, рутина, эллаговой кислоты, глюкозы и 100-кратного избытка аскорбиновой кислоты [44].
Таким образом, сенсоры на основе сочетаний модификаторов характеризуются высокими операционными характеристиками, демонстрируют высокую чувствительность и селективность отклика на природные фенольные антиоксиданты одного класса, в том числе и изомеры.
ОДНОВРЕМЕННОЕ ОПРЕДЕЛЕНИЕ СИНТЕТИЧЕСКИХ ПРОСТРАНСТВЕННО-ЗАТРУДНЕННЫХ ФЕНОЛОВ
Для пространственно-затрудненных фенолов (пропилгаллата, трет-бутилгдрохинона (ТБГХ), бутилгидроксианизола (БГА) и бутилгидрокситолуола (БГТ)) характерно двухэлектронное окисление с образованием п-хинонов (для ТБГХ и БГА) или п-метиленхинона (для БГТ) [61–63] и о-хинона в случае пропилгаллата [64]. Присутствие метильной группы в пара-положении к фенольному гидроксилу в структуре БГТ обусловливает его окисление в более положительной области потенциалов по сравнению с остальными рассматриваемыми соединениями, поэтому одновременное определение БГТ в смесях с БГА, ТБГХ и пропилгаллатом не представляет сложностей. Эта задача успешно решена на углеволоконном дисковом микроэлектроде [65], СУЭ [66], золотом [67] и допированном бором алмазном электродах [62]. Как правило, токи окисления БГТ ниже, чем для остальных аналитов, поэтому используют ПАВ-содержащие среды [66] и химически модифицированные электроды [68], что обеспечивает смещение потенциалов окисления в область меньших значений и повышение чувствительности определения. Соответствующие аналитические характеристики представлены в табл. 3.
Таблица 3.
Аналитические характеристики одновременного вольтамперометрического определения синтетических фенольных антиоксидантов
| Сенсор | Метод | Аналит | ПрО, мкМ | Диапазон определяемых содержаний, мкМ | Литера тура |
|---|---|---|---|---|---|
| Допированный бором алмазный электрод | КВВ | БГА | 0.14 | 0.60–10 | [62] |
| БГТ | 0.25 | 0.60–10 | |||
| Углеволоконный дисковый микроэлектрод | ДИВ | БГА | 0.055 | 0.17–3300 | [65] |
| БГТ | 0.27 | 0.82–4181 | |||
| СУЭ в присутствии 0.1 М додецилсульфата натрия | ДИВ | БГА | 0.18 | 2.34–1170 | [66] |
| БГТ | 3.5 | 6.15–615 | |||
| ДИВ | ТБГХ | 0.23 | 2.02–1010 | ||
| БГТ | 3.5 | 6.15–615 | |||
| Cu3(PO4)2 в полиэфирной смоле–УПЭ | КВВ | БГА | 0.072 | 0.34–41 | [68] |
| БГТ | 0.093 | 0.34–41 | |||
| Ацетиленовая сажа/Золотой электрод | КВВ | ТБГХ | 0.028 | 0.30–100 | [69] |
| Пропилгаллат | 0.043 | 0.70–100 | |||
| Пастовый электрод на основе наноуглеродной сажи в присутствии 0.60 мМ ЦПБ | КВВ | ТБГХ | 0.07 | 0.23–120 | [71] |
| БГА | 0.08 | 0.26–130 | |||
| МУНТ–Brij® 35/СУЭ в мицеллярной среде Brij® 35 | ДИВ | ТБГХ | 0.26 | 1.0–1000 | [72] |
| БГА | 0.15 | 0.50–7.5, 10–750 | |||
| Печатный электрод на основе карбоксилированных МУНТ в присутствии 500 мкМ ЦТАБ | ВА | ТБГХ | 0.341 | 0.50–10 | [73] |
| БГА | 0.176 | 0.50–10 | |||
| Печатный электрод на основе карбоксилированных МУНТ в присутствии 200 мкМ ЦТАБ | ВА | ТБГХ | 0.487 | 1.0–10 | [74] |
| Пропилгаллат | 0.104 | 1.0–10 | |||
| БГА | 0.518 | 1.0–10 | |||
| Графен/холин/СУЭ | ДИВ | ТБГХ | 0.14 | 0.40–120 | [75] |
| БГА | 0.19 | 0.60–200 | |||
| Наночастицы Au/СУЭ | ДВА | ТБГХ | 0.48 | 1.2–16.8 | [76] |
| БГА | 0.22 | 0.55–8.3 | |||
| БГТ | 0.36 | 0.91–10 | |||
| Наночастицы Au/электровос-становленный оксид графена/СУЭ | ВА | ТБГХ | 0.31 | 0.60–42.2 | [77] |
| БГА | 0.23 | 0.56–55.6 | |||
| Тетрасульфозамещенный фталоцианин меди(II)–восстановленный оксид графена/СУЭ | ДИВ | ТБГХ | 0.045 | 0.1–500 | [78] |
| БГА | 0.036 | 0.1–500 | |||
| Полые пористые трехслойные наносферы ZnO@оксид графена/СУЭ | КВВ | ТБГХ | 0.134 | 0.80–65 | [79] |
| БГА | 0.0438 | 0.30–60 | |||
| “Колючие” нанотрубки Au–Pt/пероксидаза хрена/ Наночастицы Au–графен/СУЭ | ВА | БГА | 0.26 | 1.66–277 | [80] |
| Пропилгаллат | 0.11 | 0.47–471 | |||
| Поли(карминовая кислота)/МУНТ/СУЭ | ДИВ | ТБГХ | 0.36 | 0.50–75 | [81] |
| БГА | 0.23 | 0.25–75 | |||
| ПМО ТБГХ на основе поли(метакриловой кислоты-гемина)–карбоксилированные МУНТ/СУЭ | ДИВ | ТБГХ | 0.85 | 2.84–150 | [82] |
| БГА | 0.50 | 1.66–150 |
Обозначения: ПрО – предел обнаружения, КВВ – квадратно-волновая вольтамперометрия, ДИВ – дифференциально-импульсная вольтамперометрия, ЦПБ – цетилпиридиний бромид, ВА – вольтамперометрия с линейной разверткой потенциала, ЦТАБ – цетилтриметиламмоний бромид, ДВА – дифференциальная вольтамперометрия первого порядка, ПМО – полимер с молекулярными отпечатками.
Окисление ТБГХ, БГА и пропилгаллата на электродах из углеродистых материалов и благородных металлов протекает при близких потенциалах [66, 69–72], что приводит к частичному перекрыванию пиков окисления. Один из подходов к решению этой проблемы – использование проточного анализа с амперометрическим детектированием. Так, порционный инжекционный анализ с импульсным амперометрическим детектированием на СУЭ позволяет одновременно определять ТБГХ и БГА в диапазоне 1–1000 мкМ с пределами обнаружения 75 и 73 нМ соответственно [83]. Одновременное определение ТБГХ, пропилгаллата и БГА возможно на СУЭ в условиях проточно-инжекционного анализа с мультиимпульсным амперометрическим детектированием [84]. Диапазоны определяемых содержаний синтетических фенолов составляют 2–100 мкМ для ТБГХ, 1–100 для пропилгаллата и 0.8–100 мкМ для БГА.
Другой подход к одновременному определению ТБГХ, БГА и пропилгаллата заключается в разработке химически модифицированных электродов-сенсоров. Анализ публикаций по различным типам модификаторов показал, что наибольшее число работ посвящено углеродным наноматериалам [71–75, 83, 84]. Следует отметить, что значительное улучшение формы вольтамперограмм и разрешения пиков, а также увеличение токов окисления достигается с использованием ПАВ как в качестве диспергирующего агента для МУНТ [72], так и в составе фонового электролита [71–74]. Это объясняется улучшением растворимости аналитов в водно-органических средах в присутствии ПАВ. Так, использование мицеллярной среды неионогенного Brij® 35 позволяет полностью исключить органический растворитель и определять ТБГХ и БГА в водной среде [72]. Для печатных электродов на основе МУНТ показано, что катионные ПАВ (цетилпиридиний и цетилтриметиламмоний бромид) в концентрациях ниже критической концентрации мицеллообразования обеспечивают статистически значимое увеличение токов окисления. Это обусловлено адсорбцией ПАВ на электродной поверхности и их гидрофобными взаимодействиями с молекулами аналитов, что обеспечивает их солюбилизацию и концентрирование на электродной поверхности [71, 73, 74]. Такое влияние катионных ПАВ согласуется с данными для природных фенольных антиоксидантов [42, 85–87]. Кроме того, присутствие ПАВ на поверхности сенсора предотвращает ее пассивацию.
Электростатическое взаимодействие положительно заряженного холина и отрицательно заряженных листов графена обеспечивает структурирование электродной поверхности и высокую скорость переноса электрона, что приводит к росту токов окисления ТБГХ и БГА и смещению потенциалов окисления в область меньших значений (рис. 6). Разность потенциалов пиков достигает 238 мВ, что позволяет проводить их одновременное определение [75].
Рис. 6.
Схематический механизм сборки графена на поверхности, функционализированной монослоем холина, для электрохимического детектирования антиоксидантов. Цитируется из работы [75] с разрешения Elsevier.

Другие типы модификаторов (наночастицы металлов, оксидов металлов, полимерные покрытия, их сочетания с наноматериалами) не получили широкого применения в качестве чувствительного слоя сенсоров. Наночастицы золота [76], в том числе в сочетании с углеродными наноматериалами [77], а также тетрасульфозамещенного фталоцианина меди(II) [78] проявляют электрокаталитический эффект при окислении синтетических фенольных антиоксидантов, что позволяет незначительно улучшить аналитические характеристики аналитов. Сочетание электрополимеризованной карминовой кислоты с МУНТ обеспечивает достоверное увеличение эффективной площади поверхности сенсора и скорости переноса электрона, что приводит к улучшению отклика ТБГХ и БГА по сравнению с СУЭ [81]. Форма вольтамперограмм позволяет проводить их одновременное определение в широком диапазоне концентраций при разности потенциалов окисления 195 мВ.
Представляет интерес сенсор на основе полимера с молекулярными отпечатками ТБГХ на основе композита поли(метакриловой кислоты-гемина) и карбоксилированных МУНТ, характеризующийся селективным откликом на ТБГХ в присутствии аскорбиновой кислоты, эпинефрина, БГА, пирокатехина, допамина, гидрохинона, ацетаминофена и пропилгаллата [82]. Показана возможность одновременного определения ТБГХ и БГА с помощью предложенного сенсора. Полученные аналитические характеристики уступают другим сенсорам (табл. 3).
В целом можно отметить, что все рассмотренные сенсоры характеризуются сопоставимыми аналитическими характеристиками при определении низких содержаний синтетических фенольных антиоксидантов, которые позволяют анализировать реальные объекты. Типичными примерами являются жировые продукты питания (пищевые [69, 72, 75–77, 79–82] и косметические [74] масла, сливочное масло [69], картофельные чипсы [80], майонез и маргарин [68, 71, 82]) и биодизель [71, 73, 78, 82]. Учитывая химический состав этих образцов, показана селективность отклика описанных сенсоров на синтетические фенольные антиоксиданты в присутствии неорганических ионов, аскорбиновой и лимонной кислот, α-токоферола, ретинола, а также других фенольных соединений (фенола, нитро- и хлорфенолов, амино- и гидроксибензойных кислот), в том числе пропилгаллата и БГТ при определении ТБГХ и БГА.
* * *
Обобщая представленный материал, следует отметить, что в настоящее время имеется достаточно большое разнообразие электрохимических сенсоров для одновременного определения природных или синтетических фенольных антиоксидантов, характеризующихся в ряде случаев высокими чувствительностью и селективностью. Это достигается главным образом за счет использования наноразмерных модификаторов поверхности сенсора, причем более низкие пределы обнаружения и достаточно широкие диапазоны определяемых концентраций аналитов достигнуты при сочетании нескольких типов модификаторов. Следует отметить, что изготовление таких сенсоров является сложной и длительной процедурой, которая предусматривает многостадийный синтез каждого из сомодификаторов и контроль его структуры. Использование электрохимических способов получения модифицирующих покрытий предпочтительно, так как они менее трудоемки, обеспечивают возможность контроля толщины покрытий и равномерность их распределения на поверхности сенсора. Дальнейшее развитие в области электрохимических сенсоров на фенольные антиоксиданты связано с исследованием и разработкой новых химически модифицированных электродов с высокими аналитическими и операционными характеристиками, позволяющими одновременно определять изомеры, что пока практически не рассматривается. Актуальной задачей остается расширение числа одновременно определяемых фенольных антиоксидантов одного класса, например гидроксибензойных или гидроксикоричных кислот, флавоноидов одного подкласса и т.д. Для решения этой задачи необходимы либо принципиально новые типы модификаторов с уникальной селективностью по отношению к целевым аналитам, что может быть реализовано путем направленного синтеза с применением методов молекулярного моделирования, либо дальнейшее усложнение состава и структуры гибридных и композитных материалов для обеспечения селективности отклика сенсоров. Другим подходом является создание электрохимических сенсоров, дающих отклик на нано- и пикомолярные концентрации фенольных антиоксидантов, что может обеспечить высокую селективность определения и значительно расширить область практического применения таких сенсоров.
Список литературы
Halliwell B., Gutteridge J.M.C. Free Radicals in Biology and Medicine. 5th ed. Oxford: Oxford University Press, 2015. 896 p. https://doi.org/10.1093/acprof:oso/9780198717478.003. 0003
Li A.N., Li S., Zhang Y.J., Xu X.R., Chen Y.M., Li H.B. Resources and biological activities of natural polyphenols // Nutrients. 2014. V. 6. № 12. P. 6020 https://doi.org/10.3390/nu6126020
Зиятдинова Г.К., Будников Г.К. Антиоксиданты специй как объекты аналитической химии // Журн. аналит. химии. 2018. Т. 73. № 10. С. 739. (Ziyatdinova G.K., Budnikov H.C. Spice antioxidants as objects of analytical chemistry // J. Anal. Chem. 2018. V. 73. № 10. P. 946. )https://doi.org/10.1134/S106193481810012X
Lattanzio V. Phenolic compounds: Introduction / Natural Products. Phytochemistry, Botany and Metabolism of Alkaloids, Phenolics and Terpenes / Eds. Ramawat K.G., Mérillon J.M. Berlin, Heidelberg: Springer-Verlag, 2013. P. 1544. https://doi.org/10.1007/978-3-642-22144-6_57
Hudson B.J.F. Food Antioxidants. London: Elsevier, 1990. 317 p.
Sherwin E.R. Antioxidants / Food Additives / Eds. Branen A.L., Davidson P.M., Salminen S. N.Y.: Marcel Dekker Inc., 1990. P. 139.
Ignat I., Volf I., Popa V.I. Analytical methods of phenolic compounds / Natural Products. Phytochemistry, Botany and Metabolism of Alkaloids, Phenolics and Terpenes / Eds. Ramawat K.G., Mérillon J.M. Berlin, Heidelberg: Springer-Verlag, 2013. P. 2061. https://doi.org/10.1007/978-3-642-22144-6_56
Kafkas N.E., Kosar M., Öz A.T., Mitchell A.E. Advanced analytical methods for phenolics in fruits // J. Food Qual. 2018. V. 2018. Article ID 3836064. https://doi.org/10.1155/2018/383606
Kalogiouri N.P., Samanidou V.F. Advances in the optimization of chromatographic conditions for the separation of antioxidants in functional foods // Rev. Sep. Sci. 2019. V. 1. № 1. P. 17. https://doi.org/10.17145/rss.19.003
Huck C.W., Stecher G., Scherz H., Bonn G. Analysis of drugs, natural and bioactive compounds containing phenolic groups by capillary electrophoresis coupled to mass spectrometry // Electrophoresis. 2005. V. 26. № 7–8. P. 1319. https://doi.org/10.1002/elps.200410315
Cesla P., Fischer J., Jandera P. Separation of phenolic acids and flavone natural antioxidants by two-dimensional method combining liquid chromatography and micellar electrokinetic capillary chromatography // Electrophoresis. 2010. V. 31. № 13. P. 2200. https://doi.org/10.1002/elps.200900689
Milevskaya V.V., Prasad S., Temerdashev Z.A. Extraction and chromatographic determination of phenolic compounds from medicinal herbs in the Lamiaceae and Hypericaceae families: A review // Microchem. J. 2019. V. 145. P. 1046. https://doi.org/10.1016/j.microc.2018.11.041
Ziyatdinova G., Budnikov H. Electroanalysis of antioxidants in pharmaceutical dosage forms: state-of-the-art and perspectives // Monatsh. Chem. 2015. V. 146. № 5. P. 741. https://doi.org/10.1007/s00706-014-1376-5
Chiorcea-Paquim A.M., Enache T.A., De Souza Gil E., Oliveira-Brett A.M. Natural phenolic antioxidants electrochemistry: Towards a new food science methodology // Compr. Rev. Food Sci. Food Saf. 2020. V. 19. № 4. P. 1680. https://doi.org/10.1111/1541-4337.12566
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии и медицине. М.: Бином. Лаборатория знаний, 2012. 419 с.
Temerk Y., Ibrahim H., Schuhmann W. Simultaneous anodic adsorptive stripping voltammetric determination of luteolin and 3-hydroxyflavone in biological fluids using renewable pencil graphite electrodes// Electroanalysis. 2019. V. 31. № 6. P. 1095. https://doi.org/10.1002/elan.201900066
Karaboduk K., Hasdemir E. Simultaneous determination of quercetin and luteolin in mate and white tea samples by voltammetry // Rev. Roum. Chim. 2020. V. 65. № 4. P. 375. https://doi.org/10.33224/rrch.2020.65.4.07
Alpar N., Yardım Y., Şentürk Z. Selective and simultaneous determination of total chlorogenic acids, vanillin and caffeine in foods and beverages by adsorptive stripping voltammetry using a cathodically pretreated boron-doped diamond electrode // Sens. Actuators B. 2018. V. 257. P. 398. https://doi.org/10.1016/j.snb.2017.10.100
Ziyatdinova G., Budnikov H. Carbon nanomaterials and surfactants as electrode surface modifiers in organic electroanalysis / Nanoanalytics: Nanoobjects and Nanotechnologies in Analytical Chemistry / Ed. Shtykov S.N. Berlin, Boston: De Gruyter, 2018. P. 223. https://doi.org/10.1515/9783110542011-007
Abdel-Hamid R., Bakr A., Newair E.F., Garcia. Simultaneous voltammetric determination of gallic and protocatechuic acids in mango juice using a reduced graphene oxide-based electrochemical sensor // Beverages. 2019. V. 5. № 1. Article 17. https://doi.org/10.3390/beverages5010017
Kalaiyarasi J., Meenakshi S., Pandian K., Gopinath S.C.B. Simultaneous voltammetric determination of vanillin and guaiacol in food products on defect free graphene nanoflakes modified glassy carbon electrode // Microchim. Acta. 2017. V. 184. № 7. P. 2131 https://doi.org/10.1007/s00604-017-2161-z
Li C., Fu J., Tan X., Song X., Li Q. A simple and effective strategy based on sodium gallate-exfoliated graphene for the simultaneous voltammetric determination of guaiacol and vanillin // Anal. Methods. 2019. V. 11. № 32. P. 4099. https://doi.org/10.1039/C9AY01018A
Yiğit A., Alpar N., Yardım Y., Çelebi M., Şentürk Z. A graphene-based electrochemical sensor for the individual, selective and simultaneous determination of total chlorogenic acids, vanillin and caffeine in food and beverage samples // Electroanalysis. 2018. V. 30. № 9. P. 2011. https://doi.org/10.1002/elan.201800229
Lin X.-Q., He J.-B., Zha Z.-G. Simultaneous determination of quercetin and rutin at a multi-wall carbon-nanotube paste electrodes by reversing differential pulse voltammetry // Sens. Actuators B. 2006. V. 119. № 2. P. 608. https://doi.org/10.1016/j.snb.2006.01.016
Ghoreishi S.M., Behpour M., Khayatkashani M., Motaghedifard M.H. Simultaneous determination of ellagic and gallic acid in Punica granatum, Myrtus communis and Itriphal formulation by an electrochemical sensor based on a carbon paste electrode modified with multi-walled carbon nanotubes // Anal. Methods. 2011. V. 3. № 3. P. 636. https://doi.org/10.1039/C0AY00691B
Ghoreishi S.M., Behpour M., Khayatkashani M., Motaghedifard M.H. New applied method for simultaneous determination of ellagic and tannic acid by multi-wall carbon nanotube paste electrode: Application in quantification Punica granatum and Quercus infectoria // Digest J. Nanomater. Biostruct. 2011. V. 6. № 2. P. 625.
Jin J.-H., Kim H., Jung S. Electrochemical selectivity enhancement by using monosuccinyl β-cyclodextrin as a dopant for multi-wall carbon nanotube-modified glassy carbon electrode in simultaneous determination of quercetin and rutin // Biotechnol. Lett. 2009. V. 31. № 11. Article 1739. https://doi.org/10.1007/s10529-009-0066-6
Guo J., Kong W., Wang L., Ren H., Sun X., Ye B., Shen Q. Simultaneous determination of rutin and quercetin at a graphite oxide and ionic liquid modified electrode by square wave voltammetry // Sens. Lett. 2013. V. 11. № 3. P. 603. https://doi.org/10.1166/sl.2013.2823
Jing L., Lin J., Fei Q., Tang H., Yang X., Sun C. Simultaneous quantitation of caffeic acid and ferulic acid based on graphite-like C3N4/chitosan modified film // Int. J. Electrochem. Sci. 2017. V. 12. № 9. P. 8504. https://doi.org/10.20964/2017.09.48
Feng M., Feng H. Effect of reducing agent on the chemical reduction of graphene oxides // J. Nanosci. Nanotechnol. 2013. V. 13. № 2. P. 937. https://doi.org/10.1166/jnn.2013.6005
De Silva K.K.H., Huang H.-H., Joshi R.K., Yoshimura M. Chemical reduction of graphene oxide using green reductants // Carbon. 2017. V. 119. P. 190. https://doi.org/10.1016/j.carbon.2017.04.025
Liu L., Gou Y., Gao X., Zhang P., Chen W., Feng S., Hu F., Li Y. Electrochemically reduced graphene oxide-based electrochemical sensor for the sensitive determination of ferulic acid in A. sinensis and biological samples // Mater. Sci. Eng. C. 2014. V. 42. P. 227. https://doi.org/10.1016/j.msec.2014.05.045
Pwavodi P.C., Ozyurt V.H., Asir S., Ozsoz M. Electrochemical sensor for determination of various phenolic compounds in wine samples using Fe3O4 nanoparticles modified carbon paste electrode // Micromachines. 2021. V. 12. № 3. Article 312. https://doi.org/10.3390/mi12030312
Xie Z., Li G., Fu Y., Sun M., Ye B. Sensitive, simultaneous determination of chrysin and baicalein based on Ta2O5-chitosan composite modified carbon paste electrode // Talanta. 2017. V. 165. P. 553. https://doi.org/10.1016/j.talanta.2017.01.021
Xie Z., Lu W., Yang L., Li G., Ye B. A voltammetry sensor platform for baicalein and baicalin simultaneous detection in vivo based on Ta2O5-Nb2O5@CTS composite // Talanta. 2017. V. 170. P. 358. https://doi.org/10.1016/j.talanta.2017.04.022
Arvand M., Daneshvar S. Facile strategy for preparation of core/shell-structured zinc oxide-magnetite hybrids for quantification of quercetin and rutin in pharmaceutical herbs // J. Anal. Chem. 2019. V. 74. № 9. P. 920. https://doi.org/10.1134/S106193481909003X
Li X., Niu Q., Li G., Zhan T., Sun W. Electropolymerization of brilliant cresyl blue on carbon ionic liquid electrode and electrocatalytic application for the voltammetric determination of ascorbic acid // J. Braz. Chem. Soc. 2011. V. 22. № 3. P. 422. https://doi.org/10.1590/S0103-50532011000300003
Huang J., Shen X., Hu Q., Ma Y., Bai S., Yue G., Yu X., Zeng Q., Wang L. High sensitivity simultaneous determination of myricetin and rutin using a polyfurfural film modified glassy carbon electrode // RSC Adv. 2016. V. 6. № 98. P. 95435. https://doi.org/10.1039/C6RA20459G
Fu Y., Lin Y., Chen T., Wang L. Study on the polyfurfural film modified glassy carbon electrode and its application in polyphenols determination // J. Electroanal. Chem. 2012. V. 687. P. 25. https://doi.org/10.1016/j.jelechem.2012.09.040
Mbokou Foukmeniok S., Ilboudo O., Njanja E., Tapsoba I., Pontie M., Kenfack I.T. New electrochemical carbon paste electrode (CPE) based on Arabic Gum modifier and dedicated to 4-aminophenol // J. Appl. Electrochem. 2019. V. 49. № 6. P. 575. https://doi.org/10.1007/s10800-019-01300-7
Mbokou Foukmeniok S., Ilboudo O., Karanga Y., Tapsoba I., Njanja E., Kenfack I.T. Direct and simultaneous quantification of rutin and quercetin in natural fruits base on purified Arabic Gum modified carbon paste electrode // SN Appl. Sci. 2019. V. 1. № 5. Article 385. https://doi.org/10.1007/s42452-019-0413-8
Зиятдинова Г.К., Козлова Е.В., Зиганшина Э.Р., Будников Г.К. Применение электрода, модифицированного углеродными нановолокнами и катионным ПАВ, для вольтамперометрического определения сиреневого альдегида и ванилина при совместном присутствии // Бутлеровские сообщения. 2015. Т. 42. № 6. С. 132.
Gan T., Shi Z., Deng Y., Sun J., Wang H. Morphology-dependent electrochemical sensing properties of manganese dioxide–graphene oxide hybrid for guaiacol and vanillin // Electrochim. Acta. 2014. V. 147. P. 157. https://doi.org/10.1016/j.electacta.2014.09.116
Puangjan A., Chaiyasith S. An efficient ZrO2/Co3O4/reduced graphene oxide nanocomposite electrochemical sensor for simultaneous determination of gallic acid, caffeic acid and protocatechuic acid natural antioxidants // Electrochim. Acta. 2016. V. 211. P. 273. https://doi.org/10.1016/j.electacta.2016.04.185
Yola M.L., Gupta V.K., Eren T., Şenc A.E., Atar N. A novel electro analytical nanosensor based on graphene oxide/silver nanoparticles for simultaneous determination of quercetin and morin // Electrochim. Acta. 2014. V. 120. P. 204. https://doi.org/10.1016/j.electacta.2013.12.086
Yola M.L., Atar N. A novel voltammetric sensor based on gold nanoparticles involved in p-aminothiophenol functionalized multi-walled carbon nanotubes: Application to the simultaneous determination of quercetin and rutin // Electrochim. Acta. 2014. V. 119. P. 24. https://doi.org/10.1016/j.electacta.2013.12.028
Zhai H., Wang H., Wang S., Chen Z., Wang S., Zhou Q., Pan Y. Electrochemical determination of mangiferin and icariin based on Au-AgNPs/MWNTs-SGSs modified glassy carbon electrode // Sens. Actuators B. 2018. V. 255. № 2. P. 1771. https://doi.org/10.1016/j.snb.2017.08.196
Elçin S., Yola M.L., Eren T., Girgin B., Atar N. Highly selective and sensitive voltammetric sensor based on ruthenium nanoparticle anchored calix[4]amidocrown-5 functionalized reduced graphene oxide: simultaneous determination of quercetin, morin and rutin in grape wine // Electroanalysis. 2016. V. 28. № 3. P. 611. https://doi.org/10.1002/elan.201500495
Tursynbolat S., Bakytkarim Y., Huang J., Wang L. Highly sensitive simultaneous electrochemical determination of myricetin and rutin via solid phase extraction on a ternary Pt@r-GO@MWCNTs nanocomposite // J. Pharm. Anal. 2019. V. 9. № 5. P. 358. https://doi.org/10.1016/j.jpha.2019.03.009
Liu C., Huang J., Wang L. Electrochemical synthesis of a nanocomposite consisting of carboxy-modified multi-walled carbon nanotubes, polythionine and platinum nanoparticles for simultaneous voltammetric determination of myricetin and rutin // Microchim. Acta. 2018. V. 185. № 9. Article 414. https://doi.org/10.1007/s00604-018-2947-7
Özdokur K.V., Koçak Ç.C. Simultaneous determination of rosmarinic acid and protocatechuic acid at poly(o-phenylenediamine)/pt nanoparticles modified glassy carbon electrode // Electroanalysis. 2019. V. 31. № 12. P. 2359. https://doi.org/10.1002/elan.201900144
Ziyatdinova G., Guss E., Morozova E., Budnikov H., Davletshin R., Vorobev V., Osin Yu. Simultaneous voltammetric determination of gallic and ellagic acids in cognac and brandy using electrode modified with functionalized SWNT and poly(pyrocatechol violet) // Food Anal. Methods. 2019. V. 12. № 10. P. 2250. https://doi.org/10.1007/s12161-019-01585-6
Зиятдинова Г.К., Гусс Е.В., Морозова Е.В., Будников Г.К. Электрод на основе электрополимеризованного желтого “солнечного заката” для одновременного вольтамперометрического определения хлорогеновой и феруловой кислот // Журн. аналит. химии. 2021. Т. 76. № 3. С. 268. (Ziyatdinova G.K., Guss E.V., Morozova E.V., Budnikov H.C. An electrode based on electropolymerized sunset yellow for the simultaneous voltammetric determination of chlorogenic and ferulic acids // J. Anal. Chem. 2021. V. 76. № 3. P. 371. )https://doi.org/10.1134/S1061934821030163
Zhupanova A., Guss E., Ziyatdinova G., Budnikov H. Simultaneous voltammetric determination of flavanones using an electrode based on functionalized single-walled carbon nanotubes and polyaluminon // Anal. Lett. 2020. V. 53. № 13. P. 2170. https://doi.org/10.1080/00032719.2020.1732402
Гусс Е.В., Зиятдинова Г.К., Жупанова А.С., Будников Г.К. Вольтамперометрическое определение кверцетина и рутина при совместном присутствии на электроде, модифицированном политимолфталеином // Журн. аналит. химии. 2020. Т. 75. № 4. С. 348. (Guss E.V., Ziyatdinova G.K., Zhupanova A.S., Budnikov H.C. Voltammetric determination of quercetin and rutin in their simultaneous presence on an electrode modified with polythymolphthalein // J. Anal. Chem. 2020. V. 75. № 4. P. 526. )https://doi.org/10.1134/S106193482004005X
Kumar D.R., Sayed M.S., Baynosa M.L., Shim J.-J. 5-Amino-2-mercapto-1,3,4-thiadiazole coated nitrogen-doped-carbon sphere composite for the determination of phenolic compounds // Microchem. J. 2020. V. 157. Article 105023. https://doi.org/10.1016/j.microc.2020.105023
Ma Y., Kong Y., Xu J., Deng Y., Lu M., Yu R., Yuan M., Li T., Wang J. Carboxyl hydrogel particle film as a local pH buffer for voltammetric determination of luteolin and baicalein // Talanta. 2020. V. 208. Article 120373. https://doi.org/10.1016/j.talanta.2019.120373
Ran X., Yang L., Zhang J., Deng G., Li Y., Xie X., Zhao H., Li C.-P. Highly sensitive electrochemical sensor based on β-cyclodextrine-gold@3,4,9,10-perylene tetracarboxylic acid functionalized single-walled carbon nanohorns for simultaneous determination of myricetin and rutin // Anal. Chim. Acta. 2015. V. 892. P. 85. https://doi.org/10.1016/j.aca.2015.08.046
Della Pelle F., Rojas D., Silveri F., Ferraro G., Fratini E., Scroccarello A., Escarpa A., Compagnone D. Class-selective voltammetric determination of hydroxycinnamic acids structural analogs using a WS2/catechin-capped AuNPs/carbon black–based nanocomposite sensor // Microchim. Acta. 2020. V. 187. № 5. Article 296. https://doi.org/10.1007/s00604-020-04281-z
Tomás-Barberán F.A, Clifford M.N. Flavanones, chalcones and dihydrochalcones – nature, occurrence and dietary burden // J. Sci. Food Agric. 2000. V. 80. № 7. P. 1073. https://doi.org/10.1002/(SICI)1097-0010(20000515)80: 7<1073::AID-JSFA568>3.0.CO;2-B
Рогинский В.А. Фенольные антиоксиданты. Реакционная способность и эффективность. М.: Наука, 1988. 247 с.
Medeiros R.A., Rocha-Filho R.C., Fatibello-Filho O. Simultaneous voltammetric determination of phenolic antioxidants in food using a boron-doped diamond electrode // Food Chem. 2010. V. 123. № 3. P. 886. https://doi.org/10.1016/j.foodchem.2010.05.010
Ziyatdinova G., Khuzina A., Budnikov H. Determination of sterically hindered phenols and α-tocopherol by cyclic voltammetry // Anal. Lett. 2012. V. 45. № 12. P. 1670. https://doi.org/10.1080/00032719.2012.677788
Gunckel S., Santander P., Cordano G., Ferreira J., Munoz S., Nunez-Vergara L.J., Squella J.A. Antioxidant activity of gallates: An electrochemical study in aqueous media // Chem. Biol. Interact. 1998. V. 114. № 1–2. P. 45. https://doi.org/10.1016/S0009-2797(98)00041-6
Jakubczyk M., Michalkiewicz S. Electrochemical behavior of butylated hydroxyanisoleand butylated hydroxytoluenein acetic acid solutions and their voltammetric determination in pharmaceutical preparations // Int. J. Electrochem. Sci. 2018. V. 13. № 5. P. 4251. https://doi.org/10.20964/2018.05.76
Зиятдинова Г.К., Зиганшина Э.Р., Оськина К.С., Будников Г.К. Вольтамперометрическое определение пространственно-затрудненных фенолов в самоорганизующихся средах на основе ПАВ // Журн. аналит. химии. 2014. Т. 69. № 8. С. 825. (Ziyatdinova G.K., Ziganshina E.R., Os’kina K.S., Budnikov H.C. Voltammetric determination of sterically hindered phenols in surfactant-based self-organized media 2014. V. 69. № 8. P. 750. )https://doi.org/10.1134/S1061934814080140
Tomášková M., Chýlková J., Jehlička V., Navrátil T., Švancara I., Šelešovská R. Simultaneous determination of BHT and BHA in mineral and synthetic oils using linear scan voltammetry with a gold disc electrode // Fuel. 2014. V. 123. P. 107. https://doi.org/10.1016/j.fuel.2014.01.052
Freitas K.H.G., Fatibello-Filho O. Simultaneous determination of butylated hydroxyanisole (BHA) and butylatedhydroxytoluene (BHT) in food samples using a carbon composite electrode modified with Cu3(PO4)2 immobilized in polyester resin // Talanta. 2010. V. 81. № 3. P. 1102. https://doi.org/10.1016/j.talanta.2010.02.004
Thomas A., Kumar K.G. Electro-catalytic resolution and simultaneous determination of two phenolic antioxidants // J. Electrochem. Soc. 2018. V. 165. № 9. P. B351. https://doi.org/10.1149/2.0241809jes
Hoffmann da Rocha A.A., Casagrande M., de Souza Schaumlöffel L., da Silva Y.P., Sartori Piatnicki C.M. Simultaneous voltammetric determination of TBHQ and PG in biodiesel-ethanol at a Pt ultramicroelectrode // Energy Fuels. 2017. V. 31. № 7. P. 7076. https://doi.org/10.1021/acs.energyfuels.7b00204
Angelis P.N., de Cássia Mendonça J., Rocha L.R., Capelari T.B., Prete M.C., Segatelli M.G., Borsato D., Tarley C.R.T. Feasibility of a nano-carbon black paste electrode for simultaneous voltammetric determination of antioxidants in food samples and biodiesel in the presence of surfactant // Electroanalysis. 2020. V. 32. № 6. P. 1198. https://doi.org/10.1002/elan.201900479
Ziyatdinova G., Os’kina K., Ziganshina E., Budnikov H. Simultaneous determination of TBHQ and BHA on a MWNT-Brij® 35 modified electrode in micellar media // Anal. Methods. 2015. V. 7. № 19. P. 8344. https://doi.org/10.1039/C5AY01973G
Caramit R.P., de Freitas Andrade A.G., de Souza J.B.G., de Araujo T.A., Viana L.H., Trindade M.A.G., Ferreira V.S. A new voltammetric method for the simultaneous determination of the antioxidants TBHQ and BHA in biodiesel using multi-walled carbon nanotube screen-printed electrodes // Fuel. 2013. V. 105. P. 306. https://doi.org/10.1016/j.fuel.2012.06.062
Caramit R.P., Araújo A.S.A., Fogliatto D.K., Viana L.H., Trindade M.A.G., Ferreira V.S. Carbon-nanotube-modified screen-printed electrodes, a cationic surfactant, and a peak deconvolution procedure: Alternatives to provide satisfactory simultaneous determination of three synthetic antioxidants in complex samples // Anal. Methods. 2015. V. 7. № 9. P. 3764. https://doi.org/10.1039/C4AY02875A
Wang P., Han C., Zhou F., Lu J., Han X., Wang Z. Electrochemical determination of tert-butylhydroquinone and butylated hydroxyanisole at choline functionalized film supported graphene interface // Sens. Actuators B. 2016. V. 224. P. 885. https://doi.org/10.1016/j.snb.2015.10.098
Lin X., Ni Y., Kokot S. Glassy carbon electrodes modified with gold nanoparticles for the simultaneous determination of three food antioxidants // Anal. Chim. Acta. 2013. V. 765. P. 54. https://doi.org/10.1016/j.aca.2012.12.036
Yue X., Song W., Zhu W., Wang J., Wang Y. In situ surface electrochemical co-reduction route towards controllable construction of AuNPs/ERGO electrochemical sensing platform for simultaneous determination of BHA and TBHQ // Electrochim. Acta. 2015. V. 182. P. 847. https://doi.org/10.1016/j.electacta.2015.09.162
Carvalho R.M.S., Neto S.Y., Silva F.C., Damos F.S., Luz R. de C.S. A sensitive sensor based on CuTSPc and reduced graphene oxide for simultaneous determination of the BHA and TBHQ antioxidants in biodiesel samples // Electroanalysis. 2016. V. 28. № 12. P. 2930. https://doi.org/10.1002/elan.201600187
Gan T., Zhao A.-x., Wang S.-h., Lv Z., Sun J.-y. Hierarchical triple-shelled porous hollow zinc oxide spheres wrapped in graphene oxide as efficient sensor material for simultaneous electrochemical determination of synthetic antioxidants in vegetable oil // Sens. Actuators B. 2016. V. 235. P. 707. https://doi.org/10.1016/j.snb.2016.05.137
Wu L., Yin W., Tang K., Li D., Shao K., Zuo Y., Ma J., Liu J., Han H. Enzymatic biosensor of horseradish peroxidase immobilized on Au-Pt nanotube/Au-graphene for the simultaneous determination of antioxidants // Anal. Chim. Acta. 2016. V. 933. P. 89. https://doi.org/10.1016/j.aca.2016.06.020
Ziyatdinova G., Guss E., Budnikov H. Amperometric sensor based on MWNT and electropolymerized carminic acid for the simultaneous quantification of TBHQ and BHA // J. Electroanal. Chem. 2020. V. 859. Article 113885. https://doi.org/10.1016/j.jelechem.2020.113885
Moretti E. dos S., Oliveira F.M., Scheel G.L., DalĺAntônia L.H., Borsato D., Kubota L.T., Segatelli M.G., Tarley C.R.T. Synthesis of surface molecularly imprinted poly(methacrylic acid-hemin) on carbon nanotubes for the voltammetric simultaneous determination of antioxidants from lipid matrices and biodiesel // Electrochim. Acta. 2016. V. 212. P. 322. https://doi.org/10.1016/j.electacta.2016.06.174
Tormin T.F., Cunha R.R., Richter E.M., Munoz R.A.A. Fast simultaneous determination of BHA and TBHQ antioxidants in biodiesel by batch injection analysis using pulsed-amperometric detection // Talanta. 2012. V. 99. P. 527. https://doi.org/10.1016/j.talanta.2012.06.024
Bavol D., Economou A., Zima J., Barek J., Dejmkova H. Simultaneous determination of tert-butylhydroquinone, propyl gallate, and butylated hydroxyanisole by flow-injection analysis with multiple-pulse amperometric detection // Talanta. 2018. V. 178. P. 231. https://doi.org/10.1016/j.talanta.2017.09.032
Ziyatdinova G., Ziganshina E., Budnikov H. Electrooxidation of morin on glassy carbon electrode modified by carboxylated single-walled carbon nanotubes and surfactants // Electrochim. Acta. 2014. V. 145. P. 209. https://doi.org/10.1016/j.electacta.2014.08.062
Зиятдинова Г.К., Козлова Е.В., Зиганшина Э.Р., Будников Г.К. Электрохимическое окисление сиреневого альдегида на ПАВ-модифицированном электроде // Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2014. Т. 156. Кн. 4. С. 29.
Ziyatdinova G., Kozlova E., Ziganshina E., Budnikov H. Surfactant/carbon nanofibers modified electrode for the determination of vanillin // Monatsh. Chem. 2016. V. 147. № 1. P. 191. https://doi.org/10.1007/s00706-015-1559-8
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии