Журнал аналитической химии, 2022, T. 77, № 3, стр. 263-268
Микроэкстракционное выделение 17-β-эстрадиола из лекарственных препаратов для последующего ВЭЖХ-УФ-определения
З. Р. Якупова a, b, *, С. А. Лебединец a, К. С. Вах a, С. Ю. Гармонов b, А. В. Булатов a
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Петергоф, Университетский просп., 26, Россия
b Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Республика Татарстан, Россия
* E-mail: yakupovalab@yandex.ru
Поступила в редакцию 08.06.2021
После доработки 21.06.2021
Принята к публикации 21.06.2021
- EDN: IVRYRE
- DOI: 10.31857/S0044450222010169
Аннотация
Предложен способ хроматографического определения 17-β-эстрадиола в лекарственных препаратах, включающий микроэкстракционное выделение аналита из раствора пробы. Процедура предполагает диспергирование экстрагента (1-додеканола) в водной фазе при вращении хлопкового диска, оснащенного вкладышем магнитной мешалки. Образование эмульсии экстрагента обеспечивает быстрый массоперенос целевого аналита. При вращении диска в водной фазе также происходит образование центрального вихря, в котором формируется капля экстракта при последующем разрушении эмульсии. Охлаждение экстракционной системы обеспечивает кристаллизацию экстракта, который отбирают для выполнения анализа методом ВЭЖХ-УФ. Достигнут предел обнаружения (3σ) 0.03 мг/л. Аналитические возможности разработанного способа показаны на примере определения 17-β-эстрадиола в трансдермальных гелях.
Эстрогены являются одними из наиболее распространенных и значимых гормонов в женском организме. Содержание эстрадиола и его производных на физиологическом уровне обеспечивает половое созревание, развитие вторичных половых признаков, усиливает рост и дифференцировку влагалищного эпителия и оказывает антисклеротическое действие. В свою очередь, снижение содержания эстрогенов в организме женщин может приводить к развитию остеопороза, сопровождается симптомами менопаузного периода, такими как расстройство сна, сосудодвигательная и терморегулирующая нестойкость [1, 2]. В медицинской практике эстрогены назначают как противозачаточные лекарственные препараты, при лечении симптомов менопаузы, остеопороза, а также для профилактики эстрогензависимого рака груди [3].
В настоящее время существует большое количество лекарственных препаратов для заместительной гормональной терапии. К их числу относятся препараты синтетического эстрогена – 17-β-эстрадиола, выпускаемые в форме трансдермальных гелей, таблеток и пластырей. Контроль качества таких препаратов с целью подтверждения их подлинности, а также оценки содержания действующего вещества является важной задачей.
Для определения 17-β-эстрадиола в лекарственных препаратах и биологических жидкостях широкое применение находят методы ВЭЖХ и газовой хроматографии с различными способами детектирования [4, 5], капиллярный электрофорез [6], хемилюминесценция [7] и электрохемилюминесценция [8]. Как правило, инструментальный анализ лекарственных препаратов, содержащих помимо лекарственных вспомогательные вещества, требует включения в общую схему анализа стадии пробоподготовки, которая, кроме растворения проб, может предполагать извлечение целевых аналитов из твердых проб или их экстракцию из приготовленных растворов.
В современной аналитической химии для выделения лекарственных веществ из различных матриц активно применяют методы жидкостной микроэкстракции, позволяющие упростить процедуры пробоподготовки, обеспечивая ее высокую эффективность при минимальных расходах реагентов и проб [9]. Экспрессным методом является дисперсионная жидкостная микроэкстракция, которая предполагает диспергирование экстрагента в пробе с образованием тонкодисперсной эмульсии, в которой быстро устанавливается межфазное равновесие за счет большой площади контакта фаз [10–13]. Смесь неполярного экстрагента и растворителя-диспергатора, неограниченно смешивающегося с ним и с пробой, быстро вводят в анализируемый раствор, в результате чего фаза экстрагента равномерно распределяется в нем в виде тонкодисперсной эмульсии. Разделение фаз достигается центрифугированием, органическую фазу отбирают для проведения анализа. Для упрощения процедуры отделения фазы экстракта предложено использовать ее кристаллизацию при охлаждении экстракционной системы [14]. При этом применяют экстрагенты с температурой кристаллизации, близкой к комнатной, например такие длинноцепочечные спирты, как 1-ундеканол [15, 16] и 1-додеканол [17, 18]. Однако введение полярного растворителя (диспергатора) приводит к повышению растворимости аналита и экстрагента в водной фазе, результатом чего является снижение коэффициента распределения [19].
В данной работе для хроматографического определения 17-β-эстрадиола в лекарственных препаратах реализован новый вариант дисперсионной жидкостной микроэкстракции, включающий диспергирование экстрагента в водном растворе пробы при вращении хлопкового диска, оснащенного вкладышем магнитной мешалки, с последующей кристаллизацией экстракта. С целью подтверждения эффективности предложенного варианта дисперсионной жидкостной микроэкстракции изучили возможность выделения 17-β-эстрадиола из проб трансдермальных гелей для последующего определения методом ВЭЖХ-УФ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Раствор 17-β-эстрадиола (10 г/л) готовили путем растворения точной навески вещества (Sigma-Aldrich, Германия) в метаноле. Приготовленный раствор хранили в темном месте при +4°C. Рабочие растворы гормона готовили непосредственно перед экспериментом путем последовательного разбавления исходного раствора деионизованной водой. В работе использовали 1-додеканол производства “Sigma-Aldrich” (Германия), ацетонитрил и метанол производства “J.T. Baker Chemical Company” (США).
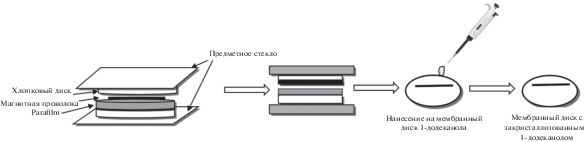
Для приготовления хлопковых дисков использовали хлопковое полотно и лабораторную пленку Parafilm M (Bemis Company, Inc, США), из которых вырезали диски внутренним диаметром 10 ± 1 мм (рис. 1). Затем каждый диск из хлопкового полотна аккуратно разделяли на два слоя. Пленку Parafilm M и вкладыш магнитной мешалки (металлическая проволока, длина 10 мм, внутренний диаметр 1 мм) помещали между двумя слоями хлопка. Систему накрывали двумя предметными стеклами и помещали в сушильный шкаф (100°С, 10 мин) для плавления пленки Parafilm M и склеивания дисков между собой. На диск помещали 50 мкл расплавленного 1-додеканола (30°С). При охлаждении 1-додеканол кристаллизовался на диске. Диски хранили в холодильнике в эксикаторе.
Для определения 17-β-эстрадиола использовали систему ВЭЖХ LC-20 Prominence (Shimadzu, Япония) с УФ-детектором. Хроматографическое разделение выполняли на колонке Luna C18 (250 × 4.6 мм, 5 мкм). Элюирование осуществляли в изократическом режиме. Подвижную фазу, состоящую из деионизованной воды и ацетонитрила (в соотношении 2 : 3), подавали со скоростью 1.0 мл/мин. Объем пробы составлял 20 мкл. Детектирование выполняли при длине волны 280 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На основании данных в качестве экстрагента для извлечения 17-β-эстрадиола выбрали 1-додеканол, который имеет ограниченную растворимость в водной фазе (0.004 г/л [21]), низкую летучесть и температуру кристаллизации, близкую к комнатной (температура плавления 24°C [22]). Перечисленные свойства этого длинноцепочечного спирта позволили применить его в дисперсионной жидкостной микроэкстракции с кристаллизацией экстракта.
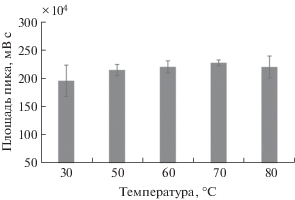
Для исключения применения полярных растворителей в процессе диспергирования экстрагента в водной фазе реализовали способ, предполагающий переход твердой фазы 1-додеканола в жидкую и ее диспергирование в водной фазе при вращении хлопкового диска при нагревании. Для нагрева экстракционной системы использовали лабораторную магнитную мешалку с контролируемой температурой. Температура играет ключевую роль для фазового перехода и диспергирования экстрагента. С целью оптимизации условий микроэкстракции варьировали температуру от 30 до 80°С. Предварительно на диск помещали 60 мкл расплавленного экстрагента, затем выполняли микроэкстракцию из 3 мл раствора 17-β-эстрадиола (10 мг/л) при вращении диска (700 об/мин) в течение 15 мин. Установили, что при 30°С 1-додеканол не полностью переходит с поверхности диска в водную фазу и как следствие воспроизводимость результатов определения аналита в экстрактах оказывается неудовлетворительной (рис. 2). При охлаждении экстракционной системы на поверхности диска оставались частицы твердой фазы 1-додеканола. Удовлетворительное извлечение гормона и минимальное значение относительного стандартного отклонения (sr) (5%) достигаются при 70°С. В этом случае после охлаждения остатки твердой фазы 1-додеканола на поверхности диска не наблюдали.
Рис. 2.
Влияние температуры на эффективность микроэкстракции 17-β-эстрадиола. Концентрация аналита 10 мг/л, объем водной фазы 3 мл, объем органической фазы 60 мкл, время перемешивания 15 мин, 700 об/мин.
Трансдермальные гели 17-β-эстрадиола являются высоковязкими пробами, в состав которых входят полярные вспомогательные органические вещества (карбомеры, многоатомные спирты), снижающие эффективность извлечения гормона в фазу 1-додеканола. Для снижения вязкости гелей и устранения мешающего влияния вспомогательных веществ использовали растворение проб в деионизованной воде. Установили, что при 80-кратном разбавлении проб трансдермальных гелей мешающее влияние вспомогательных веществ устраняется.
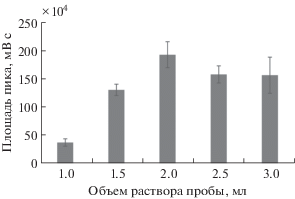
Объем раствора пробы влияет на эффективность концентрирования и достигаемую чувствительность определения целевого аналита. Изучили влияние объема раствора пробы в диапазоне от 1 до 3 мл на эффективность микроэкстракции путем сравнения площадей пиков на хроматограммах. При увеличении объема раствора пробы до 2 мл аналитический сигнал возрастает (рис. 3). Следует также отметить, что при экстракции из 2.5 и 3.0 мл раствора пробы получали невоспроизводимые результаты, что можно объяснить неравномерным диспергированием 1-додеканола в большом объеме водной фазы. Таким образом, для дальнейших исследований выбрали объем пробы 2 мл.
Рис. 3.
Влияние объема раствора пробы на эффективность микроэкстракции 17-β-эстрадиола. Концентрация аналита 10 мг/л, объем органической фазы 60 мкл, время перемешивания 15 мин, 700 об/мин.
Объем экстрагента существенно влияет на степень извлечения аналита. Для оптимизации этого параметра проводили процедуру микроэкстракции с различными объемами 1-додеканола (от 10 до 70 мкл), который предварительно наносили на диск. Установили, что объем экстрагента 50 мкл обеспечивает самые высокие значения площадей хроматографических пиков (рис. 4) при перемешивании фаз в течение 10 мин. При уменьшении времени перемешивания фаз возрастало значение sr.
Рис. 4.
Влияние объема экстрагента на эффективность микроэкстракции 17-β-эстрадиола. Концентрация аналита 10 мг/л, объем водной фазы 50 мкл, время перемешивания 10 мин, 700 об/мин.

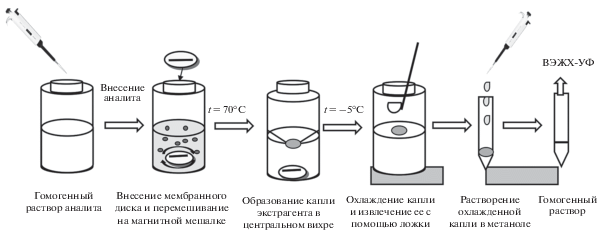
На основе полученных результатов разработали способ определения 17-β-эстрадиола в трансдермальных гелях (рис. 5): 0.025 ± 0.005 г пробы помещают в стеклянный флакон, добавляют 2 мл деионизованной воды и интенсивно встряхивают смесь в течение 2 мин. Хлопковый диск с 1-додеканолом (50 мкл) помещают во флакон с раствором пробы и перемешивают со скоростью 700 об/мин в течение 10 мин при 70°С. Плотность экстракта меньше плотности водной фазы, поэтому органическую фазу выделяют в форме капли в центральном вихре в водной фазе. Для кристаллизации экстракта стеклянный флакон помещают в криостат (–5°С, 5 мин). После этого твердую фазу экстракта (в форме капли) аккуратно переносят в другой сосуд с помощью шпателя, растворяют в 100 мкл метанола при комнатной температуре и вводят приготовленный раствор в хроматографическую систему.
Рис. 5.
Схема проведения дисперсионной жидкостной микроэкстракции с последующей кристаллизацией экстракта.
Для построения градуировочного графика использовали водные растворы 17-β-эстрадиола. Градуировочный график линеен в диапазоне концентраций от 0.1 до 15.0 мг/л (y = 64.363х). Достигнут предел обнаружения (3σ) 0.03 мг/л. Значение sr не превышало 10% (n = 5). Степень извлечения составила 90%, коэффициент концентрирования 36.
Разработанный способ использовали для определения содержания 17-β-эстрадиола в трансдермальных гелях “Дивигель” и “Эстрожель”. Правильность результатов подтверждали методом введено–найдено. Найденные результаты определения содержания эстрадиола в лекарственных препаратах представлены в табл. 1.
Таблица 1.
Результаты (мг/л) определения 17-β-эстрадиола в лекарственных препаратах (n = 3, P = 0.95)
| Лекарственный препарат | Введено | Найдено | Степень извлечения, % |
|---|---|---|---|
| Дивигель (1.0 мг/г) | 0 | 1.11 ± 0.16 | – |
| 0.80 | 1.68 ± 0.65 | 71.3 | |
| 1.60 | 2.52 ± 0.93 | 88.1 | |
| Эстрожель (0.6 мг/г) | 0 | 0.57 ± 0.28 | – |
| 1.60 | 1.98 ± 0.59 | 88.8 |
* * *
Разработан эффективный вариант дисперсионной жидкостной микроэкстракции, включающий диспергирование экстрагента в водном растворе пробы при вращении хлопкового диска, оснащенного вкладышем магнитной мешалки, с последующей кристаллизацией экстракта. Описан способ изготовления хлопкового диска для реализации дисперсионной жидкостной микроэкстракции. Показана возможность применения 1-додеканола в качестве экстрагента для микроэкстракционного выделения 17-β-эстрадиола. Разработанный способ микроэкстракции исключает необходимость применения полярных растворителей для диспергирования экстрагентов. Предложенный способ ВЭЖХ-УФ-определения 17-β-эстрадиола в лекарственных препаратах по сравнению с аналогами [4–8] позволил упростить процедуру пробоподготовки и сократить расход экстрагентов (на одно определение требуется 50 мкл экстрагента). Разработанный способ микроэкстракции может в дальнейшем найти применение в практике персонализированной медицины для определения гормонов в биологических жидкостях методом ВЭЖХ-МС/МС.
Список литературы
Ruggiero RJ, Likis FE. Estrogen: Physiology, pharmacology, and formulations for replacement therapy // J. Midwifery Womens Health. 2002. V. 47. № 3. P. 130. https://doi.org/10.1016/S1526-9523(02)00233-7
Ricanyova J., Gadzala-Kopciuch R., Reiffova K., Bazel Y., Buszewski B. Molecularly imprinted adsorbents for preconcentration and isolation of progesterone and testosterone by solid phase extraction combined with HPLC // Adsorption. 2010. V. 16. P. 473. https://doi.org/10.1007/s10450-010-9265-7
Середа Е.Е., Кондакова И.В., Слонимская Е.М. Ферменты метаболизма эстрогенов и рецепторы как факторы риска развития и прогноза при раке молочной железы // Сибирский онкологический журн. 2004. № 1(9). С. 35. (Sereda E.E., Kondakova I.V., Slonimskaya E.M. Enzymes of estrogen metabolism and receptors as risk factors for the development and prognosis in breast cancer // Siberian J. Oncol. 2004. V. 1. № 9. P. 35.)
Saini Shivender Singh. A novel hybrid micro extraction for the sensitive determination of 17b-estradiol in water samples // Anal. Methods. 2020. V. 12. P. 2614. https://doi.org/10.1039/D0AY00581A
Robles J., Marcos J., Renau N., Garrostas L., Segura J., Ventura R., Barceló B., Barceló A., Pozo O.J. Quantifying endogenous androgens, estrogens, pregnenolone and progesterone metabolites in human urine by gas-chromatography tandem mass spectrometry // Talanta. 2017. V. 169. P. 20. https://doi.org/10.1016/j.talanta.2017.03.032
DeMaleki Z, Lai EPC, Dabek-Zlotorzynska E. Capillary electrophoresis characterization of molecularly imprinted polymer particles in fast binding with 17α-estradiol // J. Sep. Sci. 2010. V. 33. P. 2796. https://doi.org/10.1002/jssc.201000257
Zhao L., Lin J.M., Li Z., Ying X. Development of a highly sensitive, second antibody format chemiluminescence enzyme immunoassay for the determination of 17β-estradiol in wastewater // Anal. Chim. Acta. 2006. V. 558. P. 290. https://doi.org/10.1016/j.aca.2005.11.034
Kim Y.S., Jung H.S., Matsuura T., Lee H.Y., Kawai T., Gu M.B. Electrochemical detection of 17β-estradiol using DNA aptamer immobilized gold electrode chip // Biosens. Bioelectron. 2007. V. 22. P. 2525. https://doi.org/10.1016/j.bios.2006.10.004
Крылов В.А., Крылов А.В., Мосягин П.В., Маткивская Ю.О. Жидкофазное микроэкстракционное концентрирование примесей // Журн. аналит. химии. 2011. Т. 6. № 4. С. 341. (Krylov V.A., Krylov A.V., Mosyagin P.V., Matkivskaya Yu.O. Liquid-phase microextraction concentration of impurities // J. Anal. Chem. 2011.V. 6. № 4. P. 341.) https://doi.org/10.31857/S0044450220100059
Дмитриенко С.Г., Апяри В.В., Толмачева В.В., Горбунова М.В. Дисперсионная жидкостно-жидкостная микроэкстракция органических соединений. Обзор обзоров // Журн. аналит. химии. 2020. Т. 75. № 10. С. 867. (Dmitrienko S.G., Apyari V.V., Tolmacheva V.V., Gorbunova M.V. Dispersion liquid-liquid microextraction of organic compounds. Review of Reviews // J. Anal. Chem. 2020. V. 75. № 10. P. 867.) https://doi.org/10.31857/S0044450220100059
Olatz Zuloaga, Maitane Olivares, Patricia Navarro, Asier Vallejo, Ailette Prieto. Dispersive liquid-liquid microextraction: Trends in the analysis of biological samples // Bioanalysis. 2015. V. 7. № 17. P. 2211. https://doi.org/10.4155/bio.15.141
Mansour F.R., Khairy M.A. Pharmaceutical and biomedical applications of dispersive liquid–liquid microextraction // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2017. V. 1061–1062. P. 382. https://doi.org/10.1016/j.jchromb.2017.07.055
Andruch Vasil, Ioseph S. Balogh, Lívia Kocúrová, Jana Šandrejová. Five years of dispersive liquid–liquid microextraction // Appl. Spectrosc. Rev. 2013. V. 48. № 3. P. 161. https://doi.org/10.1080/05704928.2012.697087
Mansour F.R., Danielson N.D. Solidification of floating organic droplet in dispersive liquid-liquid microextraction as a green analytical tool // Talanta. 2017. V. 170. P. 22. https://doi.org/10.1016/j.talanta.2017.03.084
Jafarinejad M., Ezoddin M., Lamei N., Abdi K., Babhadi-Ashar N., Pirooznia N., Akhgari M. Effervescent tablet-assisted demulsified dispersive liquid–liquid microextraction based on solidification of floating organic droplet for determination of methadone in water and biological samples prior to GC-flame ionization and GC−MS // J. Sep. Sci. 2020. V. 43. № 16. P. 3266. https://doi.org/10.1002/jssc.202000078
Wang, X., Wang Y., Zou X., Cao Y. Improved dispersive liquid-liquid microextraction based on the solidification of floating organic droplet method with a binary mixed solvent applied for determination of nicotine and cotinine in urine // Anal. Methods. 2014. V. 6. № 7. P. 2384. https://doi.org/10.1039/C3AY42308E
Farahmand Farnaz, Bahar Ghasemzadeh, Abdolhossein Naseri. Air-assisted liquid–liquid microextraction using floating organic droplet solidification for simultaneous extraction and spectrophotometric determination of some drugs in biological samples through chemometrics methods // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2018. № 188. P. 72. https://doi.org/10.1016/j.saa.2017.06.069
Pelit F.O., Yengin T. Application of solidified floating organic drop microextraction method for biomonitoring of chlorpyrifos and its oxon metabolite in urine samples // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2014. V. 949. P. 109. https://doi.org/10.1016/j.jchromb.2014.01.004
Regueiro J., Llompart M., Garcia-Jares C., Garcia-Monteagudo J.C., Cela R. Ultrasound-assisted emulsification-microextraction of emergent contaminants and pesticides in environmental waters // J. Chromatogr. A. 2008. V. 1190. P. 27. https://doi.org/10.1016/j.chroma.2008.02.091
Shishov A., Chromá R., Vakh C., Kuchár J., Simon A., Andruch V., Bulatov A. In situ decomposition of deep eutectic solvent as a novel approach in liquid-liquid microextraction // Anal. Chim. Acta. 2019. V. 1065. P. 49. https://doi.org/10.1016/j.aca.2019.03.038
Perez Avila A.D., Rodriguez-Barona S., Fontalvo-Alzate J. Molecular toxicity of potential liquid membranes for lactic acid removal from fermentation broths using lactobacillus Casei ATCC 393 // DYNA. 2018. V. 85. P. 360. https://doi.org/10.15446/dyna.v85n207.72374
Maryadele J. O’Neil. The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals. Cambridge, UK: Royal Society of Chemistry, 2013. P. 6.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии