Журнал аналитической химии, 2022, T. 77, № 4, стр. 384-390
Методика поляризационного флуоресцентного иммуноанализа для определения дибутилфталата в воде
В. С. Барановская a, А. Н. Берлина b, С. А. Еремин a, b, *
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, Россия
b Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Ленинский просп., 33, Россия
* E-mail: saeremin@gmail.com
Поступила в редакцию 30.07.2021
После доработки 12.08.2021
Принята к публикации 14.08.2021
- EDN: NTGBWI
- DOI: 10.31857/S004445022204003X
Аннотация
Разработана методика поляризационного флуоресцентного иммуноанализа (ПФИА) для определения в воде пластификатора дибутилфталата (ДБФ) – токсичного техногенного загрязнителя окружающей среды. Методика основана на конкурентном взаимодействии с антителами ДБФ в пробе и меченного флуорофором ДБФ, возбуждении флуоресценции плоскополяризованным светом и регистрации поляризации флуоресценции излучаемого света. Синтезирован конъюгат аминопроизводного флуоресцеина с сукцинат-дибутилфталатом, подтверждено его связывание с поликлональными антителами. Методика ПФИА характеризуется пределом обнаружения ДБФ 0.35 мкг/мл и диапазоном определяемых концентраций от 0.5 до 7.5 мкг/мл. Продолжительность анализа – 2 мин.
В настоящее время проблема загрязнения окружающей среды пластификаторами и продуктами их трансформации стоит особенно остро. Ранее последствиям использования таких соединений не уделялось должного внимания, а токсикологические и экологические риски стали оцениваться позже, когда появились данные о нарушениях функционирования систем организма человека и обнаружении фталатов в бутилированной воде и продуктах питания [1, 2].
Эфиры фталевой кислоты широко используют в производстве полимерных материалов в качестве пластификаторов [3]. Данные соединения добавляют к материалам на основе поливинилхлорида, полиэтилентерефталата и других полимеров [4]. Введение пластифицирующих компонентов не сопровождается формированием ковалентных связей [5], а ограничивается слабыми межмолекулярными взаимодействиями [6], поэтому пластификаторы со временем экстрагируются в окружающую среду. Основные опасности попадания фталатов в живые организмы обусловлены их влиянием на эндокринную и репродуктивную системы, а также на процессы детоксикации с участием печени, почек [7, 8].
В связи с обнаруженной токсичностью допустимые уровни фталатов в воде и продуктах пита-ния нормативно регулируются. Данные о допустимых уровнях потребления фталатов суммированы, в частности, в недавнем обзоре Кортенкамп и соавт. [9]. Отметим значительное варьирование этих величин для дибутилфталата – от 6.7 до 100 мкг/кг/день [10, 11]. В России предельно допустимая концентрация данного контаминанта в воде составляет 0.2 мг/л [12]. Агентство по охране окружающей среды США (USEPA) установило предельно допустимую концентрацию для ДБФ на уровне 0.45 мг/л [13].
Существующие хроматографические методы определения фталатов (газовая хроматография, ВЭЖХ с масс-спектрометрическим детектированием) трудоемки, дорогостоящи, анализ занимает несколько часов, включая подготовку пробы чаще всего с использованием твердофазной экстракции [14–16]. По данным хроматографического контроля фталаты присутствуют в воде, почве, молоке, косметических средствах, смывах с игрушек и других объектах [15]. Вследствие высокой гидрофобности фталаты накапливаются в почве, донных отложениях, тканях обитателей водоемов [14, 16].
В качестве альтернативы хроматографическим разрабатываются иммунохимические методы анализа, позволяющие быстро и точно, в том числе и при проведении скрининга, определять аналиты [17]. Преимуществами иммунохимических методов, в частности иммуноферментного анализа, по сравнению с хроматографическими методами анализа являются возможность одновременного анализа многих проб в одинаковых условиях, разнообразие схем анализа, позволяющее выбирать варианты с необходимыми пределами обнаружения, относительная простота подготовки проб, доступность недорогого оборудования, в том числе – портативного для внелабораторного тестирования [17–19].
Среди иммунохимических методов анализа поляризационный флуороиммуноанализ (ПФИА) занимает особое место, поскольку позволяет определять аналит в гомогенной среде в течение нескольких минут [20]. Преимуществом ПФИА является возможность его проведения в одну стадию без разделения реагентов [21]. Поляризационный флуоресцентный иммуноанализ низкомолекулярных соединений основыван на использовании конъюгата производного аналита с флуоресцентной меткой [22]. Чаще всего в качестве метки применяют производные флуоресцеина, обеспечивающие интенсивный и воспроизводимый аналитический сигнал [23].
Известно большое количество эфиров фталевой кислоты, используемых в качестве пластификаторов и характеризующихся различной токсичностью по отношению к живым организмам. Среди массово производимых фталатов наиболее опасными и приоритетными для мониторинга являются диэтилфталат, дибутилфталат, диизобутилфталат и ди-(2-этилгексил)фталат [1]. В настоящее время среди всей палитры эфиров фталевой кислоты описано ПФИА-определение только диизобутилфталата и диэтилфталата [20, 24, 25].
Цель данной работы – разработка методики определения дибутилфталата методом ПФИА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реагенты. Использовали дибутилфталат (ДБФ), флуоресцеинизотиоцианат (ФИТЦ), этилендиамин гидрохлорид, тетраборат натрия, N-гидроксисукцинимид (N-ГС), N,N'-дициклогексилкарбодиимид (N,N-ДЦК) (Sigma Aldrich Corporation, США); метанол, диметилформамид (Реахим, Россия); триэтиламин (Merck, Германия); хлороформ ос.ч. (Химмед, Россия); азид натрия (Serva, США). Специфические поликлональные антитела против дибутилфталата, полученные, как описано в работе [26], были предоставлены проф. Сукинг Чжао (Гуандунский технологический университет, Гуанчжоу, Китай).
При проведении экспериментов использовали 2.5 мМ боратный буферный раствор (рН 8.5), содержащий 0.1% NaN3.
Для очистки конъюгата использовали тонкослойную хроматографию на пластинах “Silufol” (Чехия). Для измерения поляризации флуоресценции использовали прибор Sentry 200 (Ellie, США). Кинетические измерения осуществляли на флуориметре BEACON 2000 фирмы “Panvera” (США). Полученные данные обрабатывали с использованием программного пакета Origin 8.5 (Origin, USA).
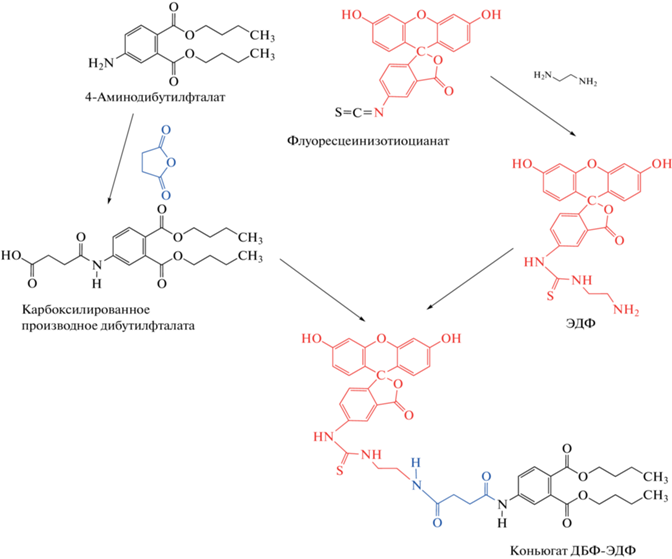
Синтез конъюгата дибутилфталата с этилендиаминфлуоресцеинтиокарбаматом (ЭДФ). Флуоресцирующую метку ЭДФ синтезировали из ФИТЦ и этилендиамина дигидрохлорида [27, 28]. Для получения конъюгата 14.9 мг сукцинат-дибутилфталата с активной группой –СООН смешивали с 10.4 мг N-ГС и 18 мг N,N-ДЦК в 1 мл диметилформамида, смесь инкубировали в течение ночи. Далее к 50 мкл раствора полученного активированного производного добавляли 10 мкл триэтиламина и 1 мг ЭДФ. Конъюгат ДБФ-ЭДФ очищали от примесей методом тонкослойной хроматографии (ТСХ), используя в качестве элюента систему метанол–хлороформ (1 : 4) (по объему). Основную желтую флуоресцирующую полосу (Rf = 0.9) собирали с хроматографической пластины и экстрагировали 1 мл метанола. Концентрацию конъюгата ДБФ-ЭДФ определяли спектрофотометрически по поглощению при 492 нм в 50 мМ карбонатном буферном растворе с рН 9.0, используя молярный коэффициент поглощения флуоресцентного соединения 8.78 × 104 (л/(моль см)), как описано в работе [28].
Определение рабочей концентрации конъюгата ДБФ-ЭДФ. В пробирках для ПФИА готовили серии разведений конъюгата ДБФ-ЭДФ в боратном буферном растворе и регистрировали их поляризацию флуоресценции. Критерием выбора рабочей (оптимальной) концентрации конъюгата ДБФ-ЭДФ являлось десятикратное превышение фонового значения (для буферного раствора) поляризации флуоресценции [27].
Тестирование флуоресцентного конъюгата на связывание с антителами. В объеме 500 мкл готовили серию разведений антител в боратном буферном растворе, начиная с 1 мг/мл. Затем во все пробирки вносили по 500 мкл раствора конъюгата ДБФ-ЭДФ с концентрацией порядка 1 нМ и измеряли поляризацию флуоресценции.
Определение оптимального времени связывания. К 500 мкл конъюгата ДБФ-ЭДФ в выбранном разведении добавляли 500 мкл раствора IgG антител против дибутилфталата в концентрации 1 мкг/мл в боратном буферном растворе. Измерения проводили через каждые 30 с и строили зависимость поляризации флуоресценции от времени взаимодействия.
Проведение конкурентного ПФИА. В стеклянные пробирки вносили по 10 мкл стандартных растворов вещества (0, 0.001, 0.01, 0.03, 0.1, 0.3, 1, 0.3, 10, 30, 100 мкг/мл) и 500 мкл раствора конъюгата ДБФ-ЭДФ выбранной концентрации. Затем добавляли 500 мкл раствора антител против ДБФ с концентрацией 1 мкг/мл, через 2 мин проводили измерение. Каждое измерение проводили в трех повторах. Получали полулогарифмическую зависимость поляризации флуоресценции от концентрации ДБФ (градуировочную кривую) и аппроксимировали ее с помощью четырехпараметрической сигмоидной функции, используя программное обеспечение Origin 8.5 (OriginLab, США).
Определение аналитических характеристик методики ПФИА. Предел обнаружения ДБФ определяли по 3s-критерию [29]. Для этого выполняли 20 измерений растворов с нулевой концентрацией ДБФ. Предел обнаружения соответствовал концентрации ДБФ, выбранной на начальном участке градуировочной кривой с поляризацией флуоресценции, равной:
где mPmin – значение степени поляризации флуоресценции для предела обнаружения; mP0 – средняя величина поляризации флуоресценции, измеренная для раствора с нулевой концентрацией ДБФ; s – стандартное отклонение для результатов 20 измерений поляризации флуоресценции раствора с нулевой концентрацией ДБФ.Рабочий диапазон определяемых содержаний ДБФ определяли как диапазон от IC20 (концентрация, при которой поляризация флуоресценции снижается на 20% от амплитуды между максимальным и минимальным ее значениями) до IC80 (концентрация, при которой поляризация флуоресценции уменьшается на 80%).
Воспроизводимость результатов ПФИА оценивали для растворов ДБФ с концентрациями, лежащими в рабочем диапазоне определяемых содержаний. Для этого определяли поляризацию флуоресценции смеси из 10 мкл стандартного раствора ДБФ, 500 мкл рабочего раствора конъюгата ДБФ-ЭДФ и 500 мкл рабочего раствора антител. В течение трех дней выполняли по три повторных измерения и вычисляли относительное стандартное отклонение результатов измерений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор метода определения. Поляризационный флуоресцентный иммуноанализ представляет собой конкурентный метод анализа, который проводят в гомогенной среде. При отсутствии в растворе контролируемого антигена все центры связывания антител заняты только молекулами меченого антигена, и поляризация флуоресценции максимальна. При добавлении к реакционной смеси контролируемого (немеченого) антигена поляризация флуоресценции уменьшается пропорционально росту концентрации добавленного антигена. Это связано с тем, что с увеличением концентрации немеченого антигена в растворе все большая часть молекул конъюгата (антигена с флуоресцентной меткой) остается в не связанном с антителами состоянии, что приводит к уменьшению поляризации флуоресценции. Соответственно регистрируемая поляризация флуоресценции при добавлении пробы отражает концентрацию антигена в пробе, регистрируемую, таким образом, без разделения реагентов. Градуировочная кривая ПФИА представляет собой зависимость поляризации флуоресценции (mP) от концентрации аналита в пробе.
Синтез дибутилфталата, модифицированного ЭДФ (ДБФ-ЭДФ). Для определения дибутилфталата синтезировали конъюгат, содержащий в качестве флуоресцентной метки этилендиаминфлуоресцеинтиокарбамат. Полученное соединение очищали от непрореагировавших компонентов методом ТСХ и собирали конъюгат, соответствующий значению Rf = 0.9. Дибутилфталат не имеет функциональных групп для активации и конъюгирования, поэтому получали его производное, содержащее аминогруппу. Добавление к этому производному янтарного ангидрида, как описано в работе [26], обеспечило включение в конъюгат группы –СООН, при этом введение остатка янтарной кислоты обеспечило пространственную удаленность флуоресцентной метки от сайта связывания антител [20]. При синтезе дибутилфталата, модифицированного ЭДФ, протекают многие побочные процессы и образуются неопознанные вещества, которые удаляются при ТСХ. Количество и выход искомого вещества не определяли, количество синтезированного дибутилфталата, модифицированного ЭДФ, был достаточным для проведения последующих исследований. Схема синтеза приведена на рис. 1.
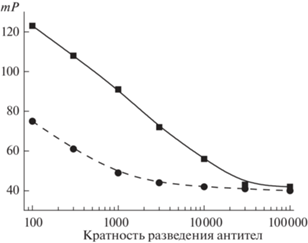
Оценка эффективности применения конъюгата ДБФ-ЭДФ. Чувствительность и точность ПФИА зависят от используемой пары иммунореагентов антитела–конъюгат. Выбранная (данные не приведены) рабочая концентрация конъюгата ДБФ-ЭДФ составила 0.7 нМ. Далее тестировали связывание конъюгата с имеющимися специфическими антителами – двумя кроличьими антисыворотками против дибутилфталата. Получение данных антисывороток и их свойства описаны в работе [30], посвященной разработке методики определения ДБФ с помощью иммуноферментного анализа. Полученные зависимости поляризации флуоресценции от концентрации антител при постоянной концентрации конъюгата ДБФ-ЭДФ (0.7 нМ) представлены на рис. 2. Как видно, максимальное соотношение сигнал–фон наблюдается при использовании антител 1 в концентрации 1 мкг/мл.
Рис. 2.
Зависимость поляризации флуоресценции от разведения поликлональных антител 1 (◼) и антител 2 (⚫) при связывании с конъюгатом ДБФ-ЭДФ (0.7 нМ).
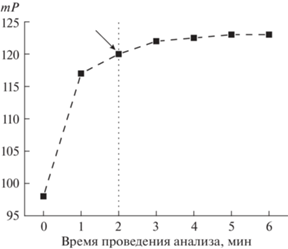
Оптимальное время взаимодействия конъюгата ДБФ-ЭДФ и антител. Исследовали зависимость поляризации флуоресценции от продолжительности взаимодействия конъюгата ДБФ-ЭДФ и антител 1 (рис. 3). Установили, что химическое равновесие в системе достигается за 4–5 мин, что подтверждает экспрессность формирования комплексов антитело–меченый антиген в растворе. Это время выбрали для проведения ПФИА.
Рис. 3.
Зависимость поляризации флуоресценции от времени связывания реагентов ДБФ-ЭДФ (концентрация 0.4 нМ) и поликлональных антител к дибутилфталату (разведение 1 : 1000, концентрация 1 мкг/мл).
Градуировочная зависимость для определения дибутилфталата методом ПФИА и аналитические характеристики предложенной методики. В выбранных условиях (конъюгат ДБФ-ЭДФ (0.7 нМ) и раствор антител 1 (1 мкг/мл)) получили зависимость поляризации флуоресценции от концентрации ДБФ (рис. 4). Для расчета аналитических параметров использовали четырехпараметрическое сигмоидное приближение, общепринятое для конкурентных схем иммуноанализа. Рабочий диапазон определяемых концентраций оценивалия в соответствии с рекомендациями [31] после линеаризации участка кривой (уравнение прямой Y = (101.31 ± 0.43) – (30.09 ± 0.82)X).
Рис. 4.
Градуировочная кривая для определения дибутилфталата и ее линейный участок (на вставке) при рабочих концентрациях конъюгата ДБФ-ЭДФ (0.7 нМ) и раствора антител 1 мкг/мл.
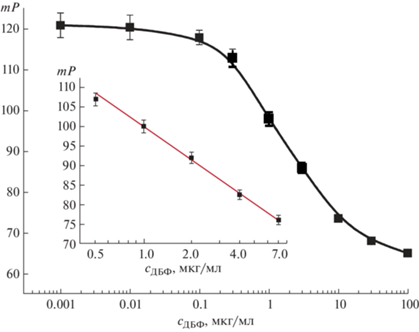
Предел обнаружения ДБФ составил 0.35 мкг/мл, а диапазон определяемых концентраций – 0.5–7.5 мкг/мл. Относительное стандартное отклонение в этом диапазоне варьировалось от 3.5 до 4.9%, а на всем протяжении градуировочной кривой – от 1.2 до 7.5%. При оценке воспроизводимости результатов ПФИА показано, что относительное стандартное отклонение варьировалось от 1.5 до 9% в течение дня и в диапазоне 0.8–9.5% в течение нескольких дней.
Предложенную методику апробировали в анализе бутилированной питьевой воды. Готовили серию растворов с добавлением в воду дибутилфталата в диапазоне концентраций 0.001–300 мкг/мл и анализировали их. При этом форма градуировочной кривой и положение точек на ней не изменилась; границы диапазона определяемых концентраций остались прежними (рис. 5), что свидетельствует об отсутствии влияния матрицы проб на результаты определения и пригодности разработанной методики ПФИА для определения дибутилфталата в питьевой воде.
Рис. 5.
Результаты определения дибутилфталата (◼) в пробах питьевой воды и влияние добавления бисфенола А (⚫).
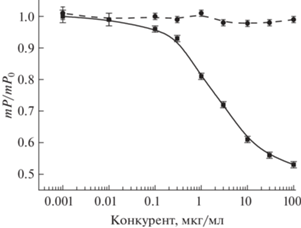
Дополнительное введение бисфенола А – важного загрязнителя водных ресурсов [32] – в пробы с ДБФ не влияет на регистрируемую поляризацию флуоресценции в концентрациях до 300 мкг/мл, что подтверждает специфичность разработанной методики.
Достигнутые значения предела обнаружения (0.35 мкг/мл) и рабочий диапазон определяемых концентраций дибутилфталата (0.5–7.5 мкг/мл) соответствуют требованиям нормативных документов (предельно допустимая концентрация ДБФ 0.45 мг/л по данным Агентства по охране окружающей среды США (USEPA)). Стоит отметить, что увеличение объема пробы с 10 мкл в предложенной методике до 50–100 мкл позволит повысить чувствительность определения аналита. Такой подход применен ранее в работе [33], где увеличение объема пробы позволило снизить предел обнаружения и добиться соответствия требованиям нормативов по содержанию контаминанта в воде.
Работа выполнена при поддержке гранта РНФ 21-14-00306.
Авторы выражают благодарность проф. Сукинг Чжао (Гуандунский технологический университет, Гуанчжоу, Китай) за предоставление 4-аминопроизводного дибутилфталата и поликлональных антител.
Список литературы
Huang S., Qi Z., Ma S., Li G., Long C., Yu Y. A critical review on human internal exposure of phthalate metabolites and the associated health risks // Environ. Pollut. 2021. V. 279. Article 116941.
Xu Z., Xiong X., Zhao Y., Xiang W., Wu C. Pollutants delivered every day: Phthalates in plastic express packaging bags and their leaching potential // J. Hazard. Mater. 2020. V. 384. Article 121282.
Salazar-Beltrán D., Hinojosa-Reyes L., Ruiz-Ruiz E., Hernández-Ramírez A., Guzmán-Mar J.L. Phthalates in beverages and plastic bottles: Sample preparation and determination // Food Anal. Methods. 2018. V. 11. № 1. P. 48.
Wang R., Ma X., Zhang X., Li X., Li D., Dang Y. C8-modified magnetic graphene oxide based solid-phase extraction coupled with dispersive liquid-liquid microextraction for detection of trace phthalate acid esters in water samples // Ecotoxicol. Environ. Safety. 2019. V. 170. P. 789.
Pang Y.-H., Yue Q., Huang Y.-Y., Yang C., Shen X.-F. Facile magnetization of covalent organic framework for solid-phase extraction of 15 phthalate esters in beverage samples // Talanta. 2020. V. 206. Article 120194.
Moazzen M., Khaneghah A.M., Shariatifar N., Ahmadloo M., Eş I., Baghani A.N., Yousefinejad S., Alimohammadi M., Azari A., Dobaradaran S. Multi-walled carbon nanotubes modified with iron oxide and silver nanoparticles (MWCNT-Fe3O4/Ag) as a novel adsorbent for determining PAEs in carbonated soft drinks using magnetic SPE-GC/MS method // Arab. J. Chem. 2019. V. 12. № 4. P. 476.
Sun R., Wang L., Jiao Y., Zhang Y., Zhang X., Wu P., Chen Z., Feng C., Li Y., Li X. Metabolic process of di-n-butyl phthalate (DBP) by Enterobacter sp. DNB-S2, isolated from Mollisol region in China // Environ. Pollut. 2019. V. 255. Article 113344.
Zhang Y., Jiao Y., Li Z., Tao Y., Yang Y. Hazards of phthalates (PAEs) exposure: A review of aquatic animal toxicology studies // Sci. Total Environ. 2021. V. 771. Article 145418.
Kortenkamp A., Koch H.M. Refined reference doses and new procedures for phthalate mixture risk assessment focused on male developmental toxicity // Int. J. Hyg. Environ. Health. 2020. V. 224. Article 113428.
EFSA. Opinion of the scientific panel on food additives, flavourings, processing aids and material in contact with food (AFC) on a request from the commission related to di-butylphthalate (DBP) for use in food contact materials question N ° EFSA-Q-2003-19 // Sci. Panel Food Add. 2005. P. 1.
National Research Council. Phthalates and cumulative risk assessment: The tasks ahead. 2009.
САНПИН 1.2.3685-21. Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания. Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. Зарегистрировано в Минюсте России 29 января 2021 г. № 62296. 2021. С. 229.
US EPA. United States Environmental Protection Agency (US). National primary drinking water regulations. Final rule. Fed. Regist. 1991 Jul 1. V. 56. № 126 Article 30266.
Fernández-González V., Moscoso-Pérez C., Muniategui-Lorenzo S., López-Mahía P., Prada-Rodríguez D. Reliable, rapid and simple method for the analysis of phthalates in sediments by ultrasonic solvent extraction followed by head space-solid phase microextraction gas chromatography mass spectrometry determination // Talanta. 2017. V. 162. P. 648.
Huysman S., Van Meulebroek L., Janssens O., Vanryckeghem F., Van Langenhove H., Demeestere K., Vanhaecke L. Targeted quantification and untargeted screening of alkylphenols, bisphenol A and phthalates in aquatic matrices using ultra-high-performance liquid chromatography coupled to hybrid Q-Orbitrap mass spectrometry // Anal. Chim. Acta. 2019. V. 1049. P. 141.
Hu H., Li T., Bao J., Zhang X., Sun X., Xu K., Liu Q., Guo Y. Determination of phthalates in marine sediments using ultrasonic extraction followed by dispersive solid-phase extraction and gas chromatography–mass spectrometry // J. Chromatogr. Sci. 2021. Article bmab080. https://doi.org/10.1093/chromsci/bmab080
Li L., Zhang M. Development of immunoassays for the determination of phthalates // Food Agr. Immunol. 2020. V. 31. № 1. P. 303.
Sun Q., Chen Y., Li F., Jia M., Shi G. A one-step incubation ELISA kit for rapid determination of dibutyl phthalate in water, beverage and liquor // Open Chem. 2019. V. 17. №. 1. P. 392.
Li M., Cui Y., Liu Z., Xue Y., Zhao R., Li Y., Du D. Sensitive and selective determination of butyl benzyl phthalate from environmental samples using an enzyme immunoassay // Sci. Total Environ. 2019. V. 687. P. 849.
Chen Y., Cui X., Wu P., Jiang Z., Jiao L., Hu Q., Eremin S.A., Zhao S. Development of a homologous fluorescence polarization immunoassay for diisobutyl phthalate in Romaine lettuce // Food Anal. Methods. 2017. V. 10. № 2. P. 449.
Hendrickson O.D., Taranova N.A., Zherdev A.V., Dzantiev B.B., Eremin S.A. Fluorescence polarization-based bioassays: New horizons // Sensors. 2020. V. 20. № 24. P. 7132.
Huang X., Tang X., Jallow A., Qi X., Zhang W., Jiang J., Li H., Zhang Q., Li P. Development of an ultrasensitive and rapid fluorescence polarization immunoassay for ochratoxin A in rice // Toxins. 2020. V. 12. № 11. P. 682.
Yang H., He Q., Eremin S.A., Pan J., Zou Y., Cui X., Zhao S. Fluorescence polarization immunoassay for rapid determination of dehydroepiandrosterone in human urine // Anal. Bioanal. Chem. 2021. V. 413. № 17. P. 4459.
Tian X., Dong Y., Wang Y., Song Z., Meng M., Eremin S.A., Deng C., Yin Y., Xi R. Quantification of diethyl phthalate by a rapid and homogenous fluorescence polarization immunoassay // Anal. Lett. 2015. V. 48. № 18. P. 2843.
Cui X., Wu P., Lai D., Zheng S., Chen Y., Eremin S.A., Peng W., Zhao S. Development of a highly specific fluorescence immunoassay for detection of diisobutyl phthalate in edible oil samples // J. Agric. Food Chem. 2015. V. 63. № 42. P. 9372.
Ius A., Bacigalupo M., Meroni G., Pistillo A., Roda A. Development of a time-resolved fluoroimmunoassay for phthalate esters in water // Fresenius J. Anal. Chem. 1993. V. 345. № 8. P. 589.
Raysyan A., Moerer R., Coesfeld B., Eremin S.A., Schneider R.J. Fluorescence polarization immunoassay for the determination of diclofenac in wastewater // Anal. Bioanal. Chem. 2021. V. 413. № 4. P. 999.
Pourfarzaneh M., White G., Landon J.,Smith D. Cortisol directly determined in serum by fluoroimmunoassay with magnetizable solid phase // Clin. Chem. 1980. V. 26. № 6. P. 730–733.
Long G.L., Winefordner J.D. Limit of detection. A closer look at the IUPAC definition // Anal. Chem. 1983. V. 55. № 7. P. 712A.
Lai D., Zheng S., Zhao S. Synthesis of artificial antigens for immunoassay of four phthalate esters // Food Sci. 2016. V. 37. № 5. P. 114.
International Union of Pure and Applied Chemistry (IUPAC), Compendium of Analytical Nomenclature (Orange Book). United Kingdom: Blackwell Science, 1998. P. 223.
Carr Kinnear E.J., Miller K.Y., Tong A.Z. Impacts of brewing time, brewing temperature and brands on the leaching of phthalates and bisphenol A in dry tea // Food Addit. Contam. A. 2021. https://doi.org/10.1080/19440049.2021.1940307.
Berlina A.N., Sharma A.K., Zherdev A.V., Gaur M.S., Dzantiev B.B. Colorimetric determination of lead using gold nanoparticles // Anal. Lett. 2015. V. 48. № 5. P. 766.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии