Журнал аналитической химии, 2022, T. 77, № 4, стр. 375-383
Пьезоэлектрический иммуносенсор на основе магнитных углеродных нанокомпозитов для определения ципрофлоксацина
Е. В. Бизина a, О. В. Фарафонова a, *, Н. И. Золотарева b, С. С. Гражулене b, Т. Н. Ермолаева a
a Липецкий государственный технический университет
398055 Липецк, ул. Московская, 30, Россия
b Институт проблем технологии микроэлектроники и особо чистых материалов Российской академии наук
142432 Черноголовка, ул. Академика Осипьяна, 6, Россия
* E-mail: farafonova.ov@mail.ru
Поступила в редакцию 23.06.2021
После доработки 02.07.2021
Принята к публикации 06.07.2021
- EDN: ZYLDIX
- DOI: 10.31857/S0044450222040041
Аннотация
Разработан пьезоэлектрический иммуносенсор с распознающим слоем на основе магнитных углеродных нанокомпозитов для определения ципрофлоксацина. Рецепторное покрытие сенсора сформировано за счет воздействия магнитного поля на магнитные частицы, расположенные на поверхности углеродных нанотрубок, модифицированных конъюгатом ципрофлоксацина. Методом сканирующей электронной микроскопии установлены размеры магнитных частиц, входящих в состав нанокомпозита. Показана зависимость массы распознающего покрытия от размера магнитных частиц на поверхности углеродных нанотрубок. Предложена ячейка детектирования с сенсором, расположенным над неодимовым магнитом. Установлены аналитические характеристики иммуносенсора, предел обнаружения ципрофлоксацина составляет 2 нг/мл, линейный диапазон определяемых содержаний – 5–400 нг/мл. Применение магнитных углеродных нанокомпозитов при создании распознающего слоя позволяет сократить время подготовки сенсора к анализу с 24 до 1.5 ч и продлить срок его службы. Сенсор апробирован для определения антибиотика в молоке и мясе.
Пьезоэлектрические иммуносенсоры положительно зарекомендовали себя в анализе пищевых продуктов, объектов окружающей среды, биологических сред. Практически без предварительной пробоподготовки удается осуществлять экспрессное определение остаточных количеств лекарственных препаратов, пестицидов, природных токсинов в различных пробах [1–3]. Аналитическим сигналом гравиметрического пьезоэлектрического сенсора служит уменьшение частоты его колебаний, вызванное увеличением массы распознающего слоя вследствие образования иммунохимического комплекса на поверхности электрода [4, 5]. Низкомолекулярные соединения, как правило, определяют в конкурентном формате иммуноанализа, основанном на предварительном введении в пробу фиксированного количества антител, образующих в растворе с аналитом гомогенный иммунокомплекс. Аналитический сигнал регистрируют при контакте пробы, содержащей несвязавшиеся антитела, с иммобилизованным на поверхности сенсора белковым конъюгатом аналита, сопровождающимся образованием гетерогенного иммунокомплекса.
Чувствительность гравиметрического пьезоэлектрического иммуносенсора определяется концентрацией и пространственной доступностью распознающих молекул на поверхности его электрода. В последнее время при разработке сенсоров применяют различные наноматериалы, в частности, одностенные и многостенные углеродные нанотрубки (УНТ), способствующие увеличению удельной поверхности распознающего слоя без существенного увеличения его массы [6–8]. Более того, сенсоры на основе УНТ могут быть функционализированы путем сопряжения нескольких компонентов, что не только потенциально усилит процессы распознавания и передачи сигнала, но и существенно сократит стадию формирования распознающего слоя [9, 10].
Обычно для получения распознающего покрытия пьезоэлектрического сенсора используют многослойные способы [11, 12], способствующие образованию устойчивых связей между металлическим электродом и слоями модификаторов, что является залогом многократного применения рецепторного слоя в анализе. Однако процесс формирования распознающего покрытия пьезоэлектрического сенсора остается продолжительным, и часто происходит его разрушение вследствие разрыва связей с поверхностью металлического электрода.
Значительная часть современных исследований по созданию биосенсоров – электрохимических [13, 14] или оптических [15, 16] – посвящена применению магнитных наночастиц (МНЧ). Описано применение в электрохимических иммуносенсорах магнитных наночастиц, скомбинированных с углеродными нанотрубками. Такие нанокомпозиты уже зарекомендовали себя в качестве эффективных сорбентов для извлечения и концентрирования аналитов [17, 18]. Применение магнитных углеродных нанокомпозитов (МУНК) открывает новые возможности в биосенсорике, позволяет существенно упростить процедуру подготовки сенсора к анализу [19]. Применение МНЧ в пьезоэлектрических иммуносенсорах пока ограничено [20, 21]. Тем не менее, комбинирование углеродных материалов с высокой площадью поверхности, механической прочностью, сверхнизкой массой, химической и термической стабильностью со свойствами магнитных наночастиц с пьезоэлектрическими сенсорами обещает существенное увеличение чувствительности определения аналитов. Кроме этого, появляется возможность создания распознающего слоя сенсора под действием магнитного поля, что может существенно сократить продолжительность его формирования и обеспечить прочную связь с поверхностью электрода сенсора. Важной стадией разработки пьезоэлектрических сенсоров является выбор способа синтеза магнитных углеродных нанокомпозитов, влияющего на размер МНЧ и, следовательно, на массу рецепторного слоя, которая может лимитировать диапазон определяемых содержаний и даже приводить к срыву аналитического сигнала.
Цель настоящего исследования – разработка пьезоэлектрического иммуносенсора на базе магнитных углеродных нанокомпозитов для экспрессного определения в продуктах питания остаточных концентраций ципрофлоксацина – противомикробного препарата, широко применяющегося в ветеринарии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. Использовали следующе иммунореагенты: ципрофлоксацин (Цип), левофлоксацин (Sigma-Aldrich, США), энорофлоксацин (AlpoVet Ltd., Кипр), тетрациклина гидрохлорид, канамицина сульфат (Алмабион, Россия), пенициллин G (Биохимик, Россия), бычий сывороточный альбумин (БСА) (ПанЭко, Россия). Поликлональные антитела к ципрофлоксацину синтезированы по описанной ранее методике [22] и получены от профессора С.А. Еремина (МГУ им. М.В. Ломоносова).
В ходе исследования применяли следующие реагенты: 30%-ный раствор H2O2, FeSO4⋅7H2O, FeCl2⋅4H2O, FeCl3⋅6H2O, (NH4)2SO4, KH2PO4 и NaH2PO4⋅12H2O (Реахим, Россия); 25%-ный раствор аммиака, NaCl и KCl (База № 1 Химреактивов, Россия). Перевод МУНК в дисперсное состояние осуществляли с использованием диметилформамида (ДМФ) (Sigma, Германия) и Тритона X-100 (Sigma-Aldrich, США). Активационная смесь включала N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлорид (ЭДАК) и N-гидроксисукцинимид (N-ГС) (Sigma-Aldrich, США). Электроды сенсора очищали с применением соляной кислоты (ρ = 1.198 г/мл) (Реахим, Россия), ацетона и этанола (Quimica, Испания). Регенерацию распознающего покрытия на поверхности резонатора осуществляли 1 мМ раствором KCNS (Реахим, Россия).
Для синтеза магнитных углеродных нанокомпозитов использовали многостенные углеродные нанотрубки, полученные в Институте проблем технологии микроэлектроники и особо чистых материалов РАН (Черноголовка) методом газофазного пиролиза этанола на поверхности никелевого катализатора при 550°С с последующей окислительной модификацией УНТ посредством кипячения в конц. HNO3 в течение 1.5 ч. Далее нанотрубки промывали водой и этанолом до рН 7 [23].
Для предотвращения агломерации МУНК использовали ультразвуковую ванну (ПСБ-Галас, Россия). Размер и форму магнитных наночастиц на поверхности углеродных нанотрубок изучали методом сканирующей электронной микроскопии (СЭМ) на электронно-ионном микроскопе Scios 2 DualBeam Thermo Scientific (Thermo Fisher Scientific, США). В ходе пробоподготовки использовалась лабораторная центрифуга (MPW-310, Польша).
Образование связей между конъюгатом ципрофлоксацина и МУНК контролировали методом ИК-спектрометрии (ИК-Фурье спектрометр Iraffinity-1 (Shimadzu, Япония)). ИК-спектры регистрировали после нанесения на подложку (пластина монокристаллического кремния КЭС-0.01, ПРОМТЕХ, Россия) 100 мкл исследуемого раствора и высушивания в потоке теплого воздуха.
В качестве сенсоров применяли пьезокварцевые резонаторы АТ-среза с собственной частотой колебаний 10 МГц с золотыми электродами диаметром 8 мм на двух сторонах, полученными методом магнетронного напыления (ЭТНА, Россия). Аналитический сигнал регистрировали на измерительной установке CPNA-330 (ЭТНА, Россия) после нанесения на распознающий слой капли анализируемого раствора, промывания от несвязавшихся компонентов и высушивания в потоке воздуха до постоянной массы.
Массу покрытия рассчитывали по уравнению Зауэрбрея [24]:
где ∆f – изменение частоты колебаний кристалла кварца, Гц; f0 – собственная частота колебаний кристалла, 10 МГц; ∆m – масса нанесенного на электрод покрытия, г; А – площадь поверхности электрода, 0.10066 см2.Устойчивость биослоя оценивали по числу циклов измерений (N), при котором аналитический отклик сенсора не претерпевал значительного изменения (менее 5%).
Синтез магнитных углеродных нанокомпозитов. В работе использовали МУНК, полученные разными способами:
Способ 1. Нанокомпозит МУНК 1 получали путем иммобилизации магнитных наносфер Fe3O4 на поверхности углеродных нанотрубок по методике, описанной ранее [25]. Для синтеза магнитных наночастиц Fe3O4 использовали свежеприготовленные растворы хлоридов железа(III) и (II) в соотношении 2 : 1, содержащие 11.7 г FeCl3⋅6H2O и 4.3 г FeCl2⋅4H2O. Смесь помещали в колбу и интенсивно перемешивали в течение 1 ч при 80°С в атмосфере аргона. Далее в колбу вносили 20 мл 25%-ного раствора аммиака до рН 10 и охлаждали. Удерживая частицы магнитом, промывали их деионизованной водой и этанолом до рН 7, высушивали в сушильном шкафу при 60°С до сухого остатка.
Магнитный углеродный композит МУНК 1 получали в результате смешения 200 мг наночастиц Fe3O4 и 100 мг УНТ с 30 мл деионизованной воды. Раствор перемешивали при комнатной температуре в течение 30 мин. Образующийся магнитный наноматериал удерживали с помощью магнита, надосадочную жидкость осторожно сливали, после чего нанокомпозит дважды промывали деионизованной водой. Смесь высушивали под ИК-лампой.
Способ Фентона. Магнитный углеродный композит по модифицированному методу Фентона [26] получали путем синтеза магнитных частиц Fe2O3 непосредственно на поверхности углеродных нанотрубок. Для приготовления раствора Фентона УНТ массой 0.15 мг вносили в 7.5 мл 0.5 М раствора FeSO4 и тщательно перемешивали в течение 10 мин до образования суспензии. Далее добавляли 37.5 мл 30%-ного раствора Н2О2, тщательно перемешивали и оставляли на 12 ч. Надосадочную жидкость осторожно сливали и упаривали смесь при 80°С досуха.
Способ 2. Синтез магнитных углеродных нанокомпозитов МУНК 2 осуществляли по методу Фентона, однако концентрацию сульфата железа уменьшали в четыре раза (${{c}_{{{\text{FeS}}{{{\text{O}}}_{{\text{4}}}}}}}$ = 0.125 М).
Перевод магнитных углеродных нанокомпозитов в дисперсное состояние осуществляли следующими способами: 1 мг МУНК вносили в 1 мл ДМФ (способы А и Б) или в 1 мл 1%-ого водного раствора Тритона X-100 (способ В) и проводили ультразвуковую обработку в течение 1 ч (способы А и В) или 2 ч (способ Б), нагревая до 90°С в течение первых 15 мин.
Синтез белкового конъюгата ципрофлоксацина. Конъюгат ципрофлоксацина с бычьим сывороточным альбумином (Цип-БСА) синтезировали карбодиимидным методом: 5 мг БСА и 2 мг ципрофлоксацина растворяли в 2.5 мл дистиллированной воды и добавляли 30 мг ЭДАК. Реакционную смесь выдерживали 4 ч при комнатной температуре, а затем 16 ч при 4°С. Очистку конъюгата осуществляли путем диализа смеси против дистиллированной воды в течение 4 сут, меняя воду каждые 24 ч.
Формирование иммуноаффинного слоя. Предварительно активировали карбоксильные группы на поверхности МУНК смесью, полученной растворением 2.5 мг ЭДАК и 5 мг N-ГС в 200 мкл 1%-ного водного раствора Тритона X-100.
Для иммобилизации белковых молекул Цип-БСА на поверхности МУНК к 10 мкл дисперсии МУНК в 1%-ном водном растворе Тритона X-100 добавляли 10 мкл активационной смеси и оставляли на 20 мин при комнатной температуре. Далее в систему вводили 10 мкл раствора конъюгата Цип-БСА фиксированной концентрации и оставляли на 10–12 ч при 4°С для получения устойчивого нанокомпозита МУНК/Цип-БСА.
Перед формированием слоя МУНК/Цип-БСА поверхность электрода сенсора последовательно очищали 1 М HCl, ацетоном и этанолом. Сенсор помещался в ячейку детектирования над неодимовым магнитом (рис. 1), наносили 2 мкл раствора МУНК/Цип-БСА, оставляли на 90 мин на воздухе при комнатной температуре, после чего промывали сенсор 200 мкл дистиллированной воды для удаления несвязавшихся компонентов и высушивали в потоке теплого воздуха.
Рис. 1.
Ячейка детектирования пьезоэлектрического сенсора на основе магнитных углеродных нанокомпозитов.

Селективность сенсора оценивали по коэффициентам перекрестного реагирования (ПР, %):
(2)
${\text{ПР}}\left( \% \right) = ({{\Delta {{f}_{{{\text{Меш}}}}}} \mathord{\left/ {\vphantom {{\Delta {{f}_{{{\text{Меш}}}}}} {\Delta {{f}_{{{\text{Цип}}}}}}}} \right. \kern-0em} {\Delta {{f}_{{{\text{Цип}}}}}}}) \times 100,$Пробоподготовка. К 10 мл молока, предварительно разбавленного в три раза дистиллированной водой, добавляли 5 мл этанола и 2 мл насыщенного раствора сульфата аммония и подвергали центрифугированию в течение 3 мин (скорость 7000 об/мин). Экстракт использовали для анализа.
К 1 г измельченной мышечной ткани (свинина) добавляли 20 мл фосфатного буферного раствора (рН 7.2), тщательно перемешивали, встряхивали в течение 1 ч и центрифугировали в течение 10 мин на скорости 6000 об./мин. Экстракт использовали для анализа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
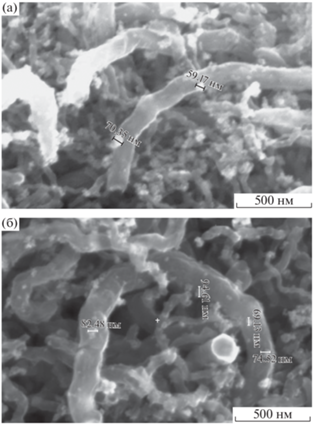
Формирование распознающего слоя пьезоэлектрического иммуносенсора на основе магнитных углеродных нанокомпозитов. На массу и устойчивость распознающего слоя пьезоэлектрического гравиметрического сенсора на основе МУНК существенное влияние оказывает размер магнитных частиц на поверхности углеродных нанотрубок. Использование нанокомпозита с МНЧ слишком большого размера приводит к чрезмерному утяжелению рецепторного покрытия, что сопровождается срывом аналитического сигнала сенсора. В то же время отмечено [27], что частицы размером в несколько десятков нанометров проявляют хорошие магнитные свойства, что обеспечивает высокую устойчивость рецепторного слоя, формируемого под действием магнитного поля. В данной работе размер магнитных наночастиц на поверхности углеродных нанотрубок устанавливали методом сканирующей электронной микроскопии, а методом пьезокварцевого микровзвешивания контролировали массу слоя МУНК, полученных различными способами.
Установлено, что в составе МУНК 1 (способ 1) присутствуют магнитные частицы сферической формы диаметром 64 ± 5 нм, равномерно распределенные на поверхности углеродных нанотрубок (рис. 2а). Применение метода Фентона, описанного в работе [26], приводило к формированию на поверхности УНТ близко расположенных магнитных частиц кубической формы с широким распределением по размерам (298 ± 117 нм), что объясняется применением при синтезе сильного окислителя H2O2, а также избыточной ко-нцентрацией ионов OH– относительно ионов Fe2+ [28]. Уменьшение концентрации ионов железа в четыре раза (способ 2) способствовало получению наночастиц диаметром 80 ± 18 нм с формой, близкой к сферической (рис. 2б).
Методом пьезокварцевого микровзвешивания оценивали влияние размера наночастиц и способа перевода нанокомпозита в дисперсное состояние на массу слоя на поверхности сенсора (табл. 1). Во всех случаях масса слоя на основе МУНК 2 ниже, несмотря на больший диаметр МНЧ, что, вероятно, связано с менее плотным расположением магнитных частиц на поверхности углеродных нанотрубок, приводящим к уменьшению количества закрепляемого на сенсоре наноматериала.
Таблица 1.
Зависимость массы слоя на основе магнитных углеродных наноматериалов от размера магнитных наночастиц и способа перевода магнитных углеродных нанокомпозитов в дисперсное состояние
| Способ перевода в дисперсное состояние | МУНК 1 | МУНК 2 | ||
|---|---|---|---|---|
| ∆m, мкг | sr | ∆m, мкг | sr | |
| А | 6.8 ± 2.6 | 0.24 | 5.6 ± 2.6 | 0.29 |
| Б | 4.2 ± 1.1 | 0.17 | 2.7 ± 1.6 | 0.36 |
| В | 1.9 ± 0.1 | 0.01 | 0.7 ± 0.1 | 0.05 |
На массу слоя МУНК существенное влияние оказывает также способ перевода нанокомпозита в дисперсное состояние. Так, применение способов А и Б приводит к получению более тяжелого покрытия сенсора, что объясняется недостаточной смачиваемостью МУНК диметилформамидом, сопровождающейся агрегацией частиц и образованием неоднородного слоя. Суспензии на основе Тритона X-100 демонстрируют более высокую стабильность, что связано с наличием в структуре последнего гидрофобных (4-трет-октилфенол) групп, за счет которых поверхностно-активные вещества адсорбируются на поверхности УНТ, и гидрофильных фрагментов (из остатков оксида этилена), обеспечивающих хорошую смачиваемость наноматериала водой.
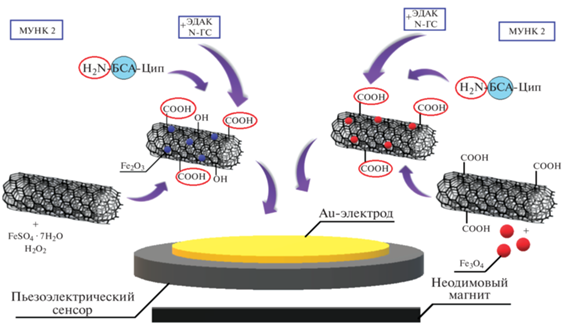
Для определения ципрофлоксацина в конкурентном формате иммуноанализа на поверхности магнитных углеродных нанотрубок после предварительной активации карбоксильных групп раствором ЭДАК и N-ГС проводили иммобилизацию Цип-БСА и формировали распознающий слой сенсора под действием магнитного поля ниодимового магнита. Общий процесс формирования распознающего покрытия на основе магнитных углеродных нанокомпозитов можно представить в виде схемы, приведенной на рис. 3.
Рис. 3.
Формирование распознающего покрытия сенсора на основе магнитных углеродных нанокомпозитов МУНК 1 и МУНК 2.
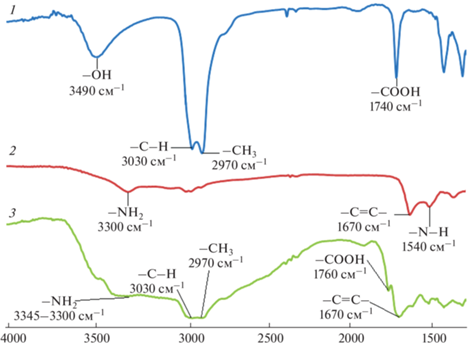
Методом ИК-спектроскопии изучали структуру распознающего слоя пьезоэлектрического иммуносенсора на основе магнитных углеродных нанокомпозитов. Для выявления связей, образующихся между отдельными компонентами и установления функциональных групп, отвечающих за данное взаимодействие, сравнивали ИК-спектры МУНК, Цип-БСА, и МУНК/Цип-БСА (рис. 4). Уширение и сдвиг пика карбоксильных групп в спектре МУНК/Цип-БСА относительно спектра МУНК с 1740 до 1760 см–1 свидетельствует об их участии в образовании связей. Смещение положения и расширение пика аминогрупп в спектре МУНК/Цип-БСА (3345–3300 см–1) по отношению к спектру Цип-БСА (3300 см–1) подтверждает участие NH2-группы в формировании связей между Цип-БСА и карбоксильными группами МУНК. Кроме того, об участии Тритона X-100 в образовании устойчивой суспензии свидетельствует уменьшение интенсивности пиков –С–Н (3030 см–1) и –СН3 (2970 см–1) в спектре МУНК/Цип-БСА по сравнению со спектром МУНК, что объясняется способностью Тритона X-100 образовывать с молекулами белков комплексы с сохранением их активности и строения.
Рис. 4.
Изучение образования связи при формировании распознающего слоя методом ИК-спектрометрии: 1 – МУНК, 2 – Цип-БСА, 3 – МУНК/Цип-БСА.
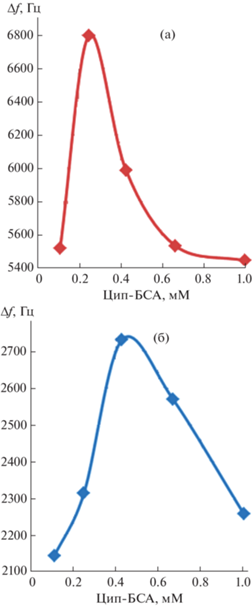
Разработка методики определения ципрофлоксацина с помощью пьезоэлектрического иммуносенсора. На аналитические характеристики пьезоэлектрического сенсора существенно влияет концентрация конъюгата Цип-БСА, определяющая количество активных сайтов связывания на поверхности пьезоэлектрического сенсора. Выбор рабочей концентрации конъюгата ципрофлоксацина осуществляли по максимуму на графике зависимости аналитического сигнала сенсора от концентрации Цип-БСА (рис. 5). Для МУНК 1 она составила 0.25 мМ, для МУНК 2 – 0.43 мМ, что объясняется различным количеством магнитного углеродного нанокомпозита, закрепленного на поверхности сенсора под действием магнитного поля (коррелирует с данными табл. 1) и, следовательно, с концентрацией биомолекул, связанных с ним.
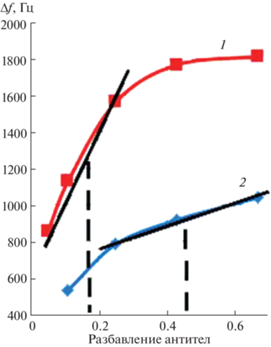
Концентрацию антител, соответствующую 50%-ному связыванию с активными центрами покрытия, определяли на линейном участке зависимости аналитического сигнала от разбавления антител (рис. 6). Разбавление антител для магнитного композита МУНК 1 составило 14/86, для МУНК 2 – 20/80.
Рис. 6.
Выбор разбавления первичной сыворотки антител, соответствующего 50%-ному связыванию: 1 – МУНК 1/Цип-БСА, 2 – МУНК 2/Цип-БСА.
Установлены характеристики пьезоэлектрического сенсора с распознающим слоем на базе различных видов МУНК (табл. 2). Наибольшим диапазоном определяемых содержаний характеризуется сенсор с покрытием на основе МУНК 1. Более узкий диапазон определяемых содержаний ципрофлоксацина при применении МУНК 2 объясняется меньшим количеством наноматериала, закрепленного на поверхности сенсора. Кроме того, распознающий слой на основе МУНК 1 более устойчив, его можно использовать в 33 циклах измерений.
Таблица 2.
Сравнение характеристик пьезоэлектрических иммуносенсоров с распознающим покрытием на основе магнитных углеродных нанокомпозитов
| Особенности формирования подложки | сmin, нг/мл | Диапазон определяемых содержаний, нг/мл | Уравнение градуировочного графика | R2 | N |
|---|---|---|---|---|---|
| МУНК 1 | 2 | 5–400 | ∆f = (2234 ± 316) – (3.5 ± 1.5)c | 0.97 | 33 |
| МУНК 2 | 8 | 15–240 | ∆f = (1898 ± 294) – (6.4 ± 1.9)c | 0.96 | 30 |
Коэффициенты перекрестного реагирования для пьезоэлектрического сенсора с распознающим слоем на основе МУНК (табл. 3) свидетельствуют о высокой селективности по отношению к Цип. Присутствующие в пробе фторхинолоны энрофлоксацин и левофлоксацин родственного строения могут мешать определению ципрофлоксацина при двукратном (энрофлоксацин) или десятикратном (левофлоксацин) избытке. Другие антибиотики практически не мешают определению Цип даже при 20-кратном избытке.
Таблица 3.
Оценка селективности определения ципрофлоксацина с помощью коэффициента перекрестного реагирования (ПР, %; концентрация аналитов 200 нг/мл)
| Антибиотик | ПР, % |
|---|---|
| Ципрофлоксацин | 100.0 |
| Энорофлоксацин | 57.0 |
| Левофлоксацин | 12.4 |
| Пенициллин G | 1.6 |
| Канамицина сульфат | 2.5 |
| Тетрациклина гидрохлорид | 4.5 |
Сенсор апробирован при определении ципрофлоксацина в молоке и мясе (табл. 4). Установлено, что во всех пробах содержание ципрофлоксацина не превышает значение максимально допустимого уровня препарата (0.1 мг/кг) [29 ] . Значения sr свидетельствуют о высокой воспроизводимости результатов измерений.
* * *
Таким образом, с помощью пьезоэлектрического иммуносенсора с распознающим слоем на основе магнитных углеродных нанокомпозитов можно осуществлять чувствительное и селективное определение ципрофлоксацина в пищевой продукции. При этом существенно упрощается процедура создания распознающего слоя за счет применения внешнего магнитного поля, что в свою очередь позволяет сократить время подготовки сенсора к анализу по сравнению с традиционно используемыми многослойными способами (с 24 до 1.5 ч) [30]. Это также способствует увеличению срока службы сенсора (до 33 циклов измерений после регенерации слоя) и резонатора - полное удаление распознающего слоя производится извлечением сенсора из ячейки детектирования и не требует применения кислот и органических растворителей, разрушающих поверхность золотого электрода.
Исследование выполнено при финансовой поддержке РФФИ и Липецкой области в рамках научного проекта № 20-43-480001. В ИПТМ РАН работа выполнена в рамках Госзадания 075-00355-21-0.
Список литературы
Skládal P. Piezoelectric biosensors // Trends Anal. Chem. 2016. V. 79. № 5. P. 127.
Ермолаева Т.Н., Калмыкова Е.Н., Шашканова О.Ю. Пьезокварцевые биосенсоры для анализа объектов окружающей среды, пищевых продуктов и клинической диагностики // Рос. хим. журн. 2008. Т. 52. № 2. С. 17. (Ermolaeva T.N., Kalmykova E.N., Shashkanova O.Y. Piezoquartz biosensors for the analysis of environmental objects, foodstuff and for clinical diagnostic // Russ. J. Gen. Chem. 2008. V. 78. № 12. P. 2430.)
Chauhan R., Singh J., Solanki P.R., Basu T., O’Kennedyd R., Malhotrae B.D. Electrochemical piezoelectric reusable immunosensor for aflatoxin B1 detection // Biochem. Eng. J. 2015. V. 103. № 15. P. 103.
Vaughan R.D., Guilbault G.G. Piezoelectric sensor. Piezoelectric immunosensor // Springer Ser. Chem. Sens. Biosens. 2007. V. 5. P. 237.
Ермолаева Т.Н., Калмыкова Е.Н. Пьезокварцевые сенсоры: аналитические возможности и перспективы // Успехи химии. 2006. Т. 75. № 5. С. 445. (Ermolaeva T.N., Kalmykova E.N. Piezoelectric immunosensors: analytical potentials and outlooks // Russ. Chem. Rev. 2006. V. 75. № 5. P. 397.)
Yanga N., Chena X., Renb T., Zhanga P., Yang D. Carbon nanotube based biosensors // Sens. Actuators B. 2015. V. 207. P. 690.
Jithesh V.V., Kaiming Y. Development of immunosensors using carbon nanotubes // Biotechnol. Progr. 2007. V. 23. P. 517.
Fama D.W.H., Palaniappana Al., Toka A.I.Y., Liedberga B., Moochhalaa S.M. A review on technological aspects influencing commercialization of carbon nanotube sensors // Sens. Actuators B. 2011. V. 157. P. 1.
Wang J., Lin Y. Functionalized carbon nanotubes and nanofibers for biosensing applications // Trends Anal. Chem. 2008. V. 27. № 7. P. 619.
Le J., Ju H. Nanotubes in biosensing // Adv. Rev. 2010. V. 2. P. 496.
Hampitak P., Jowitt T.A., Melendrez D., Fresquet M., Hamilton P., Iliut M., Nie K., Spencer B., Lennon R., Vijayaraghavan A. A Point-of-care immunosensor based on a quartz crystal microbalance with graphene biointerface for antibody assay // ACS Sens. 2020. V. 5. № 11. P. 3520.
Sassolas A., Prieto-Simon B., Marty J.-L. Biosensors for pesticide detection: New trends // Am. J. Anal. Chem. 2012. V. 3. P. 210.
Медянцева Э.П., Брусницын Д.В., Варламова Р.М., Максимов А.А., Коновалова О.А., Будников Г.К. Модификация поверхности электродов углеродными нанотрубками и наночастицами металлов золота и серебра в моноаминоксидазных биосенсорах для определения некоторых антидепрессантов // Журн. аналит. химии. 2017. Т. 72. № 4. С. 305. (Medyantseva E.P., Brusnitsyn D.V., Varlamova R.M., Maksimov A.A., Konovalova O.A., Budnikov H.C. Surface modification of electrodes by carbon nanotubes and gold and silver nanoparticles in monoaminoxidase biosensors for the determination of some antidepressants // J. Anal. Chem. 2017. V. 72. № 4. P. 362.)
Zhoua J., Gana N., Li T., Zhoua H., Li X., Caoa Y., Wang L., Sangc W., Hu F. Ultratrace detection of C-reactive protein by a piezoelectric immunosensor based on Fe3O4@SiO2 magnetic capture nanoprobes and HRP-antibody co-immobilized nano gold as signal tags // Sens. Actuators B. 2013. V. 178. P. 494.
Li Z., Cai P., Fenga Y., Chenga J., Xianga H., Liub J., Wua D., Zhou X. Synthesis and photophysical properties of water-soluble sulfonato-Salen-type Schiff bases and their applications of fluorescence sensors for Cu2+ in water and living cells // Anal. Chim. Acta. 2012. V. 735. P. 96.
J., Xu Q., Wei X., Hao Z. Electrogenerated chemiluminescence immunosensor for bacillus thuringiensis Cry1Ac Based on Fe3O4@Au Nanoparticles // J. Agric. Food Chem. 2013. V. 61. P. 1435.
Gao L., Chen L. Preparation of magnetic carbon nanotubes for separation of pyrethroids from tea samples // Microchim. Acta. 2013. V. 180. P. 423.
Zarei H., Ghourchian H., Eskandari K., Zeinali M. Magnetic nanocomposite of anti-human IgG/COOH–multiwalled carbon nanotubes/Fe3O4 as a platform for electrochemical immunoassay // Anal. Biochem. 2012. V. 421. P. 446.
Sánchez-Tirado E. González-Cortés A., Yáñez-Sedeño P., Pingarrón J.M. Magnetic multiwalled carbon nanotubes as nanocarrier tags for sensitive determination of fetuin in saliva // Biosens. Bioelectron. 2018. V. 113. P. 88.
Zhang Y., Wang H., Yan B., Zhang Y., Li J., Shen G., Yu R. A reusable piezoelectric immunosensor using antibody-adsorbed magnetic nanocomposite // J. Immunol. Methods. 2008. V. 332. P. 103.
Zhou J., Gan N., Li T., Zhou H., Li X., Cao Y., Wang L., Sang W., Hu F. Ultratrace detection of C-reactive protein by a piezoelectric immunosensor based on Fe3O4@SiO2 magnetic capture nanoprobes and HRP-antibody co-immobilized nano gold as signal tags // Sens. Actuators B. 2013. V. 178. P. 494.
Шанин И.А., Нгуен Ти Диу Тхай, Еремин С.А. Разработка непрямого твердофазного иммуноферментного анализа для детектирования левовращающего стереоизомера офлоксацина (левофлоксацина) в молоке // Вестн. Моск. ун-та. 2014. Т. 55. № 3. С. 180.
Гражулене С.С., Золотарева Н.И., Редькин А.Н., Шилкина Н.Н., Митина А.А., Ходос И.И. Сорбционные свойства магнитного композита на основе модифицированных углеродных нанотрубок в зависимости от условий синтеза // Журн. прикл. химии. 2020. Т. 93. № 1. С. 66. (Grazhulenea S.S., Zolotareva N.I., Red’kin A.N., Shilkina N.N., Mitina A.A., Khodos I.I. sorption properties of a magnetic composite based on modifi ed carbon nanotubes: Influence of the synthesis conditions. Russ. J. Appl. Chem. 2020. V. 93. № 1. P. 57.)
Sauerbrey G. Verwendung von Schwingquarzen zur Wigung dünner Schichten und zur Mikrowigung // Zeitschrift fiir Physik. 1959. V. 55. P. 206.
Гражулене С.С., Золотарева Н.И., Редькин А.Н., Шилкина Н.Н., Митина А.А., Колесникова А.М. Магнитный сорбент на основе магнетита и модифицированных углеродных нанотрубок для извлечения некоторых токсичных элементов // Журн. прикл. химии. 2018. Т. 91. № 11. С. 1642. (Grazhulene S.S., Zolotareva N.I., Red’kin A.N., Shilkina N.N., Mitina A.A., Kolesnikova A.M. Magnetic sorbent based on magnetite and modifi ed carbon nanotubes for extraction of some toxic elements // Russ. J. Appl. Chem. 2018. V. 91. № 11. P. 1849.)
Yu F., Chen J., Chen L., Huai J., Gong W., Yuan Z., Wang J., Ma J. Magnetic carbon nanotubes synthesis by Fenton’s reagent method and their potential application for removal of azo dye from aqueous solution // J. Coll. Interface Sci. 2012. V. 378. P. 175.
Netto C.G.C.M., Toma H.E, Andrade L.H. Superparamagnetic nanoparticles as versatile carriers and supporting materials for enzymes // J. Mol. Catal. B: Enzym. 2013. V. 85. P. 71.
Verges A., Costo R., Roca G., Marco J., Goya G., Serna C., Morales M. Uniform and water stable magnetite nanoparticles with diameters around the monodomain–multidomain limit // J. Phys. D: Appl. Phys. 2008. V. 41. P. 1.
Решение Коллегии Евразийской экономической комиссии от 13 февраля 2018 г. № 28 “О максимально допустимых уровнях остатков ветеринарных лекарственных средств (фармакологически активных веществ), которые могут содержаться в непереработанной пищевой продукции животного происхождения, в том числе в сырье, и методиках их определения”. https://docs.cntd.ru/document/556522984 (20.06.2021 г.)
Шукшина Е.И., Фарафонова О.В., Шанин И.А., Гражулене С.С., Еремин С.А., Ермолаева Т.Н. Аффинные взаимодействия на поверхности пьезоэлектрического сенсора, модифицированного углеродными нанотрубками, при определении фторхинолонов // Сорбционные и хроматографические процессы. 2018. Т. 18. № 3. С. 394.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии