Журнал аналитической химии, 2022, T. 77, № 4, стр. 321-342
Сухие образцы биологических жидкостей на пористых мембранах – перспективый метод пробоподготовки для биомедицинской и ветеринарной диагностики
Ж. В. Самсонова a, *, Н. Ю. Саушкин a, А. П. Осипов a
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: jvsamsonova@gmail.com
Поступила в редакцию 24.07.2021
После доработки 11.10.2021
Принята к публикации 11.10.2021
- EDN: JITPAJ
- DOI: 10.31857/S0044450222040119
Аннотация
Метод пробоподготовки жидких биообразцов в высушенном на носителе виде (технология сухих пятен крови) в последние 20 лет находит все более широкое применение в разных областях биоанализа, фармакокинетике, терапевтическом мониторинге лекарственных средств, токсикокинетике, метаболомике и диагностике заболеваний. Технология сухих пятен крови включает в себя нанесение образца непосредственно на носитель; после высушивания образец анализируют с помощью современных аналитических, иммунохимических и генетических методов. К преимуществам такого метода пробоподготовки относятся минимальная инвазивность, небольшой объем образца, легкость и экономичность отбора, транспортировки и хранения проб, высокая стабильность аналитов. В обзоре рассмотрены основные аспекты применения метода пробоподготовки биологических жидкостей, суспензий, тканей и органов в виде сухих пятен на пористых мембранных носителях в аналитической практике. Описаны принципы использования мембранных носителей для получения биологических образцов в виде сухих пятен, подходы к их аналитическому применению, мешающие факторы и ограничения, связанные с реологическими свойствами крови, виды устройств для отбора крови и других проб, текущее состояние и перспективы развития технологии сухих пятен.
Метод пробоподготовки образцов крови в виде высушенных на носителе пятен – технология сухих пятен крови (СПК) (от англ. dried blood spots, DBS) – получил свое распространение с 60‑х гг. прошлого столетия, когда полученные на фильтровальной бумаге сухие пятна крови новорожденных были успешно использованы для обнаружения наследственного заболевания фенилкетонурии путем определения маркера фенилаланина [1]. Используя данный подход, доктор Роберт Гатри на ранней стадии обнаружил 39 случаев заболевания среди 400 тысяч новорожденных, что в конечном итоге послужило толчком к развитию неонатального скрининга и внедрению технологии СПК в медицину. На сегодняшний день пробоподготовка проб биологических жидкостей в виде сухих пятен является важнейшим средством для проведения неонатального скрининга и выявления редких генетических заболеваний новорожденных, также она получает широкое распространение в различных биоаналитических исследованиях, прежде всего, в доклинических испытаниях лекарств, медицинских, токсикокинетических и фармакокинетических исследованиях, в клинической фармакологии; высушенные на носителе пробы также используются в судебной, допинговой, экологической экспертизах, создании биобанков [2–11]. В сухих пятнах биологических жидкостей определяют как низкомолекулярные вещества, так и белковые молекулы, например антитела, а также ДНК/РНК. Использование технологии СПК позволяет снизить инвазивность процесса отбора крови, т.е. травмируемость пациента, уменьшить смертность подопытных животных в доклинических исследованиях, поскольку для получения одного сухого образца в виде пятна требуется всего одна капля крови (30–50 мкл). Сухие образцы обладают высокой стабильностью и не требуют соблюдения норм холодовой цепи при перевозке к месту их анализа. Именно поэтому данный подход хорошо зарекомендовал себя при использовании в дистанционной диагностике заболеваний человека, мониторинге эпидемиологических ситуаций, например, при выявлении вируса иммунодефицита человека (ВИЧ) в странах Африки, где жаркий климат и недостаточное лабораторное обеспечение затрудняют работу с жидкими образцами [12–14]. Такой подход позволяет упростить хранение и транспортировку биобразцов, так как сухие образцы могут храниться и/или пересылаться к месту лабораторного анализа при температуре окружающей среды, в том числе при повышенных температурах, в течение нескольких дней, сохраняя при этом стабильность сорбированных на мембранный носитель компонентов. При работе с сухими образцами снижается риск биологического заражения, помимо этого сухие образцы после проведения анализа проще утилизировать, чем жидкие. Сухие пятна крови могут быть легко получены пациентом самостоятельно, так как не требуют специальных навыков работы с комплектом для отбора, а высушенные образцы могут быть направлены в лабораторию, к примеру, по почте, исключая лишние расходы на транспортировку. Биоаналитические методы, основанные на технологии СПК, за счет своих преимуществ уже стали серьезной альтернативой традиционному анализу жидкой венозной крови или сыворотки. Использование биообразцов в виде сухих пятен на сегодняшний день с успехом распространяется не только на цельную кровь, но также и на другие биологические жидкости, такие как слюна, плазма, синовиальная жидкость, моча, молоко и др. [15]. Для таких сухих пятен применяют общее название – матричные пятна (от англ. matrix spots). Целевые аналиты определяют в сухих пятнах с помощью различных аналитических методов, таких как газовая (ГХ) или жидкостная хроматография (ЖХ) в сочетании с масс-спектрометрией (МС), иммунохимические методы, например иммуноферментный анализ (ИФА) и методы, основанные на принципе агглютинации, полимеразная цепная реакция (ПЦР) и др. [16–20].
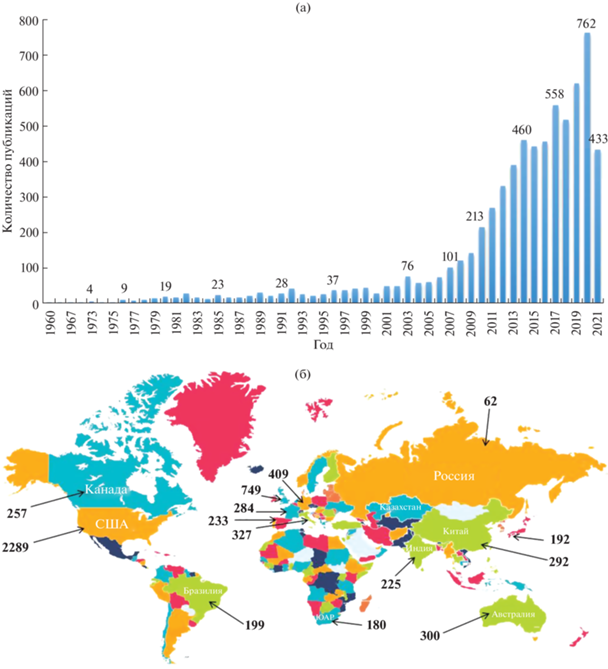
Интерес к тематике СПК, бурно развивавшейся в последние 10–15 лет, не ослабевает до сих пор. Согласно данным Scopus, c 2014 года ежегодно публикуется более 400 научных статей по этой тематике, причем порядка 10% из них составляют обзорные статьи (рис. 1а). В России, по данным Scopus, число научных публикаций по тематике СПК значительно меньше по сравнению со многими другими странами (рис. 1б). Пока в отечественной науке данной тематике уделяется недостаточное внимание, а использование технологии СПК на практике ограничено.
Рис. 1.
Распределение публикаций по тематике СПК (DBS) по данным Scopus по годам (а); количество публикаций с 2000 по 2021 гг. в разных странах (б).
ПРИНЦИП МЕТОДА ПРОБОПОДГОТОВКИ БИООБРАЗЦОВ В ВИДЕ СУХИХ ПЯТЕН НА ПОРИСТЫХ МЕМБРАНАХ
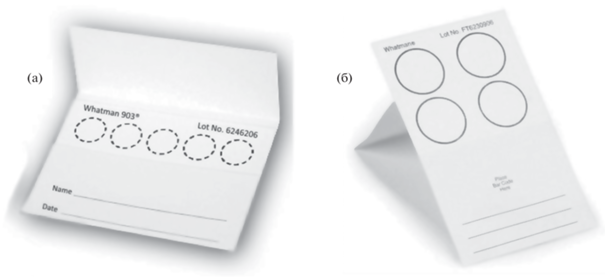
Пробоподготовка образцов в виде сухих пятен основана на капельном нанесении биологической жидкости, суспензии, либо получении отпечатка органа или ткани на специальной впитывающей мембране и последующем высушивании пробы. Пористый мембранный материал, состоящий из переплетенных волокон, впитывает наносимую пробу за счет капиллярных сил согласно его сорбционной емкости. В классическом варианте карточка для отбора пробы цельной крови представляет собой конверт, внутри которого находится целлюлозная мембрана в виде прямоугольника с обозначенными круглыми зонами для нанесения образца (рис. 2). Мембранный материал может содержать предварительно нанесенные реагенты для повышения сохранности белков либо нуклеиновых кислот, например лизирующие, хелатирующие вещества и детергенты [21, 22].
Рис. 2.
Классический вариант карточки для отбора и получения сухих пятен крови Whatman 903 (а), FTA карта (Whatman, США) для получения сухих образцов для проведения ПЦР (б).
При отборе крови ее по каплям наносят в центр окружности, соблюдая правило: одна капля – одна окружность. У взрослых пациентов, как правило, кровь отбирают из пальца, у новорожденных – из пятки, у животных – из уха, хвоста. После нанесения биопробы карточку с образцом высушивают при комнатной температуре, после чего сухая проба готова к отправке в лабораторию. Помимо капельного нанесения возможно нанесение необходимого объема биологической жидкости полуавтоматическим дозатором, а также получение отпечатка исследуемого органа (например, селезенки) или ткани путем их соприкосновения с впитывающим мембранным материалом. Таким образом, такие карточки для получения сухих пятен являются универсальным средством для хранения и транспортировки разнообразных биообразцов.
Для проведения анализа в лаборатории из сухого пятна вырезают участок мембраны в виде диска диаметром в несколько миллиметров, например, с помощью специального ручного приспособления – медицинского дырокола или панчера (от англ. puncher). Затем проводят элюирование сухого образца в раствор для выполнения соответствующего анализа. Развитие современных аналитических систем направлено на автоматизацию процессов пробоподготовки, экстракции и анализа проб. Существуют автоматизированные станции, которые способны работать одновременно с десятками подобных карточек с СПК, проводить их идентификацию, сортировку, отделение участков с образцом, последующую экстракцию и добавление внутреннего стандарта (ВС) [23]. Такие автосамплеры в сочетании с аналитическими установками на базе ЖХ-МС позволяют быстро количественно определять диагностически значимые вещества в крови [24–26].
АНАЛИТИЧЕСКИЕ АСПЕКТЫ ТЕХНОЛОГИИ СУХИХ ПЯТЕН КРОВИ
Понимание того, как целевой аналит распределяется между плазмой и эритроцитами, имеет большое значение для разработки лекарств и проведения клинических исследований. Для технологии СПК важно знать, как будут соотноситься концентрации определяемого вещества в сухом пятне с реальной концентрацией в плазме/сыворотке крови, поскольку на носитель наносится цельная кровь, имеющая в своем составе и плазму, и форменные элементы крови, которые в процессе высушивания пробы на мембране лизируются. Исторически сложилось, что в аналитических целях в медицине и ветеринарии используют плазму либо сыворотку крови, отделенную от клеток. Эритроциты играют важную роль в распределении аналита и могут влиять на полученные в фармакокинетике и фармакодинамике данные [27]. Если аналит в крови присутствует не только в плазме, но и в эритроцитах, то в сухом пятне его определяемая концентрация будет выше, чем в плазме. Такое распределение определяемого вещества зависит от его физико-химических свойств и должно подтверждаться в корреляционных параллельных измерениях сухих образцов крови и жидких образцов плазмы/сыворотки с введением поправочного коэффициента, если это необходимо.
Экстракция сухих пятен с носителя. Экстракция сорбированного на мембранный материал образца – один из важнейших подготовительных этапов перед проведением количественного анализа. Эффективность экстракции напрямую влияет на степень извлечения вещества и в конечном итоге на чувствительность методов к целевому аналиту. Более того, стадия экстрагирования критична при добавлении ВС, а также при экстрагировании СПК с использованием органических растворителей и смесей для анализа инструментальными методами [28, 29].
В целом способы экстракции биообразцов в виде сухих пятен подразделяют на две группы: офлайн и онлайн. При офлайн экстракции все необходимые этапы восстановления сухого образца посредством перевода сорбированных на носителе компонентов в растворитель проводят вручную. Это – отделение необходимого участка мембраны с сухим пятном, добавление экстрагирующего раствора с включенным ВС, центрифугирование и ввод полученного экстракта в хроматографическую систему. Иногда требуется также выпаривание, перерастворение в более подходящем для конкретной системы растворителе и т.д. Офлайн экстракция – эффективная процедура, однако является трудо- и времязатратной, ограничивая широкое применение технологии СПК в неинструментальных методах анализа, таких как иммунохимические методы и ПЦР. Причем в первом случае, как правило, используют экстракцию определяемых веществ в буферный раствор, а для выделения нуклеиновых кислот и последующего проведения ПЦР используют стандартные методы экстракции [22, 30, 31]. В отличие от офлайн, онлайн экстрагирование – процесс, позволяющий снизить затраты времени за счет автоматизации и одновременной подготовки к анализу сразу нескольких образцов. Онлайн экстрагирование стало возможным благодаря развитию соответствующего инструментария для автоматической пробоподготовки СПК. Компания “CAMAG” (Швейцария) выпускает автоматизированные системы пробоподготовки, оборудованные считывателем штрих-кодов, встроенной промывающей станцией, возможностью добавления ВС и подключения к системам ЖХ-МС [23]. Такая система способна обрабатывать набор из 500 карточек с СПК. Другая установка Prolab GmbH (Reinach, Швейцария) способна применять различные протоколы экстрагирования за счет возможности зажима карт и пропускания через пятно крови раствора под давлением до 200 атм. Автоматизированные станции по экстракции образцов СПК совмещают с твердофазной экстракцией (ТФЭ). Компания “Spark Holland” (Emmen, Нидерланды) представила модифицированную установку, не требующую предварительного разделения экстрагированного образца с помощью ЖХ. Установка способна проводить предварительное экстрагирование на основе метода flow-through, т.е. путем пропускания элюента сквозь пятно и затем направлять поток в ТФЭ-МС/МС-систему. Подобная установка может с высокой точностью и воспроизводимостью обрабатывать порядка 20 образцов в час.
В идеале анализ на основе СПК должен осуществляться без предварительных стадий вырезания части мембраны с образцом и элюирования, например, на основе прямого МС-анализа поверхности (ПА-МС). Способ ПА-МС позволяет формировать заряженные ионы при комнатной температуре и нормальном давлении и затем направлять их в масс-спектрометр для количественного определения [32]. К методам ПА-МС относится десорбционная электрораспылительная ионизация (desorption electrospray ionization, DESI), где ионизация происходит за счет бомбардировки поверхности заряженными микрокаплями с образованием капель, содержащих целевой аналит, которые испаряются в нагретой капиллярной системе и детектируются в масс-анализаторе. Наиболее ч-асто встречающиеся ионизирующие анализаторы – это PaperSpray, DESI (Prosolia Inc., USA) и прямой анализ в режиме реального времени, (direct analysis in real time, DART) [32]. DART анализ основан на прямом воздействии ионизирующих газов на сухой анализируемый образец, исключая стадию предварительной экстракции биологического материала с носителя. Подобный способ способен значительно сократить время проведения анализа, но пока отстает от традиционных МС-методов по чувствительности и воспроизводимости результатов.
Методы анализа сухих пятен биологических образцов. В большинстве случаев имеющегося объема материала достаточно для проведения качественного и количественного анализа, однако ввиду малого объема отбираемого образца следует учитывать, что используемый метод анализа СПК должен обладать достаточной чувствительностью [2, 4, 6, 9]. Для количественного определения целевого аналита в образцах сухих пятен используют ГХ и ЖХ, МС, атомно-абсорбционную спектроскопию и МС с индуктивно связанной плазмой. Для анализа СПК наиболее часто применяют ЖХ в сочетании с различными методами детектирования, так как большая часть аналитов – это органические вещества, лекарства, их метаболиты и эндогенные соединения. Сочетание ГХ с МС применяют для анализа образцов СПК в неонатальном и метаболическом скрининге [33, 34], при определении аминокислот, гормонов и других метаболитов. Для определения широкого круга веществ используют также МС с матрично-активированной лазерной десорбцией/ионизацией (МАЛДИ-МС). Предварительное разделение образцов с использованием ЖХ в данном случае обычно не требуется, что сокращает продолжительность анализа. Показано, что полуколичественное и в некоторых случаях количественное определение может занимать уникально короткое время – порядка 5–10 с на один образец [35, 36].
Как отмечено выше, большинство методов, использующих СПК, предполагает определение низкомолекулярных веществ, например биомаркеров заболеваний, лекарств, запрещенных веществ и др. [2–11]. Для определения высокомолекулярных веществ сухие образцы используют значительно реже. Кехлер с соавт. [37] сравнили эффективность ЖХ с тандемным МС-детектированием (ЖХ-МС/МС) для определения белковой молекулы с иммуноанализом – золотым стандартом выявления высокомолекулярных белков. Авторы сделали вывод, что использование МС для количественного определения крупных белковых молекул возможно, но чувствительность метода при анализе СПК примерно в 20 раз ниже, чем в иммунохимическом анализе. Следует отметить, что иммунохимические методы для анализа сухих пятен применяют значительно реже. Это связано, прежде всего, с трудоемкостью анализа, большим числом операций предварительной подготовки сухих образцов в ручном режиме, так как применение инструментальных методов для количественного определения высокомолекулярных веществ ограничено. Помимо этого количественный анализ затруднен в связи со сложностью состава крови и особенностями распределения вещества между плазмой и клетками крови [27]. Однако ИФА и методы на основе агглютинации в качественном или полуколичественном варианте используют в серологических исследованиях, например, при мониторинге распространенности инфекционных заболеваний в популяциях сельскохозяйственных и диких животных и птиц [38, 39]. Для выявления искомых фрагментов нуклеиновых кислот в сухих образцах используют метод ПЦР, причем для экстракции и последующей амплификации пригоден образец любого происхождения, нанесенный и высушенный на носителе (биологическая жидкость, экстракт, суспензия, ткань, орган) [21, 22].
Стабильность определяемых компонентов в составе сухих образцов. Одним из преимуществ пробоподготовки образцов в виде сухих пятен в большинстве случаев является увеличение стабильности определяемых компонентов биологических жидкостей после высушивания на мембранном носителе. Так, например, наблюдаемые концентрации аминокислот, хранимых в СПК при комнатной температуре, лишь незначительно снижались в переделах от 3.1 до 7.3% ежегодно [40]. При хранении при –18°C таких подверженных разложению веществ, как ацилкарнитины, зафиксирована их стабильность в течение как минимум 330 дней. При хранении сухих образцов при комнатной температуре период полураспада ацилкарнитинов составлял от 161 до 990 дней [41].
Антитела достаточно стабильны при хранении в составе высушенной на носителе крови, сыворотки или плазмы. Так, образцы СПК, полученные от диких северных оленей в полевых условиях, при определении антител к возбудителям инфекционных заболеваний демонстрировали идентичные результаты в течение двух лет хранения при комнатной температуре [31]. ДНК- и РНК-содержащие вирусы также удается сохранять в высушенном виде достаточно продолжительное время. Многочисленные примеры использования специальных FTA карт (Whatman, США), импрегнированных лизирующими и хелатириущими агентами для лизиса клеток и увеличения сохранности нуклеиновых кислот вирусов-возбудителей при хранении, описаны в работе [30]. Так, например, в работе [42] на примере чумы мелких жвачных животных показано, что одноцепочечные вирусные РНК вируса-возбудителя могут быть выявлены в СПК спустя, как минимум, три месяца хранения при температурах, характерных для тропических стран. Более того, при анализе СПК провирусную ДНК вируса-возбудителя африканской чумы свиней удалось обнаружить даже спустя девять месяцев хранения при 37°С. В другом исследовании [43] определяли РНК вируса ящура в сухих образцах эпителия языка и конечностей зараженных коров, отправленных по почте без охлаждения по длинному маршруту от места отбора до лаборатории после периода дождей, а также в летний период в Индии. Показано, что независимо от температурных условий (21–45°C) и влажности окружающей среды (20–100%) во всех образцах определили геном и серотип вируса ящура через 22–56 дней после отбора образцов.
Использование мембранных носителей для хранения образцов в высушенном виде позволяет улучшить стабильность многих биомолекул за счет дегидратации образца и, следовательно, минимизации ферментативных и гидролитических процессов. Например, вещество лопинавир в течение двух лет хранения в образцах СПК сохраняется значительно лучше, чем в замороженной плазме [36]. На примере бензодиазепинов, определение которых проводят в судебной медицине, показано увеличение стабильности аналитов при хранении на носителе [44]. В некоторых случаях отмечено, что на стабильность при хранении влияет наличие в составе мембранного носителя стабилизирующего агента, например ЭДТА [45]. Подводя итог, можно заключить, что технология СПК предлагает простой и эффективный способ доставки и хранения биологических образцов, сокращая расходы на перемещение проб к месту анализа и хранение, позволяет снизить требования к соблюдению температурных норм. Стабильность конкретного вещества и возможность его анализа в сухом матричном пятне следует изучать в отдельных исследованиях, однако в большинстве случаев транспортировку и краткосрочное хранение сухих образцов с уверенностью можно проводить без охлаждения.
ПРОБЛЕМЫ И ОГРАНИЧЕНИЯ ПРИ ПРИМЕНЕНИИ ПРОБОПОДГОТОВКИ ОБРАЗЦОВ В ВИДЕ СУХИХ ПЯТЕН
Эффект гематокрита исследуемого образца крови. На сегодняшний день серьезным ограничением применения технологии СПК в количественном анализе является вариативность уровня гематокрита от образца к образцу цельной крови. Гематокрит (Ht) – это отношение объема эритроцитов к объему образца крови. Значение Ht образца может значительно влиять на точность определения целевого вещества в биоаналитических методах на основе СПК. Нормальное значение Ht составляет порядка 0.41–0.51 для мужчин и 0.37–0.47 для женщин [46]. Однако в определенных группах населения его пределы варьируются, например, 0.28–0.67 у новорожденных (0–1 год) и 0.35–0.42 у детей (2–12 лет). Уровень Ht капиллярной крови, как правило, выше, чем венозной. Для разных видов животных и птиц величина Ht также варьируется. Величина Ht прямо пропорциональна вязкости крови, что влияет на текучесть и диффузионные свойства крови, нанесенной на мембрану (рис. 3). При высоких значениях Ht образца распределение капли крови по мембране затруднено; размер пятна на носителе при этом будет меньше по сравнению с каплей равного объема, но с меньшим значением Ht [47]. Очевидно, что чем больше объем цельной крови, приходящейся на единицу площади сухого пятна, тем большая масса соответствующего сухого образца будет отобрана для анализа при отделении части мембраны равного размера, а значит, концентрации выявленных аналитов будут варьироваться.
Рис. 3.
Величина пятна крови на карточке Whatman 903 в зависимости от значения гематокрита наносимого образца цельной крови: А – Ht = 0.18, B – Ht = 0.35, С – Ht = 0.50 [46].

Эффект гематокрита зависит также от физико-химических свойств аналита и от свойств используемого мембранного материала. Относительно низкое значение Ht приводит к отклонению результатов определения концентраций аналита в отрицательную сторону (в сравнении со средним уровнем Ht, равным 0.45), тогда как положительное отклонение наблюдается при повышенном значении Ht. Различия в коэффициентах распределения определяемых веществ между клетками крови и плазмой приводят к тому, что эффект гематокрита может проявляться для разных веществ по-разному. Так, на примере нескольких иммунодепрессантов с использованием пяти различных карточек для отбора СПК изучена взаимосвязь значений Ht со степенью извлечения веществ с мембран [48]. Эффект гематокрита проявлялся на всех пяти карточках. В зависимости от типа карточек результаты анализа, в особенности при экстремальных значениях Ht и повышенных концентрациях, варьировались в значительной степени. При повышенных концентрациях иммунодепрессантов такролимуса, сиролимуса, эверолимуса, аскомицина и темсиролимуса эффект гематокрита проявлялся намного сильнее, чем при низких концентрациях. В целом эффект гематокрита увеличивает разброс результатов анализа, увеличивая суммарную погрешность, которая может превысить допустимое значение 15% [49, 50].
Эффект размера пятна. Нанесение разных объемов крови на мембрану может быть причиной различия результатов определения концентрации аналита при фиксированных размере отделенного участка мембраны с образцом и значении Ht образца. Исследованы диски диаметром 3 мм из центра и периметра пятна, а также с участка “гало” вокруг пятна [51]. “Гало-эффект” возникает при высыхании пятна крови и характеризуется более светлым оттенком края, нежели основной части пятна. В участке “гало” наблюдали значительное (более 15%) отклонение концентрации целевого аналита от значений, полученных из центральных участков. Данное отклонение вызвано неравномерным распределением аналита, а также эффектом гематокрита образца. При исследовании наличия врожденных заболеваний точность определения аминокислот, ацилкарнитинов и гуанидиацетата сильно зависит от используемого в анализе участка пятна [51]. Для преодоления эффекта размера пятна используют ряд контрольных образцов нескольких концентраций и объемов нанесенной крови. После высушивания участок мембраны с образцом (например, диск диаметром 3 мм) анализируют вместе с набором градуировочных стандартов, для которых объем нанесенной крови может быть таким же, как один из указанных выше или иным. Разница результатов ЖХ-МС/МС-анализа не должна превышать 15% от номинального значения [20, 52, 53].
Хроматографический эффект. При нанесении крови на бумажный мембранный носитель может происходить неравномерное распределение определяемых веществ вследствие проявления хроматографического эффекта, в результате концентрации аналита в центре пятна крови и на его периферии будут различаться. В зависимости от типа используемых целлюлозных мембран можно наблюдать различия в получаемых результатах [54, 55]. Ранее показано, что целевые низкомолекулярные аналиты могут неравномерно распределяться по мембранному компоненту. Рен с соавт. [56] визуализировал распределение вещества на различных целлюлозных карточках для отбора крови (31 ETF, Grade 226, FTA Elute, 903 и FTA, Whatman, США) и продемонстрировал неравномерное распределение веществ, меченных изотопом C14. Более того, степень неравномерности распределения целевого аналита на конкретной мембране зависела помимо состава мембраны и от количества нанесенной крови. Например, для карточки FTA elute лучший результат получен при нанесении меньших объемов крови (30 мкл вместо 100 мкл). Показано также, что распределение аналитов на химически модифицированных карточках, таких как FTA и FTA elute, сильнее зависит от внешних факторов: влажность воздуха и температура в значительной степени влияют на точность результатов анализа. Негомогенное распределение целевого аналита наблюдали также О’Мара с соавт. [57], которые исследовали распределение гликогенсинтаз с различным связыванием с белками плазмы. В зависимости от структурных особенностей исследуемых молекул хроматографический эффект значительно влиял на их распределение вдоль пятна крови.
Введение внутреннего стандарта в сухую пробу, эффект матрицы. При количественном анализе жидких образцов инструментальными методами добавление ВС осуществляется просто, быстро и надежно по сравнению с сухими образцами. Равномерно распределить ВС в сухом образце без предварительного элюирования – непростая задача, которую приходится решать при детектировании методом МС, основанном на непосредственном пропускании элюирующего раствора через пятно крови и последующем распылении [29]. Помимо этого, на точность результатов МС-определения может влиять наличие матрицы. Использование при экстрагировании СПК растворов с высоким содержанием воды в сочетании с полярным органическим растворителем (метанол, ацетонитрил) может привести к совместной экстракции полярных компонентов матрицы, что впоследствии вызовет эффекты ионной супрессии или усиления при МС-анализе [2].
Пути преодоления эффекта гематокрита образца крови. Эффект гематокрита, пожалуй, самое главное препятствие на пути широкого применения СПК в биоанализе. Для преодоления эффекта гематокрита на сегодняшний день предложены различные подходы, направленные в основном на осуществление отбора фиксированного объема пробы. Например, нивелировать эффект можно за счет ограничения площади впитывающей поверхности при нанесении образца на участки мембраны в виде дисков определенного размера или перфорированные по краю [35, 58–60]. В работе [58] использовали предварительно вырезанные (pre-cut) целлюлозные диски, закрепленные на клейкой ленте. Для проведения анализа вырезанный диск используют целиком с известным объемом нанесенной крови. Этот подход уменьшает отклонения при анализе проб с низким и высоким гематокритом по сравнению со средним (0.45). Однако результаты все равно могут заметно варьироваться для некоторых аналитов в зависимости от значений гематокрита, что объясняется различным распределением определяемого вещества между плазмой и клетками крови. В работе [59] также использовали заранее вырезанные диски для определения ацетаминофена. Такой подход позволил увеличить точность результатов анализа. Кроме того, он упростил утилизацию образцов, так как для анализа пробу берут целиком без остатка. Другие предлагаемые в литературе варианты pre-cut устройств с дисками определенного диаметра представляют собой пластиковые картриджи или кейсы с помещенным внутрь индивидуальным целлюлозным диском [35]. Иной способ преодоления эффекта гематокрита подразумевает перерасчет найденных концентраций аналита, исходя из значений Ht конкретного образца. Однако для этих целей требуется определить значение Ht, что затруднительно для сухих образцов, хотя соответствующие методики существуют. К примеру, известен метод, позволяющий с достаточной точностью определить гематокрит по уровню калия в крови либо по оценке отражения ультрафиолетового излучения от поверхности пятна [61, 62], в том числе с помощью автоматической системы [63]. Другие разработки направлены на создание вспомогательных устройств, точно дозирующих образец на мембранный носитель. Эффект гематокрита удается исключить в случае использования полученного пятна крови в анализе целиком. Недавно представлено устройство на основе мембранного фильтра [64], позволяющее отделять плазму от клеточных элементов крови. Конструкция состоит из двух различных мембран, первая из которых представляет собой барьер для эритроцитов и задерживает их, а вторая служит носителем для отделенной от клеток плазмы. Таким образом, образцы плазмы могут быть получены без предварительного центрифугирования. Такая технология может стать альтернативой СПК и другим методам микросэмплинга (отбора микроколичеств крови), так как полностью исключает влияние гематокрита на точность анализа сухого образца. Более радикальным способом борьбы с имеющимися недостатками анализа СПК является разработка новых альтернативных форматов устройств для получения сухих пятен, в том числе содержащих мембранные носители различного состава. Некоторые устройства описаны в следующем разделе.
УСТРОЙСТВА ДЛЯ ПОЛУЧЕНИЯ СУХИХ ОБРАЗЦОВ НА МЕМБРАННОМ НОСИТЕЛЕ
В настоящее время для отбора сухих биопроб в основном используют целлюлозные карточки, производство которых началось с момента успешного применения технологии СПК в неонатальном скрининге. С тех пор принципиальное устройство и состав данных карточек не претерпели серьезных изменений. Карточка состоит из внутренней впитывающей части, представляющей собой целлюлозный материал определенного химического и физического состава, а также из внешней части, выполняющей защитную и информационную функции (рис. 2). На внутренней части очерчены круги, которые обозначают места нанесения капель биообразца или отпечатка ткани/органа. Большая часть карточек для медицинских целей производится фирмой “Whatman” (США) – крупной компанией по производству бумажных фильтров и сопутствующих материалов. Некоторые другие компании (“Ahlstrom-Munktell” (Швеция), “Fisher Scientific” (США) и др.) производят карточки под своим брендом, но используют схожий формат и целлюлозный материал (Whatman 903). Данный формат карточки удобен для нанесения капиллярной крови из пальца пациента, но при этом для корректного нанесения крови требуется соблюдать ряд условий, которые часто нарушаются. Так, например, каплю крови нужно наносить в центр круга, при этом нельзя наносить каплю в один круг дважды. Отклонения от центра приводит часто к необходимости повторного нанесения капли на ту же область, что вызывает локальное увеличение концентрации вещества на носителе и как следствие завышение результатов анализа, а также снижение воспроизводимости. Кроме того, сам по себе используемый в качестве впитывающей мембраны целлюлозный материал обладает рядом свойств, которые затрудняют последующий анализ сухого образца. Выше описаны мешающие анализу эффект гематокрита и хроматографический эффект за счет физико-химических свойств полых целлюлозных волокон. Помимо этого, количество сорбируемого образца на единицу площади целлюлозной мембраны, как правило, неизвестно. Использование целлюлозного материала на данный момент является, скорее, данью традициям и устоявшимся рыночным отношениям. Современные научные разработки направлены не только на создание новых аналитических подходов для анализа СПК, но и на использование более технологичных мембранных материалов, роль которых заключается не только в адсорбции и сохранении биологического образца, но и в минимизации влияния различных факторов на последующий анализ сухих пятен [65]. Так, например, описано использование нецеллюлозных материалов для получения СПК [66, 67]. Отмечено, что нецеллюлозные материалы обладают лучшими параметрами распределения независимо от вязкости наносимой жидкости, однако пятно на таких носителях может быть неравномерным по форме, а при вырезании диска материал оказывается более хрупким по сравнению с бумажным [48].
Для преодоления проблем пробоподготовки и анализа, связанных с применением целлюлозного материала, предложено множество различных устройств, основная цель которых – получение микроколичеств сухих образцов определенного объема и облегчение последующего анализа [68]. Новое устройство для получения сухих образцов HemaSpot TE (SpotOnScience, США) [69] представляет собой футляр, содержащий внутри пористый целлюлозный носитель, выполненный в виде пропеллера (рис. 4). Каплю крови наносят на центральную часть мембраны, после чего она распространяется по лепесткам мембраны в радиальном направлении, футляр плотно закрывается, и мембрана высушивается за счет находящегося внутри осушителя. Лепестки мембраны впитывают ограниченный объем крови, при полном их заполнении снижается влияние гематокрита. Для проведения анализа достаточно отделить один из лепестков и провести десорбцию определяемого вещества из мембраны. Подобный подход к пробоподготовке в сравнении с классическим целлюлозным носителем для капельного нанесения (Munktel TFN) приводил к более высокой корреляции результатов в сравнении с быстрыми тестами при выявлении ВИЧ в Нигерии [53]. Данное исследование показало, что при недостаточной оснащенности лабораторного и врачебного персонала требуются более оптимизированные методики и строгое соблюдение правил использования устройств при получении сухих образцов. Помимо этого, необходимы устройства, пригодные для отбора проб в полевых условиях, обеспечивающие получение точных результатов анализа, а также высокую корреляцию с методами – золотыми стандартами. К недостаткам системы HemaSpot следует отнести ее относительную сложность в изготовлении и последующем использовании, так как для нанесения образца крови требуются дополнительные инструменты, например дозаторы. Для достижения высокой воспроизводимости результатов анализа обязательно наносить точную аликвоту крови в центр мембраны, причем необходимо контролировать объем наносимой жидкости, чтобы он не превышал максимальную емкость мембраны. Более того, если не удается отобрать необходимый для нанесения объем (кровь может плохо вытекать из пальца), то невозможно полностью заполнить лепестки, и объем крови в лепестке оказывается неизвестным, а результат анализа – некорректным. Компания-производитель разработала также устройство с носителем в виде спирали Hemaspot SE: кровь наносится в центр и в процессе распространения пробы по носителю происходит отделение клеточных элементов. Таким образом, отделяя необходимый участок носителя, можно анализировать сухой образец крови или соответствующей плазмы.
Другое устройство для микросэмплинга Volumetric Absorptive Microsampling VAMS (Neoteryx, США) [70, 71] представляет собой пластиковый стержень, на конце которого располагается небольшой адсорбционный элемент из полимерного материала в виде спичечной головки (рис. 5). Авторы утверждают, что емкость элемента фиксированная и в зависимости от назначения устройства может составлять от 10 до 30 мкл, что подтверждено введением в пробу радиоактивных изотопов и измерением радиоактивности адсорбента с образцом [70]. Для нанесения крови конец впитывающей головки опускают в образец до полного насыщения. Влияние гематокрита на анализ в диапазоне значений Ht 0.20–0.70 незначительно, и отклонение от условно нормального значения (0.45) составляло 5%, что значительно меньше, чем для классической целлюлозной мембраны, где результаты измерений варьировались в пределах 30%.
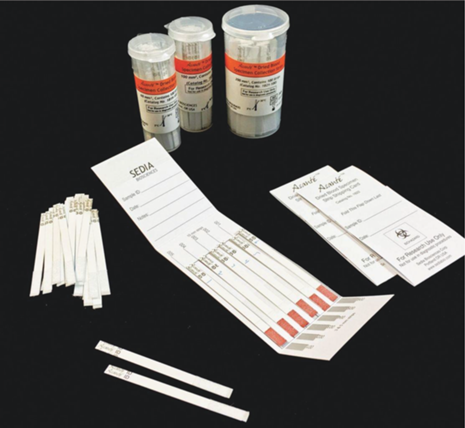
Устройство Asante Dried Blood Specimen Collection Strips (Sedia Biosciences Corporation, США) (рис. 6) представляет собой впитывающую полоску на пластиковой основе по типу латеральной. Кровь впитывается в сорбционный материал длиной около 2 см, который имеет определенную емкость, что позволяет отбирать фиксированный объем крови. Перед анализом проводят полную экстракцию сорбированной крови в раствор. Это позволяет снизить влияние погрешностей при отборе крови, связанных с переизбытком или недостаточным количеством нанесенной пациентом крови. Однако дозирование сухого образца в данном случае не предусмотрено, нанесенный и высушенный образец полностью смывается в раствор. На подобном принципе построена карточка фирмы “RayBiotech Life” (США), содержащая несколько полосок для отбора около 30 мкл цельной крови на каждую.
Рис. 6.
Устройство для отбора крови Asante Dried Blood Specimen Collection Strips (Sedia Biosciences Corporation, США).
С целью отбора фиксированного объема крови представлено вспомогательное устройство HemaXis (DBS System SA, Швейцария) [72], интегрированное со стандартной карточкой фирмы “Whatman”, которое с помощью капиллярной системы позволяет наносить кровь на мембрану в центр окружности в фиксированном объеме (рис. 7). Это позволяет избежать погрешностей при нанесении крови пациентом при условии последующего экстрагирования в автоматических проточных системах, в которых используется вся площадь мембраны с нанесенным сухим образцом.
В работе [73] авторы использовали капилляр для точного дозирования 3 мкл крови вместе с заранее вырезанными дисками целлюлозного материала (рис. 8). Данная система состоит из фиксированных в пластиковом картридже частей мембраны, на которые наносят точный объем крови (3 мкл) из капиляра. Подобная система позволяет повысить точность нанесения образца по сравнению полуавтоматическим дозатором. Однако все это, несомненно, усложняет устройство и способ нанесения пробы. По практичности подобные устройства вряд ли сравнятся с классическими карточками для отбора, которые просты в изготовлении, хранении и при транспортировке.
Помимо новых устройств также описаны форматы карточек и мембранных материалов, которые могли бы служить альтернативой традиционному прямоугольному формату карточек. Например, в работе [74] для получения СПК использованы полоски из целлюлозного материала с уширенным концом (рис. 9). Такой формат, по мнению авторов, удобен для отбора определенного объема крови (около 20 мкл) и последующего анализа крови методом ПЦР для диагностики малярии. Безусловно, такой формат пригоден для качественного анализа, но не подходит для количественных измерений, так как дозирование образца является неточным.
Отбор крови на полоски целлюлозного материала впервые предложен Кензо Нобуто для диагностики токсоплазмоза в 1966 г. [75]. Полоски состояли из двух частей: впитывающей и области распределения (рис. 10). В дальнейшем полоски Нобуто неоднократно использовались для ветеринарной диагностики различных инфекционных заболеваний как домашних, так и диких животных [31, 76–79].
Наша научная лаборатория активно работает по тематике пробоподготовки биообразцов виде сухих пятен в течение последних 10 лет. Авторы обзора предложили новый формат пробоподготовки сухих образцов с использованием разделенных на зоны одинакового размера узких полосок (стрипов) высокопористого материала (рис. 11) [80, 81]. Такой стрип мембранного материала несет в себе две функции: во-первых, функцию носителя биоматериала для хранения и транспортировки сухого образца в лабораторию и, во-вторых, функцию микросэмплера, т.е. устройства, способного впитывать фиксированное микроколичество жидкости, представляя собой капиллярный дозатор. Количество сорбированной жидкости определяется сорбционными свойствами используемого материала. Данный формат позволяет дозировать сухой образец, используя необходимое количество идентичных участков мембраны, что обеспечивает возможность проведения повторных исследований или нескольких видов анализа одной сухой пробы. Помимо этого, нанесение образца при использовании стрипа облегчается: образец можно наносить из наплыва крови в месте пункции или из пробирки, опустив край стрипа в жидкость. В первом случае это значительно облегчает отбор образца крови у животных и птицы. Жидкость, попадая на материал, легко впитывается и распространяется вдоль полоски пористого мембранного материала за счет капиллярных сил. На многочисленных примерах показано, что распределение как низкомолекулярных, так и высокомолекулярных веществ вдоль стрипа происходит равномерно, что позволяет использовать для анализа любой участок мембраны без ущерба для точности анализа [80–83]. Показано также, что это условие соблюдается для мембранных материалов из цельных стекловолоконных и полимерных волокон, тогда как для целлюлозного материала имеет место хроматографический эффект [80]. Изучение физико-химических свойств мембранных материалов разной природы с точки зрения их применимости для данного формата и последующего использования для пробоподготовки и анализа сухих образцов биологических жидкостей позволило выделить стекловолоконный материал как наиболее эффективный для использования в биоаналитике. Так, например, на стекловолоконном материале образцы крови с различным значением гематокрита распределяются более равномерно, чем на целлюлозном (рис. 12). При этом равномерность распространения зависит от сорбционных свойств мембраны. Успешное использование предложенного формата пробоподготовки в сочетании с количественным, полуколичественным и качественным иммунохимическим анализом и ПЦР продемонстрировано на примере выявления гормонов, метаболитов, белков, антител, ДНК в образцах цельной крови, сыворотки, плазмы и цельного молока для целей биомедицинской и ветеринарной диагностики [80–93].
ПРИМЕНЕНИЕ ТЕХНОЛОГИИ ПРОБОПОДГОТОВКИ БИООБРАЗЦОВ В ВИДЕ СУХИХ ПЯТЕН НА ПОРИСТЫХ НОСИТЕЛЯХ
На сегодняшний день пробоподготовка биопроб в виде сухих пятен применяется преимущественно для определения низкомолекулярных веществ, например биологически активных фармацевтических соединений и запрещенных наркотических веществ [7, 8, 11, 18], а также для сбора биоматериала для проведения ПЦР и генетических исследований [22, 30, 42, 43, 94]. Метод СПК хорошо подходит для терапевтического лекарственного мониторинга, требующего многократных измерений во время терапии веществами с коротким интервалом воздействия [44]. Особое место технология СПК занимает в дистанционной диагностике заболеваний человека и в неонатальном скрининге [43].
Мониторинг заболеваний человека. По мнению авторов работы [95], можно выделить как минимум 45 аналитов, выявление которых в СПК представляет наибольшую ценность для популяционных исследований. Среди них биомаркеры, характеризующие состояние эндокринной, сердечно-сосудистой, репродуктивной, иммунной систем организма, которые на современном уровне развития диагностических технологий могут быть выявлены в малом объеме исследуемого образца. В настоящее время технология СПК интегрирована в несколько национальных американских и международных программ популяционных исследований детей старшего возраста, взрослых и пожилых людей. Так, технология СПК нашла широкое применение в дистанционном исследовании гепатита [96] и ВИЧ в африканских странах [12, 13, 15]. Усилия, направленные на повышение доступности тестирования на ВИЧ в сельских районах развивающихся стран, где живут более 90% всех ВИЧ-инфицированных людей, имеют решающее значение для борьбы с этой болезнью. Технология СПК обеспечивает простой, надежный и доступный способ сбора образцов крови и других биологических жидкостей для скрининга болезни, контроля качества санитарной помощи, измерения вирусной нагрузки ВИЧ и тестирования лекарственной устойчивости в условиях, когда отбор венозной крови и ее транспортировка неосуществимы или затруднены [14]. Большинство количественных анализов на вирусную нагрузку ВИЧ проводят методом ПЦР, который требует большого количества плазмы (100–600 мкл) и транскрипции РНК в ДНК до амплификации. Кроме внеклеточной РНК ВИЧ-1, которая содержится в образцах плазмы, сухие образцы содержат цельную кровь, а следовательно, внутриклеточную РНК ВИЧ-1 и провирусную ДНК ВИЧ-1. В результате анализ на вирусную нагрузку с использованием технологии СПК потенциально более чувствителен, чем определение ВИЧ-1 в плазме или сыворотке. Это имеет большое значение для раннего выявления ВИЧ [21].
Доклинические и клинические исследования лекарств. В основе работ в области доклинических испытаний лежит отбор крови подопытных животных в течение определенного периода времени после введения препарата для установления точных значений концентраций соответствующих препаратов в крови. Доклинические испытания включают в себя исследование фармакологических и токсикологических свойств препаратов. В настоящее время очень многие исследования и публикации посвящены именно этому направлению использования технологии СПК в области фармакокинетики [4, 27, 49, 50, 97, 98]. Стандартная методика выполнения анализов и проведения фармакокинетических исследований предусматривает серийный забор достаточно большого объема крови (обычно около 1 мл) животных (крыс, мышей), при этом животное в процессе отбора крови погибает. Переход на технологию СПК позволяет значительно сократить объем отбираемого биологического материала и сэкономить значительные средства. Кроме того, с помощью СПК можно использовать одно и то же животное в одной и той же серии измерений многократно [98].
Терапевтический мониторинг лекарств. Низкая травмируемость при использовании технологии СПК делает ее незаменимой в терапевтическом мониторинге лекарственных препаратов, когда с целью назначения необходимого курса приема препарата необходимо отслеживать его концентрацию в организме в динамике. Это особенно актуально для препаратов с малым терапевтическим временем воздействия на организм или для нестабильных препаратов. Например, в работе [99] СПК анализировали на наличие иммуносупрессоров методом ЖХ-МС/МС. Технологию СПК, особенно в сочетании с ЖХ-МС/МС, активно используют в клинических исследованиях жаропонижающих, противокашлевых, противовирусных, противосудорожных, иммуносупрессорных, противоэпилептических и других лекарственных средств. Однако в случае применения СПК в терапевтическом мониторинге необходимо учитывать некоторые факторы, которые могут значительно влиять на результаты анализа сухих и жидких образцов (например, гематокрит) [95].
Неонатальный скрининг. Использование технологии СПК в неонатальном скрининге получило широкое распространение во всем мире [4]. Ввиду малого объема отбираемой крови травмируемость новорожденных снижается, облегчается отбор крови и становится возможным ранняя диагностика патологий. У грудных детей в основном выявляют этиологию и патогенез врожденных заболеваний. Такие заболевания встречаются очень редко и составляют единицы на тысячу и десятки тысяч новорожденных, однако их своевременная диагностика и последующее наблюдение гарантирует избавление ребенка от негативных проявлений заболевания. Так, например, при обнаружении фенилкетонурии (нарушения метаболизма фенилаланина) ребенку назначают специальную диету, исключающую потребление высокобелковой пищи. Ограничение потребления организмом фенилаланина позволяет избежать необратимых паталогических изменений, приводящих к умственной отсталости [100].
Технология сухих пятен крови в ветеринарии и биологии. Несмотря на то, что технология СПК относительно широко применяется в медицинских исследованиях, ее значимость для ветеринарии и биологии на сегодняшний день явно недооценена. По сути использование технологии СПК для отбора, хранения и анализа сухих образцов в диагностике болезней сельскохозяйственных животных, птицы, домашних и диких животных находится лишь в самой начальной стадии развития, хотя успешные попытки исследовать серологическими методами полученные на мембранных материалах сухие образцы крови сельскохозяйственных животных описаны еще в 50–60-х годах прошлого века [74, 101]. После этого в течение нескольких лет наблюдался всплеск научных работ не только по медицинской, но и ветеринарной тематике. В течение последующих 30 лет технология не вызывала серьезного интереса в ветеринарии и биологии и только в конце 90-х–начале 2000-х гг. число публикаций начало расти вслед за широким распространением технологии СПК в мире. Однако даже на сегодняшний день общее число публикаций, посвященных применению СПК в ветеринарной диагностике и биологических исследованиях, невелико и составляет порядка двухсот пятидесяти работ.
Ветеринарную диагностику на основе технологии СПК проводят с использованием широкого спектра методов, в основном это серодиагностика для выявления специфических антител в крови животного и ПЦР для обнаружения генома возбудителя. Для определения антибиотиков, пестицидов, металлов применяют инструментальные методы анализа, такие как ЖХ, МС и др. [102–107]. Большой практический интерес вызывает использование высушенных на носителе образцов для мониторинга заболеваний в регионах с тропическим климатом, труднодоступных и удаленных местах, странах с обширной территорией, где могут наблюдаться сложности при транспортировке и хранении проб. Технология СПК неоднократно применялась для мониторинга важных инфекционных заболеваний сельскохозяйственных и домашних животных, например трипаносомных заболеваний скота в странах Африки [108], а также для исследования векторных организмов, участвующих в переносе инфекции [109]. Интересным направлением таких исследований является анализ слюны комаров, а также частей самих векторных насекомых, например мухи цеце, клопов и других насекомых, на предмет выявления генома возбудителя [110, 111]. В работе [112] идентификация инфицированных и неинфицированных животных серологическим методом проходила эффективнее на основе результатов, полученных с помощью СПК, чем при анализе жидких проб. Отмечено, что для получения сыворотки для стандартного анализа жидкой пробы в полевых условиях требуется гораздо больше усилий, так как необходим отбор значительного количества материала из хвостовой или яремной вены крупного рогатого скота.
Технологии СПК находит применение при мониторинге заболеваний разнообразных диких животных и птиц [21, 30, 31, 76–78, 113–115]. Большинство инфекционных заболеваний диких животных слабо подвержено контролю. Ввиду невозможности массового отбора проб в один день, пробы аккумулируются в течение длительного времени. Технология СПК позволяет хранить высушенные пробы в течение всего срока экспедиции, не прибегая к их охлаждению. Данный подход использовали при мониторинге бруцеллеза северных оленей в Канаде [77]. Данное заболевание сложно контролируется ввиду сурового климата и огромного ареала обитания диких животных. Домашний скот также подвержен этому заболеванию и основная причина инфицирования – передача инфекции от диких животных. Кроме того, не исключена опасность заражения человека при недостаточной тепловой обработке пищи. Образцы отбирали у убитых в ходе отстрела оленей в экстремальных условиях при температурах до –40°C на полоски Нобуто и через два месяца анализировали методом ИФА. Сбор сухих проб на мембранные носители используют при генетических и морфологических исследованиях, например, для определения генома и серотипа возбудителей инфекционных заболеваний, создания биобанков [22, 43]. С использованием технологии СПК изучают антропогенное влияние на представителей дикой фауны. Для этого в крови перелетных птиц определяют токсиканты, наличие тяжелых металлов, пестицидов и антибиотиков [102–106].
Перспективно использование технологии СПК для мониторинга инфекционных заболеваний сельскохозяйственных животных и уровня поствакцинального иммунитета [85, 91]. Сельскохозяйственные животные и птица ввиду массовости содержания подвержены большому числу инфекционных заболеваний, обычно имеющих вирусную природу, а в условиях промышленного содержания инфекция способна быстро распространятся и поражать большое число голов. В зависимости от распространенности в конкретном регионе для профилактики инфекционных заболеваний существуют специальные программы вакцинирования поголовья. В большинстве публикаций, освещающих применение технологии СПК, отмечается, что для успешной борьбы с опасными инфекциями диких и сельскохозяйственных животных требуется развитие эффективного и недорогого метода хранения и транспортировки образцов крови, каким и является метод получения сухих пятен биологических жидкостей на мембранных носителях [22, 43, 76, 79, 94]. Однако в ветеринарной практике в России технология непопулярна и малоизвестна, отсутствуют утвержденные методические указания для использования сухих образцов в мониторинговых программах. Для животных возможности нанесения крови и получения сухих пятен при использовании классических карточек ограничены. Показательно, что в некоторых работах исследователи для удобства нанесения пробы самостоятельно нарезали целлюлозный материал на полосы для возможности пропитки мембраны напрямую из пункции и удобства дозирования на последующих этапах [38, 116, 117].
ПЕРСПЕКТИВЫ РАЗВИТИЯ ТЕХНОЛОГИИ СУХИХ ПЯТЕН КРОВИ
Метод отбора микроколичеств крови на мембранный носитель будет находить все более широкое применение при разработке новых лекарственных препаратов, где необходимо постоянно отбирать образцы биологических жидкостей у лабораторных животных. Очевидно, что технология СПК также будет распространяться на методики сбора и анализа не только образцов цельной крови, но и других биологических жидкостей человека и животных [2, 15, 83, 84]. На данном этапе развития множество операций при пробоподготовке образца проводят вручную. И хотя это не представляет проблему для маленьких выборок, при масштабном исследовании необходимо применение автоматизированных технологий. На сегодня уже созданы приборы, позволяющие полностью автоматизировать процесс обработки карточек с образцами в виде сухих пятен для последующего автоматизированного анализа [23, 63]. Параллельно с уменьшением количества отбираемого материала, миниатюризацией устройств, способных отбирать микроколичества жидкостей, идет процесс миниатюризации анализаторов, включающих в себя одновременно узлы пробоподготовки образцов СПК и масс-спектрометр. Делаются попытки сопряжения автоматизированных устройств, используемых для СПК, с инструментами, применяемыми в других методиках, для расширения спектра анализируемых объектов и увеличения точности анализа. Опубликовано довольно много работ по разработке методов СПК с применением ЖХ-МС/МС, что значительно расширяет возможности технологии за счет сочетания нескольких методик, которые взаимно компенсируют недостатки друг друга [2]. При точном соблюдении методики отбора образцов, автоматизации операций отделения участка мембраны с образцом и экстракции (элюировании) аналитов, усовершенствовании химического состава пористых сорбирующих мембран для повышения устойчивости нестабильных соединений технология СПК будет играть важную роль в количественном анализе лекарственных препаратов и определении метаболитов в крови, а также в диагностике заболеваний в медицине и ветеринарии [15]. Расширяется спектр определяемых соединений с использованием СПК; разрабатываются методы определения микроэлементов [117], насыщенных и полиненасыщенных жирных кислот [118]. Новое направление использования технологии СПК анонсировано в июле 2021 года. На 138-й сессии МОК Всемирное антидопинговое агентство (WADA) объявило об утверждении метода тестирования пятен сухой крови спортсменов на запрещенные вещества (допинг) на международных соревнованиях, в том числе на Олимпийских играх, начиная с Олимпиады-2021 в Токио.
* * *
Поводя итог, хочется отметить, что, несмотря на широкое распространение, целлюлозные пористые носители имеют общепризнанные недостатки – неравномерность нанесения и распределения пятна крови, зависимость площади зоны распространения пятна крови от вязкостных свойств индивидуального образца, а также неполное смывание образца с носителя вследствие частично необратимой сорбции компонентов крови на волокнах целлюлозы. Эти недостатки ограничивают возможности технологии СПК при использовании в количественном анализе для целей диагностики. Особенно это касается иммунохимических методов, хотя для неонатального скрининга технология хорошо отработана и стандартизована. Сегодня для получения сухих пятен биообразцов предлагаются новые нецеллюлозные пористые мембранные материалы, обладающие неоспоримыми эксплуатационными и аналитическими преимуществами и позволяющими нивелировать либо полностью избежать нежелательных эффектов, присущих целлюлозе. Помимо этого, ведется поиск более удобных в использовании форматов устройств для отбора биопроб, которые позволят осуществлять эффективный отбор образцов не только у человека, но и у животных, в том числе вне лаборатории. Стоит отметить, что большинство новых устройств для отбора и пробоподготовки образцов в виде сухих пятен не предназначены для массового скрининга, а рассчитаны на индивидуальное применение. Стоимость усовершенствованного индивидуального устройства для отбора крови, сложность его изготовления и использования предполагает, скорее, применение в медицине. В ветеринарной диагностике применение биообразцов в виде сухих пятен для мониторинга инфекционных заболеваний мало распространено, что связано в том числе с высокой стоимостью предлагаемых на рынке устройств для отбора проб, рассчитанных на медицинское применение, с отсутствием альтернативных систем и форматов пробоподготовки, удобных для ветеринарного применения, в частности для отбора крови у животных и птицы в полевых условиях. Кроме этого, слабо развиты методические подходы к работе с сухими образцами. Путем развития удобных устройств для отбора проб технология СПК может стать альтернативой использованию жидких проб для массового мониторинга сельскохозяйственных животных и птицы, а также других ветеринарных и биологических исследований представителей дикой флоры и фауны. Применение в диагностике медицинских устройств на основе целлюлозных мембран, преимущественно в виде карточек, ориентировано на количественный анализ физико-химическими методами с целью оценки уровня низкомолекулярных веществ в крови человека. Продолжительность анализа и перечень определяемых веществ сильно зависят от возможности автоматизации стадий работы с сухими образцами. Наличие станций для автоматической пробоподготовки – серьезный барьер для широкого внедрения технологии в практику в развивающихся странах. Для рутинного иммунохимического анализа в лабораториях, ориентированных на исследование жидких образцов, использование сухих образцов создает дополнительные методические сложности, так как большинство операций с СПК проводится вручную. Несмотря на растущую популярность, технология СПК еще не до конца устоялась и не утвердилась по некоторым аналитическим аспектам. В целом технология СПК развивается в направлении усовершенствования и увеличения доли автоматизированных процессов, что в конечном итоге приведет к снижению средней продолжительности анализа и к возможности проведения масштабных исследований и мониторинга заболеваний. С развитием современных технологий повышается точность и чувствительность результатов, полученных с использованием сухих пятен биологических жидкостей. Использование технологии СПК, очевидно, будет постепенно заменять традиционный анализ жидкой плазмы. Неоспоримыми преимуществами технологии СПК являются простота отбора крови самим пациентом, возможность отправки сухого образца по почте и получения результата анализа дистанционно, возможность доставки сухого образца в лабораторию из удаленных районов, например из стран Африки. Подобный способ доставки способен упросить работу и способствовать выявлению и искоренению заболеваний, таких как ВИЧ и гепатит B, в странах третьего мира.
Список литературы
Guthrie R., Ada S. A simple phenylalanine method for detecting phenylketonuria in lage populations of newborn infants // Pediatrics. 1963. V. 32. № 3. P. 338.
Meesters R.J., Hooff G.P. State-of-the-art dried blood spot analysis: An overview of recent advances and future trends // Bioanalysis. 2013. V. 5. № 17. P. 2187. https://doi.org/10.4155/bio.13.175
Demirev P.A. Dried blood spots: Analysis and applications // Anal. Chem. 2013. V. 85. № 2. P. 779. https://doi.org/10.1021/ac303205m
Sharma A., Jaiswal S., Shukla M., Lal J. Dried blood spots: Concepts, present status, and future perspectives in bioanalysis // Drug Test. Anal. 2014. V. 6. № 5. P. 399. https://doi.org/10.1002/dta.1646
Diener C., Galata V., Keller A., Meese E. MicroRNA profiling from dried blood samples // Crit. Rev. Clin. Lab. Sci. 2019. V. 56. № 2. P. 111. https://doi.org/10.1080/10408363.2018.1561641
Antunes M.V., Charão M.F., Linden R. Dried blood spots analysis with mass spectrometry: Potentials and pitfalls in therapeutic drug monitoring // Clin. Biochem. 2016. V. 49. № 13–14. P. 1035. https://doi.org/10.1016/j.clinbiochem.2016.05.004
Lim M.D. Dried blood spots for global health diagnostics and surveillance: Opportunities and challenges // Am. J. Trop. Med. Hyg. 2018. V. 99. № 2. P. 256. https://doi.org/10.4269/ajtmh.17-0889
Stove C.P., Ingels A.S., De Kesel P.M., Lambert W.E. Dried blood spots in toxicology: From the cradle to the grave? // Crit. Rev. Toxicol. 2012. V. 42. № 3. P. 230. https://doi.org/10.3109/10408444.2011.650790
Enderle Y., Foerster K., Burhenne J. Clinical feasibility of dried blood spots: Analytics, validation, and applications // J. Pharm. Biomed. Anal. 2016. V. 130. P. 231. https://doi.org/10.1016/j.jpba.2016.06.026
Malsagova K., Kopylov A., Stepanov A., Butkova T., Izotov A., Kaysheva A. Dried blood spot in laboratory: Directions and prospects // Diagnostics. 2020. V. 10. № 3. P. 248. https://doi.org/10.3390/diagnostics10040248
McClendon-Weary B., Putnick D.L., Robinson S., Yeung E. Little to give, much to gain – What can you do with a dried blood spot? // Curr. Environ. Health. Rep. 2020. V. 7. P. 211. https://doi.org/10.1007/s40572-020-00289-y
Smit P.W., Sollis K.A., Fiscus S., Ford N., Vitoria M., Essajee S., Barnett D., Cheng B., Crowe S.M., Denny T., Landay A., Stevens W., Habiyambere V., Perriens J.H., Peeling R.W. Systematic review of the use of dried blood spots for monitoring HIV viral load and for early infant diagnosis // PLoS One. 2014. V. 9. № 3. Article e86461. https://doi.org/10.1371/journal.pone.0086461
Parry C.M, Parkin N., Diallo K., Mwebaza S., Batamwita R., DeVos J., Bbosa N., Lyagoba F., Magambo B., Jordan M.R., Downing R., Zhang G., Kaleebu P., Yang C., Bertagnolio S. Field study of dried blood spot specimens for HIV-1 drug resistance genotyping // J. Clin. Microbiol. 2014. V. 52. № 8. P. 2868. https://doi.org/10.1128/jcm.00544-14
Solomon S.S., Solomon S., Rodriguez I.I., McGarvey S.T., Ganesh A.K., Thyagarajan S.P., Mahajan A.P., Mayer K.H. Dried blood spots (DBS): A valuable tool for HIV surveillance in developing/tropical countries // Int. J. STD AIDS. 2002. V. 13. № 1. P. 25. https://doi.org/10.1258/0956462021924578
Li W., Lee M.S. Dried Blood Spots: Applications and Techniques. USA: Wiley, 2014. P. 363.
Lehmann S., Picas A., Tiers L., Vialaret J., Hirtz C. Clinical perspectives of dried blood spot protein quantification using mass spectrometry methods // Crit. Rev. Clin. Lab. Sci. 2017. V. 54. № 3. P. 173. https://doi.org/10.1080/10408363.2017.1297358
Freeman J.D., Rosman L.M., Ratcliff J.D., Strickland P.T., Graham D.R., Silbergeld E.K. State of the science in dried blood spots // Clin. Chem. 2018. V. 64. № 4. P. 656. https://doi.org/10.1373/clinchem.2017.275966
Li W., Tse F.L.S. Dried blood spot sampling in combination with LC-MS/MS for quantitative analysis of small molecules // Biomed. Chromatogr. 2010. V. 24. № 1. P. 49. https://doi.org/10.1002/bmc.1367
Wagner M., Tonoli D., Varesio E., Hopfgartner G. The use of mass spectrometry to analyze dried blood spots // Mass Spectrom. Rev. 2016. V. 35. № 3. P. 361. https://doi.org/10.1002/mas.21441
Jager N.G., Rosing H., Schellens J.H., Beijnen J.H. Procedures and practices for the validation of bioanalytical methods using dried blood spots: A review // Bioanalysis. 2014. V. 6. № 18. P. 2481. https://doi.org/10.4155/bio.14.185
Smit P.W., Elliott I., Peeling R.W., Mabey D., Newton P.N. An overview of the clinical use of filter paper in the diagnosis of tropical diseases // Am. J. Trop. Med. Hyg. 2014. V. 90. № 2. P. 195. https://doi.org/10.4269/ajtmh.13-0463
Smith, L.M., Burgoyne, L.A. Collecting, archiving and processing DNA from wildlife samples using FTA data basing paper // BMC Ecology. 2004. V. 4. № 4. https://doi.org/10.1186/1472-6785-4-4
Luginbühl M, Gaugler S. The application of fully automated dried blood spot analysis for liquid chromatography-tandem mass spectrometry using the CAMAG DBS-MS 500 autosampler // Clin. Biochem. 2020. V. 82. P. 33. https://doi.org/10.1016/j.clinbiochem.2020.02.007
Thomas A., Déglon J., Steimer T., Mangin P., Daali Y., Staub C. On-line desorption of dried blood spots coupled to hydrophilic interaction/reversedphase LC/MS/MS system for the simultaneous analysis of drugs and their polar metabolites // J. Sep. Sci. 2010. V. 33. № 6–7. P. 873. https://doi.org/10.1002/jssc.200900593
Wong P., Pham R., Whitely C., Soto M., Salyers K., James C., Bruenner B.A. Application of automated serial blood sampling and dried blood spot technique with liquid chromatography-tandem mass spectrometry for pharmacokinetic studies in mice // J. Pharm. Biomed. Anal. 2011. V. 56. № 3. P. 604. https://doi.org/10.1016/j.jpba.2011.06.022
Déglon J., Thomas A., Mangin P., Staub C. Direct analysis of dried blood spots coupled with mass spectrometry: Concepts and biomedical applications // Anal. Bioanal. Chem. 2012. V. 402. № 8. P. 2485. https://doi.org/10.1007/s00216-011-5161-6
Emmons G., Rowland M. Pharmacokinetic considerations as to when to use dried blood spot sampling // Bioanalysis. 2010. V. 2. № 11. P. 1791. https://doi.org/10.4155/bio.10.159
Abu-Rabie P., Denniff P., Spooner N., Brynjolffssen J., Galluzzo P., Sanders G. Method of applying internal standard to dried matrix spot samples for use in quantitative bioanalysis // Anal. Chem. 2011. V. 83. № 22. P. 8779. https://doi.org/10.1021/ac202321q
Meesters R., Hooff G., van Huizen N., Gruters R., Luider T. Impact of internal standard addition on dried blood spot analysis in bioanalytical method development // Bioanalysis. 2011. V. 3. № 20. P. 2357. https://doi.org/10.4155/bio.11.202
Cardona-Ospina J.A., Villalba-Miranda M.F., Palechor-Ocampo L.A., Mancilla L.I., Sepúlveda-Arias J.C. A systematic review of FTA cards® as a tool for viral RNA preservation in fieldwork: Are they safe and effective? // Prev. Vet. Med. 2019. V. 172. 104772. https://doi.org/10.1016/j.prevetmed.2019.104772
Curry P.S., Ribble C., Sears W.C., Orsel K., Hutchins W., Godson D., Lindsay R., Dibernardo A., Campbell M., Kutz S.J. Blood collected on filter paper for wildlife serology: Evaluating storage and temperature challenges of field collections // J. Wildl. Dis. 2014. V. 50. № 2. P. 308. https://doi.org/10.7589/2012-06-150
Van Berkel G.J., Pasilis S.P., Ovchinnikova O. Established and emerging atmospheric pressure sur-face sampling/ionization techniques for mass spectrometry // J. Mass Spectrom. 2008. V. 43. № 9. P. 1161. https://doi.org/10.1002/jms.1440
Chace D.H. Mass spectrometry in newborn and metabolic screening: Historical perspective and future directions // J. Mass Spectrom. 2009. V. 44. № 2. P. 163. https://doi.org/10.1002/jms.1528
Hernandes V.V., Barbas C., Dudzik D. A review of blood sample handling and pre-processing for metabolomics studies // Electrophoresis. 2017. V. 18. P. 2232. https://doi.org/10.1002/elps.201700086
Meesters R.J., Zhang J., van Huizen N.A., Hooff G.P., Gruters R.A., Luider T.M. Dried matrix on paper disks: The next generation DBS microsampling technique for managing the hematocrit effect in DBS analysis // Bioanalysis. 2012. V. 4. № 16. P. 2027. https://doi.org/10.4155/bio.12.175
Meesters R.J., Hooff G.P., Gruters R., van Kampen J.J., Luider T.M. Incurred sample reanalysis comparison of dried blood spots and plasma samples on the measurement of lopinavir in clinical samples // Bioanalysis. 2012. V. 4. № 3. P. 237. https://doi.org/10.4155/bio.11.328
Kehler J.R., Bowen C.L., Boram S.L., Evans C.A. Application of DBS for quantitative assessment of the peptide Exendin-4; comparison of plasma and DBS method by UHPLC-MS/MS. // Bioanalysis. 2010. V. 2. № 8. P. 1461. https://doi.org/10.4155/bio.10.108
Randriamparany T., Kouako, K.V., Michaud V., Fernández-Pinero J., Gallardo C., Le Potier M.F., Rabenarivahiny R., Couacy-Hymann E., Raherimandimby M., Albina E. African swine fever diagnosis adapted to tropical conditions by the use of dried-blood filter papers // Transbound. Emerg. Dis. 2016. V. 63. № 4. P. 379. https://doi.org/10.1111/tbed.12295
Sharma R., Parker S., Al-Adhami B., Bachand N., Jenkins E. Comparison of tissues (heart vs. brain) and serological tests (MAT, ELISA and IFAT) for detection of Toxoplasma gondii in naturally infected wolverines (Gulo gulo) from the Yukon, Canada // Food Waterborne Parasitol. 2019. V. 15. Article e00046. https://doi.org/10.1016/j.fawpar.2019.e00046
Strnadová K.A., Holub M., Mühl A., Heinze G., Ratschmann R., Mascher H., Stöckler-Ipsiroglu S., Waldhauser F., Votava F., Lebl J., Bodamer O.A. Long-term stability of amino acids and acylcarnitines in dried blood spots // Clin. Chem. 2007. V. 53. № 4. P. 717. https://doi.org/10.1373/clinchem.2006.076679
Fingerhut R., Ensenauer R., Röschinger W., Arnecke R., Olgemöller B., Roscher A.A. Stability of acylcarnitines and free carnitine in dried blood samples: Implications for retrospective diagnosis of inborn errors of metabolism and neonatal screening for carnitine transporter deficiency // Anal. Chem. 2009. V. 81. № 9. P. 3571. https://doi.org/10.1021/ac8022235
Michaud V., Gil P., Kwiatek O., Prome S., Dixon L., Romero L., Le Potier M.F., Arias M., Couacy-Hymann E., Roger F., Libeau G., Albina E. Long-term storage at tropical temperature of dried-blood filter papers for detection and genotyping of RNA and DNA viruses by direct PCR // J. Virol. Methods. 2007. V. 146. № 1–2. P. 257. https://doi.org/10.1016/j.jviromet.2007.07.006
Madhanmohan M., Yuvaraj S., Manikumar K., Kumar R., Nagendrakumar S.B., Rana S.K., Srinivasan V.A. Evaluation of the flinders technology associates cards for storage and temperature challenges in field conditions for foot-and-mouth disease virus surveillance // Transbound. Emerg. Dis. 2016. V. 63. P. 675. https://doi.org/10.1111/ tbed.12316
Alfazil A.A., Anderson R.A. Stability of benzodiazepines and cocaine in blood spots stored on filter paper // J. Anal. Toxicol. 2008. V. 32. № 7. P. 511. https://doi.org/10.1093/jat/32.7.511
Prieto J.A., Andrade F., Lage S., Aldámiz-Echevarría L. Comparison of plasma and dry blood spots as samples for the determination of nitisinone (NTBC) by high-performance liquid chromatography-tandem mass spectrometry. Study of the stability of the samples at different temperatures // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2011. V. 879. № 11–12. P. 671. https://doi.org/10.1016/j.jchromb.2011.01.031
De Kesel P.M., Sadones N., Capiau S., Lambert W.E., Stove C.P. Hemato-critical issues in quantitative analysis of dried blood spots: Challenges and solutions // Bioanalysis. 2013. V. 5. № 16. P. 2023. https://doi.org/10.4155/bio.13.156
Adam B.W., Alexander J.R., Smith S.J., Chace D.H., Loeber J.G., Elvers L.H., Hannon W.H. Recoveries of phenylalanine from two sets of dried blood spot reference materials: prediction from hematocrit, spot volume, and paper matrix // Clin. Chem. 2000. V. 46. № 1. P. 126. https://doi.org/10.1093/clinchem/46.1.126
Koster R.A., Botma R., Greijdanus B., Uges D.R.A., Kosterink J.G.W., Touw D.J., Alffenaar J.W.C. The performance of five different dried blood spot cards for the analysis of six immunosuppressants // Bioanalysis. 2015. V. 7. № 10. P. 1225. https://doi.org/10.4155/bio.15.63
Beaudette P., Bateman K.P. CIRRIG: Weather-based irrigation management program for container nurseries // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2004. № 809. P. 153. https://doi.org/10.21273/HORTTECH.25.4.528
Pandya H.C., Spooner N., Mulla H. Dried blood spots, pharmacokinetic studies and better medicines for children // Bioanalysis. 2011. V. 3. № 7. P. 779. https://doi.org/10.4155/bio.11.19
Denniff P., Spooner N. The effect of hematocrit on assay bias when using DBS samples for the quantitative bioanalysis of drugs // Bioanalysis. 2010. V. 2. № 8. P. 1385. https://doi.org/10.4155/bio.10.103
Spooner N., Lad R., Barfield M. Dried blood spots as a sample collection technique for the determination of pharmacokinetics in clinical studies: Considerations for the validation of a quantitative bioanalytical method // Anal. Chem. 2009. V. 81. № 4. P. 1557. https://doi.org/10.1021/ac8022839
Liang X., Li Y., Barfield M., Ji Q.C. Study of dried blood spots technique for the determination of dextromethorphan and its metabolite dextrorphan in human whole blood by LC-MS/MS // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2009. V. 877. № 8–9. P. 799. https://doi.org/10.1016/j.jchromb.2009.02.015
Holub M., Tuschl K., Ratschmann R., Strnadová K.A., Mühl A., Heinze G., Sperl W., Bodamer O.A. Influence of hematocrit and localisation of punch in dried blood spots on levels of amino acids and acylcarnitines measured by tandem mass spectrometry // Clin. Chim. Acta. 2006. V. 373. № 1–2. P. 27. https://doi.org/10.1016/j.cca.2006.04.013
Zheng N., Yuan L., Ji Q.C., Mangus H., Song Y., Frost C., Zeng J., Aubry A.F., Arnold M.E. “Center punch” and “whole spot” bioanalysis of apixaban in human dried blood spot samples by UHPLC-MS/MS // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2015. V. 988. P. 66. https://doi.org/10.1016/j.jchromb.2015.02.023
Ren X., Paehler T., Zimmer M., Guo Z., Zane P., Emmons G.T. Impact of various factors on radioactivity distribution in different DBS papers // Bioanalysis. 2010. V. 2. № 8. P. 1469. https://doi.org/10.4155/bio.10.96
O’Mara M., Hudson-Curtis B., Olson K., Yueh Y., Dunn J., Spooner N. The effect of hematocrit and punch location on assay bias during quantitative bioanalysis of dried blood spot samples // Bioanalysis. 2011. V. 3. № 20. P. 2335. https://doi.org/10.4155/bio.11.220
Youhnovski N., Bergeron A., Furtado M., Garofolo F. Pre-cut Dried Blood Spot (PCDBS): An alternative to dried blood spot (DBS) technique to overcome hematocrit impact // Rapid Commun. Mass Spectrom. 2011. V. 25. № 19. P. 2951. https://doi.org/10.1002/rcm.5182
Li F., Zulkoski J., Fast D., Michael S. Perforated dried blood spots: A novel format for accurate microsampling // Bioanalysis. 2011. V. 3. № 20. P. 2321. https://doi.org/10.4155/bio.11.219
Li F., Ploch S., Fast D., Michael S. Perforated dried blood spot accurate microsampling: The concept and its applications in toxicokinetic sample collection. // J. Mass Spectrom. 2012. V. 47. № 5. P. 655. https://doi.org/10.1002/jms.3015
Capiau S., Stove V.V., Lambert W.E., Stove C.P. Prediction of the hematocrit of dried blood spots via potassium measurement on a routine clinical chemistry analyzer // Anal. Chem. 2013. V. 85. № 1. P. 404. https://doi.org/10.1021/ac303014b
Miller IV J.H., Poston P.A., Rutan S.C., Thomas K.H. An on-card approach for assessment of hematocrit on dried blood spots which allows for correction of sample volume // J. Anal. Bioanal. Tech. 2013. V. 4. № 1. P. 1. https://doi.org/10.4172/2155-9872.1000162
Luginbühl M., Fischer Y., Gaugler S. Fully automated optical hematocrit measurement from dried blood spots // J. Anal. Toxicol. 2020. Article bkaa189. https://doi.org/10.1093/jat/bkaa189
Li Y., Henion J., Abbott R., Wang P. The use of a membrane filtration device to form dried plasma spots for the quantitative determination of guanfacine in whole blood // Rapid Commun. Mass Spectrom. 2012. V. 26. № 10. P. 1208. https://doi.org/10.1002/rcm.6212
Velghe S., Delahaye L., Stove C.P. Is the hematocrit still an issue in quantitative dried blood spot analysis? // J. Pharm. Biomed. Anal. 2019. V. 163. P. 188. https://doi.org/10.1016/j.jpba.2018.10.010
Li W., Doherty J.P., Kulmatycki K., Smith H.T., Tse F.L. Simultaneous LC-MS/MS quantitation of acetaminophen and its glucuronide and sulfate metabolites in human dried blood spot samples collected by subjects in a pilot clinical study // Bioanalysis. 2012. V. 4. № 12. P. 1429. https://doi.org/10.4155/bio.12.119
Lawson G., Cocks E., Tanna S. Quantitative determination of atenolol in dried blood spot samples by LC-HRMS: A potential method for assessing medication adherence // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2012. V. 897. P. 72. https://doi.org/10.1016/j.jchromb.2012.04.013
Delahaye L., Veenhof H., Koch B.C.P., Alffenaar J.C., Linden R., Stove C. Alternative sampling devices to collect dried blood microsamples: State-of-the-art // Ther. Drug. Monit. 2021. V. 43. № 3. P. 310. https://doi.org/10.1097/FTD.0000000000000864
Rosypal A.C., Pick L.D., Hernandez J.O.E., Lindsay D.S. Evaluation of a novel dried blood spot collection device (HemaSpotTM) to test blood samples collected from dogs for antibodies to Leishmania infantum // Vet. Parasitol. 2014. V. 205. № 1–2. P. 338. https://doi.org/10.1016/j.vetpar.2014.07.031
Denniff P., Spooner N. Volumetric absorptive microsampling: A dried sample collection technique for quantitative bioanalysis // Anal. Chem. 2014. V. 86. № 16. P. 8489. https://doi.org/10.1021/ac5022562
Kip A.E., Kiers K.C., Rosing H., Schellens J.H.M., Beijnen J.H., Dorlo T.P.C. Volumetric absorptive microsampling (VAMS) as an alternative to conventional dried blood spots in the quantification of miltefosine in dried blood samples // J. Pharm. Biomed. Anal. 2017. V. 135. P. 160. https://doi.org/10.1016/j.jpba.2016.12.012
Leuthold L.A., Heudi O., Déglon J., Raccuglia M., Augsburger M., Picard F., Kretz O., Thomas A. New microfluidic-based sampling procedure for overcoming the hematocrit problem associated with dried blood spot analysis // Anal. Chem. 2015. V. 8. № 4. P. 2068. https://doi.org/10.1021/ac503931g
Neto R., Gooley A., Breadmore M.C., Hilder E.F., Lapierre F. Precise, accurate and user - independent blood collection system for dried blood spot sample preparation // Anal. Bioanal. Chem. 2018. V. 410. № 14. P. 3315. https://doi.org/10.1007/s00216-018-0993-y
Polley S.D., Bell D., Oliver J., Tully F., Perkins M.D., Chiodini P.L., Gonzalez I.J. The design and evaluation of a shaped filter collection device to sample and store defined volume dried blood spots from finger pricks // Malar. J. 2015. V. 14. № 1. P. 1. https://doi.org/10.1186/s12936-015-0558-x
Nobuto K. Toxoplasmosis in animal and laboratory diagnosis // Jpn. Agric. Res. Q. 1966. V. 1. № 3. P. 11.
Curry P.S., Ribble C., Sears W.C., Hutchins W., Orsel K., Godson D., Lindsay R., Dibernardo A., Kutz S.J. Blood collected on filter paper for wildlife serology: Detecting antibodies to Neospora Caninum, West Nile virus, and five bovine viruses in reindeer // J. Wildl. Dis. 2014. V. 50. № 2. P. 297. https://doi.org/10.7589/2012-02-047
Curry P.S., Elkin B.T., Campbell M., Nielsen K., Hutchins W., Ribble C., Kutz S.J. Filter-paper blood samples for Elisa detection of brucella antibodies in Caribou // J. Wildl. Dis. 2011. V. 47. № 1. P. 12. https://doi.org/10.7589/0090-3558-47.1.12
Jara R.F., Sepúlveda C., Ip H.S., Samuel M.D. Total protein concentration and diagnostic test results for gray wolf (Canis lupus) serum using Nobuto filter paper strips // J. Wildl. Dis. 2015. V. 51. № 2. P. 475. https://doi.org/10.7589/2013-07-185
Nemeth N.M., Bosco-Lauth A.M., Williams L.M., Bowen R.A., Brown J.D. West nile virus infection in ruffed grouse (Bonasa umbellus): Experimental infection and protective effects of vaccination // Vet. Pathol. 2017. V. 54. № 6. P. 901. https://doi.org/10.1177/0300985817717770
Саушкин Н.Ю. Аналитические системы на основе технологии сухих пятен крови и высокопористых мембранных носителей для целей ветеринарной диагностики. Дис. … канд. хим. наук. Москва: МГУ им. М.В. Ломоносова, 2019. 174 с.
Осипов А.П., Кондаков С.Э., Григоренко В.Г., Смоленский В.И., Прокопцева О.С., Самсонова Ж.В. Устройство для получения, хранения и транспортировки сухих образцов жидкостных объектов, предназначенных для последующего проведения лабораторного анализа. Патент РФ № 2519030. Заявка 2013102274/15 от 18.01.2013, опубл. 15.07.2014.
Samsonova J.V., Chadina A.D., Osipov A.P., Kondakov S.E. Porous membrane strip microsampling: a dried biofluid collection format and application for quantitative enzyme immunoassay // Anal. Methods. 2016 V. 8. P. 4835. https://doi.org/10.1039/C6AY00724D
Samsonova J.V., Osipov A.P., Kondakov S.E. Strip-dried whole milk sampling technique for progesterone detection in cows by ELISA // Talanta. 2017. V. 175. P. 143. https://doi.org/10.1016/j.talanta.2017.07.032
Samsonova J.V., Osipov A.P., Kondakov S.E. A new dried milk sampling technique and its application for progesterone detection in cows // Vet. J. 2014. V. 199. № 3. P. 471. https://doi.org/10.1016/j.tvjl.2013.10.031
Samsonova J.V., Saushkin N.Yu., Osipov A.P., Kondakov S.E., Fomina S.N., Mischenko A.V. Detection of antibodies against foot-and-mouth disease virus serotypes A, O and Asia-1 by ELISA in strip-dried samples from vaccinated bovines // Appl. Biochem. Biotechnol. 2019. V. 188. P. 491. https://doi.org/10.1007/s12010-018-02938-3
Saushkin N.Yu., Samsonova J.V., Osipov A.P., Kondakov S.E. Strip-dried blood sampling: applicability for bovine leukemia virus detection with ELISA and real-time PCR // J. Virol. Methods. 2019. V. 263. P. 101. https://doi.org/10.1016/j.jviromet.2018.11.004
Саушкин Н.Ю., Самсонова Ж.В., Осипов А.П., Кондаков С.Э., Лысова Е.С., Елизарова И.А., Хаертынов К.С., Шуралев Э.А. Использование стрипованных образцов биологических жидкостей для определения специфических антител у инфицированного мелкого рогатого скота // Вестн. Моск. ун-та. Серия 2. Химия. 2018. Т. 59. № 3. С. 235. (Saushkin N.Yu, Samsonova J.V., Osipov A.P., Kondakov S.E., Lysova E.S., Elizarova I.A., Khaertynov K.S., Shuralev E.A. Strip-dried biofluids for the detection of specific antibodies in small, infected ruminants // Moscow Univ. Chem. Bull. 2018. V. 73. № 3. P. 135. ).https://doi.org/10.3103/S0027131418030069
Чвала И.А., Мищенко А.В., Лозовой Д.А., Саушкин Н.Ю., Самсонова Ж.В., Кондаков С.Э., Осипов А.П., Кузнецов Д.В., Черных О.Ю. Контроль эффективности иммунизации птиц против гриппа А/Н5 с использованием технологии сухих пятен крови // Ветеринария. 2018. № 2. С. 24.
Саушкин Н.Ю., Самсонова Ж.В., Осипов А.П., Кондаков С.Э., Ефимова М.А., Чернов А.Н. Диагностика инфекционных заболеваний крупного рогатого скота методом иммуноферментного анализа в сухих пятнах крови с использованием нового формата пробоподготовки // Вестн. Моск. ун-та. Серия 2: Химия. 2016. Т. 57 № 4. С. 263. (Saushkin N.U., Samsonova J.V., Osipov A.P., Kondakov S.E., Efimova M.A., Chernov A.N. A new sampling format for the diagnostics of bovine infectious diseases in dried blood spots by ELISA // Moscow Univ. Chem. Bull. 2016. V. 71. № 4. P. 253. )https://doi.org/10.3103/S0027131416040088
Саушкин Н.Ю., Самсонова Ж.В., Осипов А.П., Кондаков С.Э., Хаммадов Н.И., Усольцев К.В., Макаев Х.З., Чернов А.Н. Сравнение методов ПЦР и ИФА для определения лейкоза крупного рогатого скота с использованием сухих пятен крови // Вестн. Моск. ун-та. Серия 2: Химия. 2016. Т. 57. № 5. С. 41. (Saushkin N.U., Samsonova J.V., Osipov A.P., Kondakov S.E., Khammadov N.I., Usoltsev K.V., Makaev Kh Z., Chernov A.N. Comparison of PCR and ELISA methods for the detection of bovine leucosis in dried blood spots // Moscow Univ. Chem. Bull. 2016. V. 71. № 5–6. P. 319. )https://doi.org/10.3103/S0027131416050084
Самсонова Ж.В., Саушкин Н.Ю., Осипов А.П., Яковлев С.С., Рождественская Т.Н. Сухие образцы крови для транспортировки и анализа при контроле поствакцинального иммунитета птицы // Птица и птицепродукты. 2019. № 5. С. 48.
Саушкин Н.Ю., Самсонова Ж.В., Осипов А.П., Серебренникова К.В. Набор для получения, хранения и транспортировки сухих образцов крови или сыворотки крови птиц для контроля эффективности вакцинации. Патент РФ № 2706405. Заявка 2018143019 от 05.12.2018, опубл. 18.11.2019.
Trifonova O.P., Maslov D.L., Balashova E.E., Lokhov P.G. Evaluation of dried blood spot sampling for clinical metabolomics: Effects of different papers and sample storage stability // Metabolites. 2019. V. 9. № 11. P. 277. https://doi.org/10.3390/metabo9110277
Bhuiyan A.R., Chowdhury E.H., Kwiatek O., Parvin R., Rahman M.M., Islam M.R., Albina E., Libeau G. Dried fluid spots for peste des petits ruminants virus load evaluation allowing for non-invasive diagnosis and genotyping // BMC Vet. Res. 2014. V. 10. 247. https://doi.org/10.1186/s12917-014-0247-y
McDade T.W., Williams S.A., Snodgrass J.J. What a drop can do: Dried blood spots as a minimally invasive method for integrating biomarkers into population-based research // Demography. 2007. V. 44. № 4. P. 899. https://doi.org/10.1353/dem.2007.0038
Lange B., Roberts T., Cohn J., Greenman J., Camp J., Ishizaki A., Messac L., Tuaillon E., van de Perre P., Pichler C., Denkinger C.M., Easterbrook P. Diagnostic accuracy of detection and quantification of HBV-DNA and HCV-RNA using dried blood spot (DBS) samples - A systematic review and meta-analysis // BMC Infect. Dis. 2017. V. 17 (Suppl 1). P. 693. https://doi.org/10.1186/s12879-017-2776-z
Rowland M., Emmons G.T. Use of dried blood spots in drug development: Pharmacokinetic considerations // AAPS J. 2010. V. 12. № 3. P. 290. https://doi.org/10.1208/s12248-010-9188-y
Henion J., Oliveira R. V., Chace D.H. Microsample analyses via DBS: Challenges and opportunities // Bioanalysis. 2013. V. 5. № 20. P. 2547. https://doi.org/10.4155/bio.13.197
Marca G. la, Malvagia S., Pasquini E., Innocenti M., Fernandez M.R., Donati M.A., Zammarchi E. The inclusion of succinylacetone as marker for tyrosinemia type I in expanded newborn screening programs // Hell. J. Nucl. Med. 2008. V. 22. P. 812. https://doi.org/10.1002/rcm.3428
Blau N. Genetics of phenylketonuria: Then and now // Hum. Mutat. 2016. V. 37. № 6. P. 508. https://doi.org/10.1002/humu.22980
Karstad L., Spalatin J., Hanson R.P. Application of the paper disc technique to the collection of whole blood and serum samples in studies on eastern equine encephalomyelitis // J. Infect. Dis. 1957. V. 101. № 3. P. 295.
Lehner A.F., Rumbeiha W., Shlosberg A., Stuart K., Johnson M., Domenech R., Langner H. Diagnostic analysis of veterinary dried blood spots for toxic heavy metals exposure // J. Anal. Toxicol. 2013. V. 37. № 7. P. 406. https://doi.org/10.1093/jat/bkt048
Shlosberg A., Rumbeiha W.K., Lublin A., Kannan K. A database of avian blood spot examinations for exposure of wild birds to environmental toxicants: The DABSE biomonitoring project // J. Environ. Monit. 2011. V. 13. № 6. P. 1547. https://doi.org/10.1039/C0EM00754D
Shlosberg A., Wu Q., Rumbeiha W.K., Lehner A., Cuneah O., King R., Hatzofe O., Kannan K., Johnson M. Examination of eurasian griffon vultures (Gyps fulvus fulvus) in Israel for exposure to environmental toxicants using dried blood spots // Arch. Environ. Contam. Toxicol. 2012. V. 62. № 3. P. 502. https://doi.org/10.1007/s00244-011-9709-4
Lehner A.F., Johnson M., Buchweitz J. Veterinary utility of dried blood spots for analysis of toxic chlorinated hydrocarbons // Toxicol. Mech. Methods. 2017. V. 28. № 1. P. 29. https://doi.org/10.1080/15376516.2017.1354414
Perkins M., Basu N. Dried blood spots for estimating mercury exposure in birds // Environ. Pollut. 2018. V. 236. P. 236. https://doi.org/10.1016/j.envpol.2018.01.036
Posyniak A., Zmudzki J., Niedzielska J. Liquid chromatography analysis of enrofloxacin and ciprofloxacin in chicken blood spotted on filter-paper disks // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2002. V. 780. № 2. P. 309. https://doi.org/10.1016/S1570-0232(02)00540-8
Ahmed H.A., Picozzi K., Welburn S.C., MacLeod E.T. A comparative evaluation of PCR- based methods for species- specific determination of African animal trypanosomes in Ugandan cattle // Parasit. Vectors. 2013. V. 6. № 1. P. 316. https://doi.org/10.1186/1756-3305-6-316
Adams E.R., Hamilton P.B., Malele I.I., Gibson W.C. The identification, diversity and prevalence of trypanosomes in field caught tsetse in Tanzania using ITS-1 primers and fluorescent fragment length barcoding // Infect. Genet. Evol. 2008. V. 8. № 4. P. 439. https://doi.org/10.1016/j.meegid.2007.07.013
Hall-Mendelin S., Ritchie S.A., Johansen C.A., Zborowski P., Cortis G., Dandridge S., Hall R.A., Van den Hurk A.F. Exploiting mosquito sugar feeding to detect mosquito-borne pathogens // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 11255. https://doi.org/10.1073/pnas.1002040107
Brito C.M., Lima M.M., Sarquis O., Pires M.Q., Coutinho C.F., Duarte R., Pacheco R.S. Genetic polymorphism in Trypanosoma cruzi I isolated from Brazilian Northeast triatomines revealed by low-stringency single specific primer-polymerase chain reaction // Parasitol. Res. 2008. V. 103. № 5. P. 1111. https://doi.org/10.1007/s00436-008-1102-5
Hopkins J.S., Chitambo H., Machila N., Luckins A.G., Rae P.F., Van Den Bossche P., Eisler M.C. Adaptation and validation of antibody-ELISA using dried blood spots on filter paper for epidemiological surveys of tsetse-transmitted trypanosomosis in cattle // Prev. Vet. Med. 1998. V. 37. № 1–4. P. 91. https://doi.org/10.1016/S0167-5877(98)00101-9
Rasolonjatovo F.S., Guis H., Rajeev M., Dacheux L., Arivony Nomenjanahary L., Razafitrimo G., Rafisandrantantsoa J.T., Cêtre-Sossah C., Heraud J.M., Andriamandimby S.F. Enabling animal rabies diagnostic in low-access areas: Sensitivity and specificity of a molecular diagnostic test from cerebral tissue dried on filter paper // PLoS Negl. Trop. Dis. 2020. V. 14. № 3. Article e0008116. https://doi.org/10.1371/journal.pntd.0008116
Foss L., Reisen W., Fang Y., Kramer V., Padgett K. Evaluation of nucleic acid preservation cards for West Nile virus testing in dead birds // PLOS One. 2016. V. 11. Article e0157555. https://doi.org/10.1371/journal.pone.0157555
Al-Kappany Y.M., Abbas I.E., Devleesschauwer B., Dorny P., Jennes M., Cox E. Seroprevalence of anti-Toxoplasma gondii antibodies in Egyptian sheep and goats // BMC Vet. Res. 2018. V. 14. № 1. P. 120. https://doi.org/10.1186/s12917-018-1440-1
Jefferies R., Ryan U.M., Irwin P.J. PCR-RFLP for the detection and differentiation of the canine piroplasm species and its use with filter paper-based technologies // Vet. Parasitol. 2007. V. 144. № 1–2. P. 20. https://doi.org/10.1016/j.vetpar.2006.09.022
Pedersen L., Andersen-Ranberg K., Hollergaard M., Nybo M. Quantification of multiple elements in dried blood spot samples // Clin. Biochem. 2017. V. 50. № 12. P. 703. https://doi.org/10.1016/j.clinbiochem.2017.01.010
Liu G., Mühlhäusler B.S., Gibson R.A. A method for long term stabilisation of long chain polyunsaturated fatty acids in dried blood spots and its clinical application // Prostaglandins Leukot. Essent. Fatty Acids. 2014. V. 91. № 6. P. 251. https://doi.org/10.1016/j.plefa.2014.09.009
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии