Журнал аналитической химии, 2022, T. 77, № 4, стр. 343-353
Ацетилхолинэстеразный сенсор на основе композита пиллар[6]арена и наночастиц серебра для определения лекарственных препаратов для лечения болезни альцгеймера
Р. В. Шамагсумова a, *, А. В. Васюк a, Д. Н. Шурпик a, В. Г. Евтюгин a, И. И. Стойков a, Г. А. Евтюгин a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: rezeda84190@mail.ru
Поступила в редакцию 19.08.2021
После доработки 11.10.2021
Принята к публикации 12.10.2021
- EDN: NVXMPE
- DOI: 10.31857/S0044450222040132
Аннотация
Разработан вольтамперометрический сенсор на основе стеклоуглеродного электрода, модифицированного углеродной чернью, пиллар[6]ареном и наночастицами серебра, для определения обратимых ингибиторов ацетилхолинэстеразы, используемых при лечении болезни Альцгеймера и других нейродегенеративных заболеваний. Наночастицы серебра формируются непосредственно в слое за счет восстановления ионов серебра гидрохиноновыми фрагментами макроцикла. Их образование подтверждено трансмиссионной электронной микроскопией. Фермент иммобилизовали поверх модифицирующего слоя с помощью карбодиимидного связывания. Установлены электрохимические характеристики компонентов покрытия. Определена зависимость токов пика окисления макроцикла и наночастиц серебра от способа формирования поверхностного слоя. Показано, что ток пика окисления пилларарена меняется при добавлении ацетилтиохолина в силу его включения в окисление продукта ферментативного гидролиза субстрата. В присутствии донепезила, гуперзина А, берберина и галантамина скорость ферментативной реакции снижается. Изменение тока окисления, измеряемого в хроноамперометрическом режиме, зависит от концентрации ингибитора. Градуировочная зависимость для определения ингибиторов имеет сигмоидный характер и аппроксимируется логистической функцией. Пределы обнаружения, оцениваемые по концентрации, отвечающей 15%-ному ингибированию, составили для гуперзина А 1.2 нМ, галантамина 12.5 нМ, донепезила 2.5 нМ и берберина 10 нМ. Разработанный биосенсор апробирован при определении остаточных содержаний галантамина в искусственной урине.
Электрохимические ферментные биосенсоры находят применение при определении широкого круга соединений, используемых в качестве лекарственных препаратов, химических средств защиты растений, пищевых добавок, а также относящихся к метаболитам и биомаркерам заболеваний [1–3]. Значительная их часть выступает в качестве субстратов ферментативных реакций. Так, глюкоза окисляется до глюконолактона в присутствии глюкозооксидазы [4], а молочная кислота до пировиноградной – в присутствии лактатоксидазы [5]. Такие биосенсоры отличаются высокой специфичностью отклика, однако обеспечивают относительно низкую чувствительность определения аналитов. Альтернативой выступают биосенсоры, в которых определяемые вещества ингибируют целевую реакцию субстрата, снижая ферментативную активность [6, 7]. В этом случае определяемые концентрации могут находиться в нано- и даже пикомолярном диапазоне, что имеет значение при определении токсинов и остаточных количеств лекарственных препаратов [8–10]. Среди многочисленных компонентов таких биосенсоров наиболее известным и перспективным является фермент ацетилхолинэстераза (АХЭ, КФ 3.1.1.7) [11–13]. Он играет ключевую роль в переносе нервного импульса в синаптической щели, разделяющей окончания аксонов, благодаря быстрому и селективному гидролизу природного нейротрансмиттера – ацетилхолина. Снижение активности АХЭ влечет за собой мышечные судороги, миоз зрачка, нарушение сердечной деятельности, при тяжелых поражениях – летальный исход. Вещества нервнопаралитического действия, разработанные как химическое оружие, относятся к сильным необратимым ингибиторам АХЭ [12, 14].
После запрещения химического оружия фокус применения АХЭ сместился в сторону определения фосфорорганических и карбаминатных пестицидов, а в последнее время – лекарственных препаратов миорелаксантного действия, применяемых в офтальмологии [15], и лекарств против нейродегенеративных заболеваний, таких как болезнь Альцгеймера и старческая деменция [16]. В настоящее время терапия подобных заболеваний направлена на купирование основных симптомов путем компенсации снижения уровня ацетилхолина. Для этого применяют обратимые ингибиторы АХЭ, как правило, включающие в свой состав катионные или способные к протонированию центры, имитирующие триметиламмонийную группу природного субстрата – ацетилхолина. Взаимодействие таких препаратов с активным центром фермента снижает его доступность для взаимодействия с субстратом и тем самым снижает скорость ферментативной реакции.
Основное методическое отличие функционирования биосенсоров на основе АХЭ для определения необратимых и обратимых ингибиторов состоит в том, что в последнем случае измерение сигнала происходит в присутствии и субстрата, и ингибитора. Это снижает определяемые концентрации обратимых ингибиторов по сравнению с сильными необратимыми ингибиторами, а также ужесточает требования к устойчивости сигнала во времени и его воспроизводимости в серии измерений.
С учетом указанных особенностей возрастает внимание к совершенствованию конструкции биосенсоров с иммобилизованной АХЭ, которые должны обеспечивать высокую стабильность сигнала и чувствительность его регистрации. Ранее нами исследованы условия определения обратимых ингибиторов АХЭ, применявшихся в качестве лекарственных препаратов для лечения болезни Альцгеймера, с использованием методов физической иммобилизации фермента и традиционного в подобных биосенсорах медиатора электронного переноса фталоцианина кобальта в качестве модификатора [17–19].
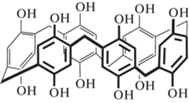
В данной работе мы впервые использовали с той же целью новый перспективный медиатор – композит пиллар[6]арена с наночастицами серебра. Необходимость применения медиатора электронного переноса обусловлена большим перенапряжением окисления тиохолина. Данный продукт образуется при ферментативном гидролизе тиоаналога ацетилхолина и часто используется для вольтамперометрической и амперометрической регистрации сигнала биосенсора. Пиллар [6]арен – макроциклическое производное гидрохинона, в котором шесть его фрагментов соединены мостиковыми метиленовыми группами в мета-положении (схема 1 ) [20].
Схема 1 . Структурная формула пиллар[6]арена.
Электрохимическая активность пиллар[n]аренов связана с обратимым окислением–восстановлением фрагментов гидрохинона, а реакционная способность в значительной степени зависит от внутримолекулярных водородных связей между соседними гидроксильными группами обоих ободов макроцикла. Включение наночастиц серебра, образующихся за счет химического восстановления ионов серебра пиллар[6]ареном, является перспективным приемом повышения эффективности медиаторного переноса электрона за счет способности металла к взаимодействию с тиольными группами органических соединений. Поскольку тиохолин при этом может дополнительно накапливаться в приэлектродном слое, использование такого композита может повысить чувствительность биосенсора в отношении ацетилтиохолина и ингибиторов фермента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
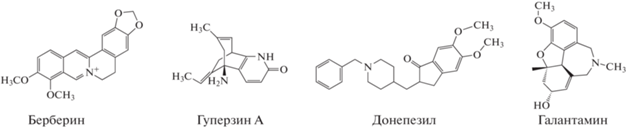
Реагенты. Использовали АХЭ из электрического угря (156 Е/мг препарата или 224 Е/мг белка), углеродную чернь (N220, IMERIS, Бельгия), ацетилтиохолин хлорид, 2-(N-морфолино)этансульфоновую кислоту (МЭС), N-гидроксисукцинимид (N-ГС), N-(3-диметиламинопропил)-N-этилкарбодиимида хлорид (ЭДХ), хлорид берберина, гидрохлорид донепезила, гуперзин А, гидробромид галантамина (Sigma-Aldrich, США) (схема 2 ).
Схема 2 . Структурные формулы обратимых ингибиторов ацетилхолинэстеразы.
Другие реагенты категории ч.д.а. и analytical grade использовали без дополнительной очистки. Буферные растворы и растворы реагентов для электрохимических измерений готовили на деионизованной воде (Millipore-Q, Франция). Концентрированные растворы АХЭ и ацетилтиохолина хранили в замороженном виде при –20°С и разводили до рабочей концентрации непосредственно перед использованием. Искусственную урину готовили путем растворения точных навесок компонентов, конечные концентрации составили 0.02 М KCl, 0.049 M NaCl, 0.015 KH2PO4, 0.01 M CaCl2, 0.018 M NH4Cl и 0.018 M мочевины.
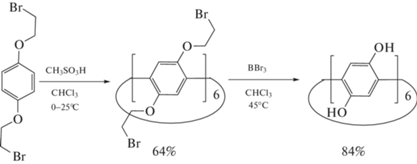
Пиллар[6]арен синтезировали на кафедре органической и медицинской химии Казанского федерального университета по модифицированной методике [21]. Кратко, для этого проводили циклизацию 1,4-бис(2-бромэтокси)бензола в присутствии метансульфоновой кислоты в хлороформе сначала при 0°С, затем при 35°С. Продукт обрабатывали BBr3 для освобождения гидроксидных групп (схема 3 ). Структуру пиллар[6]арена подтверждали данными 1H, 13C ЯМР-спектроскопии и MALDI-TOF масс-спектроскопии. Синтезированный пиллар[6]арен хранили в атмосфере аргона при –20°С.
Схема 3 . Общая схема синтеза пиллар[6]арена.
Микроизображения с помощью трансмиссионной электронной микроскопии получали с помощью микроскопа Hitachi HT7700 Exalens (Япо-ния) при напряжении 120 кэВ. Смесь пиллар[6]арена и нитрата серебра наносили на медную сетку 3 мм 200 меш, покрытую формваром и углеродом.
Вольтамперометрические измерения проводили в трехэлектродной ячейке в режиме постояннотоковой вольтамперометрии и хроноамперометрии с помощью потенциостата-гальваностата AUTOLAB PGSTAT 302N (Metrohm Autolab, Нидерланды). В качестве рабочих электродов использовали стеклоуглеродный электрод (СУЭ) из стержней СУ2000 диаметром 1.7 мм (НИИГрафит, Москва) в оболочке из политетрафторэтилена со стальным токосъемником. Противоэлектродом служила платиновая проволока, электродом сравнения – хлоридсеребряный электрод (Ag/AgCl/3.0 М KCl; Metrohm AG, Швейцария). Измерения проводили в нетермостатированной трехэлектродной ячейке объемом 5 мл.
Модификация стеклоуглеродного электрода. Перед нанесением модифицирующего покрытия СУЭ механически полировали, промывали ацетоном, этанолом и деионизованной водой. После этого проводили циклирование его потенциала в 0.1 М фосфатном буферном растворе, содержащем 0.1 М Na2SO4, в течение 10 мин или до постоянства токов в интервале потенциалов от –1.0 до 1.0 В (приблизительно 10 циклов). Для нанесения суспензии углеродной черни электрод подсушивали на воздухе при комнатной температуре и закрепляли в штативе рабочей поверхностью вверх. Суспензию углеродной черни готовили, добавляя ее точную навеску в диметилформамид из расчета 1 мг/мл, с последующей ультразвуковой обработкой в течение 30 мин. Далее 3 мкл суспензии наносили на электрод и высушивали при 60°С в течение 20 мин. Затем на слой углеродной черни капельно наносили 2 мкл 30 мкМ раствор пиллар[6]арена в этаноле и высушивали при комнатной температуре. После этого на ту же поверхность наносили 5 мкл 0.1 мМ раствора нитрата серебра, поверхность закрывали пластиковой пробиркой для предотвращения высыхания и оставляли на 10 мин. Поверхность электрода после этого промывали деионизованной водой. В ряде экспериментов нанесение растворов пиллар[6]арена и нитрата серебра повторяли 2–3 раза для увеличения концентрации наночастиц серебра в слое.
Иммобилизация ацетилхолинэстеразы. На поверхность СУЭ, модифицированного пиллар[6]ареном и наночастицами серебра, последовательно наносили 3 мкл раствора ЭДХ (3 мг/мл в 0.05 М МЭС, рН 5.5) и 3 мкл N-ГС (1 мг/мл в 0.05 М МЭС, рН 5.5). Электрод закрывали пластиковой пробиркой и оставляли на 30 мин. Далее поверхность промывали деионизованной водой и вносили 2 мкл раствора АХЭ (2.5–20 Е/мл в 0.005 М фосфатном буферном растворе с рН 7.2). После высушивания при комнатной температуре электроды промывали тем же фосфатным буферным раствором и хранили при необходимости при 4°С в сухом виде.
Измерение сигнала биосенсора проводили в измерительной ячейке, содержащей 5 мл 0.05 М фосфатного буферного раствора, в хроноамперометрическом режиме при 0–0.4 В. Регистрировали хроноамперограмму до и после введения в буферный раствор ацетилхолина (концентрация в ячейке 0.5 мМ). При определении концентрации ингибитора сначала регистрировали анодный ток в течение 200 с в присутствии 0.5 мМ ацетилтиохолина, далее в ячейку добавляли раствор ингибитора и продолжали регистрацию тока в течение еще 200 с. Степень ингибирования (I, %) рассчитывали, исходя из изменения тока:
где ΔI – изменение тока при введении в раствор ингибитора и I0 – анодный ток, отвечающий исходной концентрации субстрата в отсутствие ингибитора.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Условия получения композита пиллар[6]арена и наночастиц серебра. При модификации СУЭ, модифицированного углеродной чернью, пиллар[6]ареном и нитратом серебра на циклических вольтамперограммах наблюдали пики окисления–восстановления макроцикла и анодного окисления элементного серебра, образующегося в слое за счет восстановления ионов Ag+ гидрохиноновыми фрагментами пиллар[6]арена. Образование наночастиц серебра независимо подтвердили данными трансмиссионной электронной микроскопии (рис. 1). Как видно, наночастицы серебра равномерно распределены в пленке пиллар[6]арена, с которым они образуют высокопористые сетчатые структуры.
Рис. 1.
Микрофотографии, полученные из смеси пиллар[6]арена и нитрата серебра с помощью трансмиссионной микроскопии при 50 000-кратном увеличении.

Концентрации компонентов покрытия изменяли путем последовательного нанесения одинаковых аликвот растворов пиллар[6]арена и нитрата серебра (см. “Экспериментальную часть”). В целом вольтамперограммы имели сходный вид, однако токи растворения элементного серебра (острый необратимый пик при 0.3 В) выражены сильнее для покрытий, в которых последним слоем был AgNO3 (рис. 2).
Рис. 2.
Циклические вольтамперограммы, полученные на стеклоуглеродном электроде, покрытом углеродной чернью, пиллар[6]ареном (1) и композитами состава пиллар[6]арен–Ag–пиллар [6]арен (2), (пиллар[6]арен–Ag)2–пиллар[6]арен (3), (пиллар[6]арен–Ag)2 (4) и (пиллар[6]арен–Ag)3 (5). Измерения в 0.1 М растворе NaNO3, 100 мВ/с. Время инкубирования в 0.1 мМ растворе AgNO3 10 мин. Стрелки обозначают направление сканирования потенциала.
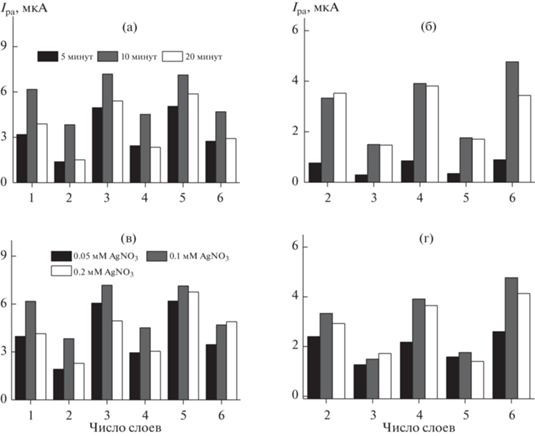
Исследовали влияние на сигналы на вольтамперограммах времени инкубирования электрода в растворе нитрата серебра и его концентрации при различном числе слоев реагентов (рис. 3). Из рисунка следует, что увеличение времени инкубирования приводит к регулярному возрастанию тока пика окисления наночастиц серебра, в то время как ток пика окисления пиллар[6]арена меняется менее регулярно с максимумом при времени инкубирования 10 мин. Последующее снижение тока пика может быть связано как с частичной инактивацией окисленных продуктов, склонных к хемосорбции, так и с увеличением сопротивления переноса заряда в слое. Оптимальная концентрация ионов серебра в процессе формирования поверхностного слоя составила 0.1 мМ. Ее увеличение снижает ток пика окисления пиллар[6]арена и слабо влияет на токи пика окисления самого серебра. Интересно отметить, что с формальной точки зрения увеличение количества макроцикла, участвующего в окислении ионов Ag+, должно снижать поверхностную концентрацию гидрохиноновых фрагментов, а значит, и токи их окисления на электроде. Противоположное влияние при промежуточной концентрации AgNO3 свидетельствует в пользу сложного механизма электродных реакций со взаимным влиянием обоих электрохимически активных компонентов слоя на процессы переноса заряда. Это подтверждается пилообразной зависимостью тока пика окисления пиллар[6]арена от природы внешнего слоя.
Рис. 3.
Зависимость тока пика окисления пиллар[6]арена (а, в) и наночастиц серебра (б, г) от числа слоев модификаторов при варьировании времени инкубирования электрода в 0.1 мМ растворе AgNO3 (а, б) и концентрации раствора AgNO3 при времени инкубирования 10 мин (в, г).
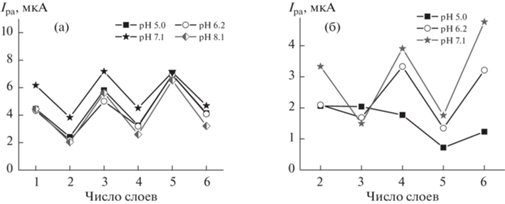
При последовательном добавлении к углеродной черни растворов пиллар[6]арена и нитрата серебра ток пика окисления макроцикла выше, когда он присутствует во внешнем слое, и снижается при нанесении в заключительной стадии модификации раствора AgNO3. При этом токи пика окисления пиллар[6]арена сохраняют постоянство в интервале рН 5.0–8.1 (рис. 4). Для пика окисления элементного серебра столь регулярного изменения тока пика при рН 5.0 не наблюдали, а при более высоких значениях рН изменения противоположны наблюдаемым для макроцикла: токи пика снижались для внешнего слоя покрытия из пиллар[6]арена и увеличивались при внешнем слое из наночастиц серебра. Необходимо отметить, что во всех вариантах модификации электрода частицы, участвующие в переносе электрона, находились на поверхности стеклоуглерода, но не в растворе, поэтому указанные изменения не могут быть связаны с диффузионным переносом окисляющейся формы реагента из раствора. По-видимому, можно говорить об эффективности восстановления ионов Ag+ и челночном механизме переноса электрона внутри многослойного покрытия, испытывающего влияние регулярности строения слоя пиллар[6]арена и наночастиц серебра. Поскольку условия регистрации микроснимков в трансмиссионной электронной микроскопии радикально отличались от условий регистрации вольт-амперных кривых (пиллар[6]арен и нитрат серебра смешивали в гомогенных условиях, после чего их смесь наносили на медную сетку и высушивали), сопоставление полученных результатов не позволило оценить регулярность распределения частиц серебра на поверхности СУЭ в слое углеродной черни.
Рис. 4.
Зависимость тока пика окисления пиллар[6]арена (а) и наночастиц серебра (б) от числа слоев модификаторов при варьировании рН. Измерения в 0.1 М растворе NaNO3, 100 мВ/с. Время инкубирования в 0.1 мМ растворе AgNO3 10 мин.
Условия измерения сигнала ацетилхолинэстеразы биосенсора. Исходя из полученных данных о влиянии состава поверхностного слоя на электрохимические характеристики, для последующей иммобилизации фермента использовали электрод, покрытый четырьмя слоями модификаторов. Присутствие серебра во внешнем слое облегчало перенос электрона от тиохолина, образующегося в ферментативной реакции, а увеличение числа слоев до шести снижало абсолютную величину токов пика.
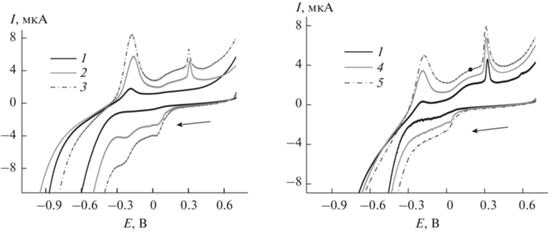
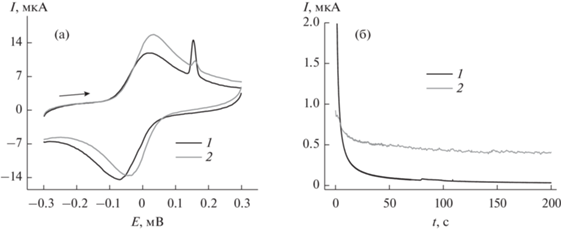
Иммобилизация фермента поверх модифицирующего слоя из углеродной черни, пиллар[6]арена и наночастиц серебра незначительно меняла морфологию пиков на вольтамперограммах. В частности, пики окисления–восстановления макроцикла становились более симметричными, а относительная величина пика окисления серебра снижалась. Введение в раствор фермента и ацетилтиохолина приводило к закономерным изменениям на циклических вольтамперограммах (рис. 5а): токи пика окисления снижались, а ток пика восстановления – увеличивался. Такие изменения связаны с участием окисленной формы пиллар[6]арена в химическом окислении тиохолина, что приводило к изменению соотношения бензохиноновых и гидрохиноновых фрагментов макроцикла. Изменения тока пика окисления серебра, по-видимому, связаны с их участием в переносе электрона внутри слоя, а также с частичным блокированием поверхности тиохолином, накапливающимся за счет самопроизвольного образования связей Ag–S. Аналогичное поведение наблюдали ранее для сходных модифицирующих материалов, полученных из тиакаликсарена с пирокатехиновыми группами и нитрата серебра [22, 23].
Рис. 5.
Циклические вольтамперограммы (а) и хроноамперограммы (б), полученные на стеклоуглеродном электроде, модифицированном углеродной чернью, композитом (пиллар[6]арен–Ag)2 и ацетилхолинэстеразой (0.005 Е на электрод). Измерения в 0.1 М фосфатном буферном растворе, содержащем 0.1 М NaCl, до (1) и после добавления 1.0 мМ ацетилтиохолина (2). Потенциал электрода в хроноамперометрическом режиме 0.3 В.
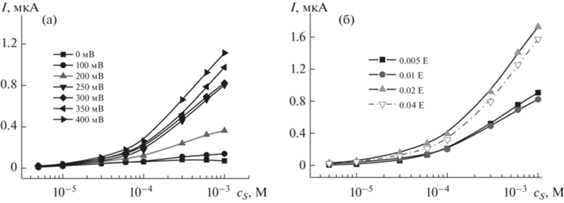
Аналогичные изменения тока наблюдали в хроноамперометрическом режиме (рис. 5б) при поляризации электрода в интервале 50–400 мВ. Поскольку формат биосенсора лучше совместим с хроноамперометрическим режимом измерения сигнала, дальнейшие исследования проводили в указанных условиях. Зависимости стационарного тока, устанавливающегося при 100 с после введения субстрата, от концентрации субстрата и количества фермента, взятого для иммобилизации, приведены на рис. 6. Как видно, сигнал биосенсора закономерно увеличивается с потенциалом электрода, начиная с 200 мВ. Последующие измерения проводили при потенциале 300 мВ, обеспечившим несколько меньший разброс результатов измерения (2.5% относительно 3.5% для 400 мВ в серии из пяти биосенсоров). Что касается влияния количества фермента, устойчивый сигнал зарегистрирован, начиная с 0.005 Е на электрод. Поскольку ингибитор рекомендовано определять при минимальной концентрации фермента [10, 12], в дальнейшем использовали 0.005 Е АХЭ на электрод.
Рис. 6.
Зависимость сигнала ацетилхолинэстеразных биосенсоров от концентрации субстрата, полученная при разных потенциалах электрода (а) (0.005 E АХЭ на электрод) и количестве взятой для иммобилизации ацетилхолинэстеразы (б) (потенциал электрода 0.3 В). Измерения в 0.1 М фосфатном буферном растворе, содержащем 0.1 М NaCl.
Определение обратимых ингибиторов ацетилхолинэстеразы. Введение в рабочий раствор, содержащий субстрат, лекарственных препаратов – обратимых ингибиторов АХЭ приводило к снижению стационарного тока за счет уменьшения скорости гидролиза субстрата и, как следствие, – уменьшения количества тиохолина, реагирующего на электроде. Градуировочные зависимости (рис. 7) имели сигмоидную форму, типичную для обратимых ингибиторов. Для ее аппроксимации применяли логистическую аппроксимирующую функцию (2), ранее успешно использованную в аналогичных исследованиях обратимого ингибирования АХЭ [17–19] и распространённую в иммунохимических исследованиях:
(2)
$I{\text{\% }} = \frac{{{{A}_{1}} - {{A}_{2}}}}{{1 + {{{\left( {{x \mathord{\left/ {\vphantom {x {{{x}_{0}}}}} \right. \kern-0em} {{{x}_{0}}}}} \right)}}^{p}}}} + {{A}_{2}}.$Рис. 7.
Градуировочные зависимости для определения обратимых ингибиторов ацетилхолинэстеразы с помощью биосенсора на основе стеклоуглеродного электрода, модифицированного углеродной чернью, композитом (пиллар[6]арен–Ag)2 и ацетилхолинэстеразой (0.005 Е на электрод). Измерения в 0.1 М фосфатном буферном растворе, содержащем 0.1 М NaCl, тиохолин 1.0 мМ.
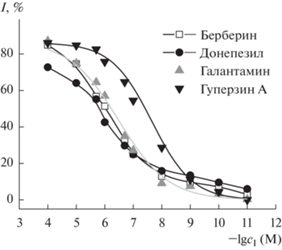
Здесь I (%) – степень ингибирования АХЭ, рассчитанная по уравнению (1), исходя из относительного уменьшения тока окисления тиохолина при введении в раствор ингибитора; A1 и A2 – верхний и нижний пределы изменения степени ингибирования; x – мера содержания ингибитора (в данном случае x = –lg(cI, M); xо – точка перегиба графика, формально отвечающая 50%‑ному ингибированию фермента (концентрация ЕС50); p – параметр, определяющий крутизну средней части графика, т.е. чувствительность определения ингибитора. Значения соответствующих параметров градуировочных зависимостей приведены в табл. 1. Концентрацию ингибитора, отвечающую 15%-ному ингибированию (ЕС15), выбрали в качестве предела обнаружения. Это связано с тем, что стандартное отклонение при измерении сигнала биосенсора обычно составляет 3–5%, что при соотношении сигнал/шум, равном 3, дает минимальный достоверный результат измерения ингибирования 15% [12, 14, 17–19]. В нашем случае в серии из пяти биосенсоров относительная дисперсия отклика на 0.5 мМ ацетилтиохолин составила 3.5%, в серии из пяти измерений с одним биосенсором – 2.5%, так что использованная оценка оказалась даже более строгой, чем следует из метрологических характеристик разработанного биосенсора.
Таблица 1.
Параметры логистической аппроксимационной модели (уравнение (2)) отклика АХЭ биосенсора на обратимые ингибиторы и значения ЕС15 и ЕС50 индивидуальных ингибиторов
| Ингибитор | А1, % | А2, % | хо | p | R2 | ЕС15, нМ | ЕС50, мкМ |
|---|---|---|---|---|---|---|---|
| Гуперзин А | 86 ± 2 | 2 ± 1 | 7.4 ± 0.2 | 3.0 ± 0.2 | 0.9920 | 1.2 | 0.04 |
| Галантамин | 91 ± 2 | 1 ± 1 | 6.2 ± 0.2 | 1.5 ± 0.1 | 0.9829 | 12.5 | 0.63 |
| Донепезил | 72 ± 1 | 6 ± 1 | 6.0 ± 2 | 2.9 ± 0.2 | 0.9945 | 2.5 | 1.0 |
| Берберин | 84 ± 2 | 6 ± 1 | 6.6 ± 2 | 2.2 ± 0.1 | 0.9855 | 10.0 | 0.25 |
Чувствительность определения аналитов с помощью разработанного биосенсора сопоставима или лучше характеристик АХЭ-биосенсоров, описанных в литературе. Так, при проточно-инжекционном определении донепезила с ферментом, иммобилизованным на наночастицах золота, значение ЕС50 составило 0.5 мкМ, берберина 6.45 мкМ [24]. Использование в качестве трансдьюсера нитрида углерода с частицами палладия и включение АХЭ в пленку хитозана позволило добиться предела обнаружения гуперзина А 1.3 нМ [25], проведение измерения в микрореакторе с АХЭ, адсорбированной на силикагеле, показало ЕС50 1.52 мкМ [26]. В той же системе значение ЕС50 галантамина составило 13 мкМ, для фермента, иммобилизованного в полиметилметакрилате, – 0.47 мкМ [27]. Предел обнаружения галантамина при его определении с помощью АХЭ, иммобилизованной на магнитных частицах, составил 1.5 мкМ [28], в колориметрическом сенсоре на основе смартфона в качестве измерительного инструмента и АХЭ, иммобилизованной в хитозане, – 1.3 мкМ [28]. При физической адсорбции фермента в полиэлектролитные комплексы значение ЕС50 берберина составило 0.6 мкМ гуперзина А – 0.05 мкМ [19], галантамина – 0.69 мкМ [18].
Попытки получить сигнал об ингибировании АХЭ с помощью сенсора, содержащего пиллар[6]арен без наночастиц серебра, показали значительно меньшую чувствительность определения аналитов. Так, для гуперзина А предел обнаружения составил 10 нМ, галантамина – 50 нМ, донепезила – 12 нМ и берберина – 120 нМ. Возможно, это частично связано с неустойчивостью отклика на макроцикл, который даже в отсутствие фермента имеет тенденцию к уменьшению в серии последовательных измерений из одного раствора. Такое поведение может быть обусловлено хемосорбцией промежуточных продуктов окисления пиллар[6]арена и недостаточной его стабилизацией в частицах углеродной черни. Возможно, аккумуляция тиохолина, обладающего свойствами восстановителя, на наночастицах серебра дополнительно стабилизирует медиатор в составе биосенсора. Для дальнейшего применения пиллар[6]арена в составе АХЭ-биосенсора может понадобиться оптимизация матрицы для включения макроцикла.
Операционные характеристики и анализ реального объекта. Биосенсор показал высокую устойчивость сигнала при хранении в рабочем буферном растворе и в сухом виде. Так, при использовании в течение дня при комнатной температуре сигнал на 0.5 мМ ацетилтиохолин практически не менялся, в течение двух недель он снижался на 20–25% от исходной величины, но при этом его чувствительность в отношении обратимых ингибиторов не менялась. Реактивация биосенсора после его контакта с ингибитором достигалась путем промывки рабочим буферным раствором. Степень реактивации оценивали по воспроизводимости отклика на субстрат. Каждый биосенсор позволял проводить до 50 циклов измерения ингибирования–реактивации без потери чувствительности сигнала к ингибитору в изученном интервале его концентраций.
При хранении биосенсора в сухом виде при 4°С 50% исходного сигнала сохранялось после трех месяцев хранения. Значение ЕС50 изученных ингибиторов при этом несколько возрастало, поскольку инактивации повергались в первую очередь молекулы фермента, наиболее доступные для ингибитора. Указанные изменения слабо влияют на возможности использования разработанного биосенсора для определения остаточных количеств лекарственных препаратов в урине. По результатам фармакокинетических исследований, с уриной выделяются в неизменном виде 30–40% принимаемых препаратов [29–31], при этом их концентрация в случае суточного приема 3–5 мг составляет 0.8 мкМ (расчет для донепезила).
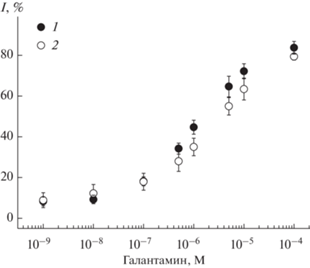
Для оценки возможности применения разработанного биосенсора в терапевтической практике при лечении больных нейродегенеративными заболеваниями протестировали искусственную урину (состав приведен в “Экспериментальной части”), содержащую переменные количества галантамина. Урину предварительно разбавляли в 10 раз и корректировали рН до 7.8. Как следует из рис. 8, в пределах погрешности измерений установленные значения концентрации не отличались от полученных в стандартных условиях. Степень открытия, рассчитанная по графикам, составляла 92–98%. Следует отметить, что воспроизводимость результатов измерений в урине ниже, чем в фосфатном буферном растворе, и составила в среднем 5%. Полученные результаты свидетельствуют о возможности применения разработанного биосенсора для контроля остаточных количеств изученных лекарственных препаратов в урине пациентов.
Рис. 8.
Градуировочные зависимости для определения галантамина в фосфатном буферном растворе (⚫) и в искусственном образце урины (⚪). Измерения при рН 7.8, концентрации ацетилтиохолина 0.5 мМ. Приведены средние значения для трех биосенсоров.
Действие обратимых ингибиторов на АХЭ неселективно, регистрируемая степень ингибирования АХЭ не дает информации о природе и числе ингибиторов в анализируемом образце. Однако, учитывая близость полученных характеристик ингибирования, снижение сигнала биосенсора можно рассматривать как оценку общего содержания препаратов антихолинэстеразного действия в образце. Возможно, в перспективе можно повысить селективность определения остаточных количеств лекарственных препаратов, используя мультисенсорный подход с варьированием природы и способа модификации электрода-трансдьюсера, а следовательно, и индивидуальных характеристик определения аналитов.
Работа выполнена при поддержке Российского научного фонда (проект 17-13-01208).
Список литературы
Ispas C.R., Crivat G., Andreescu S. Review: Recent developments in enzyme-based biosensors for biomedical analysis // Anal. Lett. 2012. V. 45. P. 168. https://doi.org/10.1080/00032719.2011.633188
Nigam K.V., Shukla P. Enzyme based biosensors for detection of environmental pollutants – A review // J. Microbiol. Biotechnol. 2015. V. 25. № 11. P. 1773. https://doi.org/10.4014/jmb.1504.04010
Yang H. Enzyme-based ultrasensitive electrochemical biosensors // Curr. Opin. Chem. Biol. 2012. V. 16. № 3–4. P. 422. https://doi.org/10.1016/j.cbpa.2012.03.015
Wang H.-C., Lee A.-R. Recent developments in blood glucose sensors // J. Food Drug Anal. 2015. V. 23. № 2. P. 191. https://doi.org/10.1016/j.jfda.2014.12.001
Rattu G., Khansili N., Maurya V.K., Krishna P.M. Lactate detection sensors for food, clinical and biological applications: A review // Environ. Chem. Lett. 2021. V. 19. P. 1135. https://doi.org/10.1007/s10311-020-01106-6
Budnikov H.C., Evtugyn G.A. Electrochemical biosensors for inhibitor determination: Selectivity and sensitivity control // Electroanalysis. 1996. V. 8. № 8–9. P. 817. https://doi.org/10.1002/elan.1140080821
Bucur B., Purcarea C., Andreescu S., Vasilescu A. Addressing the selectivity of enzyme biosensors: solutions and perspectives // Sensors. 2021. V. 21. № 9. Article 3038. https://doi.org/10.3390/s21093038
Kurbanoglu S., Ozkan S. A., Merkoçi A. Nanomaterials-based enzyme electrochemical biosensors operating through inhibition for biosensing applications // Biosens. Bioelectron. 2017. V. 89. P. 886. https://doi.org/10.1016/j.bios.2016.09.102
Tortolini C., Bollella P., Antiochia R., Favero G., Mazzei F. Inhibition-based biosensor for atrazine detection // Sens. Actuators B. 2016. V. 224. P. 552. https://doi.org/10.1016/j.snb.2015.10.095
Amine A., Mohammadi H., Bourais I., Palleschi G. Enzyme inhibition-based biosensors for food safety and environmental monitoring // Biosens. Bioelectron. 2006. V. 21. № 8. P. 1405. https://doi.org/10.1016/j.bios.2005.07.012
Pundir C.S., Chauhan N. Acetylcholinesterase inhibition-based biosensors for pesticide determination: A review // Anal. Biochem. 2012. V. 429. № 1. P. 19. https://doi.org/10.1016/j.ab.2012.06.025
Arduini F., Amine A., Moscone D., Palleschi G. Biosensors based on cholinesterase inhibition for insecticides, nerve agents and aflatoxin B1 detection (review) // Microchim. Acta. 2010. V. 170. P. 193. https://doi.org/10.1007/s00604-010-0317-1
Pohanka M. Cholinesterases in biorecognition and biosensors construction: A review // Anal. Lett. 2013. V. 46. № 12. P. 1849. https://doi.org/10.1080/00032719.2013.780240
Pohanka M., Adam V., Kizek R. An acetylcholinesterase-based chronoamperometric biosensor for fast and reliable assay of nerve agents // Sensors 2013. V. 13. № 9. P. 11498. https://doi.org/10.3390/s130911498
Pohanka M. Diagnoses of pathological states based on acetylcholinesterase and butyrylcholinesterase // Curr. Med. Chem. 2020. V. 27. № 18. P. 2994. https://doi.org/10.2174/0929867326666190130161202
Caratelli V., Ciampaglia A., Guiducci J., Sancesario G., Moscone D., Arduini F. Precision medicine in Alzheimer’s disease: An origami paper-based electrochemical device for cholinesterase inhibitors // Biosens. Bioelectron. 2020. V. 165. № 1. Article 112411. https://doi.org/10.1016/j.bios.2020.112411
Ivanov A., Davletshina R., Sharafieva I., Evtugyn G. Electrochemical biosensor based on polyelectrolyte complexes for the determination of reversible inhibitors of acetylcholinesterase // Talanta. 2019. V. 194. P. 723. https://doi.org/10.1016/j.talanta.2018.10.100
Davletshina R., Ivanov A., Evtugyn G. Acetylcholinesterase sensor based on polyelectrolyte complexes with DNA inclusion for the determination of reversible inhibitors // Electroanalysis. 2020. V. 32. № 2. P. 308. https://doi.org/10.1002/elan.201900507
Davletshina R., Ivanov A., Shamagsumova R., Evtugyn V., Evtugyn G. Electrochemical biosensor based on polyelectrolyte complexes with dendrimer for the determination of reversible inhibitors of acetylcholinesterase // Anal. Lett. 2021. V. 54. P. 1709. https://doi.org/10.1080/00032719.2020.1821700
Ogoshi T., Yamagishi T. Pillararenes: Versatile synthetic receptors for supramolecular chemistry // Eur. J. Org. Chem. 2013. V. 15. P. 2961. https://doi.org/10.1002/ejoc.201300079
Cao D., Kou Y., Liang J., Chen Z., Wang L., Meier H. Eine leichte und effiziente Herstellung von Pillararenen und einem Pillarchinon // Angew. Chem. 2009. V. 121. P. 9901. https://doi.org/10.1002/ange.200904765
Evtugyn G.A., Shamagsumova R.V., Sitdikov R.R., Stoikov I.I., Antipin I.S., Ageeva M.V., Hianik T. Dopamine sensor based on a composite of silver nanoparticles implemented in the electroactive matrix of calixarenes // Electroanalysis. 2011. V. 23. № 10. P. 2281. https://doi.org/10.1002/elan.201100197
Kuzin Yu. Porfireva, A., Stepanova V., Evtugyn V., Stoikov I., Evtugyn G., Hianik T. Impedimetric detection of DNA damage with the sensor based on silver nanoparticles and neutral red // Electroanalysis. 2015. V. 27. № 12. P. 2800. https://doi.org/10.1002/elan.201500312
Vandeput M., Parsajoo C., Vanheuverzwijn J., Patris S., Yardim Y., le Jeune A., Sarakbi A., Mertens A., Kauffmann J.-M. Flow-through enzyme immobilized amperometric detector for the rapid screening of acetylcholinesterase inhibitors by flow injection analysis // J. Pharm. Biomed. Anal. 2015. V. 102. P. 267. https://doi.org/10.1016/j.jpba.2014.09.012
Wang B., Ye C., Zhong X., Chai Y., Chen S., Yuan R. Electrochemical biosensor for organophosphate pesticides and huperzine-A detection based on Pd wormlike nanochains/graphitic carbon nitride nanocomposites and acetylcholinesterase // Electroanalysis. 2016. V. 28. P. 304. https://doi.org/10.1002/elan.201500339
da Silva J.I., de Moraes M.C., Vieira L.C.C., Corrêa A.G., Cass Q.B., Cardoso C.L. Acetylcholinesterase capillary enzyme reactor for screening and characterization of selective inhibitors // J. Pharm. Biomed. Anal. 2013. V. 73. P. 44. https://doi.org/10.1016/j.jpba.2012.01.026
Kostelnik A., Pohanka M. Superficially bound acetylcholinesterase based on a chitosan matrix for neurotoxic compound assay by a photographic technique // Anal. Lett. 2018. V. 51. P. 1622. https://doi.org/10.1080/00032719.2017.1381846
Kostelnik A., Kopel P., Cegan A., Pohanka M. Construction of an acetylcholinesterase sensor based on synthesized paramagnetic nanoparticles, a simple tool for neurotoxic compounds assay // Sensors. 2017. V. 17. P. 676. https://doi.org/10.3390/s17040676
Jia J., Zhao Q., Liu Y., Gui Y., Liu G., Zhu D., Yu C., Hong Z. Phase I study on the pharmacokinetics and tolerance of ZT-1, a prodrug of huperzine A, for the treatment of Alzheimer’s disease // Acta Pharmacol. Sin. 2013. V. 34. P. 976. https://doi.org/10.1038/aps.2013.7
Lin P.P., Li X.N., Yuan F., Chen W.L., Yang M.J., Xu H.R. Evaluation of the in vitro and in vivo metabolic pathway and cytochrome P450 inhibition/induction profile of Huperzine A // Biochem. Biophys. Res. Commun. 2016. V. 11. P. 248. https://doi.org/10.1016/j.bbrc.2016.10.039
Mannens G.S.J., Snel C.A.W., Hendrickx J., Verhaeghe T., le Jeune L., Bode W., van Beijsterveldt L., Lavrijsen K., Leempoels J., van Osselaer N., van Peer A., Meuldermans W. The metabolism and excretion of galantamine in rats, dogs, and humans // Drug Metab. Dispos. 2002. V. 30. P. 553. https://doi.org/10.1124/dmd.30.5.553
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии