Журнал аналитической химии, 2022, T. 77, № 9, стр. 864-870
Определение перфторорганических соединений в цельной крови и тканях органов лабораторных животных методом газожидкостной хромато-масс-спектрометрии
И. К. Журкович a, В. А. Утсаль a, Е. В. Островидова a, *, В. А. Баринов a, Н. В. Луговкина a, Е. Ю. Бонитенко a, Н. А. Белякова a, В. В. Баринов a
a Научно-клинический центр токсикологии имени академика С.Н. Голикова
Федерального медико-биологического агентства
192019 Санкт-Петербург,
ул. Бехтерева, 1, Россия
* E-mail: yekaterina.ostrov@yandex.ru
Поступила в редакцию 08.10.2021
После доработки 12.11.2021
Принята к публикации 15.11.2021
- EDN: LSJYIB
- DOI: 10.31857/S0044450222070143
Аннотация
В опытах in vitro разработана методика определения группы перфторорганических соединений, перспективных для медицинского применения, в цельной крови и тканях органов лабораторных животных методом газожидкостной хромато-масс-спектрометрии. Оптимизирована процедура подготовки проб, основанная на жидкостной экстракции целевых соединений из биоматериала гептаном, содержащим в качестве внутреннего стандарта перфторбензол. Валидация методики и апробация в опытах in vivo проведена на примере перфтордекалина. Установлено время присутствия ксенобиотика в кровотоке и в различных органах мелких лабораторных животных при эндотрахеальном пути введения.
Применение в современной медицинской практике перфторорганических соединений (ПФОС) в качестве кровезаменителей или дыхательных жидкостей требует их тщательного изучения как ксенобиотиков. Относительно новым направлением является применение ПФОС для доставки лекарственных препаратов в легкие. Их высокая растворяющая способность по отношению к кислороду и диоксиду углерода, низкое поверхностное натяжение и способность проникать в отделы легких, находящиеся в состоянии коллапса, способствуют лучшему распределению лекарства в пораженном органе. Эффективность такого подхода уже показана на примере транспорта антибиотиков, анестетиков и вазоактивных веществ [1].
Кроме того, при терапии синдрома респираторного дистресса, который может возникать при дефиците или дисфункции легочного сурфактанта, в том числе у новорожденных, практикуют введение искусственных добавок (например, фосфолипидов) в виде композиции с ПФОС [2].
В медико-биологических исследованиях значительное внимание уделяется оценке периодов циркуляции ксенобиотиков данного класса в кровотоке и удерживания в органах-депо. Эта информация особенно важна с точки зрения влияния на метаболические процессы, протекающие в крови, поскольку ПФОС могут служить сорбентом для некоторых биологически активных соединений, в том числе липидов и белков [3, 4]. Надежность полученных результатов в значительной степени определяется качеством химико-аналитического обеспечения. На сегодняшний день в научной литературе описан целый ряд методик, предназначенных для определения концентрации различных ПФОС в биологических образцах. Среди них перфтордекалин, соединения, содержащие третичную аминогруппу (например, перфтортрибутиламин и перфтор-N,N-диэтилциклогексиламин) или фурановый цикл (перфторбутилперфтортетрагидрофуран), а также их производные [5–9].
Наиболее подробные описания определения перфтордекалина и других перфторорганических соединений методом ГЖХ в биологических опытах in vivo представлены Центральной исследовательской лабораторией японской компании Green Corporation в 1975 году [5–7]. Исследования выполнены с использованием хроматографической системы Shimadzu простейшей конфигурации, включающей обычную насадочную колонку и пламенно-ионизационный детектор. Независимо аналогичные разработки проводились в Американском детском госпитальном медицинском центре штата Цинциннати [10–12]. Однако они описаны менее подробно. В дальнейшем по мере развития аналитического приборостроения и совершенствования хроматографических фаз появились различные модификации первых методик с применением капиллярных колонок и новых типов детекторов [13].
Полный перечень исследованных в данной работе ПФОС включает перфтордекалин (ПФД), перфтороктан (ПФО), Карбогал, 1-бромперфтор(4-метил-3,6-диоксаоктан) (ПФБДО) и перфтор(5-метил-3,6-диоксанонан) (ПФДО). Их структурные формулы представлены на схеме 1 . В перечень включены производные, которые оказались наиболее перспективными по результатам медико-биологического исследования технологий на основе жидкостного дыхания и целевого транспорта лекарственных средств в легкие при ряде бронхолегочных заболеваний. Важным аргументом выбора целевых соединений является относительная доступность, поскольку их синтез и производство осуществляются в России. Это способствует более оперативному внедрению новых подходов в лечебную практику. За рубежом в аналогичных исследованиях применяют перфлуброн С8F17Br (ПФБ).
Схема 1. Структурные формулы перфтордекалина (ПФД) (С10F18), перфтороктана (ПФО) (С8F18), Карбогала (С8F16), 1-бромперфтор(4-метилФД,6-диоксаоктана) (ПФБДО) (С7F15O2Br), перфтор(5-метил-3,6-диоксанонана) (ПФДО) (C8F18O2).
Цель настоящего исследования состояла в разработке общей методики количественного определения ПФОС в образцах биоматериалов методом газожидкостной хромато-масс-спектрометрии (ГЖХ-МС) и ее апробация в опытах in vivo на примере ПФД. Аналитическую процедуру оптимизировали с учетом групповой специфичности некоторых физико-химических свойств, представленных в табл. 1. Перфторгексан (т. кип. 57°С) исключили из рассмотрения в связи с интенсивным газообразованием в опытах in vivo.
Таблица 1.
Физико-химические свойства перфторорганических соединений
| Показатель | Диапазон | Сравнительная оценка |
|---|---|---|
| Молекулярная масса, Да | 400−488 | ПФБ > ПФДО > ПФБДО > ПФД > ПФО > Карбогал |
| Температура кипения, °С | 102−180 | ПФБДО > ПФБ > ПФД > ПФДО > ПФО > Карбогал |
| Давление пара (37°С), кПа | 0.1−8.0 | ПФО > ПФД > ПФБ > ПФДО > ПФБДО |
| Плотность, г/мл | 1.6−1.95 | ПФД > ПФБ > Карбогал > ПФБДО > ПФО > ПФДО |
| Кинематическая вязкость (25°С), сСт | 0.59−2.90 | ПФД > Карбогал > ПФБ > ПФО > ПФБДО > ПФДО |
| Поверхностное натяжение (25°С), дин/см | 10.0−18.0 | ПФБ > ПФБДО > ПФД > ПФДО > ПФО |
| Растворимость О2 (25°С), мл газа/100 мл жидкости | 48−54 | Карбогал > ПФБ > ПФД > ПФО |
| Растворимость СО2 (25°С), мл газа/100 мл жидкости | 140−210 | ПФБ > Карбогал > ПФО > ПФД |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы и реагенты. Перфтордекалин (Ф-ГБОУ ВО СибГМУ, Россия), перфторгексан, перфтороктан и карбогал (все ООО “ГалоПолимер”, Россия), 1-бромперфтор(4-метил-3,6-диоксаоктан) и перфтор(5-метил-3,6-диоксанонан) (P&M Invest, Россия), гептан (Вектон, Россия), перфторбензол (ГИПХ, Санкт-Петербург), 0.001%-ный раствор перфторбензола в гептане (раствор внутреннего стандарта) готовили методом растворением точных навесок перфторбензола в экстрагенте в день проведения измерений. Градуировочные образцы цельной крови лабораторных животных с внесением ПФОС in vitro c концентрацией в диапазоне от 0.1 до 20 мкг/мл готовили добавлением к 1 мл крови аликвот 0.1 или 0.01%-ных растворов индивидуальных экспериментальных образцов ПФОС в гептане.
Оборудование. Использовали газожидкостный хромато-масс-спектрометр GCMS-QP2010 Plus (Shimadzu, Япония) и капиллярную хроматографическую колонку Ultra-2 (25 м × 0.2 мм). Экспериментальные данные регистрировали и обрабатывали с помощью программы GS-MS Solutions.
Для подготовки проб использовали: весы лабораторные электронные, модель Adventurer AR 2140 (Ohaus, США) с точностью взвешивания 0.0001 г, центрифугу лабораторную, ОПН-8УХЛ4 (Россия), аппарат для встряхивания образцов (Chirana, Чехия), ультразвуковую баню D-7824 Singen/HTW (Elma, Германия), смеситель лабораторный MS 3 basic (IKA, США).
В ходе исследования выбрали условия пробоподготовки биологических образцов крови и тканей органов и хроматографического анализа проб в режиме электронной ионизации и селективного мониторинга характеристичных ионов определяемых соединений.
Подготовка биопроб и анализ. Цельная кровь. 1 мл крови помещали в стеклянную пробирку с завинчивающейся крышкой объемом 5 мл, прибавляли 1 мл раствора внутреннего стандарта. Пробу выдерживали в УЗ-бане в течение 10 мин при температуре не выше +5°С, перемешивали в течение 2 мин на лабораторном смесителе и центрифугировали 5 мин при скорости 3000 об/мин. Аликвоту верхнего слоя переносили в стеклянную хроматографическую виалу с завинчивающейся крышкой объемом 4 мл и анализировали методом ГЖХ-МС.
Ткани органов. Перед анализом температуру замороженных образцов поднимали до комнатной. Точные навески от 0.1 до 0.5 г переносили в стеклянные пробирки с завинчивающимися крышками и прибавляли 1 мл раствора внутреннего стандарта. Пробу выдерживали в УЗ-бане в течение 10 мин при температуре не выше +5°С, перемешивали в течение 2 мин на лабораторном смесителе и центрифугировали 5 мин при скорости 3000 об/мин. Аликвоту верхнего слоя переносили в стеклянную хроматографическую виалу с завинчивающейся крышкой объемом 4 мл и анализировали методом ГЖХ-МС.
Газожидкостный хромато-масс-спектрометрический анализ. Компоненты проб разделяли в условиях градиентного элюирования при температуре инжектора и детектора 280°С, начальной температуре колонки 80°С (2 мин), скорости нагрева 45°С/мин и конечной температуре колонки 280°С (15 мин), газ-носитель He, скорость потока 1 мл/мин, деление потока 1 : 10.
МС-детектироание проводили в условиях электронной ионизации при потенциале 70 eV в режиме сканирования SIM при температуре источника ионов и интерфейса 280°С. Аналитические сигналы регистрировали в интервале от 1 до 2 мин при отсечении шумов на уровне 50 усл. ед.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Оптимизация процедуры подготовки биопроб. Для определения ПФОС в биоматериале использовали жидкостную экстракцию и метод внутреннего стандарта. Вследствие высокой гидрофобности и отсутствия межмолекулярного взаимодействия у перфторированных углеводородов в качестве экстрагента целесообразно использовать аполярный апротонный растворитель по классификации Паркера [14]. К их числу относятся жидкости с низкой диэлектрической проницаемостью и слабым дипольным моментом, не склонные к образованию водородных связей, прежде всего, алифатические или ароматические углеводороды. Учитывая летучесть указанных углеводородов, в качестве оптимального экстрагента ПФОС из биоматериала выбрали н-гептан (т. кип. 98.4°С), а внутреннего стандарта – гексафторбензол (т. кип. 80.1°С).
Параметры жидкостной экстракции оптимизировали в опытах in vitro. Удалось подобрать оптимальные условия проведения процедуры: соотношение массы биологической пробы и объема экстрагента, температура УЗ-бани и время эксперимента. Однократная степень извлечения, установленная в опытах введено–найдено, составляет не менее 95% для всех исследуемых ПФОС. Подтверждением этих данных служат высокие значения коэффициентов корреляции линейных градуировочных графиков, представленных в табл. 2.
Таблица 2.
Метрологические характеристики определения перфторорганических соединений в цельной крови методом ГЖХ-МС
| ПФОС | Линейный диапазон, мкг/мл |
Уравнение 1 порядка |
Коэффициент корреляции |
Предел обнаружения, мкг/мл |
|---|---|---|---|---|
| Перфтордекалин | 0.5−20.0 | y = 0.0005x | 0.9983 | 0.05 |
| Перфтороктан | 0.5−20.0 | y = 0.0001x | 0.9946 | 0.02 |
| Карбогал | 0.5−20.0 | y = 0.0002x | 0.9996 | 0.02 |
| ПФБДО | 0.1−20.0 | y = 0.00006x | 0.9997 | 0.01 |
| ПФДО | 0.1−20.0 | y = 0.0001x | 0.9998 | 0.01 |
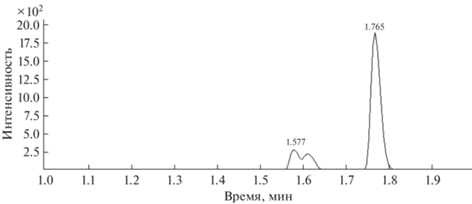
ПФОС в биообразцах идентифицировали по хроматографическим параметрам удерживания и значениям массовых чисел характеристических ионов. За результат идентификации принимали совпадение указанных характеристик на хроматограммах стандартного и испытуемого растворов. Соответствующие параметры для целевых соединений представлены на рис. 1 и в табл. 3.
Рис. 1.
Масс-спектры фрагментации ионов перфторорганических соединений, выбранных для их определения в режиме электронной ионизации.

Таблица 3.
Критерии идентификации перфторорганических соединений
| Определяемое вещество | Время удерживания, мин | Детектируемый ион: m/z, Да |
|---|---|---|
| Перфтордекалин | 1.60 ± 0.05 (цис-изомер) 1.63 ± 0.05 (транс-изомер) |
${{{\text{С}}}_{{\text{6}}}}{\text{F}}_{9}^{ + }$:243, C7F11+:293 |
| Перфтороктан | 1.45 ± 0.05 | ${\text{СF}}_{3}^{ + }$ :69 |
| Карбогал | 1.48 ± 0.05 | ${\text{СF}}_{3}^{ + }$:69, C4F7:181 |
| ПФБДО | 1.50 ± 0.05 | ${\text{СF}}_{5}^{ + }$:119 |
| ПФДО | 1.50 ± 0.05 | ${\text{СF}}_{5}^{ + }$:119 |
| Перфторбензол (внутренний стандарт) | 1.82 ± 0.05 | ${{{\text{С}}}_{6}}{\text{F}}_{6}^{ + }$ |
Концентрацию (мкг/мл) ПФОС в пробах цельной крови определяли по градуировочной кривой как средний результат двух анализов. Массовые концентрации ПФОС в тканях органов (с) вычисляли по формуле (1) как средний результат параллельных определений:
(1)
$с = {{{{с}_{{{\text{гр}}}}}} \mathord{\left/ {\vphantom {{{{с}_{{{\text{гр}}}}}} m}} \right. \kern-0em} m},$Метрологические характеристики и апробация методики на примере перфтордекалина в опытах in vivo. Градуировочные графики строили для каждого ПФОС, используя соответствующие градуировочные образцы цельной крови крыс. Пробоподготовку, а также анализ градуировочных и тестируемых биообразцов проводили с соблюдением описанных выше процедур. Метрологические характеристики определения целевых аналитов представлены в табл. 2.
Пределы обнаружения ПФОС, установленные для соотношения сигнал/шум более 3, превышают аналогичные показатели, приведенные в литературе, примерно в 1000 раз.
При апробации методики in vivo в качестве тест-системы выбрали белых крыс-самцов Вистар. Перфтордекалин вводили животным натощак однократно в дозе 19.4 мг/кг (10 мл/кг) эндотрахеально (э/т) через полимерную интубационную трубку при общей анестезии.
Кровь и органы (головной мозг, легкие, печень, селезенка, почка) отбирали через определенные интервалы времени: 1 ч, 24 ч, 3 и 10 сут после введения перфтордекалина. Образцы крови лабораторных животных в объеме не менее 2 мл помещали в пробирки с Na-гепарином объемом 5.0−6.0 мл и хранили при температуре от −4 до −6°С в течение не более 1 сут. Фрагменты органов гомогенизировали в присутствии хладоагента и хранили в морозильной камере при −45°С.
Концентрацию ПФД в каждой временной точке, определяли в пяти повторностях, используя биопробы, отобранные у пяти животных. Усредненные результаты анализа представлены в табл. 4.
Таблица 4.
Фармакокинетическое исследование перфтордекалина при эндотрахеальном способе введения крысам
| Тест-объект | Содержание ПФД, мкг/мл | |||
|---|---|---|---|---|
| через 1 ч | через 24 ч | через 72 ч | через 240 ч | |
| Цельная кровь | 0.56 | 0.36 | 0.52 | 0.18 |
| Легкие | 490.0 | 2.49 | 3.53 | 0.56 |
| Печень | 0.88 | 0.49 | 0.49 | 0.29 |
| Почка | 1.12 | 0.38 | 0.49 | 0.23 |
| Селезенка | 1.04 | 0.65 | 0.77 | 0.49 |
| Головной мозг | 0.53 | 0.43 | 0.42 | 0.25 |
Демонстрационные хроматограммы приведены на рис. 2 и 3. Сигналы со временем удерживания в диапазоне 1.55−1.65 мин соответствуют цис- и транс-изомерам ПФД, а сигнал со временем удерживания около 1.75−1.85 мин – внутреннему стандарту (перфтобензолу).
Полученные данные, свидетельствуют о крайне низкой биодоступности ПФД при эндотрахеальном пути введения, расчетные значения которой составляют не более 0.2%. Органом-депо для него являются легкие, где большая часть ксенобиотика содержится в альвеолярном пространстве при незначительном проникновении в легочную ткань. Более чем 200-кратное снижение концентрации ПФД в легких через сутки после эндотрахеального введения свидетельствует о его быстрой элиминации с выдыхаемым воздухом. Через 10 сут концентрация ПФД в легких сопоставима со значениями концентраций в других исследованных органах.
Представленные экспериментальные данные позволяют интерпретировать фармакокинетику ПФОС как длительный процесс их циркуляции в организме лабораторных животных при изученном способе введения. Это затрудняет применение стандартного набора кинетических параметров для классического описания абсорбции ксенобиотиков данного класса, а также особенностей распределения, метаболизма и элиминирования.
Важным результатом исследования in vivo является установление факта аккумулирования ПФД в тканях органов. Степень депонирования, по-видимому, характеризуется соответствующими коэффициентами распределения, которые зависят от содержания липидов в крови и в различных органах.
Таким образом, разработана современная высокочувствительная методика определения ПФОС, используемых в биомедицинских технологиях, и показана возможность ее применения в доклинических исследованиях.
Список литературы
Kaisers U. British J. Liquid ventilation // Br. J. Anaesth. 2003. V. 91. P. 143.
Патент США № 5.853.003.
Calderwood H., Ruiz B., Tham M. Residual levels and biochemical changes after ventilation with perfluorinated liquids // J. Appl. Physiol. 1975. V. 39. P. 603.
Kollpara S., Gandhi R. Pharmacokinetic aspects and in vitro-in vivo correlation potential for lipid-based formulations // Acta Pharm. Sin. B. 2014. V. 4. № 5. P. 333.
Yamanouchi K., Murashima R., Yokoyama K. Determination of perfluorochemicals in organ and body fluids by gas chromatography // Chem. Pharm. Bull. 1975. V. 23. № 6. P. 1363.
Yokoyama K., Yamanouchi K., Murashima R. Excretion of perfluorochemicals after intravenous injection of their emulsion // Chem. Pharm. Bull. 1975. V. 23. № 6. P. 1368.
Okamoto H., Yamanouchi K., Yokoyama K. Retention of perfluorochemicals in circulating blood and organs of animals after intravenous injection of their emulsions // Chem. Pharm. Bull. 1975. V. 23. № 7. P. 1452.
Yokoyama K., Yamanouchi K., Ohyanagi H., Mitsuno T. Fate of perfluorochemicals after intravenous injection with their emulsions // Chem. Pharm. Bull. 1978. V. 26. № 6. P. 956.
Holaday D., Fiserova-Bergerova V., Modell J. Uptake, distribution and excretion of fluorocarbon FX-80 (perfluorobutyl perfluorotetrahydrofuran) during liquid breathing in dog // Anesthesiology. 1972. V. 37. № 4. P. 387.
Shaffer T., Wolfson M., Greenspan J., Hoffman R., Davis S., Clark L. Liquid ventilation in premature lambs: Uptake, biodistribution and elimination of perfluorodecalin liquid // Reprod. Fertill. Dev. 1996. № 8. P. 409.
Clark L., Gollan F. Survival of mammals breathing organic liquids equilibrated with oxygen at atmospheric pressure // Science. 1966. V. 152. P. 1755.
Gollan F., Clark L. Organ perfusion with fluorocarbon liquids // Physiologist. 1966. V. 9. P. 191 M.
Audran M., Krafft M., Ceaurritz J., Maturin J.-C., Sicart M., Marion B., Bougard G., Bressolle F. Determination of perfluorodecalin and perfluoro-N-methylcyclohexylpiperidine in rat blood by gas chromatography-mass spectrometry // J. Chromatogr. B. 2000. V. 745. P. 333.
Райхардт К. Растворители и эффекты среды в органической химии. М.: Мир, 1991. С. 759.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии