Журнал аналитической химии, 2022, T. 77, № 9, стр. 777-787
Теоретический анализ структуры и реакционной способности как инструмент интерпретации и прогнозирования свойств аналитических реагентов и форм
А. Н. Панкратов *
Саратовский национальный исследовательский государственный университет имени Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: PankratovAN@info.sgu.ru
Поступила в редакцию 06.07.2021
После доработки 16.08.2021
Принята к публикации 17.08.2021
- EDN: XHAPTJ
- DOI: 10.31857/S0044450222090092
Аннотация
Представлено одно из научных направлений кафедры аналитической химии и химической экологии Саратовского университета – установление связи физико-химических, аналитических и иных свойств, реакционной способности, биологической активности веществ с энергетикой, пространственным и электронным строением, дескрипторами молекул реактантов, переходных состояний, интермедиатов, нанокластеров в основном и возбужденных состояниях, обобщение воззрений на механизмы и регионаправленность реакций, изучение влияния электростатического и гидрофобного факторов, среды на различные свойства и протекание химических процессов; квантовохимическое исследование электронных эффектов атомных групп в молекулах, водородной связи; выявление природы взаимодействий между валентно несвязанными атомами в небольших и/или напряжeнных молекулярных системах, в малых и средних квазициклах; выяснение (на основе NBO-анализа гибридизации) вопроса о дифференциальном участии неподелeнных электронных пар гетероатомов в реакциях с электрофильными агентами; прогноз возможности формирования и устойчивости ионных ассоциатов, их способности к экстракции; рассмотрение факторов стабилизации ионных ассоциатов (включая значимые для аналитической химии) и систем с открытой электронной оболочкой (в том числе аналитических реагентов); нахождение количественных соотношений структура–свойство; развитие теории строения и действия аналитических реагентов; молекулярное моделирование аналитически значимого биоспецифического белок-лигандного взаимодействия.
Общие замечания. На кафедре аналитической химии и химической экологии Саратовского университета под руководством автора этой статьи на протяжении ряда лет развивается направление, связывающее аналитическую химию с химией теоретической. Это направление включает следующие аспекты:
• установление связи физико-химических, аналитических и иных свойств, реакционной способности, биологической активности веществ с энергетикой, пространственным и электронным строением, дескрипторами молекул или других структурных единиц, ассоциатов, нанокластеров, реакционных интермедиатов в основном и возбужденных состояниях на основе углубления представлений об электронных эффектах, электроотрицательности атомных групп, водородной связи, выявления природы взаимодействий между валентно несвязанными атомами в небольших и/или напряженных молекулярных системах, в малых и средних квазициклах, выяснения вопроса о дифференциальном участии несвязывающих (неподеленных) электронных пар гетероатомов в реакциях с электрофильными агентами – жесткими и мягкими кислотами Льюиса, прогноза возможности формирования и устойчивости ионных ассоциатов, их способности к экстракции, рассмотрения факторов стабилизации ионных ассоциатов (в том числе значимых для аналитической химии) и молекулярных систем с открытой электронной оболочкой, обобщения воззрений на механизмы и регионаправленность реакций (включая окисление и восстановление, нитрозирование, нитрование, азосочетание, галогенирование, алкоксилирование, конденсации, другие электрофильные, нуклеофильные и радикальные процессы, комплексообразование, обмен лигандов, молекулярную и ионную ассоциацию, диссоциацию, таутомерию и двойственную реакционную способность, изомеризацию, перенос протона, атома водорода и “гидрид-аниона”), на региоселективность реакций гомолитического (радикального) окислительного и восстановительного сочетания (димеризации) веществ различных классов;
• изучение влияния среды на свойства и протекание химических процессов;
• нахождение количественных соотношений структура–свойство в рядах неорганических, органических, элементоорганических, координационных соединений;
• развитие теории строения и действия аналитических реагентов;
• молекулярное моделирование биоспецифического (аффинного) белок-лигандного взаимодействия;
• развитие физической химии морфообразующих белков и процессов жизнедеятельности высших грибов, квантовая химия низкомолекулярных эффекторов;
• систематизация и обобщение сведений об информационных ресурсах по естественным наукам, по экологии.
В рамках обозначенного научного направления изучаются в том числе процессы, протекающие в живых организмах.
На разных этапах исследования осуществлялись и/или проводятся различными методами, среди которых – методы квантовой химии (ab initio, DFT, HMDFT и др., полуэмпирические), молекулярной механики, QM/MM, молекулярной динамики, QSAR/QSPR-моделирования, молекулярного докинга; корреляционный анализ; электронная абсорбционная и флуоресцентная, рентгенофлуоресцентная, энергодисперсионная рентгеновская, ИК-, КР-, ЯМР-, ЯКР-, ЭПР-спектроскопия; мессбауэровская спектроскопия (ядерный гамма-резонанс); масс-спектрометрия, хроматография (газовая, газожидкостная, высокоэффективная жидкостная, эксклюзионная (гель-проникающая) и др.), хромато-масс-спектрометрия, денситометрия; вольтамперометрия, полярография, потенциометрия, электрофорез; вискозиметрия; измерение акустических свойств тонких пленок с помощью пьезоэлектрических резонаторов и фиттинговое моделирование; рентгенофазовый и рентгеноструктурный анализ; сканирующая и просвечивающая (трансмиссионная) электронная микроскопия; метод динамического рассеяния света (динамическое светорассеяние, фотонная корреляционная спектроскопия) с использованием технологии NIBS (неинвазивного обратного рассеяния), метод электрофоретического рассеяния света с применением технологии M3-PALS; рассмотрение кинетики реакций; препаративный синтез; экстракция; сорбция и др.
В соответствии со спецификой конкретных задач применяются квантовохимические методы различной иерархии и разного уровня теории, от полуэмпирических до модернизированных ab initio, DFT, HMDFT и др., а также современные подходы и методики, включая NBO-анализ, исключение энергетических вкладов, QTAIM, исследование орбитального взаимодействия, электростатического потенциала, расчет колебательных, электронных абсорбционных, ЯМР-спектров, масштабирование колебательных частот, разделение и анализ нормальных колебаний, учет ZPVE-, термических и BSSE-поправок, построение профилей поверхностей потенциальной энергии химических реакций, локализация переходных состояний, IRC, SCRF и т.д.
Столь широкий охват тем и подходов кажется автору оправданным. “Природа не знает о нашем делении на науки. Она едина. А это означает, что истинное познание ее законов требует коллективных усилий многих наук, иначе мы будем видеть только одну сторону явления и ничего не знать о других. Вот почему самые интересные открытия часто рождаются именно на стыках наук” [1].
Низкий поклон учителям – профессору Светлане Петровне Муштаковой и члену-корреспонденту РАН Льву Александровичу Грибову.
Основные результаты. Главная задача теоретической химии – предсказать течение химического процесса во времени и его конечный результат на основе сведений об энергии, строении и свойствах реактантов, интермедиатов, продуктов с учетом влияния среды (растворителя). На первый план сегодня выдвигаются задачи направленного конструирования (молекулярного дизайна) веществ и материалов с заданными характеристиками.
Перечислим здесь лишь основные научные результаты, полученные автором лично, а также совместно с учениками и коллегами.
Аналитические редокс-реагенты. Обоснованы механизмы химического и электрохимического окисления ароматических и гетероциклических аминосоединений, многие из которых являются аналитическими редокс-реагентами. Реакции окисления дифениламина (C6H5)2NH и его производных, трифениламина (C6H5)3N, карбазола, акридона, феноксазина, фенотиазина и его замещенных в кислых, нейтральных, щелочных водных, кислых водно-органических средах разными окислителями включают бимолекулярную лимитирующую стадию, образование катион-радикалов или аминильных радикалов, способных к димеризации; процесс носит одно- или двухэлектронный характер. Константа скорости второго порядка зависит от кислотности среды, что связано с участием окислителей и/или субстратов в протолитических равновесиях ([2–5] и др.).
Аналитический редокс-реагент 4-амино-4′-метоксидифениламин (вариаминовый синий, вариаминовый голубой) 4′-CH3OC6H4NHC6H4NH2-4 окисляется в умеренно кислых водных и водно-органических растворах в две одноэлектронные стадии до мономерного иминохиноидного катиона; в случае электроокисления на вращающемся дисковом электроде из стеклографита вторая стадия – скоростьопределяющая. Как показано для водно-диметилформамидных растворов, повышение pH от 2.45 до 4.52 сопровождается сменой лимитирующей стадии [4].
Процесс одноэлектронного электроокисления карбазола на вращающемся дисковом электроде из стеклографита в сернокислых водно-этанольных растворах в целом подчиняется смешанному (диффузионному и стадии переноса электрона) контролю. Происходит пассивация электрода вследствие осаждения на его поверхности димера, олигомера или полимера карбазола [3]. Покажем в этой связи вольт-амперные кривые редко встречающегося типа (рис. 1).
Рис. 1.
Кривые анодного окисления 1 мМ раствора карбазола на вращающемся дисковом электроде из стеклографита в смеси 5.25 M H2SO4–этанол (1 : 1, по объему) на фоне 0.3 M LiCl при различных значениях угловой скорости вращения электрода ω (рад/с): 1 – 87.2, 2 – 117.3, 3 – 167.6, 4 – 209.4, 5 – 303.7. Обозначения: I – сила анодного тока, E – потенциал относительно насыщенного хлоридсеребряного электрода.

Выяснена общность механизма окисления различных аминосоединений, которая обусловлена близким положением соответствующих азотсодержащих группировок в рядах изменения электронных эффектов, электроотрицательности заместителей, сходным характером распределения спиновой плотности в катион-радикалах и аминильных радикалах.
Развит подход к прогнозу селективности и молекулярному дизайну аналитических редокс-реагентов [6, 7].
Региоселективность реакций гомолитического сочетания. Сформулированы закономерности, регулирующие реакционную способность и регио-направленность гомолитического (радикального) окислительного и восстановительного сочетания (димеризации) органических веществ. Показано, что региоселективность реакций гомолитического сочетания регулируется в основном распределением спиновой плотности в радикальных интермедиатах [2].
Симбатность направлений электрофильных или нуклеофильных процессов и реакций окислительного либо восстановительного сочетания тиомочевины (H2N)2C=S $ \rightleftarrows $ HN=C(NH2)SH, N-фенилтиомочевины, многих соединений C6H5X, нафталина, антрацена, фенантрена, карбазола, акридана, акридона, 5,10-дигидрофеназина, феноксазина, фенотиазина, акридина, катионов N-метилпиридиния, пирилия, тиопирилия закладывается на уровне качественного сходства распределения электронной плотности в молекулах субстратов и спиновой плотности в радикальных интермедиатах [2].
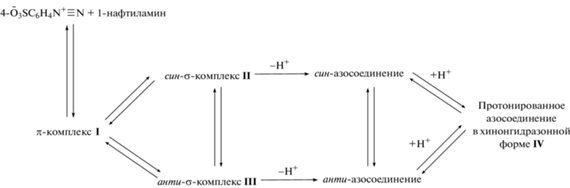
Аналитические характеристики реакций азосочетания. Обратимся теперь к примерам гетеролитических реакций. Тандем реакций диазотирования и азосочетания широко используется в производстве красителей, а также в аналитической химии. Нами созданы научные основы прогноза аналитических характеристик реакций азосочетания. Выяснено, в частности, что региоселективность реакций однозначно определяется термодинамикой интермедиатов – σ-комплексов, а также влиянием водной среды. Последняя обусловливает высокую позиционную селективность, обеспечивая выбор одного из двух возможных реакционных каналов, предсказанных на основе квантовохимических расчетов изолированных молекулярных систем. Кроме того, водная среда осуществляет селекцию аналитических форм – протонированных по β-атому азота азогруппы продуктов азосочетания, имеющих хинонгидразонное строение (пример – на схемах 1 и 2 ) [8, 9].
Схема 1 . Диазотирование 1-аминонафталина.
Схема 2 . Азосочетание: возможные направления взаимодействия 1-аминонафталина с катионом нафталин-1-диазония; региоселективность протонирования аминоазонафталинов.
Установлены закономерности, открывающие возможность предсказывать реакционную способность, выход аналитических форм реакций азосочетания с различными азо- и диазосоставляющими и, в конечном итоге, сравнительные аналитические характеристики реакций [8, 9].
Предложена вероятная схема реакции азосочетания 4-диазонийбензолсульфоната с 1-амино-нафталином (1-нафтиламин). Первоначально возникает π-комплекс I, предшествующий двум изомерным σ-комплексам II, III, которые трансформируются в син- и анти-азосоединения, каждое из которых при протонировании переходит в регистрируемый конечный продукт IV (аналитическую форму), представляющий собой сопряженную кислоту аминоазосоединения, имеющую хинонгидразонное строение (схема 3 ). Син-σ-комплекс II стабилизирован внутримолекулярной водородной связью N–H…O.
Схема 3 . Азосочетание 4-диазонийбензолсульфоната с 1-нафтиламином.
Теоретическое моделирование комплексообразования и других реакций. Многие положения аналитической химии основываются на ионных равновесиях в растворах. Изучено поведение тетрахлоропалладата(II) калия K2[PdCl4] в средах, моделирующих биологические жидкости. Показано, что в водных растворах хлорида натрия скорость акватации выше, чем скорость вхождения лиганда Cl− во внутреннюю координационную сферу атома палладия. В растворах хлороводородной кислоты, напротив, доминирует процесс образования хлорокомплексов палладия. Вероятно, последнее обусловлено протонированием молекулы воды в составе аквакомплексов. Квантовохимически исследованы внутримолекулярная водородная связь, реакции замещения лигандов – молекулы воды и катиона гидроксония – в планарных комплексах палладия(II) на хлорид-анион. По первым трем ступеням замещение катиона гидроксония во внутренней сфере атома палладия термодинамически благоприятнее по сравнению с вытеснением из координационной сферы молекулы воды. Установлено, что логарифмы ступенчатых констант устойчивости хлоридных комплексов палладия(II) линейно коррелируют с энтальпией реакций замещения молекул воды на хлорид-ион [10].
Объяснена стереонаправленность комплексообразования палладия(II) с хлорид-анионом и пирролин-2-олом (L) – таутомером 2-пирролидона. Термодинамически менее стабильный биологически активный цис-изомер комплекса [PdCl2L2] образуется вследствие того, что ему структурно предшествует энергетически наиболее предпочтительный тетрагонально-пирамидальный интермедиат ассоциативного нуклеофильного замещения. На надмолекулярном уровне цис-продукт стабилизируется межмолекулярной диполь-дипольной ассоциацией в кристалле [11].
Разработана методология квантовохимического исследования переноса “гидрид-иона”, основанная на анализе соответствия последовательности изменения энергии (потенциала) ионизации, энтальпии и свободной энергии сродства к гидрид-иону, атому водорода и протону молекул субстратов, а также производных от них катионов, катион-радикалов, радикалов, анионов, экспериментально обоснованным рядам “гидридной” подвижности [12].
Выяснена химическая сущность реакции между 1,5-дифенилселенопентандионом-1,5 C6H5COCH2SeCH2COC6H5 и L-цистеином H2NCH(CH2SH)COOH $ \rightleftarrows $ H3N+CH(CH2SH)COO− с образованием ацетофенона C6H5COCH3, элементного селена и L-цистина HOOCCH(NH2)- CH2SSCH2CH(NH2)COOH.
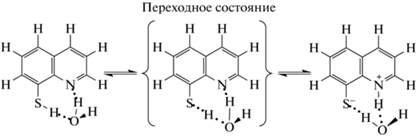
Водородная связь, протонный перенос, таутомерия. Изучен двойной протонный перенос (по типу бифункционального катализа) для водородносвязанного комплекса 8-меркаптохинолина с одной молекулой воды в газовой фазе и в растворе (схема 4 ):
Схема 4 . Перенос протона в молекуле 8-меркаптохинолина с участием воды.
Превращение с участием воды кинетически менее, а термодинамически более предпочтительно по сравнению с переносом одного протона без содействия молекулы воды [13].
Налицо принципиальное различие в степени влияния электростатических эффектов растворителя на относительную устойчивость различных форм 8-гидроксихинолина [14] и 8-меркаптохинолина [13]. Для первого из названных аналитических реагентов определяющим является вклад в устойчивость, внутренне присущий самим прототропным структурам. Напротив, в случае 8-меркаптохинолина полярная среда играет решающую роль в определении относительной стабильности различных форм.
Известно, что специфическое взаимодействие с растворителем в основном может быть учтено, если моделировать в явном виде комплекс изучаемой молекулы с одной молекулой растворителя. Рассмотрение переноса протона с содействием воды и помещение комплекса 8-меркаптохинолина с молекулой воды в диэлектрический континуум растворителя позволяют одновременно учесть влияние специфической и универсальной сольватации на реакционную способность в рамках дискретно-континуального подхода. Результаты изучения реакции с участием воды показывают возможность эстафетной передачи протона, как это происходит в воде с ее сложной структурой, выраженными элементами структурной упорядоченности в жидком состоянии.
Внутримолекулярный перенос протона в мономере 2-пирролидона имеет барьер ~50 ккал/моль и практически не зависит от растворителя. Двойной протонный перенос в водородносвязанных димерах происходит концертно и синхронно с низким барьером. Таким образом, прототропная таутомеризация 2-пирролидон–пирролин-2-ол протекает по межмолекулярному механизму [15].
Статья [16], посвященная конформационному анализу, рассмотрению электронной структуры, топологии распределения электронной плотности, внутримолекулярной водородной связи, таутомерии, спектров ЯМР на ядрах 1H, 13C, 15N, 17O и реакционной способности окисляющих и хелатообразующих аналитических реагентов 2-нитрозофенола и орто-нитрозонафтолов, в том числе с учетом влияния среды, признана одной из вызвавших наибольший интерес читателей (most-accessed articles) в 2007 г.
Изучено (ab initio и DFT) влияние внутримолекулярной водородной связи (ВВС) на электронное строение молекул с плоским квазициклом. Установлено, что ВВС приводит к локальному электронному перераспределению в квазицикле по сравнению с конформером без ВВС и соответствующим пара-изомером (в случае замещенных бензолов) [13, 14, 16, 17]. По-видимому, ВВС не влияет на механизм хелатообразования органических соединений (в том числе аналитических реагентов) с ионами металлов. Однако разрыв ее [17, 18] включается в энергетический эффект реакции, что важно для целевого конструирования аналитических реагентов [17].
Квантовохимически исследованы колебательные спектры салицилового альдегида 2-HOC6H4CH=O, салициловой кислоты 2-HOC6H4COOH, 1-нитрозо-2-нафтола, 2-нитрофенола 2-O2NC6H4OH, пирокатехина 1,2-C6H4(OH)2, гваякола 2-CH3OC6H4OH, 8-гидроксихинолина, трополона. Наиболее сильные сдвиги частот при образовании ВВС испытывают три колебания, связанные с движением гидроксильного протона: валентное q(OH) (частота уменьшается), плоское угловое β(OH) (частота незначительно повышается), неплоское движение связи OH типа кручения (ρ(OH)) (частота возрастает). Следует ожидать влияния ВВС на реакционную способность изученных соединений именно в реакциях с участием OH-группы, что подтверждается, в частности, зависимостью кислотно-оснóвных свойств от ВВС. Небольшие (~40 см−1) и, как правило, низкочастотные сдвиги наблюдаются у колебаний, локализованных на протоноакцепторной группировке. Для большинства колебаний ароматического цикла частоты повышаются (Δν ≤ 10−15 см−1). Отмеченные особенности имеют место для всего изученного ряда. Понижение частоты валентного колебания q(OH) и повышение частоты неплоского колебания ρ(OH) коррелируют с величиной энтальпии водородной связи (ΔH). Например, для 2-нитрофенола ΔH = –10.3 ккал/моль, Δν(q(OH)) = = –341 см−1, Δν(ρ(OH)) = +361 см−1; а для гваякола ΔH = –4.43 ккал/моль, Δν(q(OH)) = –55 см−1, Δν(ρ(OH)) = +203 см−1. В области проявления валентных колебаний OH экспериментальных ИК-спектров пирокатехина и гваякола имеются две полосы, отстоящие друг от друга на величину ~50 см−1. Этот сдвиг хорошо согласуется с величинами, полученными из квантовохимических расчетов: Δν = –41 см−1 (пирокатехин), –49 см−1 (гваякол), и свидетельствует о наличии в газовой фазе одновременно двух ротамеров названных веществ. В спектре пирокатехина (конформер с ВВС) имеется полоса валентного колебания q(OH) второй (свободной) OH-группы, причем Δν = +56 см−1 по сравнению с полосой ассоциированной гидроксильной группы. Для 2-нитрофенола и всех других исследованных соединений с ΔH < –5 ккал/моль в газофазных ИК-спектрах наблюдается только одна интенсивная полоса, отвечающая конформеру с ВВС.
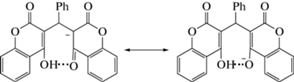
Факторы стабилизации ионных ассоциатов. Методом рентгеноструктурного анализа установлена молекулярная и кристаллическая структура ионного ассоциата катиона 2-аминобензимидазолия, моносольватированного диметилсульфоксидом (CH3)2S → O, с амбидентным анионом (V) кето-енольной триады 3,3′-(фенилметилен)бис-4-гидрокси-2Н-хромен-2-она (Ph = C6H5) (схема 5 ), возникающего в результате конкурентной кротоновой конденсации в реакционной one-pot системе 4-гидрокси-2Н-хромен-2-он–2-аминобензимидазол–бензальдегид C6H5CH=O наряду с региоизомерными дигидрохроменопиримидобен-зимидазолонами, формирующимися по механизму реакции Биджинелли. На примере названной молекулярной системы развита методология рассмотрения факторов стабилизации ионных ассоциатов (включая значимые для аналитической химии), связанных с катионной и анионной частями, аттрактивным взаимодействием катиона с анионом, с эффектами стабилизации ионной пары в целом и ее составных частей кристаллическим полем и сольватацией. Показана необратимость образования 3-[2,4-диоксо-(3Н-хромен-3-ил)(фенил)метил]-2-оксо-2Н-хромен-4-олат-аниона в one-pot реакции [19].
Схема 5 . Резонансные структуры, отражающие делокализацию отрицательного заряда в анионе V (Ph = C6H5).
Стабилизация систем с открытой электронной оболочкой. На уровне теории UB3LYP/6-311++G(3df,3pd) с привлечением NBO-анализа обоснованы факторы стабилизации свободного радикала 1,1-дифенил-2-пикрилгидразила (2,2-дифенил-1-пикрилгидразил, N,N-дифенил-N′-пикрилгидразил, ДФПГ, DPPH) (C6H5)2N–N•–C6H2(NO2)3-2,4,6 – мягкого дегидрирующего средства, ингибитора гомолитических реакций, аналитического реагента, стандарта в спектроскопии ЭПР: делокализация электронной и спиновой плотности, отрицательный заряд на радикальном и аминном N-центрах, стерическое экранирование радикального и аминного атомов азота. Рассмотрение данных литературы позволило выявить такие факторы, как ассоциация в монокристаллах в антиферромагнитные димеры без спаривания спинов электронов и образования новой связи N–N и сольватация. Выявленные нами факторы стабилизации радикала ДФПГ могут быть положены в основу методологии дизайна стабильных свободных радикалов и ион-радикалов различного строения.
Количественные соотношения структура–свойство. Доказано существование молекул (C6H5)3AsCl2, (C6H5)3Sb(OH)Cl, (C6H5)3SbCl2, (C6H5)3Bi(ONO2)2, (C6H5)3BiCl2 соединений пентакоординированных мышьяка, сурьмы и висмута в растворах в форме тригональной бипирамиды с аксиальными неорганическими лигандами (см. например, [20]).
Установлены количественные соотношения (сотни зависимостей для сотен молекулярных систем), имеющие четко выраженный физический смысл и дающие возможность a priori оценивать теплоту и свободную энергию образования, энтропию, значения энергии (потенциала) ионизации, сродства к электрону, потенциала химического и электрохимического окисления и восстановления, величины pKa, константы устойчивости, значения дипольного момента, частоты колебательных спектров, электроотрицательность, индуктивные и мезомерные параметры атомных групп и другие свойства неорганических, органических, элементоорганических, координационных соединений, выход продуктов и скорость реакций электрофильного и нуклеофильного ароматического замещения, скорость ферментативного окисления аминов и фенольных субстратов, переноса ионов поверхностно-активных веществ через нанофильтрационные мембраны (молекулярные сита) ([6, 7, 10, 20–24] и др.).
Развита методология простой теоретической оценки теплоты образования химических соединений в конденсированном состоянии [24].
Электроотрицательность и другие эффекты заместителей в молекулах. Взаимосвязанные концепции жесткости (мягкости) и электроотрицательности приобретают все большее значение в химии для реализации единого подхода к двум важнейшим химическим проблемам – конструированию барьеров реакций и молекулярному дизайну, для объяснения региоселективности и амбивалентности (нуклеофильно-электрофильной дихотомии) ([25–27] и др.), для описания и моделирования химической связи, свойств молекул и кристаллов, межмолекулярного взаимодействия [28], сольватации, экстракции [29, 30].
Концепция электроотрицательности (в том числе в связи с принципом жестких и мягких кислот и оснований), особенно в варианте переменной орбитальной электроотрицательности, оказывается по существу именно тем языком химии, благодаря которому она легко встраивается в общую теорию систем. Действительно, отчетливая периодичность электроотрицательности и подчеркнутая ею контрастность свойств (электроположительные и электроотрицательные элементы, жесткие и мягкие кислоты и основания) лежат в основе природы химического взаимодействия и появления новых качеств в результате выравнивания электроотрицательности (или электронного химического потенциала), погашения противоположностей в ходе кислотно-оснóвных реакций и т.п. [28].
Аналитические свойства органических реагентов зависят от электронной структуры их молекул, электроотрицательности атомных групп. Не всегда роль последнего фактора прослеживается в явном виде. Существуют, однако, и количественные соотношения подобного рода. Например, экстракционная способность коррелирует с электроотрицательностью заместителей в молекулах экстрагентов [29].
Многосторонне, в том числе с позиций жесткости (мягкости) (связанной с электроотрицательностью) трактуются реакции комплексообразования, экстракционная и сорбционная аналитическая химия комплексов ионов металлов с макроциклическими лигандами [31].
Для решения разнообразных химических задач построены различные эмпирические и теоретические шкалы электроотрицательности. Нами установлены 90 прогностических линейных корреляций, связывающих электротрицательность, индуктивный параметр иота и мезомерный дипольный момент атомных групп (величины, имеющие ясный физический смысл, в отличие от констант заместителей, базирующихся на принципе линейности свободных энергий) с индексами электронной структуры молекул [21].
Выяснены дальность и специфика действия эффекта электроотрицательности атомных групп в насыщенных системах. Дальность не превышает трех атомов углерода и не связана прямо с общей электроноакцепторной способностью заместителя. Считается и пишется в учебниках, что под влиянием названного эффекта происходит альтернирование (чередование) знака заряда углеродных атомов алифатической цепи. На самом деле имеет место альтернирование знака изменений натурального заряда [32].
Для многих органических соединений химические сдвиги в спектрах ЯМР 13C линейно коррелируют с натуральным зарядом на атомах углерода. α- и β-Эффекты в спектроскопии ЯМР 1H широко распространены, но не являются универсальными, так как не во всех случаях введение заместителя приводит к уменьшению электронной плотности на атоме α-C и к увеличению ее на атоме β-C [32].
Показано, что заместители в молекулах влияют на реакционную способность мостиковых дифенилов в электрофильных реакциях (протонирование, ацилирование), на скорость окисления диариламинов в основном посредством эффекта поля независимо от природы мостиковых групп (CH2, CH=CH, NH, O, S).
Молекулярное моделирование белок–лигандного взаимодействия. Биоспецифическое (аффинное) взаимодействие (фермент–субстрат или ингибитор, антиген–антитело, рецептор–лиганд (например, гормон), белок–белок, белок (в наибольшей степени лектин)–углевод, белок–липид, белок–нуклеотид, нуклеотид–нуклеотид и др.) играет важнейшую роль в живой природе, лежит в основе современных методов и подходов аналитической химии (иммунохимические методы анализа, аффинная хроматография и т.п.), в которых достигается специфичность как предельное выражение селективности. Молекулярное распознавание специфическими мишенями занимает центральное положение в процессе адресной доставки лекарств.
Методом QM/MM нами осуществлено моделирование взаимодействия лектина арахиса с семью углеводами, молекулы которых включают звенья D-галактозы (рис. 2) и D-глюкозы. При этом квантовохимической подсистемой служили аминокислотные фрагменты сайта связывания и молекула углевода. В качестве критерия углеводной специфичности предложена величина энергии образования комплекса (конъюгата) лектин–углевод из его составных частей. Дано теоретическое обоснование наибольшей специфичности лектина арахиса по отношению к β-аномерным галактобиозам, а также большей специфичности к производным галактозы по сравнению с производными глюкозы [33].
Рис. 2.
Макромолекула лектина арахиса в комплексе с β-1,4-D-галактобиозой (одна четвертая элементарной ячейки кристалла). В нижней левой части рисунка скопление красных шаров соответствует молекуле β-1,4-D-галактобиозы. В нижней части рисунка крупные красные шары обозначают: слева – ион кальция, справа – ион марганца(II). Не показаны атомы водорода. Цвет полипептидной цепи постепенно меняется с красного на синий (красный С-конец, синий N-конец).

Проведен QTAIM-анализ взаимодействия между гидроксильными группами углевода и полярными (амидными, карбоксильными, гидроксильными) группами белка. Установлено, что это взаимодействие удовлетворяет критериям водородного связывания. Анализ топологических свойств электронной плотности указывает на доминирующую роль остатков L-аспарагиновой H2NCH(CH2COOH)COOH $ \rightleftarrows $ $ \rightleftarrows $ H3N+CH(CH2COOH)COO− и L-глутаминовой H2NCH(CH2CH2COOH)COOH $ \rightleftarrows $ $ \rightleftarrows $ H3N+CH(CH2CH2COOH)COO− кислот в белок-углеводном связывании. Результаты молекулярного моделирования коррелируют с данными экспериментов по углеводной специфичности, а также вкладу в нее природы аномеров углеводов и звеньев L-глутаминовой кислоты. Последнее подтверждает предсказательную силу метода QM/MM в целом, энергии образования конъюгата белок–углевод как критерия углеводной специфичности, а также электронной плотности в критической точке связи и лапласиана этой величины в отношении установления ключевых для проявления лектиновой активности аминокислотных остатков [33].
Результаты проведенных исследований и обобщения (включая классификационные) находят отражение в учебных пособиях и монографиях в пограничном поле различных областей науки и знаний ([34–37] и др.). Такие издания призваны “наводить мосты” между разными сторонами постижения действительности, способствуют формированию единой картины мира, пониманию сущности явлений и процессов в их единстве и многообразии.
* * *
В ходе наших исследований, наряду с другими научными результатами, разработана методология решения ряда прогностических, структурных, динамических и интерпретационных задач химии: априорного предсказания разнообразных характеристик веществ, молекул и атомных групп; простой теоретической оценки теплоты образования химических соединений в конденсированном состоянии; выяснения дальности и специфики действия эффекта электроотрицательности заместителей в молекулах; выявления природы взаимодействий между валентно несвязанными атомами в молекулярных системах некоторых типов; обсуждения участии несвязывающих (неподеленных) электронных пар гетероатомов в реакциях с электрофильными агентами; количественного предсказания абсорбционных максимумов в электронных спектрах ненасыщенных соединений; прогноза селективности и молекулярного дизайна аналитических редокс-реагентов; обоснования региоселективности реакций гомолитического окислительного и восстановительного сочетания соединений различных классов (в том числе еще в 1980-е годы – вытекающей из химической неэквивалентности ароматических колец замещенных соединений ряда дифениламина); изучения влияния энергетики, геометрии, электронной структуры, дескрипторов молекул реактантов, переходных состояний, интермедиатов, продуктов, водородной связи, электростатического, гидрофобного факторов, гидратации, сольватации на реакционную способность химических соединений, механизмы, регионаправленность и аналитические параметры реакций; обсуждения участия тех или иных несвязывающих (неподеленных) электронных пар гетероатомов в реакциях с электрофильными агентами; оценки дифференциального влияния растворителей на кислотно-оснóвные свойства; прогноза возможности формирования и устойчивости ионных ассоциатов, их способности к экстракции; рассмотрения факторов стабилизации ионных ассоциатов и систем с открытой электронной оболочкой; установления структуры соединений пентакоординированных мышьяка, сурьмы и висмута в растворах; квантовохимического исследования переноса “гидрид-иона”; аналитического определения дисульфидов в препаратах соединений с тиольной функцией (спектроскопия КР, ЯМР 1H, высокоэффективная жидкостная хроматография); молекулярного моделирования (QM/MM, QTAIM) биоспецифического (аффинного) взаимодействия (на примере систем лектин–углевод) и др. Прогноз свойств молекул и веществ может служить основанием для решения о целесообразности синтеза тех или иных соединений. Получаемые научные результаты имеют значение для управления химическими процессами и аналитическими эффектами, создания новых аналитических реагентов, других практически ценных веществ и материалов. Рассмотрение тонких деталей биоспецифического (аффинного) взаимодействия делают принципиально возможными разработку высокоспецифичных способов определения различных аналитов.
Список литературы
Семенов Н.Н. Многообещающий союз наук // Наука и жизнь. 1968. № 3. С. 3.
Pankratov A.N. Trends in spin density distribution in radical intermediates in connection with homolytic coupling directions of organic compounds // J. Mol. Struct.: THEOCHEM. 1994. V. 315. № 1. P. 179. https://doi.org/10.1016/0166-1280(94)03779-K
Pankratov A.N., Stepanov A.N. Oxidation and homolytic coupling regioselectivity of carbazole in acidic media // Croat. Chem. Acta. 1997. V. 70. № 2. P. 585.
Pankratov A.N., Bilenko O.A., Mushtakova S.P. Oxidation of 4-amino-4′-methoxydiphenylamine in aqueous and organo-aqueous media // Afinidad. 2000. T. 57. № 487. P. 201.
Панкратов А.Н. Строение продукта окисления дифениламина – родоначального представителя ряда аналитических редокс-реагентов // Журн. аналит. химии. 2001. Т. 56. № 2. С. 161. (Pankratov A.N. Structure of the products of the oxidation of diphenylamine, the first member in a family of analytical redox reagents // J. Anal. Chem. 2001. V. 56. № 2. P. 140.)https://doi.org/10.1023/A:1009494602408
Pankratov A.N., Shchavlev A.E. Semiempirical quantum chemical PM3 computations and evaluations of redox potentials, basicities and dipole moments of the diphenylamine series as analytical reagents // Canad. J. Chem. 1999. V. 77. № 12. P. 2053. https://doi.org/10.1139/v99-206
Панкратов А.Н., Щавлев А.Е. Протолитические, окислительно-восстановительные и полярные свойства реагентов ряда дифениламина: квантовохимическая оценка // Журн. аналит. химии. 2001. Т. 56. № 2. С. 143. (Pankratov A.N., Shchavlev A.E. Protolytic, redox, and polar properties of diphenylamine and related reagents: quantum-chemical evaluation // J. Anal. Chem. 2001. V. 56. № 2. P. 123.)https://doi.org/10.1023/A:1009438517429
Pankratov A.N. Azo-coupling reactions used in analytical chemistry: The role of reactants, intermediates, and aqueous medium // Helvetica Chim. Acta. 2004. V. 87. № 6. P. 1561. https://doi.org/10.1002/hlca.200490143
Панкратов А.Н. Аналитические реакции азосочетания: взгляд с точки зрения квантовой химии // Журн. аналит. химии. 2005. Т. 60. № 10. С. 1036. (Pankratov A.N. Analytical azo coupling reactions: A quantum-chemical consideration // J. Anal. Chem. 2005. V. 60. № 10. P. 920.)https://doi.org/10.1007/s10809-005-0210-y
Панкратов А.Н., Бородулин В.Б., Чаплыгина О.А. Обмен лигандов в системах Pd(II)–NaCl–H2O и Pd(II)–HCl–H2O: квантово-химическое рассмотрение // Коорд. химия. 2005. Т. 31. № 9. С. 696. (Pankratov A.N., Borodulin V.B., Chaplygina O.A. Ligand exchange in Pd(II)–NaCl–H2O и Pd(II)–HCl–H2O systems: Quantum-chemical consideration // Russ. J. Coord. Chem. 2005. V. 31. № 9. P. 660.)https://doi.org/10.1007/s11173-005-0152-9
Панкратов А.Н., Бородулин В.Б., Чаплыгина О.А. Таутомерия и региоселективность протонирования 2-пирролидона. Стереонаправленность комплексообразования палладия(II) с хлорид-ионом и 2-пирролидоном // Коорд. химия. 2005. Т. 31. № 7. С. 523. (Pankratov A.N., Borodulin V.B., Chaplygina O.A. Tautomerism and regioselectivity of the protonation of 2-pyrrolidone. Stereoselectivity of complexation between palladium(II), chloride ion, and 2-pyrrolidone // Russ. J. Coord. Chem. 2005. V. 31. № 7. P. 494.)https://doi.org/10.1007/s11173-005-0125-z
Панкратов А.Н., Древко Б.И. Квантово-химическое изучение “гидридной” подвижности в молекулах халькогенопиранов // Химия гетероцикл. соедин. 2005. № 9. С. 1305. (Pankratov A.N., Drevko B.I. Quantum-chemical study of “hydride” mobility in the molecules of chalcogenopyrans // Chem. Heterocycl. Compds. 2005. V. 41. № 9. P. 1105.)https://doi.org/10.1007/s10593-005-0287-0
Shchavlev A.E., Pankratov A.N., Shalabay A.V. Theoretical studies on the intramolecular hydrogen bond and tautomerism of 8-mercaptoquinoline in the gaseous phase and in solution using modern DFT methods // J. Phys. Chem. A. 2005. V. 109. № 18. P. 4137. https://doi.org/10.1021/jp050838e
Shchavlev A.E., Pankratov A.N., Shalabay A.V. DFT computational studies on rotation barriers, tautomerism, intramolecular hydrogen bond, and solvent effects in 8-hydroxyquinoline // Int. J. Quantum Chem. 2006. V. 106. № 4. P. 876. https://doi.org/10.1002/qua.20759
Shchavlev A.E., Pankratov A.N., Borodulin V.B., Chaplygina O.A. DFT Study of the monomers and dimers of 2-pyrrolidone: Equilibrium structures, vibrational, orbital, topological, and NBO analysis of hydrogen-bonded interactions // J. Phys. Chem. A. 2005. V. 109. № 48. P. 10982. https://doi.org/10.1021/jp053753m
Shchavlev A.E., Pankratov A.N., Enchev V. Intramolecular hydrogen-bonding interactions in 2-nitrosophenol and nitrosonaphthols: Ab initio, density functional, and nuclear magnetic resonance theoretical study // J. Phys. Chem. A. 2007. V. 111. № 30. P. 7112. https://doi.org/10.1021/jp068540r
Панкратов А.Н., Шалабай А.В. Влияние внутримолекулярной водородной связи на электронное строение органических молекул с планарным квазициклом // Журн. структ. химии. 2007. Т. 48. № 3. С. 472. (Pankratov A.N., Shalabay A.V. Effect of the intramolecular hydrogen bond on the electronic structure of organic molecules with a planar quasicycle // J. Struct. Chem. 2007. V. 48. № 3. P. 427.)https://doi.org/10.1007/s10947-007-0064-2
Fedorov E.E., Makarov O.E., Pankratov A.N., Grinev V.S. Gas-liquid chromatography-obtained differences in the dissolution enthalpy between two positional isomers in a polar stationary phase: A measure of the inter- or intramolecular hydrogen bond energy? // J. Chromatogr. A. 2012. V. 1241. P. 76. https://doi.org/10.1016/j.chroma.2012.04.010
Панкратов А.Н., Федотова О.В., Озерова А.Г., Мажукина О.А., Страшилина И.В. Структура и факторы стабилизации ионного ассоциата катиона 2-аминобензимидазолия с анионом 3,3′-(фенилметилен)бис(4-гидрокси-2Н-хромен-2-она), образующегося в системе 4-гидрокси-2Н-хромен-2-он−2-аминобензимидазол–бензальдегид // Журн. орг. химии. 2016. Т. 52. № 9. С. 1338. (Pankratov A.N., Fedotova O.V., Ozerova A.G., Mazhukina O.A., Strashilina I.V. Structure and stabilization factors of the 2-aminobenzimidazolium–3,3′-(phenylmethylene)-bis(4-hydroxy-2H-chromen-2-one) anion associate in the system 4-hydroxy-2H-chromen-2-one–benzimidazole-2-amine–benzaldehyde // Russ. J. Org. Chem. 2016. V. 52. № 9. P. 1326.)https://doi.org/10.1134/S107042801609013X
Панкратов А.Н., Учаева И.М. Термодинамические свойства соединений висмута и конфигурация молекул (C6H5)3BiX2 (X = Cl, ONO2) по данным квантово-химических исследований // Журн. неорг. химии. 2004. Т. 49. № 9. С. 1520. (Pankratov A.N., Uchaeva I.M. Thermodynamic properties of bismuth compounds and the configuration of (C6H5)3BiX2 (X = Cl, ONO2) molecules from quantum-chemical data // Russ. J. Inorg. Chem. 2004. V. 49. № 9. P. 1403.)
Pankratov A.N., Shchavlev A.E. Group electronegativities, inductive and mesomeric parameters from semiempirical quantum chemical computations // Monatsh. Chem. 1998. V. 129. № 10. P. 1007. https://doi.org/10.1007/PL00010111
Панкратов А.Н. Количественные соотношения структура–свойство в ряду катионов диазония – полупродуктов синтеза аналитических форм и красителей // Журн. аналит. химии. 2005. Т. 60. № 2. С. 149. (Pankratov A.N. Quantitative structure–property relationships in the series of diazonium cations, intermediate products in the synthesis of analytical forms and dyes // J. Anal. Chem. 2005. V. 60. № 2. P. 130.)https://doi.org/10.1007/s10809-005-0038-5
Панкратов А.Н., Шалабай А.В. Квантовохимическая оценка протолитических свойств тиофенолов // Журн. структ. химии. 2004. Т. 45. № 5. С. 800. (Pankratov A.N., Shalabai A.V. Quantum-chemical evaluation of the protolytic properties of thiophenols // J. Struct. Chem. 2004. V. 45. № 5. P. 756.)https://doi.org/10.1007/s10947-005-0055-0
Панкратов А.Н. Методология простой квантовохимической оценки твердофазных теплот образования при постоянстве межмолекулярных взаимодействий в рядах соединений (на примере хинонов) // Журн. структ. химии. 2007. Т. 48. № 3. С. 478. (Pankratov A.N. Methodology of simple quantum chemical estimation of solid-phase heats of formation with constant intermolecular interactions over the series of compounds (by the example of quinones) // J. Struct. Chem. 2007. V. 48. № 3. P. 433.)https://doi.org/10.1007/s10947-007-0065-1
Воловик С.В., Дядюша Г.Г., Станинец В.И. Региоселективность и реакционная способность свободных радикалов в процессах присоединения и ароматического замещения / Под ред. Походенко В.Д. Киев: Наукова думка, 1988. 112 с.
Воловик С.В., Станинец В.И., Зефиров Н.С. Природа эффектов амбивалентности в химической реакционноспособности // Теор. эксп. химия. 1990. Т. 26. № 4. С. 413. (Volovik S.V., Staninets V.I., Zefirov N.S. Nature of ambivalence effects in chemical reactivity // Theor. Exp. Chem. 1990. V. 26. № 4. P. 390.)https://doi.org/10.1007/BF00530251
Воловик С.В., Станинец В.И., Зефиров Н.С. К интерпретации природы химических реакций в рамках теории функционала плотности // Докл. АН (Россия). 1993. Т. 330. № 3. С. 321.
Урусов В.С. Концепция орбитальной электроотрицательности и ее место в энергетической кристаллохимии // Журн. структ. химии. 1994. Т. 35. № 1. С. 111. (Urusov V.S. Orbital electronegativity concept and its role in energetic crystal chemistry // J. Struct. Chem. 1994. V. 35. № 1. P. 101.)https://doi.org/10.1007/BF02578507
Розен А.М., Крупнов Б.В. Зависимость экстракционной способности органических соединений от их строения // Успехи химии. 1996. Т. 65. № 11. С. 1052. (Rozen A.M., Krupnov B.V. Dependence of the extraction ability of organic compounds on their structure // Russ. Chem. Rev. 1996. V. 65. № 11. P. 973. )https://doi.org/10.1070/RC1996v065n11ABEH000241
Бучихин Е.П., Чекмарев А.М., Бобыренко Н.А. Параметры “жесткости” и “мягкости” катионов и их применение для расчета констант экстракции // Журн. неорг. химии. 2010. Т. 55. № 5. С. 847. (Buchikhin E.P., Chekmarev A.M., Bobyrenko N.A. Parameters of cation “hardness” and “softness” and application thereof for calculation of extraction constants // Russ. J. Inorg. Chem. 2010. V. 55. № 5. P. 790.)https://doi.org/10.1134/s0036023610050219
Золотов Ю.А., Формановский А.А., Плетнев И.В., Дмитриенко С.Г., Беклемишев М.К., Исакова Н.В., Моросанова Е.И., Пасекова Н.А., Шпигун Л.К., Цингарелли Р.Д., Торочешникова И.И. Макроциклические соединения в аналитической химии / Под. ред. Золотова Ю.А., Кузьмина Н.М. М.: Наука, 1993. 320 с.
Pankratov A.N. Electronic structure and reactivity of inorganic, organic, organoelement and coordination compounds: An experience in the area of applied quantum chemistry / Quantum Chemistry Research Trends / Ed. Kaisas M.P. New York: Nova Science Publishers, Inc., 2007. P. 57.
Панкратов А.Н., Бычков Н.А., Цивилева О.М. Методология QM/MM-обоснования углеводной специфичности белков (на примере лектина арахиса) // Прикл. аналит. химия. 2014. № 1 (11). С. 26.
Панкратов А.Н. Кислоты и основания в химии. Саратов: Изд-во Саратовск. ун-та, 2006. 196 с.
Панкратов А.Н. Избранные главы электрохимии органических соединений. Ионные жидкости. Саратов: Изд-во Саратовск. ун-та, 2011. 132 с.
Бурмистрова Н.А., Панкратов А.Н., Муштакова С.П. Ароматические амины: структура, реакции окисления, применение в аналитической химии. Саратов: Изд-во Саратовск. ун-та, 2016. 108 с.
Панкратов А.Н., Учаева И.М. Реакции окисления-восстановления в окружающей среде. М.: Изд-во “Перо”, 2020. 256 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии