Журнал аналитической химии, 2023, T. 78, № 1, стр. 43-47
Замена ацетонитрила на этанол при определении антоцианов методом обращенно-фазовой высокоэффективной жидкостной хроматографии
В. И. Дейнека a, *, Е. Ю. Олейниц a, И. П. Блинова a, Л. А. Дейнека a
a Белгородский государственный национальный исследовательский университет,
Институт фармации, химии и биологии
308015 Белгород, ул. Победы, 85, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 17.01.2022
После доработки 27.01.2022
Принята к публикации 29.01.2022
- EDN: KKKPBF
- DOI: 10.31857/S0044450222110056
Аннотация
Экспериментально установлено, что замена ацетонитрила на этанол при подкислении подвижной фазы ортофосфорной кислотой является эффективным вариантом замены ацетонитрила. При этом порядок элюирования однотипных гликозидов пяти основных антоцианидинов (дельфинидина, цианидина, петунидина, пеонидина и мальвидина) не изменяется в удобных для анализа элюентах, а диапазон времен удерживания полного набора таких антоцианов заметно сокращается при переходе от ацетонитрила к этанолу. Для определения влияния строения гликозидного радикала на удерживание производных одного и того же антоцианидина (цианидина) использовали смесь шести гликозидов – одного моногликозида (3-глюкозида), двух 3-дигликозидов (софорозида и самбубиозида) и двух 3‑тригликозидов (2"-глюкозилрутинозида и 2"-ксилозилрутинозида). Эта смесь представляет собой реально встречающийся набор антоцианов, требующих тщательного подбора подвижной фазы для разделения всех компонентов. В работе на основе анализа карт разделения определен состав подвижной фазы на основе этанола, позволяющий добиться эффективного разделения этих антоцианов.
Обращенно-фазовая ВЭЖХ относится к числу наиболее часто используемых методов в аналитических лабораториях. При этом в качестве подвижной фазы часто применяют ацетонитрил как растворитель с уникальными и удобными для реализации метода свойствами [1]. Кроме благоприятных для ВЭЖХ-анализа свойств ацетонитрил имеет и недостатки – высокую стоимость и токсичность, что вынуждает искать другие растворители для замены ацетонитрила. В работе [1] изучали возможность замены ацетонитрила на метанол и получили положительные результаты, однако исследование носило фрагментарный характер: сопоставляли результаты разделения антоцианов ограниченного набора объектов при случайно выбранных составах подвижных фаз в градиентном режиме с недостаточно подкисленным одним из компонентов в каждом из вариантов (при использовании ацетонитрила или метанола). О том, что недостаточное и неравномерное подкисление подвижной фазы может привести к проблемам при количественном определении антоцианов указано в работе [2]. Систематический анализ изменения селективности разделения антоцианов при замене ацетонитрила на метанол выявил особенности удерживания антоцианов в зависимости от строения агликона и гликозидных радикалов и показал, что метанол может эффективно заменить ацетонитрил [3].
Среди альтернативных растворителей для обращенно-фазовой ВЭЖХ обычно выделяют этанол как менее токсичный по сравнению с ацетонитрилом и метанолом, повсеместно доступный и более дешевый компонент подвижных фаз [4]. Примеры (21 вариант) использования этанола в качестве компонента подвижных фаз в фармацевтическом анализе приведены в работе [4]. Известно лишь несколько работ по определению антоцианов с этанолом в качестве органического компонента подвижной фазы. В работе [5] проблемы при разделении антоцианов отсутствовали, поскольку в плодах жимолости голубой, шелковицы и ежевики антоцианы представлены практически единственным цианидин-3-глюкозидом. Аналогично в работе [6] определен также один основной антоциан (пара-кумароил − производное петунидин-3-рутинозил-5-глюкозида). В работе [7] разделены компоненты более сложной смеси трех производных цианидина из красных листьев Prunus cerasifera var. Atropurpurea, однако качество хроматограмм невысокое.
Цель настоящей работы – исследование возможностей подвижных фаз на основе этанола при разделении сложных смесей антоцианов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экстракты антоцианов готовили настаиванием растительного материала (плодов винограда и красной смородины) в 0.1 М водном растворе соляной кислоты в течение суток и хранили в бытовом холодильнике. Экстракты очищали методом твердофазной экстракции на патронах ДИАПАК С18 (БиоХимМак СТ, Москва, Россия).
Для контроля видового состава антоцианов в образцах применяли хроматографическую систему Agilent 1260 Infinity с диодно-матричным детектором. Использовали хроматографическую колонку 150 × 4.6 мм Symmetry C18, 3.5 мкм при температуре термостата колонок 40°С. В работе использовали следующие системы:
(а) 10 об. % муравьиной кислоты–(6–10) об. % ацетонитрила–вода;
(б) 1 об. % ортофосфорной кислоты–(10–20) об. % ацетонитрила–вода;
(в) 1 об. % ортофосфорной кислоты–10–15 об. % этанола–вода.
Все хроматограммы записывали в изократическом режиме в нескольких различных составах подвижных фаз для каждой из элюентных систем.
Хроматограммы записывали, хранили и обрабатывали, используя программное обеспечение Agilent ChemStation.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для сопоставления удерживания антоцианов в подвижных фазах с различными органическими модификаторами сопоставляли карты разделения, позволяющие сделать вывод об особенностях хроматографического поведения не при одном случайно выбранном составе подвижных фаз, а во всей элюентной системе.
Данные об удерживании цианидин-3-глюкозида (Cy3G) на карте разделения в координатах lgk(i)−ϕ (объемная доля органического модификатора) приведены на рис. 1. Как видно, для всех трех элюентных систем зависимость логарифма фактора удерживания Cy3G от состава подвижных фаз описывается квадратичным уравнением [8]:
Рис. 1.
Влияние концентрации органического модификатора на удерживание цианидин-3-глюкозида в трех элюентных системах: (а) 10 об. % муравьиной кислоты–(6–10) об. % ацетонитрила–вода; (б) 1 об. % ортофосфорной кислоты–(10–20) об. % ацетонитрила–вода; (в) 1 об. % ортофосфорной кислоты–(10–15) об. % этанола–вода.

При этом ослабление элюирующей силы подвижных фаз при переходе от системы (а) к системе (б) объясняется тем, что муравьиная кислота является не только кислотным модификатором для перевода форм антоцианов преимущественно во флавилиевую, но и модификатором, определяющим удерживание антоцианов вместе с ацетонитрилом. Переход к элюентной системе (б) связан с необходимостью создания корректной системы сравнения для системы (в) из-за нестабильности свойств системы 10 об. % муравьиной кислоты–этанол–вода вследствие ацилирования спирта муравьиной кислотой. Сопоставление показывает, что этанол оказывается компонентом с заметно меньшей по сравнению с ацетонитрилом элюирующей силой: для достижения lg k(Cy3G) = 0.5 требуются подвижные фазы, содержащие 7.25, 10.12 и 12.62 об. % органического модификатора для систем (а), (б) и (в) соответственно.
Зависимость удерживания антоцианов от строения агликона (антоцианидина, образовавшего антоциан). По предложенному в нашей лаборатории поплавочному механизму [9] зависимость удерживания от строения принципиально различается для агликона, проникающего внутрь привитой фазы, и для гликозидных заместителей, остающихся на поверхности обращенной фазы.
Зависимость удерживания от строения агликона исследовали по картам относительного удерживания [10] на примере пяти 3-глюкозидов (3G), (дельфинидина, Dp; цианидина, Cy; петунидина, Pt, пеонидина, Pn; и мальвидина, Mv), встречающихся, например, в экстрактах плодов винограда Vitis vinifera [11], а также в экстрактах многих других растительных объектов в виде однотипных производных различных агликонов. На рис. 2 сопоставлено разделение антоцианов в двух элюентных системах (а) и (б). Видно, что порядок элюирования пяти 3-глюкозидов оказывается одинаковым для любых удобных для определения этих антоцианов (по затратам времени) составов подвижных фаз сопоставляемых элюентных систем:
Рис. 2.
Сопоставление удерживания пяти 3-глюкозидов в двух элюентных системах (а) и (б). Антоцианы: 1 – Dp3G, 2 – Cy3G, 3 – Pt3G, 4 – Pn3G, 5 – Mv3G.
При этом замена муравьиной кислоты на ортофосфорную несколько уменьшает диапазон времен удерживания между Dp3G и Mv3G, что удобно при определении чувствительного к сорту винограда соотношения между концентрациями пяти неацилированных антоцианов [11].
Результат замены ацетонитрила на этанол (при сохранении ортофосфорной кислоты в качестве подкислителя подвижной фазы) иллюстрирует рис. 3.
Рис. 3.
Сопоставление удерживания пяти 3-глюкозидов в двух элюентных системах (б) и (в). Антоцианы: 1 – Dp3G, 2 – Cy3G, 3 – Pt3G, 4 – Pn3G, 5 – Mv3G.

Очевидно, что относительное падение удерживания 3-гликозидов, содержащих в кольце В агликона метоксигруппы (производные мальвидина, пеонидина и петунидина), с ростом концентрации этанола в подвижной фазе существенно возрастает при замене ацетонитрила на этанол. Добавление ОН-группы в кольцо В (переход от Cy3G к Dp3G) приводит к противоположному эффекту. При этом порядок элюирования пяти 3-глюкозидов остается таким же, как указано выше, но с ростом концентрации этанола различие во временах удерживания Mv3G и Pn3G уменьшается, создавая проблемы при разделении этих компонентов.
Зависимость удерживания антоцианов от строения гликозидного радикала. Для анализа влияния строения гликозидного радикала на удерживание антоцианов выбрано шесть производных цианидина – один 3-моногликозид (Cy3G), три 3-дигликозида: 3-софорозид (Cy3Sopho); 3-самбубиозид (Cy3Sam) и 3-рутинозид (Cy3Rut) и два 3-тригликозида: 3-(2"-глюкозилрутинозид) (Сy3GRut) и 3-(2"-ксилозилрутинозид) (Сy3XRut). Эти антоцианы встречаются в плодах популярных в России некоторых сортов и видов вишни [12], некоторых сортов красной смородины [13], в уменьшенном числе производных в плодах черной малины [14], бузины черной [15] и др.
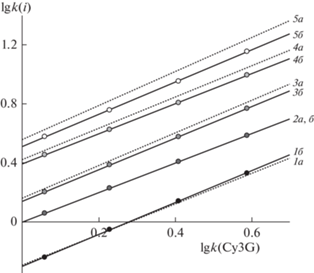
На рис. 4 сопоставлены карты разделения этих соединений в элюентных системах (б) и (в). Очевидно, что анализ смеси всех шести компонентов требует тщательного подбора состава подвижной фазы для каждой из систем вследствие большого числа пересечений линий на карте (т.е. инверсий порядка элюирования). В обоих случаях наклон прямых линий возрастает при усложнении состава гликозидного радикала от моногликозада до тригликозида. Очевидно также, что утверждение о том, что при добавлении гликозидного радикала в структуру уже существующего заместителя не может быть корректным, поскольку порядок элюирования зависит от состава подвижной фазы. Но при этом замена ацетонитрила на этанол приводит к заметному ослаблению удерживания 3-тригликозидов и 3-дигликозидов по сравнению с моногликозидом, что можно объяснить лучшей сольватацией гликозидных заместителей этанолом по сравнению с ацетонитрилом.
Рис. 4.
Сопоставление удерживания шести различных 3-глюкозидов цианидина в двух элюентных системах (б) и (в). Антоцианы: 1 – Cy3Sopho, 2 – Cy3GRut, 3 – Cy3G, 4 – Cy3Sam, 5 – Cy3XRut, 6 – Cy3Rut.

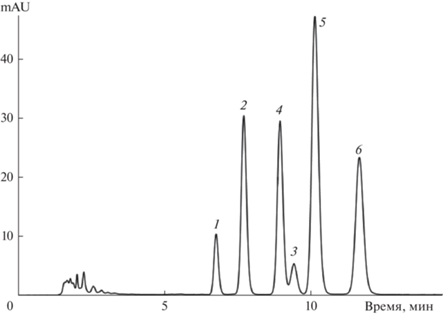
Рис. 5.
Разделение шести различных 3-глюкозидов цианидина в подвижной фазе состава 11.2 об. % этанола–1 об. % ортофосфорной кислоты–87.8 об. % воды. Расход подвижной фазы 0.8 мл/мин, температура 40°С, колонка 150 × 4.6 мм Symmetry C18, 3.5 мкм. Антоцианы: 1 – Cy3Sopho, 2 – Cy3GRut, 3 – Cy3G, 4 – Cy3Sam, 5 – Cy3XRut, 6 – Cy3Rut.
Кроме того, установлено, что отмеченная в качестве “неудобного” свойства этанола высокая вязкость элюентов, содержащих более 80% воды, мало сказывается на величинах входного давления на колонку по сравнению с ацетонитрилом – давление возрастает только от 150 до 170 бар. Эффективность (число теоретических тарелок) оказалась также сопоставимой для элюентных систем (б) и (в).
Таким образом, этанол является эффективной альтернативой экологически неблагоприятному ацетонитрилу при определении антоцианов, как однотипных гликозидов различных агликонов, так и различных типов гликозидов одного и того же агликона.
Работа поддержана грантом Российского фонда фундаментальных исследований “Аспиранты”, номер 20-33-90031/20.
Список литературы
Bordonaba J.G., Crespo P., Terry L.A. A new acetonitrile-free mobile phase for HPLC-DAD determination of individual anthocyanins in blackcurrant and strawberry fruits: A comparison and validation study // Food Chem. 2011. V. 129. P. 1265.
Дейнека В.И., Олейниц Е.Ю., Саласина Я.Ю., Блинова И.П., Дейнека Л.А. Хроматографическое разделение и определение антоцианов в условиях обращенно-фазовой хроматографии при использовании в качестве подвижных фаз систем ацетонитрил–муравьиная кислота/фосфорная кислота–вода // Журн. физ. химии. 2021. Т. 95. С. 1278.
Дейнека В.И., Олейниц Е.Ю., Блинова И.П., Дейнека Л.А. Управление селективностью разделения антоцианов. Замена ацетонитрила на метанол в подвижной фазе // Журн. аналит. химии. 2021. Т. 76. С. 701.
Yabré M., Ferey L., Somé I.T., Gaudin K. Greening reversed-phase liquid chromatography methods using alternative solvents for pharmaceutical analysis // Molecules. 2018. V. 23. Article 1065.
Sang J., Ma Q., Li C.-Q. Development and validation of green chromatography for the determination of anthocyanins in haskap berry, mulberry and blackberry // Anal. Methods. 2017. V. 9. P. 25.
Zhang Y., Chen F.F., Sang J. Green approach for sample preparation and determination of anthocyanins from Lycium ruthenicum Murr. Using a β-cyclodextrin-based extraction method coupled with UPLC-DAD analysis // Food Anal. Methods. 2018. V. 11. P. 2141.
Chen F.F., Sang J., Zhang Y., Sang J. Development of a green two-dimensional HPLC-DAD/ESI-MS method for the determination of anthocyanins from Prunus cerasifera var. atropurpurea leaf and improvement of their stability in energy drinks // Int. J. Food Sci. Technol. 2018. V. 53. P. 1494.
Schoenmakers P.J., Billiet H.A.H., Tijssen R., De Galan L. Gradient selection in reversed-phase liquid chromatography // J. Chromatogr. A. 1978. V. 149. P. 519.
Дейнека В.И., Дейнека Л.А., Саенко И.И., Чулков А.Н. “Поплавочный” механизм удерживания в обращенно-фазовой хроматографии // Журн. физ. химии. 2015. Т. 89. С. 1172.
Дейнека В.И. Карта хроматографического разделения и инкрементные зависимости в методе относительного анализа удерживания в ВЭЖХ // Журн. физ. химии. 2006. Т. 80. С. 511.
Revilla E., García-Beneytez E., Cabello F., Martín-Ortega G., Ryan J.-M. Value of high-performance liquid chromatographic analysis of anthocyanins in the differentiation of red grape cultivars and red wines made from them // J. Chromatogr. A. 2001. V. 915. P. 53.
Дейнека Л.А., Чулков А.Н., Дейнека В.И., Сорокопудов В.Н., Шевченко C.М. Антоцианы плодов вишни и родственных растений // Научные ведомости БелГУ Сер. Естественные науки. 2011. № 9 (104). Вып. 15/1. С. 364.
Goiffon J.P., Mouly P.P., Gaydou E.M. Anthocyanic pigment determination in red fruit juices, concentrated juices and syrups using liquid chromatography // Anal. Chim. Acta. V. 382. P. 39.
Dossett M., Lee J., Finn C.E. Variation in anthocyanins and total phenolics of black raspberry populations // J. Funct. Foods. 2010. V. 2. P. 292.
da Silva R.F.R., Barreira J.C.M., Heleno S.A., Barros L., Calhelha R.C., Ferreira I.C.F.R. Anthocyanin profile of elderberry juice: A natural-based bioactive colouring ingredient with potential food application // Molecules. 2019. V. 24. Article 2359.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


