Журнал аналитической химии, 2023, T. 78, № 1, стр. 34-42
Применение углеродных квантовых точек для определения аминогликозидных антибиотиков методом поляризационного флуоресцентного иммуноанализа
М. Ю. Ларина a, О. В. Фарафонова a, *, С. А. Еремин b, Т. Н. Ермолаева a
a Липецкий государственный технический университет
398055 Липецк, ул. Московская, стр. 30, Россия
b Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: ov.farafonova@yandex.ru
Поступила в редакцию 15.12.2021
После доработки 10.01.2022
Принята к публикации 17.02.2022
- EDN: KKHWLP
- DOI: 10.31857/S0044450222110068
Аннотация
Изучены условия получения углеродных квантовых точек (УКТ) с зеленой флуоресценцией путем ультразвуковой обработки многослойных углеродных нанотрубок в смеси HNO3 и H2SO4 (УКТ-1) и микроволнового разложения 9,10-динитроантрацена в этаноле (УКТ-2). Методом атомно-силовой микроскопии оценены размеры УКТ, а методами спектрофотометрии и флуоресценции их оптические свойства. Для выявления на поверхности УКТ активных функциональных групп, участвующих в образовании устойчивых связей при синтезе трейсеров, применен метод ИК-спектрометрии. Показана возможность применения УКТ в качестве меток в поляризационном флуоресцентном иммуноанализе (ПФИА). Разработаны методики определения аминогликозидных антибиотиков гентамицина, стрептомицина и амикацина методом ПФИА на TDx-анализаторе (Abbott Diagnostics, США), приведены их метрологические характеристики. Предел обнаружения составляет (нг/мл) 20, 10 и 3, а диапазон определяемых содержаний (мкг/мл) 0.05–3.00, 0.02–6.00 и 0.01–3.00 для гентамицина, стрептомицина и амикацина соответственно. Методики апробированы при определении гентамицина, стрептомицина и амикацина в молочных продуктах.
В иммунохимических методах анализа для контроля над протеканием иммунохимических реакций применяют различные метки, наиболее часто ферментные или флуоресцентные. Невысокая стабильность применяемых ферментов и флуоресцентных органических красителей в качестве меток снижает воспроизводимость результатов анализа, поэтому актуален поиск новых меток, лишенных таких недостатков, в том числе на основе наночастиц [1, 2]. Наночастицы с размерами, близкими к длине волны электрона (1–10 нм), называют квантовыми точками (КТ). Длиной волны поглощения или люминесценции легко управлять, изменяя размеры самой квантовой точки. В настоящее время КТ активно используют в аналитической химии в качестве флуоресцентных меток с уникальными оптическими свойствами, в несколько раз превосходящими свойства традиционно используемых органических красителей (высокая фотостабильность, поглощение света в широком спектральном диапазоне, длительное время жизни во флуоресцентном состоянии). Квантовые точки на основе халькогенидов металлов (CdSe, ZnS, PbTe) широко применяют в иммунохроматографии [3, 4] и твердофазном флуоресцентном иммуноанализе [5, 6]. Тем не менее токсичность исходных материалов, многоэтапный процесс получения и необходимость гидрофилизации поверхности несколько ограничивают применение таких КТ в иммуноанализе [7].
Углеродные квантовые точки (УКТ) размером <10 нм – новый тип флуоресцентных наночастиц. В отличие от КТ на основе халькогенидов металлов, УКТ обладают не только уникальными оптическими свойствами, но и высокой гидрофильностью, низкой токсичностью, а также могут быть получены простыми способами [8]. К настоящему времени УКТ положительно зарекомендовали себя как эффективные флуоресцентные метки в иммунохроматографии [9, 10], микрофлюидном [11] и твердофазном флуоресцентном иммуноанализах [12, 13].
Поляризационный флуоресцентный иммуноанализ (ПФИА) – это гомогенный метод, основанный на измерении поляризации флуоресценции флуоресцентно-меченного аналита – трейсера, конкурирующего с определяемым компонентом в анализируемой пробе за ограниченное число специфических сайтов связывания антител. Метод ПФИА характеризуется простотой, экспрессностью и точностью, а отсутствие стадии иммобилизации и разделения свободных и связанных фракций иммунореагентов делает его привлекательным для определения низкомолекулярных соединений, в частности антибиотиков [14], микотоксинов [15], пестицидов [16] и др.
В качестве флуоресцентной метки в ПФИА наиболее часто применяют органический краситель флуоресцеин и его структурные изомеры, имеющие невысокую молекулярную массу, хорошую биосовместимость и относительно высокий квантовый выход флуоресценции [17]. Однако существенным недостатком таких флуорофоров являются ограниченные спектральные характеристики, низкая фото- и химическая стабильность, влияющие на чувствительность ПФИА-методик определения аналитов.
Следует отметить, что большая группа приборов, предназначенных для измерения поляризации флуоресценции, ориентирована на применение флуоресцеиновых красителей. К таким приборам относится и широко используемый в лабораторной практике анализатор TDx (Abbott Diagnostics, США), оснащённый светофильтрами с длинами волн возбуждения и эмиссии 485 нм и 525–550 нм соответственно [18]. Это накладывает определенные ограничения на применяемую флуоресцентную метку. Исследована возможность применения в ПФИА полупроводниковых квантовых точек CdTe, CdTe/CdS, CdTe/CdS/ZnS [19, 20]. Установлено, что медленное вращение свободного КТ-меченного трейсера за счет большой молекулярной массы значительно сокращает диапазон определяемых концентраций аналита, даже несмотря на его длительное время жизни во флуоресцентном состоянии [21]. Углеродные квантовые точки в поляризационном флуоресцентном иммуноанализе ранее не применяли. В то же время уникальные оптические характеристики УКТ, превосходящие характеристики органических красителей, и их меньшая молекулярная масса по сравнению с халькогенидами металлов дают основание предполагать более высокую чувствительность определения низкомолекулярных соединений методом ПФИА.
Цель настоящего исследования − разработка методик определения ряда аминогликозидных антибиотиков – гентамицина, стрептомицина, амикацина − методом поляризационного флуоресцентного иммуноанализа на анализаторе поляризации флуоресценции TDx с применением в качестве флуоресцентных меток углеродных квантовых точек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. Для получения УКТ использовали: многостенные углеродные нанотрубки (МУНТ) “Таунит” (диаметр 20–50 нм, длина ~1 см) (НаноТехЦентр, Россия); азотную кислоту (ρ = 1.513 г/мл), серную кислоту (ρ = = 1.8356 г/мл), 9,10-динитроантрацен, этанол (ρ = 0.7893 г/мл) (Химмед, Россия).
Для синтеза трейсеров применяли сульфаты стрептомицина (СТР), гентамицина (ГЕНТ), амикацина (АМИК) (Sigma-Aldrich, США); 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид; N-гидроксисукцинимид (Termo Fisher Scientific InP., США); центрифужные концентраторы 3 кДа с полиэфирсульфоновой (ПЭС) мембраной (Pall Life Sciences, США).
В анализе применяли поликлональные антитела (пАн) к гентамицину, стрептомицину, амикацину (Abcam, Великобритания). Разбавление иммунореагентов осуществляли 0.1 М фосфатным буферным раствором (ФБР) (рН 7.6), содержащим 0.1% азида натрия.
Для получения УКТ использовали ультразвуковую ванну ПСБ-2835-03 с рабочей частотой 40 кГц (ПСБ-Галас, Россия), настольную центрифугу ЦЛН-2 (КиргизИНТИ, Киргизия), микроволновую печь Elenberg MG 2025 с регулируемой мощностью излучения 100–700 Вт (Elenberg, Россия), гидрофильный политетрафторэтиленовый (ПТФЭ) фильтр с диаметром пор 0.22 мкм (АкваАналитикс Техника, Россия).
Спектры поглощения и флуоресценции УКТ регистрировали на спектрофлуориметре ФЛЮОРАТ-02 ПАНОРАМА (Люмекс, Россия). Присутствие функциональных групп на поверхности УКТ устанавливали методом ИК-спектрометрии в области 4500–400 см–1 на спектрометре IRAffinity-1 (Shimadzu, Япония). Размер УКТ оценивали с помощью сканирующего зондового микроскопа Solver P47-PRO (Нанотехнология-МДТ, Россия) в контактном режиме сканирования на подложке из слюды диаметром 15 × 0.1 мм. Изображения, полученные методом атомно-силовой микроскопии (АСМ), обрабатывали с помощью программы Image Analysis 3.5, средний размер УКТ рассчитывали статистическим методом анализа 100 случайных частиц, используя функцию Grain Analysis с построением кривой Гауссовой аппроксимации.
Поляризацию флуоресценции измеряли в режиме Photo Check на анализаторе TDх (Abbott Diagnostics, США). Длина волны возбуждения (λex) – 485 нм, эмиссии (λem) – 525–550 нм.
Получение углеродных квантовых точек осуществляли следующими способами:
1) УКТ-1 – смешивали 7.5 мл азотной и серной кислот в соотношении 1 : 3, добавляли 2.5 мг МУНТ и подвергали ультразвуковой обработке при 120°C в течение 15 ч;
2) УКТ-2 – растворяли 50 мг 9,10-динитроантрацена в 5 мл 20%-ного этанола и подвергали обработке микроволновым излучением мощностью 700 Вт в течение 4 мин.
Продукты реакции, промывали 20%-ным этанолом, центрифугировали при 10 000 об/мин в течение 20 мин и фильтровали через ПТФЭ-фильтр.
Синтез трейсеров. Трейсеры с меткой УКТ-1 синтезировали следующим образом: в этанольный раствор УКТ-1 (800 мкл, 0.8 мкг) вводили 1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорид (100 мкл, 10 мкмоль) и N-гидроксисукцинимид (100 мкл, 15 мкмоль). Смесь перемешивали в течение 15 мин при 37°С и добавляли антибиотик (ГЕНТ, СТР, АМИК) (800 мкл, 10 мкмоль), затем инкубировали в течение 4 ч при комнатной температуре.
При синтезе трейсеров с меткой УКТ-2 в их этанольный раствор (800 мкл, 0.8 мкг) вводили избыток антибиотика (ГЕНТ, СТР, АМИК) (800 мкл, 50 мкмоль) и перемешивали реакционную смесь в течение 12 ч при 24°С.
Синтезированные трейсеры очищали методом ультрафильтрации с использованием центрифужных концентраторов 3 кДа с ПЭС-мембраной.
Измерение поляризации флуоресценции. Для установления оптимальной концентрации антител проводили их последовательное разбавление в 1000 раз 0.1 М фосфатным буферным раствором. В кюветы вносили по 500 мкл растворов антител и трейсера и измеряли поляризацию флуоресценции. По результатам измерения строили графики зависимости величины поляризации флуоресценции (mP) от разбавления антител.
Для построения градуировочных графиков 50 мкл стандартного раствора антибиотика с концентрацией 1–10 000 нг/мл смешивали с 500 мкл растворов трейсера и антител с выбранной концентрацией. Смесь инкубировали в течение 10 мин и измеряли поляризацию флуоресценции. По результатам измерения строили графики зависимости относительной величины поляризации флуоресценции (mP/mP0) от логарифма концентрации стандартных растворов антибиотиков.
Пробоподготовка проб молочной продукции. Пробы молочных продуктов смешивали с фосфатным буферным раствором в соотношении 1 : 1 и фильтровали через нейлоновый фильтр.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение и исследование свойств углеродных квантовых точек. Условием проведения измерений на TDx-анализаторе является применение меток, флуоресцирующих в области λem 525–550 нм, поэтому изучали способы получения углеродных квантовых точек с зеленой флуоресценцией.
Исследовали два способа синтеза КТ: “сверху-вниз” (УКТ-1) и “снизу-вверх” (УКТ-2). Первый способ включает обработку макрообъекта с его последующим постепенным уменьшением до наноразмеров [22]. В качестве исходного материала выбрали МУНТ, представляющие собой листы графена, свернутые в цилиндр с толщиною стенок в один атом, поэтому УКТ-1 условно можно назвать “графеновыми” точками. Углеродный материал обрабатывали смесью азотной и серной кислот в соотношении 1 : 3. Серная кислота ускоряет процесс разрушения МУНТ, поскольку ион нитрония из азотной кислоты образуется только в кислой среде. Для инициации разрушения МУНТ не только в местах дефектов, но и вдоль базальных графитовых плоскостей применяли ультразвуковое воздействие [23].
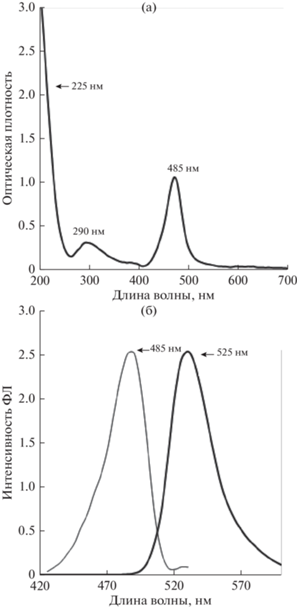
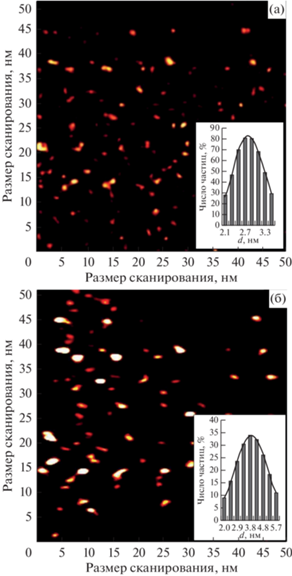
Результаты исследования методом АСМ показали, что УКТ-1 имеют форму частиц, близкую к сферической, со средним диаметром 2.7 ± 0.2 (рис. 1а). Спектр поглощения (рис. 2а) имеет два пика при 225 и 290 нм, первый из которых можно объяснить π–π* переходами в связях C=C. Размытие второго пика в сторону длин волн с меньшей энергией связано с n–π* переходами функциональных групп (карбонил/амин) на поверхности УКТ. Флуоресценция наблюдается при 525 нм (рис. 2а), что соответствует заданным условиям.
Рис. 1.
АСМ-снимки и распределительные гистограммы диаметров углеродных квантовых точек: (а) − УКТ-1; (б) − УКТ-2.
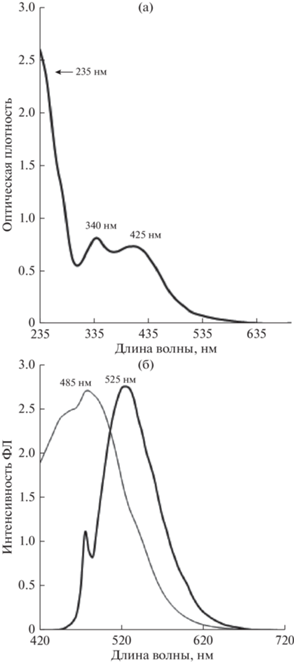
При синтезе наноструктур способом “снизу-вверх” происходит выстраивание отдельных атомов или молекул в упорядоченную систему. Ранее установлено [24], что из полициклических ароматических углеводородов можно получить УКТ кристаллической структуры, а применение микроволнового воздействия, сопровождающегося быстрым равномерным нагревом реакционной смеси, способствует увеличению дисперсности частиц. В связи с этим разложение 9,10-динитроантрацена в этаноле под действием микроволнового излучения осуществляли, контролируя размер синтезируемых квантовых точек (УКТ-2).
Установлено, что частицы, флуоресцирующие в диапазоне 525–550 нм, образуются при воздействии микроволнового излучения мощностью 700 Вт в течение 4 мин. Средний диаметр УКТ-2 составляет 4.1 ± 0.5 нм, при этом для большинства частиц характерна эллиптическая форма (рис. 1а). Спектр флуоресценции для УКТ-2 имеет “предпик”, появление которого объясняется присутствием поверхностных ловушек – дефектных участков в структуре отдельных наноточек (рис. 3б). Сам пик размыт, но соответствует необходимой области свечения.
Химическую структуру поверхности УКТ изучали методом ИК-спектроскопии. Данные ИК-спектрометрических исследований для УКТ-1 подтверждают присутствие на поверхности карбоксильных групп C=O (1730 см–1) и существование полиароматической связи С=С (1520 см–1) между отдельными атомами. Пики при 3550–3200 см–1 и 1780 см–1 в спектре УКТ-2 указывают на валентные колебания связей O−H/N−H и карбоксильных групп −COOH соответственно. Вместе с этим линии поглощения связей С=N (1640 см–1) и связи С−N/C−O (1390–1360 см–1), подтверждают присутствие атомов азота в структуре УКТ-2.
Синтез трейсеров. Синтез трейсера является критическим шагом в разработке ПФИА-методики. Молекулярная структура трейсера, включающая антиген, линкерную цепь и флуоресцентную метку, может напрямую влиять на чувствительность определения. При синтезе трейсеров использовали три антибиотика ГЕНТ, СТР, АМИК (рис. 4) и различные по структуре УКТ-1, УКТ-2. Трейсеры с меткой УКТ-1 синтезировали карбодиимидным методом путем сопряжения аминогруппы антибиотика с карбоксильной группой на поверхности УКТ [25]. Характер связи, образующейся при синтезе трейсеров с “графеновыми” квантовыми точками, на поверхности которых преобладают карбоксильные группы, достаточно подробно изучен и описан для углеродных нанотрубок [26].
Для выявления связей, образующихся между аминогликозидными антибиотиками и УКТ-2 сравнивали их ИК-спектры со спектрами синтезированных трейсеров. Смещение пика поглощения связи С=N трейсера ГЕНТ-УКТ-2 в коротковолновую область спектра (рис. 5) с 1640 до 1648 см–1, а также существенное уширение и смещение связей С−N/C−O с 1360 до 1420 см–1 при одновременном отсутствии пиков поглощения связей N−H (2920 см–1) и С−N (1520, 1377, 1280 см–1), характерных для аминогрупп гентамицина, свидетельствует об образовании амидной связи −CONH− (1580 см–1) с молекулой гентамицина. Поскольку наблюдаемый пик в спектре трейсера ГЕНТ-УКТ-2 достаточно мал, можно говорить о сопряжении УКТ-2 с молекулой гентамицина через одну аминогруппу.
Таким образом, образование связи через карбоксильные группы на поверхности УКТ позволяло независимо оценить влияние структуры и размера флуоресцентной метки на чувствительность ПФИА, исключая длину линкерной цепи трейсера и его вариабельность, связанную с изменением структуры антибиотика.
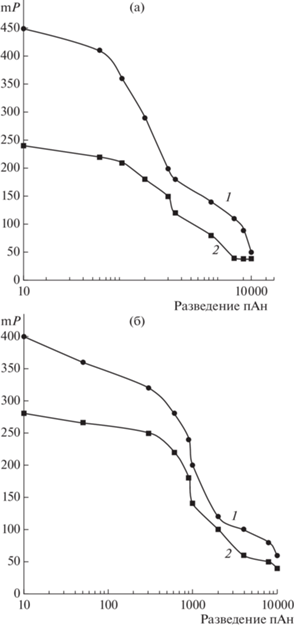
Измерение поляризации флуоресценции. Важной задачей при разработке методики ПФИА является выбор оптимальных концентраций иммунореагентов, поскольку от этого зависит чувствительность анализа. Рабочую концентрацию трейсеров устанавливали, исходя из 10-кратного увеличения сигнала интенсивности флуоресценции по сравнению со значением для 0.1 М ФБР. Оптимальную концентрацию поликлональных антител находили из расчета 50%-ного связывания с трейсером, принимая во внимание линейность кривой в полулогарифмических координатах в диапазоне от 80 до 20%. Используя графические зависимости, в ПФИА СТР, ГЕНТ (рис. 6) и АМИК выбрали концентрации антител 1/2000, 1/800 и 1/3000 соответственно.
Рис. 6.
Зависимости связывания антител с трейсерами от степени их разведения: (а): ГЕНТ-УКТ-1 (1), ГЕНТ-УКТ-2 (2); (б): СТР-УКТ-1 (1), СТР-УКТ-2 (2).
При построении градуировочных графиков использовали зависимости относительной величины поляризации флуоресценции (mP/mP0) от логарифма концентрации стандартных растворов антибиотиков. Градуировочные графики для определения гентамицина и амикацина представлены на рис. 7, аналогичный график построили для стрептомицина. Диапазон определяемых концентраций для всех исследуемых аминогликозидных антибиотиков при применении трейсеров с меткой УКТ-1 значительно шире, чем для трейсеров с меткой УКТ-2, а предел обнаружения составил 20, 10 и 3 нг/мл для ГЕНТ, СТР и АМИК соответственно. При использовании трейсеров с меткой УКТ-2 предел обнаружения ГЕНТ и СТР в два раза ниже по сравнению с меткой УКТ-1, а для амикацина наблюдается обратный эффект. Однако диапазон определяемых содержаний сужается при применении УКТ-2. Стоит отметить, что середина градировочных графиков, так называемый параметр IC50 (концентрация аналита при 50%-ном ингибировании сигнала), также существенно ниже для СТР при применении УКТ-2 и выше для АМИК, что нужно учитывать при разработке методики анализа. В табл. 1 для сравнения приведены метрологические характеристики определения аминогликозидов с трейсерами на основе флуоресцеинизотиоционата (ФИТЦ), заимствованные из работы [27], демонстрирующие более высокие пределы обнаружения. Например, для ГЕНТ предел обнаружения на порядок выше соответствующих значений, полученных с использованием трейсеров с УКТ.
Рис. 7.
Градуировочные графики для определения (а) гентамицина с трейсерами ГЕНТ-УКТ-1 (1), ГЕНТ-УКТ-2 (2); (б) амикацина с трейсерами АМИК-УКТ-1 (1), АМИК-УКТ-2 (2) методом поляризационного флуоресцентного иммуноанализа.

Таблица 1.
Метрологические характеристики определения аминогликозидных антибиотиков методом поляризационного флуоресцентного иммуноанализа
| Антибиотик | Трейсер | cmin, нг/мл | IC50, мкг/мл | Диапазон определяемых концентраций, мкг/мл |
|---|---|---|---|---|
| ГЕНТ | ГЕНТ-УКТ-1 | 20 | 0.5 | 0.05–3.00 |
| ГЕНТ-УКТ-2 | 10 | 0.4 | 0.02–1.00 | |
| ГЕНТ-ФИТЦ | 110 | – | 0.15–4.50 | |
| СТР | СТР-УКТ-1 | 10 | 0.8 | 0.03–6.00 |
| СТР-УКТ-2 | 5 | 0.3 | 0.01–3.00 | |
| СТР-ФИТЦ | 15 | – | 0.02–10.00 | |
| АМИК | АМИК-УКТ-1 | 3 | 0.1 | 0.01–3.00 |
| АМИК-УКТ-2 | 5 | 0.2 | 0.01–1.00 | |
| АМИК-ФИТЦ | 9 | – | 0.02–1.40 |
В этой связи можно говорить о том, что трейсеры с метками УКТ-1 легко образуют иммунокомплексы с антителами, поскольку их малый размер исключает или снижает вероятность стерических конформаций, что однозначно подтверждается при определении амикацина. Дополнительное присутствие азотсодержащих групп на поверхности УКТ-2 при определении гентамицина и стрептомицина, по-видимому, обеспечивают структурную схожесть трейсера с иммуногеном, что обеспечивает более высокую чувствительность. Однако их больший размер сокращает диапазон определяемых концентраций за счет стерических эффектов конформаций при высокой концентрации антител.
Оценка специфичности определения гентамицина, стрептомицина и амикацина методом поляризационного флуоресцентного иммуноанализа. При разработке иммунохимических методик необходимо оценивать специфичность используемых для анализа антител. Коэффициент перекрестного реагирования (%) поликлональных антител рассчитывали в присутствии родственных структурных аналогов ГЕНТ, СТР и АМИК (табл. 2).
Таблица 2.
Коэффициенты перекрестного реагирования (%) поликлональных антител
| Родственные структуры | Гентамицин | Стрептомицин | Амикацин |
|---|---|---|---|
| Гентамицин | 100 | 5 | 4 |
| Канамицин | 2 | 5 | 2 |
| Стрептомицин | 5 | 100 | <1 |
| Амикацин | 4 | <1 | 100 |
| Неомицин | 4 | 3 | 1 |
Антитела к ГЕНТ, СТР и АМИК не проявляют высокой перекрестной реактивности к родственным структурным аналогам, что позволяет говорить о возможности высокоспецифичного определения ГЕНТ, СТР и АМИК по разработанным ПФИА-методикам.
Определение аминогликозидных антибиотиков в молочных продуктах. Правильность разработанных методик ПФИА-определения гентамицина, стрептомицина и амикацина в образцах молочной продукции оценивали методом введено−найдено (табл. 3). С использованием критерия Стьюдента показано отсутствие систематической погрешности (tэксп < tтабл = 2.78).
Таблица 3.
Результаты определения гентамицина, стрептомицина, амикацина в молочной продукции (n = 5, P = 0.95, tтабл = 2.78)
| Продукт | Антибиотик | Введено, мкг/кг | Найдено, мкг/кг |
sr | tэксп |
|---|---|---|---|---|---|
| Молоко (2.5%) | Гентамицин | 50.00 | 50.02 ± 1.55 | 0.02 | 0.04 |
| Стрептомицин | 50.00 | 50.58 ± 2.07 | 0.02 | 0.60 | |
| Амикацин | 50.00 | 50.68 ± 1.05 | 0.03 | 1.39 | |
| Кефир (1%) | Гентамицин | 100.00 | 101.80 ± 2.22 | 0.02 | 1.74 |
| Стрептомицин | 100.00 | 100.40 ± 1.11 | 0.01 | 0.77 | |
| Амикацин | 100.00 | 100.82 ± 1.34 | 0.01 | 1.32 |
* * *
Таким образом, применение углеродных квантовых точек для определения аминогликозидных антибиотиков методом поляризационного флуоресцентного иммуноанализа позволяет добиться более высокой чувствительности определения по сравнению с данными ПФИА с использованием в качестве флуоресцентной метки ФИТЦ.
Исследование выполнено в рамках Программы развития Междисциплинарной научно-образовательной школы Московского университета “Будущее планеты и глобальные изменения окружающей среды”.
Список литературы
Горячева И.Ю. Современные тенденции развития иммунохимических методов анализа медицинских объектов // Журн. аналит. химии. 2015. Т. 70. № 8. С. 787. (Goryacheva I.Yu. Modern trends in the development of immunochemical methods for the analysis of medical objects // J. Anal. Chem. 2015.V. 70. № 8. P. 903.)
Speranskaya E.S., Goryacheva I.Yu. Fluorescent quantum dots: Synthesis, modification, and application in immunoassays // Nanotechnologies in Russia. 2013. V. 8. № 11–12. P. 685.
Di Nardo F., Anfossi L., Giovannoli C., Passini C., Goftman V.V., Goryacheva I.Yu., Baggiani C. A fluorescent immunochromatographic strip test using quantum dots for fumonisins detection // Talanta. 2016. V. 150. P. 463.
Anfossi L., Di Nardo F., Cavalera S., Giovannoli C., Spano G., Speranskaya E.S., Baggiani C. A lateral flow immunoassay for straightforward determination of fumonisin mycotoxins based on the quenching of the fluorescence of CdSe/ZnS quantum dots by gold and silver nanoparticles // Microchim. Acta. 2018. V. 185. № 2. P. 94.
Zhang C., Han Y., Lin L., Deng N., Chen B., Liu Y. Development of quantum dots-labeled antibody fluorescence immunoassays for the detection of morphine // J. Agric. Food Chem. 2017. V. 65. № 6. P. 1290.
Zhu L., Cui X., Wu J., Wang Z., Wang P., Hou Y., Yang M. Fluorescence immunoassay based on carbon dots as labels for the detection of human immunoglobulin G // Anal. Methods. 2014. V. 6. № 12. P. 4430.
Cahuilla A., Soriano M.L., Carrillo-Carrion C., Valances M. Semiconductor and carbon-based fluorescent nanodots: The need for consistency // Chem. Commun. 2016. V. 52. P. 1311.
Li S., Wang Y., Mu X., Sheng W., Wang J., Wang S. Two fluorescence quenching immunochromatographic assays based on carbon dot and quantum dot as donor probes for the determination of enrofloxacin // Anal. Methods. 2019. V. 11. P. 2378.
Pan M., Xie X., Liu K., Yang J., Hong L., Wang S. Fluorescent carbon quantum dots — Synthesis, functionalization and sensing application in food // Analysis. Nanomaterials. 2020. V. 10. № 5. P. 930.
Chunduri L.A.A., Haleyurgirisetty M.K., Patnaik S., Bulagonda P.E., Kurdekar A., Liu J. Development of carbon dot-based microplate and microfluidic chip immunoassay for rapid and sensitive detection of HIV-1 p24 antigen // Microfluid Nanofluid. 2016. V. 20. P. 167
Zhang C., Yu X., Shi X., Han Y., Guo Z., Liu Y. Development of carbon quantum dot–labeled antibody fluorescence immunoassays for the detection of morphine in hot pot soup base // Food Anal. Methods. 2020. V. 13. P. 1042.
Yao D., Liang A., Jiang Z. A fluorometric clenbuterol immunoassay using sulfur and nitrogen doped carbon quantum dots // Microchim. Acta. 2020. V. 186. P. 323.
Zhu L., Cui X., Wu J., Wang Z., Wang P., Hou Y., Yang M. Fluorescence immunoassay based on carbon dots as labels for the detection of human immunoglobulin G // Anal. Methods. 2014. V. 6. № 12. P. 4430.
Воронежцева О.В., Еремин С.А., Ермолаева Т.Н. Определение аминогликозидных антибиотиков в пищевых продуктах методом поляризационного флуоресцентного иммуноанализа // Вестник ВГУ. 2009. № 2. С. 11.
Beloglazova N.V., Eremin S.A. Rapid screening of aflatoxin B1 in beer by fluorescence polarization immunoassay // Talanta. 2015. V. 142. P. 170.
Ma M., Chen M., Feng L., You H.J., Yang R., Boroduleva A., Hua X.D., Eremin S.A., Wang M.H. Fluorescence polarization immunoassay for highly efficient detection of imidaclothiz in agricultural samples // Food Anal. Methods. 2016. V. 9. P. 2471.
Jameson D.M., Ross J.A. Fluorescence polarization/anisotropy in diagnostics and imaging // Chem. Rev. 2010. V. 110. P. 2685.
Hendrickson O.D., Taranova N.A., Zherdev A.V., Dzantiev B.B., Eremin S.A. Fluorescence polarization-based bioassays: New horizons // Sensors. 2020. V. 20. № 24. P. 7132.
Meng Z., Song R., Chen Y. Rapid screening and identification of dominant B cell epitopes of HBV surface antigen by quantum dot-based fluorescence polarization assay // Nanoscale Res. Lett. 2013. V. 8. № 1. P. 118.
Tian J., Zhou L., Zhao Y. The application of CdTe/CdS in the detection of carcinoembryonic antigen by fluorescence polarization immunoassay // J. Fluoresc. 2012. V. 22. № 6. P. 1571.
Petryayeva E., Algar W.R., Medintz I.L. Quantum dots in bioanalysis: A review of applications across various platforms for fluorescence spectroscopy and imaging // Appl. Spectrosc. 2013. V. 67. № 3. P. 215.
Wang H., Liu C., Liu Z., Ren J., Qu X. Specific oxygenated groups enriched graphene quantum dots as highly efficient enzyme mimics // Small. 2018. V. 14. № 13. Article 1703710.
Retamal Marin R.R., Babick F., Stintz M. Ultrasonic dispersion of nanostructured materials with probe sonication − Practical aspects of sample preparation // Powder Technol. 2017. V. 318. P. 451.
Zhang L., Wang Z., Wang H., Dong W., Liu Y., Hu Q., Shuang S. Nitrogen-doped carbon dots for wash-free imaging of nucleolus orientation // Microchim. Acta. 2021. V. 188. № 183. P. 1.
Егоров А.М. Теория и практика иммуноферментного анализа. М.: Высшая школа, 1991. С. 288.
Zhu L., Cui X., Wu J., Wang Z., Wang P., Hou Y., Yang M. Fluorescence immunoassay based on carbon dots as labels for the detection of human immunoglobulin G // Anal. Methods. 2014. V. 6. № 12.
Farafonova O.V., Vasiliev S.V., Eremin S.A., Ermolaeva T.N. Determination of aminoglycosides in food by fluorescence polarization immunoassay // Int. Res. J. 2015. № 7–2 (38). C. 65.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии