Журнал аналитической химии, 2023, T. 78, № 1, стр. 24-33
Идентификация и аутентификация молока с использованием цифровой цветометрии индикаторных тест-систем, смартфона и хемометрического анализа
В. Г. Амелин a, b, *, З. А. Ч. Шаока a, Д. С. Большаков c, А. В. Третьяков b
a Владимирский государственный университет имени Александра Григорьевича и Николая Григорьевича Столетовых
600000 Владимир, ул. Горького, 87, Россия
b Всероссийский государственный центр качества и стандартизации
лекарственных средств для животных и кормов
123022 Москва, Звенигородское шоссе, 5, Россия
c Центр гигиены и эпидемиологии в Владимирской области
600005 Владимир, ул. Токарева, 5, Россия
* E-mail: amelinvg@mail.ru
Поступила в редакцию 11.04.2022
После доработки 13.05.2022
Принята к публикации 19.05.2022
- EDN: KKFRPQ
- DOI: 10.31857/S0044450223010024
Аннотация
Предложен простой и доступный способ идентификации и аутентификации молока с использованием тест-устройства, смартфона и хемометрического анализа. Для идентификации по региону происхождения и видовой принадлежности молока (коровье, козье, овечье и др.) и аутентификации (подлинность, фальсификация молока) использованы кислотно-основные индикаторные бумаги и тест-бумаги для определения общей жесткости и общей щелочности воды, содержания хлорид- и сульфат-ионов. Предложены две индикаторные системы. В первой тест-системе реализованы 16 индикаторных зон, из них 12 – кислотно-основные индикаторы с изменением цвета в интервале рН 3–9, и 4 – индикаторные зоны, изменение цвета которых зависит от концентрации ионов кальция, хлорид-, сульфат-, карбонат- и гидрокарбонат-ионов. Во второй тест-системе использованы флуоресцирующие индикаторы, а также собственная флуоресценция молока на целлюлозной бумаге и тонком слое силикагеля. В этом случае осуществляли облучение монохроматическим ультрафиолетовым светом (365 нм) индикаторных зон матрицы после нанесения на них проб молока. Предложено устройство и способ измерения цветометрических параметров тест-систем с помощью смартфона. Массив данных (сумма значений каналов RGB) обрабатывали с использованием программного обеспечения XLSTAT. Применение хемометрического анализа позволило установить подлинность молока, провести идентификацию его по региону происхождения, а также выявить факты фальсификации молока путем разбавления водой, использования растительных жиров и эмульгирования с помощью ПАВ. Проведена идентификация производителей пастеризованного молока и установлена возможность определения его жирности по массиву данных цветометрических параметров RGB.
Молоко – это продукт физиологической секреции молочных желез сельскохозяйственных животных (коровы, овцы, козы, буйволицы, верблюдицы, кобылы и др.), полученный от одной или более особей, при одном или нескольких доениях. Оно содержит в своем составе питательные и биологически активные вещества (белки, жиры, углеводы, минеральные компоненты, витамины) в оптимально сбалансированном соотношении, которые обеспечивают нормальный рост, развитие и жизнедеятельность организма не только новорожденных животных, но и человека.
Все возрастающее значение молока как полноценного продукта питания и сырьевого материала приводит к увеличению спроса на него и, как следствие, к дефициту, что зачастую инициирует его фальсификацию. Замещение молочной продукции фальсификатом в рационе питания человека приводит не только к дефициту незаменимых аминокислот, жирных кислот, биологически активных веществ, микроэлементов, но и к негативному воздействию на его здоровье.
Фальсификацию молочных продуктов осуществляют путем частичной замены молока или молочного жира на более дешевые безмолочные продукты (воду, растительное масло, соевые белки, крахмал, мочевину, меламин, поверхностно-активные вещества и т.п.) [1]. Факты фальсификации молока обычно выявляют методами ближней инфракрасной, флуоресцентной спектроскопии, по соотношению стабильных изотопов легких элементов (Н, С, N, S), методом ядерного магнитного резонанса и хроматографическими методами c обработкой массива данных хемометрическими алгоритмами [2–6]. Идентификация по региону происхождения и видовой принадлежности молока (коровье, козье, овечье, буйволиное и др.) осуществляется по соотношению стабильных изотопов легких элементов (Н, С, N, S) [7] и методами флуоресцентной спектроскопии [4, 8, 9]. Перечисленные методы дорогостоящи, сложны, требуют квалифицированных операторов и реализуются в условиях лаборатории. В связи с этим актуально появление упрощенных способов выявления фактов фальсификации молока. Так, с целью установления фальсификации молока в работе [10] определены массовые доли жира и белка по рассеянию света с длинами волны 465, 526 и 630 нм. Цифровые изображения светорассеяния получали с помощью цифрового фотоаппарата. Содержание жира и белка и соответственно фальсификацию молока определяли по значениям цветовых каналов RGB.
Предложено микрожидкостное устройство на основе целлюлозной бумаги для установления фальсификации буйволиного молока по результатам определения в нем додецилсульфата натрия, мочевины, карбонатов и гидрокарбонатов [11]. Устройство напечатано на 3D принтере c ограничением трех индикаторных зон парафином. Каждая из зон целлюлозной бумаги пропитана розоловой кислотой (аурином), бромкрезоловым пурпурным и диметиламинобензальдегидом. Наличие фальсифицирующих ингредиентов определяли визуально по изменению окраски индикаторных зон.
Наличие крахмала в фальсифицированном молоке устанавливали по появлению синей окраски индикаторной бумаги, содержащей KI [12]. Интенсивность окраски бумаги определяли цветометрическим методом с использованием смартфона. Установлена прямолинейная зависимость параметров RGB от концентрации крахмала в диапазоне 0–100 г/л.
Фальсификацию молока путем разбавления его водой предложено устанавливать по содержанию белка [13]. После осаждения белков сульфатом меди проводили колориметрическое определение остаточного количества Cu(II), пропорционального содержанию белка, с помощью цифровой цветометрии на смартфоне. Способ позволяет обнаруживать до 1.0 об. % воды в фальсифицированном молоке. Используемые добавки для фальсификации белка (мочевина, меламин) не мешают определению.
Цель данной работы состояла в разработке простого и доступного способа идентификации и аутентификации молока с использованием тест-устройства, смартфона и хемометрического анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура. Для изучения оптических и цветометрических характеристик в качестве цветорегистрирующего устройства использовали смартфоны iPhone X и iPhone ХIII (Apple, США), оснащенные специализированным программным обеспечением RGBer. Для возбуждения флуоресценции использовали источник монохроматического излучения с длиной волны 365 нм − осветитель люминесцентный диагностический Лампа Вуда ОЛДД-01 (Россия). Значения рН измеряли иономером Эксперт-001-3(0.1) (Россия) с комбинированным стеклянным электродом ЭСК-10603 (Россия).
В работе применяли аналитические весы Pioneer PA 214С специального класса точности с пределом взвешивания 0.1 мг (Ohaus Corporation, USA), дозаторы Proline Biohit одноканальные механические переменного объема 2–20 мкл, 100–1000 мкл, 1000–5000 мкл (Biohit, Финляндия).
Реактивы. Применяемые при изготовлении тест-устройств реактивы указаны в табл. 1 (Sigma-Aldrich, США и ООО “ХИМРЕАКТИВ”, Россия). Для приготовления растворов использовали дистиллированную воду, соответствующую требованиям [14].
Таблица 1.
Реагенты, используемые для изготовления тест-устройств
| № | Индикатор | Интервал рН перехода и окраска индикатора | рКа | Составы пропиточных растворов |
|---|---|---|---|---|
| 1 | Конго красный | 3.0–5.2, красная–фиолетовая | 4.0 | 0.1%-ный водный раствор конго красного |
| 2 | Бромфеноловый синий | 3.0–4.6, желтая–синяя | 4.1 | 0.1%-ный водный раствор бромфенолового синего |
| 3 | Ализариновый красный С | 3.7–5.2, желтая–фиолетовая | 5.5 | 0.1%-ный водно-этанольный раствор ализаринового красного С |
| 4 | Бромкрезоловый зеленый | 3.8–5.4, желтая–синяя | 4.9 | 0.1%-ный водно-этанольный раствор бромкрезолового зеленого |
| 5 | Метиловый красный | 4.2–6.2, красная–желтая | 5.0 | 0.1%-ный водно-этанольный раствор метилового красного |
| 6 | Бромфеноловый красный | 5.0–6.8, желтая–красная | 6.3 | 0.1%-ный водно-этанольный раствор бромфенолового красного |
| 7 | Бромкрезоловый пурпуровый | 5.2–6.8, желтая–пурпурная | 6.4 | 0.1%-ный водно-этанольный раствор бромкрезолового пурпурового |
| 8 | Ализарин | 5.8–7.2, желтая–розовая | 6.9 | 0.1%-ный водно-этанольный раствор ализарина |
| 9 | Бромтимоловый синий | 6.0–7.6, желтая–синяя | 7.3 | 0.1%-ный водно-этанольный раствор бромтимолового синего |
| 10 | Феноловый красный | 6.8–8.4, желтая–красная | 8.0 | 0.1%-ный водно-этанольный раствор фенолового красного |
| 11 | Нейтральный красный | 6.8–8.4, красная–желтая | 7.4 | 0.1%-ный водно-этанольный раствор нейтрального красного |
| 12 | Крезоловый красный | 7.0–8.8, желтая–пурпурная | 8.5 | 0.1%-ный водно-этанольный раствор крезолового красного |
| 13 | Эриохромовый черный Т | Синяя–вишневая | – | 0.08%-ный водный раствор эриохромового черного Т и 0.8%-ный водный раствор тетрабората натрия |
| 14 | Хромат серебра | Оранжевая–бесцветная | – | 1) 0.05%-ный водный раствор
сульфата серебра; 2) 0.05%-ный водный раствор дихромата калия |
| 15 | Комплекс бария с эриохромовым черным Т | Вишневая–синяя | – | 1) 0.05%-ный водный раствор
хлорида бария; 2) 0.05%-ный водный раствор эриохромового черного Т |
| 16 | Конго красный с лимонной кислотой | Синяя–красная | – | 1) 0.05%-ный водный раствор конго красного; 2) 0.05%-ный водный раствор лимонной кислоты |
| 17 | Бумага без пропитки | Синяя флуоресценция | – | – |
| 18 | Пластина ТСХ (силикагель) без пропитки | Синяя флуоресценция | – | – |
Изготовление тест-устройства для анализа. Применяли пластины для высокоэффективной тонкослойной хроматографии HPTLC Silica gel 60 (Merck, Германия) и целлюлозную бумагу для хроматографии Whatman 17 Chr (Cytiva, США). Для изготовления тест-устройства бумагу замачивали однократно или двукратно (с высушиванием перед повторным замачиванием) в растворах реагентов (табл. 1) с последующим высушиванием.
Из полученных индикаторных бумаг изготавливали тест-устройство (рис. 1, 2) и после нанесения пробы молока измеряли цветометрические параметры.
Рис. 1.
Схема изготовления тест-устройства и измерения цветометрических характеристик индикаторных зон смартфоном. 1 – изготовление индикаторных зон с помощью дырокола, 2 – приклеивание индикаторов на двухсторонний скотч, 3 – нанесение пробы молока на индикаторные зоны, 4, 5 – измерение цветометрических характеристик с помощью смартфона с УФ-облучением и без него.
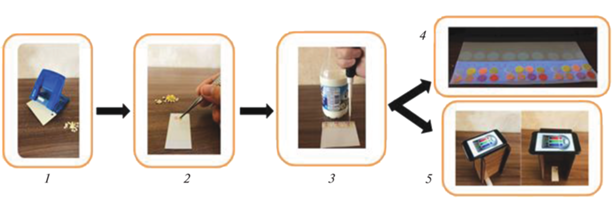
Рис. 2.
Тест-устройство и схема расположения индикаторных зон (номер зоны соответствует номеру индикатора из табл. 1).

Ход анализа. Образцы питьевого молока коммерческого производства для исследований приобретали в магазинах розничной торговли (супермаркетах) г. Владимира в период с апреля по декабрь 2021 г. (табл. 2). Все образцы были упакованы в пластиковую тару, отбирались с соблюдением сроков годности. Анализ проводили непосредственно после вскрытия бутылки. На индикаторные зоны наносили по 10 мкл образца питьевого молока, через 10–15 мин тест-устройство помещали в бокс (15 × 10 × 8 см) и фотографировали камерой смартфона со вспышкой (рис. 1). При изучении твердофазной флуоресценции индикаторных зон тест-устройство подвергали обработке монохроматическим излучением в УФ-диапазоне и проводили фотографирование в темном помещении. Цветометрические характеристики индикаторных зон оценивали с использованием программного продукта RGBer, установленного на смартфоне. Аналитический сигнал для каждой индикаторной зоны рассчитывали как сумму значений каналов R, G и B.
Таблица 2.
Образцы питьевого молока, исследуемые в работе
| № | Бренд | Производитель | Массовая доля жира, % | рН после вскрытия бутылки |
|---|---|---|---|---|
| 1 | Простоквашино | г. Липецк | 1.5 | 6.71 |
| 2.5 | 6.68 | |||
| 3.5 | 6.67 | |||
| 2 | Домик в деревне | г. Нижний Новгород | 2.5 | 6.68 |
| 3.8 | 6.71 | |||
| 3 | Глобус | г. Медынь, Калужская обл. | 4.0 | 6.23 |
| 4 | Искренне ваш | Солнечногорский р-н, Московская обл. | 1.5 | 6.62 |
| 2.5 | 6.60 | |||
| 3.2 | 6.58 | |||
| 4.0 | 6.56 | |||
| 5 | Ополье | г. Юрьев-Польский, Владимирская обл. | 2.5 | 6.62 |
| 3.2 | 6.62 | |||
| 3.9 | 6.59 | |||
| 6 | Муромское подворье | г. Муром, Владимирская обл. | 3.2 | 6.65 |
| 7 | Белорусское | г. Минск | 2.5 | 6.66 |
| 8 | Магнит | Кировская обл. | 2.5 | 6.67 |
| 9 | Торговый дом “Сметанин” | г. Иваново | 2.5 | 6.63 |
| 10 | Васильково | Калужская обл. | 2.5 | 6.44 |
| 11 | ВкусВилл | г. Лебедянь, Липецкая обл. | 1.0 | 6.69 |
| 2.5 | 6.60 | |||
| 3.2 | 6.58 | |||
| 4.0 | 6.53 | |||
| 12 | Экомилк | с. Озерецкое, Дмитровский р-н, Московская обл. | 3.2 | 6.65 |
| 13 | Царка | г. Судогда, Владимирская обл. | 3.2 | 6.70 |
| 14 | ВкусВилл | Молоко козье | 5.2 | 6.78 |
| 15 | ВкусВилл | Овечье молоко | 7.0 | 6.59 |
| 16 | ВкусВилл | Буйволиное молоко | 6.9 | 6.60 |
| 17 | ВкусВилл | Кобылье молоко | 1.5 | 6.70 |
| 18 | Светаево | с. Озерецкое, Дмитровский р-н, Московская обл. | 1.5 | 6.71 |
| 19 | Молоко цельное | г. Судогда, Владимирская обл. | 4.1 | 6.58 |
Хемометрический анализ. Для идентификации и аутентификации молока применяли метод главных компонент (principal component analysis, PCA), иерархический кластерный анализ (hierarchical clustering analysis, HCA) и метод k-средних (k-means) c использованием программного обеспечения XLSTAT (v. 2021.3.1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Цветометрия окрашенных индикаторных систем для идентификации и аутентификации молока. Молоко содержит молочный жир, углеводы и минеральные вещества (кальций, фосфор, калий, магний и др.) и в среднем состоит из 87% воды, 4–5% лактозы, 3% белка, 3–4% жира, 0.8% минералов и 0.1% витаминов [15]. Состав молока зависит от вида млекопитающего и его рациона. В частности, распределение жирных кислот сильно зависит от вида животного и в значительной степени коррелирует с типом используемого корма [7]. Одним из важных показателей качества молока является активная кислотность (рН). Этот показатель колеблется в пределах 6.55–6.75 и поддерживается белковой, фосфатной, цитратной и др. буферными системами.
Выбор индикаторов в тест-устройстве для идентификации и аутентификации молока обусловлен его химическим составом, указанным выше. Использовали 12 кислотно-основных индикаторов с рКа 4.0–8.5, изменение цвета которых зависит от содержания белков, поверхностно-активных веществ и активной кислотности (индикаторы 1–12). Также использовали четыре индикаторные системы, изменяющие цвет в присутствии солей кальция и магния, хлоридов, сульфатов, карбонатов и гидрокарбонатов (индикаторы 13–16) (табл. 1).
Установлены оптимальные условия регистрации аналитического сигнала: время регистрации – 10 мин после нанесения молока на индикаторные зоны, фотографирование со вспышкой при помещении тест-системы в бокс (рис. 1). Аналитический сигнал (A) рассчитывали по формуле: А = R + G + B.
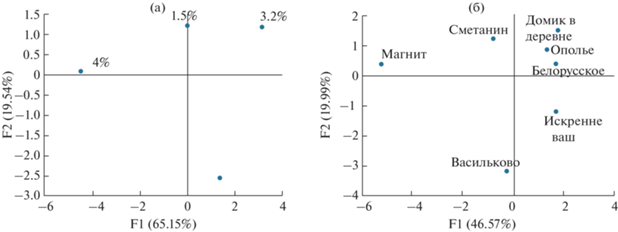
Идентифицировали козье, коровье, овечье и буйволиное молоко. Как видно из рис. 3а, при использовании метода главных компонент можно однозначно установить видовую принадлежность молока: на графике все образцы располагаются в различных квадрантах и образуют соответствующие кластеры. Козье и коровье молоко (“Простоквашино”, 3.5%) оказались в одном кластере (второй квадрант), что свидетельствует о близости их химического состава (рис. 3б).
Рис. 3.
График РСА для идентификации молока от различных видов животных (а) и соответствующая дендрограмма (б). “linkage distance” – расстояние идентифицируемого молока от аналогичного молока, использованного для обучающей выборки.

Установлено, что дифференциация коровьего молока наблюдается как по массовой доле жира образцов, приобретенных у одного производителя (рис. 4а), так и по производителям (региону происхождения) при одинаковой массовой доле жира (жирности) (2.5%) (рис. 4б).
Рис. 4.
График РСА для образца молока “Искренне ваш” с массовой долей жира 1.5–4.0% (а) и для образцов молока с массовой долей жира 2.5% разных производителей (б).
Использование метода иерархического кластерного анализа позволило идентифицировать молоко по массовой доле жира и производителю (рис. 5). Идентифицируемое молоко (Х) выделено в кластеры с нулевым или небольшим расстоянием (linkage distance) от аналогичного молока, использованного для обучающей выборки. Идентификацию проводили также методом k-средних (k-means) по расстоянию от центроида до молока Х. В табл. 3 приведены расстояния от центроида (“Домик в деревне”, 2.5%) до центральной точки кластера определенного молока. Как видно, расхождения в расстояниях молока Х и молока, использованного для обучающей выборки, незначительны, что приводит к 100%-ной идентификации.
Рис. 5.
График РСА для молока разной жирности и разных производителей (а) и соответствующая дендрограмма (б). ИВ – образец молока “Искренне ваш”, ДВД – образец молока “Домик в деревне”.
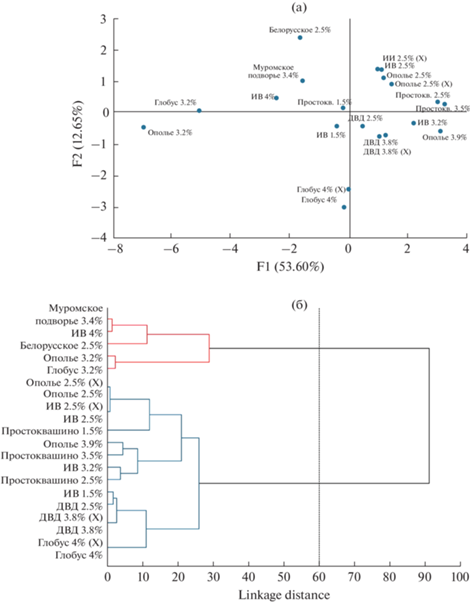
Таблица 3.
Идентификация молока методом k-средних
| Наименование образца | Расстояние от центроида (“Домик в деревне”, 2.5%), усл. ед. |
Наименование образца | Расстояние от центроида (“Домик в деревне”, 2.5%), усл. ед. |
|---|---|---|---|
| “Простоквашино” 1.5% | 44.939 | “Ополье” 3.2% | 96.043 |
| “Простоквашино” 2.5% | 47.374 | “Глобус” 3.2% | 71.019 |
| “Простоквашино” 3.5% | 57.029 | “Искренне ваш” 1.5% | 21.779 |
| “Домик в деревне” 2.5% | 19.759 | “Искренне ваш” 2.5% | 33.230 |
| “Домик в деревне” 3.8% | 31.493 | “Искренне ваш” 2.5% (Х) | 33.112 |
| “Домик в деревне” 3.8% (Х) | 32.201 | “Искренне ваш” 3.2% | 36.931 |
| “Глобус” 4.0% | 42.857 | “Искренне ваш” 4.0% | 47.955 |
| “Глобус” 4.0% (Х) | 36.030 | “Ополье” 2.5% | 30.537 |
| “Ополье” 3.9% | 73.281 | “Ополье” 2.5% (Х) | 31.633 |
| “Муромское подворье” 3.4% | 34.543 | “Белорусское” 2.5% | 63.688 |
Цветометрия флуоресценции индикаторных систем для идентификации и аутентификации молока. Флуоресценция молока в основном формируется за счет жирных кислот и витаминов [16]. Флуоресцентные свойства жирных кислот характеризуются максимумом излучения флуоресценции при 400 нм (длины волн возбуждения 310, 325, 355 и 370 нм). Определенный вклад в формирование спектра флуоресценции молока вносят и входящие в его состав витамины. Максимумы полос излучения находятся при следующих длинах волн: витамин А – 510 нм (327 нм), витамин Е – 347 нм (295 нм), витамин С – 460 нм (369 нм), витамин В2 – 520 нм (470 нм), витамин В6 – 400 нм, фолиевая кислота – 450 нм (345 нм).
В данном случае тест-устройство состояло из семи индикаторных зон, пропитанных флуоресцирующими реагентами (1, 2, 6, 7, 10−12) и двух зон из целлюлозной бумаги и пластины ТСХ (силикагель) (табл. 1, рис. 2).
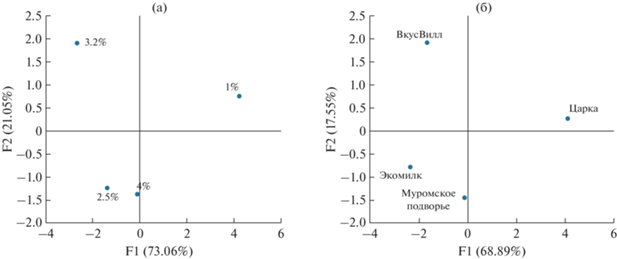
На рис. 6 представлены данные РСА для образцов молока “ВкусВилл” с различной массовой долей жира (от 1.0 до 4%) и образцов молока различных производителей при одинаковом значении массовой доли жира (3.2%). Как и в случае окрашенных индикаторных систем, применение метода главных компонент для обработки аналитического сигнала собственной флуоресценции молока позволяет дифференцировать представленные образцы по массовой доле жира (рис. 6а) и по производителям (региону происхождения) (рис. 6б).
Рис. 6.
График РСА для образцов молока “ВкусВилл” с массовой долей жира 1.0–4.0% (а) и для образцов молока с массовой долей жира 3.2% разных производителей (б).
Фальсификация молока путем разбавления водой или добавления растительных жиров (например, пальмового масла) четко проявляется на графике РСА и дендрограмме (рис. 7). Разбавление молока “Простоквашино” (массовая доля жира 3.5%) в два раза водопроводной водой приводит к переходу позиции образца в другой квадрант и соответственно в другой кластер (3, 6 на рис. 7). Еще большая дифференциация наблюдается при добавлении в молоко “Светаево” (массовая доля жира 1.5%) пальмового масла до массовой доли жира 2.5% (1, 2 на рис. 7).
Рис. 7.
График РСА и дендрограмма для образцов “Светаево” (м.д.ж. 1.5%) с добавлением пальмового масла до массовой доли жира 2.5% (1); “Светаево” (м.д.ж. 1.5%) (2); “Простоквашино” (м.д.ж. 3.5%) (3); козьего молока (м.д.ж. 5.2%) (4); цельного молока (м.д.ж. 4.1%) (5); “Простоквашино” (м.д.ж. 3.5%), разбавленного водой в два раза (6).
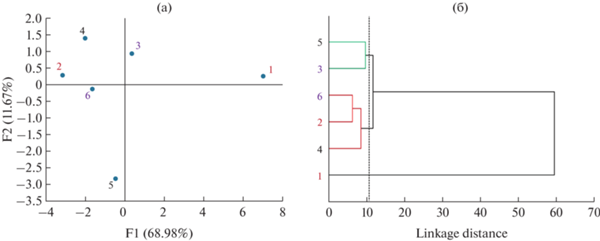
Подобные виды фальсификации напрямую влияют на состав исходных образцов натурального происхождения, что приводит к изменению их физико-химических свойств и естественного баланса ингредиентов. Это, в свою очередь, влияет на интенсивность окраски или флуоресценции индикаторных зон тест-устройства. Учитывая аддитивный характер аналитического сигнала (А) в выбранной цветометрической системе RGB и многофакторность исследования (16 и 9 индикаторных зон), смещение позиции на графике или дендрограмме исходного и фальсифицированного образцов будет значительным. Данный факт является несомненным преимуществом, который уменьшает вероятность выдачи ложного результата.
* * *
Таким образом, представлен способ идентификации и аутентификации молока с использованием индикаторных тест-устройств, цветометрического и хемометрического анализов. Сочетание доступных методологий способствует решению нетривиальных задач выявления фальсификации, установления региона производства и видового происхождения продукции посредством комбинации современных, экспрессных и экологичных инструментов. Разработаны тест-системы для комплексной оценки физико-химических показателей и собственной флуоресценции молока, которые обеспечивают дифференциацию представленной в работе выборки по аддитивному аналитическому сигналу (А = R + G + B). Массив данных обрабатывали методами главных компонент и иерархического кластерного анализа. Установлена возможность выявления фальсификатов молока, полученных разбавлением водой и добавлением растительных жиров, по смещению позиции образцов на графике РСА и дендрограмме относительно опорных значений.
Список литературы
Mohanty T.J., Sahoo J.P., Samal K.C. Common milk adulteration in India and rapid detection techniques // Food Sci. Reports. V. 1. № 10. P. 59.
Zachar P., Soltes M., Kasarda R., Novotny J., Novikmecova M., Marcincakova D. Analytical methods for the species identification of milk and milk products // Mljekarstvo. 2011. V. 3. № 63. P. 199.
Musa M.A., Yang S. Detection and quantification of cow milk adulteration using portable near-infrared spectroscopy combined with chemometrics // African J. Agric. Res. 2020. V. 112. № 2. P. 198.
Ullah R., Khan S., Ali H., Bilal M. Potentiality of using front face fluorescence spectroscopy for quantitative analysis of cow milk adulteration in buffalo milk // Spectrochim. Acta A. 2020. V. 225. Article 117518.
Karoui R., Baerdemaeker J.D. A review of the analytical methods coupled with chemometric tools for the determination of the quality and identity of dairy products // Food Chem. 2007. V. 102. P. 621.
Hosseini E., Ghasemi J.B., Daraei B., Asadi G., Adib N. Near-Infrared spectroscopy and machine learning-based classification and calibration methods in detection and measurement of anionic surfactant in milk // J. Food Compos. Anal. 2021. V. 104. Article 104170.
Schipilliti L., Bonaccorsi I., Consolo G., Mondello L. Isotopic and statistical method for the traceability of milk and dairy products // Food Anal. Methods. 2022. https://doi.org/10.1007/s12161-022-02258-7
Genis D.O., Bilge G., Sezer B., Durna S. Boyaci I.H. Identification of cow, buffalo, goat and ewe milk species in fermented dairy products using synchronous fluorescence spectroscopy // Food Chem. 2019. V. 284. P. 60.
El-Garhi H.M., El-Aidie S., Hamdy S.M., Abbas K. Identification of milk types using front face and synchronous scanning fluorescence spectroscopy // Egyptian J. Food Sci. 2020. V. 48. № 1. P. 73.
Kucheryavskiy S., Melenteva A., Bogomolov A. Determination of fat and total protein content in milk using conventional digital imaging // Talanta. 2014. V. 121. P. 144.
Younas M., Maryam A., Khan M., Nawaz A.A., Jaffery S.H.I., Anwar M.N., Ali L. Parametric analysis of wax printing technique for fabricating microfluidic paper-based analytic devices (µPAD) for milk adulteration analysis // Microfluidics and Nanofluidics. 2019. V. 23. Article 38.
Govindarajalu A.K., Ponnuchamy M., Sivasamy B., Prabhu M.V., Kapoor A.A. Cellulosic paper-based sensor for detection of starch contamination in milk // Bull. Mater. Sci. 2019. V. 42. Article 255.
Silva A.F.S., Rocha F.R.P. A novel approach to detect milk adulteration based on the determination of protein content by smartphone-based digital image colorimetry // Food Control. 2020. V. 115. Article 107299.
ГОСТ Р 58144-2018. Вода дистиллированная. Технические условия. М.: Стандартинформ, 2019. 10 с.
Pereira P.C. Milk nutritional composition and its role in human health // Nutrition. 2013. V. 30. P. 619.
Посудин Ю.И. Люминесцентные методы контроля состава молока // Изв. вузов. Пищевая технология. 1993. № 5–6. P. 79.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


