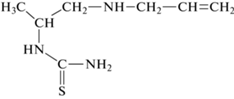Журнал аналитической химии, 2023, T. 78, № 11, стр. 1014-1018
Определение микроколичеств никеля(II) после предварительной экстракции комплексов с 1-(2-аллиламино-1-метилетил)тиокарбамидом
Т. А. Джавадзаде a, В. И. Марданова a, *, А. Р. Суджаев b, Х. Д. Нагиев a, Ф. М. Чырагов a
a Бакинский государственный университет, химический факультет
Az 1148 Баку, ул. З. Халилова, 23, Азербайджан
b Институт химии присадок
Az 1029 Баку, просп. З. Буньятова, 2062, Азербайджан
* E-mail: vusala_chem@mail.ru
Поступила в редакцию 14.09.2022
После доработки 27.01.2023
Принята к публикации 01.02.2023
- EDN: VRRVYV
- DOI: 10.31857/S004445022307006X
Аннотация
Исследована возможность экстракции комплекса никеля(II) с 1-(2-алиламино-1-метилэтил)тиокарбамидом в присутствии и в отсутствие гидрофобных аминов- дифенилгуанидина и трифенилгуанидина. Установлено, что в присутствии гидрофобных аминов образуются смешанолигандные комплексы, хорошо растворимые в бутаноле-1. Извлечение комплексов происходит в течение 60 с, разделение фаз занимает 80 с. Однократной экстракцией извлекается до 96.7 и 98.0% никеля(II) в присутствии дифенилгуанидина и трифенилгуанидина соответственно. Установлены оптимальные условия образования и экстракции комплексов никеля(II) в присутствии и в отсутствие гидрофобных аминов. Определено соотношение компонентов в составе комплексов, установлен интервал линейности градуировочного графики для определения никеля(II) (0.10–2.80 мкг/мл) и получены уравнения градуировочных графиков по методу наименьших квадратов. Изучено влияние посторонних ионов и маскирующих веществ на экстракционно-спектрофотометрическое определение никеля(II) и установлено, что за счет образования смешанолигандных комплексов значительно увеличивается избирательность реакции. Разработана методика экстракционно-спектрофотометрического определения микроколичеств никеля в водах рек Акстафа и Джогаз Казахского района Азербайджанской Республики.
Наиболее простыми и экспрессными методами определения никеля(II) в природных и промышленных объектах являются спектрофотомерический, а также экстракционно-спектрофотометрический. Никель(II) склонен к образованию окрашенных прочных комплексов с органическими реагентами, содержащими донорные атомы серы, азота и кислорода [1]. Такие реагенты, как дитизон, дитиокарбамат, бисацетилацетонэтилендиимин, 2-гидрокси-5-йодтиофен и т.д. используют в основном для экстракционного отделения никеля [2–8]. К наиболее важным фотометрическим реагентам относятся диоксимы, особенно диметилглиоксим, которые долгое время использовались в качестве наиболее важных реагентов при исследовании смешанолигандных соединений никеля [9–11]. В последнее время расширяется применение азосоединений для определения никеля в сложных природных и промышленных объектах [12–14].
Цель настоящей работы – исследование экстракционное поведение комплекса 1-(2-алиламино-1-метилэтил)тиокарбамида (R) с ионами никеля(II) в присутствии и в отсутствие гидрофобных аминов – дифенилгуанидина и трифенилгуанидина, выбор условий комплексообразования и разработка методики экстракционно-спектрофотометрического определения микроколичеств никеля в речных водах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура. Спектрофотометрические измерения в УФ- и видимой областях спектра проводили на спектрофотометре Lambda-40 с компьютерным обеспечением в кюветах толщиной 1.0 см. Кислотность растворов измеряли с помощь рН-метра рН-121 со стеклянным электродом.
Растворы и реагенты. Реагент – 1-(2-алиламино-1-метилэтил)тиокарбамид (R) синтезировали по методике [15]. Выход реагента составил 59.0%. Для определения структуры реагента использовали ЯМР-спектроскопию. Спектр ЯМР 1H (CCl4 mh): 9.48 с (2H, NH2); 7.21 α (1H, NH); 3.22 м (2H, CH2); 2.01 (1H, NH); 2.64–2.89 α (2H, CH2); 1.50–3.03 м (1H, CH); 1.10 с (3H, CH3); 5.15 (1H, –CH– sis); 5.17 м (1H, –C–H– транс); 5.83 м (1H, –C–H–). Спектр ЯМР 13С: 18.6, 52.0, 53.7, 55.5, 116.2, 134.2, 184.7. Структурная формула реагента представлена на схеме 1 .
Схема 1 . Структурная формула 1-(2-алиламино-1-метилэтил)тиокарбамида.
Использовали 1.0 × 10–3 М раствор реагента, который готовили растворением точной навески в этаноле. Стандартный раствор никеля(II) с концентрацией 0.1 М готовили из соли NiSO4⋅7H2O растворением навески в дистиллированной воде [16]. Рабочие 2.0 × 10–4 М растворы получали разбавлением исходного дистиллированной водой перед употреблением. В качестве гидрофобных аминов (ГА) использовали дифенилгуанидин (ДФГ) и трифенилгуанидин (ТФГ), их 1.0 × 10–3 М растворы готовили растворением соответствующих навесок в этаноле. Для создания необходимой кислотности использовали фиксанал HCl (рН 0–2.0) и ацетатно-аммиачные буферные растворы (рН 3.0–11.0). Все использованные реагенты имели квалификацию не ниже ч. д. а. [17].
Методика. В мерную колбу емк. 25 мл помещали различные количества раствора никеля(II), 1.2 мл 1.0 × 10–3 М раствора реагента и 1.0 мл 1.0 × × 10–3 М раствора гидрофобного амина, разбавляли до метки ацетатно-аммиачным буферным раствором с рН 5.0. Раствор переносили в делительную воронку, добавляли 10.0 мл бутанола-1 и встряхивали в течение 90 с. Черезе 80 с измеряли оптическую плотность органической фазы в кювете толщиной 1.0 см на спектрофотометре Lambda-40 при λмах на фоне экстракта контрольного опыта (R + ГА), приготовленного в аналогичных условиях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии никеля(II) с 1-(2-алиламино-1-метилэтил)тиокарбамидом в кислой среде при рН 0–7.0 образуется окрашенное комплексное соединение. Для экстракции полученного комплекса использовали различные растворители – бензол, хлороформ, четырёххлористый углерод, бутанол-1 и изобутанол. Установили, что лучшим экстрагентом является бутанол-1. Оптимальные условия экстракции следующие: время контакта фаз – 120 с, продолжительность расслаивания – 90 с. При однократной экстракции извлекается до 92% ионов никеля(II). Степень извлечения никеля(II) в виде комплекса не зависит от соотношения объемов водной и органической фаз в широком интервале от 10 : 10 до 200 : 10. Остаточные количеств никеля(II) определяли с помощью спектрометра ICP-OES thermo ICAP 7400 Duo. Коэффициент распределения (D) составил 29. Экстракты окрашенного комплекса никеля(II) с 1-(2-алиламино-1-метилэтил)тиокарбамидом устойчивы в течение более 2 ч, а также при нагревании до 50°С.
Спектры светопоглощения экстрактов реагента и его комплексов с никелем(II) приведены на рис. 1. Установлено, что экстракт реагента поглощает свет в области длин волн 300–550 нм. Максимальное поглощение экстракта реагента наблюдается при 338 нм (спектр 1), а его комплекса с никелем(II) при 469 нм (сректр 2).
Рис. 1.
Спектры светопоглощения экстрактов комплексов никеля(II) при оптимальном значении рН среды. 1 – R, 2 – Ni(II)–R, 3 – Ni(II)–R–ДФГ, 4 – Ni(II)–R–ТФГ. cNi = 2.0 × 10–5 М, cR = 2.0 × 10–4 М, cГА = 1.0 × 10–4 М, Lambda-40, $\ell $ = 1.0 см.
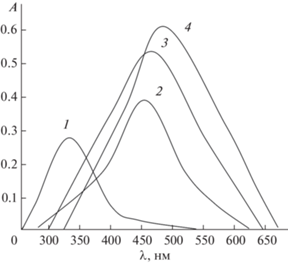
Степень извлечения комплекса максимальна при рН 4.7–5.8 (рис. 2, кривая 1); для полного связывания ионов никеля(II) в комплекс необходимо 2.0 × 10–4 М раствор реагента.
Рис. 2.
Влияние рН на светопоглощение экстрактов комплексов никеля(II) при λмах на фоне холостого экстракта. 1 – Ni(II)–R, 2 – Ni(II)–R–ДФГ, 3 – Ni(II)–R–ТФГ. cNi = 2.0 × 10–5 М, cR = 2.0 × 10–4 М, cГА = 1.0 × 10–4 М, Lambda-40, $\ell $ = 1.0 см.
Влияние гидрофобных аминов. В присутствии гидрофобных аминов – дифинилгуанидина и трифенилгуанидина образуются смешанолигандные комплексы Ni(II)–R–ДФГ и Ni(II)–R–ТФГ, которые также хорошо растворимы в бутаноле-1. Извлечение смешанолигандных комплексов происходит в течение 60 с, время расслаивания фаз – 80 с. Однократной экстракцией извлекается до 96.7 и 97.4% никеля(II) в виде смешнолигандных комплексов Ni(II)–R–ДФГ и Ni(II)–R–ТФГ соответственно. Коэффициент распределения соответственно равен 73 и 95. Экстракты обоих смешнолигандных комплексов устойчивы в течение более суток и при нагревании до 70°С.
Как видно из рис. 1, светопогплощение экстрактов смешанолигандных комплексов Ni(II)–R–ДФГ (спектр 3) и Ni(II)–R–ТФГ (спектр 4) максимально при 480 и 489 нм соответственно. Значения рНопт образования обоих смешанолигандных комплексов лежат в диапазоне 4.4–5.2 (рис. 2, кривые 2 и 3). Изучение влияния концентраций реагирующих компонентов на образование смешанолигандных комплексов показало, что выход обоих комплексов максимален при концентрациях растворов реагента 1.2 × 10–4 М, гидрофобных аминов 1.0 × 10–4 М.
Состав комплексов. Соотношение компонентов в составе образующихся комплексов определяли методами изомолярных серий, относительного выхода Старика–Барбанеля и сдвига равновесия [17]. Установили, что соотношение компонентов в комплексе Ni(II)–R равно 1 : 2, а в смешанолигандных комплексах Ni(II)–R–ДФГ и Ni(II)–R–ТФГ – 1 : 2 : 2.
Молярные коэффициенты светопоглощения экстрактов Ni(II)–R, Ni(II)–R–ДФГ и Ni(II)–R–ТФГ при λмах равны (1.8 ± 0.04) × 104 л/(мол см), (2.5 ± 0.03) × 104 л/(мол⋅см) и (2.7 ± 0.04) × × 104 л/(мол⋅см) соответственно. Градуировочный график линеен в диапазоне концентрации никеля(II) 0.10–4.00 мкг/мл для комплекса Ni(II)–R и 0.10–2.80 мкг/мл для Ni(II)–R–ДФГ и Ni(II)–R–ТФГ (табл. 1). По методу наименьших квадратов получили уравнения градуировочных графиков [18]:
Таблица 1.
Аналитические характеристики комплексов никеля(II)
| Комплекс | рН | λмах, нм | Соотношение компонентов |
εмах × 10–4, л/(мол см) | Подчинение закону Бера, мкг/мл | Предел обнаружения, нг/мл |
|---|---|---|---|---|---|---|
| Ni(II)–R | 4.7–5.8 | 469 | 1 : 2 | 1.8 ± 0.04 | 0.5–4.0 | 230 |
| Ni(II)–R–ДФГ | 4.4–5.2 | 480 | 1 : 2 : 2 | 2.5 ± 0.03 | 0.1–2.8 | 65 |
| Ni(II)–R–ТФГ | 4.4–5.2 | 489 | 1 : 2 : 2 | 2.7 ± 0.04 | 0.1–2.8 | 50 |
Пределы обнаружения никеля(II) в виде комплексов Ni(II)–R, Ni(II)–R–ДФГ и Ni(II)–R–ТФГ равны 230, 65 и 50 нг/мл соответственно [19].
Влияние посторонних ионов. Изучение влияние посторонних ионов и маскирующих веществ на экстракционно-спектрофотометрическое определение никеля(II) показало, что с образованием смешанолигандных комплексов значительно увеличивается избирательность реакции (табл. 2). Из табл. 2 видно, что предложенные методики более избирательны по сравнению с описанной в работе [20].
Таблица 2.
Допустимое соотношение по массе посторонних веществ и никеля(II) при его определении в виде Ni(II)–R–ГА (погрешность 5%)
| Посторонние ионы и маскирующие вещества | R | R–ДФГ | R–ТФГ | 2-[(2-Меркаптофенил-имино)]фенол [20] |
|---|---|---|---|---|
| Na | 6000 | 6000 | 6000 | |
| K | 10 000 | 1000 | 1000 | |
| Mg | 170 | 200 | 200 | |
| Ca | 700 | 520 | 700 | 20 |
| Ba | 700 | 870 | 1100 | |
| Zn | 910 | 1000 | 1000 | |
| Cd | 120 | 180 | 193 | 50 |
| Mn(II) | 500 | 610 | 640 | |
| Ni(II) | 700 | 820 | 800 | |
| Co(II) | 450 | 520 | 530 | |
| Hg(II) | 69 | 207 | 346 | |
| Al(II) | 50 | 47 | 93 | 250 |
| Cr(III) | 1320 | 1220 | 1340 | 20 |
| Fe(III) | 10 | 193 | 193 | 20 |
| Mo(VI) | 0.8 | 1.0 | 1.2 | |
| W(VI) | 1 | 1.5 | 1.2 | |
| Pb(IV) | 150 | 180 | 185 | |
| Ti(IV) | 83 | 195 | 496 | 30 |
| Bi(III) | 55 | 295 | 250 | 235 |
| Cu(II) | 708 | 712 | 710 | 20 |
| Mo(VI) | 331 | 828 | 828 | 25 |
| V(V) | 10 | 14 | 18 | 12 |
| ЭДТА | 17 | 24 | 25 | 15 |
| Мочевина | 420 | 475 | 480 | |
| Тиомочевина | 1800 | 1950 | 1950 | |
| Лимонная к-та | 33 | 47 | 50 | |
| Винная к-та | 40 | 180 | 200 | 200 |
Определение никеля(II) речных водах. Проанализированы воды, взятые из рек Акстафа и Джогаз Казахского района Азербайджанской республики.
Для определения никеля в воде пробу отстаивали в течение суток и отфильтровывали. Фильтрат объемом 1.0 л подкисляли 10.0 мл HNO3 (1 : 1) Аликвотную часть воды (10–30 мл) переносили в делительную воронку, приливали 1.2 мл 1.0 × 10–3 М раствора реагента 1.0 мл 1.0 × 10–3 М раствора трифенилгуанидина, 20 мл ацетатно-аммиачного буферного раствора с pH 5.0 и добавляли 10 мл бутанола-1. Полученный раствор встряхивали в течение 90 с и через 80 с измеряли оптическую плотность, как описано выше. Правильность результатов проверяли анализом проб методом оптической эмиссионной спектрометрии с индуктивно связанной плазмой (ОЭС-ИСП) на приборе ICP-OES thermo ICAP 7400 Duo. Результаты представлены в табл. 3.
Таблица 3.
Результаты определения никеля(II) в речных водах (n = 5, Р = 0.95)
| Образец речной воды | Найдено Ni фотометрическим методом, мг/л | Найдено Ni методом ОЭС-ИСП, мг/л |
|---|---|---|
| Река Акстафа | 0.189 ± 0.005 | 0.195 ± 0.004 |
| Река Джогаз | 0.189 ± 0.004 | 0.193 ± 0.003 |
Таким образом, предлагаемые методики определения никеля(II) с 1-(2-алиламино-1-метилэтил)тиокарбамидом в присутствии гидрофобных аминов дифенилгуанидина и трифенилгуанидина позволяют определять его микроколичества непосредственно в речной воде. Методики просты, экспрессны и дают надeжные результаты.
Список литературы
Пешкова В.М., Савостина В.М. Аналитическая химия никеля. М.: Наука, 1966. 204 с.
Марченко 3. Фотометрическое определение элементов. М.: Мир, 1971. 272 с.
Ravichandraiah C., Bensil D., Ramachachandraiah C., Chandrasekhar K.B. Extraction and spectrophotometric determination oil samples // Int. J. Bioassay 2015. V. 4. № 11. P. 4468.
Zianab Tariq, Shaimaa Adnan Statistical evaluation of spectrophotometric determination of nickel(II) using micelle-mediated extraction // J. Phys.: Conf. Series. 2019. V. 1294. № 5. P. 1294.
Pradnya Lokhande. Solvent extraction and spectrophotometric determination of nickel (II) using 2-hydroxy-1-naphthaldehyde thiosemicarbazone (HNT) as an analytical reagent // Int. J. Trend Sci. Res. Develop. (IJTSRD). 2019. V. 3. № 3. P. 694.
Zalov A.Z., Cavazov K.B. Extractive spectrophotometric determination of nickel with 2-haydroxy-5-iodothiophenol and biphenyldiamidine // J. Azerbaijan Chem. 2014. V. 104. № 5. P. 20.
Шилыковская Д.О., Елохов А.М. Экстракционно-спектрофотометрическое определение никеля с 4-(2-пиридилазо) резорцином в системе неонол АФ 9-10 – вода // Вестник Пермского университета. 2021. Т. 11. №. 4. С. 223.
Sarma L.S., Kumar J.R., Reddy K.J. Development of highly sensitive extractive spectrophotometric determination of nickel in medicinal leaves, soil, industrial efflux and standard alloy complex using piridoxal-4-phenyl-3-fluisemicorbazone // J. Trace Elements Med. Biol. 2008. V. 22. P. 285.
Hashemi-Moghaddam H. A selective flotation-spectrophotometric method for the determination of nickel using dimethylglyoxime // J. Braz. Chem. Soc. 2011. V. 22. № 6. P. 1056.
Natesh Kumar B., Suvardhan K., Myalowenkosi I., Sabela Krishna B. Spectrophotometric determination of nickel (II) in waters and soils: Novel chelating agents and their biological applications supported by DFT method // Karbala Int. J. Modern Sci. 2016. V. 2. № 4. P. 1.
Синяева Н.П., Омельянчик Л.А., Неккрасова Л.П., Луганская О.В. Спектрофотометрическое определение никеля, марганца, кобальта из одной навески в припое ВПР-4 // Вестник двигателестроения. 2017. № 2. С. 153.
Марданова В.И., Тахирли Ш. А., Гаджиева С.Р., Чырагов Ф.М. Изучение комплексообразования никеля(II) с 1,3-дифенил-2-(2-гидрокси-4-нитрофенилгидрозо) проподионом-1,3 в присутствии третьих компонентов // Изв. вузов. Прикл. химия и биотехнол. 2020. Т. 10. № 2. С. 196.
Марданова В.И., Тахирли Ш.А., Чырагов Ф.М. Изучение комплексообразования никеля(II) с 1-фенил-2-(2-гидрокси-4-нитрофенилгидрозо)бутадионом-1,3 в присутствии третьих компонентов // Wschodnioeuropejskie Czasopismo Naukowe (East Eur. Sci. J.) 2018. Т. 37. № 10. С. 63.
Mardanova V.I., Tahirli Sh.A., Babaev A.Q., Chiragov F.M. Studying of the complex formation of nickel(II) with 1-phenyl-2-(2-hydroxynitrophenylhydroso) butanedione-1,3 in the presence of third components // J. Chem. Problems. 2019. V. 17. № 2. P. 316.
Бусев А.И. Синтез новых органических реагентов для неорганического анализа. М.: МГУ, 1972. 245 с.
Коростелев П.П. Приготовление растворов для химико-аналитических работ. М.: Наука, 1964. 261 с.
Булатов М.И., Калинкин Н.П. Практическое руководство по фотометрическим методам анализа. Л.: Химия, 1986. 432 с.
Батунер Л.М., Позин М.Е. Математические методы в химической технике. Л.: Хим. лит., 1963. 638 с.
Дорохова Е.Н., Прохорова Г.В. Аналитическая химия, физико-химические методы анализа. М.: Высшая школа, 1991. 250 с.
Haji Shabani A.M., Dadfarnia S., Shakbaazi Z., Jafari A.A. Extraction spectrophotometric determination of nickel at microgram level in water and waste water using 2-[(2-mercaptophenylimino)]phenol // Chem. Soc. Ethiopia. 2008. V. 22. № 3. P. 323.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии