Журнал аналитической химии, 2023, T. 78, № 2, стр. 187-192
Хроматографическое определение ибупрофена в культуральных средах родококков и кинетическое моделирование процесса его биодеструкции
Е. В. Вихарева a, b, *, А. А. Селянинов c, Г. А. Бажутин a, Е. А. Тюмина a
a Пермский федеральный исследовательский центр Уральского отделения Российской академии наук
614990 Пермь, ул. Ленина, 13а, Россия
b Пермская государственная фармацевтическая академия
614900 Пермь, ул. Полевая, 2, Россия
c Пермский национальный исследовательский политехнический университет
614990 Пермь, Комсомольский просп., 29, Россия
* E-mail: vihareva@pfa.ru
Поступила в редакцию 15.04.2022
После доработки 12.05.2022
Принята к публикации 12.05.2022
- EDN: CELDRE
- DOI: 10.31857/S0044450223010140
Аннотация
Подобраны условия хроматографического определения ибупрофена в культуральных средах Rhodococcus spp. методом обращенно-фазовой ВЭЖХ. Процедурой валидации подтверждены специфичность, линейность и точность предложенной методики, что позволяет использовать ее для достоверной оценки содержания ибупрофена в процессе бактериальной деструкции. С применением кинетического моделирования осуществлен прогноз изменения содержания ибупрофена, определены период полураспада, время окончания процесса биодеструкции и его воспроизводимость.
Развитие фармацевтической промышленности и рост объемов производства лекарственных препаратов поставили человечество перед новой экологической проблемой, связанной с попаданием лекарственных средств и их метаболитов (так называемых фармацевтических поллютантов) в окружающую среду. Применение высокоэффективной жидкостной и газовой хроматографии, часто в сочетании с масс-спектрометрией, позволяет обнаруживать фармполлютанты не только в сточных водах, но и в природных водоемах и даже в питьевой воде [1–6].
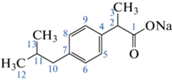
Одним из широко используемых в медицинской практике нестероидных противовоспалительных препаратов является ибупрофен (C13H18O2; CAS: 15687-27-1; (2RS)-2-[4-(2-метилпропил)фенил]пропановая кислота [7]. Ибупрофен (ИБ, схема 1 ) и его метаболиты обнаружены в сточных водах очистных сооружений разных стран в концентрациях от нескольких нг/л до 6000 мкг/л [8–11].
Схема 1 . Структурная формула натриевой соли ибупрофена.
На настоящий момент накоплен значительный экспериментальный материал по биодеструкции ИБ различными микроорганизмами, в том числе почвенными и водными бактериями рода Rhodococcus, которые отличаются наибольшим разнообразием деградируемых фармполлютантов [12–14]. Исследования направлены в основном на изучение метаболических путей процесса биодеструкции ИБ. Однако информация о возможности определения ИБ в ходе данного процесса явно недостаточна. При этом особый интерес представляет кинетическое моделирование, которое дает возможность оценивать не только скорость, но и воспроизводимость процесса, время его окончания, а также осуществлять переход от лабораторных исследований к промышленным технологиям.
Цель настоящего исследования – подбор методики хроматографического анализа ибупрофена в среде культивирования актинобактерий рода Rhodococcus с использованием обращенно-фазовой ВЭЖХ и кинетическое моделирование процесса биодеструкции данного вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Использовали натриевую соль ибупрофена (C13H17NaO2, CAS 31121-93-4, соль α-метил-4-(изобутил)фенилуксусной кислоты; Sigma-Aldrich, США) − белый кристаллический порошок, хорошо растворимый в воде. Реагенты имели квалификацию х. ч., ч. д. а. или ос. ч. (База № 1 химреактивов, Россия; Криохром, Россия; Merck, Германия; Sigma-Aldrich, США).
Условия проведения процесса биодеструкции ибупрофена. В качестве деструктора ибупрофена использовали штамм Rhodococcus cerastii ИЭГМ 1243 из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, http://www.iegmcol.ru, ЦКП 480868, УНУ 73559, WDCM 768) [15]. В колбу Эрленмейера емк. 250 мл вносили 0.01 г ибупрофена, 100 мл минерально-солевой среды “K” состава (г/л): K2HPO4 − 1.0; KH2PO4 − 1.0; NH4NO3 − 1.0; NaCl − 1.0; MgSO4·7Н2О − 0.2; CaCl2·2Н2О − 0.02; FeСl3·7Н2О − 0.001; 0.5 г/л глюкозы, 0.1 мл/л н-гексадекана в качестве косубстратов (дополнительных источников углерода и энергии) и инокулят (взвесь клеток родококков) до соответствия стандарту мутности БАК5 (5 NTU). Клетки родококков предварительно выращивали в течение трех суток в мясопептонном бульоне и отмывали 10 мМ фосфатным буферным раствором (рН 7.0). Биодеструкцию ибупрофена проводили в условиях периодического культивирования на орбитальном шейкере Certomat IS (Sartorius, Германия) при 160 об/мин и 28°С. Продолжительность экспериментов составляла 5 сут. Пробы объемом 2.0 мл отбирали с интервалом 1 сут.
Приборы и оборудование. Орбитальный шейкер Certomat IS (Sartorius, Германия); хроматограф LC Prominence 20А (Shimadzu, Япония), оснащенный хроматографической колонкой с сорбентом с обращенной фазой Luna 5uC18(2) 100A (4.6 мм × 250 мм) и диодно-матричным детектором (SPD-M20A); лабораторная центрифуга (12 000 об/мин, Eppendorf, Германия).
Модельные смеси для построения градуировочной кривой для ВЭЖХ − растворы ибупрофена в среде “К” в диапазоне концентраций 1–100 мкг/мл в зависимости от валидируемого показателя.
Подготовка проб культуральной жидкости родококков для анализа методом ВЭЖХ. Аликвотную часть культуральной среды в количестве 1.0 мл, содержащей ибупрофен, продукты его биодеструкции, бактериальные клетки и продукты их жизнедеятельности, помещали в пробирку Эппендорфа и центрифугировали при 10 000 об/мин в течение 5 мин. Надосадочную жидкость, освобожденную от клеток, фильтровали через мембранный шприцевой нейлоновый фильтр с размером пор 0.45 мкм (Agilent Technologies, США). В качестве контрольных сред использовали стерильную минеральную среду “К” с ибупрофеном (0.01%) без внесения бактериальных клеток (абиотический контроль); стерильную среду “К” с клетками родококков без ибупрофена (биотический контроль или плацебо).
Учет результатов. Хроматографическую информацию записывали и обрабатывали с помощью программного обеспечения LCSolution (v/1.25 rus).
Валидация методики. Валидационную оценку проводили в 6-кратной повторности по показателям: селективность, линейность, прецизионность и правильность результатов анализа [16].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментально установили, что ИБ подвергается бактериальному разложению. Остаточная концентрация исследуемого соединения из среды культивирования Rhodococcus cerastii ИЭГМ 1243 на уровне 20% через 5 сут эксперимента.
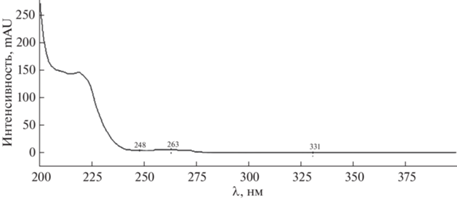
Условия хроматографического определения ибупрофена. При выборе оптимальных условий определения ибупрофена в культуральной среде родококков в качестве неподвижной фазы использовали обращенно-фазовый сорбент из группы алкилсиликагелей. В качестве растворителей применяли смеси ацетонитрила и фосфатного буферного раствора (рН 3) в разных соотношениях, которые позволяли работать в широком УФ-диапазоне и использовать наиболее популярный при анализе лекарственных препаратов спектрофотометрический детектор. Длина волны детектирования ибупрофена составила 220 нм (рис. 1).
Поскольку в изократическом режиме элюирования удалось получить симметричные пики ибупрофена с приемлемыми временами удерживания, то исследования по возможности использования градиентного режима не проводились. В результате для разделения образующейся в процессе биодеструкции ибупрофена многокомпонентной системы предложены следующие условия хроматографического анализа: подвижная фаза ацетонитрил–фосфатный буферный раствор (рН 3) (60 : 40); скорость потока элюента – 1 мл/мин; температура колонки – 40°С; объем пробы – 10 мкл; длина волны детектирования – 220 нм. В описанных условиях время удерживания ибупрофена составило 10.80 ± 0.02 мин.
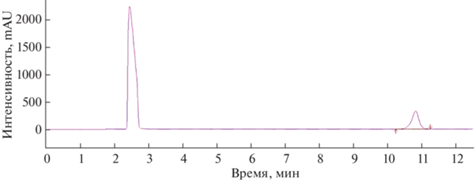
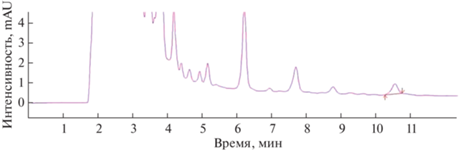
Валидационная оценка методики. Для оценки селективности хроматографического определения ибупрофена в предложенных условиях получили хроматограммы раствора стандартного образца ибупрофена (0.01%) в среде “К” (рис. 2), раствора плацебо (среды “К” с клетками родококков без ибупрофена) и раствора ибупрофена в культуральной среде родококков после биодеструкции в течение 5 сут (рис. 3). Установили, что на хроматограмме раствора плацебо отсутствуют пики с временами удерживания, близкими к ибупрофену. Пики плацебо и культуральной жидкости хорошо разделяются с пиком ибупрофена, что свидетельствует о селективности методики.
При оценке линейности построили градуировочный график зависимости площади пика ибупрофена (S) от его концентрации (c) в модельных растворах в интервале от 1 до 100 мкг/мл. Градуировочная зависимость описывается уравнением S = 13083c; полученный коэффициент корреляции 0.999 указывает на линейность зависимости в данном диапазоне концентраций ибупрофена.
Прецизионность и правильность методики оценивали по величинам относительного стандартного отклонения (sr, %) и относительной погрешности (ε, %), используя модельные смеси с тремя уровнями содержаний ибупрофена: 0.0001, 0.002 и 0.007% (табл. 1). Полученные данные удовлетворяют критериям приемлемости, предъявляемым к биоаналитическим методикам [16].
Таблица 1.
Прецизионность и правильность методики хроматографического определения ибупрофена в культуральной среде родококков
| Концентрация ибупрофена в модельном растворе | Найдено ибупрофена, мкг/мл | x̅ (n = 6) |
s, мкг/мл | sr, % | ε, % |
|---|---|---|---|---|---|
| 1.01 мкг/мл (0.0001%) |
0.98 | 0.99 | 0.11 | 11.11 | –1.00 |
| 0.86 | |||||
| 1.08 | |||||
| 0.87 | |||||
| 1.05 | |||||
| 1.11 | |||||
| 20.03 мкг/мл (0.002%) |
21.10 | 20.30 | 0.84 | 4.14 | 1.50 |
| 19.62 | |||||
| 19.31 | |||||
| 20.84 | |||||
| 21.19 | |||||
| 19.73 | |||||
| 70.02 мкг/мл (0.007%) |
68.42 | 69.02 | 1.25 | 1.81 | –1.40 |
| 69.18 | |||||
| 69.20 | |||||
| 71.18 | |||||
| 67.39 | |||||
| 68.77 |
Предложенную методику хроматографического определения ибупрофена использовали для изучения динамики удаления данного вещества в процессе биодеструкции клетками Rhodococcus cerastii ИЭГМ 1243 (табл. 2). Эксперименты проводили в 10 повторностях (реализациях) в одинаковых условиях.
Таблица 2.
Динамика процесса биодеструкции ибупрофена (0.01%) клетками Rhodococcus cerastii ИЭГМ 1243
| № опыта | Экспозиция | Кинетическое моделирование | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 сут | 2 сут | 3 сут | 4 сут | 5 сут | k, сут–1 | t1/2, сут | t1, сут | |
| 1 | 42.66* | 33.99 | 25.97 | 22.16 | 19.67 | 0.5086 | 1.36 | 9.05 |
| 2 | 45.82 | 34.57 | 27.02 | 23.21 | 20.42 | 0.4861 | 1.43 | 9.47 |
| 3 | 44.19 | 31.70 | 23.67 | 19.82 | 17.37 | 0.5252 | 1.32 | 8.77 |
| 4 | 49.51 | 36.78 | 29.57 | 26.23 | 25.22 | 0.4439 | 1.56 | 10.38 |
| 5 | 50.30 | 38.30 | 29.22 | 26.69 | 24.52 | 0.4377 | 1.58 | 10.52 |
| 6 | 49.82 | 37.14 | 23.54 | 22.08 | 19.06 | 0.4767 | 1.45 | 9.66 |
| 7 | 50.47 | 36.16 | 26.85 | 25.24 | 22.11 | 0.4553 | 1.52 | 10.11 |
| 8 | 48.85 | 35.33 | 27.01 | 25.29 | 21.16 | 0.4655 | 1.49 | 9.89 |
| 9 | 49.91 | 36.84 | 31.14 | 26.96 | 25.56 | 0.4367 | 1.59 | 10.54 |
| 10 | 50.06 | 36.44 | 29.31 | 26.61 | 25.18 | 0.4425 | 1.57 | 10.41 |
Абиотический контроль показал отсутствие изменений содержания ибупрофена за время отбора проб. Остаточное содержание ибупрофена в культуральной среде Rhodococcus cerastii ИЭГМ 1243 в 10 реализациях за первые сутки уменьшилось до 43–50% и после пяти суток до 17–26%, что свидетельствует об эффективности процесса биодеструкции ибупрофена в данных условиях. Разброс значений концентрации исследуемого вещества по реализациям в день отбора проб составил 7–9%, что при достаточной точности методики хроматографического анализа подтверждает случайность процесса биодеструкции с позиций стохастического анализа [17, 18].
Кинетическое моделирование процесса биодеструкции ибупрофена. Для кинетического моделирования использовали уравнение первого порядка dx/dt = – kx с начальным условием x0 = 100% при t = 0. Данное уравнение адекватно описывает динамику изменения концентрации лекарственных средств (дротаверина гидрохлорида, кодеина фосфата, ацетилсалициловой кислоты и др.) в процессе бактериальной деструкции [19–21]. Значения параметра скорости биодеструкции k в реализациях определяли с применением метода наименьших квадратов по полученным экспериментальным данным (табл. 2). Помимо этого, согласно выражению t1/2 = ln(2)/k определяли период полураспада ибупрофена в процессе биодеструкции, а по выражению t1 = ln(100)/k устанавливали время окончания процесса биодеструкции при 100-кратном уменьшении начальной концентрации исследуемого вещества (табл. 2).
Кинетические кривые, характеризующие изменение остаточной концентрации ибупрофена в культуральных средах родококков в процессе его биодеструкции (рис. 4), хорошо соответствуют полученным экспериментальным данным (табл. 2).
Рис. 4.
Кинетические кривые изменения концентрации ибупрофена в процессе биодеструкции клетками Rhodococcus cerastii ИЭГМ 1243.
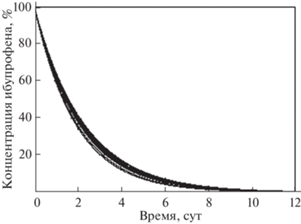
Значения параметра k скорости процесса биодеструкции ибупрофена с использованием клеток Rhodococcus cerastii ИЭГМ 1243 находятся в пределах 0.4367−0.5252 сут–1, период полураспада t1/2 − 1.32−1.59 сут, время окончания процесса t1 − 8.77−10.54 сут. Доверительные интервалы для выборочных средних значений периода полураспада и времени окончания процесса биодеструкции ибупрофена, установленные с применением критического значения коэффициента Стьюдента для доверительной вероятности P = 95% и числа степеней свободы (n – 1) = 9, составляют (1.49 ± ± 0.07) сут и (9.88 ± 0.45) сут соответственно. Полученное значение относительного стандартного отклонения для данных интервалов (6.4%) свидетельствует о приемлемой воспроизводимости процесса биодеструкции ибупрофена [18].
* * *
Методом обращенно-фазовой ВЭЖХ подобраны условия хроматографического определения ибупрофена в культуральных средах родококков. Предложенная методика характеризуется достаточной точностью, линейной градуировочной зависимостью, что позволяет использовать ее для достоверной оценки содержания ибупрофена в процессе бактериальной деструкции. С применением кинетического моделирования осуществлен прогноз изменения содержания ибупрофена в процессе биодеструкции, определены период полураспада вещества, время окончания процесса и его воспроизводимость. Полученные данные могут быть использованы при разработке биотехнологических способов очистки сточных вод фармацевтических предприятий от опасных для окружающей природной среды фармацевтических отходов.
Исследования выполнены при поддержке Госзадания АААА-А19-119112290008-4 Минобрнауки РФ и РНФ (грант 21-14-00132).
Список литературы
Nikolaou A. Pharmaceuticals and related compounds as emerging pollutants in water: Analytical aspects // Global NEST J. 2013. V. 15. № 1. P. 1. https://doi.org/10.30955/gnj.000969
aus der Beek T., Weber F.A., Bergmann A., Hickmann S., Ebert I., Küster A.H.A. Pharmaceuticals in the environment. Global occurrences and perspectives // Environ. Toxicol. Chem. 2016. V. 35. P. 823. https://doi.org/10.1002/etc.3339
Баренбойм Г.М., Чиганова М.А. Загрязнение поверхностных и сточных вод лекарственными препаратами // Вода: хим. экол. 2012. № 10. С. 40.
Lin A.Y., Tsai Y.T. Occurrence of pharmaceuticals in Taiwan’s surface waters: Impact of waste streams from hospitals and pharmaceutical production facilities // Sci. Total Environ. 2009. V. 407. № 12. P. 793. https://doi.org/10.1016/j.scitotenv.2009.03.009
Ortiz de Garcia S.A., Pinto G.P., Garcia-Encina P.A., Irusta R. Ecotoxicity and environmental risk assessment of pharmaceuticals and personal care products in aquatic environments and wastewater treatment plants // Ecotoxicology. 2014. V. 23. P. 1517. https://doi.org/10.1007/s10646-014-1293-8
Weigel S., Kallenborn R., Hühnerfuss H. Simultaneous solid-phase extraction of acidic, neutral and basic pharmaceuticals from aqueous samples at ambient (neutral) pH and their determination by gas chromatography-mass spectrometry // J. Chromatog. A. 2003. V. 1023. № 2. P. 183. https://doi.org/10.1016/j.chroma.2003.10.036
Регистр лекарственных средств России. URL: https://www.rlsnet.ru/mnn_index_id_1061.htm (дата обращения: 12.04.2022).
Chopra S., Kumar D. Ibuprofen as an emerging organic contaminant in environment, distribution and remediation // Heliyon. 2020. V. 6. № 6. P. e04087. https://doi.org/10.1016/j.heliyon.2020.e04087
Singh V., Suthar S. Occurrence, seasonal variations, and ecological risk of pharmaceuticals and personal care products in River Ganges at two holy cities of India // Chemosphere. 2021. V. 268. P. 129331. https://doi.org/10.1016/j.chemosphere.2020.129331
Moreau M., Hadfield J., Hughey J., Sanders F., Lapworth D.J., White D., Civil W. A baseline assessment of emerging organic contaminants in New Zealand groundwater // Sci. Total Environ. 2019. V. 686. P. 425. https://doi.org/10.1016/j.scitotenv.2019.05.210
Guruge K.S., Goswami P., Tanoue R., Nomiyama K., Wijesekara R.G.S., Dharmaratne T.S. First nationwide investigation and environmental risk assessment of 72 pharmaceuticals and personal care products from Sri Lankan surface waterways // Sci. Total Environ. 2019. V. 690. P. 683. https://doi.org/10.1016/j.scitotenv.2019.07.042
Ivshina I.B., Mukhutdinova A.N., Tyumina H.A., Vikhareva H.V., Suzina N.E., El’-Registan G.I., Mulyukin A.L. Drotaverine hydrochloride degradation using cyst-like dormant cells of Rhodococcus ruber // Curr. Microbiol. 2015. V. 70. № 3. P. 307. https://doi.org/10.1007/s00284-014-0718-1
Ivshina I.B., Tyumina E.A., Kuzmina M.V., Vikhareva E.V. Features of diclofenac biodegradation by Rhodococcus ruber IEGM 346 // Sci. Rep. 2019. № 9. P. 9159. https://doi.org/10.1038/s41598-019-45732-9
Ivshina I.B., Tyumina E.A., Bazhutin G.A., Vikhareva E.V. Response of Rhodococcus cerastii IEGM 1278 to toxic effect of ibuprofen // PLoS ONE. 2021. V. 16. № 11. P. e0260032. https://doi.org/10.1371/journal.pone.0260032
Catalogue of Strains of Regional Specialized Collection of Alkanotrophic Microorganisms. URL: http://www.iegmcol.ru/strains/index.html (дата обращения 12.04.2022).
Guidance for Industry. Bioanalytical Method Validation. U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Veterinary Medicine (CVM), 2018.
Селянинов А.А., Вихарева Е.В., Ившина И.Б., Баранова А.А., Карпенко Ю.Н. Стохастический анализ повторяемости процесса биодеструкции дротаверина гидрохлорида // Рос. журн. биомех. 2013. Т. 17. № 1(59). С. 41. (Selyaninov A.A., Vikhareva E.V., Ivshina I.B., Baranova A.A., Karpenko Yu.N. The stochastic analysis of repeatability of the process of biological destruction of drotaverine hydrochloride // Russ. J. Biomech. 2013. V. 17. № 1(59). P. 35.)
Сергиенко В.И., Бондарева И.Б. Математическая статистика в клинических исследованиях. М.: ГЭОТАР МЕДИЦИНА, 2000. 256 с.
Карпенко Ю.Н., Селянинов А.А., Мухутдинова А.Н., Рычкова И.И., Баранова А.А., Вихарева Е.В., Ившина И.Б. Хроматографический анализ и кинетическое моделирование процесса биодеструкции дротаверина в культуральной жидкости R. rhodochrous // Журн. аналит. химии. 2014. Т. 69. № 7. С. 750. (Karpenko Yu.N., Selyaninov A.A., Mukhutdinova A.N., Rychkova M.I., Baranova A.A., Vikhareva E.V., Ivshina I.B. Chromatographic determination of drotaverine hydrochloride and kinetic modeling of the process of its biodestruction in a R. rhodochrous culture liquid // J. Anal. Chem. 2014. V. 69. № 7. P. 681.)https://doi.org/10.1134/S1061934814070077
Плотников А.Н., Карпенко Ю.Н., Вихарева Е.В., Тюмина Е.А., Рычкова М.И., Селянинов А.А. Определение кодеина фосфата в культуральной жидкости родококков методом высокоэффективной жидкостной хроматографии // Вестн. Моск. ун-та. Серия Химия. 2018. Т. 59. № 1. С. 50. (Plotnikov A.N., Karpenko Y.N., Vikhareva E.V., Tyumina E.A., Richkova M.I., Selyaninov A.A. Determination of codeine phosphate in the culture fluid of Rhodococcus by high-performance liquid chromatography // Moscow Univ. Chem. Bull. 2017. V. 72. № 6. P. 328.)https://doi.org/10.3103/S0027131418010054
Хренков А.Н., Вихарева Е.В., Тумилович Е.Ю., Карпенко Ю.Н., Селянинов А.А., Тюмина Е.А. Хроматографический анализ ацетилсалициловой кислоты в культуральных жидкостях родококков // Вестн. Моск. ун-та. Серия Химия. 2020. Т. 61. № 5. С. 388. (Khrenkov A.N., Vikhareva E.V., Tumilovich E.Yu., Karpenko Yu.N., Selyaninov A.A., Tyumina E.A. Chromatographic analysis of acetylsalicylic acid in Rhodococcus cultural fluids // Moscow Univ. Chem. Bull. 2020. V. 61. № 5. Р. 309.)https://doi.org/10.3103/S0027131420050053
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии