Журнал аналитической химии, 2023, T. 78, № 2, стр. 176-186
Извлечение и концентрирование высоколипофильного антиоксиданта 2,6-диизоборнил-4-метилфенола и его метаболита из образцов плазмы крови для определения методом ВЭЖХ-МС/МС
А. П. Лакеев a, b, *, Е. А. Яновская a, b, **, В. А. Яновский a, М. О. Андропов a
a Национальный исследовательский Томский государственный университет, химический факультет,
научно-образовательный центр “Перспективные материалы и технологии в недропользовании”
634050 Томск, просп. Ленина, 36, Россия
b Научно-исследовательский институт фармакологии и регенеративной медицины им. Е. Д. Гольдберга
Томский национальный исследовательский медицинский центр Российской академии наук
634028 Томск, просп. Ленина, 3, Россия
* E-mail: lakeevs@mail.ru
** E-mail: elena.yanovskaya@pharmso.ru
Поступила в редакцию 23.06.2022
После доработки 13.07.2022
Принята к публикации 13.07.2022
- EDN: CEKHAR
- DOI: 10.31857/S0044450223020068
Аннотация
Предложена методика извлечения 2,6-диизоборнил-4-метилфенола (ИБФ), молекула которого обладает потенциальной мультитаргетной активностью, и его активного метаболита 2,6-диизоборнил-4-гидроксиметилфенола (ИБФ–ОН) из образцов плазмы человека и крысы для дальнейшего определения методом жидкостной тандемной хромато-масс-спектрометрии. Определена растворимость ИБФ (в мг/мл) в различных органических растворителях. В частности, соединение легко растворимо в хлороформе (346 ± 14), метил-трет-бутиловом эфире (98.6 ± 3.8) и этилацетате (96.8 ± 2.0). Показано, что использование в качестве экстракционной системы с одновременной денатурацией белка смеси хлороформа и изопропанола (5 : 1, по объему) позволяет извлекать лишь 66 ± 10% ИБФ от его общего количества, в то время как степень извлечения ИБФ–ОН составляет 96 ± 7%. Предварительное разбавление 200 мкл плазмы 300 мкл физиологического раствора повышает извлечение ИБФ до 100 ± 4%. Высушивание экстрактов в вакуумном концентраторе (воздух, 45°C) с дальнейшим растворением сухих остатков в 300 мкл ацетонитрила способствует очистке биообразцов и концентрированию аналитов. Общее время пробоподготовки не превышает 70 мин, а продолжительность анализа составляет 7 мин, объем вводимой аликвоты − 2 мкл. Методика успешно апробирована на реальных образцах плазмы крыс после однократного перорального введения масляной формы ИБФ (10 мг/кг) в рамках фармакокинетических исследований.
В настоящее время, несмотря на значительные успехи в разработке биофармацевтических препаратов, актуальной остается задача поиска и создания лекарственных средств на основе малых молекул. Значительный интерес представляют так называемые “мультитаргетные лекарственные средства” [1, 2], воздействующие одновременно на несколько биологических мишеней, что обусловлено современной точкой зрения на мультифакториальную, т.е. вызываемую совокупностью как наследственных, так и внешних факторов, этиологию заболеваний.
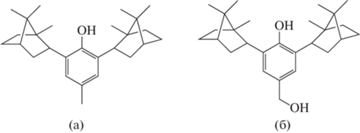
Одной из таких молекул является 2,6-диизоборнил-4-метилфенол (ИБФ, диборнол, медиборол, схема 1 а) – полусинтетическое соединение класса пространственно-затрудненных фенолов, полученное из продуктов лесопереработки в институте химии Коми научного центра Уральского отделения РАН (Сыктывкар) [3].
Схема 1 . Структурные формулы 2,6-диизоборнил-4-метилфенола (а) и 2,6-диизоборнил-4-гидроксиметилфенола (б).
В рамках проведенных доклинических исследований, а также в ходе последующих научных изысканий установлено, что ИБФ обладает выраженной антиоксидантной активностью [4], вследствие чего демонстрирует нейро-, кардио- и ретинопротекторные свойства [5–8], улучшает реологические показатели крови при моделировании различных патологических состояний [9–11]. Кроме того, соединение оказывает мембранопротекторное действие на сперматозоиды и способствует нормализации их окислительно-восстановительного статуса [12], а также обладает терапевтическим потенциалом для лечения доброкачественной гиперплазии предстательной железы [13]. Тем не менее, как отмечают авторы работы [13], метаболит ИБФ – 2,6-диизоборнил-4-гидроксиметилфенол (ИБФ–ОН, простагенин, схема 1 б) более перспективен для применения в лечении указанного заболевания.
Сотрудниками НИИ фармакологии и регенеративной медицины им. Е. Д. Гольдберга (Томск) изучена фармакокинетика ИБФ, а также его биодоступность при различных способах введения [14–18]. Установлено, что масляная форма препарата является наиболее подходящей для дальнейшего перорального использования, поскольку ИБФ относится к числу высоколипофильных веществ (lgP = 8.14) [17]. Для подобных соединений следует ожидать связывания с липидными компонентами биологических систем помимо уже известной способности лекарственных средств связываться с белками плазмы, в том числе с липопротеинами, а также клетками крови. Данные обстоятельства создают ряд сложностей для извлечения ИБФ из биологических жидкостей и тканей. Кроме того, высокое значение коэффициента липофильности определяет растворимость препарата в неполярных и малополярных растворителях. При использовании классического способа пробоподготовки методом жидкостно-жидкостной экстракции (ЖЖЭ) указанными выше типами растворителей в органическую фазу наряду с целевыми компонентами экстрагируются различные липофильные соединения биологической матрицы, обусловливающие матричный эффект и загрязнение аналитического оборудования.
В литературе описан ряд традиционных методик пробоподготовки биологического материала для извлечения высоколипофильных соединений, за прототип которых выбран пробукол (lgP = = 11.30) [19–24]. В качестве экстрагентов авторы использовали следующие смеси (по объему): MeOH−(Me)2CO (3 : 2) [19], (Et)2O−CH2Cl2 (1 : 1) [20], EtOH [21], н-C6H14 с добавлением MeOH и EtOH [22], н-C7H16 с физиологическим раствором и EtOH [23], изо-C8H18 с дистиллированной водой и EtOH [24]. Для концентрирования и очистки проб экстракты высушивали в токе азота с последующим растворением сухих остатков в небольшом количестве органического растворителя. Авторы работы [21] высушивали экстракт в токе воздуха, остаток растворяли в (Et)2O и NaOH, затем вновь отбирали полученную органическую фракцию и высушивали досуха с дальнейшим растворением в MeOH. Что касается ИБФ, описана следующая методика пробоподготовки образцов плазмы [15, 17]: 4 мл биоматериала подвергали термической денатурации (30 мин), разбавляли 2 мл физиологического раствора, центрифугировали (10 мин), добавляли смесь CHCl3−изо-PrOH−H3PO4 (9 : 1 : 0.15, по объему), перемешивали (20 мин), центрифугировали (15 мин), отбирали органической слой и высушивали в токе азота, сухой остаток растворяли в 100 мкл смеси н-C6H14−изо-PrOH−MeCN (3 : 5 : 2, по объему), фильтровали через пористый фильтр и 5 мкл использовали для хроматографического анализа с флуориметрическим детектированием (общее время анализа 16 мин). Количественная характеристика извлечения ИБФ не приведена.
Одно из требований при выборе подходящего экстрагента – его способность растворять максимальное количество аналита. В литературе приведены лишь качественные характеристики растворимости ИБФ в некоторых растворителях [25]: практически нерастворим в воде, очень плохо растворим в 95%-ном EtOH, умеренно растворим в (Et)2O, н-C6H14 и (Me)2CO, хорошо растворим в CHCl3.
Цель настоящей работы – разработка методики пробоподготовки образцов плазмы для определения ИБФ и его метаболита ИБФ–ОН методом жидкостной тандемной хромато-масс-спектрометрии (ВЭЖХ-МС/МС). Особое внимание уделено минимизации количества биологического материала, а также продолжительности пробоподготовки, что, несомненно, важно для дальнейших клинических исследований. Интерес также представляло получение количественных данных о растворимости ИБФ в различных растворителях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Использовали стандартные образцы (содержание основного вещества не менее 98%) 2,6-диизоборнил-4-метилфенола и 2,6-диизоборнил-4-гидроксиметилфенола (институт химии Коми научного центра Уральского отделения РАН, Россия), ацетонитрил сорт 0, ос. ч. (Криохром, Россия), ацетон х. ч. (ЭКОС-1, Россия), гексан х. ч. (ЭКОС-1, Россия), гептан х. ч. (ЭКОС-1, Россия), диметилсульфоксид (99%, Иодные технологии и маркетинг, Россия), диэтиловый эфир х. ч. (Кузбассоргхим, Россия), изопропанол х. ч. (ЭКОС-1, Россия), метанол х. ч. (Вектон, Россия), метил-трет-бутиловый эфир х. ч. (ЭКОС-1, Россия), хлороформ х. ч. (ЭКОС-1, Россия), этанол (95%, Кемеровская фармацевтическая фабрика, Россия), этилацетат х. ч. (ЭКОС-1, Россия), концентрированную серную х. ч. (Сигма Тек, Россия) и ортофосфорную х. ч. (Химпром, Россия) кислоты, муравьиную кислоту (~98%, Sigma-Aldrich, США), аммиак х. ч. (Сигма Тек, Россия), сульфат аммония х. ч. (Химреактивснаб, Россия), физиологический раствор (Мосфарм, Россия). Сверхчистую воду (тип I) получали c применением специализированной системы очистки воды Millipore Direct-Q 5 UV (Merck, США).
Оборудование. Аналитическая ВЭЖХ-МС/МС-система включала дегазатор DGU-20A5R, насосы высокого давления LC-20ADXR, автоинжектор SIL-20ACXR, термостат CTO-20A (Shimadzu, Япония), тандемный масс-спектрометр Triple Quad 3500 с тройным квадруполем (AB Sciex, США), хроматографическую колонку EC Nucleodur C8ec (150 × 4.6 мм, 5 мкм, 100 Å) (Macherey-Nagel, Германия) с предколоночным картриджем, газогенератор азота Genius (Peak Scientific, Великобритания).
Для пробоподготовки образцов применяли универсальный пробирочный вортекс MSV-3500 (Biosan, Латвия), мультифункциональную центрифугу с охлаждением SL 16R (Thermo Scientific, США), вакуумный центробежный концентратор Concentrator plus (Eppendorf, Германия), термошейкер TS-100 (Biosan, Латвия).
Программное обеспечение Analyst 1.7.2 и MultiQuant 3.0.3 использовали для сбора и обработки хромато-масс-спектрометрических данных соответственно.
Биологические образцы. Образцы интактной плазмы здоровых добровольцев, содержащей дикалиевую соль этилендиаминтетрауксусной кислоты в качестве антикоагулянта, приобретали у частной организации и хранили при –32°C. Образцы интактной плазмы крыс линии Вистар с добавлением гепарината натрия в качестве антикоагулянта получали из сонной артерии, предварительно наркотизировав животных диэтиловым эфиром. Образцы крови центрифугировали (3000×g, 15 мин, 4°C), отбирали полученную плазму и хранили при –32°C.
Все процедуры с участием животных как объектов данного исследования выполнены в соответствии с международными и национальными руководящими принципами по уходу и использованию животных, а также одобрены локальным комитетом НИИФиРМ им. Е. Д. Гольдберга, где выполнено исследование.
Приготовление стандартных растворов. Исходные растворы ИБФ и ИБФ–ОН (1000 мкг/мл) готовили растворением их точных навесок в MeOH и в смеси MeCN−(Me)2CO (8 : 2, по объему) соответственно. Затем из полученных растворов последовательным разбавлением MeCN получали рабочие растворы с концентрациями 400, 40, 0.8 мкг/мл (ИБФ) и 40, 0.8, 0.08 мкг/мл (ИБФ–ОН). Из них, в свою очередь, готовили градуировочные растворы (n = 9) в концентрационном диапазоне 0.2–100 мкг/мл (ИБФ) и (4–400) × × 10–3 мкг/мл (ИБФ–ОН). Для оценки степени извлечения аналитов готовили растворы контроля качества с концентрациями 90 мкг/мл (ИБФ) и 0.36 мкг/мл (ИБФ–ОН). При приготовлении градуировочных растворов и растворов контроля качества использовали отдельные исходные и рабочие растворы.
Все исходные и рабочие растворы хранили в посуде из темного стекла в холодильных камерах при –32°C, а градуировочные растворы и растворы контроля качества – при 4°C в виалах из прозрачного стекла.
Определение растворимости 2,6-диизоборнил-4-метилфенола. В сверхчистую воду (500 мкл), (Me)2SO, (Me)2CO, MeOH, MeCN, MeOC(Me)3, EtOH, (Et)2O, EtOAc, изо-PrOH, н-C6H14, н-C7H16, CHCl3 (300 мкл для каждого растворителя) вносили навески ИБФ до получения насыщенных растворов. Суспензии интенсивно встряхивали на термошейкере (500 об/мин, 25°C) в течение 6 ч для установления гетерогенного равновесия (при растворении вещества в раствор вносили его новую порцию). Эксперимент проводили в плотно закрытых пробирках типа Эппендорф во избежание улетучивания органических растворителей (количество контролировали по заранее установленным меткам). Далее полученные насыщенные растворы центрифугировали (12 000 об/мин, 3 мин, 25°C) и 20 мкл надосадочной жидкости переносили в виалы. После испарения растворителя остаток растворяли в MeCN, разбавляли и анализировали методом ВЭЖХ-МС/МС. В случае таких растворителей, как вода, ROH, MeCN, (Me)2SO надосадочные жидкости разбавляли без предварительного высушивания.
Для количественной оценки содержания ИБФ в полученных растворах использовали метод абсолютной градуировки, которую строили по градуировочным растворам в диапазоне 0.1–5 мкг/мл (n = 7; готовили отдельно из растворов, указанных в разделе “Приготовление стандартных растворов”). Уравнение градуировочной зависимости имело следующий вид: y = 11.1595x – 472.2379 (линейная функция с весовым фактором 1/x; коэффициент детерминации R2 = 0.9932).
Приготовление градуировочных, контрольных и холостых образцов. Образцы интактной плазмы человека или крысы перед анализом размораживали при комнатной температуре, 190 мкл плазмы затем помещали в пробирки типа Эппендорф и добавляли 10 мкл стандартного градуировочного или контрольного раствора (смесь ИБФ и ИБФ–ОН). Для приготовления холостых образцов к плазме добавляли 10 мкл MeCN. Диапазон концентраций аналитов в градуировочных образцах составил 0.01–5 мкг/мл (ИБФ) и (0.2–20) × 10–3 мкг/мл (ИБФ–ОН). Концентрации в образцах контроля качества – 4.5 мкг/мл (ИБФ) и 18 × 10–3 мкг/мл (ИБФ–ОН).
Пробоподготовка. Ниже описаны различные способы пробоподготовки исследуемых биологических образцов. В каждом случае общим этапом, если не указано иное, являлось перемешивание проб на вортексе (2100 об/мин, 5 мин), центрифугирование (12 000×g, 8 мин, 4°C), отбор органической фракции и ее высушивание в концентраторе (1200 об/мин, 30–50 мин в зависимости от растворителя, 45°C), растворение остатков в 300 мкл MeCN с последующим перемешиванием при 1500 об/мин в течение 5 мин и переносом полученного экстракта в виалу для дальнейшего анализа. Под образцом далее будем понимать смесь 190 мкл плазмы и 10 мкл контрольного раствора.
(1) Образец + 400 мкл охлажденного MeCN (или MeOH) (без высушивания);
(2) Образец + 1200 мкл н-C6H14;
(3) Образец + 1200 мкл н-C7H16;
(4) Образец + 600 мкл н-C6H14 + 600 мкл MeOC(Me)3;
(5) Образец + 400 мкл н-C6H14 + 400 мкл MeOC(Me)3 + 400 мкл (Et)2O;
(6) Образец + 600 мкл н-C6H14 + 600 мкл EtOAc;
(7) Образец + 1200 мкл CHCl3;
(8) Образец + 200 мкл изо-PrOH + 1000 мкл CHCl3;
(9) Образец + 200 мкл MeOH + 1000 мкл CHCl3.
В качестве наиболее подходящей экстракционной системы выбрали смесь (8) (см. ниже раздел “Результаты и их обсуждение”), поэтому тщательно проанализировали влияние соотношения растворителей CHCl3−изо-PrOH (1 : 1; 2 : 1; 2.5 : 1; 3 : 1; 5 : 1, по объему) на степень извлечения ИБФ и ИБФ–ОН. Также изучили роль неорганических добавок 3 М (NH4)2SO4, 0.6 М H2SO4 и 30%-ной (по массе) H3PO4 в процессе извлечения целевых компонентов. Более детально оценили влияние физиологического раствора. Так, физиологический раствор добавляли к 200 мкл плазмы, содержащей аналиты, в соотношениях 1 : 2; 1 : 1 и 1.5 : 1 (объем плазмы был постоянным).
Оценка степени извлечения. Извлечение оценивали на образцах контроля качества (n = 3). В качестве образцов сравнения использовали экстракты холостых образцов, к которым непосредственно перед анализом на этапе высушивания добавляли известное количество аналита (образцы, представляющие 100%-ную эффективность экстракции). Степень извлечения рассчитывали согласно формуле:
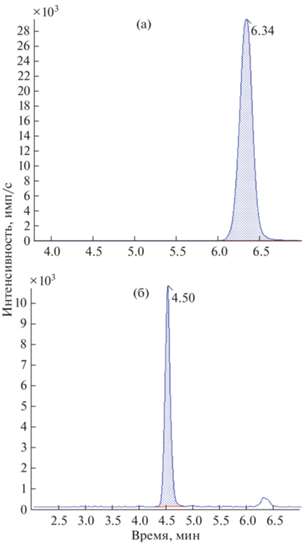
где Sреал – площадь пика образца контроля качества, подвергшегося процедуре пробоподготовки, S100% – площадь пика образца контроля качества, представляющего 100%-ную эффективность экстракции.Условия хромато-масс-спектрометрического анализа. Хроматографирование осуществляли в изократическом режиме при использовании в качестве подвижной фазы MeCN (элюент Б) и 0.1%-ную HCOOH в воде (элюент А) при объемном соотношении 97 : 3 соответственно. Объем вводимой аликвоты 2 мкл, скорость потока элюента 0.55 мл/мин, температура автоинжектора и колонки 15 и 40°C соответственно, среднее время удерживания ИБФ 6.34 ± 0.02 мин (рис. 1а) и ИБФ–ОН 4.51 ± 0.02 мин (рис. 1б), общая продолжительность анализа 7.00 мин.
Рис. 1.
Репрезентативные хроматограммы смеси стандартных образцов 2,6-диизоборнил-4-метилфенола (c = 4.5 мкг/мл) (а) и 2,6-диизоборнил-4-гидроксиметилфенола (c = 18 × 10–3 мкг/мл) (б), экстрагированных из плазмы.
Для детектирования аналитов использовали метод тандемной масс-спектрометрии с электрораспылительной ионизацией в режиме мониторинга заданных реакций (регистрировали отрицательно заряженные ионы) на основе переходов, m/z: 379.1 → 256.1 (ИБФ) и 395.1 → 377.1 (ИБФ–ОН). Время накопления сигнала 150 мс. В табл. 1 приведены условия МС/МС-детектирования, предварительно оптимизированные для обеспечения максимальной чувствительности прибора путем прямого шприцевого ввода раствора аналита в камеру источника (c = 1 мкг/мл в соответствующей подвижной фазе при скорости потока 7 мкл/мин).
Таблица 1.
Условия МС/МС-детектирования
| Параметр | Значение параметра | |
|---|---|---|
| ИБФ | ИБФ–ОН | |
| Потенциал входа, В | –3.4 | |
| Потенциал декластеризации, В | –260 | –200 |
| Энергия столкновения, В | –60 | –48 |
| Потенциал столкновения на выходе из ячейки, В | –10 | |
| Газовая завеса (N2), psi | 20 | |
| Газ столкновения (N2), psi | 10 | |
| Напряжение на капилляре, В | –4500 | |
| Температура источника, °C | 500 | |
| Газ-распылитель (воздух), psi | 40 | |
| Газ-нагреватель (воздух), psi | 35 | |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
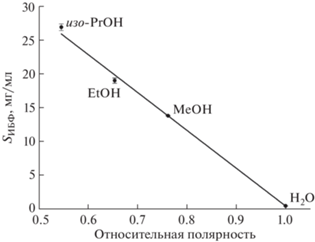
Растворимость 2,6-диизоборнил-4-метилфенола. Растворимость ИБФ изучали в 13 растворителях различной природы (табл. 2): полярные протонные (ROH, H2O) и апротонные (EtOAc, (Me)2CO, MeCN, (Me)2SO), неполярные (н‑C6H14, н-C7H16, (Et)2O, MeOC(Me)3, CHCl3). Как и ожидалось, аналит оказался лучше всего растворим в неполярных растворителях (за исключением (Et)2O), а также в одном полярном апротонном (EtOAc). В связи с тем, что даже в таких неполярных растворителях, как (Et)2O, MeOC(Me)3, CHCl3, ориентационные и индукционные силы на фоне преобладания дисперсионных вносят определенный вклад в межмолекулярные взаимодействия, довольно сложно выявить характер зависимостей растворимости ИБФ от диэлектрической проницаемости конкретного растворителя, его поляризуемости или дипольного момента даже в пределах одной группы. Тем не менее можно выделить следующую корреляцию. В ряду полярных амфипротонных растворителей (в скобках приведены значения их полярности, рассчитанные относительно полярности воды [26]) H2O (1.000), MeOH (0.762), EtOH (0.654), изо-PrOH (0.546) наблюдается возрастание растворимости ИБФ (табл. 2) наряду с закономерным уменьшением энергий водородных связей и диполь-дипольных взаимодействий между молекулами растворителя (параметры δh и δp по Хансену [27] соответственно). Зависимость значения растворимости ИБФ в рассматриваемых растворителях от их относительной полярности носит линейный характер (рис. 2; y = –56.0537x + 56.5124, R2 = 0.9998). Полученный порядок указывает на то, что в общем случае растворимость соединения возрастает с увеличением размера молекул растворителя и уменьшением его полярности. В целом экспериментальные данные свидетельствуют о незначительном вкладе специфической сольватации в процесс растворения аналита, что, вероятно, обусловлено стерической заслоненностью гидроксильной группы объемными изоборнильными группировками. Так, по мере введения в молекулу фенола различных заместителей в ряду фенол (9.98 [28], 82.8 мг/мл [29]), пара-крезол (10.14 [28], 21.5 мг/мл [29]), 2,6-диизоборнил-4-метилфенол (11.20, 0.46 мг/мл), 2,6-ди-трет-бутил-4-метилфенол (12.20 [30], 0.6 × 10–3 мг/мл [29]) наблюдается снижение подвижности атома водорода гидроксила, что выражается в возрастании значений pKa и уменьшении растворимости соединений в воде (данные представлены для I = 0 и t = 20 или 25°C).
Таблица 2.
Растворимость 2,6-диизоборнил-4-метилфенола в различных растворителях при 25°C
| Растворитель | S, мг/мл | S, мл растворителя на 1 г вещества* |
|---|---|---|
| Гексан | 53.6 ± 1.0 | 19 |
| Гептан | 50.3 ± 1.1 | 20 |
| Диэтиловый эфир | 22.7 ± 1.5 | 44 |
| Метил-трет- бутиловый эфир | 98.6 ± 3.8 | 10 |
| Хлороформ | 346 ± 14 | 3 |
| Этилацетат | 96.8 ± 2.0 | 10 |
| Изопропанол | 26.9 ± 0.5 | 37 |
| Ацетон | 12.57 ± 0.31 | 80 |
| Этанол | 19.0 ± 0.4 | 53 |
| Метанол | 13.80 ± 0.05 | 73 |
| Ацетонитрил | 25.50 ± 0.23 | 39 |
| Диметилсульфоксид | 0.40 ± 0.06 | 2500 |
| Вода | 0.460 ± 0.032 | 2174 |
* Характеристика растворимости вещества согласно Государственной Фармакопеи РФ XIV издания [31].
Рис. 2.
Зависимость растворимости 2,6-диизоборнил-4-метилфенола (мг/мл) от относительной полярности растворителя (R2 = 0.9998).
В фармакопейном анализе понятие растворимости используется в качестве характеристики приблизительной растворимости фармацевтической субстанции при постоянной температуре. Согласно общей фармакопейной статье (ОФС. 1.2.1.0005.15 Растворимость) [31], растворимость соединения в различных растворителях можно охарактеризовать терминами (в скобках приведено примерное количество растворителя в мл, необходимое для растворения 1 г вещества): практически нерастворим (более 10 000), очень мало растворим (1000–10 000), мало растворим (100–1000), умеренно растворим (30–100), растворим (10–30), легко растворим (1–10) и очень легко растворим (до 1). Из представленных значений (табл. 2) следует, что ИБФ легко растворим в CHCl3, MeOC(Me)3 и EtOAc, растворим в н-C6H14 и н-C7H16, умеренно растворим в изо-PrOH, MeCN, (Et)2O, EtOH, MeOH и (Me)2CO, очень мало растворим в воде и (Me)2SO.
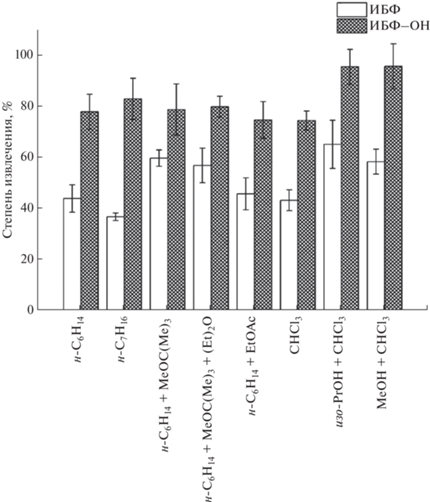
Выбор экстракционной системы. На начальном этапе оценивали возможность извлечения ИБФ из плазмы человека и крысы методом осаждения белка добавлением MeCN или MeOH (система 1), отличающимся высокой производительностью и экспрессностью. Тем не менее степень извлечения аналита варьировалась от 58 до 61%, что косвенно указывает на высокую степень связывания препарата с белками и/или липидами биологической матрицы. Вследствие этого данные варианты исключены нами из дальнейшего рассмотрения. По результатам определения растворимости ИБФ в различных растворителях (табл. 2) выбрали ряд наиболее подходящих экстрагентов, в том числе их смесей, для извлечения аналитов из биообразцов методом ЖЖЭ (системы 2–9). Несмотря на то, что ИБФ (lg P = 8.14) и ИБФ–ОН (lg P = 6.20) – высоколипофильные соединения, экстракция с применением неполярных растворителей, а также их смесей (системы 2–5 и 7) оказалась наименее эффективна с точки зрения извлечения ИБФ (рис. 3), которая не превышала 61% (здесь и далее приводим усредненные величины). Аналогичная ситуация наблюдалась и для смеси н-C6H14 с полярным апротонным растворителем EtOAc (46%, система 6). Использование CHCl3 с добавлением полярных протонных растворителей – спиртов MeOH и изо-PrOH (5 : 1, по объему), выступающих в роли депротеинизирующих агентов, позволило достичь степени извлечения ИБФ, равной 66% (рис. 3). CHCl3 по сравнению с н-C6H14 характеризуется бóльшей летучестью, что позволяет значительно сократить время высушивания экстрактов в ходе дальнейшей пробоподготовки. Именно это преимущество определило выбор данного растворителя в качестве основного компонента экстракционной системы, несмотря на близкие значения степени извлечения ИБФ CHCl3 и н-C6H14 (~44%, рис. 3). Напротив, для ИБФ–ОН при использовании неполярных растворителей получили удовлетворительные результаты по его извлечению (75–83%). Тем не менее выбор системы CHCl3−изо-PrOH позволил существенно повысить степень извлечения соединения (96%, рис. 3). Следует отметить, что при экстракции ИБФ из плазмы наблюдали большой разброс данных между тестируемыми системами (степень извлечения варьировалась от 37 до 66%, рис. 3). Полученные показатели были ниже и не коррелировали с результатами по извлечению ИБФ–ОН, что, вероятно, обусловлено бóльшей липофильностью ИБФ. Таким образом, в качестве окончательного варианта экстракционной системы выбрали смесь CHCl3−изо-PrOH (5 : 1, по объему).
Рис. 3.
Результаты оценки степени извлечения 2,6-диизоборнил-4-метилфенола и 2,6-диизоборнил-4-гидроксиметилфенола из образцов плазмы с использованием различных экстракционных систем.
Влияние соотношения компонентов экстракционной системы на извлечение аналитов. Для выбранной экстракционной системы CHCl3−изо-PrOH оценили влияние соотношения компонентов (1 : 1, 2 : 1, 2.5 : 1, 3 : 1, 5 : 1 соответственно, по объему) на степень извлечения аналитов (изначально выбрали соотношение 5 : 1). Статистических различий, рассчитанных попарно между двумя группами относительно системы CHCl3−изо-PrOH (5 : 1, по объему) с помощью t-критерия Стьюдента, выявлено не было (p > 0.05). Однако отмечены визуальные различия – при соотношении CHCl3−изо-PrOH, равном 5 : 1, белковый слой на границе фаз тоньше, что позволяет отбирать бóльший объем органической фазы (рис. 4). В связи с этим указанное соотношение компонентов используемой экстракционной системы выбрали как наиболее подходящее.
Рис. 4.
Визуальное представление образцов после экстракции аналитов из плазмы смесью CHCl3−изо-PrOH при различных соотношениях компонентов (по объему).

Влияние добавок неорганических соединений на извлечение аналитов. Одним из факторов, влияющих на полноту процесса экстракции, является величина pH водной фазы, так как только в нейтральной форме аналит в максимальном количестве переходит в органическую составляющую и в меньшей степени связывается с белками плазмы. Экстракция соединений, представляющих собой слабые кислоты, максимальна только при значениях pH ниже pKa аналита не менее чем на две единицы. ИБФ (pKa1 = 11.20) и ИБФ–ОН (pKa1 = = 10.33, pKa2 = 15.20) обладают слабыми кислотными свойствами, поэтому их экстракция из плазмы крови, состоящей на 90–92% из воды, наиболее эффективна лишь в кислых, нейтральных и слабощелочных средах. В связи с этим мы наблюдали незначительное влияние pH водной фазы при добавлении H2SO4 и H3PO4 на извлечение аналитов, так как в интервале pH от 0 до 8 соединения находятся в молекулярной форме. Кроме того, добавление кислот способствовало частичному растворению белка, что приводило к загрязнению получаемых экстрактов.
При внесении 3 М раствора (NH4)2SO4 между фазами формировался выраженный белковый слой, что затрудняло отбор нижней органической фракции и приводило, таким образом, к потере аналитов. Кроме того, введение в систему (NH4)2SO4 значительно уменьшало извлечение ИБФ (по сравнению с системой, в которой (NH4)2SO4 отсутствовал).
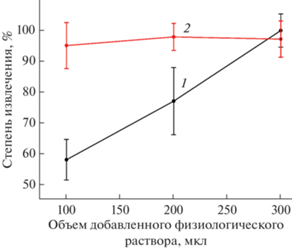
Принимая во внимание методики, описанные в работах [15, 17, 23], изучили также влияние добавки физиологического раствора на степень извлечения ИБФ и ИБФ–ОН. Для этого в 10 мкл стандартного раствора аналитов вносили 100–300 мкл физиологического раствора и 190 мкл плазмы, создавая, таким образом, соотношения раствор–плазма, равные 1 : 2, 1 : 1, 1.5 : 1 (по объему) соответственно. Далее проводили пробоподготовку образцов (см. выше раздел “Пробоподготовка”). Как видно из рис. 5, наблюдалось симбатное изменение степени извлечения ИБФ в зависимости от количества добавленного физиологического раствора. Так, разбавление плазмы 300 мкл физиологического раствора позволило достичь максимального извлечения ИБФ (100 ± 4%). В случае ИБФ–ОН добавление физиологического раствора не оказывало влияния на его извлечение (рис. 5, по сравнению с системой, не содержащей физиологический раствор).
Рис. 5.
Зависимость степени извлечения 2,6-диизоборнил-4-метилфенола (1) и 2,6-диизоборнил-4-гидроксиметилфенола (2) от объема добавленного физиологического раствора на этапе экстракции.
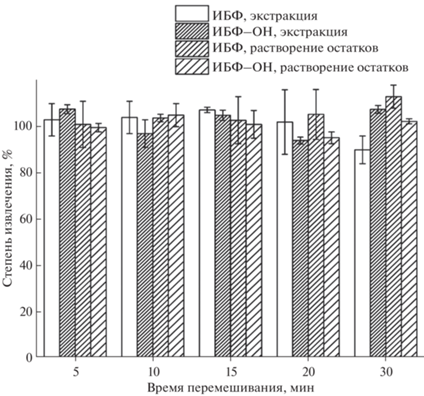
Влияние времени перемешивания на извлечение аналитов. После окончательного выбора способа пробоподготовки образцов плазмы человека и крысы (10 мкл стандартного раствора аналитов + 190 мкл плазмы + 300 мкл физиологического раствора + 200 мкл изо-PrOH, перемешивание, + + 1000 мкл CHCl3, далее см. выше раздел “Пробоподготовка”) требовалось установить подходящее время перемешивания образцов, обеспечивающее наиболее полное извлечение аналитов как на этапе их экстракции, так и при растворении остатков после высушивания. Как видно из рис. 6, практически полное извлечение целевых компонентов (с учетом погрешности) достигается уже после 5 мин интенсивного встряхивания экстрактов и сухих остатков на пробирочном вортексе. Близкие результаты по извлечению аналитов как на этапе экстракции, так и растворения остатков указывают на отсутствие термической деградации соединений при их высушивании (~45 мин) в ходе очистки и концентрирования образцов.
Рис. 6.
Влияние времени перемешивания образцов на степень извлечения 2,6-диизоборнил-4-метилфенола и 2,6-диизоборнил-4-гидроксиметилфенола на этапах экстракции и растворения сухих остатков.
* * *
Разработана методика пробоподготовки образцов плазмы крови человека и крысы, обеспечивающая практически 100%-ное извлечение как 2,6-диизоборнил-4-метилфенола, так и его активного метаболита 2,6-диизоборнил-4-гидроксиметилфенола. В качестве способа пробоподготовки выбран простой и доступный метод жидкостно-жидкостной экстракции с использованием смеси CHCl3−изо-PrOH (5 : 1, по объему) в качестве экстрагента, в одном из компонентов которого (CHCl3) 2,6-диизоборнил-4-метилфенол демонстрирует наибольшую растворимость (346 мг/мл). Показано, что добавление 300 мкл физиологического раствора препятствует связыванию соединения с белками и липидами плазмы, повышая тем самым его извлечение с 66 до 100%. Высушивание образцов в вакуумном концентраторе на воздухе при 45°C с дальнейшим растворением сухих остатков в MeCN способствует не только их очистке и снижению возможного мешающего влияния со стороны соэкстрагирующихся компонентов биологической матрицы, но и позволяет сконцентрировать аналиты почти в три раза. Предложенная методика по сравнению с описанной ранее позволяет сократить затраты времени на этапе пробоподготовки как минимум в два раза с объемом вводимой аликвоты 2 мкл. Указанные преимущества весьма существенны при работе с чувствительным и дорогостоящим аналитическим оборудованием, а также при анализе большого количества биообразцов методом ВЭЖХ-МС/МС. Для анализа достаточно 0.2 мл плазмы крови, тогда как по известной методике требовалось 4 мл биоматериала. Методика пробоподготовки и анализа успешно апробирована на реальных образцах плазмы крыс после однократного перорального введения им субстанции 2,6-диизоборнил-4-метилфенола в персиковом масле в дозе 10 мг/кг в рамках фармакокинетических исследований.
Исследование выполнено за счет гранта Российского научного фонда (проект № 22-25-00575; https://rscf.ru/project/22-25-00575/).
Авторы выражают благодарность сотрудникам лаборатории органического синтеза и химии природных соединений института химии Коми научного центра Уральского отделения РАН (Сыктывкар, Россия) в лице А.В. Кучина и И.Ю. Чукичевой за предоставление субстанций 2,6-диизоборнил-4-метилфенола и 2,6-диизоборнил-4-гидроксиметилфенола.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Makhoba X.H., Jr C.V., Mosa R.A., Viegas F.PD., Pooe O.J. Potential impact of the multi-target drug approach in the treatment of some complex diseases // Drug Des. Devel. Ther. 2020. V. 14. P. 3235. https://doi.org/10.2147/DDDT.S257494
Talevi A. Multi-target pharmacology: possibilities and limitations of the “skeleton key approach” from a medicinal chemist perspective // Front. Pharmacol. 2015. V. 6. Article 205. https://doi.org/10.3389/fphar.2015.00205
Кучин А.В., Чукичева И.Ю., Федорова И.В. Способ получения 2,6-диизоборнил-4-метилфенола. Патент РФ № 2394807. Заявка 2008120876/04 от 28.05.2008, опубл. 20.07.2010.
Чукичева И.Ю., Буравлев Е.В., Федорова И.В., Борисенков М.Ф., Кучин А.В. Антиоксидантные свойства терпенофенолов // Изв. АН. Сер. хим. 2010. № 12. С. 2220. (Chukicheva I.Yu., Buravlev E.V., Fedorova I.V., Borisenkov M.F., Kutchin A.V. Antioxidant properties of terpene-substituted phenols // Russ. Chem. Bull. 2010. V. 59. № 12. P. 2276.)https://doi.org/10.1007/s11172-010-0388-5
Плотников М.Б., Краснов Е.А., Чернышева Г.А., Смольякова В.И., Иванов И.С., Кучин А.В., Чукичева И.Ю., Федорова И.В. Нейропротекторное средство. Патент РФ № 2406488. Заявка 2009115030/15 от 20.04.2009, опубл. 20.12.2010.
Чернышева Г.А., Смольякова В.И., Кучин А.В., Чукичева И.Ю., Плотников М.Б. Нейропротективный эффект диборнола на модели фокальной ишемии-реперфузии головного мозга у крыс // Бюл. эксп. биол. и мед. 2018. Т. 166. № 7. С. 18. (Chenysheva G.A., Smol’akova V.A., Kutchin A.V., Chukicheva I.Yu., Plotnikov M.B. Neuroprotective effects of dibornol in focal cerebral ischemia/reperfusion in rats // Bull. Exp. Biol. Med. 2018. V. 166. № 1. P. 15.)https://doi.org/10.1007/s10517-018-4278-4
Плотникова Т.М., Чернышева Г.А., Смольякова В.А., Щетинин П.П., Кучин А.В., Чукичева И.Ю., Плотников М.Б. Кардиопротективная активность 2,6-диизоборнил-4-метилфенола при острой ишемии-реперфузии миокарда у крыс // Бюл. эксп. биол. и мед. 2018. Т. 165. № 5. С. 601. (Plotnikova T.M., Chernysheva G.A., Smol’yakova V.A., Shchetinin P.P., Kuchin A.V., Chukicheva I.Yu., Plotnikov M.B. Cardioprotective activity of 2,6-diisobornyl-4-methylphenol in acute myocardial ischemia/reperfusion in rats // Bull. Exp. Biol. Med. 2018. V. 165. № 5. P. 657.)https://doi.org/10.1007/s10517-018-4235-2
Жданкина А.А., Логвинов С.В., Плотников М.Б., Смольякова В.И., Иванов И.С., Кучин А.В., Чукичева И.Ю., Федорова И.В. Средство, обладающее ретинопротекторной активностью. Патент РФ № 2406487. Заявка 2009117355/15 от 06.05.2009, опубл. 20.12.2010.
Плотникова Т.М., Чернышева Г.А., Смольякова В.А., Щетинин П.П., Кучин А.В., Чукичева И.Ю., Плотников М.Б. Гемореологические эффекты диборнола в условиях модели ишемии/реперфузии миокарда // Бюл. эксп. биол. и мед. 2014. Т. 157. № 2. С. 173. (Plotnikova T.M., Chernysheva G.A., Smol’yakova V.I., Shchetinin P.P., Kuchin A.V., Chukicheva I.Yu., Plotnikov M.B. Hemorheologic effects of dibornol in a model of myocardial ischemia/reperfusion // Bull. Exp. Biol. Med. 2014. V. 157. № 2. P. 211.)https://doi.org/10.1007/s10517-014-2527-8
Плотников М.Б., Краснов Е.А., Смольякова В.И., Иванов И.С., Кучин А.В., Чукичева И.Ю. Средство, увеличивающее мозговой кровоток. Патент РФ № 2351321. Заявка 2007126303/15 от 10.07.2007, опубл. 10.04.2009.
Плотников М.Б., Краснов Е.А., Смольякова В.И., Иванов И.С., Кучин А.В., Чукичева И.Ю., Буравлев Е.В. Средства, обладающие гемореологической, антиагрегантной и антитромбогенной активностью. Патент РФ № 2347561. Заявка 2007115301/15 от 23.04.2007, опубл. 27.02.2009.
Боровская Т.Г., Камалова С.И., Кривова Н.А., Заева О.Б., Полуэктова М.Е., Вычужанина А.В., Григорьева В.А., Плотников М.Б., Гольдберг В.Е. Экспериментальное изучение эффективности фенольных антиоксидантов при мужской инфертильности, обусловленной патоспермией // Бюл. эксп. биол. и мед. 2018. Т. 166. № 7. С. 10. (Borovskaya T.G., Kamalova S.I., Krivova N.A., Zaeva O.B., Poluektova M.E., Vychuzhanina A.V., Grigor’eva V.A., Plotnikov M.B., Goldberg V.E. Experimental study of the effectiveness of phenolic antioxidants in male infertility caused by pathospermia // Bull. Exp. Biol. Med. 2018. V. 166. № 1. P. 7.)https://doi.org/10.1007/s10517-018-4276-6
Боровская Т.Г., Камалова С.И., Григорьева В.А., Полуэктова М.Е., Вычужанина А.В., Кучин А.В., Чукичева И.Ю., Буравлев Е.В., Фомина Т.И., Плотников М.Б., Гольдберг В.Е., Дыгай А.М. Эффективность антиоксидантов фенольной природы в экспериментальной модели доброкачественной гиперплазии предстательной железы // Бюл. эксп. биол. и мед. 2019. Т. 167. № 5. С. 541. (Borovskaya T.G., Kamalova S.I., Grigor’eva V.A., Poluektova M.E., Vychuzhanina A.V., Kuchin A.V., Chukicheva I.Yu., Buravlev E.V., Fomina T.I., Plotnikov M.B., Goldberg V.E., Dygai A.M. Effectiveness of phenolic antioxidants in experimental model of benign prostatic hyperplasia // Bull. Exp. Biol. Med. 2019. V. 167. № 5. P. 606.)https://doi.org/10.1007/s10517-019-04580-3
Чернышева Г.А., Смольякова В.И., Плотников М.Б., Яновская Е.А., Гурто Р.В., Удут В.В., Кучин А.В., Чукичева И.Ю. Фармакокинетика фенольного антиоксиданта 4-метил-2,6-диизоборнилфенола при внутривенном введении // Эксп. клин. фармакол. 2011. Т. 74. № 9. С. 20.
Смольякова В.И., Чернышева Г.А., Яновская Е.А., Гурто Р.В., Кучин А.В., Чукичева И.Ю., Удут В.В., Плотников М.Б. Оценка линейности фармакокинетики фенольного антиоксиданта 4-метил-2,6-диизоборнилфенола при внутрижелудочном введении // Эксп. клин. фармакол. 2014. Т. 77. № 2. С. 31.
Смольякова В.И., Чернышева Г.А., Яновская Е.А., Гурто Р.В., Кучин А.В., Чукичева И.Ю., Удут В.В., Плотников М.Б. Распределение 4-метил-2,6-диизоборнилфенола в тканях и органах крыс // Эксп. клин. фармакол. 2014. Т. 77. № 9. С. 28.
Чернышева Г.А., Смольякова В.И., Яновская Е.А., Кучин А.В., Чукичева И.Ю., Удут В.В., Плотников М.Б. Биодоступность фенольного антиоксиданта 4-метил-2,6-диизоборнилфенола при пероральном введении // Бюл. эксп. биол. и мед. 2016. Т. 161. № 4. С. 494. (Chernysheva G.A., Smolyakova V.I., Yanovskaya E.A., Kutchin A.V., Chukicheva I.Yu., Udut V.V., Plotnikov M.B. Bioavailability of phenolic antioxidant 4-methyl-2,6-diisobornylphenol after oral administration // Bull. Exp. Biol. Med. 2016. V. 161. № 4. P. 505.)https://doi.org/10.1007/s10517-016-3448-5
Яновская Е.А., Смольякова В.И., Чернышева Г.А., Гурто Р.В., Кучин А.В., Чукичева И.Ю., Удут В.В., Плотников М.Б. Экскреция высоколипофильного фенольного антиоксиданта у крыс // Хим.-фарм. журн. 2017. Т. 51. № 5. С. 13. (Yanovskaya E.A., Smol’yakova V.I., Chernysheva G.A., Gurto R.V., Kuchin A.V., Chukicheva I.Yu., Udut V.V., Plotnikov M.B. Excretion of a highly lipophilic phenolic antioxidant from rats // Pharm. Chem. J. 2017. V. 51. № 5. P. 340.)https://doi.org/10.1007/s11094-017-1610-7
Bird D.A., Tangirala R.K., Fruebis J., Steinberg D., Witztum J.L., Palinski W. Effect of probucol on LDL oxidation and atherosclerosis in LDL receptor-deficient mice // J. Lipid Res. 1998. V. 39. № 5. P. 1079.
Xie K., Xiang J., Yu Q., Liang M.-Z., Nan F., Qin Y.-P. Determination of probucol in human plasma by HPLC–MS/MS // J. Sichuan Univ. (Med. Sci. Edi.). 2012. V. 43. № 5. P. 775.
Kudo S., Akiyama H., Odomi M., Miyamoto G. High-performance liquid chromatographic procedure for the determination of probucol in human plasma // J. Chromatogr. B: Biomed. Appl. 1983. V. 277. P. 419. https://doi.org/10.1016/s0378-4347(00)84869-0
Ortega H., Coperias J.L., Castilla P., Gómez-Coronado D., Lasunción M.A. Liquid chromatographic method for the simultaneous determination of different lipid-soluble antioxidants in human plasma and low-density lipoproteins // J. Chromatogr. B: Biomed. Appl. 2004. V. 803. № 2. P. 249. https://doi.org/10.1016/j.jchromb.2003.12.025
Elinder L.S., Walldius G. Simultaneous measurement of serum probucol and lipid-soluble antioxidants // J. Lipid Res. 1992. V. 33. № 1. P. 131.
Nourooz-Zadeh J., Gopaul N.K., Forster L.A., Ferns G.A., Änggård E.E. Measurement of plasma probucol levels by high-performance liquid chromatography // J. Chromatogr. B: Biomed. Appl. 1994. V. 654. № 1. P. 55. https://doi.org/10.1016/0378-4347(94)00003-4
Краснов Е.А., Назмутдинова Е.Е., Иванов И.С., Чукичева И.Ю., Кучин А.В., Плотников М.Б. Разработка методик анализа нового пространственно-затрудненного фенола диборнола в качестве фармацевтической субстанции // Хим.-фарм. журн. 2010. Т. 44. № 11. С. 53. (Krasnov E.A., Nazmutdinova E.E., Ivanov I.S., Chukicheva I. Yu., Kuchin A.V., Plotnikov M.B. Development of methods for the analysis of the new sterically hindered phenol dibornol as a pharmaceutical substance // Pharm. Chem. J. 2011. V. 44. № 11. P. 639.) https://doi.org/10.1007/s11094-011-0536-8
Reichardt C., Welton T. Solvents and Solvent Effects in Organic Chemistry. Weinheim: Wiley-VCH, 2011. 711 p.
Hansen C.M. Hansen Solubility Parameters: A User’s Handbook. N. W.: CRC Press, 2007. 520 p.
Gross K.C., Seybold P.G. Substituent effects on the physical properties and pKa of phenol // Int. J. Quantum Chem. 2001. V. 85. № 4–5. P. 569. https://doi.org/10.1002/qua.1525
https://pubchem.ncbi.nlm.nih.gov (23.05.2022).
Boulebd H. Radical scavenging behavior of butylated hydroxytoluene against oxygenated free radicals in physiological environments: Insights from DTF calculations // Int. J. Chem. Kinet. 2021. V. 54. P. 50. https://doi.org/10.1002/kin.21540
Государственная Фармакопея РФ XIV издания. М.: ФГБУ “Научный центр экспертизы средств медицинского применения” Минздрава России, 2018. Т. 1. С. 542 (ОФС. 1.2.1.0005.15 Растворимость). https://pharmacopoeia.ru/ofs-1-2-1-0005-15-rastvorimost (23.05.2022). https://femb.ru/record/pharmacopea14 (23.05.2022).
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии