Журнал аналитической химии, 2023, T. 78, № 2, стр. 108-128
Аналитические возможности определения углеводов хроматографическими и электрофоретическими методами
Л. А. Карцова a, А. В. Малюшевская a, *, Е. А. Колобова a, b
a Санкт-Петербургский государственный университет
198504 Петродворец, Санкт-Петербург, Университетский просп., 26, Россия
b Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России
194044 Санкт-Петербург, ул. Академика Лебедева, 4/2, Россия
* E-mail: malushevskaa@gmail.com
Поступила в редакцию 18.07.2022
После доработки 28.07.2022
Принята к публикации 28.07.2022
- EDN: CDPKAH
- DOI: 10.31857/S0044450223020044
Аннотация
В обзоре обсуждаются достоинства и ограничения хроматографических и электрофоретических подходов при определении нейтральных углеводов в различных объектах со сложной матрицей, возможность реализации многообразия режимов жидкостной хроматографии и капиллярного электрофореза (в зонном и мицеллярном вариантах), особенности их сочетания с различными вариантами дериватизации, детектирования и пробоподготовки. Обсуждаются условия косвенного детектирования сахаров при введении в подвижную фазу или фоновый электролит различных поглощающих добавок, лигандообменного капиллярного электрофореза и внутрикапиллярного комплексообразования, определение углеводов методами анионообменной и гидрофильной хроматографии.
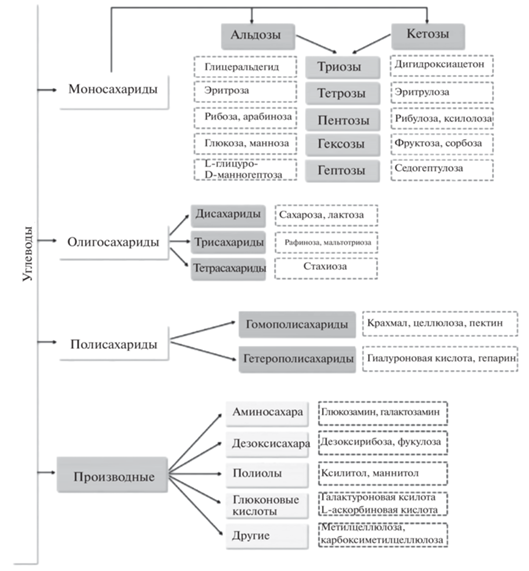
Углеводы – обширный класс органических веществ, в молекулах которых содержатся гидроксильные и карбонильные группы. Название этого класса соединений происходит от слов “гидраты углерода” (К. Шмидт, 1844 г.): первые из известных науке углеводов описывались брутто-формулой Cn(H2O)m. Углеводы подразделяют на свободные и связанные, т.е. коньюгаты, соединенные с молекулами других классов соединений. Свободные углеводы, в свою очередь, включают моносахариды (альдозы и кетозы), дисахариды, олигосахариды (восстанавливающие и невосстанавливающие) и полисахариды (гомо- и гетеро-) (рис. 1).
Выделяют и функциональные производные углеводов, выполняющие различные функции в живом организме: дезокси-, амино- и сульфосахара, фосфорные эфиры моносахаридов, глюконовые кислоты, полиолы и иминосахара и т.д., основой которых служат нейтральные природные моносахариды. Из моносахаридов наиболее распространены пентозы и гексозы. В метаболизме живых существ важнейшую роль в развитии, роста, функционирования или выживания организма играют олигосахариды. Они могут быть мишенями для распознавания патогенными токсинами и микроорганизмами, подвержены большей внутри- и межвидовой изменчивости из-за взаимодействий хозяина и патогена в ходе эволюции [2, 3]. Неотъемлемыми компонентами многих биологических объектов являются и полисахариды (крахмал, целлюлоза, хитин, инулин и др.).
К связанным углеводам традиционно относят гликопротеины и гликолипиды [2]. Гликопротеины – углеводы, ковалентно связанные с белком в результате реакции гликозилирования, одной из наиболее частых посттрансляционных модификаций в эукариотических клетках [4]. Отдельную группу гликопротеинов представляют протеогликаны. Белковая часть этих молекул гликозилирована. Помимо протеогликанов также выделяют гликозаминогликаны, состоящие из неразветвленной гетерополисахаридной основы, O-гликозилированной серином или триптофаном [5]. К этому классу углеводов относят, например, хондроитин, гепарин и дерматан.
Гликолипиды имеют в структуре как гидрофильные, так и гидрофобные группы, составляют основу клеточных мембран, проявляя поверхностную активность на границах раздела, обладают такими уникальными свойствами, как низкая токсичность, высокая способность к биологическому разложению, пенообразующая способность и т.д. Выявлен их большой потенциал в медико-биологической области [6].
Особенности структур углеводов приходится учитывать при выборе аналитического метода их определения. Они могут существовать в растворах в виде нескольких равновесных изомерных структур, имеют хиральные центры; в составе их молекул отсутствуют хромофорные группы. Ввиду разнообразия углеводов в живых организмах используют различные методы их определения: химические (титриметрия, гравиметрия, колометрия), физические (поляриметрия, рефрактометрия, денситометрия, ЯМР- и масс-спектрометрия), энзиматические, методы иммуноанализа [7–10]. Несмотря на множество подходов, предложенных для определения сахаров, наиболее востребованы хроматографические и электрофоретические методы, позволяющие разделять сложную многокомпонентную смесь на отдельные аналиты.
Данный обзор посвящен обсуждению возможностей и ограничений различных вариантов жидкостной и газовой хроматографии, а также режимов капиллярного электрофореза при определении нейтральных углеводов.
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ УГЛЕВОДОВ
Жидкостная хроматография. Поскольку нейтральные углеводы являются гидрофильными соединениями, прямое разделение высокополярных моно- и олигосахаридов предпочтительнее проводить в режиме гидрофильной хроматографии (HILIC – hydrophilic interaction chromatography) [11–14] с применением следующих детектирующих систем: рефрактометрический [15], испарительный светорассеивающий [16, 17] или масс-спектрометрический (МС) [18]. Для этой цели используют полярные колонки c амино-, циано- и диольными группами. Так, при определении олигосахаридов на основе ксилозы, хитозана и альгиновой кислоты на различных типах колонок (Silica, Diol, TSK Amide80, XAmide, Click Maltose, Click β-CD и Click TE-Cys) применяли испарительный светорассеивающий детектор [17]. В работе [19] определяли нейтральные углеводы – полиолы и фосфаты сахаров − в экстракте листьев Arabidopsis thaliana c использованием масс-селективного детектора на основе ионной ловушки с электроспрей-ионизацией, а методом HILIC в сочетании с тандемной масс-спектрометрией проводили определение углеводов в экстрактах семян Moringa oleifera [18], а также в образцах Streptococcus thermophiles после их ферментации [20]. Авторами работы [21] предложена и валидирована HILIC-MС/MС-методика определения лактулозы и маннитола в моче. Соотношение концентраций этих аналитов использовано в качестве независимого диагностического показателя (двойной сахарный тест) проницаемости кишечника [22].
Вариант HILIC с МС-детектированием применяется и при исследовании профилирования углеводов. Так, в работе [23] на полимерной колонке Aminex HPX-87H, модифицированной аминогруппами, в сочетании c времяпролетной масс-спектрометрией с электроспрей-ионизацией (ESI-TOF) проведено профилирование целлюлозной биомассы после предварительной термохимической обработки для выбора гликозилгидролазы с целью превращения в биотопливо или биохимические продукты.
Проблему размывания хроматографических пиков сахаров на классических полярных неподвижных фазах в условиях HILIC можно преодолеть применением монолитных колонок, обладающих большей удельной поверхностью. Так, авторам работы [24] удалось достичь высокой эффективности при разделении моно- и дисахаридов (рибозы, седогептулозы, глюкозы, сахарозы, мальтозы, трегалозы и раффинозы) в экстрактах растений c использованием силикагелевой монолитной колонки. Пределы обнаружения (ПО) составили 470 аттомоль для сахарозы, трегалозы и невосстанавливающих дисахаридов. Мальтоза не определялась при концентрации ниже 16 нг/л.
Перспективным направлением при разделении углеводов является использование ионных жидкостей (ИЖ), которые могут быть иммобилизованы на поверхности неподвижной фазы и обеспечить определение моно- и олигосахаридов с высокой эффективностью. Так, достигнуто разделение глюкозы и ксилозы [25] с использованием различных неподвижных фаз на основе имидазолиевых ИЖ и диоксида кремния. Ионные жидкости применяются и для модификации сорбента при твердофазной экстракции углеводов [26] с последующим их определением методом HILIC с рефрактометрическим детектированием Пределы обнаружения глюкозы, ксилозы, фруктозы и рибозы лежат в диапазоне 0.45–3 мкг/мл. В работе [27] предложена модификация поверхности аминированной полимерной колонки с использованием диглицидилового эфира 1,4- бутандиола, что обеспечило селективное разделение 9 сахаров в течение 12 мин.
Другим режимом жидкостной хроматографии, успешно зарекомендовавшим себя при разделении заряженных аналитов, является высокоэффективная анионообменная хроматография (HPAEC – high-performance anion-exchange chromatography), позволяющая определять углеводы без предварительной дериватизации, например моносахариды или N-гликаны, при высоких значениях pH (pH > > 11) элюента [28]. Обычно HPAEC комбинируют с амперометрическим [29, 30] или рефрактометрическим детектированием [31]. Амперометрическое детектирование широко применяется для обнаружения N-гликопротеинов и реализовано, например, при определении нейтральных углеводов (арабинозы, рамнозы, галактозы, глюкозы, ксилозы и маннозы) в образцах водоросли Chlorella sorokiniana; ПО аналитов составили 0.07–0.12 ppm [32]. Рефрактометрическое детектирование применяли при обнаружении лактулозы и маннитола в образцах мочи [33].
Вариант HPAEC мало совместим с масс-спектрометрией с электроспрей ионизацией (ESI-MS). Основной проблемой является сильнощелочная среда элюента. Применение обессоливающих мембран позволяет предварительно удалить из пробы мешающие компоненты [32]. Определение глюкозы, фруктозы и сахарозы в образцах меда проводили с использованием HPAEC-МС с обессоливающей мембраной, достигнутые значения ПО составили 1.49, 1.19 и 0.46 пмоль соответственно [33].
Несмотря на отсутствие хромофорных групп в молекулах углеводов, их определение возможно и с использованием спектрофотометрического детектирования. В сильнощелочной среде определяемые нейтральные сахара (глюкоза, сахароза и фруктоза) в результате фотоокисления образуют производные малонового альдегида, поглощающие свет в УФ-области спектра (λmax = 266 нм), что использовано при определении сахаров в составе фруктовых соков [34].
Наиболее распространенный обращенно-фазовый режим высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ) мало приемлем для разделения высокополярных нейтральных углеводов без предварительной их дериватизации с получением более гидрофобных производных [35–39]. Удерживание углеводов на таких колонках можно увеличить за счет образования ионных пар между молекулами сахаров и добавками аминов, например диэтаноламином, введенными в состав подвижной фазы. Показано, что при анализе смесей гликанов эффективность оказалась сопоставимой со значениями, достигнутыми в условиях гидрофильной хроматографии [40]. В работе [41] сопоставлены результаты разделения углеводов на различных колонках в режиме ОФ ВЭЖХ с рефрактометрическим детектированием или детектором заряженных аэрозолей, методами HPAEC с амперометрическим детектированием и газовой хроматографии (ГХ) с пламенно-ионизационным детектированием после дериватизации алдитолацетатом (рис. 2).
Рис. 2.
Хроматограммы модельной смеси моносахаридов, полученные различными методами: A – ВЭЖХ с использованием Prevail™ Carbohydrate колонки; B – ВЭЖХ с использованием Shodex Pb2+ колонки; С – ГХ алдитолацетат-дериватов; D – HPAEC-PAD. Аналиты: 1 – глюкоза, 2 – ксилоза, 3 – рамноза, 4 – галактоза, 5 – фукоза, 6 – арабиноза, 7 – манноза, 8 – мио-инозитол, 9 – рибоза, 10 – глюкозамин, 11 – галастозамин, 12 – глюкуроновая кислота, 13 – галактуроновая кислота [41].
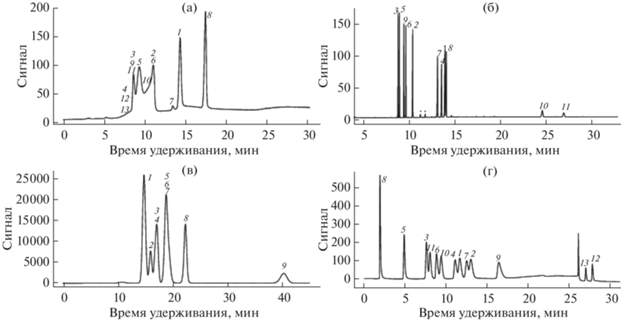
Показано, что полное разделение модельной смеси достигается в условиях HPAEC или после дериватизации методом ГХ, что успешно реализовано при определении углеводов в экстрактах водорослей [41]. Для совместного определения аналитов различной природы и полярности в биологических объектах успешно зарекомендовала себя двумерная жидкостная хроматография, основанная на последовательном разделении сложных смесей с использованием двух хроматографических колонок [42]. Применение различных стационарных фаз для каждой колонки позволяет разделять и идентифицировать большее количество аналитов. Проблемой является поиск условий кондиционирования каждой из колонок, выбор подходящей подвижной фазы, разбавление образцов при последовательном прохождении через колонки. Так, двумерную ВЭЖХ применяли при определении низкомолекулярных гепаринов [43, 44]. Исходный анализируемый образец после обработки ферментом гепариназой был разделен на отдельные фракции. Анализ проводили методом УВЭЖХ-МС с использованием двух колонок: анионообменной (Ultisil XB-SAX) и эксклюзионной (Waters SEC BEH).
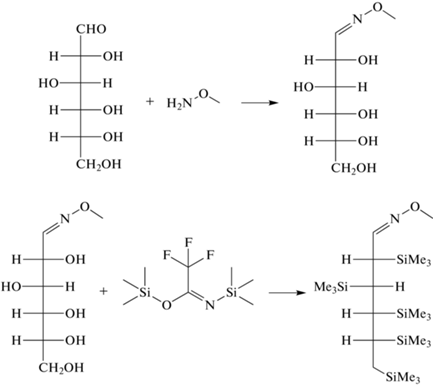
Газовая хроматография. Газовая хроматография является еще одним широко востребованным методом определения углеводов в биологических образцах в силу ее высокой эффективности, экспрессности и возможности совмещения с различными типами детекторов. В подавляющем большинстве случаев необходимо предварительное получение производных углеводов, что обусловлено их низкой летучестью и высокой полярностью [45]. Наиболее распространенными дериватами углеводов, определяемых методом ГХ, являются ацетаты, триметилсилиловые эфиры и триметилсилилоксимы [46]. Так, разработан [47] способ определения сахарозы в меде, включающий дериватизацию образца уксусным ангидридом с использованием N-метилимидазола в качестве катализатора, концентрирование аналита методом твердофазной микроэкстракции с использованием полиакрилатного волокна с последующим ГХ-МС-анализом. Пределы обнаружения составили 0.3 мас. %. Силилирование позволяет увеличить летучесть исследуемых соединений с использованием одностадийной процедуры дериватизации и провести их определение в биологическом образце (схема 1 ) [48].
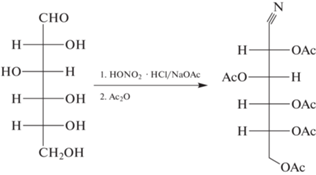
Авторам работы [49] удалось успешно разделить фруктозу, ксилозу, арабинозу, фукозу, маннозу и галактозу, извлеченных из экстрактов A. asphodeloides и G. ganoderma. Помимо триметилсилильных производных для дериватизации при ГХ-анализе применяют производные пентаацетата альдонитрила, например, при определении глюкозы и галактозы в плазме крови человека (схема 2 ) [50]. Микроволновая обработка на этапе дериватизации позволила сократить ее продолжительность с 60 до 3–5 мин.
Схема 1 . Схема дериватизации углевода с использованием метоксиамина и N,O-бис(триметил)силилтрифторацетамида [48].
Схема 2 . Схема дериватизации углевода с получением пентаацетата альдонитрила [50].
Триметилсилилирование остается наиболее распространенным вариантом получения производных для ГХ-анализа смесей углеводов, обеспечивая определение как нейтральных углеводов, так и других классов органических соединений. Это, в свою очередь, позволяет в условиях газохроматографического анализа осуществлять метаболическое профилирование, например, при поиске возможных маркеров рака легких у мышей [51]. Выявлены [51, 52] возможности различных силилирующих агентов при определении моно- и дисахаридов в пищевых продуктах. От-мечено, что наиболее предпочтителен N,O-бис(триметил)силилтрифторацетамид за счет сокращения времени анализа и снижения количества возможных побочных продуктов. Разработаны также автоматизированные системы получения триметилсилильных производных, которые применялись при определении нейтральных сахаров (арабинозы и фруктозы) наряду с органическими кислотами и аминокислотами в образцах вина [53].
Газовая хроматография, несмотря на необходимость предварительного получения соответствующих производных, является одним из наиболее эффективных методов определения нейтральных углеводов благодаря высокой чувствительности и эффективности. Однако способы дериватизации не являются селективными по отношению к углеводам, поэтому в многокомпонентной смеси нельзя исключить наложения нескольких сигналов. Применение масс-спектрометрического детектирования позволяют существенно улучшить идентификацию [54, 55].
ОПРЕДЕЛЕНИЕ УГЛЕВОДОВ МЕТОДОМ КАПИЛЛЯРНОГО ЭЛЕКТРОФОРЕЗА
Капиллярный электрофорез (КЭ) хорошо зарекомендовал себя как эффективный метод разделения, в первую очередь, заряженных частиц. Поскольку pKa нейтральных углеводов в общем случае выше 12, их электрофоретическое разделение возможно лишь при высоких значениях рН фонового электролита (ФЭ) для перевода данных аналитов в анионную форму.
Так, моно- и дисахариды разделены с использованием в качестве ФЭ раствора гидроксида натрия с амперометрическим [56] и кондуктометрическим [57] детектированием. Сообщается [58] о селективном электрофоретическом определении углеводов в образцах красного и белого вина с масс-спектрометрическим детектированием. Применение спектрофотометрических детекторов для прямого обнаружения сахаров ограничено, поскольку в составе молекул этих аналитов отсутствуют хромофорные группы. Однако установлено, что при высоких значениях рН в ячейке детектирования происходит их фотоокисление с образованием малонового альдегида и других низкомолекулярных соединений, поглощающих свет при 268 нм [59–62], что обеспечивает возможность определения сахаров в соках и винах с пределами обнаружения 0.02–0.05 мМ, а также в растительных волокнах [63] и олигомерах целлодекстринов [64].
Сообщается [65] о целевом электрофоретическом профилировании углеводов в водных экстрактах сосны и ели в зависимости от времени экстракции с прямым УФ-детектированием. Основываясь на миграции модельных соединений (фурфурол, инозитол, сахароза, глюкоза, полидатин и глюкуроновая кислота), на электрофореграммах выделили три группы аналитов: производные фурана и сахароспирты, моно- и дисахариды и уроновые кислоты. Определению сахаров в виноградных листьях и почках методом капиллярного зонного электрофореза с использованием 130 мМ раствора NaOH (pH 13.0) в качестве фонового электролита посвящена публикация [66].
Другой подход к определению углеводов методом КЭ – косвенное детектирование [67] с введением в ФЭ поглощающих в УФ-области спектра добавок: сорбиновой [68–70], 1-нафтилуксусной [71, 72], бензойной [73], 3,5-динитробензойной [74], 2,6-пиридиндикарбоновой кислот (ПДКК) [75–77], триптофана [77, 78], глицилглицина [79]. При таком подходе возможно также детектирование неорганических анионов, карбоновых и аминокислот, что может оказаться как достоинством предлагаемого варианта анализа, так и ограничением, затрудняя определение минорных концентраций углеводов [76] (рис. 3). Для сахаров пределы определения составили десятки мкг/мл.
Рис. 3.
Разделение неорганических и органических анионов, аминокислот и углеводов. Условия: кварцевый капилляр Ltot = 112.5 см (Leff = 104 см), внутренний диаметр 50 мкм; фоновый электролит: 20 мМ 2,6-пиридинкарбоновая кислота, 0.5 мМ ЦТАБ (цетилтриметиламмоний бромид), pH 12.1; 15°С; напряжение −30 кВ; гидродинамический ввод пробы в течение 6 с, давление – 50 мбар; детектирование: 350 нм; 230 нм. Концентрации: Cl– – 110 мг/л, углеводы – 200 мг/л, остальные – 50 мг/л [75].

Предложен [77] экспрессный электрофоретический вариант анализа смеси сахаров, содержащей девять моно- и олигосахаридов, в сильнощелочном (pH > 12) растворе с косвенным УФ-детектированием (280 нм). Пределы обнаружения составили несколько фемтомолей. Для сокращения времени анализа и увеличения селективности разделения нейтральных углеводов применяют различные катионные детергенты: цетилтриметиламмония бромид [75] или гидроксид [76, 77], миристилтриметиламмония бромид [72], гексадиметрина бромид [69, 70]. Модифицируя стенки капилляра, они ослабляют и обращают электроосмотический поток (ЭОП). Интересный вариант с использованием имидазолиевых ионных жидкостей предложен для определения моно- и дисахаридов (глюкозы, фруктозы и сахарозы) в овощных соках [81]. Так, 1-додецил-3-этилимидазолия хлорид использовали не только для обращения ЭОПа, но и в качестве поглощающей добавки (λdet = 207 нм) для обеспечения режима косвенного детектирования.
Поиск новых хромофорных добавок в фоновый электролит весьма актуален при решении задач обнаружения и определения нейтральных углеводов косвенным детектированием. Идеальный хромофорный агент должен характеризоваться высоким коэффициентом поглощения и обладать электрофоретической подвижностью, близкой к подвижности определяемых аналитов.
Весьма успешными при определении сахаров в различных объектах являются подходы, основанные на процессах комплексообразования с компонентами фонового электролита, например боратами, что обеспечивает перевод углеводов в анионную форму и расширяет аналитические возможности метода КЭ. При использовании таких фоновых электролитов сахара могут быть превращены in situ в анионные боратные комплексы. Их стабильность обусловлена положением гидроксильных групп, участвующих в комплексообразовании: для циклических аналитов только вицинальные группы с цис-конфигурацией могут формировать стабильные комплексы; для полиолов предпочтительнее цис-1,2-диолы [82, 83]. Устойчивость подобных комплексов возрастает при увеличении числа гидроксильных групп и зависит от рН ФЭ. Существенно, что УФ-поглощение таких комплексов заметно увеличивается при 195 нм, что обеспечивает их обнаружение [74].
Хорошо известно, что полиолы образуют хелатные комплексы и с ионами металлов [84]. Лигандообменный КЭ с участием ионов меди(II) реализован при анализе красного вина, цветочного меда и грейпфрутового сока [79, 85]. Предложены варианты разделения и обнаружения нейтральных углеводов за счет комплексообразования с солями меди(II) в режиме лигандообменного капиллярного электрофореза (ЛОКЭ) [72, 86]. В аммиачных растворах ион Cu2+ координирует четыре молекулы аммиака и две молекулы воды ([Cu(NH3)4(H2O)2]2+). Хелатирование с углеводами возможно только при высоких значениях рН фонового электролита. Формирующиеся связи металл–лиганд обладают повышенным поглощением в УФ-диапазоне, которое батохромно смещено по сравнению с первоначальным комплексом. Таким образом достигнуто разделение трех сахаров (сахарозы, рибозы и глюкозы) с высокой эффективностью (200 тыс. т.т. /м) при прямом детектировании при длине волны 245 нм [86, 87]. Установлено, что чувствительность в режиме ЛО-КЭ ограничена разницей в поглощении между хелатным комплексом углевод–Cu(II) и [Cu(NH3)4(OH2)2]2+, а пределы обнаружения оказались в три раза выше по сравнению с косвенным детектированием [72].
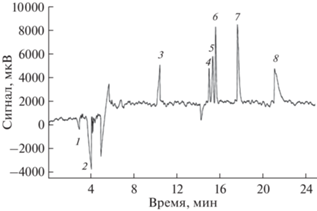
В условиях ЛОКЭ возможно совместное с углеводами обнаружение и определение неорганических катионов и аминокислот (рис. 4) [86]. Более подробно особенности метода ЛОКЭ и его аналитические возможности обсуждаются в обзоре [87]
Рис. 4.
Совместное определение сахаров, неорганических катионов и аминокислот в условиях ЛОКЭ. Условия: кварцевый капилляр Ltot = 73 см (Leff = 50 см), внутренний диаметр 50 мкм; фоновый электролит: 7.5 мМ CuSO4, 500 мМ NH3, pH 11.6; 25 кВ; 245 нм. Аналиты: 1 – К+, 2 – Nа+, 3 – глутамин, 4 – сахароза, 5 – рибоза, 6 – глюкоза, 7 – аспартат, 8 – глутамат [86].
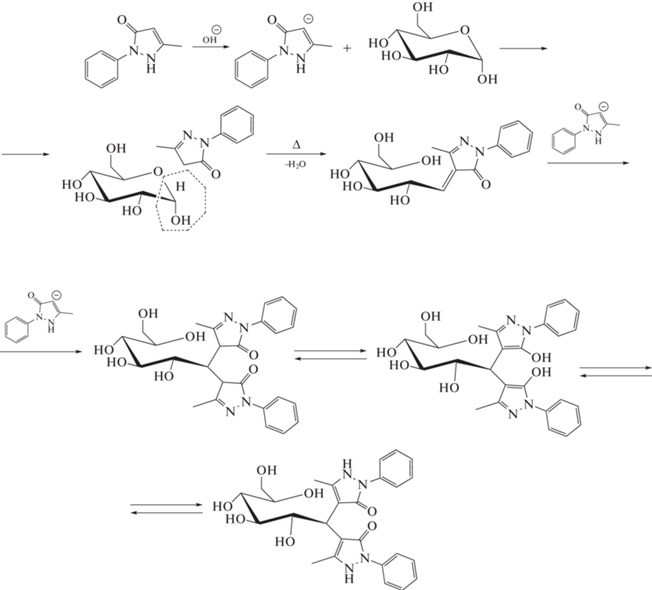
Перспективными способами электрофоретического определения углеводов являются варианты с применением внутрикапиллярной дериватизации [88–93]. Так, предложен [88] подобный подход, основанный на взаимодействии аналитов с флуоресцентным агентом 7-амино-1,3-нафталиндисульфоновой кислотой. В качестве модельных аналитов выбраны ксилоза, фукоза, глюкоза, N-ацетилглюкозамин и лактоза. В качестве внутрикапиллярного дериватизирующего реагента для определения глюкозы в плазме крови применяли п-гидразинбензолсульфоновую кислоту [89]. Предел обнаружения составил 31.2 мкМ. В работе [90] внутрикапиллярная дериватизация олигосахаридов проведена с использованием 1-фенил-3-метил-пиразолона (схема 3 ).
Схема 3 . Схема дериватизации углеводов с использованием 1-фенил-3-метил-5-пиразолона [90].
Предложена система мониторинга уровня глюкозы в крови человека с использованием микрочипового электрофореза. Сочетание восстановительного аминирования глюкозы флуоресцентным 2-аминоакридоном и образования комплекса глюкоза–борат обеспечило высокоселективное обнаружение глюкозы в такой сложной матрице, как образцы крови [92]. Обсуждаются [93] условия внутрикапиллярной дериватизации и последующего прямого УФ-детектировании (270 нм) в соках лимона, ананаса, апельсина и пробе коньяка нейтральных углеводов: ксилита, D-(−)-маннита, сахарозы, D-(+)-фукозы, D-(+)-целлобиозы, D‑(+)-галактозы, D-(+)-глюкозы, L-рамнозы, D-(+)-маннозы, D-(−)-арабинозы, D-(+)-ксилозы и D-(−)-рибозы. Воспроизводимость времен миграции составила от 0.3 до 1.1%. При этом не требовалось другой пробоподготовки, кроме разбавления анализируемой пробы.
Метод капиллярного электрофореза применяется и при разделении производных углеводов после дериватизации на стадии пробоподготовки. В качестве фонового электролита преимущественно применяют боратные буферные растворы, обеспечивая дополнительное комплексообразование с аналитами, что, в свою очередь, приводит к увеличению селективности разделения [94]. В ряде исследований разделение дериватов проводили в режиме мицеллярной электрокинетической хроматографии (МЭКХ) с использованием в качестве псевдостационарной фазы додецилсульфата натрия [94], холевой кислоты [95], цетилтриметиламмония бромида при определении фруктозы, глюкозы, мальтозы, мальтотриозы, лактозы и сахарозы в злаках и молочных продуктах [96]. В работе [94] удалось достичь разделения глюкозы и фруктозы в форме 4-аминобензонитрильных производных методом МЭКХ, что в условиях зонного варианта КЭ оказалось невозможным.
Основные реагенты дериватизации и условия разделения производных рассмотрены в следующем разделе.
ПРОБОПОДГОТОВКА
При выполнении пробоподготовки природного объекта к хроматографическому или электрофоретическому определению углеводов требуется учитывать природу и концентрацию соответствующих моносахаридов, наличие различных изомерных структурных форм и коньюгатов и др. [97–99]. Основные этапы включают извлечение из матрицы растворимых полисахаридов, их гидролиз, дериватизацию с последующим хроматографическим или электрофоретическим анализом. Гидролиз полисахаридов проводят обычно с использованием серной или трифторуксусной кислот. Ускорению гидролиза способствует микроволновая обработка.
Наиболее распространенными приемами пробоподготовки для очистки образца со сложной матрицей являются фильтрация, экстракция, хроматографическое разделение и химическая либо биологическая обработка пробы. В подавляющем большинстве случаев для извлечения и очистки нейтральных углеводов применяют различные варианты экстракции: жидкостная, твердофазная, сверхкритическая флюидная или жидкостная экстракция под давлением. В случае жидкостной экстракции наиболее часто в качестве экстрагентов используют воду и низкомолекулярные спирты [100] либо такие органические растворители, как диметилсульфоксид [101]. Имеются публикации, где роль экстрагента выполняют ионные жидкости [102]. Эффективность экстракции возрастает с применением микроволнового излучения [103]. Применение сверхкритической жидкостной экстракции для выделения углеводов пока остается ограниченным, поскольку их растворимость в наиболее распространенном в этом методе пробоподготовки сверхкритическом CO2 оказывается достаточно низкой. Предприняты попытки увеличить их растворимость добавлением смеси этанол–вода для выделения из образца углеводов, синтезированных бактериями-пребиотиками [104, 105]. Для жидкостной экстракции под давлением чаще всего в качестве экстрагента используют воду, обеспечивая разделение углеводов на фракции в зависимости от их молекулярной массы [106–109]. Так, с помощью жидкостной экстракции под давлением получены фракции образцов меда, содержащих ди- и трисахариды [108]. Твердофазная экстракция по-прежнему остается наиболее востребованным вариантом пробоподготовки. Для этой цели используют обращенно-фазовые (C8 и C18) картриджи, ионообменные сорбенты либо графитированный углерод [110–112].
В работе [113] предложено частично заполнять кварцевый капилляр карбоксилированными одностенными углеродными нанотрубками при электрофоретическом определении глюкозы, мальтозы и фруктозы. Наночастицы удерживают примесные компоненты матрицы. Электрофоретическое разделение углеводов осуществляли с использованием 200 мМ боратного буферного раствора (рН 9.5; 15 кВ). Перед вводом анализируемого образца в капилляр в течение 60 с вводили суспензию углеродных нанотрубок (50 мг/л в 300 мМ боратном буферном растворе).
Среди хроматографических методов для пробоподготовки образцов, содержащих углеводы, наибольшее распространение получила эксклюзионная хроматография. Время элюирования различных компонентов зависит от соотношения между размером их молекул и размером пор выбранной стационарной фазы. Это может быть полезно в случае необходимости выделять моно- или олигосахариды из образца, содержащего углеводы с различной степенью поликонденсации [114]. Биологическая обработка образцов для анализа смесей углеводов применяется реже, однако описано использование дрожжей для удаления моносахаридов из образцов меда, в которых требовалось установить содержание олигосахаридов [115].
В качестве методов пробоподготовки с применением химических реагентов обычно рассматриваются варианты разложения проб под действием кислот и органических растворителей (табл. 1). Кислотный гидролиз применяется для разрушения полисахаридов и их определения в образцах почвы [116, 117]. Для определения содержания ксилозы, рамнозы, маннозы, фукозы и галактозы полисахариды, присутствующие в образцах почвы, гидролизовали при 100°C в течение 4 ч до моносахаридов путем добавления трифторуксусной кислоты непосредственно в почву. Полученные моносахариды количественно дериватизировали этиловым эфиром 4-аминобензойной кислоты с восстановительным аминированием цианоборгидридом натрия и разделяли методом мицеллярной электрокинетической хроматографии с УФ-детектированием при 300 нм [117].
Метанолиз является более мягким способом расщепления полисахаридов и предложен, например, для определения компонентов лигноцеллюлоз в различных растительных объектах [118].
Формолиз обычно используется при определении сложных углеводов, нерастворимых в горячей воде [120].
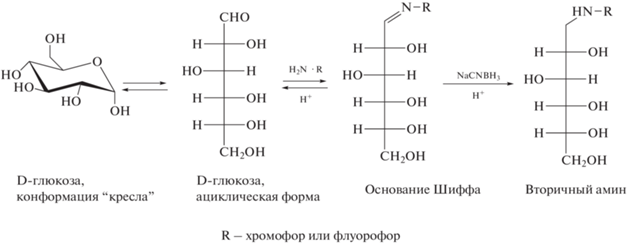
Необходимым этапом пробоподготовки является дериватизация, позволяющая изменить свойства углеводов и обеспечить их обнаружение выбранным методом. Предложено немало дериватизирующих агентов [121, 122] с введением в состав молекул углеводов хромофорных или флуорофорных групп. При этом желательно, чтобы реакция протекала с участием одной функциональной группы аналита, исключая тем самым образование нескольких продуктов. Более того, выбранный вариант получения производных должен быть воспроизводимым и характеризоваться высокой конверсией. Весьма распространена дериватизация путем восстановительного аминирования. В таких реакциях подходящие хромофоры или флуорофоры, несущие первичную аминогруппу, взаимодействуют с карбонильной группой восстанавливающих сахаров в присутствии цианоборогидрида натрия (схема 4 ) [123].
Схема 4 . Схема восстановительного аминирования сахаров на примере глюкозы [123].
В качестве дериватизирующих реагентов, участвующих в восстановительном аминировании, применяют аминобензойные кислоты и их эфиры [124–128]. Для электрофоретического разделения необходимо получать дериваты, имеющие ионогенную аналитическую форму. Так, в работе [128] в качестве реагента для дериватизации используют сульфатированные ароматические амины. В ряде публикаций для получения производных используют конденсацию между карбонильной группой восстанавливающих углеводов и активными атомами водорода 1-фенил-3-метил-5-пиразолона, что успешно применяется как в хроматографическом [129], так и в электрофоретическом анализе [90]. Фенилгидразины применяют в качестве агентов для дериватизации восстанавливающих сахаров с образованием производных, обеспечивающих высокую чувствительность и при МС- и УФ-детектировании [130].
Некоторые примеры агентов дериватизации и условия их использования представлены в табл. 2.
Таблица 2.
Реагенты дериватизации и условия хроматографического и электрофоретического определения нейтральных углеводов
| Реагент дериватизации | Метод | Аналиты | Образец | ПО | Литера- тура |
|---|---|---|---|---|---|
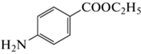 Этил-п-аминобензоат |
КЗЭ-УФ (305 нм); ФЭ: 450 мМ боратный буферный р-р, рН 9.94 | Целлобиоза, ксилоза, глюкоза, манноза, арабиноза и галактоза | Бумага | 35–72 мг/л | [124] |
| КЗЭ-УФ 305 нм; ФЭ: 450 мМ боратный буферный р-р, рН 9.7 | Ликсоза, ксилоза, рибоза, арабиноза, гулоза, талоза, глюкоза, манноза, идоза, аллоза, альтроза, галактоза | Смесь стандартов | – | [125] | |
| КЗЭ-УФ 280 нм; ФЭ: 500 мМ боратного буферного р-ра, 20% MeOH, 0.001% гексадиметринбромида; pH 10.0 | Галактоза, фукоза, арабиноза, манноза, фруктоза, глюкоза, лактоза, рибоза, сорбоза, ксилоза, мелибиоза, целлобиоза, ликсоза, мальтоза, рамноза, мальтотетроза, генциобиоза | Гидролизат листьев плюща | 1 ppm | [131] | |
| ОФ ВЭЖХ-УФ (254 нм) |
Мелибиоза, лактоза, изомальтоза, генциобиоза целлобиоза, мальтоза, галактоза, глюкоза, манноза, арабиноза, рибоза, ксилоза, фукоза, рамноза | Смесь стандартов | – | [132] | |
| HPAEC амперометрическ. детектирование |
Фукоза, рамноза, арабиноза, галактоза, глюкоза, ксилоза, фруктоза, рибоза | Смесь стандартов | 0.1–0.2 мкг/мл | [133] | |
| ОФ ВЭЖХ с диодно-матричным детектированием (250–350 нм) | 0.3–1.0 мкг/мл | ||||
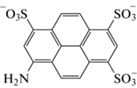 8-Аминопирен-1,3,6- трисульфоновая кислота |
КЗЭ флуориметрическое детектирование (экс: 488 нм; эм: 520 нм); ФЭ: 100 мМ боратный буферный р-р; рН 10.2 |
Рамноза, манноза, глюкоза, фруктоза, ксилоза, фукоза, галактоза | Смесь стандартов | – | [134] |
| КЗЭ, флуориметрическое детектирование (экс: 488 нм; эм:
520 нм); ФЭ: 25 мМ ацетатный буферный р-р (рН 2.4) + 0.4% полиэтиленоксидa; МС-детектирование; ФЭ: 0.3 об. % муравьиной кислоты, pH 2.4 |
Профилирование олигосахаридов | Грудное молоко | – | [135] | |
| КЗЭ, флуориметрическое детектирование (экс: 488 нм; эм: 520 нм); ФЭ: 240 мМ боратный буферный р-р, рН 9.0 |
Манноза, глюкоза, фукоза галактоза, ксилоза | Гидрализаты 6'-сиалил-N-ацетиллактозамина и гликаны бычьего фетуина | 50 пМ | [136] | |
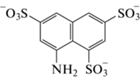 8-Аминонафталин-1,3,6- трисульфоновая кислота |
КЗЭ, флуориметрическое детектирование (экс: 370 нм; эм: 520 нм) и УФ-детектирование (214 нм); ФЭ: 200 мМ фосфатный буферный р-р, рН 2.0 |
Глюкоза, мальтоза, олигосахариды | Смесь стандартов | – | [137] |
| КЗЭ-УФ, КЗЭ-МС полиакриламидное покрытие; ФЭ: уксусная кислота (0.15 мМ)–муравьиная кислота (0.06 мМ) |
Глюкоза, мальтоза и неразветвленные мальтоолигосахариды | Декстрин-15 | – | [138] | |
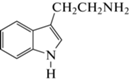 Триптамин |
МЭКХ-УФ (220 нм); ФЭ: 25 мМ холевая кислота, 100 мМ борат, 2% 1-пропанола, рН 9.7 |
Рамноза, целлюлоза, ксилоза, арабиноза, глюкоза, манноза, фукоза, галактоза, целлобиоза, мелибиоза | Экстракты растений | 50 пМ | [95] |
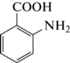 2-Аминобензойная кислота |
КЗЭ-УФ (214 нм); ФЭ: 150 мМ борат натрия, 50 мМ фосфат натрия, рН 7 |
Рибоза, фукоза, глюкоза, манноза, галактоза | Смесь стандартов | – | [126] |
| [139] | |||||
| ОФ ВЭЖХ флуориметрическое детектирование (экс: 360 нм; эм: 425); МС-детектирование |
Глюкоза, галактоза, манноза, ксилоза, рибоза, фукоза, рамноза | Гликаны улитки | – | [127] | |
| HPAEC-УФ (328 нм) |
Ксилоза, галактоза, глюкоза, арабиноза | Растения | – | [128] | |
| ОФ ВЭЖХ флуориметрическое детектирование (экс: 360 нм; эм: 425) | Галактоза, глюкоза, манноза, фукоза | Клетки яичника китайского хомячка | – | [140] | |
| ОФ ВЭЖХ флуориметрическое детектирование (экс: 360 нм; эм: 425) | 26 моноолигосахаридов | Гликаны улитки | 65 фМ | [141] | |
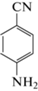 2-Аминобензонитрил |
КЗЭ-УФ (280 нм); ФЭ: 500 мМ борат, 5% н-пропанола, 5% метанола, 0.001% гексадиме-тринбромида, рН 10.5 |
Галактоза, фукоза, арабиноза, манноза, фруктоза, глюкоза, лактоза, рибоза, сорбоза, ксилоза, мелибиоза, целлобиоза, ликсоза, мальтоза, рамноза, мальтотетроза, генциобиоза | Гидролизат листьев плюща | 0.6 ppm | [131] |
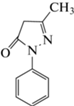 1-Фенил-3-метил-5-пиразолон |
ОФ ВЭЖХ; HILIC-УФ (248 нм); светорассеивающий детектор |
Манноза, рибоза, мальтоза, лактоза, глюкоза, галактоза, ксилоза | Смесь стандартов | 2.01–3.89 мкг/мл 38.32–43.26 мкг/мл |
[142] |
| ОФ ВЭЖХ-УФ (245 нм) | Манноза, рибоза, рамноза, глюкоза, ксилоза, галактоза, арабиноза, фукоза | Профилирование агроиндустриальных выбросов | 1.17–4.83 мкг/мл | [129] | |
| ОФ ВЭЖХ-УФ (245 нм) | 26 моно- и олигосахаридов | Гликаны улитки | 65 фМ | [142] | |
| HPLC-МС | Манноза, рибоза, рамноза, глюкоза, ксилоза, галактоза, фукоза | Экстракты растений | 0.06–0.20 нг/мл | [143] | |
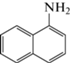 1-Аминонафталин |
ОФ КЭХ с УФ-детектированием 214 нм; ФЭ: 17.5 мМ борная кислота, рН 10, 65% ацетонитрила | Профилирование олигосахаридов | Пиво | – | [144] |
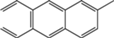 2-Аминоантрацен |
|||||
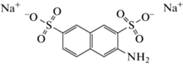 3-Амино-2,7-нафталиндисульфоновая кислота |
ОФ КЭХ-УФ (214 нм); ФЭ: 10 мМ дигидрофосфат натрия, рН 6.0, 80% ацетонитрила |
||||
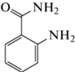 2-Аминобензамид |
ОФ ВЭЖХ флуориметрическое детектирование (экс: 260 нм, эм: 440 нм) | Глюкоза, галактоза, манноза, ксилоза, арабиноза | Морская вода | 1.2–10.8 нМ | [145] |
* * *
Рассмотрены возможности и ограничения определения нейтральных углеводов в объектах природного происхождения методами хроматографии и электрофореза. Низкие константы ионизации, отсутствие хромофорных групп в составе молекул сахаров, наличие в водных растворах нескольких равновесных изомерных структур – главные проблемы при определении этих аналитов. Один из важнейших этапов пробоподготовки углеводов к анализу различными физико-химическими методами – получение соответствующих производных. Доминирующими тенденциями в выборе стратегии при определении сахаров в объектах со сложной матрицей является применение различных методов ГХ и ВЭЖХ с масс-спектрометрическим детектированием и с получением производных. Значительная роль при решении этих задач отводится методам анионообменной и гидрофильной хроматографии. Электрофоретические методы имеют свою нишу за счет их высокой эффективности, возможности онлайн концентрирования и внутрикапиллярной дериватизации. При этом методы капиллярного электрофореза (зонный и мицеллярный варианты) могут выступать и в качестве референтных по отношению к хроматографическим. Поиск новейших и высокоселективных дериватизирующих агентов – одна из приоритетных задач при разработке как электрофоретических, так и хроматографических способов определения нейтральных углеводов.
Работа выполнена при финансовой поддержке Российского научного фонда (номер гранта 19-13-00370).
Список литературы
Wiecinska P., Zurawska A., Falkowski P., Jeong D.Y., Szafran M. Sweet ceramics: How saccharide-based compounds have changed colloidal processing of ceramic materials // J. Korean Ceram. Soc. 2020. V. 57. № 3. P. 231. https://doi.org/10.1007/S43207-020-00036-X
Gerwig G.J. The Art of Carbohydrate Analysis. Groningen: Springer, 2021. https://doi.org/10.1007/978-3-030-77791-3
Varki A. Biological roles of oligosaccharides: All of the theories are correct // Glycobiology. 1993. V. 3. № 2. P. 97. https://doi.org/10.1093/GLYCOB/3.2.97
Varki A. Biological roles of glycans // Glycobiology. 2017. V. 27. № 1. P. 3. https://doi.org/10.1093/GLYCOB/CWW086
Gandhi N.S., Mancera R.L. The Structure of glycosaminoglycans and their interactions with proteins // Chem. Biol. Drug Des. 2008. V. 72. № 6. P. 455. https://doi.org/10.1111/J.1747-0285.2008.00741.X
Cortés-Sánchez A., Hernández-Sánchez H., Jaramillo-Flores M.E. Biological activity of glycolipids produced by microorganisms: New trends and possible therapeutic alternatives // Microbiol. Res. 2013. V. 168. № 1. P. 22. https://doi.org/10.1016/j.micres.2012.07.002
Niaz K., Khan F., Shah M.A. Analysis of carbohydrates (monosaccharides, polysaccharides) / Recent Advances in Natural Products Analysis / Eds. Nabavi S.M., Saeedi M., Nabavi S.F., Silva A.S. Amsterdam: Elsevier, 2020. P. 621. https://doi.org/10.1016/B978-0-12-816455-6.00018-4
Geijtenbeek T., Torensma R., van Vliet S., van Duijnhoven G., Adema G., Kooyk Y., Figdor C. Identification of DC-SIGN, a novel dendritic cell–specific ICAM-3 receptor that supports primary immune responses // Cell. 2000. V. 100. P. 575. https://doi.org/10.1016/S0092-8674(00)80693-5
Kapaev R., Egorova K., Toukach P. Carbohydrate structure generalization scheme for database-driven simulation of experimental observables, such as NMR chemical shifts // J. Chem. Inf. Model. 2014. V. 54. № 9. P. 2594. https://doi.org/10.1021/ci500267u
Varki A., Freeze H.H., Manzi A.E. Preparation and analysis of glycoconjugates / Current Protocols in Molecular Biology. Hoboken: John Wiley & Sons, Inc, 2009. P. 1. https://doi.org/10.1002/0471142727.mb1700s88
Карцова Л.А., Бессонова Е.А., Сомова В.Д. Гидрофильная хроматография // Журн. аналит. химии. 2019. Т. 74. № 5. P. 323. (Kartsova L.A., Bessonova E.A., and Somova V. D. Hydrophilic interaction chromatography // J. Anal. Chem. 2019. V. 74. № 5. P. 415. https://doi.org/10.1134/S106193481905005810.1134/S1061934819050058https://doi.org/10.1134/S0044450219050050
Nagy G., Peng T., Pohl N.L.B. Recent liquid chromatographic approaches and developments for the separation and purification of carbohydrates // Anal. Methods UK. 2017. V. 9. № 24. P. 3579. https://doi.org/10.1039/c7ay01094j
Ikegami T., Horie K., Saad N., Hosoya K., Fiehn O., Tanaka N. Highly efficient analysis of underivatized carbohydrates using monolithic-silica-based capillary hydrophilic interaction (HILIC) HPLC // Anal. Bioanal. Chem. 2008. V. 391. № 7. P. 2533. https://doi.org/10.1007/s00216-008-2060-6
Tang K., Liang L., Cai Y., Mou S. Determination of sugars and alditols in tobacco with high-performance anion-exchange chromatography // J. Sep. Sci. 2007. V. 30. P. 2160. https://doi.org/10.1002/jssc.200700044
Захарова А.М., Гринштейн И.Л., Карцова Л.А. Определение углеводов и подсластителей в пищевых продуктах и биологически активных добавках методом высокоэффективной жидкостной хроматографии // Журн. аналит. химии. 2013. V. 68. № 12. P. 1208. (Zakharova A.M., Grinshtein I.L., and Kartsova L.A. Determination of sugars using ligand-exchange capillary electrophoresis // J. Anal. Chem. 2010. V. 68. № 12. P. 1081. https://doi.org/10.1134/S106193481310012210.1134/S1061934813100122)https://doi.org/10.7868/s0044450213100149
Fu Q., Liang T., Zhang X., Du Y., Guo Z., Liang X. Carbohydrate separation by hydrophilic interaction liquid chromatography on a “click” maltose column // Carbohydr. Res. 2010. V. 345. № 18. P. 2690. https://doi.org/10.1016/j.carres.2010.09.033
Fu Q., Liang T., Li Z., Xu X., Ke Y., Jin Y., Liang X. Separation of carbohydrates using hydrophilic interaction liquid chromatography // Carbohydr. Res. 2013. V. 379. P. 13. https://doi.org/10.1016/J.CARRES.2013.06.006
Liu J., Li J., Yi D., Liu Y., Liu R., Xue Y., Huang Q., Liu S., Jiang Y. Non-derivatization strategy for the comprehensive characterization of neutral monosaccharide isomers and neutral disaccharide isomers using hydrophilic interaction liquid chromatography coupled to quadrupole/time-of-flight mass spectrometry // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2021. V. 1185. https://doi.org/10.1016/j.jchromb.2021.122972
Antonio C., Larson T., Gilday A., Graham I., Bergström E., Thomas-Oates J. Hydrophilic interaction chromatography/electrospray mass spectrometry analysis of carbohydrate-related metabolites from Arabidopsis thaliana leaf tissue // Rapid Commun. Mass Spectrom. 2008. V. 22. № 9. P. 1399. https://doi.org/10.1002/rcm.3519
Pismennõi D., Kiritsenko V., Marhivka J., Küt M.L., Vilu R. Development and optimisation of HILIC-LC-MS method for determination of carbohydrates in fermentation samples // Molecules. 2021. V. 26. № 12. P. 3669. https://doi.org/10.3390/molecules26123669
Gervasoni J., Primiano A., Graziani C., Scaldaferri F., Gasbarrini A., Urbani A., Persichilli S. Validation of UPLC-MS/MS Method for determination of urinary lactulose/mannitol // Molecules. 2018. V. 23. № 10. P. 2705. https://doi.org/10.3390/molecules23102705
Grootjans J. Non-invasive assessment of barrier integrity and function of the human gut // World J. Gastrointest. Surg. 2010. V. 2. № 3. P. 61. https://doi.org/10.4240/wjgs.v2.i3.61
Vismeh R., Humpula J.F., Chundawat S.P.S., Balan V., Dale B.E., Jones A.D. Profiling of soluble neutral oligosaccharides from treated biomass using solid phase extraction and LC-TOF MS // Carbohydr. Polym. 2013. V. 94. № 2. P. 791. https://doi.org/10.1016/j.carbpol.2013.02.005
Ikegami T., Horie K., Saad N., Hosoya K., Fiehn O., Tanaka N. Highly efficient analysis of underivatized carbohydrates using monolithic-silica-based capillary hydrophilic interaction (HILIC) HPLC // Anal. Bioanal. Chem. 2008. V. 391. № 7. P. 2533. https://doi.org/10.1007/s00216-008-2060-6
Bi W., Zhou J., Row K.H. Separation of xylose and glucose on different silica-confined ionic liquid stationary phases // Anal. Chim. Acta. 2010. V. 677. № 2. P. 162. https://doi.org/10.1016/j.aca.2010.08.004
Tian M., Bi W., Row K.H. Separation of monosaccharides by solid-phase extraction with ionic liquid-modified microporous polymers // J. Sep. Sci. 2011. V. 34. № 22. P. 3151. https://doi.org/10.1002/jssc.201100546
Chikurova N.Yu., Shemiakina O., Shpigun O.A., Chernobrovkina A.V. Multicomponent Ugi reaction as a tool for fast and easy preparation of stationary phases for hydrophilic interaction liquid chromatography. Part I: The influence of attachment and spacing of the functional ligand obtained via the Ugi reaction // J. Chromatogr. A. 2022. V. 1666. Article 462804. https://doi.org/10.1016/j.chroma.2022.462804
Maier M., Reusch D., Bruggink C., Bulau P., Wuhrer M., Mølhøj M. Applying mini-bore HPAEC-MS/MS for the characterization and quantification of Fc N-glycans from heterogeneously glycosylated IgGs // J. Chromatogr. B. 2016. V. 1033–1034. P. 342. https://doi.org/10.1016/J.JCHROMB.2016.08.001
Corradini C., Cavazza A., Bignardi C. High-performance anion-exchange chromatography coupled with pulsed electrochemical detection as a powerful tool to evaluate carbohydrates of food interest: Principles and applications // Int. J. Carbohydr. Chem. 2012. V. 2012. P. 1. https://doi.org/10.1155/2012/487564
Tommaso R., Cataldi I., Margiotta G., Iasi L., di Chio B. Determination of sugar compounds in olive plant extracts by anion-exchange chromatography with pulsed amperometric detection // Anal. Chem. 2000. V. 72. P. 3902. https://doi.org/10.1021/ac000266o
Sequeira I.R., Kruger M.C., Hurst R.D., Lentle R.G. A simple, robust, and convenient HPLC assay for urinary lactulose and mannitol in the dual sugar absorption test // Molecules. 2022. V. 27. № 9. P. 2677. https://doi.org/10.3390/molecules27092677
de Souza M.F., Pereira D.S., Freitas S.P., Bon E., Rodrigues M.A. Neutral sugars determination in Chlorella: Use of a one-step dilute sulfuric acid hydrolysis with reduced sample size followed by HPAEC analysis // Algal Res. 2017. V. 24. P. 130. https://doi.org/10.1016/J.ALGAL.2017.03.019
Bruggink C., Maurer R., Herrmann H., Cavalli S., Hoefler F. Analysis of carbohydrates by anion exchange chromatography and mass spectrometry // J. Chromatogr. A. 2005. V. 1085. № 1. P. 104. https://doi.org/10.1016/j.chroma.2005.03.108
Schmid T., Baumann B., Himmelsbach M., Klampfl C.W., Buchberger W. Analysis of saccharides in beverages by HPLC with direct UV detection // Anal. Bioanal. Chem. 2016. V. 408. № 7. P. 1871. https://doi.org/10.1007/s00216-015-9290-1
Gonzalez N.M., Fitch A., Al-Bazi J. Development of a RP-HPLC method for determination of glucose in Shewanella oneidensis cultures utilizing 1-phenyl-3-methyl-5-pyrazolone derivatization // PLoS ONE. 2020. V. 15. № 3. Article e0229990. https://doi.org/10.1371/journal.pone.0229990
Bai W., Fang X., Zhao W., Huang S., Zhang H., Qian M. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography // J. Food Drug Anal. 2015. V. 23. № 4. P. 645. https://doi.org/10.1016/J.JFDA.2015.04.011
Rakete S., Glomb M.A. A novel approach for the quantitation of carbohydrates in mash, wort, and beer with RP-HPLC using 1-naphthylamine for precolumn derivatization // J. Agric. Food Chem. 2013. V. 61. № 16. P. 3828. https://doi.org/10.1021/JF400463R
Wu W., Hamase K., Kiguchi M., Yamamoto K., Zaitsu K. Reversed-phase HPLC of monosaccharides in glycoproteins derivatized with aminopyrazine with fluorescence detection // Anal Sci. 2000. V. 16. № 9. P. 919. https://doi.org/10.2116/analsci.16.919
Nakamura A., Hatanaka C., Nagamatsu Y. Ultraviolet spectrometric determination of neutral monosaccharides by HPLC with ethanolamine // Biosci. Biotechnol. Biochem. 2000. V. 64. № 1. P. 178. https://doi.org/10.1271/bbb.64.178
Melmer M., Stangler T., Premstaller A., Lindner W. Comparison of hydrophilic-interaction, reversed-phase and porous graphitic carbon chromatography for glycan analysis // J. Chromatogr. A. 2011. V. 1218. № 1. P. 118. https://doi.org/10.1016/J.CHROMA.2010.10.122
Templeton D.W., Quinn M., van Wychen S., Hyman D., Laurens L.M.L. Separation and quantification of microalgal carbohydrates // J. Chromatogr. A. 2012. V. 1270. P. 225. https://doi.org/10.1016/j.chroma.2012.10.034
Stoll D.R., Carr P.W. Two-dimensional liquid chromatography: A state of the art tutorial // Anal. Chem. 2017. V. 89. № 1. P. 519. https://doi.org/10.1021/ACS.ANALCHEM.6B03506
Chen L., Zhu W., Yan N., Guo Y., Yi L., Ouyang Y., Zhang Z. Analysis of heparinase derived LMWH products using a MHC 2D LC system linked to Q-TOF MS // J. Pharm. Biomed. Anal. 2022. V. 212. Article 114616. https://doi.org/10.1016/J.JPBA.2022.114616
Chen L., Ouyang Y., Yan N., Guo Y., Yi L., Sun Y., Liu D., Zhang Z. Comprehensive analysis of heparinase derived heparin-products using two-dimensional liquid chromatography coupled with mass spectrometry // J. Chromatogr. A. 2021. V. 1643. Article 462049. https://doi.org/10.1016/J.CHROMA.2021.462049
Ruiz-Matute A.I., Brokl M., Soria A.C., Sanz M.L., Martínez-Castro I. Gas chromatographic–mass spectrometric characterisation of tri- and tetrasaccharides in honey // Food Chem. 2010. V. 120. № 2. P. 637. https://doi.org/10.1016/J.FOODCHEM.2009.10.050
Ruiz-Matute A.I., Hernández-Hernández O., Rodríguez-Sánchez S., Sanz M.L., Martínez-Castro I. Derivatization of carbohydrates for GC and GC-MS analyses // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2011. V. 879. № 17–18. P. 1226. https://doi.org/10.1016/J.JCHROMB.2010.11.013
Wang H., Geppert H., Fischer T., Wieprecht W., Möller D. Determination of sucrose in honey with derivatization/solid-phase microextraction and gas-chromatography/mass spectrometry // J. Chromatogr. Sci. 2015. V. 53. № 9. P. 1427. https://doi.org/10.1093/chromsci/bmv044
Morvai-Vitányi M., Molnár-Perl I., Knausz D., Sass P. Simultaneous GC derivatization and quantification of acids and sugars // Chromatographia. 1993. V. 36. № 1. P. 204. https://doi.org/10.1007/BF02263864
Xia Y.G., Sun H.M., Wang T.L., Liang J., Yang B.Y., Kuang H.X. A modified GC-MS analytical procedure for separation and detection of multiple classes of carbohydrates // Molecules. 2018. V. 23. № 6. P. 1284. https://doi.org/10.3390/MOLECULES23061284
Silva F.O. Microwave-assisted derivatization of glucose and galactose for gas chromatographic determination in human plasma // Clin. Chem. 2006. V. 52. № 2. P. 334. https://doi.org/10.1373/CLINCHEM.2005.062109
Li Z., Wang J., Huang C., Zhang S., Yang J., Jiang A., Zhou R., Pan D. Gas chromatography/time-of-flight mass spectrometry-based metabonomics of hepatocarcinoma in rats with lung metastasis: Elucidation of the metabolic characteristics of hepatocarcinoma at formation and metastasis // Rapid Commun. Mass Spectrom. 2010. V. 24. № 18. P. 2765. https://doi.org/10.1002/RCM.4703
Rojas-Escudero E., Alarcón-Jiménez A.L., Elizalde-Galván P., Rojo-Callejas F. Optimization of carbohydrate silylation for gas chromatography // J. Chromatogr. A. 2004. V. 1027. P. 117. https://doi.org/10.1016/j.chroma.2003.10.131
Zarate E., Boyle V., Rupprecht U., Green S., Villas-Boas S.G., Baker P., Pinu F.R. Fully automated trimethylsilyl (TMS) derivatisation protocol for metabolite profiling by GC-MS // Metabolites. 2017. V. 7. № 1. P. 1. https://doi.org/10.3390/METABO7010001
Becker M., Liebner F., Rosenau T., Potthast A. Ethoximation-silylation approach for mono- and disaccharide analysis and characterization of their identification parameters by GC/MS // Talanta. 2013. V. 115. P. 642. https://doi.org/10.1016/j.talanta.2013.05.052
Xia Y.G., Sun H.M., Wang T.L., Liang J., Yang B.Y., Kuang H.X. A modified GC-MS analytical procedure for separation and detection of multiple classes of carbohydrates // Mol. A J. Synth. Chem. Nat. Prod. Chem. 2018. V. 23. № 6. P. 1284. https://doi.org/10.3390/MOLECULES23061284
Weber P.L., Lunte S.M. Capillary electrophoresis with pulsed amperometric detection of carbohydrates and glycopeptides // Electrophoresis. 1996. V. 17. № 2. P. 302. https://doi.org/10.1002/elps.1150170204
Carvalho A., da Silva F.J.A., do Lago C.L. Determination of mono- and disaccharides by capillary electrophoresis with contactless conductivity detection // Electrophoresis. 2003. V. 24. № 12–13. P. 2138. https://doi.org/10.1002/elps.200305408
Klampfl C.W., Buchberger W. Determination of carbohydrates by capillary electrophoresis with electrospray-mass spectrometric detection // Electrophoresis. 2001. V. 22. № 13. P. 2737. https://doi.org/10.1002/15222683(200108)22:13<2737::AID- ELPS2737>3.0.CO;2-Z
Schmid T., Himmelsbach M., Oliver J.D., Gaborieau M., Castignolles P., Buchberger W. Investigation of photochemical reactions of saccharides during direct ultraviolet absorbance detection in capillary electrophoresis // J. Chromatogr. A. 2015. V. 1388. P. 259. https://doi.org/10.1016/J.CHROMA.2015.02.030
Schmid T., Himmelsbach M., Buchberger W. Investigation of photochemical reaction products of glucose formed during direct UV detection in CE // Electrophoresis. 2016. V. 37. № 7–8. P. 947. https://doi.org/10.1002/elps.201500283
Sarazin C., Delaunay N., Costanza C.V. Eudes, Mallet J.M., Gareil P. New avenue for mid-UV-range detection of underivatized carbohydrates and amino acids in capillary electrophoresis // Anal. Chem. 2011. V. 83. № 19. P. 7381. https://doi.org/10.1021/ac2012834
Rovio S., Yli-Kauhaluoma J., Sirén H. Determination of neutral carbohydrates by CZE with direct UV detection // Electrophoresis. 2007. V. 28. № 17. P. 3129. https://doi.org/10.1002/elps.200600783
Rovio S., Simolin H., Koljonen K., Sirén H. Determination of monosaccharide composition in plant fiber materials by capillary zone electrophoresis // J. Chromatogr. A. 2008. V. 1185. № 1. P. 139. https://doi.org/10.1016/J.CHROMA.2008.01.031
Alinat E., Jemmali S., Delaunay N., Archer X., Gareil P. Analysis of underivatized cellodextrin oligosaccharides by capillary electrophoresis with direct photochemically induced UV-detection // Electrophoresis. 2015. V. 36. № 14. P. 1555. https://doi.org/10.1002/elps.201400605
Kaijanen L., Metsämuuronen S., Reinikainen S.P., Pietarinen S., Jernström E. Profiling of water-soluble carbohydrates in pine and spruce extracts by capillary zone electrophoresis with direct UV detection // Wood Sci. Technol. 2015. V. 49. № 4. P. 795. https://doi.org/10.1007/s00226-015-0729-5
Zhao L., Chanon A.M., Chattopadhyay N., Dami I.E., Blakeslee J.J. Quantification of carbohydrates in grape tissues using capillary zone electrophoresis // Front. Plant. Sci. 2016. V. 7. P. 818. https://doi.org/10.3389/fpls.2016.00818
Lagane B., Treilhou M., Couderc F. Capillary electrophoresis: Theory, teaching approach and separation of oligosaccharides using indirect UV detection // Biochem. Mol. Biol. Educ. 2000. V. 28. № 5. P. 251. https://doi.org/10.1016/S1470-8175(00)00031-X
Xu X., Kok W.T., Poppe H. Sensitive determination of sugars by capillary zone electrophoresis with indirect UV detection under highly alkaline conditions // J. Chromatogr. A. 1995. V. 716. № 1–2. P. 231. https://doi.org/10.1016/0021-9673(95)00552-X
Zemann A., Nguyen D.T., Bonn G. Fast separation of underivatized carbohydrates by coelectroosmotic capillary electrophoresis // Electrophoresis. 1997. V. 18. № 7. P. 1142. https://doi.org/10.1002/ELPS.1150180720
Zemann A.J. Sub-minute separations of organic and inorganic anions with co-electroosmotic capillary electrophoresis // J. Chromatogr. A. 1997. V. 787. № 1–2. P. 243. https://doi.org/10.1016/S0021-9673(97)00645-6
Lee Y.H., Lin T.I., Luh T.Y. Determination of carbohydrates by high-performance capillary electrophoresis with indirect absorbance detection // J. Chromatogr. B: Biomed. Sci. Appl. 1996. V. 681. № 1. P. 87. https://doi.org/10.1016/0378-4347(95)00503-X
Ramírez S.C., Carretero A.S., Blanco C.C., de Castro M.H.B., Gutiérrez A.F. Indirect determination of carbohydrates in wort samples and dietetic products by capillary electrophoresis // J. Sci. Food Agric. 2005. V. 85. № 3. P. 517. https://doi.org/10.1002/JSFA.2010
Warren C.R., Adams M.A. Capillary electrophoresis for the determination of major amino acids and sugars in foliage: Application to the nitrogen nutrition of sclerophyllous species // J. Exp. Bot. 2000. V. 51. № 347. P. 1147. https://doi.org/10.1093/JEXBOT/51.347.1147
Stroka J., Dossi N., Anklam E. Determination of the artificial sweetener Sucralose® by capillary electrophoresis // Food Addit. Contam. 2003. V. 20. № 6. P. 524. https://doi.org/10.1080/0265203031000070803
Soga T., Heiger D.N. Simultaneous determination of monosaccharides in glycoproteins by capillary electrophoresis // Anal. Biochem. 1998. V. 261. № 1. P. 73. https://doi.org/10.1006/abio.1998.2727
Soga T., Serwe M. Determination of carbohydrates in food samples by capillary electrophoresis with indirect UV detection // Food Chem. 2000. V. 69. № 3. P. 339. https://doi.org/10.1016/S0308-8146(00)00044-3
Soga T., Ross G.A. Simultaneous determination of inorganic anions, organic acids, amino acids and carbohydrates by capillary electrophoresis // J. Chromatogr. A. 1999. V. 837. № 1–2. P. 231. https://doi.org/10.1016/S0021-9673(99)00092-8
Lu B., Westerlund D. Indirect UV detection of carbohydrates in capillary zone electrophoresis by using tryptophan as a marker // Electrophoresis. 1996. V. 17. № 2. P. 325. https://doi.org/10.1002/ELPS.1150170207
Алексеева А.В., Карцова Л.А., Казачищева Н.В. Определение сахаров методом лигандообменного капиллярного электрофореза // Журн. аналит. химии. 2010. Т. 65. № 2. P. 205. (Alekseeva A.V., Kartsova L.A., Kazachishcheva N.V. Determination of sugars using ligand-exchange capillary electrophoresis // J. Anal. Chem. 2010. V. 65. № 2. P. 202.)https://doi.org/10.1134/S1061934810020176
Gürel A., Hızal J., Öztekin N., Erim F.B. CE determination of carbohydrates using a dipeptide as separation electrolyte // Chromatographia. 2006. V. 64. № 5–6. P. 321. https://doi.org/10.1365/s10337-006-0032-6
Vaher M., Koel M., Kazarjan J., Kaljurand M. Capillary electrophoretic analysis of neutral carbohydrates using ionic liquids as background electrolytes // Electrophoresis. 2011. V. 32. № 9. P. 1068. https://doi.org/10.1002/elps.201000575
Hoffstetter-Kuhn S., Paulus A., Gassmann E., Widmer M.H. Influence of borate complexation on the electrophoretic behavior of carbohydrates in capillary electrophoresis // Anal. Chem. 1991. V. 63. № 15. P. 1541. https://doi.org/10.1021/AC00015A009/ASSET/AC00015A009.FP.PNG_V03
Schmitt-Kopplin P., Fischer K., Freitag D., Kettrupgsf A. Capillary electrophoresis for the simultaneous separation of selected carboxylated carbohydrates and their related 1,4-lactones // J. Chromatogr. A. 1998. V. 807. № 1. P. 89. https://doi.org/10.1016/S0021-9673(98)00056-9
Angyal S.J. Complexing of carbohydrates with copper ions: A reappraisal // Carbohydr. Res. 1990. V. 200. P. 181. https://doi.org/10.1016/0008-6215(90)84189-2
Алексеева А.В., Карцова Л.А. Возможности лигандообменного капиллярного электрофореза при определении биологически активных веществ // Журн. аналит. химии. 2011. Т. 66. № 7. P. 764. (Alekseeva A.V., Kartsova L.A. Potencies of ligand-exchange capillary electrophoresis in the determination of biologically active compounds // J. Anal. Chem. 2011. V. 66. № 7. P. 651.)https://doi.org/10.1134/S1061934811070021
Bazzanella A., Bachmann K. Separation and direct UV detection of sugars by capillary electrophoresis using chelation of copper(II) // J. Chromatogr. A. 1998. V. 799. № 1–2. P. 283. https://doi.org/10.1016/S0021-9673(97)01039-X
Алексеева А.В., Карцова Л.А. Лигандообменный капиллярный электрофорез // Журн. аналит. химии. 2011. Т. 66. № 7. P. 677. (Kartsova L.A., Alekseeva A.V. Ligand-exchange capillary electrophoresis // J. Anal. Chem. 2011. V. 66. № 7. P. 563.)https://doi.org/10.1134/S1061934811050066
Čokrtová K., Mareš V., Křížek T. On-capillary fluorescent labeling of saccharides for capillary electrophoresis // Electrophoresis. 2022. https://doi.org/10.1002/elps.202200136
Wang X.Y., Chen Y., Li Z., Wang Z. Analysis of carbohydrates by capillary zone electrophoresis with on-capillary derivatization // J. Liq. Chromatogr. Relat. Technol. 2002. V. 25. № 4. P. 589. https://doi.org/10.1081/JLC-120008813
Taga A., Suzuki S., Honda S. Capillary electrophoretic analysis of carbohydrates derivatized by in-capillary condensation with 1-phenyl-3-methyl-5-pyrazolone // J. Chromatogr. A. 2001. V. 911. № 2. P. 259. https://doi.org/10.1016/S0021-9673(01)00516-7
Wang X.Y., Chen Y., Li Z., Wang Z. Analysis of carbohydrates by capillary zone electrophoresis with on-capillary derivatization // J. Liquid Chromatogr. Relat. Technol. 2002. V. 25. I. 4. P. 589. https://doi.org/10.1081/JLC-120008813
Maeda E., Kataoka M., Hino M., Kajimoto K., Kaji N., Tokeshi M., Kido J., Shinohara Y., Baba Y. Determination of human blood glucose levels using microchip electrophoresis // Electrophoresis. 2007. V. 28. P. 2927. https://doi.org/10.1002/elps.200600795
Rovio S., Yli-Kauhaluoma J., Sirén H. Determination of neutral carbohydrates by CZE with direct UV detection // Electrophoresis. 2007. V. 28. № 17. P. 3129. https://doi.org/10.1002/elps.200600783
Schwaiger H., Oefner P.J., Huber C., Grill E., Bonn G.K. Capillary zone electrophoresis and micellar electrokinetic chromatography of 4-aminobenzonitrile carbohydrate derivatives // Electrophoresis. 1994. V. 15. № 7. P. 941. https://doi.org/10.1002/ELPS.11501501138
Andersen K.E., Bjergegaard C., Sørensen H. Analysis of reducing carbohydrates by reductive tryptamine derivatization prior to micellar electrokinetic capillary chromatography // J. Agric. Food Chem. 2003. V. 51. № 25. P. 7234. https://doi.org/10.1021/jf030329e
Jager A.V., Tonin F.G., Tavares M.F.M. Comparative evaluation of extraction procedures and method validation for determination of carbohydrates in cereals and dairy products by capillary electrophoresis // J. Sep. Sci. 2007. V. 30. P. 586. https://doi.org/10.1002/jssc.200600370
Soria A.C., Brokl M., Sanz M.L., Martínez-Castro I. Sample preparation for the determination of carbohydrates in food and beverages / Comprehensive Sampling and Sample Preparation. V. 4 / Ed. Pawliszyn J. Amsterdam: Elsevier, 2012. P. 213. https://doi.org/10.1016/B978-0-12-381373-2.10135-8
Sanz M.L., Martínez-Castro I. Recent developments in sample preparation for chromatographic analysis of carbohydrates // J. Chromatogr. A. 2007. V. 1153. № 1–2. P. 74. https://doi.org/10.1016/J.CHROMA.2007.01.028
Бирюлин С.И., Посокина Н.Е., Тришканева М.В. Выделение углеводов из растительного сырья и их идентификация с применением капиллярного электрофореза // Овощи России. 2019. Т. 5. С. 84. https://doi.org/10.18619/2072-9146-2019-5-84-87
Norikoshi R., Imanishi H., Ichimura K. A simple and rapid extraction method of carbohydrates from petals or sepals of four floricultural plants for determination of their content // J. Japan. Soc. Hort. Sci. 2008. V. 77. № 3. P. 289.
Wanek W., Heintel S., Richter A. Preparation of starch and other carbon fractions from higher plant leaves for stable carbon isotope analysis // Rapid Commun. Mass Spectrom. 2001. V. 15. № 14. P. 1136. https://doi.org/10.1002/RCM.353
Hassan E.S.R.E., Mutelet F., Moïse J.C. From the dissolution to the extraction of carbohydrates using ionic liquids // RSC Adv. 2013. V. 3. № 43. P. 20219. https://doi.org/10.1039/C3RA42640H
Fishman M.L., Chau H.K. Cooke P.H., Yadav M.P., Hotchkiss A.T. Physico-chemical characterization of alkaline soluble polysaccharides from sugar beet pulp // Food Hydrocoll. 2009. V. 23. № 6. P. 1554. https://doi.org/10.1016/J.FOODHYD.2008.10.015
Montañés F., Fornari T., Stateva R.P., Olano A., Ibáñez E. Solubility of carbohydrates in supercritical carbon dioxide with (ethanol + water) cosolvent // J. Supercrit. Fluids. 2009. V. 49. № 1. P. 16. https://doi.org/10.1016/J.SUPFLU.2008.11.014
Montañés F., Olano A., Reglero G., Ibáñez E., Fornari T. Supercritical technology as an alternative to fractionate prebiotic galactooligosaccharides // Sep. Purif. Technol. 2009. V. 66. № 2. P. 383. https://doi.org/10.1016/J.SEPPUR.2008.12.006
Guan J., Yang F.Q., Li S.P. Evaluation of carbohydrates in natural and cultured Cordyceps by pressurized liquid extraction and gas chromatography coupled with mass spectrometry // Molecules. 2010. V. 15. № 6. P. 4227. https://doi.org/10.3390/molecules15064227
Cai K., Hu D., Lei B., Zhao H., Pan W., Song B. Determination of carbohydrates in tobacco by pressurized liquid extraction combined with a novel ultrasound-assisted dispersive liquid-liquid microextraction method // Anal. Chim. Acta. 2015. V. 882. P. 90. https://doi.org/10.1016/J.ACA.2015.03.013
Ruiz-Matute A.I., Ramos L., Martínez-Castro I., Sanz M.L. Fractionation of honey carbohydrates using pressurized liquid extraction with activated charcoal // J. Agric. Food Chem. 2008. V. 56. № 18. P. 8309. https://doi.org/10.1021/JF8014552
Al-Suod H., Ratiu I.A., Górecki R., Buszewski B. Pressurized liquid extraction of cyclitols and sugars: Optimization of extraction parameters and selective separation // J. Sep. Sci. 2019. V. 42. № 6. P. 1265. https://doi.org/10.1002/JSSC.201801269
de Villiers A., Lynen F., Crouch A., Sandra P. Development of a solid-phase extraction procedure for the simultaneous determination of polyphenols, organic acids and sugars in wine // Chromatographia. 2004. V. 59. № 7–8. P. 403. https://doi.org/10.1365/S10337-004-0204-1
Megherbi M., Herbreteau B., Faure R., Dessalces G., Grenier-Loustalot M.F. Solid phase extraction of oligo- and polysaccharides; Application to maltodextrins and honey qualitative analysis // J. Liq. Chromatogr. Relat. Technol. 2008. V. 31. № 7. P. 1033. https://doi.org/10.1080/10826070801924915
Barnes J., Tian L., Loftis J., Hiznay J., Comhair S., Lauer M., Dweik R. Isolation and analysis of sugar nucleotides using solid phase extraction and fluorophore assisted carbohydrate electrophoresis // MethodsX. 2016. V. 3. P. 251. https://doi.org/10.1016/J.MEX.2016.03.010
Morales-Cid G., Simonet B.M., Cárdenas S., Valcárcel M. On-capillary sample clean up method for the electrophoretic determination of carbohydrates in juice samples // Electrophoresis. 2007. V. 28. P. 1557. https://doi.org/10.1002/elps.200600518
Hernández O., Ruiz-Matute A.I., Olano A., Moreno F.J., Sanz M.L. Comparison of fractionation techniques to obtain prebiotic galactooligosaccharides // Int. Dairy J. 2009. V. 19. № 9. P. 531. https://doi.org/10.1016/J.IDAIRYJ.2009.03.002
Ruiz-Matute A.I., Soria A.C., Martínez-Castro I., Sanz M.L. A new methodology based on GC-MS to detect honey adulteration with commercial syrups // J. Agric. Food Chem. 2007. V. 55. № 18. P. 7264. https://doi.org/10.1021/JF070559J
Amelung W., Cheshire M.V., Guggenberger G. Determination of neutral and acidic sugars in soil by capillary gas-liquid chromatography after trifluoroacetic acid hydrolysis // Soil Biol. Biochem. 1996. V. 28. № 12. P. 1631. https://doi.org/10.1016/S0038-0717(96)00248-9
Santos S.M., Duarte A.C., Esteves V.I. Development and application of capillary electrophoresis based method for the assessment of monosaccharide in soil using acid hydrolysis // Talanta. 2007. V. 72. P. 165. https://doi.org/10.1016/j.talanta.2006.10.009
Xiao W., Chen X., Zhang Y., Qu T., Han L. Product analysis for microwave-assisted methanolysis of lignocellulose // Energy and Fuels. 2016. V. 30. № 10. P. 8246. https://doi.org/10.1021/ACS.ENERGYFUELS.6B01186
Arnous A., Meyer A.S. Quantitative prediction of cell wall polysaccharide composition in grape (Vitis vinifera L.) and apple (Malus domestica) skins from acid hydrolysis monosaccharide profiles // J. Agric. Food Chem. 2009. V. 57. № 9. P. 3611. https://doi.org/10.1021/JF900780R
Olennikov D.N., Rokhin A.V., Tankhaeva L.M. Lamiaceae carbohydrates. V. Structure of glucoarabinogalactan from Scutellaria baicalensis // Chem. Nat. Compd. 2008. V. 44. № 5. P. 560. https://doi.org/10.1007/S10600-008-9148-2
Harvey D.J. Derivatization of carbohydrates for analysis by chromatography; electrophoresis and mass spectrometry // J. Chromatogr. B. 2011. V. 879. P. 1196. https://doi.org/10.1016/j.jchromb.2010.11.010
Yu R.B., Dalman N.A.V., Wuethrich A., Quirino J.P. Derivatization of carbohydrates for analysis by liquid chromatography and capillary electrophoresis / Carbohydrate Analysis by Modern Liquid Phase Separation Techniques / Ed. El Rassi Z. Amsterdam: Elsevier, 2021. P. 1. https://doi.org/10.1016/B978-0-12-821447-3.00019-6
Campa C., Rossi M. Capillary electrophoresis of neutral carbohydrates mono-, oligosaccharides, and glycosides / Capillary Electrophoresis / Ed. Schmitt-Kopplin P. Groningen: Springer, 2008. P. 247. https://doi.org/10.1007/978-1-59745-376-9_11
Dupont A.L., Egasse C., Morin A., Vasseur F. Comprehensive characterisation of cellulose- and lignocellulose-degradation products in aged papers: Capillary zone electrophoresis of low-molar mass organic acids, carbohydrates, and aromatic lignin derivatives // Carbohydr. Polym. 2007. V. 68. № 1. P. 1. https://doi.org/10.1016/j.carbpol.2006.07.005
Sjöberg J., Adorjan I., Rosenau T., Kosma P. An optimized CZE method for analysis of mono- and oligomeric aldose mixtures // Carbohydr. Res. 2004. V. 339. № 11. P. 2037. https://doi.org/10.1016/j.carres.2004.06.003
Sato K., Sato K., Okubo A., Yamazaki S. Optimization of derivatization with 2- aminobenzoic acid for determination of monosaccharide composition by capillary electrophoresis // Anal. Biochem. 1998. V. 262. № 2. P. 195. https://doi.org/10.1006/abio.1998.2798
Windwarder M., Figl R., Svehla E., Moscai R., Farcet J.-B., Staudacher E., Kosma P., Altmann F. ‘Hypermethylation’ of anthranilic acid-labeled sugars confers the selectivity required for liquid chromatography-mass spectrometry // Anal. Biochem. 2016. V. 514. P. 24. https://doi.org/10.1016/j.ab.2016.09.008
Lorenz D., Janzon R., Saake B. Determination of uronic acids and neutral carbohydrates in pulp and biomass by hydrolysis, reductive amination and HPAEC-UV // Holzforschung. 2017. V. 71. № 10. P. 767. https://doi.org/10.1515/hf-2017-0020
Vojvodić-Cebin A., Komes D., Ralet M.C. Development and validation of HPLC-DAD method with pre-column PMP derivatization for monomeric profile analysis of polysaccharides from agro-industrial wastes // Polymers. 2022. V. 14. № 3. P. 544. https://doi.org/10.3390/polym14030544
Lattová E., Perreault H. Method for investigation of oligosaccharides using phenylhydrazine derivatization / Glycomics / Eds. Packer N.H., Karlsson N.G. Groningen: Springer, 2009. P. 65. https://doi.org/10.1007/978-1-59745-022-5_5
Nguyen D.T., Lerch H., Zemann A., Bonn G. Separation of derivatized carbohydrates by co-electroosmotic capillary electrophoresis // Chromatographia. 1997. V. 46. № 3. P. 113. https://doi.org/10.1007/BF02495320
Kwon H., Kim J. High performance liquid chromatography of mono- and oligosaccharides derivatized with p-aminobenzoic ethyl ester on a c18-bonded silica column // J. Liq. Chromatogr. 1995. V. 18. № 7. P. 1437. https://doi.org/10.1080/10826079508010422
Blanco D., Muro D., Gutiérrez. M.D. A comparison of pulsed amperometric detection and spectrophotometric detection of carbohydrates in cider brandy by liquid chromatography // Anal. Chim. Acta. 2004. V. 517. № 1–2. P. 65. https://doi.org/10.1016/j.aca.2004.04.056
Evangelista R.A., Liu M.S., Chen F.T.A. Characterization of 9-aminopyrene-1,4,6-trisulfonate derivatized sugars by capillary electrophoresis with laser-induced fluorescence detection // Anal. Chem. 1995. V. 67. № 13. P. 2239. https://doi.org/10.1021/ac00109a051
Albrecht S., Schols H.A., van den Heuvel E.G.H.M., Voragen A.G.J., Gruppen H. CE-LIF-MSn profiling of oligosaccharides in human milk and feces of breast-fed babies // Electrophoresis. 2010. V. 31. № 7. P. 1264. https://doi.org/10.1002/elps.200900646
Chen F.T.A., Dobashi T.S., Evangelista R.A. Quantitative analysis of sugar constituents of glycoproteins by capillary electrophoresis // Glycobiology. 1998. V. 8. № 11. P. 1045. https://doi.org/10.1093/GLYCOB/8.11.1045
Chiesa C., Horváth C. Capillary zone electrophoresis of malto-oligosaccharides derivatized with 8-aminonaphthalene-1,3,6-trisulfonic acid // J. Chromatogr. A. 1993. V. 645. № 2. P. 337. https://doi.org/10.1016/0021-9673(93)83394-8
Larsson M., Sundberg R., Folestad S. On-line capillary electrophoresis with mass spectrometry detection for the analysis of carbohydrates after derivatization with 8-aminonaphthalene-1,3,6-trisulfonic acid // J. Chromatogr. A. 2001. V. 934. № 1–2. P. 75. https://doi.org/10.1016/S0021-9673(01)01274-2
Sato K., Sato K., Okubo A., Yamazaki S. Determination of monosaccharides derivatized with 2-aminobenzoic acid by capillary electrophoresis // Anal. Biochem. 1997. V. 251. № 1. P. 119. https://doi.org/10.1006/ABIO.1997.2266
Saddic G.N., Dhume S.T., Anumula K.R. Carbohydrate composition analysis of glycoproteins by HPLC using highly fluorescent anthranilic acid (AA) tag / Po-st-translational Modifications of Proteins / Ed. Kannicht C. Groningen: Springer, 2008. P. 215. https://doi.org/10.1007/978-1-60327-084-7_15
Stepan H., Staudacher E. Optimization of monosaccharide determination using anthranilic acid and 1-phenyl-3-methyl-5-pyrazolone for gastropod analysis // Anal. Biochem. 2011. V. 418. № 1. P. 24. https://doi.org/10.1016/j.ab.2011.07.005
Wang W., Wang Y., Chen F., Zheng F. Comparison of determination of sugar-PMP derivatives by two different stationary phases and two HPLC detectors: C18 vs. amide columns and DAD vs. ELSD // J. Food Compos. Anal. 2021. V. 96. Article 103715. https://doi.org/10.1016/j.jfca.2020.103715
Fan B., Li T., Song X., Wu C., Qian C. A rapid, accurate and sensitive method for determination of monosaccharides in different varieties of Osmanthus fragrans Lour by pre-column derivatization with HPLC-MS/MS // Int. J. Biol. Macromol. 2019. V. 125. P. 221. https://doi.org/10.1016/j.ijbiomac.2018.12.033
Rajendiran V., El Rassi Z. Reversed-phase capillary electrochromatography of pre-column derivatized mono- and oligosaccharides with three different ultraviolet absorbing tags // J. Chromatogr. A. 2022. V. 1671. Article 463025. https://doi.org/10.1016/j.chroma.2022.463025
Alyuruk H., Kontas A., Altay O. A comparative study of two HPLC methods for dissolved monosaccharide analysis in seawater using 2-amino benzamide and 2-amino pyrazine as pre-column derivatization reagents // Talanta. 2021. V. 234. Article 122629. https://doi.org/10.1016/J.TALANTA.2021.122629
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии