Журнал аналитической химии, 2023, T. 78, № 3, стр. 223-230
Калибратор мониторов как альтернатива спектрофлуориметру. Определение хинина в напитках и лекарственных препаратах
М. В. Горбунова a, *, Т. А. Терентьев a, В. В. Апяри a, С. Г. Дмитриенко a, Ю. А. Золотов a, b
a Московский государственный университет имени М.В. Ломоносова, химический факультет
ГСП-1, 119991 Москва, Ленинские горы, 1, стр. 3, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
* E-mail: masha13_1992@mail.ru
Поступила в редакцию 24.06.2022
После доработки 08.09.2022
Принята к публикации 18.09.2022
- EDN: FUJWPC
- DOI: 10.31857/S0044450223030052
Аннотация
На примере хинина показана возможность использования калибратора мониторов для определения люминесцирующих соединений. Определение основано на облучении образца широкополосным излучением в видимом и ближнем УФ-диапазоне от встроенного источника, возбуждающим молекулы люминофора, и одновременной регистрации попадающего на детектор излучения. Выбраны условия измерений. Хинин можно определять в диапазоне 60–750 мкМ, предел обнаружения составляет 20 мкМ. Определению не мешают распространенные неорганические ионы, а также подсластители и регуляторы кислотности, присутствующие во многих напитках. Разработанный способ определения применим для анализа газированных напитков и лекарственных препаратов. По сравнению с традиционным спектрофлуориметром калибратор мониторов характеризуется компактностью, мобильностью, возможностью регистрации люминесценции в кюветах различных размера и формы и меньшей стоимостью.
В настоящее время одной из тенденций аналитической химии является миниатюризация анализа и его адаптация к проведению в полевых условиях. Для определения соединений все чаще находят применение разнообразные бытовые цветорегистрирующие устройства [1, 2]: фотоаппараты [3–5], сканеры [6, 7], мобильные телефоны [7–9]. В качестве своеобразных спектрометров диффузного отражения хорошо зарекомендовали себя калибраторы мониторов – устройства, которые используют для корректировки цветопередачи мониторов, принтеров и сканеров [10–13]. При этом особый интерес представляет изучение возможности использования калибраторов мониторов для определения содержания люминесцирующих веществ. Спектр испускания источников излучения, которыми оснащены калибраторы мониторов, часто захватывает ближнюю УФ-область, что достаточно для возбуждения люминесценции ряда соединений, в частности хинина. Хинин – основной алкалоид коры хинного дерева с сильным горьким вкусом, обладающий жаропонижающим и обезболивающим свойствами. Уже на протяжении почти 400 лет хинин остается важным противомалярийным препаратом. В настоящее время хинин также входит в состав обезболивающих и жаропонижающих препаратов – он усиливает действие основного компонента. Кроме того, хинин добавляют в различные напитки и продукты питания для придания им горьковатого вкуса.
Внедрение калибраторов мониторов в практику химического анализа в качестве альтернативы флуориметрам позволит значительно снизить стоимость анализа, а также облегчит проведение анализа во внелабораторных условиях.
Целью данной работы являлось изучение возможности применения калибратора мониторов для люминесцентного определения хинина.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и растворы. Использовали следующие реагенты: хинин ч. д. а., (Sigma-Aldrich), NaOH х. ч., H2SO4 х. ч., H3PO4 х. ч., K2SO4 х. ч., NaCl х. ч., NaNO3 х. ч., MgSO4 х. ч., CuSO4 ∙ · 5H2O х. ч., лимонную кислоту х. ч., сахарозу х. ч., ацетонитрил (для хроматографии).
Стандартный раствор хинина (10.2 мМ) готовили растворением его точной навески в 0.05 М серной кислоте. Рабочий раствор хинина (1.00 мМ) готовили разбавлением исходного стандартного раствора деионизованной водой.
Оборудование. Спектры люминесценции анализируемых растворов регистрировали на флуориметре Флюорат-02-Панорама (Люмэкс, Россия), а также с помощью калибратора мониторов i1 Pro2 (X-Rite, США). Значения pH определяли на pH-метре-иономере Эксперт 001 (Эконикс-эксперт, Россия). Деионизованную воду получали с использованием системы очистки Millipore Simplicity (Millipore, Германия). Хроматограммы образцов регистрировали на жидкостном хроматографе Цвет Яуза (НПО “Химавтоматика”, Россия) с амперометрическим детектором (Е = 1.2 В). Использовали хроматографическую колонку Agilent Eclipse XDB-C18. В качестве подвижной фазы применяли смесь, состоящую из ацетонитрила (25%) и 0.1%-ной ортофосфорной кислоты (75%). Объем вводимой пробы составлял 20 мкл, ввод пробы осуществляли с помощью петли дозатора, скорость потока составляла 0.4 мл/мин.
При исследовании растворов газированных напитков дегазацию осуществляли с помощью ультразвуковой бани Elmasonic S 15 H (Elma, Германия).
Техника эксперимента. Раствор, содержащий хинин и рН-определяющий компонент, помещали в специальную кювету и регистрировали спектр люминесценции с помощью флуориметра Флюорат-02-Панорама (Люмэкс, Россия) или калибратора мониторов i1 Pro2 (X-Rite, США). При измерениях с помощью калибратора в качестве кювет использовали микропробирки типа Eppendorf из черного пластика, в которые с помощью дозатора вносили по 1.8 мл анализируемых растворов. Объектив калибратора при проведении измерений изолировали от раствора с помощью скотча, пропускание скотча в исследуемой области спектра не ниже 97%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Предлагаемый в данной работе подход к определению люминесцирующих соединений основан на облучении образца широкополосным излучением в видимом и ближнем УФ-диапазоне с помощью калибратора мониторов (источник излучения типа D50) (рис. 1). При прохождении излучения ближнего УФ-диапазона через раствор в кювете с черными стенками (для предотвращения регистрации прибором собственного излучения) молекулы люминофора возбуждаются и флуоресцируют. Прибор регистрирует попадающее на детектор излучение в диапазоне 380–730 нм с шагом 10 нм и выводит данные в виде коэффициентов отражения, равных отношению интенсивности зарегистрированного излучения с данной длиной волны к интенсивности испускаемого излучения с этой же длиной волны (далее отношение I/I0 умножали на 103 и обозначали I). Таким образом, результаты измерения будут коррелировать со спектром люминесценции вещества.
Выбор условий регистрации сигнала на спектрофлуориметре. С помощью спектрофлуориметра Флюорат-02-Панорама зарегистрировали спектры возбуждения и люминесценции 0.25 мМ раствора хинина (рис. 2). В спектре возбуждения люминесценции хинина имеются максимумы при 230, 255 и 350 нм. Последняя из этих полос возбуждается с помощью источника излучения калибратора, что дает возможность использовать его для достижения поставленной цели. Для корректного сравнения результатов, полученных с помощью флуориметра и калибратора, при регистрации спектров люминесценции на флуориметре в дальнейшем задавали длину волны возбуждения 350 нм.
Выбор кюветы. Ранее показано [14], что для измерения люминесценции органических люминофоров с помощью калибратора в качестве кюветы лучше всего подходят микропробирка типа Eppendorf и тигель для микроанализа. На рис. 3 приведены спектры люминесценции хинина, зарегистрированные с помощью калибратора мониторов в кюветах двух типов. При получении спектра 1 в качестве кюветы использовали микропробирку из черного пластика, спектра 2 – тигель для микроанализа, покрытый изнутри черной матовой краской. Как видно, при использовании микропробирки достигается лучшее соотношение сигнал/шум; кроме того, важным достоинством емкостей этого типа является их коммерческая доступность и воспроизводимость характеристик. В дальнейших экспериментах в качестве кювет использовали микропробирки типа Eppendorf.
Рис. 3.
Спектры люминесценции 0.25 мМ раствора хинина, зарегистрированные с помощью калибратора мониторов при использовании в качестве кюветы микропробирки типа Eppendorf (1) и тигля для микроанализа (2).

Из сопоставления рис. 2 и 3 видно, что спектры люминесценции, полученные с помощью калибратора мониторов и флуориметра, коррелируют по форме и положению максимума, что свидетельствует о возможности использования калибратора в качестве альтернативы флуориметру для определения хинина. Максимум люминесценции при использовании обоих приборов наблюдается при 450 нм, значение интенсивности люминесценции при этой длине волны в дальнейшем использовали как аналитический сигнал.
Влияние pH. Для изучения влияния кислотности среды на интенсивность флуоресценции хинина готовили серию растворов со значениями pH от 1.3 до 11.9, которые регулировали добавлением растворов H2SO4 и NaOH. Из полученных зависимостей интенсивности люминесценции от рН раствора (рис. 4) видно, что максимальная интенсивность флуоресценции раствора хинина достигается в сильнокислой среде при pH < 3, т.е. в условиях, когда пиридиновый атом азота молекулы протонирован. При рН > 6, когда хинин полностью депротонирован, наблюдается слабая фиолетовая люминесценция, максимум которой, однако, не регистрируется калибратором (рис. 5). В дальнейших экспериментах в реакционной смеси поддерживали рН 2.0 добавлением серной кислоты.
Рис. 4.
Зависимости интенсивности люминесценции от pH раствора хинина, зарегистрированные с помощью флуориметра (а) и калибратора мониторов (б) (схинина = 0.25 мМ).

Рис. 5.
Спектры люминесценции 0.25 мМ раствора хинина при рН 2.0 (1) и 7.0 (2), зарегистрированные с помощью флуориметра.

Влияние концентрации хинина. Провели измерения серии растворов, содержащих 0–1.00 мМ хинина. На рис. 6 приведены соответствующие спектры люминесценции, зарегистрированные с помощью флуориметра и калибратора, фотографии растворов в ультрафиолетом излучении, а также зависимости интенсивности люминесценции от содержания хинина. При построении указанных зависимостей вычитали сигнал контрольного опыта.
Рис. 6.
Спектры люминесценции растворов, содержащих 0–1.00 мМ хинина, полученные с помощью флуориметра (а) и калибратора мониторов (б), фотографии этих растворов (в) и зависимости интенсивности люминесценции от содержания хинина, полученные с помощью флуориметра (г) и калибратора мониторов (д). схинина = 0, 0.05, 0.10, 0.20, 0.30, 0.50, 0.75, 1.00 мМ; 1 мл 0.1 М H2SO4; рН 2.0.
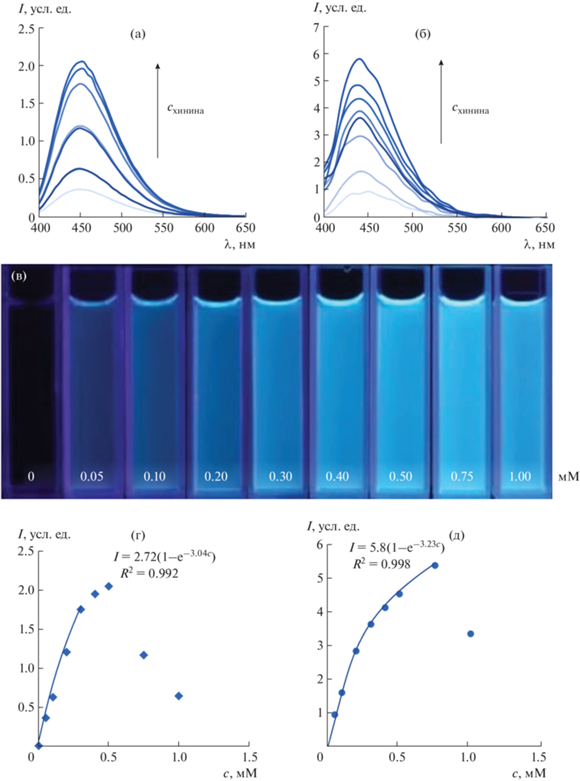
Полученные кривые монотонно возрастают на начальном участке. При использовании флуориметра уже при содержании хинина выше 0.5 мМ наблюдается заметное ослабление люминесценции, а в случае калибратора интенсивность люминесценции уменьшается только при концентрации 1 мМ. В обоих случаях уменьшение люминесценции при высоких концентрациях можно объяснить концентрационным тушением. Снижение верхней границы определяемых содержаний в случае флуориметра по сравнению с калибратором можно объяснить эффектом внутреннего фильтра: при использовании калибратора аналитический сигнал формируют молекулы, находящиеся ближе к детектору, а не в глубине раствора, ослабление первичного излучения при прохождении через слой люминофора сказывается не так сильно, как при анализе с помощью флуориметра.
Интенсивность люминесценции в зависимости от концентрации хинина, полученная с помощью флуориметра, изменяется монотонно в диапазоне 0–0.3 мМ. При определениях с использованием калибратора при увеличении содержания хинина аналитический сигнал меняется нелинейно. Это можно объяснить тем, что уменьшается эффективная длина оптического пути: до молекул, находящихся в глубине кюветы, доходит меньше первичного излучения, меньшая их доля возбуждается и люминесцирует. Зависимость аналитического сигнала от концентрации хинина можно аппроксимировать функцией вида
где параметр b учитывает изменение длины оптического пути при изменении концентрации.Флуоресцентное определение хинина. Начальные участки зависимостей интенсивности люминесценции от концентрации хинина, полученные с помощью калибратора и флуориметра, можно использовать в качестве градуировочных графиков. В табл. 1 приведены некоторые аналитические характеристики способов определения хинина с помощью калибратора и флуориметра. Предел обнаружения оценивали по 3s-критерию (n = 5). Как видно, определение с использованием калибратора характеризуется меньшей чувствительностью, однако этот способ можно применять при анализе объектов, содержащих заметные концентрации хинина (медицинские препараты, некоторые напитки). Кроме того, есть возможность использовать кюветы меньшего объема, т.е. анализировать малые количества пробы, тем самым снижая абсолютный предел обнаружения. Следует также отметить более высокую экспрессность и заметно меньшую стоимость анализа, что является несомненным достоинством калибратора по сравнению с флуориметром. Таким образом, в случаях, когда не требуется высокая чувствительность, для анализа целесообразно использовать калибратор мониторов.
Таблица 1.
Характеристики способов определения хинина с использованием калибратора мониторов и флуориметра (n = 5)
| Характеристика | Калибратор | Флуориметр |
|---|---|---|
| cmin, мкМ | 20 | 0.03 |
| Диапазон определяемых содержаний, мкМ | 60–750 | 0.09–300 |
| Объем анализируемой пробы, мл | 1.8 | 3.5 |
| Ориентировочная стоимость одной кюветы, $ | 0.15 | 200 |
| Время измерения | 1 с | 30 с |
| Требования к питанию | DC 5 В, 500 мA | AC 220 В, 50 Гц |
| Ориентировочная стоимость прибора, $ | 2 000 | 25 000 |
Влияние посторонних веществ. Изучили влияние распространенных неорганических ионов (${\text{SO}}_{4}^{{2 - }}$, Cl–, ${\text{NO}}_{3}^{ - }$, Mg2+, Na+, K+), ионов Cu2+ (как представителя тяжелых металлов, которые способны вызывать значительное тушение люминесценции), а также лимонной кислоты и сахарозы (компоненты, которые, как правило, присутствуют в напитках) на определение хинина. Установили, что в присутствии в анализируемом растворе смеси перечисленных неорганических ионов при концентрации каждого из них, не превышающей концентрацию хинина (1 : 1), значение интенсивности люминесценции, измеренное с помощью калибратора и флуориметра, лежит в пределах доверительного интервала (n = 3, P = 0.95), содержание же ионов в соотношении 10 : 1 по отношению к хинину вызывает тушение его люминесценции. В случае лимонной кислоты и сахарозы их 10-кратный избыток по отношению к хинину не влияет на результаты определения.
Анализ реальных объектов. Проанализировали лекарственный препарат “Анальгин-хинин” (Sopharma, Болгария) и газированные напитки “Schweppes Индиан Тоник” (Coca-Cola HBC, Россия) и “Tonic Indian” (ООО “ФКПЧФ БОБИМЭКС”, Россия) с помощью калибратора мониторов, флуориметра, а также методом обращенно-фазовой ВЭЖХ. Газированные напитки “Schweppes” и “Tonic” предварительно дегазировали с помощью ультразвуковой бани в течение 30 мин. Таблетку лекарственного препарата “Анальгин-хинин” растворяли в 100 мл 0.1 М серной кислоты, нерастворившиеся компоненты (тальк, диоксид титана) отфильтровывали с помощью шприцевого нейлонового фильтра (0.2 мкм). Аликвоты исследуемых растворов вводили в 0.02 М раствор серной кислоты, затем проводили определение.
Результаты определения приведены в табл. 2. Полученные данные согласуются между собой, а также с данными, полученными независимым методом, что подтверждает возможность использования калибратора мониторов i1 Pro2 для определения хинина в реальных объектах. Определить хинин в напитке “Tonic Indian” с помощью калибратора мониторов не удалось из-за его низкого содержания в данном объекте.
Таблица 2.
Результаты определения хинина в лекарственном препарате “Анальгин-хинин” и газированных напитках (n = 3, P = 0.95)
| Способ определения | Напиток “Schweppes” | Напиток “Tonic Indian” |
Таблетка “Анальгин-хинин” | |||
|---|---|---|---|---|---|---|
| схинина, мМ | sr | схинина, мкМ | sr | схинина, мг | sr | |
| С помощью калибратора мониторов | 0.11 ± 0.01 | 0.04 | <20 | – | 42 ± 4 | 0.04 |
| С помощью флуориметра | 0.125 ± 0.007 | 0.02 | 5.8 ± 0.3 | 0.02 | 44 ± 3 | 0.03 |
| Независимый метод | 0.11 ± 0.06* | 0.1 | 4 ± 2* | 0.2 | 50** | – |
* * *
Таким образом, показана возможность использования калибратора мониторов i1 Pro2 для люминесцентного определения хинина. Определение следует проводить при рН 2 с использованием в качестве кювет микропробирок типа Eppendorf из черного пластика. Предел обнаружения хинина составляет 20 мкМ. Способ применим для анализа газированных напитков и лекарственных препаратов. Недостатками калибратора мониторов по сравнению с флуориметром при определении хинина является существенно меньшая чувствительность и отсутствие возможности выбора длины волны возбуждающего излучения. Достоинства калибратора – компактность, мобильность, возможность регистрации люминесценции в кюветах различного размера и формы, более высокая экспрессность анализа и меньшая стоимость.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 18-73-10001).
Исследование выполнено в рамках Программы развития Междисциплинарной научно-образовательной школы Московского университета “Будущее планеты и глобальные изменения окружающей среды”.
Список литературы
Апяри В.В., Горбунова М.В., Исаченко А.И., Дмитриенко С.Г., Золотов Ю.А. Использование бытовых цветорегистрирующих устройств в количественном химическом анализе // Журн. аналит. химии. 2017. Т. 72. № 11. С. 963. https://doi.org/10.7868/S0044450217110019
Моногарова О.В., Осколок К.В., Апяри В.В. Цветометрия в химическом анализе // Журн. аналит. химии. 2018. Т. 73. № 11. С. 857. https://doi.org/10.1134/S0044450218110063
Lau K.T., Edwards S., Diamond D. Solid-state ammonia sensor based on Berthelot’s reaction // Sens. Actuators B: Chem. 2004. V. 98. № 1. P. 12. https://doi.org/10.1016/j.snb.2003.08.004
Lapresta-Fernández A., Capitán-Vallvey L.F. Environmental monitoring using a conventional photographic digital camera for multianalyte disposable optical sensors // Anal. Chim. Acta. 2011. V. 706. № 2. P. 328. https://doi.org/10.1016/j.aca.2011.08.042
Doeven E.H., Barbante G.J., Kerr E., Hogan C.F., Endler J.A., Francis P.S. Red–green–blue electrogenerated chemiluminescence utilizing a digital camera as detector // Anal. Chem. 2014. V. 86. № 5. P. 2727. https://doi.org/10.1021/ac404135f
Jayawardane B.M., McKelvie I.D., Kolev S.D. A paper-based device for measurement of reactive phosphate in water // Talanta. 2012. V. 100. P. 454. https://doi.org/10.1016/j.talanta.2012.08.021
Cantrell K., Erenas M.M., de Orbe-Payá I., Capitán-Vallvey L.F. Use of the hue parameter of the hue, saturation, value color space as a quantitative analytical parameter for bitonal optical sensors // Anal. Chem. 2010. V. 82. № 2. P. 531. https://doi.org/10.1021/ac901753c
Gárcia A., Erenas M.M., Marinetto E.D., Abad C.A., de Orbe-Payá I., Palma A.J., Capitán-Vallvey L.F. Mobile phone platform as portable chemical analyzer // Sens. Actuators B. 2011. V. 156. № 1. P. 350. https://doi.org/10.1016/j.snb.2011.04.045
Shahvar A., Saraji M., Shamsaei D. Smartphone-based chemiluminescence sensing for TLC imaging // Sens. Actuators B: Chem. 2018. V. 255. P. 891. https://doi.org/10.1016/j.snb.2017.08.144
Apyari V.V., Dmitrienko S.G., Zolotov Y.A. Unusual application of common digital devices: Potentialities of Eye-One Pro mini-spectrophotometer – A monitor calibrator for registration of surface plasmon resonance bands of silver and gold nanoparticles in solid matrices // Sens. Actuators B: Chem. 2013. V. 188. P. 1109. https://doi.org/10.1016/j.snb.2013.07.097
Gorbunova M.V., Apyari V.V., Zolotov I.I., Dmitrienko S.G., Garshev A.V., Volkov P.A., Bochenkov V.E. A new nanocomposite optical sensor based on polyurethane foam and gold nanorods for solid-phase spectroscopic determination of catecholamines // Gold Bull. 2019. V. 52. P. 115. https://doi.org/10.1007/s13404-019-00267-9
Зрелова Л.В., Беляева Е.И., Марченко Д.Ю., Иванова Е.А., Санджиева Д.А., Дедов А.Г. Новый эк-спресс-метод определения гидразида изоникотиновой кислоты в водных растворах с применением отражательной спектрофотометрии и цветометрии // Журн. аналит. химии. 2018. Т. 73. № 3. С. 198. https://doi.org/10.7868/S0044450218030040
Marchenko D.Y., Petrov S.I., Sandzhieva D.A., Dedov A.G. Express method of the quantitative determination of nitrites by computer colorimetry using new reagent compositions // Theor. Found. Chem. Eng. 2016. V. 50. P. 648. https://doi.org/10.1134/S0040579516040187
Gorbunova M.V., Evstigneeva P.Yu., Apyari V.V., Dmitrienko S.G. A monitor calibrator as a portable tool for determination of luminescent compounds // IEEE Trans. Instrum. Meas. 2021. V. 70. Article 6002910. https://doi.org/10.1109/TIM.2020.3041390
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии




