Журнал аналитической химии, 2023, T. 78, № 3, стр. 216-222
Анализ биологических образцов малой массы методом мс-исп с использованием кислотного микроволнового разложения нескольких образцов в общей атмосфере стандартного автоклава
В. П. Колотов a, *, Д. Н. Догадкин a, В. Е. Зайчик b, В. И. Широкова a, Н. Н. Догадкин a
a Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
b Медицинский радиологический научный центр
249031 Калужская обл., Обнинск, ул. Маршала Жукова, 10, Россия
* E-mail: kolotov@geokhi.ru
Поступила в редакцию 22.06.2022
После доработки 30.08.2022
Принята к публикации 01.09.2022
- EDN: FUIMUN
- DOI: 10.31857/S0044450223030064
Аннотация
В целях расширения арсенала средств анализа объектов биологического и растительного происхождения малой массы (10–20 мг) с использованием МС-ИСП разработана конструкция из трех компактных фторопластовых реакционных мини сосудов (вкладышей) внутренним объемом 3 мл, которые размещаются в стандартном автоклаве (EasyPrep) объемом 100 см3 микроволновой системы MARS-5 (СЕМ). Для кислотного разложения проб в реакционных мини сосудах используют не более 1.5 мл особо чистых кислот. Разложение образцов протекает в общей газовой атмосфере стандартного автоклава, наполненного расчетным количеством кислот обычной чистоты. Метод апробирован на стандартных образцах растительного и биологического происхождения. Полученные результаты соответствуют аттестованным значениям. Разработанный способ позволил снизить пределы обнаружения и получить данные по содержанию в стандартных образцах B, Ga, Y, Nb, Tl, Bi, ряда редкоземельных элементов.
В настоящее время для элементного анализа биологических образцов успешно применяются методы атомно-эмиссионной [1] и масс-спектрометрии с индуктивно связанной плазмой [2–7]. Использование данных методов анализа требует количественного переведения образца в раствор. С развитием техники микроволнового разложения кислотами этот способ перевода пробы в раствор становится все более популярным [8]. Несомненными достоинствами минерализации в микроволновой (СВЧ) печи являются полнота и интенсификация разложения образца, уменьшение количества используемых кислот и улучшение в ряде случаев метрологических характеристик анализа. Стандартный объем автоклавов для СВЧ-печей, как правило, составляет 50–120 см3, а рекомендуемое производителями минимально допустимое количество жидкости в сосуде 5–10 мл. Для большинства анализируемых образцов, таких как растения, почвы, пищевые продукты, биологические жидкости и т.д., использование стандартных автоклавов вполне оправдано. Однако такой объем сосудов не вполне подходит для разложения биологических образцов малой массы (10–50 мг) c низким содержанием микроэлементов, в частности образцов тканей человека, отобранных методом биопсии, вследствие необходимости чрезмерного разбавления получаемых растворов и, соответственно, снижения предела определения большого числа микроэлементов. Для минерализации такого рода образцов необходимы сосуды меньшего объема. В ряде работ по определению содержания микроэлементов в биологических образцах малой массы применяли автоклавы объемом 20 см3 и меньше [3, 5], однако использование подобных сосудов требует специального оборудования и сопряжено с трудностями осуществления объективного контроля условий разложения. Другим способом уменьшения реакционного объема является использование мини сосудов, размещаемых внутри стандартных автоклавов. Например, Варга с сотр. [6] для разложения биоптатов печени размещал один мини сосуд объемом 6 мл в автоклаве объемом 120 см3. В работах [2, 9] в таком же по объему автоклаве с помощью разделителя размещали 2 мини сосуда объемом 7 см3. Еще один подход был предложен Бендичо с соавт. [1, 7] для определения содержания микро- и макроэлементов в биоптатах молочной железы. Авторы использовали систему из трех стоящих друг на друге без разделителей мини сосудов объемом 6 мл, помещенных в автоклав объемом 100 см3. Такая компоновка позволила провести эффективное микроволновое разложение образцов и количественно определить ряд элементов, необходимых для исследования развития заболевания молочной железы. Несмотря на ряд достоинств, главное из которых − существенное уменьшение реакционного объема, предложенные способы размещения мини сосудов в стандартных автоклавах обладают определенными ограничениями. Мини сосуды в данном случае должны иметь геометрическую форму, обеспечивающую плотный контакт со стенками внешнего автоклава, и завинчивающиеся крышки для полной изоляции внутреннего объема. Такая конструкция не дает возможность контролировать давление внутри таких мини сосудов, которое может существенно отличаться от внешнего давления в автоклаве. Кроме того, при размещении в одном автоклаве трех мини сосудов их высота, и как следствие рабочий объем, ограничены размерами внешнего автоклава.
Цель настоящей работы заключалась в разработке конструктива сосудов-вкладышей в стандартный автоклав микроволновой системы и методического обеспечения разложения однотипных биологических образцов малой массы (10–20 мг) с использованием штатной системы контроля условий разложения (температура и давление). Решение обеспечивает повышение производительности анализа, снижение пределов обнаружения и стоимости анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Конструкция фторопластовых реакционных мини сосудов. Нами предложены и изготовлены из фторопласта мини сосуды (вкладыши) для размещения внутри стандартного автоклава EasyPrep (СЕМ). Мини сосуд представляет собой цилиндр внутренним объемом 3 см3 и внешним диаметром 1.2 см, закрываемый пробкой и далее прижимной крышкой на резьбе (рис. 1). Предусмотрено несколько вариантов конструктива пробки. Один вариант предусматривает в пробке отверстие диаметром 5 мм, в которое устанавливается фторопластовая трубка длиной около 5 см в качестве конденсатора паров кислот и своеобразного “разделителя” объема мини сосуда и автоклава EasyPrep.
Рис. 1.
Схема и фотографии вкладыша в стандартный автоклав EasyPrep, CEM. (а) − Схема вкладыша: (1) корпус вкладыша, (2) пробка с отверстием, (3) прижимная крышка с отверстием, навинчивающаяся на корпус вкладыша; (б) − фотография вкладыша с фторопластовой трубкой (4); (в) − фотография сборки трех вкладышей на платформе для размещения в автоклаве EasyPrep (CEM).
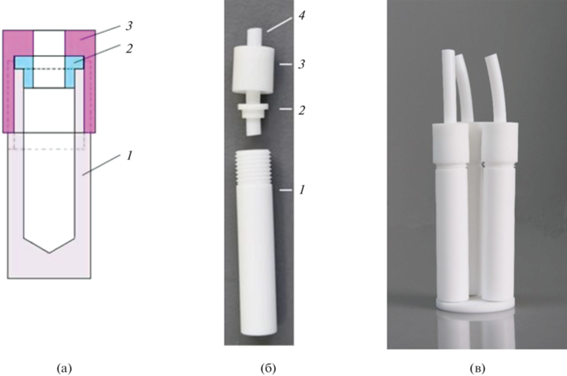
Из-за сферического дна автоклава EasyPrep для размещения вкладышей предусмотрена платформа с отверстиями, которая устанавливается на дно автоклава. Предложенная конструкция позволяет одновременно разместить на платформе в нижней части стандартного автоклава (EasyPrep) объемом 100 см3 микроволновой системы MARS-5 три мини сосуда. Благодаря платформе мини сосуды размещены на одном уровне, что обеспечивает одинаковые условия разложения. Для создания противодавления в автоклав добавляют рассчитанное количество тех же реагентов, что и в мини сосуды. Разница состоит в том, что реагенты (кислоты), добавляемые в автоклав, могут иметь более низкий уровень чистоты по сравнению с кислотами, применяемыми для разложения проб в мини сосудах.
Наличие фторопластовой трубки-конденсатора, с одной стороны, позволяет избежать потерь содержимого мини сосуда и минимизировать возможный перенос летучих компонентов между пробами. С другой стороны, за счет создания общей атмосферы выравнивается давление внутри мини сосудов и в автоклаве, что обеспечивает адекватный контроль как давления, так и температуры в мини сосудах с использованием штатных средств микроволновой системы.
Преимуществом предложенного конструктива является одинаковая интенсивность микроволнового поля для всех мини сосудов, а также возможность при необходимости варьирования высоты сосуда, и как следствие, его рабочего объема. Соответственно в три раза увеличивается производительность пробоподготовки, экономно расходуются особо чистые реагенты и минимизируется объем пробы после разложения. Последнее обеспечивает достижение более низких пределов обнаружения.
Оценка количества кислоты, добавляемой в автоклав для создания общей “несмешиваемой” атмосферы. Идея использования общей атмосферы состоит в том, что благодаря микроволновому полю нагрев кислот во вкладышах и в автоклаве идет равномерно во всем объеме, а используя правильно выбранные объемы кислот во вкладышах и автоклаве, можно избежать перетока реагентов в газовой фазе между объемами. Исходной точкой является выбор необходимого объема кислоты, достаточного для разложения пробы во вкладышах. Далее рассчитывают объем кислоты, добавляемой в автоклав для обеспечения равного давления. Данное условие выполняется при равенстве отношения занятого объема (вкладыша или автоклава) к общему объему (вкладыша или автоклава), т.е:
где $V_{a}^{'}$ – объем кислоты в автоклаве, $V_{s}^{'}$ – объем кислоты во вкладыше, n – количество вкладышей, Via – внутренний объем автоклава (при закрытой крышке), Ves – внешний объем конструкции вкладыша, Vis – внутренний объем вкладыша, Vd – объем платформы. При расчете внутреннего/внешнего объема вкладыша необходимо учитывать размеры вкладыша и трубки-конденсатора.Из уравнения (1) значение $V_{a}^{'}$ можно определить как:
Для нашего полностью собранного конструктива (вкладыши вместе с трубками) их внутренний и наружный объемы (Vis и Ves) составляют 2.92 и 10.22 см3 соответственно, n = 3, Via = 90 см3. Тогда при добавлении в каждый вкладыш 1.4 мл азотной кислоты $V_{a}^{'}$ составляет 12.5 мл. Такой объем кислоты необходимо добавлять в автоклав для создания эквивалентного противодавления.
Масс-спектрометрия. Cодержание элементов в исследуемых образцах определяли на квадрупольном масс-спектрометре с индуктивно связанной плазмой (МС-ИСП) X Series II (Thermo Scientific, США), снабженном концентрическим распылителем и кварцевой циклонной распылительной камерой, охлаждаемой элементом Пельтье (2°С). В качестве плазмообразующего газа использовали аргон высокой чистоты 99.998%. Мощность плазмы составляла 1400 Вт, скорость плазмообразующего потока аргона – 13 л/мин, скорость вспомогательного потока аргона – 1.25 л/мин, скорость распылительного потока аргона – 0.88 л/мин, глубина плазмоотбора – 105 отн. ед., скорость подачи анализируемого раствора в плазму 1 мл/мин, температура в распылительной камере – 2°C, уровень CeO+/Ce+ < < 2%, уровень Ba2+/Ba+ < 3%. Для контроля дрейфа сигнала и учета погрешности анализа в ходе обработки результатов в качестве внутреннего стандарта использовали индий, который добавляли в исследуемые растворы из расчета получения его концентрации в анализируемом растворе 10 мкг/л.
Реактивы и градуировочные растворы. Для приготовления градуировочных растворов, проведения разложения проб, разбавления растворов использовали деионизованную воду, перегнанную без кипения в системе очистки воды и кислот PTFE Subboiler ECO IR Maassen (Германия), и азотную кислоту особой чистоты (65% for analysis, max 0.005 ppm Hg) производства “Merck” (Германия). Для заполнения штатного автоклава использовали 70%-ную азотную кислоту ч.д.а. Градуировочные зависимости элементов получали с использованием стандартных растворов, изготовленных компанией “High-Purity Standards” (США): Trace Elements in Drinking Water Standard CRM-TMDW (26 элементов), 68 Element Standards ICP-MS-68A (Solution A и Solution B). Для измерения проб использовали программу спектрометра PlasmaLab, а для расчета содержаний элементов в анализируемых растворах и контроля результатов − программное обеспечение iPlasmaProQuad, разработанное в нашей лаборатории [10].
Апробация методики минерализации проб. Для апробации системы разложения проанализировали ряд стандартных образцов (СО) различной природы: образец сухого молока (IAEA-153), листья аргентинского черного чая (INCT-TL-1), листья табака сорта oriental (CTA-OTL-1) и листья виргинского табака (CTA-VTL-2).
Предварительно взвешенные стандартные образцы массой 20–30 мг помещали в мини сосуды (вкладыши). В мини сосуд добавляли 1.4 мл особо чистой азотной кислоты, закрывали пробкой, фиксировали пробку крышкой, а в общее отверстие вставляли тефлоновую трубку-конденсатор. Три сборки таких мини сосудов помещали на платформу, устанавливаемую в стандартный автоклав EasyPrep (100 см3) системы MARS-5. В автоклав добавляли 12.5 мл азотной кислоты ч.д.а. для обеспечения давления паров, равного давлению кислот в мини сосудах. Затем автоклавы с мини сосудами помещали на карусель микроволновой системы. Один из автоклавов содержал датчики температуры и давления, а также полый цилиндр из фторопласта, объем которого соответствовал объему сборки. Далее образцы нагревали до 150°С в течение 10 мин. Мощность микроволнового излучения составляла 800 Вт при частоте 2450 Гц. Эту температуру поддерживали в системе еще 25 мин, после чего сосуды охлаждали до 30°С. По окончании охлаждения содержимое мини сосудов количественно переносили в пробирки объемом 10 мл и доводили растворы до 10 мл 2%-ной HNO3. Для проведения измерений полученные растворы дополнительно разбавляли в два раза 2%-ной азотной кислотой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты анализа ряда стандартных образцов биологической природы и данные сертификатов приведены в табл. 1. Полученные результаты близки к аттестованным значениям. Разработанный способ позволил снизить пределы обнаружения и получить данные по содержанию в стандартных образцах B, Ga, Y, Nb, Tl, Bi, ряда редкоземельных элементов.
Таблица 1.
Результаты (мг/кг) анализа стандартных образцов (листья аргентинского черного чая (INCT-TL-1), листья болгарского табака Oriental (CTA-OTL-1) (), листья виргинского табака (CTA-VTL-2) и сухое молоко (IAEA-153)) методом МС-ИСП
| Элемент | INCT-TL-1 | CTA-OTL-1 | CTA-VTL-2 | IAEA-153 | ||||
|---|---|---|---|---|---|---|---|---|
| найдено (n = 5, P = 0.95) |
сертификат [12] | найдено (n = 6, P = 0.95) |
сертификат [13] | найдено (n = 5, P = 0.95) |
сертификат [14] | найдено (n = 4, P = 0.95) |
сертификат [15] | |
| Li | 0.18 ± 0.03 | – | 22.9 ± 0.3 | 23.0 ± 1.8 | 22.1 ± 0.4 | 23.0 ± 1.9 | 0.034 ± 0.005 | – |
| B | 23 ± 1 | 26 | 40.4 ± 0.3 | – | 35 ± 1 | – | 2.03 ± 0.07 | – |
| Ti | – | – | – | – | 88 ± 9 | 76.4 | <0.2 | – |
| V | 2.1 ± 0.3 | 1.97 ± 0.37 | 3.0 ± 0.6 | 3.08 ± 0.42 | 4.1 ± 0.2 | 4.00 ± 0.42 | <0.02 | – |
| Cr | 1.6 ± 0.1 | 1.91 ± 0.22 | 2.3 ± 0.2 | 2.59 ± 0.32 | 1.7 ± 0.2 | 1.87 ± 0.16 | 0.11 ± 0.05 | – |
| Mn | 1323 ± 93 | 1570 ± 110 | 372 ± 2 | 412 ± 14 | 71 ± 5 | 79.7 ± 2.6 | 0.23 ± 0.04 | 0.19 ± 0.07 |
| Co | 0.31 ± 0.03 | 0.387 ± 0.042 | 0.84 ± 0.02 | 0.879 ± 0.039 | 0.46 ± 0.05 | 0.429 ± 0.026 | 0.016 ± 0.001 | – |
| Ni | 4.7 ± 0.3 | 6.12 ± 0.52 | 5.4 ± 0.2 | 6.32 ± 0.65 | 2.5 ± 0.2 | 1.98 ± 0.30 | 0.13 ± 0.02 | – |
| Cu | 16 ± 3 | 20.4 ± 1.5 | 13 ± 1 | 14.1 ± 0.5 | 18 ± 1 | 18.2 ± 0.9 | 0.42 ± 0.03 | 0.57 ± 0.20 |
| Zn | 32 ± 2 | 34.7 ± 2.7 | 43 ± 1 | 49.9 ± 2.4 | 38 ± 1 | 43.3 ± 2.1 | 33 ± 1 | 39.560 ± 1.785 |
| Ga | 0.08 ± 0.01 | – | 0.49 ± 0.02 | – | 0.47 ± 0.03 | – | <0.01 | – |
| As | <0.2 | 0.106 ± 0.021 | 0.58 ± 0.08 | 0.539 ± 0.060 | 1.0 ± 0.1 | 0.969 ± 0.072 | <0.1 | – |
| Se | <0.2 | 0.076 | <0.2 | 0.153 ± 0.018 | 0.2 ± 0.1 | 0.188 | <0.2 | – |
| Rb | 69 ± 5 | 81.5 ± 6.5 | 9.2 ± 0.2 | 9.79 ± 1.27 | 44 ± 3 | 48.6 ± 2.3 | 14.9 ± 0.4 | 14.030 ± 1.915 |
| Sr | 18 ± 1 | 20.8 ± 1.7 | 211 ± 2 | 201 ± 20 | 118 ± 3 | 110 ± 12 | 3.8 ± 0.1 | 4.09 ± 0.62 |
| Y | 0.83 ± 0.09 | – | 0.7 ± 0.1 | – | 0.6 ± 0.3 | – | <0.01 | – |
| Nb | 0.11 ± 0.03 | – | 0.32 ± 0.07 | – | 0.37 ± 0.07 | – | <0.01 | – |
| Mo | 0.04 ± 0.02 | – | 0.28 ± 0.01 | 0.26 | 1.8 ± 0.2 | 2.01 ± 0.15 | 0.228 ± 0.004 | 0.310 ± 0.255 |
| Cd | 0.028 ± 0.006 | 0.030 ± 0.004 | 1.05 ± 0.02 | 1.12 ± 0.12 | 1.30 ± 0.06 | – | <0.01 | – |
| Sb | 0.029 ± 0.006 | 0.05 | 0.069 ± 0.006 | 0.075 | 0.28 ± 0.06 | 0.312 ± 0.025 | <0.01 | – |
| Cs | 3.2 ± 0.2 | 3.61 ± 0.37 | 0.162 ± 0.005 | 0.177 ± 0.022 | 0.47 ± 0.02 | 0.515 ± 0.046 | <0.02 | – |
| Ba | 40 ± 2 | 43.2 ± 3.9 | 87 ± 1 | 84.2 ± 11.5 | 44 ± 3 | 42.7 ± 6.6 | 0.67 ± 0.04 | – |
| La | 0.79 ± 0.09 | 1.00 ± 0.07 | 1.4 ± 0.6 | 1.44 ± 0.16 | 0.76 ± 0.06 | 1.01 ± 0.10 | <0.005 | – |
| Ce | 0.64 ± 0.07 | – | 2 ± 1 | 2.69 ± 0.3 | 1.5 ± 0.1 | 1.91 ± 0.29 | <0.005 | – |
| Pr | 0.17 ± 0.02 | – | 0.3 ± 0.1 | – | 0.16 ± 0.01 | – | <0.005 | – |
| Nd | 0.7 ± 0.07 | 0.81 | 1.0 ± 0.5 | – | 0.61 ± 0.05 | – | <0.005 | – |
| Sm | 0.15 ± 0.02 | 0.177 ± 0.022 | 0.2 ± 0.1 | 0.229 ± 0.052 | 0.12 ± 0.01 | 0.157 ± 0.022 | <0.005 | – |
| Eu | 0.046 ± 0.004 | 0.050 ± 0.009 | 0.04 ± 0.01 | 0.038 ± 0.009 | 0.035 ± 0.004 | 0.0330 ± 0.0014 | <0.005 | – |
| Gd | 0.17 ± 0.02 | – | 0.2 ± 0.1 | – | 0.12 ± 0.01 | – | <0.005 | – |
| Tb | 0.026 ± 0.002 | 0.027 ± 0.002 | 0.03 ± 0.01 | 0.032 ± 0.006 | 0.016 ± 0.002 | 0.022 ± 0.005 | <0.005 | – |
| Dy | 0.14 ± 0.01 | – | 0.14 ± 0.03 | – | 0.09 ± 0.01 | – | <0.005 | – |
| Ho | 0.030 ± 0.003 | – | 0.026 ± 0.004 | – | 0.016 ± 0.001 | – | <0.005 | – |
| Er | 0.09 ± 0.01 | – | 0.08 ± 0.01 | – | 0.049 ± 0.004 | – | <0.005 | – |
| Tm | 0.014 ± 0.001 | 0.017 | 0.009 ± 0.001 | – | 0.006 ± 0.001 | – | <0.005 | – |
| Yb | 0.10 ± 0.01 | 0.118 ± 0.013 | 0.06 ± 0.01 | 0.13 | 0.045 ± 0.005 | 0.08 | <0.005 | – |
| Lu | 0.015 ± 0.002 | 0.017 ± 0.002 | 0.008 ± 0.001 | – | 0.006 ± 0.001 | – | <0.005 | – |
| Tl | 0.060 ± 0.005 | 0.063 ± 0.005 | 0.037 ± 0.001 | – | 0.103 ± 0.003 | – | <0.005 | – |
| Pb | 1.1 ± 0.2 | 1.78 ± 0.24 | 4.4 ± 0.3 | 4.91 ± 0.8 | 22 ± 2 | 22.1 ± 1.2 | <0.05 | – |
| Bi | 0.010 ± 0.002 | – | 0.028 ± 0.002 | – | 0.04 ± 0.01 | – | <0.005 | – |
| Th | 0.03 ± 0.01 | 0.034 ± 0.005 | 0.3 ± 0.2 | 0.348 ± 0.054 | 0.30 ± 0.03 | 0.378 ± 0.031 | <0.005 | – |
| U | 0.011 ± 0.001 | – | 0.11 ± 0.03 | 0.1 | 0.134 ± 0.004 | 0.163 ± 0.008 | <0.005 | – |
При анализе проб малой массы вполне закономерно возникает вопрос о том, насколько можно уменьшить анализируемую навеску для получения воспроизводимых результатов. Понятно, что значение представительной навески обычно указано в сертификате стандартного образца, а при анализе неизвестного образца соответствующее значение вытекает из предварительных экспериментов, свойств образца и т.д. Авторами работы [11] доказано, что воспроизводимые результаты анализа различных стандартных образцов биологического происхождения (листья табака, ткани печени, плазма крови, образцы волос) методом МС-ИСП, включающим микроволновую минерализацию в автоклаве, могут быть получены и для образцов малой массы (5–10 мг). Это подтверждает применимость вкладышей малого объема для проведения производительного МС-ИСП-анализа биологических проб малой массы, например тканей, полученных пункцией. Разработанную методику предполагается применить для определения микроэлементного состава человеческих тканей на различных стадиях патологических изменений.
Список литературы
Millos J., Costas-Rodriguez M., Lavilla I., Bendicho C. Multiple small volume microwave-assisted digestions using conventional equipment for multielemental analysis of human breast biopsies by inductively coupled plasma optical emission spectrometry // Talanta. 2009. V. 77. № 4. P. 1490. https://doi.org/10.1016/j.talanta.2008.09.033
Maher W., Forster S., Krikowa F., Snitch P., Chapple G., Craig P. Measurement of trace elements and phosphorus in marine animal and plant tissues by low-volume microwave digestion and ICP-MS // At. Spectrosc. 2001. V. 22. № 5. P. 361.
Bocca B., Alimonti A., Forte G., Petrucci F., Pirola C., Senofonte O., Violante N. High-throughput microwave-digestion procedures to monitor neurotoxic elements in body fluids by means of inductively coupled plasma mass spectrometry // Anal. Bioanal. Chem. 2003. V. 377. № 1. P. 65. https://doi.org/10.1007/s00216-003-2029-4
Ionescu J.G., Novotny J., Stejskal V., Latsch A., Blaurock-Busch E., Eisenmann-Klein M. Increased levels of transition metals in breast cancer tissue // Neuroendocrinol. Lett. 2006. V. 27. № 1. P. 36. PMID: 16804515
Bocca B., Lamazza A., Pino A., De Masi E., Iacomino M., Mattei D., Rahimi S., Fiori E., Schillaci A., Alimonti A., Forte G. Determination of 30 elements in colorectal biopsies by sector field inductively coupled plasma mass spectrometry: method development and preliminary baseline levels // Rapid Commun. Mass Spectrom. 2007. V. 21. № 11. P. 1776. https://doi.org/10.1002/rcm.3016
Varga I., Szebeni A., Szoboszlai N., Kovacs B. Determination of trace elements in human liver biopsy samples by ICP-MS and TXRF: Hepatic steatosis and nickel accumulation // Anal. Bioanal. Chem. 2005. V. 383. № 3. P. 476. https://doi.org/10.1007/s00216-005-0010-0
Millos J., Costas-Rodriguez M., Lavilla I., Bendicho C. Multielemental determination in breast cancerous and non-cancerous biopsies by inductively coupled plasma-mass spectrometry following small volume microwave-assisted digestion // Anal. Chim. Acta. 2008. V. 622. № 1–2. P. 77. https://doi.org/10.1016/j.aca.2008.05.066
Nelms S.M. ICP Mass Spectrometry Handbook. Oxford: Blackwell Publishing, 2005. P. 383.
Baldwin S., Deaker M., Maher W. Low-volume microwave digestion of marine biological tissues for the measurement of trace elements // Analyst. 1994. V. 119. № 8. P. 1701. https://doi.org/10.1039/AN9941901701
Kolotov V.P., Zhilkina A.V., Khludneva A.O. iPlasmaProQuad: A computer system based on a relational DBMS for processing and monitoring the results of routine analysis by the ICP-MS method / Advances in Geochemistry, Analytical Chemistry, and Planetary Sciences: Special Publication Commemorating the 75th Anniversary of the Vernadsky Institute of Geochemistry and Analytical Chemistry of the RAS / Eds. Kolotov V.P., Bezaeva N.S. Springer, 2022.
Dombovari J., Becker J.S., Dietze H. Multielemental analysis in small amounts of environmental reference materials with inductively coupled plasma mass spectrometry // Fresenius J. Anal. Chem. 2000. V. 367. № 5. P. 407. https://doi.org/10.1007/s002160000378
http://www.speciation.net/Database/Materials/ Insti-tute-of-Nuclear-Chemistry-and-Technology-INC-TICHTJ/INCTTL1-Tea-Leaves-;i615 (29.08.2022).
http://www.speciation.net/Database/Materials/ Inst-itute-of-Nuclear-Chemistry-and-Technology-INC-TICHTJ/CTAOTL1-ORIENTAL-TOBACCO-LEAVES-;i613 (29.08.2022).
http://www.speciation.net/Database/Materials/ Ins-titute-of-Nuclear-Chemistry-and-Technology-INC-TICHTJ/CTAVTL2-VIRGINIA-TOBACCO-LEAVES-;i618 (29.08.2022).
https://nucleus.iaea.org/sites/ReferenceMaterials/Pa-ges/ IAEA-153.aspx (29.08.2022).
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


