Журнал аналитической химии, 2023, T. 78, № 3, стр. 241-252
Полислойные покрытия на основе стабилизированных цитратом наночастиц золота и полидиаллилдиметиламмоний хлорида для электрофоретического разделения карбоновых кислот
Д. В. Макеева a, *, К. С. Антипова a, Е. В. Соловьева a, В. П. Моргачева a, Е. А. Колобова a, Л. А. Карцова a
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7-9, Россия
* E-mail: dasha.dzema@gmail.com
Поступила в редакцию 12.09.2022
После доработки 30.09.2022
Принята к публикации 03.10.2022
- EDN: FUQJKK
- DOI: 10.31857/S0044450223030088
Аннотация
Предложены условия формирования физически адсорбированных трехслойных покрытий стенок кварцевого капилляра в капиллярном электрофорезе (КЭ) с последовательно нанесенными противоположно заряженными слоями модификаторов: поли(диаллилдиметиламмоний хлорида) (ПДАДМАХ) и стабилизированных цитратом наночастиц золота (НЧЗ). Показано, что трехслойные покрытия ПДАДМАХ-НЧЗ-ПДАДМАХ выгодно отличаются от монослойных с ПДАДМАХ большей стабильностью в широком диапазоне рН (2–10). Сформированные покрытия охарактеризованы сканирующей электронной микроскопией, подтверждено наличие равномерного плотного слоя наночастиц на поверхности капилляра. Возможность применения модифицированных капилляров в условиях КЭ продемонстрирована при разделении смеси 16 карбоновых кислот. Достигнутое увеличение селективности разделения с использованием трехслойных покрытий на основе НЧЗ объясняется обратимым обменом цитрат-анионов на поверхности НЧЗ с отрицательно заряженными аналитами в процессе электрофоретического анализа.
Капиллярный электрофорез (КЭ) – экспрессный метод разделения заряженных аналитов в кварцевом капилляре под действием приложенного электрического поля. Капиллярный электрофорез выгодно отличается от метода ВЭЖХ высокой эффективностью, простотой пробоподготовки и отсутствием необходимости использования дорогостоящих сорбентов и оборудования. Ограничения метода КЭ связаны с низкой концентрационной УФ-чувствительностью, недостаточной селективностью разделения и воспроизводимостью времен миграции аналитов. Однако эти проблемы могут быть решены путем использования модификаторов фонового электролита (ФЭ) и/или внутренней поверхности кварцевого капилляра [1]. Модификаторы стенок кварцевого капилляра применяют для предотвращения сорбции основных соединений на стенках капилляра, перезарядки стенок и обращения электроосмотического потока (ЭОП), что принципиально при анализе анионных соединений, проведения анализа в режиме капиллярной электрохроматографии и др. Среди используемых модификаторов наиболее перспективны наночастицы (НЧ) различной природы, применение которых обеспечивает повышение эффективности и селективности разделения заряженных соединений за счет более высокой площади удельной поверхности и большего количества активных центров для взаимодействия с аналитами [2].
Наночастицы золота (НЧЗ) нашли широкое применение в качестве модификаторов стенок кварцевого капилляра в КЭ [3–5]. При этом в подавляющем большинстве случаев используются поверхностно-модифицированные НЧЗ, где низко- и высокомолекулярные стабилизаторы предотвращают агрегацию и последующее осаждение НЧЗ в водных растворах. В качестве стабилизаторов используют ионогенные соединения: цитраты и боргидриды, поверхностно-активные вещества (ПАВ), полиэлектролиты и т.д. [6]. В одной из первых работ [7], где стабилизированные цитратом НЧЗ и модифицированные 3-меркаптопропионатом НЧЗ использовались в качестве покрытий стенок кварцевого капилляра, достигнуто увеличение эффективности и селективности разделения аминосодержащих соединений в два раза по сравнению с разделением на непокрытом капилляре. В работе [8] НЧЗ, стабилизированные дидодецилдиметиламмоний бромидом (ДДАБ), использовались в качестве динамических покрытий при электрофоретическом определении кислотных и основных белков в биологических объектах (в слюне, красных кровяных тельцах и плазме крови). Показано, что ДДАБ-модифицированные НЧЗ способствуют созданию ускоренного обращенного ЭОП по сравнению с динамическим покрытием просто на основе ДДАБ. Электростатическое отталкивание одноименно заряженных белков и ДДАБ-оболочки НЧЗ приводит к увеличению электрофоретической подвижности белков, а также росту эффективности примерно в восемь раз в случае альбумина.
Тем не менее механизм взаимодействия аналитов с поверхностно-модифицированными НЧЗ, а также роль НЧЗ на поверхности капилляра в процессе анализа мало изучены. В работе [9] для исследования взаимодействия НЧЗ с аналитами различной природы методом КЭ наночастицы с поверхностью, модифицированной 11-меркаптоундекановой кислотой, вводили в капилляр непосредственно перед вводом аналитов с последующим электрофоретическим анализом. Показано, что объем вводимой пробки НЧЗ оказал наибольшее влияние на времена миграции отрицательно заряженных аналитов. Авторы полагают, что замедление их миграции обусловлено перераспределением и обменом аналитов с 11-меркаптоундекановой кислотой на поверхности НЧЗ, что является доминирующим фактором в механизме взаимодействия разделяемых соединений и наночастиц. Таким образом, использование НЧЗ, стабилизированных отрицательно заряженными модификаторами в качестве покрытий стенок кварцевого капилляра, может быть перспективным для увеличения селективности разделения кислотных аналитов за счет специфических взаимодействий с НЧЗ и обмена лигандов на их поверхности.
Наиболее быстрым и простым в исполнении способом формирования покрытий капилляра является физическая адсорбция, когда модификация осуществляется за счет неспецифических взаимодействий (в основном электростатических) [10, 11]. Однако нередко монослойный вариант таких покрытий недостаточно стабилен, кроме того, отрицательный заряд поверхности стабилизированных цитратом НЧЗ делает формирование покрытий данным способом невозможным. Одно из решений – использование положительно заряженных полимеров в качестве связующих слоев, обеспечивающих адгезию НЧЗ на поверхности капилляра, в результате чего происходит формирование многослойных покрытий с чередованием противоположно заряженных слоев модификаторов. Высокая стабильность покрытий в данном случае достигается за счет большей плотности слоев и полного экранировании силанольных групп кварцевого капилляра.
В качестве полимера, выполняющего функции связующего слоя для стабилизированных цитратом НЧЗ, в данной работе выбрали поли(диаллилдиметиламмоний) хлорид (ПДАДМАХ), поскольку он обладает высокой молекулярной массой и не зависящим от рН положительным зарядом. Кроме того, имеются данные по условиям формирования монослойных покрытий на основе ПДАДМАХ [7], что упрощает задачу разработки полислойных покрытий. При этом использование ПДАДМАХ в качестве не только связующего, но и функционального слоя, не полностью покрывающего модифицированную НЧЗ поверхность капилляра, могло бы обеспечить наличие обращенного ЭОП, что является принципиальным фактором в случае анализа отрицательно заряженных аналитов. При формировании таких трехслойных покрытий ПДАДМАХ-НЧЗ-ПДАДМАХ наличие обращенного ЭОП значительно сокращает продолжительность анализа, а также позволяет детектировать анионы, электрофоретическая подвижность которых значительно превышает подвижность ЭОП, в то время как свободные остаточные НЧЗ за счет развитой поверхности и способности к обмену лигандов обеспечивают увеличение селективности разделения анионных аналитов.
Таким образом, данная работа посвящена поиску условий формирования трехслойных покрытий стенок кварцевого капилляра (ПДАДМАХ-НЧЗ-ПДАДМАХ) с последующим применением их для электрофоретического определения биологически активных анионогенных аналитов. В качестве модельных систем выбраны 16 короткоцепочечных жирных кислот (щавелевая, муравьиная, винная, яблочная, кетоглутаровая, лимонная, ацетоуксусная, янтарная, молочная, уксусная, β-гидроксимасляная, пропионовая, масляная, валериановая, изовалериановая, капроновая). Указанные аналиты являются важными диагностическими маркерами многих заболеваний. Так, короткоцепочечные жирные кислоты (уксусная, пропионовая и масляная) выполняют ключевую функцию при поддержании метаболизма жирных кислот и обеспечивают регуляцию кровотока в проксимальном отделе кишечника [12]. Изменение содержания этих кислот в сыворотке крови свидетельствует о нарушениях метаболизма и наличии воспалительных заболеваний кишечника (синдром раздраженного кишечника, неспецифический язвенный колит, диарея, рак). Расширение сосудов, вызванное высокими концентрациями формальдегида, может быть результатом действия метаболита – муравьиной кислоты, что является следствием развития сердечно-сосудистых заболеваний [13]. Нарушения, связанные с выработкой D-формы молочной кислоты бактериальными ферментами, могут оказывать нейротоксическое действие на живые организмы [14]. Таким образом, разработка экспрессного и одновременного определения этих аналитов является актуальной задачей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Использовали систему капиллярного электрофореза Капель-105М со спектрофотометрическим детектором (НПО “Люмэкс”, Санкт-Петербург). Источник света со спектральным диапазоном 190–380 нм, жидкостное термостатирование капилляра (+10…+50°С), ввод пробы: гидродинамический или электрокинетический. Для проведения электрофоретических экспериментов использовали кварцевые капилляры с внешним полиимидным покрытием; общая длина капилляра 60 см, эффективная – 50 см (внутренний диаметр 50 мкм). Программное обеспечение – Эльфоран (НПО “Люмэкс”, Санкт-Петербург).
Снимки внутренней поверхности кварцевых капилляров получали методом сканирующей электронной микроскопии (СЭМ) с помощью системы Zeiss Merlin. Изображения просвечивающей электронной микроскопии (ПЭМ) получали на электронном микроскопе Libra 200FE (Carl Zeiss, Германия).
Спектры поглощения растворов НЧЗ регистрировали на спектрофотометре UV-1800 (Shimadzu, Япония). Дзета-потенциал измеряли на лазерном анализаторе Zetasizer Nano ZS (Malvern Instruments Ltd., Великобритания) с лазерной линией 633 нм.
Дополнительное оборудование: лабораторный рН-метр рН 211 (Hanna Instruments, США); аналитические весы (Sartorius, Германия) (d = 0.001 мг (0.5 г)); ультразвуковая ванна Branson 1510; магнитная мешалка с нагревом IKA C-MAG HS 7; центрифуга Eppendorf 5430; деионизатор Д-301 (Аквилон, Китай).
Реагенты. Ацетат натрия х. ч., ацетон ч. д. а., карбонат натрия х. ч., концентрированная соляная кислота х. ч., цитрат натрия 5.5-водный х. ч. приобретали у ЗАО “Вектон” (Россия). Ацетонитрил х. ч., борную кислоту х. ч., дигидрофосфат натрия двуводный х. ч., диметилформамид (ДМФА) х. ч., метанол х. ч., фосфорную кислоту х. ч., а также стандарты карбоновых кислот: лимонной, уксусной, щавелевой, муравьиной, винной, яблочной, кетоглутаровой, лимонной, ацетоуксусной, янтарной, молочной, β-гидроксимасляной, пропионовой, масляной, валериановой, изовалериановой, капроновой х. ч. приобретали в ООО “АО Реахим” (Россия). Бензойную кислоту, двунатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА) ч. д. а., поли(диаллилдиметиламмоний хлорид) (20 мас. % в Н2О), тетрахлороаурат(III) водорода ос. ч. приобретали у “Sigma” (Германия).
Синтез и характеризация наночастиц золота. НЧЗ получали цитратным способом по методу Фримена [15]. В плоскодонной колбе емк. 100 мл, снабженной обратным холодильником, доводили до кипения 50 мл 0.001 М раствора тетрахлороаурата водорода при интенсивном перемешивании. В кипящий раствор быстро вливали 5 мл 38.8 М раствора цитрата натрия, после чего продолжали кипятить в течение 10 мин. Затем раствор охлаждали до комнатной температуры при слабом перемешивании.
Полученные частицы характеризовали методами ПЭМ, спектрофотометрии и динамического светорассеяния. Изображения ПЭМ в сканирующем режиме регистрировали с трех случайных областей образца. Раствор НЧ капельно наносили (10 мкл) на поверхность углеродных пленок, после чего образцы помещали в темное место для испарения растворителя на воздухе.
Спектр поглощения наночастиц регистрировали в диапазоне от 200 до 1100 нм с шагом 1 нм. Базовую линию снимали по деионизированной воде при тех же условиях. Дзета-потенциал измеряли на лазерном анализаторе Zetasizer Nano ZS с лазерной линией с длиной волны 633 нм. Для золота использовали значение показателя преломления, равное 0.27. Вязкость растворителя (воды) устанавливали равной 0.887 Па, а показатель преломления − равным 1.33. Дзета потенциал поверхности наночастиц составил −44.1 мВ.
Приготовление стандартных растворов. Стандартные растворы карбоновых кислот (2 мг/мл) готовили путем взятия точной навески массой 0.0040 г каждого стандарта на аналитических весах с последующим разбавлением с помощью автоматического микродозатора в 2 мл деионизованной воды. Приготовление рабочего раствора смеси карбоновых кислот при концентрации каждого компонента 20−100 мкг/мл осуществляли путем отбора аликвот стандартных растворов с помощью автоматических микродозаторов с последующим разбавлением деионизованной водой в пластиковых пробирках емк. 1.5 мл.
Для модификации внутренней поверхности капилляров использовали:
1. Раствор модификатора поли(диаллилдиметиламмоний хлорида) с массовой долей 0.2%. Раствор готовили в мерной колбе емк. 5 мл путем разбавления точных навесок следующих компонентов: 0.0500 г раствора ПДАДМАХ, 0.0121 г трис(гидроксиметил)аминометана, 0.0434 г NaCl в 0.5 мл 0.1 М раствора HCl. Полученный раствор доводили до метки деионизованной водой.
2. Стабилизированные цитратом наночастицы золота, синтезированные по методу Фримена [15]: диаметр 12 ± 3 нм, дзета-потенциал −44.1 мВ, концентрация 14.4 нМ. НЧЗ использовали как в виде концентрированной (14.4 нМ), так и в виде разбавленной в 2, 5, 10, 50, 100 раз деионизованной водой суспензии.
Модификация внутренней поверхности кварцевого капилляра. Апробированные условия формирования ПДАДМАХ-покрытия обобщены в табл. 1. Жирным шрифтом выделены выбранные условия, которые применяли в дальнейшем.
Таблица 1.
Подбор условий основных этапов формирования каждого слоя трехслойного покрытия ПДАДМАХ-НЧЗ-ПДАДМАХ
| Подготовка капилляра | Формирование покрытия | Стабилизация покрытия | Контроль ЭОП | Оценка стабильности покрытия |
|---|---|---|---|---|
| Первый слой − ПДАДМАХ | ||||
| Промывка
капилляра: ацетонитрил (5 мин), Н2О деиониз. (5 мин), 0.1 М HCl (10 мин), Н2О деиониз. (5 мин), 0.1 М NaOH (15, 30, 60 мин), Н2О деиониз. (10 мин) |
Капилляр промывалия раствором ПДАДМАХ 0.2 мас. % в течение 15, 30, 60 мин при 1000 мбар | 10 мМ фосфатный буферный раствор с рН 2.5, U = 10 кВ, 10 мин | 10 мМ фосфатный буферный раствор с рН 2.5, U = –20 кВ, λ = 210 нм, 20°С. Маркер ЭОП – 0.05%-ный ДМФА | Последовательное измерение µЭОП в ФЭ: 1. Фосфатный буферный раствор (рН 2−6); 2. Боратный буферный раствор (рН 8−10) |
| Второй слой − НЧЗ | ||||
| – | ПДАДМАХ-капилляр промывали суспензией НЧЗ (0.14, 0.29, 0.58, 1.44, 2.88, 14.4 нМ) в течение 10, 20, 30, 60 и 70 мин при 1000 мбар | 10 мМ цитратный буферный раствор с рН 4.6, U = –10 кВ, 10 мин | 10 мМ цитратный буферный раствор с рН 4.6 и 10 мМ ацетатный буферный раствор с рН 5.1, U = +20 кВ, λ = 210 нм, 20°С. Маркер ЭОП – 0.05%-ный ДМФА | Последовательное измерение µЭОП в ФЭ: 1. Цитратный буферный раствор (рН 2 и 4.6); 3. Боратный буферный раствор (рН 8–10) |
Условия проведения электрофоретических экспериментов. Для проведения электрофоретических экспериментов использовали следующие буферные растворы: 0.2 М ацетатный буферный раствор (рН 2.0, 3.0, 5.6), 0.3 М фосфатный буферный раствор (рН 2.0, 4.0, 6.0, 8.0), 0.3 М боратный буферный раствор (рН 8.0, 10.0), 0.1 М цитратный буферный раствор с рН 4.6. Буферные растворы готовили в мерных колбах емк. 50 мл путем растворения точной навески соответствующей соли (ацетат натрия, дигидрофосфат натрия, борная кислота, лимонная кислота) в 40 мл деионизованной воды и доведения до требуемого значения pH при помощи 0.1 М CH3COOH, 0.1 М H3PO4, 0.1 М раствора NaOH и 0.1 М HCl соответственно. Далее полученные растворы доводили до метки деионизованной водой. Для использования в качестве ФЭ при проведении электрофоретических экспериментов буферные растворы разбавляли деионизованной водой в необходимое количество раз. Все буферные растворы непосредственно перед электрофоретическими экспериментами фильтровали через бумажный фильтр и центрифугировали (7000 об/мин) в течение 3 мин.
При анализе смесей карбоновых кислот использовали ФЭ, в состав которого входили: бензойная кислота (БК), диэтаноламин (ДЭА) и ЭДТА. ФЭ готовили путем взятия аликвот необходимого объема растворов 20 мМ бензойной кислоты, 200 мМ диэтаноламина и 10 мМ ЭДТА с последующим доведением деионизованной водой до объема 4 мл в пластиковых пробирках емк. 4 мл. При оптимизации условий варьировали концентрации каждого из компонентов ФЭ: ДЭА (9.0, 10.0, 11.0 мМ); ЭДТА (0.1, 0.5, 1.0 мМ), БК (5.0, 10.0, 15.0 мМ).
Условия электрофоретического разделения карбоновых кислот: гидродинамический ввод пробы (2 с × 30 мбар), косвенное фотометрическое детектирование при λ = 254 нм, U = –20 кВ, термостатирование капилляра при 20°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для формирования стабильного трехслойного покрытия ПДАДМАХ-НЧЗ-ПДАДМАХ объединили свойства ПДАДМАХ и стабилизированных цитратом НЧЗ. Последовательно нанесенные на стенки кварцевого капилляра противоположно заряженные слои модификаторов образуют плотную структуру, обеспечивающую полную блокировку силанольных групп поверхности капилляра. При этом ожидали увеличения эффективности и селективности разделения заряженных соединений за счет высокой плотности функциональных групп полимеров и развитой поверхности наночастиц [15].
Ниже перечислены основные этапы исследования:
– Синтез и характеризация стабилизированных цитратом НЧЗ;
– Оптимизация условий формирования каждого из слоев модификаторов (первый слой – ПДАДМАХ, второй – НЧЗ, третий – ПДАДМАХ) (рис. 1а);
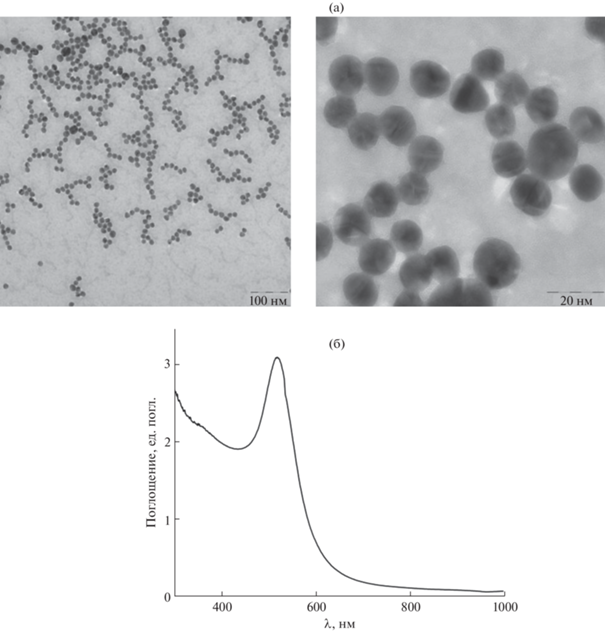
Рис. 1.
(а): ПЭМ-изображения наночастиц золота; (б): спектр поглощения раствора синтезированных наночастиц золота.
– Характеризация каждого из слоев по величине и направлению ЭОП, его стабильности и зависимости от pH фонового электролита, получение СЭМ-изображений внутренней поверхности капилляров;
– Анализ модельной смеси карбоновых кислот: оптимизация условий электрофоретического разделения, оценка влияния сформированного трехслойного покрытия на эффективность и селективность разделения аналитов.
Наночастицы золота, используемые в данной работе, синтезировали цитратным способом [15] и характеризовали методами ПЭМ и спектрофотометрии. Частота максимума поглощения синтезированных наночастиц коррелирует с их размером. Таким образом, используя УФ-спектроскопию можно оценить размер полученных НЧЗ. Спектр поглощения синтезированных НЧЗ приведен на рис. 1б. Полученные частицы имеют диаметр D = 12 ± 3 нм, что также подтверждали ПЭМ-изображениями НЧЗ (рис. 1а). Измеренный дзета-потенциал поверхности наночастиц составил –44.1 мВ. Таким образом, использование положительно заряженного ПДАДМАХ в качестве связующего слоя необходимо для обеспечения сорбции НЧЗ на поверхности капилляра.
Формирование трехслойного покрытия ПДАДМАХ-НЧЗ-ПДАДМАХ на внутренней поверхности кварцевого капилляра. Послойное нанесение модификаторов. При создании многослойных покрытий стенок капилляра на основе наночастиц золота и полимера ПДАДМАХ необходимо подобрать условия формирования каждого из слоев. Для этого варьировали время промывки капилляра раствором модификатора, концентрацию модифицирующего раствора и схему предварительной подготовки капилляра (травления). Критериями, по которым оценивали формирование каждого слоя, являлись направление и скорость ЭОП (µЭОП). Так, для первого и третьего слоев (ПДАДМАХ) ожидали обращение ЭОП, что связано с перезарядкой поверхности капилляра, в то время как для второго слоя должен наблюдаться нормальный ЭОП в силу отрицательного заряда стабилизированных цитратом НЧЗ (рис. 2а). Величина ЭОП позволяет судить о количестве заряженного модификатора, которое удалось привить к поверхности капилляра. Таким образом, условия формирования покрытия подбирали так, чтобы наблюдался максимальный ЭОП при той или иной полярности в зависимости от конкретного слоя модификатора. Получение СЭМ-изображений внутренней поверхности капилляра для каждого из слоев является независимым критерием формирования покрытия и позволяет оценить его равномерность, а также размер наночастиц на поверхности капилляра.
Рис. 2.
(а): Схематические изображения внутренней поверхности капилляров: 1 – немодифицированного, 2 – модифицированного ПДАДМАХ, 3 – модифицированного ПДАДМАХ-НЧЗ, 4 – модифицированного ПДАДМАХ-НЧЗ-ПДАДМАХ. (б): Графики зависимости µЭОП от рН фонового электролита для капилляров. Условия: маркер – 0.05%‑ный ДМФА, гидродинамический ввод пробы 2 с × 30 мбар; +20 кВ/−20 кВ, 220 нм.
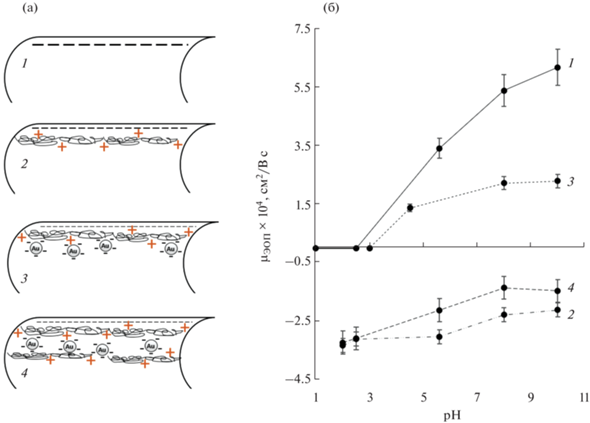
Для первого слоя ПДАДМАХ концентрацию 0.2 мас. % модифицирующего раствора выбрали на основе данных [7]. Найденное оптимальное время промывки капилляра модификатором, при котором наблюдали максимальный обращенный ЭОП (рис. 2б), составило 60 мин.
Основные этапы формирования первого слоя модификатора – поли(диаллилдиметиламмоний хлорида) − включали: травление капилляра; промывку 0.2%-ным раствором полимера в течение 60 мин; стабилизацию покрытия при 10 кВ в течение 10 мин (в 10 мМ фосфатном ФЭ с pH 2.5). Стабильность покрытия оценивали по внутрилабораторной воспроизводимости скорости ЭОП (μЭОП) на модифицированных капиллярах в 10 мМ фосфатном ФЭ (pH 2.5). Повторяемость оценивали по критерию Стьюдента с учетом выбросов по Граббсу. Полученные характеристики: sr (относительное стандартное отклонение) = 1.5%, n = 53 (от анализа к анализу) и sr = 3.8%, n = 6 (от капилляра к капилляру). Результаты указывают на высокую стабильность покрытия при работе с кислотными буферными растворами.
Для оценки стабильности сформированного слоя ПДАДМАХ при различных значениях pH получили зависимость величины ЭОП от pH фоновых электролитов (рис. 2б). В диапазоне рН 2–6 величина ЭОП практически не зависит от рН, что указывает на формирование плотного слоя ПДАДМАХ, полностью покрывающего силанольные группы поверхности капилляра. При рН ФЭ больше 6 наблюдали значительное снижение скорости миграции обращенного ЭОП. Кроме того, после проведения анализов в щелочной среде показатели µЭОП в кислой среде уменьшались. Это свидетельствует о смывании покрытия с поверхности капилляра, что согласуется с данными [7].
С учетом результатов, полученных для первого слоя, продолжили модификацию капилляра − провели перезарядку стенок за счет нанесения стабилизированных цитратом НЧЗ. При оптимизации условий формирования покрытия варьировали время промывки капилляра (10, 20, 30, 60 и 70 мин) и концентрацию наночастиц в суспензии (0.14, 0.29, 058, 1.44, 2.88 нМ). Ход модификации контролировали путем измерения скорости уменьшающегося анодного ЭОП и генерируемого в процессе модификации катодного ЭОП. При последовательной промывке капилляра суспензиями НЧЗ различной концентрации наблюдали замедление анодного ЭОП, однако обращения ЭОП данным способ добиться не удалось. Вероятно, последовательное увеличение концентрации модифицирующего раствора приводит к формированию неплотного слоя модификатора и к электростатическому отталкиванию между НЧЗ, уже адсорбировавшимися на поверхности, и вводимыми в капилляр. Перезарядки поверхности и формирования катодного ЭОП удалось достичь при промывке капилляра сразу концентрированным раствором наночастиц (14.4 нМ). При этом максимальное насыщение поверхности наночастицами и наибольший ЭОП (µЭОП = 0.8 × × 10–4 см2/В с) достигнуты при промывке капилляра неразбавленной суспензией НЧЗ в течение 1 ч.
Стабильность полученного двухслойного покрытия ПДАДМАХ-НЧЗ изучали при различных значениях рН ФЭ. На начальной стадии экспериментов обнаружили, что использование ацетатных буферных растворов приводит к постепенному замедлению катодного ЭОП (рис. 2б), что, вероятно, связано с заменой цитрат-анионов на ацетат-анионы в оболочке НЧЗ (рис. 3а). Для подтверждения этого предположения между анализами капилляр промывали цитратным буферным раствором в течение 5 мин, что обеспечило восстановление скорости ЭОП и его стабилизацию за счет восполнения слоя цитрат-анионов на поверхности НЧЗ (рис. 3б). В качестве дополнительного подтверждения данного предположения получили спектры поглощения НЧЗ в ацетатных буферных растворах с разной концентрации. Увеличение концентрации ацетата приводит к появлению дополнительного максимума в спектре поглощения НЧЗ при длине волны 616 нм. Вероятно, частичная замена цитрат-ионов на ацетат-ионы в оболочке НЧЗ приводит к снижению дзета-потенциала поверхности наночастиц, что, в свою очередь, вызывает их агломерацию и появление нового максимума в длинноволновой области спектра поглощения. В целях сохранения воспроизводимости ЭОП и состояния покрытия дальнейшие анализы в кислой среде проводили с использованием цитратных буферных растворов.
Рис. 3.
(а): Схематическое изображение замены цитрат-иона на ацетат на поверхности НЧЗ при промывке ПДАДМАХ-НЧЗ-капилляра ацетатным буферным раствором. (б): График зависимости изменения µЭОП: 1 – при проведении серии анализов в ацетатном буферном растворе, 2 – при проведении серии анализов в цитратном буферном растворе с рН 4.6.

На рис. 2 представлена зависимость µЭОП от pH ФЭ (цитратного с pH 4.5 и боратных с pH 8–10) для двухслойного покрытия. Скорость ЭОП для покрытий с внешним слоем стабилизированных цитратом НЧЗ при различных pH определяется в том числе и константами кислотности лимонной кислоты (pK1 = 3.14, pK2 = 4.77, pK3 = 6.39), и соответственно диссоциацией лимонной кислоты на поверхности НЧЗ. В кислой среде (pH 0–3) диссоциация лимонной кислоты подавлена, и, следовательно, покрытие нейтрально, ЭОП отсутствует. В диапазоне pH 8–10 все цитратные группы, покрывающие наночастицы золота, находятся в диссоциированной форме. Покрытие стабильно во всем диапазоне исследованных рН ФЭ (2–10). Однако ограничением такого двухслойного покрытия является чувствительность к природе ФЭ за счет возможности частичной или полной замены лиганда (цитрата) на поверхности НЧЗ. Это может приводить к нестабильности времен миграции аналитов или необходимости долгого промывания покрытия перед анализом для его стабилизации соответствующим ФЭ.
Финальный этап – получение трехслойного покрытия ПДАДМАХ-НЧЗ-ПДАДМАХ. Формирование функционального слоя ПДАДМАХ на поверхности ПДАДМАХ-НЧЗ-покрытия осуществляли путем промывки капилляра 0.2%-ным раствором полимера в течение 60 мин, аналогично первому слою ПДАДМАХ. На сформированном покрытии получили зависимость подвижности ЭОП от pH ФЭ: для pH 2–7 использовали фосфатные буферные растворы, а для pH 8–10 – боратные (рис. 2б). В отличие от однослойного ПДАДМАХ-покрытия, µЭОП трехслойного покрытия уменьшается с увеличением рН фонового электролита во всей изучаемой области рН. Это указывает на формирование неплотного функционального слоя ПДАДМАХ, оставляющего доступной цитратную оболочку НЧЗ, которая, в свою очередь, вносит вклад в изменение ЭОП при увеличении рН фонового электролита. Кроме того, трехслойные покрытия продемонстрировали большую стабильность по сравнению с однослойными при работе в щелочных средах: эффективность и селективность разделения аналитов, а также величина ЭОП оставались неизменными как в щелочной среде, так и при переходе обратно к кислотным буферным растворам. Это связано, в первую очередь, с многослойностью образованного покрытия, что способствует полному экранированию силанольных групп на поверхности капилляра и препятствует смыву модификаторов.
Стабильность двухслойного и трехслойного покрытий также оценивали по внутрилабораторной воспроизводимости μЭОП на модифицированных капиллярах в 10 мМ фосфатном ФЭ (pH 2.5) от анализа к анализу и от капилляра к капилляру. Для ПДАДМАХ-НЧЗ эти величины составили sr = 4.8%, n = 15 и sr = 4.9%, n = 3 соответственно. Для трехслойного ПДАДМАХ-НЧЗ-ПДАДМАХ sr = 2.8%, n = 15 и sr = 3.8%, n = 3 соответственно.
Все полученные покрытия охарактеризованы СЭМ-изображениями (рис. 4). Из рис. 4в видно наличие плотного, равномерного покрытия НЧЗ на внутренней поверхности капилляра. В среднем размер частиц на поверхности соответствует размеру НЧЗ, используемых для модификации (13 ± 2 нм). Также видны некрупные агломераты наночастиц, равномерно распределенных по модифицированной поверхности. После формирования третьего слоя ПДАДМАХ плотность покрытия, а также равномерность его распределения по поверхности не изменяются (рис. 4г). СЭМ-изображения капилляров послужили дополнительным независимым подтверждением факта наличия покрытий на стенках капилляра.
Рис. 4.
СЭМ-изображения внутренней поверхности капилляров: (a) – немодифицированный, (б) – с однослойным покрытием на основе ПДАДМАХ, (в) – с двухслойным покрытием ПДАДМАХ-НЧЗ, (г) – с трехслойным покрытием ПДАДМАХ-НЧЗ-ПДАДМАХ. Прибор: Zeiss Merlin, изображение во вторичных электронах.

Таким образом, сформированные трехслойные покрытия ПДАДМАХ-НЧЗ-ПДАДМАХ наиболее стабильны по сравнению с одно- и двухслойными в широком диапазоне рН.
Электрофоретическое разделение карбоновых кислот на однослойном покрытии ПДАДМАХ и трехслойном – ПДАДМАХ-НЧЗ-ПДАДМАХ. Аналитические возможности трехслойного покрытия ПДАДМАХ-НЧЗ-ПДАДМАХ оценивали при анализе анионных аналитов – карбоновых кислот. Наличие положительно заряженного внешнего слоя модификатора обеспечивает сонаправленный движению аналитов ЭОП и способствует сокращению продолжительности их определения, в то время как остаточные свободные НЧЗ на поверхности капилляра за счет специфических взаимодействий с аналитами могли бы способствовать увеличению селективности разделения аналитов. Состав фонового электролита для анализа подбирали на основе данных [16]. Оптимизировали концентрации основных компонентов ФЭ и выбрали следующий состав для анализа: 10 мМ ДЭА, 1 мМ ЭДТА и 10 мМ БК, где ДЭА способствует поддержанию постоянства pH, БК применяли в качестве поглощающей добавки, а ЭДТА улучшает форму пиков за счет связывания противоионов. На рис. 5 приведены электрофореграммы смеси карбоновых кислот, полученные с использованием капилляров с однослойным ПДАДМАХ (рис. 5а) и трехслойным ПДАДМАХ-НЧЗ-ПДАДМАХ покрытиями (рис. 5б). Видно, что лучшая селективность разделения аналитов в парах яблочная/кетоглутаровая, янтарная/молочная, масляная/валериановая кислоты достигается именно при использовании трехслойных покрытий с НЧЗ (табл. 2). Для всех 16 компонентов смеси достигнуто разделение, в то время как для однослойного ПДАДМАХ-покрытия удалось детектировать только 13 пиков аналитов. Уширение пика щавелевой кислоты, вероятно, происходит также по причине взаимодействия с НЧЗ поверхности капилляра. Предположительно, основной механизм взаимодействия аналитов и НЧЗ – динамический обмен между цитрат-анионами поверхности НЧЗ и аналитами.
Рис. 5.
Электрофореграммы карбоновых кислот: (а) − однослойное ПДАДМАХ-покрытие, (б) – трехслойное ПДА-ДМАХ-НЧЗ-ПДАДМАХ-покрытие. Условия: ввод пробы 2 с × 30 мбар, косвенное детектирование –20 кВ, 254 нм. Фоновый электролит: 10 мМ диэтаноламин, 10 мМ бензойная кислота,1 мМ ЭДТА. Карбоновые кислоты (50 мкг/мл): 1 – щавелевая, 2 – муравьиная, 3 – винная, 4 – яблочная, 5 – кетоглутаровая, 6 – лимонная, 7 – ацетоуксусная, 8 – янтарная, 9 – молочная, 10 – уксусная, 11 – β-гидроксимасляная, 12 – пропионовая, 13 – масляная, 14 – валериановая, 15 – изовалериановая, 16 – капроновая.

Таблица 2.
Значения эффективности (N, т.т./м)* и селективности (α)** разделения карбоновых кислот, полученных на ПДАДМАХ- и ПДАДМАХ-НЧЗ-ПДАДМАХ-модифицированных капиллярах
| Аналит | N × 103, т.т./м | α | ||
|---|---|---|---|---|
| ПДАДМАХ | ПДАДМАХ-НЧЗ-ПДАДМАХ | ПДАДМАХ | ПДАДМАХ- НЧЗ-ПДАДМАХ | |
| Щавелевая | 135 | 14 | 1.08 | 1.03 |
| Муравьиная | 400 | 567 | 1.04 | 1.08 |
| Винная | 429 | 337 | 1.10 | 1.09 |
| Яблочная | 403 | 1.02 | ||
| Кетоглутаровая | 265 | 187 | 1.05 | 1.06 |
| Лимонная | 291 | 760 | 1.02 | 1.01 |
| Ацетоуксусная | 1647 | 945 | 1.04 | 1.03 |
| Янтарная | 835 | 1.02 | ||
| Молочная | 178 | 726 | 1.08 | 1.07 |
| Уксусная | 919 | 609 | 1.06 | 1.10 |
| β-Гидроксимасляная | 1305 | 730 | 1.03 | 1.03 |
| Пропионовая | 243 | 99 | 1.02 | 1.03 |
| Масляная | 258 | 1.03 | ||
| Валериановая | 409 | 322 | 1.02 | 1.01 |
| Изовалериановая | 487 | 241 | 1.04 | 1.04 |
| Капроновая | 523 | 241 | – | – |
Таким образом, сформированные покрытия могут быть рекомендованы для селективного электрофоретического определения анионных аналитов, поскольку они быстро и воспроизводимо формируются; обладают высокой стабильностью в широком диапазоне рН, не поглощают свет в УФ-области спектра и, следовательно, не снижают чувствительности метода КЭ.
* * *
Разработанные трехслойные физически адсорбированные покрытия стенок кварцевого капилляра на основе стабилизированных цитратом наночастиц золота совместно с поли(диаллилдиметиламмоний хлоридом) характеризуются высокой стабильностью в диапазоне рН 2–10. Это выгодно отличает их от монослойного покрытия, нестабильного в щелочных средах (рабочий диапазон рН 2–8). СЭМ-изображения подтвердили наличие плотного равномерного слоя НЧЗ на внутренней поверхности капилляров. Сочетание свойств НЧЗ и положительно заряженного ПДАДМАХ в сформированных трехслойных покрытиях привело к увеличению селективности разделения карбоновых кислот. ПДАДМАХ в качестве связующего и функционального слоя способствует лучшей сорбции НЧЗ на поверхности кварца и формированию обращенного ЭОП для сокращения продолжительности анализа анионных аналитов. Присутствие НЧЗ в сформированном покрытии обеспечило полное разделение смеси 16 карбоновых кислот, предположительно, за счет динамического обмена между цитрат-анионами поверхности НЧЗ и аналитами.
Авторы выражают благодарность ресурсному центру “Методы анализа состава вещества” за возможность проведения исследований методом капиллярного электрофореза и Междисциплинарному ресурсному центру по направлению “Нанотехнологии” (Научный парк СПбГУ) за выполнение исследований методом сканирующей и просвечивающей электронной микроскопии. Эксперименты проведены с использованием инфраструктуры СПб-ГУ (кафедра органической химии, лаборатория плазмонно-усиленной спектроскопии и биоимиджинга).
Исследование выполнено при поддержке гранта Российского научного фонда № 21-73-00211, https://rscf.ru/project/21-73-00211.
Список литературы
Карцова Л.А., Макеева Д.В., Бессонова Е.А. Современное состояние метода капиллярного электрофореза // Журн. аналит. химии. 2020. Т. 12. № 75. С. 1059.
Kartsova L.A., Makeeva D.V., Davankov V.A. Capillary electrophoresis as a powerful tool for the analyses of bacterial samples // Trends Anal. Chem. 2019. V. 120. Article 115656. https://doi.org/10.1016/j.trac.2019.115656
Ban E., Yoo Y.S., Song E.J. Analysis and application of nanoparticles in capillary electrophoresis // Talanta. 2015. V. 141. P. 15. https://doi.org/10.1016/j.talanta.2015.03.020
Zhang Z., Yan B., Liu K., Liao Y., Liu H. CE-MS analysis of heroin and its basic impurities using a charged polymer-protected gold nanoparticle-coated capillary // Electrophoresis. 2009. V. 30. P. 379. https://doi.org/10.1002/elps.200800069
Hamer M., Yone A., Rezzano I. Gold nanoparticle-coated capillaries for protein and peptide analysis on open-tubular capillary electrochromatography // Electrophoresis. 2021. V. 33. P. 334. https://doi.org/10.1002/elps.201100297
Kang H., Buchman J.T., Rodriguez R.S., Ring H.L., He J., Bantz K.C., Haynes C.L. Stabilization of silver and gold nanoparticles: preservation and improvement of plasmonic functionalities // Chem. Rev. 2019. V. 119. № 1. P. 664. https://doi.org/10.1021/acs.chemrev.8b00341
Neiman B., Grushka E., Lev O. Use of gold nanoparticles to enhance capillary electrophoresis // Anal. Chem. 2001. V. 73. P. 5220. https://doi.org/10.1021/ac0104375
Yu C.J., Su C.L., Tseng W.L. Separation of acidic and basic proteins by nanoparticle-filled capillary electrophoresis // Anal. Chem. 2006. V. 78. P. 8004. https://doi.org/10.1021/ac061059c
Subramaniam V., Griffith L., Haes A.J. Varying nanoparticle pseudostationary phase plug length during capillary electrophoresis // Analyst. 2011. V. 136. P. 3469. https://doi.org/10.1039/C1AN15185A
Qu Q., Liu D., Mangelings D., Yang C., Hu X. Permanent gold nanoparticle coatings on polyelectrolyte multilayer modified capillaries for open-tubular capillary electrochromatography // J. Chromatogr. A. 2010. V. 1217. P. 6588. https://doi.org/10.1016/j.chroma.2010.08.057
Robb C.S. Applications of physically adsorbed polymer coatings in capillary electrophoresis // J. Liq. Chromatogr. Relat. Technol. 2007. V. 30. № 5. P. 729. https://doi.org/10.1080/10826070701191029
Morrison D.J., Preston T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism // Gut Microbes. 2016. V. 7. P. 189. https://doi.org/10.1080/19490976.2015.1134082
Zhang Q., Niu Y., Lyu W., Yu M. Formic acid up-regulates vascular tension through nitric oxide-cGMP signaling pathway // Chem. Biol. Interact. 2019. V. 309. Article 108710. https://doi.org/10.1016/j.cbi.2019.06.023
Galland L. The gut microbiome and the brain // J. Med. Food. 2014. V. 17. P. 1261. https://doi.org/10.1089/jmf.2014.7000
Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions // Nat. Phys. Sci. 1973. V. 241. P. 20.
Polikarpova D., Makeeva D., Kartsova L., Dolgonosov A., Kolotilina N. Nano-sized anion-exchangers as a stationary phase in capillary electrochromatography for separation and on-line concentration of carboxylic acids // Talanta. 2018. V. 188. P. 744. https://doi.org/10.1016/j.talanta.2018.05.094
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


