Журнал аналитической химии, 2023, T. 78, № 3, стр. 253-259
Последовательное инжекционное амперометрическое определение глюкозы в слюне на планарном электроде, модифицированном бинарной системой золото–кобальт
Л. Г. Шайдарова a, *, И. А. Челнокова a, И. А. Гафиатова a, А. В. Гедмина a, Г. К. Будников a
a Казанский Федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: larisashaidarova@mail.ru
Поступила в редакцию 10.06.2022
После доработки 19.09.2022
Принята к публикации 19.09.2022
- EDN: FUUDHQ
- DOI: 10.31857/S004445022303012X
Аннотация
Установлена каталитическая активность электроосажденных на поверхности планарных углеродных электродов частиц золота, кобальта и бинарной системы золото−кобальт при окислении глюкозы в нейтральной среде. Амперометрический отклик планарного электрода, модифицированного бинарной системой золото−кобальт, использовали в качестве аналитического сигнала при определении глюкозы в последовательной инжекционной системе. Линейная логарифмическая зависимость тока от концентрации глюкозы наблюдается в диапазоне от 5 × 10–8 до 5 × 10–2 М. Использование планарного электрода, модифицированного бинарной системой золото–кобальт, в качестве амперометрического детектора в последовательной инжекционной системе позволяет проводить селективное определение глюкозы в слюне в диапазоне концентраций, используемом для медицинской диагностики заболеваний.
Для клинической диагностики диабета огромное значение имеет надежное определение уровня глюкозы в крови [1]. Традиционно концентрацию глюкозы в биологических жидкостях контролируют ферментными методами [2, 3]. Однако данные методы, несмотря на присущую им высокую селективность, ограничены сложными процедурами очистки и иммобилизации ферментов, их нестабильностью, а также низкой чувствительностью и высокой стоимостью.
Помимо ферментных методов определения глюкозы существуют титриметрические [4], спектральные [4–6] и хроматографические [4, 7, 8] методы. Титриметрические методы отличаются недостаточной чувствительностью и селективностью и чаще всего используются для определения общего содержания углеводов. Применение спектральных и хроматографических методов зачастую ограничивается длительностью определения и высокой стоимостью оборудования.
Создание новых экспрессных, неферментных, неинвазивных методов определения глюкозы, обладающих повышенной стабильностью и селективностью, представляет несомненный интерес. Перспективным является метод, основанный на сочетании последовательного инжекционного анализа (ПослИА) с амперометрическим детектором на основе химически модифицированных электродов (ХМЭ) с электрокаталитическими свойствами, который позволяет проводить высокочувствительное, селективное и экспрессное определение веществ [9, 10].
В настоящей работе изучена возможность определения глюкозы в последовательной инжекционной системе (ПослИ-системе) с амперометрическим детектором на основе планарного электрода (ПЭ), модифицированного бинарной системой золото−кобальт (Au-Co-ПЭ), в слюне.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Циклические вольтамперограммы и хронамперограммы регистрировали с помощью бипотенциостата μSTAT400 (DropSens, Испания). Использовали углеродные ПЭ фирмы “DropSens” (Испания). Поверхность рабочих углеродных электродов модифицировали электроосажденными частицами золота, кобальта и бинарной системой золото−кобальт. Электроосаждение частиц золота проводили из раствора, содержащего HAuCl4 х. ч. фирмы “Aldrich” (США) на фоне 0.01 М H2SO4. Электролитический осадок кобальта на поверхности рабочих электродов ПЭ получали методом потенциостатического электролиза из раствора, содержащего хлорид кобальта (СoCl2 ⋅ 5H2O) х. ч. фирмы “Aldrich” (США) на фоне 0.1 М KNO3. Электроосаждение бинарной системы золото−кобальт проводили путем последовательного электролиза: сначала на поверхность ПЭ осаждали частицы золота, а затем кобальта. Оксо-, гидроксоформы золота и кобальта генерировали на поверхности осадка металла электрохимически в результате многократного сканирования потенциала в нейтральной среде.
Последовательная инжекционная система включала шприцевой насос, многоходовый кран и бипотенциостат DropSens μSTAT400 с проточной электрохимической ячейкой типа “wall-jet” с модифицированным ПЭ (рис. 1).
Рис. 1.
Схема последовательной инжекционной системы: 1 – шприцевой насос, 2 – многоходовый кран, 3 – детектор.

Использовали раствор, содержащий глюкозу х. ч. фирмы “Aldrich” (США). Фоновым электролитом в статических условиях и потоком-носителем в проточной системе служил фосфатный буферный раствор с рН 6.9 (ФБ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
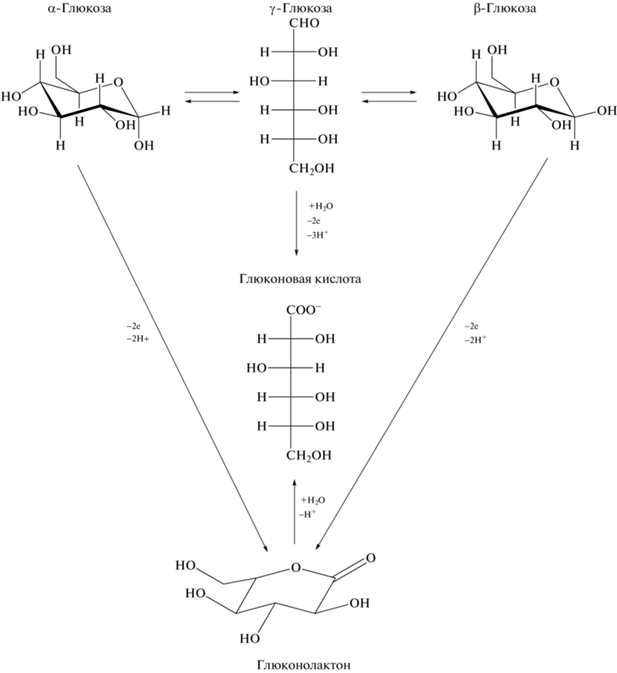
Известно, что глюкоза окисляется на металлических электродах. Равновесия в водных растворах глюкозы и общая схемa электрохимических реакций [11] представлены ниже (схема 1 ).
В растворе подавляющая часть глюкозы присутствует в форме циклического полуацеталя (α- и β-формы), а менее 1% молекул глюкозы находится в ациклической таутомерной форме (γ-форма) [11], которая и определяет окислительные свойства глюкозы. γ-Глюкоза напрямую окисляется до глюконовой кислоты, α- и β-глюкоза после депротонирования и переноса двух электронов превращается в глюконолактон, который в результате гидролиза превращается в глюконовую кислоту. Таким образом, независимо от химической формы глюкозы конечным продуктом ее окисления является глюконовая кислота.
Установлено, что глюкоза на немодифицированном ПЭ в нейтральной среде не окисляется. Для ускорения электроокисления глюкозы используют различные медиаторные системы, такие как мелкодисперсные осадки переходных (Co, Ni, Cu) и благородных металлов (Au, Pt), а также композиты на их основе [11–13]. В настоящей работе сопоставлена каталитическая активность золота, кобальта и бинарной системы на их основе, электроосажденных на поверхности рабочего электрода ПЭ, при окислении глюкозы с целью создания неферментных сенсоров.
При анодной поляризации ПЭ, модифицированного частицами золота (Au-ПЭ), в ФБ происходит окисление частиц золота с формированием оксо-, гидроксоформ Au(III), при этом на анодной ветви вольтамперограммы наблюдаются три максимума тока в области потенциалов от 0.2 до 1.0 В [14] (рис. 2, кривая 1).
Схема 1 . Равновесия в растворе глюкозы.
Рис. 2.
Вольтамперограммы, полученные на планарных электродах, модифицированных частицами золота (1), кобальта (2), бинарной системы золото−кобальт (3), на фоне фосфатного буферного раствора с pH 6.9.

При анодной поляризации ПЭ, модифицированного частицами кобальта (Co-ПЭ), в ФБ происходит окисление частиц кобальта с формированием оксо-, гидроксоформ Co(II) и Co(III), при этом на анодной ветви вольтамперограммы наблюдаются два максимума тока в области потенциалов от 0.60 до 1.30 В [15] (рис. 2, кривая 2).
На анодной ветви вольтамперограммы, полученной на электроде Au-Co-ПЭ, наблюдается нескольких максимумов тока. При этом проявляются индивидуальные свойства отдельного металла системы или имеет место аддитивный эффект (рис. 2, кривая 3).
Сопоставлены вольт-амперные характеристики электроокисления глюкозы на рассматриваемых модифицированных электродах. На рис. 3 приведены вольтамперограммы окисления глюкозы, полученные на ХМЭ (рис. 3а), и зависимости величины тока от концентрации глюкозы (рис. 3б). При окислении глюкозы на электроде Au-ПЭ (рис. 3а, кривая 1) наблюдаются два максимума тока при Е 0.20 и 0.40 В. Величина тока пика линейно зависит от концентрации глюкозы (рис. 3б, кривая 1). Каталитический эффект, рассчитанный как отношение каталитического тока окисления глюкозы на ХМЭ к току окисления модификатора, равен 25.0 и 12.5. При окислении глюкозы на электроде Co-ПЭ (рис. 3а, кривая 2) наблюдаемый максимум тока при Е 1.20 В линейно зависит от концентрации субстрата (рис. 3б, кривая 2); каталитический эффект равен 1.8. Однако при уменьшении концентрации глюкозы, например от 5 × 10–2 до 1 × 10–3 М, прирост тока в присутствии субстрата нивелируется (анодная ветвь вольтамперограммы окисления глюкозы повторяет фоновую кривую). Поэтому при использовании электрода Co-ПЭ возможно определять не более 1 × 10–3 М глюкозы.
Рис. 3.
Вольтамперограммы, полученные в присутствии глюкозы (c = 5 × 10–2 М) (а) и зависимости тока пика окисления глюкозы от концентрации (б) на планарном электроде, модифицированном частицами золота (1), кобальта (2), бинарной системы золото−кобальт (3), на фоне фосфатного буферного раствора с pH 6.9.
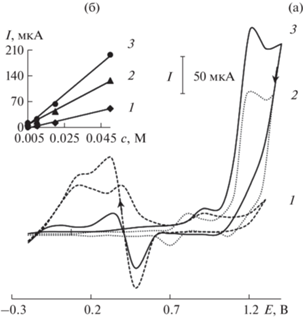
При окислении глюкозы на Au-Сo-ПЭ наблюдаeтся максимум тока при Eп 1.25 В. Величина тока окисления глюкозы на этом ХМЭ линейно зависит от ее концентрации. Каталитический эффект равен 3.5. По сравнению с электродами Сo-ПЭ и Au-ПЭ на электроде Au-Сo-ПЭ каталитические свойства модификатора проявляется в большей степени, что отражается в увеличении каталитического тока (рис 3а, табл. 1) и в более широком диапазоне линейной зависимости тока от концентрации глюкозы: от 5 × 10–6 М до 5 × 10–2 М (рис. 3б, табл. 2).
Таблица 1.
Вольт-амперные характеристики окисления глюкозы (с = 5 × 10–2 М) на планарных электродах, модифицированных частицами золота, кобальта и бинарной системы золото−кобальт, на фоне фосфатного буферного раствора с pH 6.9
| Электрод | ЕМОД, В | ЕКАТ, В | IКАТ, мкА |
|---|---|---|---|
| Au-ПЭ | 0.20 | 0.20 | 55 |
| Co-ПЭ | 1.20 | 1.20 | 140 |
| Au-Co-ПЭ | 1.25 | 1.25 | 210 |
Таблица 2.
Аналитические характеристики определения глюкозы на планарном электроде, модифицированном частицами бинарной системы золото–кобальт, на фоне фосфатного буферного раствора с pH 6.9
| Метод | Диапазон концентраций, М |
Уравнение регрессии lg I (мкА) = a + b lg с (M) |
R | |
|---|---|---|---|---|
| a ± ∆а | (b ± ∆b) × 10 | |||
| Вольтамперометрия | 5 × 10–6−5 × 10–2 | 2.2 ± 0.1 | 2.4 ± 0.2 | 0.998 |
| Амперометрия в условиях ПослИА | 5 × 10–8−5 × 10–2 | 2.6 ± 0.1 | 2.2 ± 0.1 | 0.999 |
Следует отдельно остановиться на оригинальной форме катодной ветви циклических вольтамперограмм, полученных на модифицированных электродах (рис. 3), на которых наблюдается рост анодного тока после пика восстановления поверхностного оксида металла. Величина тока зависит от концентрации глюкозы, поэтому можно предположить, что в этой области происходит также окисление глюкозы на электрогенерированных частицах металла-модификатора.
Причины аномальной формы катодной ветви циклической вольтамперограммы окисления глюкозы изложены в статье [16], где отмечен эффект уменьшения количества поверхностных оксидов на всех благородных металлах в присутствии больших концентраций углевода при развертке потенциала к его положительным значениям вплоть до начала выделения кислорода. Этот эффект отражается на величине пика, отвечающего десорбции оксида металла при обратной развертке потенциала. Потенциал начала выделения кислорода заметно сдвигается в сторону более положительных значений. В литературе приведены доказательства того, что при электроокислении глюкозы происходит адсорбция адатомов водорода и их последующее окисление при более положительных потенциалах. При этом подавляется рост оксидов на благородных металлах, в результате чего, пик, отвечающий десорбции оксида металла, уменьшается. Кроме того, предполагают, что в этом случае субстрат окисляется с помощью поверхностных оксидов, которые таким образом расходуются. Поскольку полная десорбция оксида заканчивается раньше при обратном ходе развертки потенциала, и поверхность электрода очищается еще в области весьма положительных потенциалов, возникает аномальный скачок тока в анодной области, который свидетельствует об окислении глюкозы [16].
Каталитический отклик электрода Au-Сo-ПЭ использовали в качестве аналитического сигнала при амперометрическом определении глюкозы в ПослИ-системе (рис. 1).
Оценили влияние условий регистрации аналитического сигнала на его величину. На основании полученных зависимостей тока от объема инжектируемой пробы (V), скорости потока (u) и налагаемого потенциала (E) (рис. 4а–4в) выбраны рабочие условия амперометрического определения глюкозы на электроде Au-Сo-ПЭ в условиях По-слИА (V = 15 мкл, u = 50 мкл/с и E = 1.15 В) при использовании в качестве потока-носителя ФБ. В этих условиях получали зависимость аналитического сигнала от концентрации глюкозы. Интервал линейности логарифмической зависимости каталитического тока от концентрации глюкозы и уравнение регрессии для этой зависимости приведены в табл. 2. Проведение анализа в ПослИ-системе по сравнению со статическими условиями позволяет снизить нижнюю границу определяемых содержаний глюкозы на два порядка.
Рис. 4.
Зависимость тока окисления глюкозы (c = 5 × 10–2 М) на планарном электроде с электроосажденной бинарной системой золото−кобальт на фоне фосфатного буферного раствора с pH 6.9 от объема инжектируемой пробы (а), скорости потока (б), накладываемого потенциала (в) и от количества воспроизведений (г) в последовательной инжекционной системе.
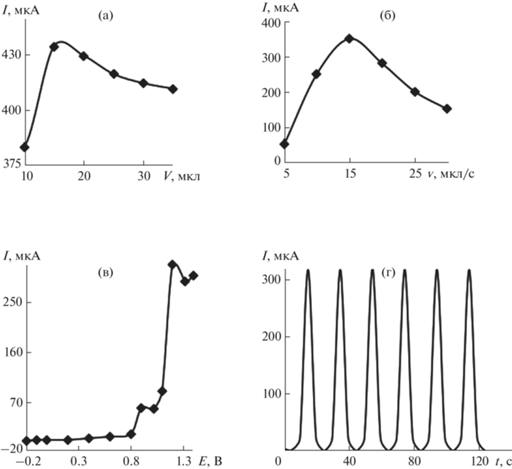
При непрерывной эксплуатации электрода Au-Co-ПЭ в проточной системе электрокаталитический отклик хорошо воспроизводим (рис. 4г). Относительное стандартное отклонение (sr) не превышает 2.0% во всем диапазоне исследуемых концентраций при n = 10. Расчетная производительность составляет 180 проб/ч.
В связи с необходимостью диагностирования сахарного диабета и подбора оптимальных доз лекарственных препаратов рассмотрена возможность анализа биологических жидкостей на содержание глюкозы. В качестве объекта анализа выбрали слюну. Известно, что уровень глюкозы в слюне прямо коррелирует с ее содержанием в крови, но ее концентрации в слюне на два порядка ниже. Тем не менее дополнительную пробоподготовку при определении глюкозы в слюне не проводили. Методика эксперимента заключается в следующем: пробу слюны вводят через инжектор в ПослИ-систему, в которой происходит разбавление исследуемого образца потоком-носителем, в качестве которого использовали ФБ (коэффициент дисперсии равен 2.5), при достижении фронтом аналита амперометрического детектора регистрируется аналитический сигнал в форме пика при фиксированном потенциале (рис. 1).
Установлено, что присутствие матричных компонентов, таких как креатинин, холестерин, мочевая, молочная, пировиноградная кислоты, не мешает определению глюкозы, поскольку они не окисляются в рассматриваемых условиях. В присутствии этих соединений наблюдается хорошая сходимость результатов определения глюкозы (sr < 5%).
Правильность способа оценивали методом введено−найдено. Для этого в исследуемый раствор слюны добавляли фиксированную аликвоту стандартного раствора глюкозы, далее приготовленный раствор также инжектировали в проточную систему. Результаты определения глюкозы в слюне в присутствии стандартных аликвот представлены в табл. 3. Полученные значения показателей правильности (ПП) лежат в диапазоне 97–98%, что указывает на отсутствие систематической погрешности.
Таблица 3.
Результаты последовательного инжекционного амперометрического определения глюкозы в слюне на планарном электроде, модифицированном частицами бинарной системы золото−кобальт (n = 3, P = 0.95, tтабл = 4.3)
| Образец | Введено, М | Расчет, М | Найдено*, М | ПП, % |
|---|---|---|---|---|
| № 1 | – | – | (1.50 ± 0.02) × 10–4 | – |
| 0.20 | 1.70 | (1.65 ± 0.05) × 10–4 | 97 | |
| № 2 | – | – | (0.90 ± 0.04) × 10–4 | – |
| 0.25 | 1.15 | (1.12 ± 0.03) × 10–4 | 97 | |
| № 3 | – | – | (2.00 ± 0.05) × 10–4 | – |
| 0.30 | 2.30 | (2.25 ± 0.04) × 10–4 | 98 |
* * *
Использование каталитического отклика электрода Au-Сo-ПЭ для последовательного инжекционного амперометрического определения глюкозы способствует повышению чувствительности, селективности, воспроизводимости, а также экпрессности и производительности анализа. Разработанный способ определения глюкозы можно предложить в качестве неинвазивного способа мониторинга диабета.
Работа выполнена за счет средств Программы стратегического академического лидерства Казанского (Приволжского) федерального университета.
Список литературы
Барсуков И.А., Демина А.А. Новые технологии в управлении сахарным диабетом: от теории − к практике // Consilium Medicum. 2018. Т. 4. № 4. С. 24.
Ortiz-Martinez M., Flores-DelaToba R., Gonzalez-Gonzalez M., Rito-Palomares M. Current challenges and future trends of enzymatic paper-based point-of-care testing for diabetes mellitus type 2 // Biosensors. 2021. V. 11. № 482. P. 1.
Mitra K., Ghosh A.B., Sarkar A., Saha N., Dutta A.K. Colorimetric estimation of human glucose level using c-Fe2O3 nanoparticles: An easily recoverable effective mimic peroxidase // Biochem. Biophys. Res. Commun. 2014. V. 451. № 1. P. 30.
Galant A.L., Kaufman R.C., Wilson J.D. Glucose: Detection and analysis // Food Chemistry. 2015. V. 188. P. 149.
Zayed M.A., Taha M.M. Spectrophotometric determination of glucose in pure form and in human embryos' culture medium using selective reagent via studying their reaction product // J. Pharm. Appl. Chem. 2018. V. 4. № 1. P. 1.
Mohammadnejad P., Soleimani S., Aminzadeh S., Haghbeen K. A new sensitive spectrophotometric method for determination of saliva and blood glucose // Spectrochim. Acta A. 2020. V. 229. P. 1.
Suksom W., Wannachai W., Boonchiangma S., Chanthai S., Srijaranai S. Ion chromatographic analysis of monosaccharides and disaccharides in raw sugar // Chromatographia. 2015. V. 78. № 13–14. P. 873.
Pereira da Costa M., Conte-Junior C.A. Chromatographic methods for the determination of carbohydrates and organic acids in foods of animal origin // Comrehensive Reviews in Food and Safety. 2015. V. 14. № 5. P. 586.
Perez-Olmos R., Soto J.C., Zarate N., Araújo A.N., Montenegro M.C.B.S.M. Sequential injection analysis using electrochemical detection: A review // Anal. Chim. Acta. 2005. V. 554. № 1–2. P. 1.
Шайдарова Л.Г., Будников Г.К. Амперометрическое детектирование лекарственных веществ в проточно-инжекционном анализе / Фармацевтический анализ. Сер. “Проблемы аналитической химии”. М.: АНРАМАК-МЕДИА, 2013. С. 580.
Park S., Boo H., Chung T.D. Electrochemical non-enzymatic glucose sensors // Anal. Chim. Acta. 2006. V. 556. № 1. P. 46.
Zhao C., Shao C., Li M., Jiao K. Flow-injection analysis of glucose without enzyme based on electrocatalytic oxidation of glucose at a nickel electrode // Talanta. 2007. V. 71. № 4. P. 1769.
Prabhu S., Baldwin R. Constant potential amperometric detection of carbohydrates at a copper-based chemically modified electrode // Anal. Chem. 1989. V. 61. № 8. P. 852.
Шайдарова Л.Г., Челнокова И.А., Дегтева М.А., Лексина Ю.А., Гедмина А.В., Будников Г.К. Порционно-инжекционное определение креатинина на электроде, модифицированном наночастицами золота // Ученые записки КазГУ. Сер. Естеств. науки. 2014. Т. 156. № 4. С. 40.
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии и медицине. М.: БИНОМ. Лаборатория знаний, 2010. 416 с.
Шайдарова Л.Г., Челнокова И.А., Махмутова Г.Ф., Гедмина А.В., Будников Г.К. Вольтамперометрическое и проточно-инжекционное определение углеводов на композитных электродах на основе углеродных нанотрубок и гексацианоферрата никеля(II) // Журн. аналит. химии. 2014. Т. 69. № 7. С. 725.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии