Журнал аналитической химии, 2023, T. 78, № 4, стр. 376-383
Хроматографическое определение остаточных количеств дифлубензурона в сельскохозяйственных растительных матрицах
Е. Ю. Алексеев a, Т. Д. Черменская a, *
a Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург-Пушкин, шоссе Подбельского, 3, Россия
* E-mail: tchermenskaya@yandex.ru
Поступила в редакцию 24.05.2022
После доработки 28.07.2022
Принята к публикации 15.10.2022
- EDN: PUIOHF
- DOI: 10.31857/S0044450223030027
Аннотация
Статья посвящена разработке способа определения дифлубензурона методом ВЭЖХ с диодно-матричным детектором в сельскохозяйственной продукции. Образцы экстрагировали ацетонитрилом, затем очищали способом твердофазной экстракции при использовании сорбентов C18Е, PSA и патрона Диапак С. Разработанный способ апробирован на зеленой массе растений, клубнях картофеля, зерне кукурузы, бобах сои, семенах подсолнечника, рапса и растительном масле в диапазоне концентраций от 0.025 до 0.25 мг/кг. Средние значения степени извлечения составили 81–91% с погрешностью 1.3–2.3%.
Инструментом обеспечения продовольственной безопасности является мониторинг химических и биологических рисков, для которого необходима разработка современных способов определения веществ.
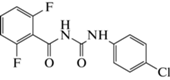
Дифлубензурон (1-(4-хлорфенил)-3-(2,6-дифторбензоил)мочевина) – инсектицид третьего поколения, относящийся к группе регуляторов роста насекомых (Димилин, Герольд, Локустин), производное бензоилмочевины. Он зарегистрирован во многих странах как средство защиты овощных культур и грибов, уничтожения личинок комаров и мух, снижения численности саранчовых, борьбы против большого числа хвоегрызущих и листогрызущих насекомых.
Дифлубензурон (схема 1 ) – это белое кристаллическое твердое вещество без запаха. Практически нерастворим в воде и плохо растворим в полярных органических растворителях, относительно стабилен в кислых и нейтральных средах [1].
Схема 1 . Структурная формула дифлубензурона.
В последние годы интерес к дифлубензурону и другим ингибиторам синтеза хитина возрос. Особенности механизма действия этих веществ позволяют эффективно бороться с популяциями членистоногих, резистентных к фосфорорганическим соединениям, пиретроидам, неоникотиноидам и другим группам инсектицидов.
На сегодняшний день существует несколько подходов к определению дифлубензурона в различных матрицах с использованием жидкостной хроматографии с различными типами детекторов [2–5]. В более ранних работах для этой цели использовали газовую хроматографию [6, 7].
Один из основных способов подготовки проб для определения остаточных количеств пестицидов на сегодняшний день − метод QuEChERS [8]. Использование данного метода для пробоподготовки позволяет за короткое время подобрать подходящие условия очистки широкого круга матриц, разработать условия пробоподготовки для смеси действующих веществ, обеспечить экспрессность анализа. Кроме того, подход QuEChERS допускает максимум модификаций, в отличие от других подходов. Большинство современных способов определения дифлубензурона базируется на данном подходе (табл. 1).
Таблица 1.
Сравнение методов определения дифлубензурона с использованием способа пробоподготовки QuEChERS
| Объект исследования | Предел определения, мг/кг | Степень извлечения, % | Метод анализа | Условия экстракции | Метод очистки | Литература |
|---|---|---|---|---|---|---|
| Персики | 0.01 | 83–119 | ВЭЖХ-МС/МС* | Ацетонитрил; 3 г NaCl | дТФЭ: 100 мг PSA, 100 мг C18, 300 мг MgSO4 | [9] |
| Мышцы и ткани печени | 0.01 | 89–111 | ВЭЖХ-МС/МС | Ацетон; 4 г MgSO4; 1 г NaCl; 1 г цитрата Na; 0.5 г динатрия цитрата полутораводного |
ТФЭ: Smart-SPE ZAX-50 мг; Smart-SPE PSA-30 мг; Smart-SPE C18-50 мг; шприцевый фильтр (0.45 мкм) | [10] |
| Фундук | 0.01 | 85–105 | ВЭЖХ-МС/МС | 50% ацетонитрил; 2 г MgSO4; 1 г CH3COONa |
дТФЭ: 50 мг PSA и 200 мг MgSO4; шприцевый фильтр (0.45 мкм) | [11] |
| Овощи | 0.01 | 87–104 | ВЭЖХ-МС/МС | Ацетонитрил; 4 г MgSO4; 1 г NaCl |
дТФЭ: 75 мг С18, 100 мг MgSO4 | [12] |
| Грибы | 0.05 | 79–107 | ВЭЖХ-МС/МС | Ацетонитрил; 4 г MgSO4; 1 г NaCl |
дТФЭ: 50 мг PSA, 100 мг MgSO4; шприцевый фильтр (0.22 мкм) | [13] |
| Томат | 0.01 | 96–115 | ВЭЖХ-МС/МС | Ацетонитрил 1% CH3COOH;
4 г MgSO4; 1.7 г CH3COONa |
Шприцевый фильтр (0.2 мкм) | [14] |
| Молоко | 0.01 | 87–104 | ВЭЖХ-МС/МС | Ацетонитрил; 4 г MgSO4; 1 г NaCl |
дТФЭ: 100 мг PSA, 300 мг MgSO4 | [15] |
| Молоко и ткани КРС | 0.01 | 72–105 | ВЭЖХ-ДМД | Ацетонитрил; 4 г MgSO4; 1 г NaCl |
ТФЭ: Phenomenex Strata C18; шприцевый фильтр (0.45 мкм) | [3] |
Как видно из табл. 1, основной метод, используемый для определения дифлубензурона, − тандемная масс-спектрометрия. Разрабатываются высокоэффективные комбинированные способы определения, такие как сочетание метода QuEC-hERS и дисперсионной жидкостно-жидкостной микроэкстракции [16, 17], которые обеспечивают степень извлечения, близкую к 100%. Разработаны достаточно специфические перспективные подходы к определению дифлубензурона, пока широко не применяемые. Это, например, метод прямой лазерной фотоиндуцированной флуоресценции [18] или кинетический спектрофотометрический метод [19].
Большинство исследовательских работ направлено на разработку высокочувствительных методов, позволяющих определять минимальные следы пестицидов, иногда в ущерб продолжительности и стоимости анализа. При рутинном анализе образцов на содержание остаточных количеств пестицидов с учетом установленных максимально допустимых уровней (МДУ) высокая чувствительность не всегда необходима, более значимыми факторами становятся экспрессность анализа, его стоимость и трудозатраты. Наиболее перспективными с точки зрения приведенных критериев можно считать способы, основанные на пробоподготовке методом QuEChERS и его модификациях, и последующем детектировании методом жидкостной хроматографии с детектором на диодной матрице (ДМД). Реагенты для реализации данного метода общедоступны и недороги; стоимость ВЭЖХ-ДМД-системы и ее обслуживание намного ниже по сравнению с ВЭЖХ-МС, кроме того, последний метод предъявляет более высокие требования к чистоте и качеству растворителей.
Стоит отметить, что способы определения остаточных количеств всего класса бензоилмочевин в масличных культурах отсутствуют в отечественной и в зарубежной литературе.
Цель настоящей работы − создание универсального способа определения дифлубензурона в растениях разныx групп, обеспечивающего экспрессность и высокую полноту извлечения на фоне снижения затрат на анализ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и материалы. Для извлечения аналита применяли ацетонитрил (сорт 5, Криохром, Россия), гексан сорт 3 (Криохром, Россия), хлорид натрия ч. д. а. (Вектон, Россия), сульфат магния безводный (97%, Sigma-Aldrich, Германия), натрия цитрат двузамещенный сесквигидрат (99%, Sigma-Aldrich, Германия), натрия цитрат трехзамещенный дигидрат (98%, Sigma-Aldrich, США), этилацетат х. ч. (Вектон, Россия).
Для очистки экстрактов использовали cорбент на основе силикагеля с привитыми эндкепированными октадецильными группами (С18Е) и сорбент с привитыми пропиламинными группами (CH2)3NH2 (PSA) (Supelco, США), Диапак С (гидрофильный слабокислотный сорбент с постоянной активностью, 3 мл, 40–63 мкм, 60 Å) (БиоХимМак СТ, Россия).
Для приготовления подвижной фазы использовали ацетонитрил сорт 0 (Криохром, Россия), воду (бидистиллированную, деионизированную), кислоту ортофосфорную х. ч. (Вектон, Россия).
Аппаратура. Использовали ультраэффективный жидкостный хроматограф ACQUITY (Waters) с быстросканирующим диодно-матричным детектором, дегазатором, автоматическим пробоотборником и термостатом колонки. Хроматографическая колонка ACQUITY UPLC BEH C18 длиной 100 мм, внутренним диаметром 2.1 мм и зернением фазы 1.7 мкм (Waters).
Аппарат для встряхивания Multi Reax (Heidolph), центрифуга 5810 (Eppendorf AG), воздушный испаритель (VLM GMBH), вакуумный манипулятор для работы с патронами для твердофазной экстракции (Waters) с мембранным насосом V 850 (Buchi).
Приготовление стандартных растворов. Стандартный раствор дифлубензурона с концентрацией 0.5 мг/мл готовили из аналитического стандарта с чистотой 99.8% (Sigma-Aldrich, Швейцария) путем его растворения (50 ± 0.5) мг в ацетонитриле в мерной колбе емк. 100 мл. Градуировочные растворы с концентрациями 0.05, 0.1, 0.2 и 0.5 мкг/мл готовили методом последовательного разбавления, используя подвижную фазу. Градуировочную зависимость строили по серии стандартных растворов, содержащих от 0.05 до 0.5 мкг/мл дифлубензурона в подвижной фазе.
Условия хроматографирования. Подвижная фаза: смесь ацетонитрила и 0.005 М H3PO4 (45 : 55, по объему). Скорость потока элюента 0.2 мл/мин. Температура колонки 30°С. Рабочая длина волны детектора 270 нм. Объем вводимой пробы 10 мкл.
Дифлубензурон идентифицировали по времени удерживания, количественное определение проводили методом абсолютной градуировки. Для каждого из четырех уровней концентраций дифлубензурона в диапазоне 0.05–0.5 мкг/мл проводили по три измерения. Градуировочный график линеен с коэффициентом корреляции 0.999.
Полноту извлечения дифлубензурона определяли на четырех уровнях концентраций в пяти повторах.
Пробоподготовка. Экстракция дифлубензурона из зеленой массы и клубней картофеля. Навеску измельченной матрицы (10 г) помещали в полипропиленовую центрифужную пробирку емк. 50 мл, добавляли 10 мл ацетонитрила и 1 г хлорида натрия. После перемешивания и центрифугирования из верхнего ацетонитрильного слоя отбирали 5 мл экстракта и переносили в центрифужную пробирку емк. 15 мл, содержащую 150 мг сорбента для твердофазной экстракции (PSA) и 900 мг безводного сульфата магния. После перемешивания и центрифугирования из верхнего ацетонитрильного слоя отбирали 2 мл экстракта (аликвота, соответствующая навеске массой 2 г) (при необходимости уменьшения предела определения можно увеличить аликвоту, но не более 5 мл), переносили в стеклянную пробирку и упаривали досуха в токе воздуха при температуре не выше 40°С. Сухой остаток подвергали очистке на патроне для твердофазной экстракции Диапак С.
Экстракция дифлубензурона из зерна кукурузы, бобов сои, семян подсолнечника, рапса и растительного масла. Навеску измельченной матрицы или масла (10 г) помещали в полипропиленовую центрифужную пробирку емк. 50 мл, последовательно добавляли 10 мл ацетонитрила, 1 г хлорида натрия и 7 мл дистиллированной воды. После перемешивания и центрифугирования от верхнего ацетонитрильного слоя отбирали 5 мл (при необходимости уменьшения предела определения можно увеличить аликвоту, но не более 7 мл), переносили в центрифужную пробирку емк. 15 мл, содержащую 150 мг сорбента для твердофазной экстракции (PSA), 150 мг эндкепированого сорбента для твердофазной экстракции (С18Е) и 900 мг безводного сульфата магния. После перемешивания и центрифугирования из верхнего слоя отбирали 2 мл экстракта (аликвота, соответствующая навеске массой 2 г) (при необходимости уменьшения предела определения можно увеличить аликвоту, но не более 5 мл), переносили в стеклянную пробирку и упаривали досуха в токе воздуха при температуре не более 40°С. Сухой остаток подвергали очистке на патроне для твердофазной экстракции Диапак С.
Очистка на патроне для твердофазной экстракции Диапак С. Полученный сухой остаток растворяли в 1 мл смеси гексан−этилацетат (9 : 1) и наносили на предварительно кондиционированный патрон, процедуру повторяли с 1 мл смеси гексан−этилацетат (9 : 1). Патрон промывали 5 мл смеси гексан−этилацетат (9 : 1). Дифлубензурон элюировали 6 мл смеси гексан−этилацетат (1 : 1), элюат собирали, упаривали досуха в токе воздуха при температуре не выше 40°С, остаток растворяли в 1 мл подвижной фазы и 10 мкл вводили в хроматограф.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследовали следующие сельскохозяйственные культуры и продукты их переработки: зеленую массу (ботва картофеля), клубни картофеля, бобы сои, зерно кукурузы, семена подсолнечника и рапса, растительное масло.
Первоначально для экстракции дифлубензурона и очистки экстракта применили метод QuEChERS EN 15662 [20], основанный на извлечении аналита из образцов ацетонитрилом в присутствии цитратного буферного раствора, насыщенного сульфатом магния и обеспечивающего разделение водной и органической фаз; очистке ацетонитрильного экстракта с помощью дисперсионной твердофазной экстракции (дТФЭ) на PSA. Так как исследовали в том числе маслосодержащие матрицы, для очистки экстрактов добавляли сорбент С18Е, обеспечивающий эффективное удаление белков, жиров и других коэкстрактивных веществ.
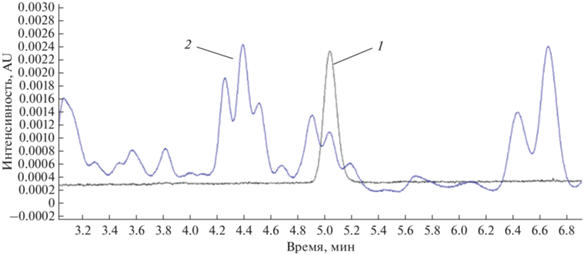
Как видно из табл. 2, значение степени извлечения более 80% было достигнуто только при анализе подсолнечника. Экстракты всех исследуемых растительных матриц были недостаточно очищены и, как следствие, хроматографический фон был высокий, что не позволило достоверно определить степень извлечения аналита (рис. 1). Кроме того, анализ плохо очищенных проб негативно сказывается на сроке службы колонки и других узлов ВЭЖХ-системы.
Рис. 1.
Хроматограмма стандартного раствора дифлубензурона (ДФБ) с концентрацией 0.1 мкг/мл (1) и хроматограмма экстракта ботвы, полученная при пробоподготовке методом EN QuEChERS, с внесением 0.05 мг/кг дифлубензурона (2).
При анализе проб сравнивали две аналитической колонки – заполненную сорбентом с привитыми монофункциональными полярными группами BEH С-18 (100 × 2.1 мм, 1.7 мкм) и колонку с привитыми монофункциональными полярными группами BEH C-8 (150 × 2.1 мм, 1.7 мкм), которую часто используют для определения дифлубензурона [21]. Вследствие отсутствия заметных различий в качестве разделения хроматографируемых экстрактов на указанных колонках и высокой стоимости колонки с фазой С-8 в дальнейшей работе использовали колонку BEH C-18.
При использовании УФ-детектора определение дифлубензурона обычно проводят при длинах волн 220, 254 нм или путем непрерывной регистрации спектра при использовании диодно-матричного детектора. В качестве компонентов подвижной фазы, как правило, используют ацетонитрил, воду и метанол в разных соотношениях [2, 3, 17, 21]. Выбор таких значений длин волн вызывает вопрос, так как в этих условиях поглощает свет большое количество органических соединений. В УФ-спектре используемого нами аналитического стандарта дифлубензурона имеется один максимум поглощения при 257 нм. Чтобы снизить влияние примесей, мы использовали длину волны 270 нм. В этом случае практически без потери чувствительности поглощение компонентов матрицы не мешает идентификации аналита. Нижняя граница определяемых содержаний – 0.5 нг, предел обнаружения – 0.05 мкг/мл.
В процессе анализа, выявили следующие проблемы:
1. Хроматографический пик дифлубензурона при исследовании экстракта зеленой массы оказался недоступным для идентификации из-за недостаточной очистки и, как следствие, перекрывания пика определяемого вещества с пиками примесей.
2. Из-за высокого содержания природных липидов в некоторых исследуемых культурах при растворении проб в подвижной фазе образовывалась эмульсия масла и ацетонитрила. Особенно это было заметно при анализе сои. Очистки с помощью селективного для липидов сорбента С18Е оказалось недостаточно.
Основываясь на полученных данных, сделали следующие предположения:
1. Недостаток влажности некоторых проб может негативно влиять на экстракцию и снижать процент извлечения;
2. Возможна адсорбция экстракционными солями исследуемого вещества;
3. Возможно химическое взаимодействие действующего вещества с экстракционными солями.
С учетом сделанных наблюдений и предположений предприняли следующие шаги:
1. В связи с недостаточной чистотой проб после дТФЭ ввели дополнительную стадию очистки с помощью патрона для ТФЭ по схеме, приведенной в “Экспериментальной части”;
2. Дополнительно увлажнили сухую пробу путем добавления 7 мл воды на 10 г сухой пробы;
3. В связи со стабильностью дифлубензурона и нейтральной средой изучаемых растительных матриц отказались от цитратного буферного раствора. Кроме того, исключили безводный сульфат магния. Хлорида натрия в количестве 1 г оказалось достаточно для повышения ионной силы раствора и разделения фаз. Повышение ионной силы водного раствора с помощью хлорида натрия − достаточно распространенный способ, который использовали ранее для определения абамектина во фруктах и овощах [22].
В результате предложили модифицированный способ определения дифлубензурона, описанный выше в “Экспериментальной части”.
Избирательность способа определения дифлубензурона обеспечивается сочетанием условий подготовки проб и хроматографирования. Метрологические характеристики приведены в табл. 3.
Таблица 3.
Метрологические характеристики методики определения дифлубензурона
| Характеристика | Значение |
|---|---|
| Показатель точности (границы относительной погрешности), ±δ, % | 25 |
| Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), σr, % | 10 |
| Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), σR, % | 12.5 |
| Предел повторяемости (значение допустимого расхождения между двумя результатами параллельных определений), r, % | 28 |
| Предел воспроизводимости (значение допустимого расхождения между двумя результатами измерений, полученных в разных лабораториях), R, % | 36 |
Схема пробоподготовки апробирована на всех изученных матрицах (табл. 4). В результате удалось достичь степени извлечения выше 80% для всех изучаемых культур и около 90% для ботвы и клубней картофеля (рис. 2).
Таблица 4.
Характеристики методики определения остаточных количеств дифлубензурона в некоторых объектах природного происхождения (n = 20, Р = 0.95)
| Объект анализа | Предел определения, мг/кг | Диапазон определяемых концентраций, мг/кг | Степень извлечения, % | Стандартное отклонение, % | Доверительный интервал среднего результата, ± % |
|---|---|---|---|---|---|
| Зеленая масса | 0.025 | 0.025–0.25 | 89.9 | 5.31 | 2.33 |
| Клубни картофеля | 0.025 | 0.025–0.25 | 91.3 | 5.11 | 2.24 |
| Зерно кукурузы | 0.025 | 0.025–0.25 | 84.0 | 4.93 | 2.16 |
| Бобы сои | 0.025 | 0.025–0.25 | 80.7 | 3.29 | 1.44 |
| Семена подсолнечника | 0.025 | 0.025–0.25 | 83.0 | 4.56 | 2.00 |
| Семена рапса | 0.025 | 0.025–0.25 | 80.9 | 3.32 | 1.45 |
| Растительные масла | 0.025 | 0.025–0.25 | 81.0 | 2.98 | 1.31 |
Рис. 2.
Хроматограмма стандартного раствора дифлубензурона с концентрацией 0.05 мкг/мл (1) и хроматограмма экстракта ботвы с внесением 0.025 мг/кг дифлубензурона (2).

Наибольшие сложности при извлечении дифлубензурона из исследуемых матриц в нашем случае связаны с тем, что часть их относится к маслосодержащим растениям. В литературе преимущественно приведены сведения об экстракции дифлубензурона из матриц, содержащих достаточное количество воды – из яблок, груш, винограда, томатов и пр. В этих случаях использование в качестве экстрагента органического растворителя и очистки на картриджах оказывается достаточным для достижения степени извлечения 88−100% и 92.9−105% для детекторов УФ/ДМД и МС с относительными стандартными отклонениями 2.9−11 и 3.7−14% соответственно [2, 23]. Более сложные методы связаны с использованием ионно- жидкостной дисперсионной микроэкстракции, что позволяет достичь низких пределов определения (0.005 мг/кг) с удовлетворительной полнотой извлечения и погрешностью выше 5% [16, 17]. Для жиросодержащих объектов описано определение дифлубензурона в тканях животных, молоке, рыбе, основанное на экстракции метанолом с последующей очисткой экстракта на картридже с С18 [3, 24].
Многоступенчатая пробоподготовка при ана-лизе проб мандаринов и яблок на содержание нескольких пестицидов, описанная в литерату-ре [5], позволила достичь степени извлечения, превышающей 94%. Однако с учетом использования МС-детектирования предел определения не сильно отличался от достигнутого нами и составил 0.02 мг/кг.
Несмотря на все большую популярность ВЭ-ЖХ-МС при определении пестицидов, использование УФ-детектора или диодной матрицы по-прежнему актуально. Определение инсектицидов, фунгицидов и гербицидов в растениях и объектах окружающей среды с помощью ВЭЖХ-УФ также характеризуется высокой степенью извлечения аналитов с небольшой погреш-ностью и достаточно низкими пределами определения [25–28].
* * *
Таким образом, разработанный способ характеризуется следующими преимуществами: высокой степенью извлечения (80.7–91.3%); высокой воспроизводимостью; является универсальным для большого числа исследуемых сельскохозяйственных культур, в отличие от ранее применявшихся методов определения дифлубензурона. Введение дополнительной стадии очистки с помощью ТФЭ позволяет достичь однозначной идентификации исследуемого вещества даже в сложных (высокопигментированных, маслосодержащих) матрицах и снизить предел определения методики. Для некоторых анализируемых культур ранее отсутствовали способы определения остаточных количеств дифлубензурона.
Список литературы
Junquera P., Hosking B., Gameiro M., Macdonald A. Benzoylphenyl ureas as veterinary antiparasitics. An overview and outlook with emphasis on efficacy, usage and resistance // Parasite. 2019. V. 26. P. 26.
Rodriguez E., de Balugera Z.G., Goicolea M.A., Barrio R.J. HPLC/diode-array method for the determination of the pesticide diflubenzuron and its major metabolites 2,6-difluorobenzamide, 4-chlorophenylurea, and 4-chloroaniline in forestry matrices // J. Liq. Chromatogr. Relat. Technol. 1998. V. 21. № 12. P. 1857.
Tfouni S.A.V., Furlani R.P.Z., Carreiro L.B., Loredo I.S.D., Gomes A.G., Alves L.A., Mata R.S.S., Fonseca A.M.D., Rocha R.M.S. Determination of diflubenzuron residues in milk and cattle tissues // Arq. Bras. Med. Veterinária e Zootec. 2013. V. 65. № 1. P. 301.
Yang X., Xia Y., Liao X., Zuo Y., Liao Y., Liu H. Fragmentation study and analysis of benzoylurea insecticides and their analogs by liquid chromatography–electrospray ionization-mass spectrometry // Talanta. 2006. V. 70. № 1. P. 75.
Kim J.-H., Seo J.-S., Moon J.-K., Kim J.-H. Multi-residue method development of 8 benzoylurea insecticides in mandarin and apple using high performance liquid chromatography and liquid chromatography-tandem mass spectrometry // J. Korean Soc. Appl. Biol. Chem. 2013. V. 56. № 1. P. 47.
Mensah J.K., Lundanes E., Greibrokk T., Holen B. Determination of diflubenzuron in apples by gas chromatography // J. Chromatogr. A. 1997. V. 765. № 1. P. 85.
Wimmer M.J., Smith R.R., Jones J.P. Analysis of diflubenzuron by gas chromatography/mass spectrometry using deuterated diflubenzuron as internal standard // J. Agric. Food Chem. 1991. V. 39. № 2. P. 280.
Anastassiades M., Lehotay S.J., Stajnbaher D., Schenck F.J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce // J. AOAC Int. 2003. V. 86. № 2. P. 412.
Dong M., Ma L., Zhan X., Chen J., Huang L., Wang W., Zhao L. Dissipation rates and residue levels of diflubenzuron and difenoconazole on peaches and dietary risk assessment // Regul. Toxicol. Pharmacol. 2019. V. 108. Article 104447.
Hamamoto K., Iwatsuki K., Akama R., Koike R. Rapid multiresidue determination of pesticides in livestock muscle and liver tissue via modified QuEChERS sample preparation and LC-MS/MS // Food Addit. Contam.: Part A. 2017. V. 34. № 7. P. 1162. https://doi.org/10.1080/19440049.2017.1319075
Cebi N., Manav O.G., Olgun E.O. Analysis of pesticide residues in hazelnuts using the QuEChERS method by liquid chromatography–tandem mass spectrometry // Microchem. J. 2021. V. 166. Article 106208.
An J., Zhang Y. Sheng Y., Liu Y., Yu H., Jing K. Determination of residues of diflubenzuron and chlorbenzuron in vegetables by high performance liquid chromatography with QuEChERS purification // Phys. Test. Chem. Anal. Part B. 2022. V. 58. № 5. P. 603.
Du P., Liu X., Gu X., Dong F., Xu J., Kong Z., Li Y., Zheng Y. Rapid residue analysis of pyriproxyfen, avermectins and diflubenzuron in mushrooms by ultra-performance liquid chromatography coupled with tandem mass spectrometry // Anal. Methods. 2013. V. 5. № 23. P. 6741.
Stringhini F.M., Ribeiro L.C., Rocha G.I., de B. Kuntz J.D., Zanella R., Prestes O.D., Adaime M.B. Dilution of QuEChERS extracts without cleanup improves results in the UHPLC-MS/MS multiresidue analysis of pesticides in tomato // Food Anal. Methods. 2021. V. 14. № 8. P. 1511.
Furlani R., Gomes F., S. Tfouni, Camargo M., Ramos B., Daniel D. Development of an analytical method for determination of antiparasitics residues in milk using QuEChERS and analysis by LC-MS/MS. Agilent Technologies, 2014. P. 4. URL: https://www.agilent.com/cs/library/applications/5991-3948EN.pdf (28.07.2022).
Zeng H., Yang X., Yang M., Wu X., Zhou W., Zhang S., Lu R., Li J., Gao H. Ultrasound-assisted, hybrid ionic liquid, dispersive liquid-liquid microextraction for the determination of insecticides in fruit juices based on partition coefficients // J. Sep. Sci. 2017. V. 40. № 17. P. 3513.
Ruan C., Zhao X., Liu C. Determination of diflubenzuron and chlorbenzuron in fruits by combining acetonitrile-based extraction with dispersive liquid-liquid microextraction followed by high-performance liquid chromatography // J. Sep. Sci. 2015. V. 38. № 17. P. 2931.
Diaw P.A., Maroto A., Mbaye O.M.A., Gaye-Seye M.D., Stephan L., Coly A., Deschamps L., Tine A., Aaron J.J., Giamarchi P. Determination of phenylurea pesticides by direct laser photo-induced fluorescence // Talanta. 2013. V. 116. P. 569.
Pecev-Marinkovic E., Grahovac Z., Pavlović A., Tošić S., Rašić Mišić I., Mitić M., Miletić A., Sejmanović D. Development of a kinetic spectrophotometric method for insecticide diflubenzuron determination in water and baby food samples // Hem. Ind. 2018. V. 72. № 5. P. 305.
BS EN 15662:2018 Foods of plant origin. Multimethod for the determination of pesticide residues using GC- and LC-based analysis following acetonitrile extraction/partitioning and clean-up by dispersive SPE. Modular QuEChERS-method − European Standards URL: https://www.en-standard.eu/bs-en-15662-2018-foods-of-plant-origin.-multimethod-for-the-determination-of-pesticide-residues-using-gc-and-lc-based-analysis-following-acetonitrile-extraction/partitioning-and-clean-up-by-dispersive-spe.-modular-quechers-method/ (02.03.2021).
FAO. FAO Specifications and Evaluations for Agricultural Pesticides –DIFLUBENZURON. Fao, 2011.
Chamkasem N., Papathakis M.L., Lee S.M. Liquid chromatographic determination of abamectin in fruits and vegetables // J. AOAC Int. 1993. V. 76. № 3. P. 691.
Markoglou A.N., Bempelou E.D., Liapis K.S., Ziogas B.N. Determination of benzoylurea insecticide residues in tomatoes by high-performance liquid chromatography with ultraviolet-diode array and atmospheric pressure chemical ionization-mass spectrometry detection // J. AOAC Int. 2007. V. 90. № 5. P. 1395.
Luvizotto-Santos R., Cordeiro P.J.M., Vieira E.M. Analysis of diflubenzuron in tilapia filet by HPLC-DAD // J. Chromatogr. Sci. 2009. V. 47. № 9. P. 785.
Комарова А.С., Черменская Т.Д., Человечкова В.В. Определение аметоктрадина в растительных остатках и объектах окружающей среды методом высокоэффективной жидкостной хроматографии с ультрафиолетовым детектором // Журн. аналит. химии. 2017. Т. 72. № 10. С. 904.
Алексеев Е.Ю., Черменская Т.Д. Оптимизация метода определения остаточных количеств флорасулама в сельскохозяйственных культурах // Вестник защиты растений. 2018. Т. 3. № 97. С. 76.
Человечкова В.В., Комарова А.С., Черменская Т.Д. Одновременное определение имидаклоприда и клотианидина в картофеле и сахарной свекле // Агрохимия. 2018. № 7. С. 81.
Черменская Т.Д., Алексеев Е.Ю. Оптимизация совокупности процедур и условий одновременного определения амикарбазона и его метаболитов в объектах окружающей среды и растительных матрицах методом высокоэффективной жидкостной хроматографии с УФ-детектированием // Журн. аналит. химии. 2021. Т. 76. № 2. С. 151.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии