Журнал аналитической химии, 2023, T. 78, № 4, стр. 365-375
Хроматографическая оценка содержания фенольных соединений в экстрактах ромашки аптечной (Matricаria chamomilla L.) В различных условиях извлечения
З. А. Темердашев a, *, Т. К. Чубукина a, Е. А. Виницкая a, b, Н. В. Киселева a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
b Субтропический научный центр Российской академии наук
354002 Сочи, ул. Яна Фабрициуса, 2/28, Россия
* E-mail: TemZA@kubsu.ru
Поступила в редакцию 09.09.2022
После доработки 04.10.2022
Принята к публикации 04.10.2022
- EDN: KZWUHC
- DOI: 10.31857/S0044450223040151
Аннотация
Обсуждаются результаты исследования водных и водно-спиртовых экстрактов фенольных соединений ромашки аптечной (Matricаria chamomilla L.) в зависимости от условий их извлечения различными способами. Объект исследований – собранная в различных регионах России ромашка аптечная. Фенольные компоненты в их нативных формах извлекали из лекарственного сырья различными способами: настаиванием, мацерацией, микроволновым, ультразвуковым, субкритическим и фармакопейным. Содержания индивидуальных компонентов и суммарное содержание фенольных соединений в экстрактах ромашки аптечной оценивали хроматографическими методами. ВЭЖХ-определение фенольных соединений с диодно-матричным и масс-спектрометрическим детектированием проводили в градиентном режиме элюирования смесью ацетонитрил–0.1%-ная муравьиная кислота. В водных и водно-спиртовых экстрактах ромашки аптечной идентифицировали хлорогеновую кислоту, гликозиды феруловой кислоты, лютеолин-7-О-глюкозид, дикофеилхинную и цикориевую кислоты, апигенин-7-глюкозид, апигенин. По содержаниям фенольных соединений в экстрактах цветов ромашки различных производителей с различных территорий изучили зависимость данного показателя от географического места произрастания растительного сырья. Максимальное суммарное содержание фенольных соединений (10.1 мг/г) наблюдали в экстракте ромашки аптечной торговой марки “Фармацвет” (Московская обл., Красногорск).
Широкое распространение при производстве препаратов терапевтического воздействия получили лекарственные растения семейства Астровые (Asteraceae) – полынь, тысячелистник, ромашка, череда, календула, одуванчик и другие [1–3]. Эти лекарственные растения обладают антиоксидантной активностью и проявляют разнообразные терапевтические свойства, обусловленные наличием в их составе комплекса ряда действующих соединений [2–6]. Например, антиоксидантное, противоопухолевое, гепатопротекторное, химиопротекторное и противовоспалительное действие связано с наличием в экстрактах лекарственного растительного сырья (ЛРС) лупеола. Противовоспалительное, антиоксидантное и противораковое действие обусловлено присутствием апигенина и лютеолина, а цинарин обеспечивает антимикробные и противоязвенные свойства [4]. Фенольные соединения (ФС) в этих лекарственных растениях преимущественно представлены флавоноидами, фенольными кислотами (гидроксибензойными и гидроксикоричными) и их производными [7].
Для определения ФС в экстрактах лекарственных растений традиционно используют методы суммарного их определения в пересчете на рутин [8]. Однако для полноценной оценки фармакологической активности ЛРС важно знать качественный состав и содержание индивидуальных компонентов, определяющих фитотерапевтические свойства ромашки аптечной. Для этих целей применяют высокоэффективную жидкостную хроматографию (ВЭЖХ) [4, 9–11], которая в сочетании с разными вариантами детектирования позволяет идентифицировать и определять содержание ФС в их нативном виде [11, 12].
Способ экстракции сказывается на содержании ФС в экстракте ромашки аптечной [13]. При хроматографическом определении ФС в экстрактах ЛРС в зависимости от выбранного способа экстракции меняется также состав (качественный и количественный) извлечений, что усложняет оценку компонентного состава экстрактов. Для экстракции фенольных веществ из растительного сырья семейства Астровые используют жидкостную экстракцию водно-спиртовыми смесями – мацерацию [4, 10, 14], водой – настаивание [15–21], а также жидкостную экстракцию с дополнительным физическим воздействием – ультразвуковым [1, 22], микроволновым [11, 23], повышением температуры и давления [11, 24].
Ромашка аптечная (Matricаria chamomilla L.) исследуется достаточно широко [5, 6], но сведения по оценке эффективности способов извлечения целевых соединений, позволяющие сопоставить различные способы экстракции компонентов из растительного материала, практически отсутствуют. В табл. 1 приведены некоторые примеры способов извлечения целевых соединений из ромашки аптечной.
Таблица 1.
Примеры извлечения фенольных соединений из цветов ромашки аптечной (Matricаria chamomilla L.) различными способами
| Способ экстракции | Экстрагент | Условия экстракции | Метод анализа | Определяемые компоненты | Литера-тура |
|---|---|---|---|---|---|
| Мацерация | 80%-ный метанол | Встряхивание 90 мин | ВЭЖХ–МС/МС | 4-Гидроксифенилуксусная кислота, изоскополетин, ресвератрол, ализарин, дантрон, хризин, пиноцембрин, ликвиритигенин, изоликвиритигенин, цис, транс-абсцизовая кислота, формононетин, алоэ-эмодин, эмодин, пиностробин, галангин, рейн, диосметин, гесперетин, морин, эллаговая кислота, рамнетин, урсоловая кислота, 18β-глицирретиновая кислота, нарингин, глицирризин | [4] |
| 70%-ный метанол | Нагрев до 70°С | ВЭЖХ–ДМД | Апигенин-7-О-(4"-ацетил)-глюкозид, апигенин-7-О-(3"-ацетил)-глюкозид, апигенин-7-О-(6"-ацетил)-глюкозид, лютеолин, апигенин, эвпатолитин, хризоспленол D, хризосплентин | [10] | |
| 80%-ный метанол | Встряхивание 30 мин, выдерживание в течение 5 дней в темноте | УВЭЖХ–МС/МС | Хлорогеновая кислота, кофейная кислота, умбеллиферон, кверцетин-3-глюкозид, рутин, апигенин-7-глюкозид, кверцитрин, кверцетин, лютеолин, кемпферол, апигенин, изорамнетин | [14] | |
| Настой | Вода | Выдерживание в течение 10–15 мин | ВЭЖХ–МС/МС | Лютеолин, рутин, гесперидин, гесперетин, апигенин, p-гидроксибензойная кислота, галловая кислота, кофейная кислота, p-кумаровая кислота, хлорогеновая кислота | [16] |
| Вода | Выдерживание в течение 10 мин | ВЭЖХ–МС/МС | Апигенин, лютеолин, гесперетин, рутин | [20] | |
| Вода | Выдерживание в течение 3–40 мин | ВЭЖХ–ДМД–МС/МС | Неохлорогеновая кислота, хлорогеновая кислота, криптохлорогеновая кислота, глюкозиды феруловой кислоты, галактозид кверцетина, глюкозид кверцетина, глюкозид лютеолина, 3,4-дикаффеоилхинная кислота, 3,5-дикаффеоилхинная кислота, 4,5-дикаффеоилхинная кислота, ацетилглюкозид апигенина, глюкозид апигенина | [21] | |
| УЗЭ | 70%-ный этанол | Выдерживание в течение 40 мин | УВЭЖХ-ДМД-МС/МС | Апигенин-7-О-глюкозид, фенилэтиловый эфир кофейной кислоты, катехин, галловая кислота, димер проантоцианидина, глюкозид феруловой кислоты, 5-О-ферулоилхиновая кислота, хлорогеновая кислота, лютеолин, эпикатехин, лютеолин-7-О-глюкозид, кофеоил-гексозид-метилглутарат, кверцетин-3-глюкозид, 3-р-кумароилхиновая кислота, пеларгонидин-сукциниларабинозид или пеларгонидин-малонилрамнозид, р-кумароил-гексозидме-тилглутарат, апигенин, дикаффеолихиновая кислота, пинобанксин-3-О-бутират, гиперфирин, апигенин-О-глюкуронид, адгиперфирин | [11] |
| 100%-ный метанол | Выдерживание в течение 30 мин при 40°С | УВЭЖХ-МС | Хлорогеновая кислота, (Z)-2-β-D-глюкопиранозилокси-4-метоксикоричная кислота, кверцетагетин-7-β-D-глюкопиранозид, кверцетин-глюкозид, (E)-2-β-D-глюкопиранозилокси-4-метоксикоричная кислота, лютеолин-7-О-β-D-глюкозид, патулетин-7-О-глюкозид, апигенин-7-О-глюкозид, ацетил-глюкозид апигенина, герниарин, апигенин, хризоспленетин, ен-ин-дициклоэфир | [25] | |
| УЗЭ | 80%-ный этанол | Выдерживание
в течение 30 мин при 40°С |
ВЭЖХ-МС/МС | Протокатехиновая, гентизиновая, 4-ОН-бензойная кислота, ванильная, кофейная, сирингиновая, р-кумаровая, салициловая, феруловая, синаптическая, розмариновая кислоты, рутин, гиперозид, изокверцетин, кемпферол-3-рутинозид, астрагалин, апигенин-7-глюкозид | [22] |
| МВЭ | 70%-ный этанол | Выдерживание в течение 40 мин, 480 Вт, 70°С | УВЭЖХ-ДМД-МС/МС | Апигенин-7-О-глюкозид, фенилэтиловый эфир кофейной кислоты, катехин, галловая кислота, димер проантоцианидина, глюкозид феруловой кислоты, 5-О-ферулоилхиновая кислота, хлорогеновая кислота, лютеолин, эпикатехин, лютеолин-7-О-глюкозид, кофеоил-гексозид-метилглутарат, кверцетин-3-глюкозид, 3-р-кумароилхиновая кислота, пеларгонидин-сукциниларабинозид или пеларгонидин-малонилрамнозид, р-кумароил-гексозидметилглутарат, апигенин, дикаффеолихиновая кислота, пинобанксин-3-О-бутират, гиперфирин, апигенин-О-глюкуронид, адгиперфирин | [11] |
| СКЭ | Вода | Выдерживание в течение 40 мин при 1.6 бар, 200°С | УВЭЖХ-ДМД-МС/МС | Апигенин-7-О-глюкозид, фенилэтиловый эфир кофейной кислоты, катехин, галловая кислота, димер проантоцианидина, глюкозид феруловой кислоты, 5-О-ферулоилхиновая кислота, хлорогеновая кислота, лютеолин, эпикатехин, лютеолин-7-О-глюкозид, кофеоил-гексозид-метилглутарат, кверцетин-3-глюкозид, 3-р-кумароилхиновая кислота, пеларгонидин-сукциниларабинозид или пеларгонидин-малонилрамнозид, р-кумароил-гексозидметилглутарат, апигенин, дикаффеолихиновая кислота, пинобанксин-3-О-бутират, гиперфирин, апигенин-О-глюкуронид, адгиперфирин | [11] |
| Вода | Выдерживание при 5 МПа, 200°С, дериватизация с БСТФА | ГХ-МС | Лютеолин, 3,5,7-флавонол, 2-фенилэтанол, 4-фенилбутан-2-ол, изоэугенол, инозит, метоксибензол, 3-гидроксибутилбензол, гидроксиметилбензол, гидроксиэтилбензол, р-крезол, 2-гидрокси-4-метоксиацетофенон, 4-гидроксиацетофенон, умбеллиферон, 6,7-гидроксикумарин, β-D-глюкопиранозид, масляная, бензойная, фенилуксусная, валериановая, винилиновая, пропионовая, винная, 4-гидроксибензойная, гидроксимасляная, 2-гидроксиизогексановая, р‑гидроксикоричная, каприловая, каприновая, 2-кетовалериановая, кофейная, лимонная, линолевая, миристиновая, молочная, малоновая, олеиновая, пальмитиновая, пеларгоновая, протокатехиновая, себациновая, стеариновая, янтарная, тетроническая, феруловая, фумаровая, хиновая, этилмалоновая кислоты и др., 2,2-диметилсукцинат, этилинолеат, этилолеат, этилпальмитат, углеводороды | [24] |
Обозначения: УЗЭ – ультразвуковая экстракция; МВЭ – микроволновая экстракция; СКЭ – экстракция при повышенных температуре и давлении (субкритическая экстракция); БСТФА – N,O-бис(триметилсилил)трифторацетамид; ВЭЖХ-МС/МС – высокоэффективная жидкостная хроматография с тандемным масс-спектрометрическим детектированием; УВЭЖХ-МС/МС – ультра высокоэффективная жидкостная хроматография с тандемным масс-спектрометрическим детектированием; В-ЭЖХ-ДМД-МС/МС – высокоэффективная жидкостная хроматография с диодно-матричным и тандемным масс-спектрометрическим детектированием; УВЭЖХ-ДМД-МС/МС – ультра высокоэффективная жидкостная хроматография с диодно-матричным и тандемным масс-спектрометрическим детектированием; ГХ-МС – газовая хромато-масс-спектрометрия.
Целью данной работы является хроматографическая оценка индивидуального и суммарного содержания фенольных соединений в водных и водно-спиртовых экстрактах в условиях различных способов извлечения из ромашки аптечной (Matricаria chamomilla L.).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растительный материал. Объекты исследования – цветки ромашки аптечной (Matricаria chamomilla L.) производителя “Родные травы” (республика Адыгея, партия 250321); цветки ромашки (Chamomillae flores) торговых марок “ФармаЦвет” (Московская обл., Красногорск, партия 210820), “Грин Сайд” (Алтайский край, Барнаул, партия 02) и “Фитофарм” (Краснодарский край, Анапа, серия 010215). Также осуществляли сбор ромашки в стадии цветения на территории г. Краснодара (Краснодарский край). Растительное сырье предварительно измельчали и просеивали, выделяя фракции размером 0.5–1.0 мм, затем растительный материал усредняли путем перемешивания [8].
Реактивы и стандартные образцы. Использовали ацетонитрил (HPLC-S, Biosolve BV, Нидерланды), муравьиную кислоту (85%, ЛенРеактив, Россия), этанол (ректифицированный, высшей очистки) и метанол х.ч. (Вектон, Россия). Деионизованную воду с удельным сопротивлением 18.2 МОм⋅см (25°С) получали на установке Milli-Q-UV (Millipore, Франция).
Для идентификации аналитов использовали стандартные образцы хлорогеновой кислоты, лютеолин-7-О-гликозида, транс-феруловой кислоты, цикориевой кислоты и апигенина (Sigma-Aldrich, Германия).
Экстракция фенольных компонентов из ромашки аптечной. Извлечение фенольных соединений из ромашки аптечной проводили с учетом рекомендаций Государственной Фармакопеи РФ (ГФ) [8], традиционными и современными способами с интенсификацией процесса ультразвуком и микроволновым излучением, а также при повышенных давлении и температуре.
Для извлечения ФС из ромашки аптечной рекомендованным ГФ методом навеску пробы (1.0000 г) помещали в колбу со шлифом емк. 250 мл, прибавляли 70%-ный этанол (100 мл). Колбу с содержимым присоединяли к обратному холодильнику, нагревали на кипящей водяной бане в течение 45 мин, периодически встряхивая. Затем колбу с экстрактом охлаждали до комнатной температуры, фильтровали раствор через вату в мерную колбу емк. 100 мл, объем раствора доводили до метки 70%-ным этанолом. Перед хроматографическим анализом полученный экстракт фильтровали через фильтр с диаметром пор 45 мкм.
Для экстракции ФС мацерацией из ромашки аптечной навеску пробы (1.0000 г) помещали в коническую колбу со шлифом емк. 250 мл, добавляли растворитель (100 мл) и оставляли отстаиваться при комнатной температуре. В качестве растворителя использовали 70%-ный этанол. Перед хроматографическим анализом полученный экстракт фильтровали через фильтр с диаметром пор 45 мкм.
Для извлечения ФС ромашки аптечной также готовили настой. Для этого навеску измельченной пробы (0.5000 г) помещали в коническую колбу с притертой пробкой объемом 100 мл и заливали деионизованной водой (25 мл) при ~95°С. Перед хроматографическим анализом полученный экстракт фильтровали через фильтр с диаметром пор 45 мкм.
Для проведения ультразвуковой экстракции (УЗЭ) ФС из ромашки аптечной навеску сухой измельченной пробы (0.5000 г) помещали в коническую колбу с притертой пробкой объемом 100 мл. В качестве растворителя использовали водно-спиртовые смеси разного состава (25 мл). Экстракция проходила в ультразвуковой ванне УЗВ–4.0/1 ТТЦ (Сапфир, Россия) с частотой ультразвукового излучения 35 кГц в течение 30 мин. После фильтрования через вату в мерную колбу емк. 25 мл объем раствора доводили до метки растворителем. Перед хроматографическим анализом полученный экстракт фильтровали через фильтр с диаметром пор 45 мкм.
Микроволновую экстракцию (МВЭ) ФС из ромашки аптечной проводили с использованием микроволновой системы ETHOS EX (Milestone, Италия). Навеску сухой измельченной пробы (0.5000 г) помещали в ячейку-экстрактор, куда добавляли растворитель (25 мл). В качестве растворителя использовали водно-спиртовые смеси различного состава. Продолжительность экстракции составляла 30 мин при мощности микроволнового излучения 300 Вт и температуре 75°С. Далее экстракт фильтровали через вату в мерную колбу емк. 25 мл и доводили объем раствора до метки растворителем. Перед хроматографическим анализом экстракт пропускали через фильтр с диаметром пор 45 мкм.
Экстракцию ФС из ромашки аптечной в динамических условиях при повышенных температуре и давлении (субкритическая экстракция, СКЭ) проводили на экспериментальной установке, подробно описанной в работе [26]. Экстрагент (деионизованная вода/водно-спиртовые смеси) подавали насосом от жидкостного хроматографа LC20AD (Shimadzu, Япония), в качестве ячейки-экстрактора использовали стальной корпус хроматографической колонки размером 150 × 4.6 мм, которую подключали к установке двумя стальными капиллярами. Для предотвращения закипания экстрагента и поддержания требуемого давления в системе использовали ограничитель давления P-455 (Upchurch Scientific, США). Высушенную и измельченную навеску пробы (0.2000 г) помещали в ячейку-экстрактор в печи термостата. Экстрагент предварительно продували азотом для удаления растворенного кислорода и с помощью насоса заполняли им систему. Затем останавливали поток экстрагента и включали нагрев термостата. По достижении термостатом заданной температуры выдерживали систему в течение 10 мин при постоянной температуре и остановленном потоке экстрагента, после чего его подавали в систему со скоростью 1 мл/мин. Давление в системе по показаниям манометра насоса составляло 80–150 атм. На выходе собирали 10 мл экстракта в стеклянные емкости. Перед хроматографическим анализом экстракт пропускали через фильтр с диаметром пор 45 мкм.
ВЭЖХ-определение фенольных соединений с диодно-матричным и масс-спектрометрическим детектированием в экстрактах ромашки аптечной. ВЭЖХ-определение ФС в полученных экстрактах проводили на хроматографе LC-20 Prominence (Shimadzu, Япония), состоящем из дегазатора DGU-20A5, насоса LC20AD, автоматического дозатора SIL-20A, термостата колонок CTO-20AC, спектрофотометрического детектора на основе диодной матрицы SPD-M20A, масс-спектрометрического детектора LCMS2010EV. Фенольные соединения разделяли на хроматографической колонке Luna C18 100А, 250 × 2.0 мм, 5 мкм (Phenomenex, США) с предколонкой C18 4 × 2.0 мм, 5 мкм (Phenomenex, США) в режиме градиентного элюирования. Подвижной фазой являлась смесь ацетонитрил (А)–0.1%-ная муравьиная кислота (В): 0.01–2 мин от 95 до 90% В, 2–10 мин от 90 до 80% В, 10–18 мин от 80 до 70% В, 18–28 мин от 70 до 10% В, 28–30 мин 10% В, 30–31 мин от 10 до 95% В. Скорость потока подвижной фазы составляла 0.40 мл/мин при температуре термостата колонки 40°С и объеме вводимой пробы 5 мкл. Спектрофотометрическое детектирование на диодно-матричном детекторе осуществляли в диапазоне длин волн 190–800 нм. При МС-детектировании веществ применяли ионизацию электрораспылением: напряжение интерфейса – 3.5 кВ, напряжение на скимере – 1.5 В, температура ионного источника – 180°C, скорость потока азота – 1.5 л/мин, скорость сканирования масс-спектра 2000 а.е.м./с, диапазон сканируемых масс 120–700 m/z. Анализ проводили в режиме отрицательной ионизации. Сбор и последующую обработку первичных данных осуществляли с помощью программного обеспечения LCMS Solution (Shimadzu, Япония).
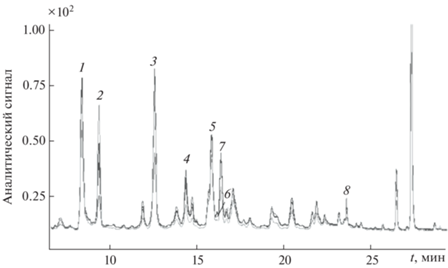
Фенольные соединения идентифицировали сопоставлением времен удерживания, спектров поглощения и масс-спектров с аналогичными характеристиками стандартов индивидуальных соединений, приведенными в литературе (табл. 2). Пример хроматограммы водно-спиртового экстракта ромашки аптечной, полученного по методике Фармакопеи РФ, в оптимальных условиях хроматографирования представлен на рис. 1.
Таблица 2.
Параметры ВЭЖХ-определения фенольных соединений с диодно-матричным и масс-спектрометрическим детектированием в водно-этанольных экстрактах цветов ромашки аптечной
| Соединение | tR, мин* | λmах, нм* | m/z |
|---|---|---|---|
| Хлорогеновая кислота (стандарт) | 8.3 | 327 | 353 |
| Гликозид феруловой кислоты I ([21, 27]) | 9.3 | 300 | 355 |
| Гликозид феруловой кислоты II ([21, 27]) | 12.6 | 300 | 355 |
| Лютеолин-7-О-глюкозид (стандарт) | 14.3 | 345 | 447 |
| Дикофеилхинная кислота ([21]) | 15.9 | 327 | 515 |
| Цикориевая кислота (стандарт) | 16.2 | 327 | 473 |
| Апигенин-7-глюкозид ([21, 27]) | 16.4 | 268; 333 | 431 |
| Апигенин (стандарт) | 23.2 | 268; 327 | 269 |
Рис. 1.
ВЭЖХ-хроматограмма этанольного экстракта цветов ромашки аптечной, полученного по методике Фармакопеи РФ, в режиме диодно-матричного и масс-спектрометрического детектирования: 1 – хлорогеновая кислота, 2 – гликозид феруловой кислоты I, 3 – гликозид феруловой кислоты II, 4 – лютеолин-7-О-глюкозид, 5 – дикофеилхинная кислота, 6 – цикориевая кислота, 7 – апигенин-7-глюкозид, 8 – апигенин.
При оценке содержания ФС в экстрактах ромашки аптечной использовали рассчитанные метрологические характеристики (табл. 3). Для всех соединений получили градуировочные зависимости, диапазоны линейности, пределы определения и обнаружения с использованием соответствующих стандартных образцов в 70%-ном этаноле. Все градуировочные кривые строили по данным шести параллельных измерений; в каждом случае проводили не менее трех параллельных определений одной концентрации раствора ФС. Содержание гликозидов феруловой кислоты в сырье определяли по градуировочной зависимости, полученной для феруловой кислоты, умножая на отношение молекулярной массы аналита к молекулярной массе феруловой кислоты ввиду их структурного подобия и схожести коэффициентов поглощения [28]. Аналогично рассчитывали содержание дикофеилхинной кислоты по градуировочной зависимости цикориевой кислоты, апигенин-7-глюкозида – по апигенину.
Таблица 3.
Метрологические характеристики методики определения фенольных соединений в экстрактах ромашки аптечной методом ВЭЖХ с диодно-матричным и масс-спектрометрическим детектированием
| Фенольное соединение | Уравнение регрессии | R2 | Диапазон линейности, мкг/мл | смин, мкг/мл* | сн, мкг/мл |
|---|---|---|---|---|---|
| Хлорогеновая кислота | y = (33100 ± 100)x | 0.9996 | 0.3–100 | 0.10 | 0.3 |
| Лютеолин-7-О-глюкозид | y = (36200 ± 200)x | 0.9994 | 0.1–100 | 0.03 | 0.10 |
| Цикориевая кислота | y = (30200 ± 100)x | 0.9995 | 0.3–200 | 0.10 | 0.3 |
| Апигенин | y = (51900 ± 600)x | 0.9999 | 1–100 | 0.4 | 1.0 |
| Феруловая кислота | y = (48300 ± 700)x | 0.9998 | 0.1–50 | 0.02 | 0.10 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
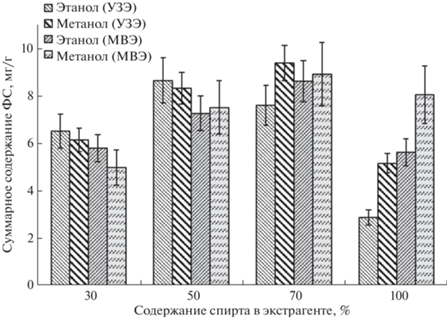
Оптимальный состав растворителя для экстракции фенольных соединений из цветов ромашки аптечной. Правильный выбор растворителя позволяет повысить эффективность извлечения ФС из ромашки аптечной. Учитывая накопленный опыт [26, 29] и литературные данные [30], сравнили эффективность извлечения фенольных соединений из ромашки аптечной при УЗЭ и МВЭ с использованием водно-этанольных и водно-метанольных смесей с различной концентрацией спирта (30, 50, 70 и 100%, по объему). Эффективность извлечения компонентов оценивали по суммарному содержанию ФС: лютеолин-7-О-глюкозида, гликозидов феруловой кислоты, апигенин-7-глюкозида, апигенина, хлорогеновой, дикофеилхинной и цикориевой кислот (рис. 2). Из полученных диаграмм видно, что эффективность 70%-ных водно-метанольной и водно-этанольной смесей при извлечении суммы ФС из растительного материала способами УЗЭ и МВЭ сопоставима. С другой стороны, 70%-ный этанол – более экологичный растворитель и перспективен для дальнейшего практического использования в медицинской практике, поэтому его выбрали для дальнейших исследований.
Рис. 2.
Суммарное содержание фенольных соединений в экстрактах ромашки аптечной, полученных под воздействием ультразвука и микроволнового излучения.
Эффективность экстракции фенольных соединений из ромашки аптечной различными способами. Изучали и сравнивали различные способы экстракции компонентов: экстракцию по Государственной Фармакопее РФ [8], мацерацию, настаивание, ультразвуковую, микроволновую и субкритическую экстракцию. Параметры каждого из способов экстракции оптимизировали по суммарному содержанию ФС в экстрактах ромашки.
Для определения оптимального времени экстрагирования строили зависимости суммарного содержания ФС от времени проведения мацерации, настаивания и УЗЭ (рис. 3). В качестве экс-трагентов для мацерации и УЗЭ использова-ли 70%-ный этанол, а для экстракции настаиванием – свежекипяченую деионизованную воду. Для построения кинетической кривой извлечения ФС из ромашки различными способами отбирали аликвоты экстракта объемом 1 мл через заданный промежуток времени.
Рис. 3.
Зависимость суммарного содержания фенольных соединений в экстракте ромашки аптечной от времени мацерации (а), настаивания (б) и воздействия ультразвука (в).
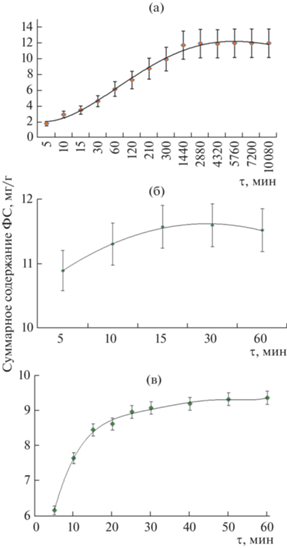
Суммарная концентрация ФС в экстракте мацерацией достигала максимальных значений в течение 1440 мин (24 ч) и далее оставалась неизменной (рис. 3а). В случае извлечения аналитов настаиванием (рис. 3б), концентрации соединений при экстрагировании сырья в течение свыше 15 мин не менялись. Более продолжительное время экстракции данным способом способствовало деградации некоторых фенольных соединений, например, лютеолин-7-О-глюкозида и дикофеилхинной кислоты. При настаивании практически не извлекается апигенин, так как агликоны флавоноидов нерастворимы в воде [31, 32]. Кинетическая кривая УЗЭ аналитов из ромашки аптечной (рис. 3в) позволила установить, что суммарное содержание ФС достигает максимальных значений (9.1 ± 0.1 мг/г) при экстракции в течение 30 мин непрерывного воздействия ультразвуком.
Субкритическая экстракция широко используется для извлечения различных классов соединений, в том числе фенольных, из лекарственного растительного сырья. При этом на эффективность извлечения компонентов влияют температура и состав используемого экстрагента. Для установления оптимальных значений данных параметров исследовали зависимость суммарного содержания ФС в экстракте ромашки от температуры СКЭ с использованием различных экстрагентов (рис. 4). В качестве экстрагентов использовали деионизованную воду [11, 24], 50 и 70%-ный этанол [24]. Температуру варьировали в диапазоне 100–165°С с шагом в 15°С. Эффективность субкритического способа экстракции для извлечения ФС также оценивали по суммарному содержанию ФС в экстракте. Как известно [11, 24], применение воды и 70%-ной водно-этанольной смеси в качестве экстрагентов для СКЭ ФС различных классов из растительного материала достаточно эффективно. При 120°С эффективность извлечения суммы аналитов водой и 70%-ным этанолом максимальна (6.6 ± 0.2 и 11.7 ± 0.3 мг/г соответственно), но дальнейшее ее повышение приводит к снижению концентрации ФС, что обусловлено их термической деградацией (рис. 4). С учетом полученной зависимости можно заключить, что оптимальная температура СКЭ ФС из ромашки аптечной деионизованной водой и 70%-ным этиловым спиртом составляет 120°С.
Рис. 4.
Зависимость суммарного содержания фенольных соединений в экстракте ромашки аптечной от температуры субкритической экстракции различными экстрагентами.
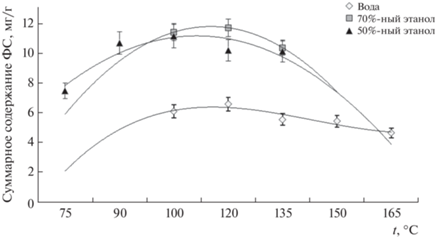
По данным [24], использование 50%-ного этанола в качестве экстрагента для СКЭ ФС из ромашки аптечной считается предпочтительным. В связи с этим изучили зависимость суммарного содержания ФС ромашки аптечной от температуры СКЭ 50%-ным этанолом. Полученные зависимости показывают целесообразность проведения СКЭ при более низких температурах (рис. 4). Строили зависимость суммарного содержания ФС от температуры в диапазоне от 75 до 135°С. Наибольшая суммарная концентрация ФС (11.1 ± ± 0.7 мг/г) в экстракте наблюдается при 100°С. Отметим, что эффективность извлечения ФС СКЭ 70%-ным этанолом при 120°С и 50%-ным этанолом при 100°С сопоставима.
Содержания ФС в экстрактах ромашки аптечной, полученные в оптимальных условиях для различных способов экстракции, представлены в табл. 4. Можно отметить, что выбор способа экстракции неоднозначен, и во многом он определяется поставленными задачами. Тем не менее отметим ряд отличий. Использование МВЭ для экстракции ФС малоэффективно, так как концентрации хлорогеновой кислоты и гликозидов феруловой кислоты имеют наименьшие значения, что, вероятно, связано с их деградацией под действием температуры и микроволнового излучения.
Таблица 4.
Концентрации (мг/г) некоторых индивидуальных фенольных соединений и их суммарное содержание в экстрактах ромашки аптечной, полученных различными способами (n = 3, P = 0.95)
| Соединение | Фармакопея РФ | Мацерация | Настаива-ние | УЗЭ | МВЭ | СКЭ |
|---|---|---|---|---|---|---|
| Хлорогеновая кислота | 2.4 ± 0.1 | 2.4 ± 0.1 | 2.5 ± 0.2 | 2.0 ± 0.1 | 1.8 ± 0.4 | 2.3 ± 0.3 |
| Гликозид феруловой кислоты I | 2.2 ± 0.1 | 2.5 ± 0.1 | 2.55 ± 0.04 | 2.2 ± 0.3 | 1.68 ± 0.02 | 2.4 ± 0.2 |
| Гликозид феруловой кислоты II | 2.7 ± 0.1 | 3.0 ± 0.1 | 2.94 ± 0.03 | 2.5 ± 0.2 | 2.2 ± 0.4 | 2.9 ± 0.1 |
| Лютеолин-7-О-глюкозид | 0.80 ± 0.03 | 0.83 ± 0.01 | 0.52 ± 0.05 | 0.64 ± 0.05 | 0.6 ± 0.1 | 0.83 ± 0.03 |
| Дикофеилхинная кислота | 1.7 ± 0.1 | 1.8 ± 0.1 | 1.6 ± 0.1 | 1.2 ± 0.3 | 1.3 ± 0.2 | 1.5 ± 0.1 |
| Цикориевая кислота | 0.140 ± 0.003 | 0.14 ± 0.02 | 0.18 ± 0.02 | 0.12 ± 0.01 | 0.11 ± 0.02 | 0.102 ± 0.005 |
| Апигенин-7-глюкозид | 1.0 ± 0.1 | 1.0 ± 0.1 | 0.80 ± 0.04 | 0.8 ± 0.1 | 0.8 ± 0.2 | 1.1 ± 0.1 |
| Апигенин | 0.07 ± 0.01 | 0.08 ± 0.01 | 0.013 ± 0.003 | 0.02 ± 0.01 | 0.05 ± 0.02 | 0.051 ± 0.004 |
| Суммарное содержание ФС | 11.0 ± 0.5 | 11.7 ± 0.7 | 11.1 ± 0.3 | 9.4 ± 0.9 | 8.6 ± 0.1 | 11.1 ± 0.9 |
Сравнительный анализ способов извлечения (ГФ, мацерация, настаивание и СКЭ) по суммарному содержанию ФС показывает, что по своей эффективности они сопоставимы. Эффективность извлечения выбранных компонентов свежекипяченой деионизованной водой при настаивании оказалась сопоставима со способами, в которых в качестве экстрагентов использовали водно-спиртовые растворы. Однако, как отмечено ранее, водные системы не извлекают агликоны флавоноидов – достаточно ценные соединения, и это значительно снижает перспективность практического использования такой процедуры для экстракции ФС из ромашки аптечной. Содержания компонентов, полученных при мацерации и настаивании различными растворителями, сопоставимы, несмотря на схожий процесс их осуществления (табл. 4).
Суммарное содержание извлеченных при УЗЭ ФС несколько выше, чем при МВЭ, и ниже, чем при других способах экстракции (табл. 4). Однако процедура УЗЭ более экспрессна и позволяет оперативно проводить предварительный скрининг и идентификацию ФС, характерных для экстрактов ромашки аптечной.
Анализ экстрактов цветов ромашки аптечной различных торговых марок. Данные о качественном и количественном составе растительного материала используют при установлении качества выпускаемой продукции. Однако содержание активных компонентов в ромашке аптечной в значительной степени может зависеть от географических особенностей произрастания лекарственного растительного сырья, условий выращивания и хранения [21, 27]. В табл. 5 приведены содержания ФС в полученных при УЗЭ экстрактах образцов ромашки аптечной различных производителей, а также в собранном самостоятельно на территории г. Краснодара образце.
Таблица 5.
Концентрации (мг/г) некоторых индивидуальных фенольных соединений и их суммарное содержание в водно-этанольных экстрактах образцов ромашки аптечной различных производителей, полученных ультразвуковой экстракцией (n = 3, P = 0.95)
| Соединение | Самостоятельный сбор на территории г. Краснодар | ФармаЦвет | Грин Сайд | Фитофарм | Родные травы |
|---|---|---|---|---|---|
| Хлорогеновая кислота | 1.50 ± 0.05 | 1.0 ± 0.2 | 0.50 ± 0.03 | 0.37 ± 0.02 | 2.0 ± 0.1 |
| Гликозид феруловой кислоты I | 0.017 ± 0.001 | 2.791 ± 0.008 | 1.804 ± 0.003 | 1.8 ± 0.3 | 2.2 ± 0.3 |
| Гликозид феруловой кислоты II | 0.017 ± 0.002 | 3.09 ± 0.07 | 1.83 ± 0.03 | 1.8 ± 0.2 | 2.5 ± 0.2 |
| Лютеолин-7-О-глюкозид | 0.258 ± 0.008 | 0.53 ± 0.08 | 0.369 ± 0.004 | 0.36 ± 0.05 | 0.64 ± 0.05 |
| Дикофеилхинная кислота | 12.0 ± 0.4 | 0.80 ± 0.10 | 0.488 ± 0.007 | 0.46 ± 0.04 | 1.2 ± 0.3 |
| Цикориевая кислота | 0.38 ± 0.04 | 0.051 ± 0.007 | 0.057 ± 0.004 | 0.077 ± 0.005 | 0.12 ± 0.01 |
| Апигенин-7-глюкозид | 0.21 ± 0.02 | 1.70 ± 0.10 | 0.61 ± 0.02 | 0.6 ± 0.1 | 0.8 ± 0.1 |
| Апигенин | 0.46 ± 0.04 | 0.05 ± 0.03 | 0.040 ± 0.002 | 0.050 ± 0.007 | 0.02 ± 0.01 |
| Суммарное содержание ФС | 14.9 ± 0.5 | 10.1 ± 0.4 | 5.7 ± 0.1 | 5.6 ± 0.6 | 9.4 ± 0.9 |
Содержания ФС в образцах торговых марок “Грин Сайд” и “Фитофарм” близки между собой как по концентрациям индивидуальных соединений, так и по суммарному содержанию аналитов. Такое сходство, вероятно, связано с использованием одного и того же растительного материала со схожими климатическими условиями его выращивания. Отметим высокое содержание хлорогеновой (2.0 ± 0.1 мг/г), дикофеилхинной (1.2 ± ± 0.3 мг/г) и цикориевой кислот (0.12 ± 0.01 мг/г), а также лютеолин-7-О-глюкозида (0.64 ± 0.05 мг/г) в экстракте образца “Родные травы” по сравнению с экстрактами ромашки аптечной других компаний.
Содержания ФС в экстрактах ромашки аптечной из полученного при самостоятельном сборе растительного материала сильно отличаются от их концентраций в других образцах. Показатель суммы ФС в данном образце (14.9 ± 0.5 мг/г) определяет дикофеилхинная кислота (12.0 ± 0.4 мг/г). В других образцах максимальное содержание ФС определяется концентрациями гликозидов феруловой кислоты (около 60%), что согласуется с данными [21, 27]. Кроме этого, содержание апигенина и цикориевой кислоты в образце, собранном на территории г. Краснодара, на порядок выше, чем в других образцах. Вероятно, что данный образец содержал ромашку других видов [27], однако это требует дальнейших исследований и подтверждения.
* * *
Изучены содержания нативных форм некоторых ФС в водных и водно-спиртовых экстрактах цветов ромашки аптечной (Matricаria chamomilla L.), полученных мацерацией, настаиванием, ультразвуковым, микроволновым, фармакопейным и субкритическим способами. Эффективность применения всех рассмотренных способов экстракции, за исключением ультразвуковой экстракции, по суммарному извлечению фенольных соединений из растительного сырья сопоставима. Определены суммарные содержания и концентрации индивидуальных фенольных соединений в экстрактах цветов ромашки аптечной различных производителей. Максимальное суммарное содержание фенольных соединений (10.1 мг/г) наблюдали в экстракте ромашки аптечной торговой марки “ФармаЦвет”.
Работа выполнена в рамках Госзадания Минобрнауки РФ (проект № FZEN-2020-0022) с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Oniszczuk A., Olech M., Oniszczuk T., Wójtowicz A., Krawczyk W. Puffed cereals with added chamomile – Quantitative analysis of polyphenols and optimization of their extraction method // Ann. Agric. Environ. Med. 2017. V. 24. № 2. P. 222. https://doi.org/10.5604/12321966.1233564
Berechet M. Manaila E., Stelescu M., Crăciun G. The composition of essential oils obtained from Achillea millefolium and Matricaria chamomilla L., originary from Romania // Rev. Chim. 2018. V. 68. № 12. P. 2787. https://doi.org/10.37358/rc.17.12.5979
Chau C.-F., Wu S.-H. The development of regulations of Chinese herbal medicines for both medicinal and food uses // Trends Food Sci Technol. 2006. V. 17. № 6. P. 313. https://doi.org/10.1016/j.tifs.2005.12.005
Šibul F., Orčić D., Berežni S., Anačkov G., Mimica–Dukić N. HPLC–MS/MS profiling of wild-growing scentless chamomile // Acta Chromatogr. 2020. V. 32. № 2. P. 86. https://doi.org/10.1556/1326.2019.00546
Singh O. Khanam Z., Misra N., Srivastava M. Chamomile (Matricaria chamomilla L.): An overview // Pharmacogn. Rev. 2011. V. 5. № 9. P. 82. https://doi.org/10.4103/0973-7847.79103
Srivastava J.K., Shankar E., Gupta S. Chamomile: A herbal medicine of the past with a bright future (Review) // Mol. Med. Rep. 2010. V. 3. № 6. P. 895. https://doi.org/10.3892/mmr.2010.377
Тараховский Ю.С, Ким Ю.А., Абдрасилов Б.С., Музафаров Е.Н. Флавоноиды: биохимия, биофизика, медицина. Пущино: Sуnchrobook, 2013. 310 с.
Государственная Фармакопея Российской Федерации. Изд. 14. М., 2018. Т. 4. С. 6394.
Bączek K.B., Wiśniewska M., Przybył J., Kosakowska O., Węglarz Z. Arbuscular mycorrhizal fungi in chamomile (Matricaria recutita L.) organic cultivation // Ind. Crops Prod. 2019. V. 140. P. 1. https://doi.org/10.1016/j.indcrop.2019.111562
Xie X.-Y., Chen F.-F., Shi Y.-P. Simultaneous determination of eight flavonoids in the flowers of Matricaria chamomilla by high performance liquid chromatography // J. AOAC Int. 2014. V. 97. № 3. P. 778. https://doi.org/10.5740/jaoacint.13-029
Cvetanović A., Švarc-Gajić J., Mašković P., Savić S., Nikolić L. Antioxidant and biological activity of chamomile extracts obtained by different techniques: Perspective of using superheated water for isolation of biologically active compounds // Ind. Crops Prod. 2015. V. 65. P. 582. https://doi.org/10.1016/j.indcrop.2014.09.044
Mulinacci N., Romani A., Pinelli P., Vincieri F.F., Prucher D. Characterization of Matricaria recutita L. flower extracts by HPLC-MS and HPLC-DAD analysis // Chromatographia. 2000. V. 51. № 5–6. P. 301. https://doi.org/10.1007/BF02490607
Ajila C.M., Brar S.K., Verma M., Tyagi R., Godbout S., Valéro J. Extraction and analysis of polyphenols: Recent trends // Crit. Rev. Biotechnol. 2011. V. 31. № 3. P. 227. https://doi.org/10.3109/07388551.2010.513677
Nováková L., Vildová A., Mateus J.P., Gonçalves T., Solich P. Development and application of UHPLC–MS/MS method for the determination of phenolic compounds in Chamomile flowers and Chamomile tea extracts // Talanta. 2010. V. 82. № 4. P. 1271. https://doi.org/10.1016/j.talanta.2010.06.057
Valduga A.T., Gonçalves I.L., Magri E., Delalibera Finzer J.R. Chemistry, pharmacology and new trends in traditional functional and medicinal beverages // Food Res. Int. 2019. V. 120. P. 478. https://doi.org/10.1016/j.foodres.2018.10.091
Sentkowska A., Biesaga M., Pyrzynska K. Effects of brewing process on phenolic compounds and antioxidant activity of herbs // Food Sci. Biotechnol. 2016. V. 25. № 4. P. 965. https://doi.org/10.1007/s10068-016-0157-9
Maschi O., Cero E.D., Galli G.V., Caruso D., Bosisio E., Dell’Agli M. Inhibition of human cAMP-phosphodiesterase as a mechanism of the spasmolytic effect of Matricaria recutita L. // J. Agric. Food Chem. 2008. V. 56. № 13. P. 5015. https://doi.org/10.1021/jf800051n
Kassi E., Papoutsi Z., Fokialakis N., Messari I., Mitakou S., Moutsatsou P. Greek plant extracts exhibit selective estrogen receptor modulator (SERM)-like properties // J. Agric. Food Chem. 2004. V. 52. № 23. P. 6956. https://doi.org/10.1021/jf0400765
Macchioni F., Perrucci S., Cecchi F., Cioni P.L., Morelli I., Pampiglione S. Acaricidal activity of aqueous extracts of camomile flowers, Matricaria chamomilla, against the mite Psoroptes cuniculi // Med. Vet. Entomol. 2004. V. 18. № 2. P. 205. https://doi.org/10.1111/j.0269-283X.2004.00488.x
Sentkowska A., Biesaga M., Pyrzynska K. Retention study of flavonoids under different chromatographic modes // J. Chromatogr. Sci. 2016. V. 54. № 4. P. 516. https://doi.org/10.1093/chromsci/bmv174
Raal A., Orav A., Püssa T., Valner C., Malmiste B., Arak E. Content of essential oil, terpenoids and polyphenols in commercial chamomile (Chamomilla recutita L. Rauschert) teas from different countries // Food Chem. 2012. V. 131. № 2. P. 632. https://doi.org/10.1016/j.foodchem.2011.09.042
Kobayashi Y., Nakano Y., Inayama K., Sakai A., Kamiya T. Dietary intake of the flower extracts of German Chamomile (Matricaria recutita L.) inhibited compound 48/80-induced itch-scratch responses in mice // Phytomedicine. 2003. V. 10. № 8. P. 657. https://doi.org/10.1078/0944-7113-00283
Ramos M.F.S., Santos E.P., Bizarri C.H.B., Mattos H.A., Padilha M.R.S., Duarte H.M. Preliminary studies towards utilization of various plant extracts as antisolar agents // Int. J. Cosmet. Sci. 2007. V. 18. № 3. P. 87. https://doi.org/10.1111/j.1467-2494.1996.tb00140.x
Павлова Л.В., Платонов И.А., Куркин В.А., Афанасьева П.В., Новикова Е.А., Муханова И.М. Оценка эффективности извлечения биологически активных соединений экстрагентами в субкритическом состоянии из цветков ромашки аптечной (Chamomilla recutita R.), произрастающей в Самарской области// Сверхкритические флюиды: теория и практика. 2018. Т. 13. № 1. С. 16. (Pavlova L.V., Platonov I.A., Kurkin V.A., Afanasyeva P.V., Novikova E.A., Mukhanova I.M. Evaluation of the extraction efficiency of biologically active compounds from chamomile flowers (Chamomilla recutita R.) grown in the Samara region by extractants in the subcritical state // Russ. J. Phys. Chem. В. 2018. V. 12. № 8. P. 1212.) https://doi.org/10.1134/S2070205114060173
Avula B., Wang Y.-H., Isaac G., Yuk J., Wrona M., Yu K., Khan I. Metabolic profiling of Hoodia, Chamomile, Terminalia species and evaluation of commercial preparations using ultrahigh-performance liquid chromatography quadrupole-time-of-flight mass spectrometry // Planta Med. 2017. V. 83. № 16. P. 1297. https://doi.org/10.1055/s-0043-109239
Милевская В.В., Статкус М.А., Темердашев З.А., Киселева Н.В., Бутыльская Т.С., Шилько Е.А. Экстракция и определение биологически активных компонентов зверобоя и препаратов на его основе // Журн. аналит. химии. 2016. Т. 71. № 7. С. 768. (Milevskaya V.V., Temerdashev Z.A., Kiseleva N.V., Butyl’skaya T.S., Shil’ko E.A., Statkus M.A. Extraction and determination of biologically active components of St. John’s wort and its pharmaceutical preparations // J. Anal. Chem. 2016. V. 71. № 7. P. 741.) https://doi.org/10.7868/S0044450216070136
Avula B., Wang Y.-H., Wang M., Avonto C., Zhao J., Smillie T.J., Rua D., Khan I.A. Quantitative determination of phenolic compounds by UHPLC-UV–MS and use of partial least-square discriminant analysis to differentiate chemo-types of Chamomile/Chrysanthemum flower heads // J. Pharm. Biomed. Anal. 2014. V. 88. P. 278. https://doi.org/10.1016/j.jpba.2013.08.037
Сычев К.С. Методы высокоэффективной жидкостной хроматографии и твердофазной экстракции. М., 2006. С. 90.
Милевская В.В., Статкус М.А., Темердашев З.А., Киселева Н.В., Верниковская Н.А. Способы экстрагирования биологически активных веществ из лекарственных растений на примере компонентов зверобоя // Журн. аналит. химии. 2015. Т. 70. № 12. С. 1255. (Milevskaya V.V., Statkus M.A., Temerdashev Z.A., Kiseleva N.V., Vernikovskaya N.A. Methods for the extraction of biologically active substances from medicinal plants based on an example of St. John’s wort components // J. Anal. Chem. 2015. V. 70. № 12. P. 1432.) https://doi.org/10.7868/S0044450215120129
Biesaga M. Influence of extraction methods on stability of flavonoids // J. Chromatogr. A. 2011. V. 1218. № 18. P. 2505. https://doi.org/10.1016/j.chroma.2011.02.059
Карпук В.В. Фармакогнозия. Минск: БГУ, 2011. С. 65.
The Science of Flavonoids / Ed. Grotewold E. N.Y.: Springer, 2006. P. 50.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


