Журнал аналитической химии, 2023, T. 78, № 4, стр. 354-364
Применение магнитных углеродных нанокомпозитов при формировании распознающего слоя пьезоэлектрического иммуносенсора для определения пенициллина G
Е. В. Бизина a, *, О. В. Фарафонова a, Н. И. Золотарева b, С. С. Гражулене b, Т. Н. Ермолаева a
a Липецкий государственный технический университет
398055 Липецк, ул. Московская, 30, Россия
b Институт проблем технологии микроэлектроники и особо чистых материалов Российской академии наук
142432 Черноголовка, ул. Академика Осипьяна, 6, Россия
* E-mail: katarina.bizina1821@mail.ru
Поступила в редакцию 12.08.2022
После доработки 22.10.2022
Принята к публикации 24.10.2022
- EDN: KZKTKE
- DOI: 10.31857/S0044450223040060
Аннотация
Изучены условия формирования распознающего слоя пьезоэлектрического иммуносенсора на основе магнитных углеродных нанокомпозитов (МУНК) под действием внешнего магнитного поля. Установлено влияние размера и количества магнитных наночастиц (МНЧ) в композите на аналитические характеристики гравиметрического иммуносенсора. Методом сканирующей электронной микроскопии определены средние размеры магнитных наночастиц Fe3O4, синтезированных методом соосаждения. Отмечено, что минимальная масса и стабильность распознающего слоя наблюдаются для нанокомпозита, полученного при соотношении углеродных нанотрубк и МНЧ со средним диаметром 22 нм, равном 3 : 1. Методом ИК-спектрометрии установлено образование пептидных связей между МУНК и конъюгатом пенициллина G. Показано, что применение магнитных углеродных нанокомпозитов при формировании распознающего слоя позволяет существенно упростить процедуру подготовки пьезоэлектрического сенсора к анализу и сократить ее продолжительность с 24 до 1.5 ч. Диапазон определяемых концентраций антибиотика составляет 1–450 нг/мл, предел обнаружения равен 0.5 нг/мл.
Существенным преимуществом гравиметрических пьезоэлектрических иммуносенсоров является возможность прямого измерения аналитического сигнала по увеличению массы распознающего слоя при протекании гетерогенной иммунохимической реакции без применения специальной метки [1–4]. Такие устройства просты в обращении и позволяют с высокими чувствительностью и экспрессностью проводить селективное определение аналитов в пробах сложного состава в присутствии большого числа посторонних веществ [5].
Важнейшей задачей при разработке пьезоэлектрических иммуносенсоров является формирование устойчивого распознающего слоя, позволяющего осуществлять многократные измерения после регенерации, а также увеличение концентрации и поверхностной доступности активных “сайтов” связывания. Наиболее часто в качестве распознающего слоя используют многослойные покрытия с прочными связями между отдельными слоями, включающие создание на поверхности электрода самоорганизованного монослоя тиолов или силанов, электрогенерированных пленок, активацию их бифункциональным реагентом и иммобилизацию антител или белковых конъюгатов аналитов [6, 7]. Процесс формирования многослойного покрытия, как правило, продолжителен и не всегда приводит к образованию устойчивого слоя. Для повышения площади активной поверхности сенсора, обеспечивающей высокую чувствительность определения, наиболее перспективно использование углеродных нанотрубок (УНТ), характеризующихся низкой массой и высокоразвитой поверхностью [8, 9].
Другим многообещающим наноматериалом, используемым в химической сенсорике, являются магнитные наночастицы (МНЧ) [10–12]. Это связано с их уникальными свойствами: простотой синтеза, легкостью функционализации поверхности, высоким магнетизмом и низкой цитотоксичностью [13, 14]. Имеется информация о применении МНЧ в пьезоэлектрических сенсорах, предназначенных для предварительного концентрирования [15] и определения высокомолекулярных соединений в прямом или конкурентном форматах иммуноанализа [16, 17].
Перспективно также использование в иммуносенсорах магнитных углеродных нанокомпозитов (МУНК) – комбинации магнитных наночастиц с углеродными нанотрубками. Применение МУНК способствует не только увеличению площади активной поверхности распознающего слоя сенсора, но и позволяет осуществлять формирование рецепторного покрытия под действием внешних магнитных сил [18]. Однако влияние размера и концентрации МНЧ, присутствующих в структуре МУНК, на метрологические характеристики гравиметрического пьезоэлектрического иммуносенсора пока практически не изучено.
Целью работы являлось изучение условий формирования распознающего слоя пьезоэлектрического сенсора на основе МУНК, влияния размеров и концентрации МНЧ на чувствительность детектирования и диапазон определяемых содержаний пенициллина G (Пен G).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. Использовали следующие иммунореагенты: бензилпенициллина натриевую соль (пенициллин G) (Биохимик, Россия), поликлональные антитела к Пен G (Abcam, Великобритания).
В ходе исследования применяли следующие реагенты: FeCl2⋅4H2O, FeCl3⋅6H2O, Na2CO3, KH2PO4, Na2HPO4⋅12H2O, NaHCO3, HCl (ρ = 1.198 г/мл), KCNS (Реахим, Россия); NH3, NaОН, NaCl и KCl (База № 1 Химреактивов, Россия); малоновую кислоту (Вектон, Россия); Тритон X-100, 2-амино-3-меркаптопропановую кислоту (цистеин), N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлорид (ЭДАК), N-гидроксисукцинимид (N-ГС), N,N'-дициклогексилкарбодиимид (ДСС) 3-аминопропилтриэтоксисилан (АПТЕС) (Sigma-Aldrich, США); диметилформамид (ДМФ) (Sigma, Германия); ацетон и этанол (Quimica, Испания); бычий сывороточный альбумин (БСА) (ПанЭко, Россия).
Для синтеза магнитных углеродных нанокомпозитов использовали многостенные углеродные нанотрубки (Институт проблем технологии микроэлектроники и особо чистых материалов РАН, Черноголовка) [19].
В качестве сенсоров применяли пьезокварцевые резонаторы АТ-среза с собственной частотой колебаний 10 МГц с золотыми электродами с двух сторон кристалла диаметром 8 мм, полученными методом магнетронного напыления (ЭТНА, Россия). Аналитический сигнал регистрировали на измерительной установке CPNA-330 (ЭТНА, Россия).
Массу покрытия рассчитывали по уравнению Зауэрбрея [20]:
где ∆f – изменение частоты колебаний кристалла кварца, Гц; f0 – собственная частота колебаний кристалла, 10 МГц; ∆m – масса нанесенного на электрод покрытия, г; А – площадь поверхности электрода, 0.10066 см2.Число циклов измерений (N) – число последовательных измерений, при котором аналитический сигнал сенсора не изменяется более чем на 5%.
Закрепление МНЧ на поверхности углеродных нанотрубок, а также их размер контролировали методом сканирующей электронной микроскопии (СЭМ) на электронно-ионном микроскопе TESCAN VEGA3 SBH (Tescan, Чехия).
Образование связей между конъюгатом Пен G и МУНК контролировали методом ИК-спектрометрии (ИК-Фурье спектрометр Iraffinity-1 (Shimadzu, Япония)). ИК-спектры регистрировали после нанесения на подложку (пластина монокристаллического кремния КЭС-0.01, “ПРОМТЕХ”, Россия) 100 мкл исследуемого раствора и высушивания в потоке теплого воздуха.
Для предотвращения агломерации дисперсий МУНК и УНТ использовали ультразвуковую ванну (ПСБ-Галас, Россия).
Синтез магнитных наночастиц. Использовали МУНК, полученные путем иммобилизации на поверхности УНТ магнитных наночастиц Fe3O4, синтезированных по методу соосаждения при разных мольных соотношениях ионов Fe2+ : Fe3+ : OH–, рН реакционной среды, температуре [21–23] и продолжительности ультразвуковой обработки (${{\tau ,}}$ ч) (табл. 1).
Наночастицы отделяли от раствора при помощи магнита, промывали до рН 7 и высушивали при 60°С до постоянной массы. Силанизацию Fe3O4 осуществляли двумя способами:
Способ 1: наночастицы Fe3O4 массой 100 мг вносили в раствор, содержащий 200 мл этанола и 4 мл дистиллированной воды, обрабатывали ультразвуком в течение 1 ч. Далее вводили 40 мл АПТЕС и перемешивали в течение 7 ч. Осадок отделяли центрифугированием (10 000 об./мин), промывали до рН 7 и высушивали при 80°С до постоянной массы [24].
Способ 2: наночастицы Fe3O4 массой 300 мг помещали в колбу, содержащую 150 мл 0.05 М раствора NaOH, нагревали до 65°С в течение 5 ч и оставляли на ночь при комнатной температуре. Образующийся осадок активированных магнитных наночастиц отделяли при помощи магнита, промывали дистиллированной водой до рН 7 и высушивали до постоянной массы. Далее проводили силанизацию магнитных частиц: 190 мг активированных МНЧ вносили в 96 мл этанола и подвергали ультразвуковой обработке в течение 10 мин. К полученной суспензии добавляли 111 мл АПТЕС и перемешивали в течение 20 ч. Органическую фазу удаляли, удерживая магнитные наночастицы при помощи магнита, осадок промывали водой до pH 7 и высушивали до постоянной массы [25].
Синтез магнитных углеродных нанокомпозитов осуществляли смешиванием магнитных наночастиц с углеродными нанотрубками в 30 мл деионизованной воды. Полученную смесь перемешивали при комнатной температуре в течение 30 мин. Образующийся магнитный композит промывали деионизованной водой и высушивали под ИК-лампой до постоянной массы. Таким образом синтезировали ряд нанокомпозитов с разным соотношением УНТ : МНЧ – 1 : 1, 2 : 1, 3 : 1, 7 : 1 и 10 : 1 [26].
Формирование распознающего слоя на основе МУНК. Перед формированием распознающего слоя поверхность электрода очищали с помощью 1 М HCl, ацетона и этанола.
Для предотвращения агломерации 1 мг МУНК вносили в 1 мл 1%-ного водного раствора Тритона X-100 и подвергали ультразвуковой обработке в течение 1 ч [18]. Иммобилизацию молекул Пен G–БСА на поверхности МУНК осуществляли следующим образом: к 10 мкл дисперсии нанокомпозита в 1%-ном водном растворе Тритона X-100 добавляли 10 мкл активационной смеси (2.5 мг ЭДАК и 5 мг N-ГС в 200 мкл 1%-ного водного раствора Тритона X-100) и оставляли на 20 мин при комнатной температуре. Далее в систему вводили 10 мкл раствора Пен G–БСА фиксированной концентрации и оставляли на 10–12 ч при 4°С для получения устойчивого нанокомпозита МУНК/Пен G–БСА.
Сенсор помещали в ячейку детектирования над неодимовым магнитом, наносили на золотой электрод 2 мкл дисперсии МУНК/Пен G–БСА и оставляли на 90 мин на воздухе при комнатной температуре, после чего промывали 200 мкл дистиллированной воды для удаления несвязавшихся компонентов и высушивали в потоке теплого воздуха.
Формирование распознающего слоя на основе углеродных нанотрубок. В 1 мл ДМФ вносили 1 мг карбоксилированных углеродных нанотрубок и подвергали ультразвуковой обработке в течение 1 ч, после чего разбавляли дисперсию ДМФ в соотношении 1 : 7 (143 мкг/мл) и вновь обрабатывали ультразвуком в течение 1 ч. Для иммобилизации белкового конъюгата Пен G на поверхность пьезоэлектрического сенсора помещали 2 мкл 1 мМ этанольного раствора цистеина и высушивали при комнатной температуре в течение 90 мин, после чего наносили 2 мкл суспензии УНТ и оставляли при 4°С на 24 ч. Сенсор промывали 200 мкл дистиллированной воды, высушивали в потоке теплого воздуха и проводили активацию карбоксильных групп на поверхности УНТ с помощью 2 мкл активационной смеси, содержащей 2.5 мг ЭДАК и 5 мг N-ГС в 200 мл ДМФ. Выдерживали сенсор 90 мин при комнатной температуре и наносили 5 мкл белкового конъюгата Пен G, после чего помещали сенсор во влажную камеру при 4°С на 10–12 ч. Вновь промывали дистиллированной водой и сушили в потоке теплого воздуха [9].
Процедура измерения аналитического сигнала иммуносенсора методом “deep-and-dry”. Для определения Пен G в конкурентном формате иммуноанализа к пробе добавляли раствор антител с концентрацией, соответствующей 50%-ному связыванию в гомогенный иммунокомплекс, и выдер-живали 15 мин. Далее 2 мкл пробы наносили на поверхность распознающего слоя сенсора и после завершения реакции (15 мин) между свободными антителами пробы и конъюгатом Пен G–БСА промывали поверхность сенсора дистиллированной водой для удаления несвязавшихся биореагентов и высушивали до постоянной массы в потоке теплового воздуха [27].
После измерения аналитического сигнала поверхность распознающего слоя регенерировали 200 мкл 0.003 М раствора тиоционата калия. Через 15 мин сенсор промывали дистиллированной водой и высушивали до постоянной массы в потоке воздуха.
Синтез белкового конъюгата пенициллина G. Белковый конъюгат Пен G синтезировали по следующей методике: 50 мг Пен G, 45 мг N-ГС и 72 мг ДСС растворяли в 1 мл ДМФ и перемешивали при комнатной температуре в течение 3 ч, после чего выдерживали при 4°С в течение 12 ч. Образовавшийся осадок отделяли центрифугированием (4 мин, 8000 об./мин). Верхний слой жидкости объемом 0.5 мл отделяли и при перемешивании по каплям добавляли к раствору, содержащему 50 мг БСА в 3.5 мл 0.1 М карбонатного буферного раствора (рН 9.5), смесь перемешивали в течение 3 ч при 25°С и оставляли на 12 ч при 4°С. После инкубации полученный раствор очищали диализом против фосфатного буферного раствора (рН 7.2) в течение двух суток.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Формирование распознающего слоя пьезоэлектрического сенсора на основе магнитных углеродных нанокомпозитов. Важнейшими характеристиками распознающего слоя пьезоэлектрического сенсора являются:
– масса (высокая масса слоя приводит не только к сужению диапазона определяемых концентраций, но и может быть причиной срыва аналитического сигнала сенсора);
– площадь активной поверхности, влияющая на концентрацию и доступность активных “сайтов” связывания, обеспечивающих чувствительность определения;
– устойчивость, позволяющая осуществлять регенерацию поверхности после каждого цикла измерения без существенного изменения свойств покрытия.
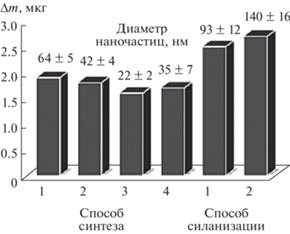
Изучили влияние способа синтеза на диаметр и массу МНЧ, которые устанавливали методами СЭМ и пьезокварцевого микровзвешивания соответственно (рис. 1). Ранее показано [28], что магнитные свойства в максимальной степени проявляются у МНЧ со средним диаметром 10–20 нм. При синтезе наночастиц способом 1 происходит формирование крупных ядер Fe3O4 (Ø = = 64 ± 5 нм). Нанокомпозит на их основе продемонстрировал хорошие магнитные свойства, обеспечивающие стабильное закрепление покрытия на поверхности сенсора, но при этом высокую массу формируемого слоя (∆m = 1.9 ± 0.1 мкг), негативно влияющую на диапазон определяемых содержаний. При получении наночастиц способом 2, отличающимся от предыдущего способа продолжительностью УЗ-обработки, наблюдали уменьшение среднего диаметра (Ø = 42 ± 4 нм), но увеличение дисперсии размеров частиц. Среди синтезированных магнитных наночастиц Fe3O4 наименьший средний диаметр и масса формируемого слоя отмечены у структур, полученных способом 3 (Ø = 22 ± 2 нм, ∆m = 1.6 ± 0.1 мкг). Установили, что увеличение концентрации ОН–-ионов при постоянном соотношении Fe3+ : Fe2+ и ультразвуковая обработка по окончании синтеза способствуют уменьшению диаметра МНЧ (способ 3). Постепенное увеличение температуры синтеза от 70 до 90°С приводит к получению МНЧ небольшого диаметра (способ 4, Ø = 35 ± 7 нм, ∆m = 1.7 ± 0.3 мкг), но неоднородных по размеру, что также не позволяет использовать их в гравиметрических пьезоэлектрических сенсорах.
Для более надежного закрепления магнитных наночастиц на поверхности углеродных нанотрубок изучили возможность применения МНЧ с оболочкой на основе кремнезема. Силанизация приводит к образованию на поверхности МНЧ аминогрупп, которые связываются с карбоксильными группами УНТ с образованием пептидной связи. Отмечено, что синтез кремниевой оболочки на поверхности наночастиц Fe3O4 (рис. 1) со средним диаметром 22 нм приводит к увеличению диаметра МНЧ до 93 нм (способ 1) или 140 нм (способ 2). Соответственно происходит увеличение массы слоя МУНК на базе МНЧ, модифицированных АПТЕС, до 2.5 ± 0.1 мкг (способ 1) и до 2.7 ± 0.2 мкг (способ 2). В дальнейших исследованиях применяли нанокомпозиты с МНЧ Fe3O4 минимального размера с Ø = 22 ± 2 нм (МУНКА) и с МНЧ Fe3O4@SiO2, обеспечивающими более высокую стабильность распознающего слоя, с Ø = 93 ± 12 нм (МУНКБ).
На характеристики рецепторного слоя пьезоэлектрического сенсора существенно влияет соотношение количества углеродных нанотрубок и МНЧ в МУНК. Избыточная концентрация частиц Fe3O4 может не только быть причиной срыва аналитического сигнала гравиметрического сенсора, но и приводить к стерическим затруднениям при связывании МУНК с белковым конъюгатом Пен G через поверхностные карбоксильные группы УНТ, и, соответственно, к уменьшению чувствительности определения аналита. С другой стороны, недостаток МНЧ в составе МУНК уменьшает магнитные свойства [26], что приводит к снижению устойчивости покрытия сенсора, сформированного под действием внешних магнитных сил.
Методом пьезокварцевого микровзвешивания контролировали массу распознающего слоя на каждом этапе его формирования (табл. 2). Сначала регистрировали массу нанокомпозита (∆mМУНК) после нанесения его на поверхность электрода сенсора. А затем определяли массу нанокомпозита с иммобилизованным на его поверхности белковым конъюгатом (∆mслоя). Массу биомолекул конъюгата антибиотика, иммобилизованных на поверхности МУНК, рассчитывали по разности (∆mбиомолекул).
Таблица 2.
Влияние соотношения компонентов на характеристики массы покрытия
| Соотношение УНТ : МНЧ |
∆mМУНК, мкг | ∆mслоя, мкг | ∆mбиомолекул, мкг | N |
|---|---|---|---|---|
| 1 : 1 | 1.5 ± 0.3 | 2.0 ± 0.4 | 0.4 | 34 |
| 2 : 1 | 1.6 ± 0.1 | 2.1 ± 0.1 | 0.5 | 33 |
| 3 : 1 | 1.7 ± 0.1 | 2.2 ± 0.1 | 0.6 | 32 |
| 7 : 1 | 1.3 ± 0.4 | 1.8 ± 1.2 | 0.5 | 14 |
| 10 : 1 | 1.2 ± 0.2 | 1.5 ± 0.1 | 0.3 | 6 |
Увеличение соотношения УНТ : МНЧ свыше 3 : 1 приводит к получению нестабильного покрытия (N ниже 15), так как присутствующие в композите МНЧ не обеспечивают достаточно прочного удерживания МУНК на поверхности сенсора под действием магнитного поля. Для нанокомпозитов с соотношениями УНТ : МНЧ 7 : 1 и 10 : 1 уменьшается масса распознающих молекул Пен G–БСА, зафиксированных на поверхности. Это связано с тем, что нанокомпозиты с низким содержанием МНЧ не обеспечивают надежное закрепление на поверхности МУНК высоких концентраций Пен G–БСА, из-за чего часть их теряется при промывке сенсора, что приводит к снижению чувствительности определения антибиотика. При использовании подложки на базе нанокомпозита с соотношением УНТ : МНЧ, равным 1 : 1, отмечается низкая воспроизводимость значений ∆mМУНК и ∆mслоя, что недопустимо для гравиметрического сенсора. В то же время покрытия на основе МУНК с соотношениями УНТ : МНЧ, равными 2 : 1 и 3 : 1, показали близкие характеристики. Однако для соотношения 3 : 1 наблюдали максимальное количество доступных “сайтов” связывания, а также высокие магнитные свойства нанокомпозита, обеспечивающие надежную фиксацию распознающего слоя на поверхности пьезоэлектрического сенсора под действием внешних магнитных сил.
При анализе нанокомпозитов методом сканирующей электронной микроскопии установили, что, независимо от формы и размера, МНЧ в МУНК располагаются на сгибах и разломах углеродных нанотрубок. В случае нанокомпозита с концентрацией компонентов, равной 3 : 1 (МУНКА), магнитные наночастицы равномерно распределяются на поверхности углеродных нанотрубок за счет физической сорбции (рис. 2). Аналогичные закономерности отмечены и для нанокомпозита на основе наночастиц Fe3O4@SiO2. Схемы формирования нанокомпозитов МУНКА и МУНКБ представлены на рис. 3.
Рис. 3.
Схема формирования магнитных углеродных нанокомпозитов на основе наночастиц Fe3O4 (а) и Fe3O4@SiO2 (б).

На массу распознающего слоя МУНК значительное влияние оказывает способ перевода нанокомпозита в дисперсное состояние [18]. Для предотвращения агломерации магнитные углеродные нанокомпозиты вносили в водный раствор Тритона Х-100, так как данное неионогенное поверхностно-активное вещество обеспечивает достаточную смачиваемость наноматериала водой, что позволяет добиться равномерного распределения МУНК на поверхности пьезоэлектрического гравиметрического сенсора.
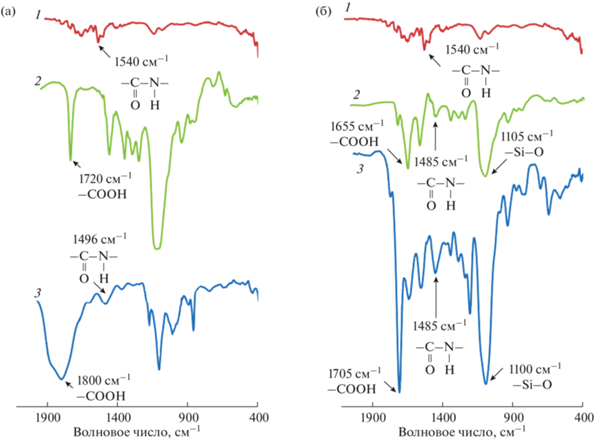
Образование связей между конъюгатом антибиотика и магнитными углеродными нанокомпозитами подтверждено методом ИК-спектрометрии (рис. 4). В случае МУНКА (рис. 4а) значительное уширение и сдвиг пика карбоксильных групп в спектре МУНКА/Пен G–БСА относительно спектра МУНКА с 1720 до 1800 см–1 свидетельствует об их участии в образовании связей. О связывании конъюгата с нанокомпозитом также говорПик амидной связи в спектре МУНКБ (1485 см–1) объясняется взаимодействием аминогрупп наночастиц Fe3O4@SiO2 и карбоксильных групп УНТ. Его уширение в спектит четкое проявление пика при 1496 см–1 в спектре МУНКА/Пен G–БСА, соответствующего пептидной связи. В спектре МУНКБ/Пен G–БСА (рис. 4б) пик, отвечающий колебаниям группы C=O, смещается и вытягивается относительно спектра МУНКБ (1705 вместо 1655 см–1). ре нанокомпозита МУНКБ/Пен G–БСА указывает на образование связей между карбоксильными группами УНТ и белковым конъюгатом антибиотика. Присутствие в спектрах МУНКБ и МУНКБ/Пен G–БСА пика в области 1100 см–1 свидетельствуют о наличии оболочки SiO2 на поверхности наночастиц магнетита.
Методика определения пенициллина G с помощью пьезоэлектрического иммуносенсора. Пенициллин G определяли при помощи пьезоэлектрического иммуносенсора в конкурентном формате иммуноанализа. Рабочую концентрацию иммобилизованного на поверхности сенсора конъюгата Пен G–БСА, существенно влияющую на концентрацию активных сайтов связывания, определяли по максимуму на графике зависимости аналитического сигнала от концентрации конъюгата. Для МУНКА рабочая концентрация конъюгата составила 0.67 мМ (рис. 5а), для МУНКБ – 0.43 мМ (рис. 5б).
Рис. 5.
Выбор рабочей концентрации конъюгата Пен G–БСА для МУНКА (а) и МУНКБ (б) и разбавления первичной сыворотки антител в случае МУНКА (в) и МУНКБ (г).
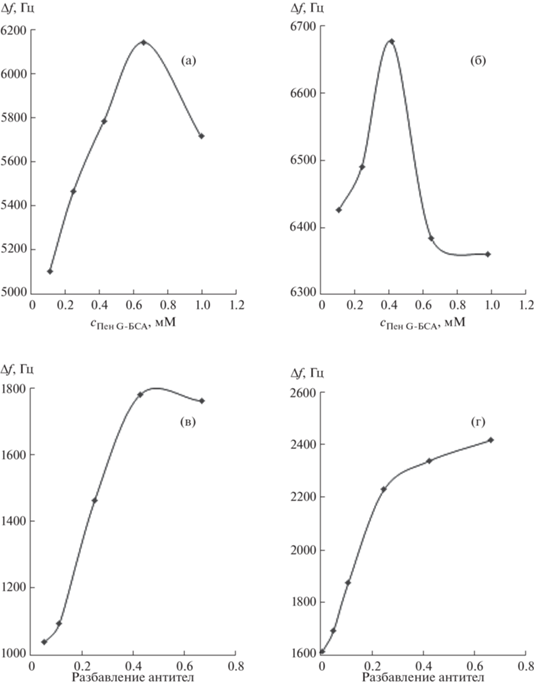
Разбавление сыворотки антител, соответствующей 50%-ному связыванию с конъюгатом на поверхности сенсора, выбирали на линейном участке зависимости аналитического сигнала от концентрации антител: для подложки на основе МУНКА разбавление первичной сыворотки антител составило 20/80 (рис. 5в), а для МУНКБ – 12/88 (рис. 5г). Как видно, применение в МУНК магнитных наночастиц меньшего диаметра сопровождается увеличением концентрации иммобилизованного на поверхности сенсора конъюгата и, следовательно, количества активных “сайтов” связывания. Установлены характеристики сенсоров с распознающим слоем на основе различных магнитных углеродных нанокомпозитов (табл. 3). Для сравнения приведены характеристики пьезоэлектрического сенсора на базе УНТ.
Таблица 3.
Аналитические характеристики пьезоэлектрических иммуносенсоров для определения пенициллина G с распознающими покрытиями на основе УНТ, МУНКА и МУНКБ
| Вид покрытия | Диапазон определяемых содержаний, нг/мл | Уравнение градуировочного графика | R2 | cmin, нг/мл |
|---|---|---|---|---|
| УНТ | 6–300 | Δf = (1522 ± 155) – (3.3 ± 0.9)с | 0.97 | 3 |
| МУНКА | 1–450 | Δf = (2740 ± 100) – (3.8 ± 0.4)с | 0.99 | 0.5 |
| МУНКБ | 10–300 | Δf = (2072 ± 172) – (5.1 ± 1.8)с | 0.97 | 5 |
Наибольший диапазон определяемых содержаний Пен G достигается при применении МУНКА. Использование для формирования распознающего слоя, включающего магнитные частицы Fe3O4@SiO2, УНТ или МУНКБ сопровождается сужением диапазона определяемых содержаний из-за более низкой концентрации конъюгата Пен G на поверхности электрода сенсора. Кроме того, увеличивается продолжительность и усложняется процедура подготовки к анализу сенсора на базе УНТ из-за необходимости послойного нанесения модификаторов для создания устойчивого слоя. Формирование подложки на основе МУНКА под действием внешних магнитных сил позволяет упростить процедуру иммобилизации биомолекул на поверхности электрода пьезокварцевого сенсора. При этом время подготовки сенсора к анализу сокращается в шестнадцать раз по сравнению с покрытием на основе УНТ (с 24 ч в случае УНТ до 1.5 ч при применении МУНК). Кроме того, удаление распознающего слоя после снижения его характеристик не требует применения агрессивных растворителей, что позволяет продлить срок службы сенсора.
Методом введено–найдено оценена правильность определения Пен G с помощью сенсора на основе МУНКА в модельных растворах. Отсутствие систематической погрешности в результатах анализа подтверждено c помощью критерия Стьюдента (tэксп < tтабл). Значения sr свидетельствуют о высокой прецизионности результатов анализа (табл. 4). Разработанные сенсоры апробированы при определении Пен G в молоке и мясе методом добавок (табл. 5). Белки осаждали обработкой проб этанолом и насыщенным раствором сульфата аммония с последующим центрифугированием (3 мин, 7000 об./мин) [18]. Прочие присутствующие в матрице компоненты не мешали определению антибиотика.
Таблица 4.
Результаты (нг/мл) определения пенициллина G в модельных растворах методом введено–найдено (tтабл = 2.1, n = 5, P = 0.95)
| Введено | Найдено | sr | tэксп |
|---|---|---|---|
| 50 | 53 ± 1 | 0.02 | 2.0 |
| 100 | 101 ± 4 | 0.01 | 0.8 |
| 300 | 305 ± 8 | 0.01 | 1.9 |
Таблица 5.
Результаты (нг/мл) определения пенициллина G в молоке и мясе (n = 5, P = 0.95)
| Введено | Найдено | sr | |
|---|---|---|---|
| с добавкой | без добавки | ||
| Свинина | |||
| 50 | 52 ± 9 | 2 ± 1 | 0.07 |
| 100 | 102 ± 11 | 2 ± 1 | 0.04 |
| Молоко | |||
| 50 | 55 ± 8 | 5 ± 1 | 0.06 |
| 100 | 108 ± 8 | 8 ± 2 | 0.03 |
* * *
Предложена методика формирования рецепторного слоя на основе МУНК на поверхности пьезоэлектрического сенсора под действием внешнего магнитного поля. Установлено влияние размера и концентрации магнитных наночастиц, полученных различными способами, на характеристики распознающего покрытия сенсора. Сенсор на основе МУНК апробирован при определении Пен G в жидких средах. Наибольший диапазон определяемых концентраций составил 1–450 нг/мл, предел обнаружения равен 0.5 нг/мл.
Исследование выполнено при финансовой поддержке РФФИ и Липецкой области в рамках научного проекта № 20-43-480001. В ИПТМ РАН работа выполнена в рамках Госзадания 075-01304-23-00.
Список литературы
Gupta B.K., Yadav A., Koch P., Mishra P. Piezoelectric biosensors: Principle, techniques, and their application in food analysis / Biosensors in Food Safety and Quality / Eds. Mishra P., Sahu P.P. CRC Press, 2022. P. 37.
Zhang J., Zhang X., Wei X., Xue Y., Wan H., Wang P. Recent advances in acoustic wave biosensors for the detection of disease-related biomarkers: A review // Anal. Chim. Acta. 2021. V. 1164. Article 338321.
Гулий О.И., Зайцев Б.Д., Алсовэйди А.К.М., Караваева О.А., Ловцова Л.Г., Бородина И.А. Биосенсорные системы для определения антибиотиков // Биофизика. 2021. Т. 66. № 4. С. 657. (Guliy O.I., Karavaeva O.A., Lovtsova L.G., Zaitsev B.D., Borodina I.A., Alsowaidi A.K.M. Biosensor systems for antibiotic detection // Biophysics. 2021. V. 66. № 4. С. 555.)
Алсовэйди А.К.М., Караваева О.А., Гулий О.И. Методы и подходы для определения антибиотиков // Антибиотики и химиотерапия. 2022. Т. 67. № 1–2. С. 53.
Ермолаева Т.Н., Калмыкова Е.Н., Шашканова О.Ю. Пьезоэлектрические биосенсоры для анализа объектов окружающей среды, пищевых продуктов и клинической диагностики // Рос. хим. журн. 2008. Т. 52. № 2. С. 17. (Ermolaeva T.N., Kalmykova E.N., Shashkanova O.Y. Piezoquartz biosensors for the analysis of environmental objects, foodstuff and for clinical diagnostic // Russ. J. Gen. Chem. 2008. V. 78. № 12. P. 2430.)
Tripathi A., Melo J.S. Immobilization Strategies. Biomedical, Bioengineering and Environmental Applications. Springer, 2021. P. 666.
Karaseva N.A., Ermolaeva T.N. Piezoelectric immunosensors for the detection of individual antibiotics and the total content of penicillin antibioticsin foodstuffs // Talanta. 2014. V. 120. P. 312.
Pohanka M. Overview of piezoelectric biosensors, immunosensors and DNA sensors and their applications // Materials. 2018. V. 11 № 3. P. 448.
Шукшина Е.И., Фарафонова О.В., Шанин И.А., Гражулене С.С., Еремин С.А., Ермолаева Т.Н. Аффинные взаимодействия на поверхности пьезоэлектрического сенсора, модифицированного углеродными нанотрубками, при определении фторхинолонов // Сорбционные и хроматографические процессы. 2018. Т. 18. № 3. С. 394.
Tajyani S., Babaei A. A new sensing platform based on magnetic Fe3O4@NiO core/shell nanoparticles modified carbon paste electrode for simultaneous voltammetric determination of Quercetin and Tryptophan // J. Electroanal. Chem. 2018. V. 808. P. 50.
Santos A.M., Wong A., Prado T.M., Fava E.L., Fatibello-Filho O., Sotomayor M.D.P.T., Moraes F.C. Voltammetric determination of ethinylestradiol using screen-printed electrode modified with functionalized graphene, graphene quantum dots and magnetic nanoparticles coated with molecularly imprinted polymers // Talanta. 2021. V. 224. Article 121804.
Sohouli E., Khosrowshahi E.M., Radi P., Naghian E., Rahimi-Nasrabadi M., Ahmadi F. Electrochemical sensor based on modified methylcellulose by graphene oxide and Fe3O4 nanoparticles: Application in the analysis of uric acid content in urine // J. Electroanal. Chem. 2020. V. 877. Article 114503.
Reddy K.R., Reddy P.A., Reddy C.V., Shetti N.P., Babu B., Ravindranadh K., Shankar M.V., Reddy M.C., Soni S., Naveen S. Functionalized magnetic nanoparticles/biopolymer hybrids: Synthesis methods, properties and biomedical applications // Methods Microbiol. 2019. V. 46. P. 227.
Kouhpanji M.R.Z., Stadler B.J.H. A guideline for effectively synthesizing and characterizing magnetic nanoparticles for advancing nanobiotechnology: A Review // Sensors. 2020. V. 20. № 9. P. 2554.
Bayramoglu G., Ozalp V.C., Oztekin M., Arica M.Y. Rapid and label-free detection of Brucella melitensis in milk and milk products using an aptasensor // Talanta. 2019. V. 200. P. 263.
Pohanka M. QCM immunosensor for the determination of Staphylococcus aureus antigen // Chem. Pap. 2020. V. 74. P. 451.
Wan Y., Zhang D., Hou B. Determination of sulphate-reducing bacteria based on vancomycin-functionalised magnetic nanoparticles using a modification-free quartz crystal microbalance // Biosens. Bioelectron. 2010. V. 25. P. 1847.
Бизина Е.В., Фарафонова О.В., Золотарева Н.И., Гражулене С.С., Ермолаева Т.Н. Пьезоэлектрический иммуносенсор на основе магнитных углеродных нанокомпозитов для определения ципрофлоксацина // Журн. аналит. химии. 2022. Т. 77. № 4. С. 375. (Bizina E.V., Farafonova O.V., Zolotareva N.I., Grazhulene S.S., Ermolaeva T.N. A piezoelectric immunosensor based on magnetic carbon na-nocomposites for the determination of ciprofloxacin // J. Anal. Chem. 2022. V. 77. № 4. P. 375.)
Гражулене С.С., Золотарева Н.И., Редькин А.Н., Шилкина Н.Н., Митина А.А., Ходос И.И. Сорбционные свойства магнитного композита на основе модифицированных углеродных нанотрубок в зависимости от условий синтеза // Журн. прикл. химии. 2020. Т. 93. № 1. С. 66. (Grazhulenea S.S., Zolotareva N.I., Red’kin A.N., Shilkina N.N., Mitina A.A., Khodos I.I. sorption properties of a magnetic composite based on modifi ed carbon nanotubes: Influence of the synthesis conditions // Russ. J. Appl. Chem. 2020. V. 93. № 1. P. 57.)
Sauerbrey G. Verwendung von Schwingquarzen zur Wigung dunner Schichten und zur Mikrowigung // Zeitschrift für Physik. 1959. V. 55. P. 206.
Гражулене С.С., Золотарева Н.И., Редькин А.Н., Шилкина Н.Н., Митина А.А., Колесникова А.М. Магнитный сорбент на основе магнетита и модифицированных углеродных нанотрубок для извлечения некоторых токсичных элементов // Журн. прикл. химии. 2018. Т. 91. № 11. С. 1642. (Grazhulene S.S., Zolotareva N.I., Red’kin A.N., Shilkina N.N., Mitina A.A., Kolesnikova A.M. Magnetic sorbent based on magnetite and modified carbon nanotubes for extraction of some toxic elements // Russ. J. Appl. Chem. 2018. V. 91. № 11. P. 1849.)
Wang J., Zheng S., Shao Y., Liu J., Xu Z., Zhu D. Amino-functionalized Fe3O4@SiO2 core–shell magnetic nanomaterial as a novel adsorbent for aqueous heavy metals removal // J. Colloid Interface Sci. 2010. V. 349. P. 293.
Singh S., Barick K.C., Bahadur D. Surface engineered magnetic nanoparticles for removal of toxic metal ions and bacterial pathogens // J. Hazard. Mater. 2011. V. 192. P. 1539.
Eguílaz M., Villalonga R., Yanez–Sedeno P., Pingarron J.M. Designing electrochemical interfaces with functionalized magnetic nanoparticles and wrapped carbon nanotubes as platforms for the construction of high-performance bienzyme biosensors // Anal. Chem. 2011. V. 83. P. 7807.
Mikhaylova M., Kim D.K., Berry C.C., Zagorodni A., Toprak M., Curtis A.S.G., Muhammed M. BSA immobilization on amine-functionalized superparamagnetic iron oxide nanoparticles // Chem. Mater. 2004. V. 16. № 12. P. 2344.
Netto C.G.C.M., Toma H.E, Andrade L.H. Superparamagnetic nanoparticles as versatile carriers and supporting materials for enzymes // J. Mol. Catal. B: Enzym. 2013. V. 85. P. 71.
Нартова Ю.В., Еремин С.А., Ермолаева Т.Н. Массочувствительные иммуносенсоры для определения хлорацетанилидных гербицидов // Журн. аналит. химии. 2008. Т. 63. № 12. С. 1302. (Nartova Yu.V., Ermolaeva T.N., Eremin S.A. Mass-sensitive immunosensors for determining chloroacetanilide herbicides // J. Anal. Chem. 2008. V. 63. № 12. P. 1191.)
Гражулене С.С., Золотарева Н.И., Редькин А.Н., Шилкина Н.Н., Митина А.А., Ходос И.И. Сорбционные свойства магнитного композита на основе модифицированных углеродных нанотрубок в зависимости от условий синтеза // Журн. прикл. химии. 2020. Т. 93. № 1. С. 66. (Grazhulene S.S., Zolotareva N.I., Red’kin A.N., Shilkina N.N., Mitina A.A., Khodos I.I. Sorption properties of a magnetic composite based on modified carbon nanotubes: Influence of the synthesis conditions // Russ. J. Appl. Chem. 2020. V. 93. № 1. P. 57.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии