Журнал аналитической химии, 2023, T. 78, № 5, стр. 427-437
Применение магнитного сорбента на основе сверхсшитого полистирола в сочетании с газовой хроматографией-масс-спектрометрией для определения хлорфенолов в рыбе пресноводного водоема
А. С. Губин a, *, П. Т. Суханов a, А. А. Кушнир a
a Воронежский государственный университет инженерных технологий
394036 Воронеж,
просп. Революции, 19, Россия
* E-mail: goubinne@mail.ru
Поступила в редакцию 05.12.2022
После доработки 14.12.2022
Принята к публикации 14.12.2022
- EDN: MIPYYF
- DOI: 10.31857/S0044450223050067
Аннотация
Для определения хлорфенолов в рыбе пресноводных водоемов предложено сочетание твердофазной экстракции на магнитном сорбенте на основе сверхсшитого полистирола и газовой хроматографии-масс-спектрометрии. В образцах плотвы (Rutilus rutilus) и толстолобика (Hypophthalmichthys molitrix) определены 2-хлорфенол, 3-хлорфенол, 4-хлорфенол, 2,4-дихлорфенол, 2,4,6-трихлорфенол и пентахлорфенол. Изучено накопление хлорфенолов в различных органах и тканях рыб (мышцы, печень, молоки, икра, жировые отложения), обитающих в Воронежском водохранилище. Разработаны способы пробоподготовки и установлены мешающие влияния различных факторов на результаты определения. Наибольший вклад в матричные эффекты вносят нефтепродукты и жирные кислоты. Пределы определения хлорфенолов разработанным способом составляют 7–18 нг/кг в мышечной ткани и печени и 30–60 нг/кг в жиросодержащих тканях. Максимальные количества хлорфенолов установлены в жировых отложениях толстолобика и составили 100, 82, 434, 1529, 383 и 411 нг/кг для 2-хлорфенола, 3-хлорфенола, 4-хлорфенола, 2,4-дихлорфенола, 2,4,6-трихлорфенола и пентахлорфенола соответственно.
С развитием химической промышленности увеличивается загрязнение окружающей среды органическими поллютантами [1]. Хлорфенолы (ХФ) – приоритетные загрязнители, внесенные в перечень Европейского Союза и Агентства по охране окружающей среды США (US Environmental Protection Agency) [2]. Они попадают в окружающую среду при разложении пестицидов (хлорбензолов, хлорированных циклогексанов, 2,4-дихлорфеноксиуксусной кислоты (2,4-Д)), хлорировании питьевой воды, в процессе цикла производства и переработки (как отходы) нефтехимии, пластика, кокса, нефти, пестицидов и бумаги [3].
Хлорзамещенные соединения значительно сложнее подвергаются биотрансформации и биодеградации и гораздо токсичнее, чем фенол, а их трансформация, в частности, может привести к увеличению токсичности из-за образования электрофильных метаболитов [4]. Например, при микробной деградации 2,4-Д и 2,4,5-трихлорфеноксиуксусной кислоты образуются 2,4-дихлорфенол и 2,4,5-трихлорфенол [5]. Более высокая гидрофобность ХФ обусловливает возможность их накопления во многих гидрофобных природных матрицах – донных отложениях, загрязненных жирами, ПАВ и нефтепродуктах. Далее фенольные загрязнители перемещаются по пищевым цепям, накапливаясь в водных растениях, фито- и зоопланктоне, рыбе [4].
Влияние ХФ на рыб заключается в острой токсичности (окислительный стресс, иммунотоксичность), гистопатологических изменениях, которые влияют не только на их размножение, здоровье, но и на стабильность популяции [6, 7]. В дальнейшем при приеме в пищу рыбы человеком ХФ накапливаются в репродуктивных органах, почках, печени и жировой ткани, вызывают онкологические заболевания и поэтому относятся 2В группе потенциальных канцерогенов [8]. Мониторинг содержания ХФ проводят в биологических объектах, отобранных в различных частях мира (табл. 1). Концентрации ХФ варьируются от 0.4 нг/кг до 155 мкг/кг [9–14]. ПДК некоторых ХФ в водоемах рыбохозяйственного назначения РФ составляет 0.1 мкг/л [15].
Таблица 1.
Характеристика способов определения хлорфенолов в образцах рыб и других продуктах животного происхождения
| Аналит | Объект анализа | Место отбора | Метод детектиро- вания |
Пределы
обнаружения, мкг/кг |
Определяемые концентрации, мкг/кг | Литера-тура |
|---|---|---|---|---|---|---|
| ΣХФ | 8 видов рыб | Залив Ханчжоу, Китай | ГХ-МС | 0.2–0.4 | 19.8–155 | [9] |
| 19 хлорфенолов | 15 видов рыб | Рынок Нинбо Лулинь, Китай | ГХ-МС | 0.01–0.05 | 0.04–8.74 | [10] |
| ПХФ | Бурый бычок (Ameiurus nebulosus) | 4 территории Канады | ГХ-МС высокого разрешения |
0.9–40 пг/кг | 0.4–1.8 нг/кг | [11] |
| ПХФ | 55 видов рыб, креветок, крабов, лягушек, черепах | Провинция Цзянсу, Китай | ГХ-ДЭЗ | 0.5–61 | 0.5–5.2 | [12] |
| ПХФ | Пищевые продукты животного происхождения | Китай | QuEChERS –МС/МС | 0.1 | 1.0 | [13] |
| 2,4-ДХФ ПХФ |
Медака японская (Oryzias latipes) |
Санджу, Корея |
ГХ-МС | 0.25–0.5 нг/кг | 0.062–0.10 | [14] |
Воронежское водохранилище построено в 1972 г. Оно представляет собой водный объект, расположенный в черте города Воронежа с населением более 1 млн человек. Как водоем, характеризующийся низкой проточностью, он является естественным накопителем загрязнений различной природы [16]. Одним из наименее изученных классов поллютантов в водной среде являются фенолы, поскольку они обычно нормируются как суммарный показатель – фенольный индекс [17]. Ранее нами проведен мониторинг содержания фенольных загрязнителей и установлено, что среди них преобладают в основном ХФ [16]. В качестве объектов настоящего исследования выбраны виды рыбы, которые являются типичными представителями ихтиофауны искусственных водоемов, – плотва (Rutilus rutilus) и толстолобик (Hypophthalmichthys molitrix) [18]. Для оценки химического загрязнения предложено шесть веществ, содержание которых в водохранилище, установленное в ранее проведенных исследованиях, было наибольшим [16] – 2-хлорфенол (2-ХФ), 3-хлорфенол (3-ХФ), 4-хлорфенол (4-ХФ), 2,4-дихлорфенол (2,4-ДХФ), 2,4,6-трихлорфенол (2,4,6-ТХФ) и пентахлорфенол (ПХФ).
В последнее время магнитная твердофазная экстракция, основанная на использовании суперпарамагнетизма магнитных наночастиц, среди которых наиболее часто применяют наночастицы магнетита [19], стала популярна при пробоподготовке объектов со сложной матрицей, содержащих следовые концентрации поллютантов [20].
Сорбенты на основе сверхсшитого полистирола предложены Даванковым и коллегами [21]. Они широко применяются для извлечения и концентрирования различных классов органических и неорганических соединений [22]. Достоинствами этого типа сорбентов является их высокая сорбционная емкость по отношению ко многим органическим адсорбатам [23, 24]. Авторами данной работы предложен еще один вариант синтеза и применения данного класса сорбентов для предварительного концентрирования и определения хлорфенолов в речной биоте.
Цель работы – разработка способа газохроматографического с масс-спектрометрическим детектированием (ГХ-МС) определения ХФ в рыбе с предварительным концентрированием на магнитном сорбенте, покрытом сверхсшитым полистиролом (Fe3O4@HCP), предложить алгоритм пробоподготовки, оценить метрологические характеристики способа и возможность применения для анализа реальных объектов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы и реактивы. 2-ХФ, 3-ХФ, 4-ХФ, 2,4-ДХФ, 2,4,6-ТХФ и ПХФ содержали не менее 99% основного вещества (Merck, США). Для подщелачивания и подкисления проб применялся HCl (ГОСТ 14261-77, Камская химическая компания, РФ) и NaOH (99% основного вещества, Ленреактив, РФ). Боратный буферный раствор (ББР, рН 10.7) готовили из NaOH и Na2B4O7·10H2O (99.5% чистого вещества, Ленреактив, РФ). Десорбцию ХФ проводили с применением ацетона ч. д. а. (Ленреактив, РФ). Для дериватизации ХФ применяли уксусный ангидрид ос. ч. (Fischer Chemical, Великобритания), K2CO3 (содержание основного вещества не менее 99%, ГОСТ 4221-76, Компонент-Реактив, РФ), н-бутилацетат х. ч. (Экос-1, РФ). Для удаления продуктов щелочного гидролиза жиров в ходе пробоподготовки применяли хлорид кальция ч. д. а. (Ленреактив, РФ). Перемешивание осуществляли с применением верхнеприводной мешалки ES8300 (Экросхим, РФ). Концентраты упаривали с использованием испарительного концентратора в токе азота EvaPor (Пущинские Лаборатории, РФ). Для перемешивания в процессе дериватизации проб применяли орбитальный шейкер OHAUS SHRK07AL1 (OHAUS, США).
Синтез и свойства магнитного сорбента. Использованные для синтеза Fe3O4@HCP приборы и реактивы, методика синтеза, а также параметры эффективности сорбции ХФ описаны в работах [16, 25].
Пробоподготовка образцов. Для анализа использовали выловленную взрослую рыбу в различных зонах водохранилища (не менее трех точек отлова), очищали от чешуи и препарировали. Для анализа выбрали 16 особей плотвы (два с икрой) и 5 толстолобика. Масса выловленной плотвы составляла 0.77–1.19 кг, масса толстолобиков 6.05–8.78 кг. Отдельно выделяли мышечную ткань и кожу, печень, молоки, икру и жировые отложения. Мышечную ткань и кожу или печень измельчали до состояния фарша. Отделяли 100 г фарша, добавляли 5 мл ББР и перетирали в ступке с кварцевым песком, который предварительно промывали 0.1 М раствором NaOH, затем 0.1 М HCl, этиловым спиртом и трижды деионизованной водой. Подсушивали фарш в течение 12 ч в холодильнике при температуре не выше +5°С. Затем с помощью ступки истирали фарш с песком до практически гомогенного состояния. Помещали смесь фарша с песком в круглодонную колбу, добавляли 100 мл ББР и интенсивно перемешивали смесь при постоянном контакте колбы со льдом. Такая процедура необходима для исключения биодеградации фенолов за счет жизнедеятельности микроорганизмов. После перемешивания смесь выдерживали 12 ч для полного разделения фаз в холодильнике при температуре не выше +5°С. Для удаления продуктов щелочного гидролиза жиров из пробы добавляли 1 мл 1%-ного раствора CaCl2 и оставляли на 30 мин отстаиваться. Отбирали 100 мл осветленного верхнего слоя и подкисляли HCl до рН 3.
Сложной для анализа матрицей являются жиросодержащие части рыбы (икра, молоки и жировые отложения). Жирные кислоты затрудняют проведение анализа [9], поэтому их удаляли в максимальной степени после выделения ХФ из пробы с применением щелочных растворов. При анализе жировых отложений их выделяли из частей, не содержащих молоки, икру и печень. Образцы замораживали при –20°С. После глубокой заморозки измельчали до размеров не более 0.5 см, затем в течение 15 мин центрифугировали (2500–3000 об./мин). Отделяли желтую, темнеющую на воздухе, массу жира. Далее добавляли к центрифужной массе 100 мл ББР, переносили в сосуд, нагревали до комнатной температуры и 3 ч перемешивали мешалкой при 100–150 об./мин. Оставляли смесь на 1 ч отстаиваться в холодильнике при температуре не выше +5°С. После отстаивания и разделения образовывалась трехфазная система – осадок в нижней части, тонкий слой жира в верхней части и прозрачная средняя часть. Сливали жидкость и слой жира с осадка в делительную воронку и отстаивали еще 3 ч при температуре не выше +5°С. Затем отделяли 60 мл нижнего слоя из делительной воронки и осаждали жирные кислоты добавлением 5 мл 1%-ного раствора CaCl2. Через 30 мин отбирали верхний слой и подкисляли HCl до рН 3.
Плотва – маложирная рыба, поэтому исследовали жировые отложения только толстолобика. Икру и молоки извлекали из плотвы (толстолобик в условиях водохранилища не размножается и вводится в водоемы при искусственном зарыблении для борьбы с сине-зелеными водорослями). Молоки и икру измельчали в ступке до однородности и гомогенизировали блендером, затем добавляли 100 мл ББР и далее пробоподготовку проводили так же, как при анализе для жировых отложений.
Процедура пробоподготовки направлена на максимальное извлечение ХФ из жировой матрицы при минимальных степенях гидролиза жиров. Для этого большинство стадий проводятся при пониженной температуре в слабощелочной среде (рН < 11), свободные жирные кислоты в щелочном растворе осаждаются солями кальция.
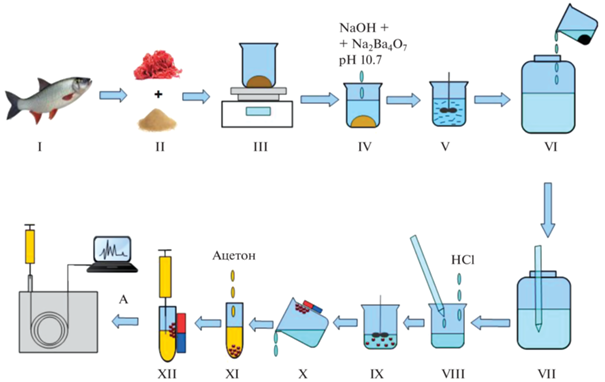
Магнитная твердофазная экстракция. Отбирали 20 мл раствора, подкисленного до рН 3 после прободготовки, переносили в стакан и добавляли 0.02 г сорбента Fe3O4@HCP. Перемешивали 10 мин, фиксировали Fe3O4@HCP с помощью магнита и отделяли раствор. Сорбент переносили в полипропиленовую пробирку типа Эппендорф и добавляли 1 мл ацетона для десорбции. Раствор после десорбции отделяли и упаривали досуха в слабом токе азота при комнатной температуре. Далее проводили дериватизацию, добавляя сначала 500 мкл 5%-ного раствора К2СО3, затем 0.5 мл деионизованной воды и 100 мкл уксусного ангидрида сразу после полного упаривания ацетонового концентрата [26–28]. Пробу перемешивали в течение 30 с в орбитальном шейкере, затем оставляли на 15 мин для отстаивания, после чего добавляли 0.25 мг NaCl и 0.5 мл н-бутилацетата и снова перемешивали 1 мин. Далее отбирали микрошприцем верхний органический слой и инжектировали в узел ввода пробы хроматографа. Общая схема пробоподготовки и концентрирования на примере мышечных тканей рыб представлена на рис. 1.
Рис. 1.
Схема пробоподготовки и концентрирования перед определением хлорфенолов в мышечных тканях рыбы: I – измельчение рыбы; II – получение фарша и перетирание с кварцевым песком; III – взвешивание (100 г образца); IV – добавление боратного буферного раствора; V – перемешивание; VI – отделение жидкости от осадка; VII – отбор пробы (20 мл); VIII – подкисление HCl; IX – добавление магнитного сорбента и перемешивание; X – отделение сорбента магнитной сепарацией; XI – десорбция ацетоном; XII – отбор растворителя после десорбции; А – упаривание концентрата досуха и дериватизация уксусным ангидридом перед инжектированием в хроматограф.
Для проверки правильности результатов и установления пределов обнаружения и определения готовили модельные образцы. В образцы препарированной рыбы, выращенной в искусственных условиях, до добавления ББР вводили известное количество ХФ.
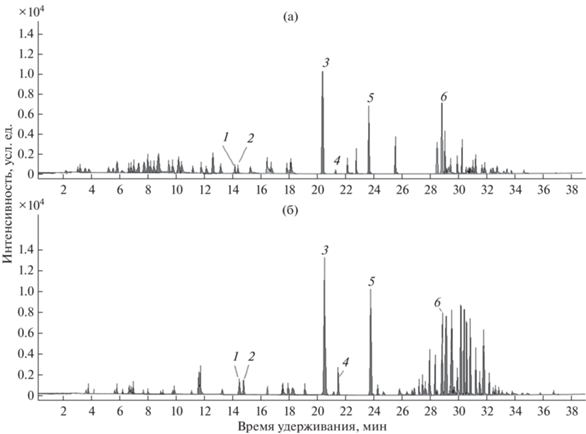
Определение хлорфенолов проводили методом ГХ-МС, для анализа использовали хроматограф Agilent 7890B GC System с детектором масс Agilent 5977A MSD. Применяли инжектрирование пробы объемом 1.0 мкл, деление потока 30 : 1, колонка HP-5MS UI (30 м × 0.25 мм × 0.25 мкм), фаза – (5% фенил)-метилполисилоксан. Газ-носитель – Не (1.0 мл/мин), температура узла ввода пробы – 300°С, температура источника ионов масс-детектора – 250°С. Применяли программирование температуры: стартовая температура составляла 150°С и удерживалась 2 мин, затем поднимали температуру со скоростью 10°С/мин до 280°С и удерживали ее 20 мин. Применяли электронную ионизацию с энергией электронов 70 эВ. Сканирование проводили по полному ионному току; диапазон масс – m/z 35–650 а. е. м. Для режима мониторинга использовали свойства дериватов отщеплять фрагмент CH2=C=O (m/z = 42) и образовывать фрагментарные ионы с m/z 128, 162, 196, 266 соответственно для моно-, ди-, трихлорфенолов и ПХФ. [29, 30]. Аналогичные подходы применяли ранее для качественного обнаружения некоторых других фенольных поллютантов в матрицах, например алкилфенолов и бисфенола А [31]. Хроматограммы образцов мышечной и жировой тканей представлены на рис. 2.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Водохранилище – малопроточный водоем с застойными зонами и активным цветением, характеризующимся высокими показателями БПК5, процессами гниения, а также наличием зон с высокими концентрациями нефтепродуктов и ПАВ [16]. Основным мешающим фактором является накопление нефтепродуктов в мышечной ткани рыб [9].
Анализ хроматограмм образцов мышечной ткани рыбы. Хроматограмма образца мышечной ткани включает несколько участков (рис. 2а). Пикам с временами удерживания (tR) от 3 до 12 мин соответствуют в основном биогенные амины, аминоспирты и аминокислоты. В условиях анализа пики малоинтенсивны и не мешают определению хлорфенолов. В интервале от 12 до 28 мин находится небольшое количество пиков. Основные затруднения возникают при определении ПХФ. Его время удерживания близко ко времени удерживания углеводородов нефтепродуктов. При анализе идентифицировали углеводороды С12–С35, в наиболее значительных количествах С15–С21. Пики углеводородов С15 (tR = 28.2 мин) и С16 (tR = 29.2 мин) практически совпадают по времени удерживания с ПХФ (tR = 28.8 мин), а по интенсивности сигнала иногда превосходят ПХФ.
Необходимо отметить, что сверхсшитый полимер Fe3O4@HCP характеризуется ограничениями, обусловленными специфическим механизмом сорбции. Сорбент Fe3O4@HCP высокоэффективен не только по отношению к фенолам, но и ко многим другим классам органических и неорганических соединений [22], поэтому при анализе сложных объектов усиливается матричный эффект и снижается чувствительность определения.
Анализ хроматограмм концентратов, полученных из жиросодержащих частей рыбы. При анализе жиросодержащих частей рыбы установлено наличие в пробах длинноцепочечных спиртов, октил- и нонилфенолов (рис. 2б). Вероятно, они образуются в результате гидролиза ПАВ – эфиров алкилфенолов и спиртов. Их времена удерживания составляют от 3 до 23 мин, они значительно отличаются от времен удерживания ХФ, поэтому эти вещества не мешают определению.
Определение ПХФ затруднено близким соседством пиков жирных кислот и эфиров жирных кислот с временами удерживания 24.2–34 мин. Разрешение пиков ПХФ и жирных кислот достигнуто на уровне 1.2, что позволяет проводить количественный анализ. Однако даже при незначительном возрастании концентрации жирных кислот и их эфиров в концентрате количественное определение затруднено.
В пробах присутствуют бисфенолы А и С, диоктил-, дибутил- и диэтилфталаты, их tR составляют 32–34.3 мин, и они не мешают определению ХФ. Также идентифицирован фенол (tR = = 13.2 мин), его количественно не определяли.
Анализ контрольной пробы (рыба, выращенная в искусственных условиях). Установлено отсутствие ХФ в рыбе за исключением следов 2,4-ДХФ в образцах жировой ткани, что, вероятно, связано с примесями хлорорганических пестицидов, используемых в производстве кормов для рыб [32].
Модельный образец после добавления ХФ анализировали методом введено–найдено, установлены пределы определения и обнаружения способа, интервалы линейности градуировочного графика (табл. 2).
Таблица 2.
Результаты определения хлорфенолов в образцах мышечной ткани плотвы методом введено–найдено (n = 3, P = 0.95)
| Вещество | Введено, нг/кг | Найдено, нг/кг | ПП, %а | sr, % | R2 | Побн, нг/кгб |
Попр, нг/кгв | Интервал линейности градуировочного графика, нг/кг |
|---|---|---|---|---|---|---|---|---|
| 2-ХФ | 0 | – | – | – | 0.996 | 3.0 | 10 | 10–1500 |
| 50 | 45 | 90 | 7.8 | |||||
| 100 | 94 | 94 | 5.7 | |||||
| 300 | 290 | 97 | 3.8 | |||||
| 1000 | 1018 | 102 | 2.3 | |||||
| 3-ХФ | 0 | – | – | – | 0.997 | 3.0 | 10 | 10–1500 |
| 50 | 45 | 90 | 6.8 | |||||
| 100 | 93 | 93 | 5.2 | |||||
| 300 | 277 | 94 | 3.7 | |||||
| 1000 | 994 | 99 | 2.5 | |||||
| 4-ХФ | 0 | – | – | – | 0.997 | 3.0 | 10 | 10–1800 |
| 50 | 44 | 88 | 7.0 | |||||
| 100 | 94 | 94 | 4.9 | |||||
| 300 | 278 | 94 | 3.7 | |||||
| 1000 | 1004 | 100 | 2.5 | |||||
| 2,4-ДХФ | 0 | – | – | – | 0.998 | 2.0 | 7.0 | 7.0–2000 |
| 50 | 46 | 92 | 6.8 | |||||
| 100 | 96 | 96 | 4.7 | |||||
| 300 | 290 | 98 | 3.4 | |||||
| 1000 | 1002 | 100 | 2.2 | |||||
| 2,4,6-ТХФ | 0 | – | – | – | 0.995 | 5.0 | 15 | 15–1500 |
| 50 | 45 | 90 | 6.8 | |||||
| 100 | 92 | 92 | 4.5 | |||||
| 300 | 285 | 95 | 3.5 | |||||
| 1000 | 1036 | 104 | 2.5 | |||||
| ПХФ | 0 | – | – | – | 0.993 | 6.0 | 18 | 18–800 |
| 50 | 40 | 80 | 8.2 | |||||
| 100 | 90 | 90 | 5.9 | |||||
| 300 | 278 | 93 | 3.8 | |||||
| 1000 | * | * | * |
Определение хлорфенолов в различных частях рыб. Способ, включающий стадию концентрирования с применением Fe3O4@HCP, позволяет определять ХФ в мышечной ткани и печени рыбы на уровне 7–18 нг/кг (табл. 2). Чувствительность снижается по мере возрастания числа заместителей и минимальна для ПХФ. Интервал линейности градуировочных графиков для большинства ХФ находится в диапазоне 10–1500 нг/кг. Определение ХФ в жиросодержащих частях рыбы характеризуется примерно в 3.5 раза меньшей чувствительностью из-за сложности пробоподготовки и загрязненности таких матриц (табл. 3). Правильность результатов определения ХФ в молоках, икре и жировых отложениях, оцененная методом введено–найдено, показывает занижение результатов анализа на 7–22%.
Таблица 3.
Результаты определения хлорфенолов в образцах жировых отложений толстолобика методом “введено-найдено” (n = 3, P = 0.95)
| Вещество | Введено, нг/кг | Найдено, нг/кг | ПП, % | sr, % | R2 | Побн, нг/кг |
Попр, нг/кг | Интервал линейности градуировочного графика, нг/кг |
|---|---|---|---|---|---|---|---|---|
| 2-ХФ | 0 | – | – | – | 0.994 | 10 | 30 | 30–1200 |
| 50 | 40 | 80 | 7.8 | |||||
| 100 | 80 | 80 | 5.7 | |||||
| 300 | 249 | 83 | 3.8 | |||||
| 1000 | 915 | 91 | 2.3 | |||||
| 3-ХФ | 0 | – | – | – | 0.994 | 10 | 30 | 30–1200 |
| 50 | 40 | 80 | 6.8 | |||||
| 100 | 78 | 78 | 5.2 | |||||
| 300 | 250 | 83 | 3.7 | |||||
| 1000 | 904 | 90 | 2.5 | |||||
| 4-ХФ | 0 | – | – | – | 0.996 | 10 | 30 | 30–1500 |
| 50 | 42 | 84 | 7.0 | |||||
| 100 | 84 | 84 | 4.9 | |||||
| 300 | 253 | 85 | 3.7 | |||||
| 1000 | 932 | 93 | 2.5 | |||||
| 2,4-ДХФ | 0 | – | – | – | 0.997 | 8.0 | 25 | 25–1800 |
| 50 | 39 | 78 | 6.8 | |||||
| 100 | 76 | 76 | 4.7 | |||||
| 300 | 246 | 82 | 3.4 | |||||
| 1000 | 920 | 92 | 2.2 | |||||
| 2,4,6-ТХФ | 0 | – | – | – | 0.995 | 15 | 45 | 45–1500 |
| 50 | 38 | 76 | 6.8 | |||||
| 100 | 76 | 76 | 4.5 | |||||
| 300 | 239 | 80 | 3.5 | |||||
| 1000 | 900 | 90 | 2.5 | |||||
| ПХФ | 0 | – | – | – | 0.992 | 20 | 60 | 60–700 |
| 50 | * | * | * | |||||
| 100 | 77 | 77 | 5.9 | |||||
| 300 | 240 | 81 | 3.8 | |||||
| 1000 | ** | ** | ** |
Предел определения ХФ снижается по сравнению с анализом мышечной ткани и составляет 30–60 нг/кг в зависимости от объекта исследования. Диапазоны линейности градуировочных графиков сокращаются; для ПХФ в жиросодержащих тканях он составляет 60–700 нг/кг.
В мышечной ткани плотвы детектируются шесть хлорфенолов, из них количественно можно определить пять (табл. 4). Концентрации ХФ составляют 37, 57, 278, 45 и 56 нг/кг для 2-ХФ, 4-ХФ, 2,4-ДХФ, 2,4,6-ТХФ и ПХФ соответственно. Содержание ХФ в толстолобике выше и составляет 47, 114, 517, 108 и 100 нг/кг для 2-ХФ, 4-ХФ, 2,4-ДХФ, 2,4,6-ТХФ и ПХФ соответственно. В образцах мышечной ткани рыбы и кожи содержание 3-ХФ находилось на уровне следов. Такое содержание ХФ в образцах мышечной ткани рыб примерно в 5–10 раз выше, чем среднегодовая концентрация в воде в различных точках водохранилища. В связи с более высокой гидрофобностью и относительно низкой способностью к деградации по сравнению с фенолами происходит накопление ХФ в тканях, богатых жирами [33]. В молоках плотвы содержание 2-ХФ, 4-ХФ, 2,4-ДХФ, 2,4,6-ТХФ и ПХФ составляет 36, 119, 928, 225 и 98 нг/кг соответственно. Наибольшее количество ХФ установлено в жировой ткани толстолобика (104, 82, 434, 1529, 383 и 411 нг/г для 2-ХФ, 3-ХФ, 4-ХФ, 2,4-ДХФ, 2,4,6-ТХФ и ПХФ соответственно). Содержание ХФ в жировых тканях приблизительно в 15–30 раз выше, чем в воде и в 7–10 раз больше, чем в донных отложениях водохранилища (эффекты биоконцентрирования и биомагнификации в пищевых цепях [34]).
Таблица 4.
Результаты анализа образцов рыб из Воронежского водохранилища (n = 3, Р = 0.95)
| Объект анализа | Вещество | Найдено*, нг/кг | sr |
|---|---|---|---|
| Плотва,
мышечная ткань N = 5 |
2-ХФ | 37 ± 4 | 10.8 |
| 3-ХФ | ** | – | |
| 4-ХФ | 57 ± 6 | 10.2 | |
| 2,4-ДХФ | 278 ± 25 | 9.1 | |
| 2,4,6-ТХФ | 45 ± 5 | 11.0 | |
| ПХФ | 56 ± 4 | 8.9 | |
| Толстолобик,
мышечная ткань N = 5 |
2-ХФ | 47 ± 4 | 10.2 |
| 3-ХФ | ** | – | |
| 4-ХФ | 114 ± 9 | 9.2 | |
| 2,4-ДХФ | 517 ± 38 | 6.7 | |
| 2,4,6-ТХФ | 108 ± 9 | 9.0 | |
| ПХФ | 100 ± 8 | 8.2 | |
| Толстолобик,
жировая ткань N = 3 |
2-ХФ | 104 ± 7 | 7.7 |
| 3-ХФ | 82 ± 6 | 8.1 | |
| 4-ХФ | 434 ± 25 | 4.5 | |
| 2,4-ДХФ | 1529 ± 62 | 2.1 | |
| 2,4,6-ТХФ | 383 ± 18 | 5.9 | |
| ПХФ | 411 ± 18 | 5.8 | |
| Толстолобик, печень N = 3 |
2-ХФ | ** | – |
| 3-ХФ | ** | – | |
| 4-ХФ | 34 ± 3 | 9.8 | |
| 2,4-ДХФ | 317 ± 38 | 6.7 | |
| 2,4,6-ТХФ | ** | – | |
| ПХФ | ** | – | |
| Плотва, молоки N = 2 |
2-ХФ | 36 ± 4 | 10.2 |
| 3-ХФ | ** | – | |
| 4-ХФ | 119 ± 10 | 9.4 | |
| 2,4-ДХФ | 928 ± 43 | 3.2 | |
| 2,4,6-ТХФ | 225 ± 16 | 7.0 | |
| ПХФ | 98 ± 7 | 8.5 | |
| Плотва, икра N = 2 |
2-ХФ | 84 ± 6 | 7.8 |
| 3-ХФ | 53 ± 4 | 8.4 | |
| 4-ХФ | 295 ± 21 | 6.5 | |
| 2,4-ДХФ | 995 ± 45 | 3.1 | |
| 2,4,6-ТХФ | 194 ± 12 | 6.8 | |
| ПХФ | 100 ± 9 | 8.1 |
* * *
Сочетание ГХ-МС с предварительным концентрированием на магнитном сорбенте на основе сверхсшитого полистирола успешно применено для определения ХФ в различных частях рыбы. Разработанный способ пробоподготовки позволяет определить шесть ХФ в сложных матрицах (мышечная ткань, печень, молоки, икра, жировые отложения). Определение затрудняют большие концентрации нефтепродуктов и жирные кислоты. Максимальное содержание ХФ установлено в жировых отложениях толстолобика (104, 82, 434, 1529, 383 и 411 нг/г для 2-ХФ, 3-ХФ, 4-ХФ, 2,4-ДХФ, 2,4,6-ТХФ и ПХФ соответственно).
Список литературы
Afsharsaveh Z., Sereshti H., Nodeh H.R. Monitoring of priority pollutants chlorophenols in water and milk by headspace solid-phase microextraction based on electrospun polycaprolactam nanofibers decorated with cadmium oxide carbon nanotubes // J. Sep. Sci. 2020. V. 43. № 22. P. 4216. https://doi.org/10.1002/jssc.202000639
Asiabi H., Yamini Y., Shamsayei M. Determination of ultra-trace amounts of chlorophenols in rain, tap and river water by an electrochemically controlled in-tube solid phase microextraction method // RSC Advances. 2016. V. 6. № 97. P. 94564. https://doi.org/10.1039/c6ra13768g
Busca G., Berardinelli S., Resini C., Arrighi L. Technologies for the removal of phenol from fluid streams: A short review of recent developments // J. Hazard. Mater. 2008. V. 160. № 2-3. P. 265. https://doi.org/10.1016/j.jhazmat.2008.03.045
Igbinosa E.O., Odjadjare E.E., Chigor V.N., Igbinosa I.H., Emoghene A.O., Ekhaise F.O., Igiehon N.O., Idemudia O.G. Toxicological profile of chlorophenols and their derivatives in the environment: The public health perspective // Sci. World J. 2013. V. 2013. Article 460215. https://doi.org/10.1155/2013/460215
Conte L.O., Schenone A.V., Alfano O.M. Photo-Fenton degradation of the herbicide 2,4-D in aqueous medium at pH conditions close to neutrality // J. Environ. Manage. 2016. V. 170. P. 60. https://doi.org/10.1016/j.jenvman.2016.01.002
Guo J., Mo J., Qi Q., Peng J., Qi G., Kanerva M., Lwata H., Li Q. Prediction of adverse effects of effluents containing phenolic compounds in the Ba River on the ovary of fish (Hemiculter leucisculus) using transcriptomic and metabolomic analyses // Sci. Total Environ. 2021. V. 801. Article 149554. https://doi.org/10.1016/j.scitotenv.2021.149554
Ge T., Han J., Qi Y., Gu X., Ma L., Zhang C., Naeem S., Huang D. The toxic effects of chlorophenols and associated mechanisms in fish // Aquatic Toxicol. 2017. V. 184. P. 78. https://doi.org/10.1016/j.aquatox.2017.01.005
Seiler J.P. Pentachlorophenol // Mutat. Res. 1991. V. 257. № 1. P. 27. https://doi.org/10.1016/0165-1110(91)90018-q
Zheng D., Jiao H., Zhong H., Qiu J., Yan X., Duan Q., Chai L.Chlorophenols in marine organisms from the southern coast of Hangzhou Bay, China, and an assessment of risks posed to human health // J. Ocean. Limnol. 2018. V. 36. P. 726. https://doi.org/10.1007/s00343-018-7039-3
Mu Y., Xing J., Shen J., Ying L., Mao L., Xu X., Lou Y., Wu X. Determination of 19 chlorophenols in fish by QuEChERS-gas chromatography-mass spectrometry // Chinese J. Chromatogr. 2022. V. 40. № 5. P. 477. https://doi.org/10.3724/SP.J.1123.2021.12002
Gilroy È.A.M., Muir D.C.G., McMaster M.E., Darling C., Campbell L.M., Alaee M., Brown S.B., Sherry J.P. Halogenated phenolic compounds in wild fish from Canadian Areas of Concern // Environ. Toxicol. Chem. 2017. V. 36. № 9. P. 2266. https://doi.org/10.1002/etc.3781
Ge J., Pan J., Fei Z., Wu G., Giesy J.P. Concentrations of pentachlorophenol (PCP) in fish and shrimp in Jiangsu Province, China // Chemosphere. 2007. V. 69. № 1. P. 164. https://doi.org/10.1016/j.chemosphere.2007.04.025
Wang L., Fang E., Wang C., Chen Y., Lin Z., Xu D. Determination of trace pentachlorophenol and its sodium salt in animal-origin foods by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry // Chinese J. Chromatogr. 2018. V. 36. № 6. P. 518. https://doi.org/10.3724/SP.J.1123.2018.03017
Kim H., Hong J.K., Kim Y.H., Kim K.R. Combined isobutoxycarbonylation and tert-butyldimethylsilylation for the GC/MS-SIM detection of alkylphenols, chlorophenols and bisphenol A in mackerel samples // Arch. Pharm. Res. 2003. V. 26. № 9. P. 697. https://doi.org/10.1007/BF02976676
ГН 2.2.5.1315-03. Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. https://docs.cntd.ru/ document/901862249 (05.02.2022).
Gubin A.S, Sukhanov P.T., Kushnir A.A., Shikhaliev Kh.S., Potapov M.A., Kovaleva E.N. Monitoring of phenols in natural waters and bottom sediments: preconcentration on a magnetic sorbent, GC–MS analysis, and weather observations // Chem. Pap. 2021. V. 75. Article 1445. https://doi.org/10.1007/s11696-020-01398-6
Бриленок Н.С., Бахарева М.В., Вершинин В.И. УФ-спектрометрическое определение суммы фенолов с применением диазотированной сульфаниловой кислоты // Журн. аналит. химии. 2018. Т. 73. № 6. С. 446. (Brilenok N.S., Bakhareva M.V., Vershinin V.I. UV-spectrometric determination of total phenols using diazotized sulfanilic acid // J. Anal. Chem. 2018. V. 73. № 6. P. 551.) https://doi.org/10.1134/S1061934818060047
Болдырев В.С., Вехов Д.А., Хоружая В.В., Самотеева В.В. Ихтиофауна Цимлянского водохранилища // Вопросы ихтиологии. 2021. Т. 61. № 1. С. 36. (Boldyrev V.S., Vekhov D.A., Khoruzhaya V.V., Samoteeva V.V. Fish fauna of the Tsimlyansk reservoir // J. Ichthyol. 2021. V. 61. P. 80.) https://doi.org/10.1134/S0032945221010045
Егунова О.Р., Решетникова И.С., Казимирова К.О., Штыков С.Н. Магнитная твердофазная экстракция и флуориметрическое определение некоторых фторхинолонов // Журн. аналит. химии. 2020. Т. 75. № 1. С. 31. (Egunova O.R., Reshetnikova I.S., Kazimirova K.O., Shtykov S.N. Magnetic solid-phase extraction and fluorimetric determination of some fluoroquinolones // J. Anal. Chem. 2020. V. 75. № 1. P. 24.) https://doi.org/10.1134/S1061934820010062
Ahmed S.F., Mofijur M., Parisa T.A., Islam N., Kusumo F., Inayat A., Le V.G., Badruddin I.A., Khan T.M.Y., Ong H.C. Progress and challenges of contaminate removal from wastewater using microalgae biomass // Chemosphere. 2022. V. 286. Article 131656. https://doi.org/10.1016/j.chemosphere.2021.131656
Davankov V.A., Tsuyrupa M.P. Hypercrosslinked Polymeric Networks and Adsorbing Materials: Synthesis, Properties, Structure and Applications. Amsterdam: Elsevier, 2010. 648 p.
Дмитриенко С.Г., Тихомирова Т.И., Апяри В.В., Толмачева В.В., Кочук Е.В., Золотов Ю.А. Применение сверхсшитых полистиролов для концентрирования и разделения органических соединений и ионов элементов // Журн. аналит. химии. 2018. Т. 73. № 11. С. 830. (Dmitrienko S.G., Tikhomirova T.I., Apyari V.V., Tolmacheva V.V., Kochuk E. V., Zolotov Yu.A. Application of hypercrosslinked polystyrenes to the preconcentration and separation of organic compounds and ions of elements // J. Anal. Chem. V. 73. № 11. Р. 1053.) https://doi.org/10.1134/S1061934818110047
Сайфутдинов Б.Р., Даванков В.А., Ильин М.М., Цюрупа М.П., Блинникова З.К. Селективная адсорбция органических соединений из растворов на сверхсшитых полистиролах с предельными степенями сшивания // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 6. С. 601. (Saifutdinov B.R., Davankov V.A., Il’in M.M., Tsyurupa M.P., Blinnikova Z.K. Selective adsorption of organic compounds from solutions on hyper-cross-linked polystyrenes with ultimate degrees of cross linking // Prot. Met. Phys. Chem. Surf .2015. V. 51. № 6. P. 957.) https://doi.org/10.1134/S2070205115060209
Пастухов А.В., Даванков В.А., Лубенцова К.И., Косандрович Е.Г., Солдатов В.С. Структура и свойства магнитных композитных сорбентов на основе сверхсшитых полистиролов // Журн. физ. химии. 2013. Т. 87. № 10. С. 1721. (Pastukhov A.V., Davankov V.A., Lubentsova K.I., Kosandrovich E.G., Soldatov V.S. Structure and properties of magnetic composite sorbents based on hypercrosslinked polystyrenes // Russ. J. Phys. Chem. 2013. V. 87. № 10. P. 1702.) https://doi.org/10.1134/S0036024413100166
Губин А.С., Суханов П.Т., Кушнир А.А., Проскурякова Е.Д. Применение магнитного сорбента на основе наночастиц Fe3O4 и сверхсшитого полистирола для концентрирования фенолов из водных растворов // Журн. прикл. химии. 2018. Т. 91. № 10. С. 1431. (Gubin A.S., Sukhanov P.T., Kushnir A.A., Proskuryakova E.D. Recovery and preconcentration of phenols from aqueous solutions with a magnetic sorbent based on Fe3O4 nanoparticles and hyper-cross-linked polystyrene // Russ. J. Appl. Chem. 2018. V. 91. № 10. P. 1626.) https://doi.org/10.1134/S1070427218100099
Андреев Ю.А., Черновьянц М.С. Газохроматографическое определение полихлорфенолов с дериватизацией ангидридом монохлоруксусной кислоты // Журн. аналит. химии. 2010. Т. 65. № 10. С. 1046. (Andreev Y.A., Chernov’yants M.S. Gas chromatographic determination of polychlorophenols after derivatization with monochloroacetic anhydride // J. Anal. Chem. 2010. V. 65. № 10. P. 1021.) https://doi.org/10.1134/S1061934810100060
Андреев Ю.А., Черновьянц М.С., Морозова В.Е. Идентификация и определение хлорированных фенолов в воде после дериватизации ангидридом монохлоруксусной кислоты газохроматографическим методом // Сорбционные и хроматографические процессы. 2014. Т. 14. № 3. С. 449.
Kim H., Kim Y., Park S., Lee J., Choi J. Gas chromatographic determination of phenol in fish tissues as a phenyl acetate derivative following solvent extraction of acidified samples // Acta Chromatogr. 2018. V. 32. № 1–4. P. 64. https://doi.org/10.1556/1326.2018.00529
Kontsas H., Rosenberg C., Jäppinen P., Riekkola M.-L. Glass fibre prefilter-XAD-2 sampling and gas chro-matographic determination of airborne chlorophenols // J. Chromatogr. A. 1993. V. 636. № 2. P. 255. https://doi.org/10.1016/0021-9673(93)80239-5
Покрышкин С.А., Косяков Д.С., Кожевников А.Ю., Лахманов Д.Е., Ульяновский Н.В. Высокочувствительное определение хлорфенолов в морской воде методом газовой хроматографии–тандемной масс-спектрометрии // Журн. аналит. химии. 2018. Т. 73. № 10. С. 768. (Pokryshkin S.A., Kosyakov D.S., Kozhevnikov A.Y., Lakhmanov D.E., Ul’yanovskii N.V. Highly sensitive determination of chlorophenols in sea water by gas chromatography–tandem mass spectrometry // J. Anal. Chem. 2018. V. 73. P. 991.) https://doi.org/10.1134/S1061934818100088
Nakamura S., Daishima S. Simultaneous determination of alkylphenols and bisphenol A in river water by stir bar sorptive extraction with in situ acetylation and thermal desorption–gas chromatography–mass spectrometry // J. Chromatogr. A. 2004. V. 1038. № 1–2. P. 291. https://doi.org/10.1016/j.chroma.2004.03.040
Maule A.G., Gannam A.L., Davis J.W. Chemical contaminants in fish feeds used in federal salmonid hatcheries in the USA // Chemosphere. 2007. V. 67. № 7. P. 1308. https://doi.org/10.1016/j.chemosphere.2006.11.029
Jackson E., Shoemaker R., Larian N., Cassis L. Adipose tissue as a site of toxin accumulation // Compr. Physiol. 2017. V. 7. № 4. P. 1085. https://doi.org/10.1002/cphy.c160038
Arnot J., Gobas F. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms // Environ. Rev. 2006. V. 14. P. 257. https://doi.org/10.1139/A06-005
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии