Журнал аналитической химии, 2023, T. 78, № 6, стр. 496-506
Определение лигнина, целлюлозы и гемицеллюлозы в растительных материалах с помощью ИК-Фурье спектроскопии
С. Г. Кострюков a, *, Х. Б. Матьякубов a, Ю. Ю. Мастерова a, А. Ш. Козлов a, М. К. Пряничникова a, А. А. Пыненков a, Н. А. Хлучина a
a Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва
430005 Саранск, ул. Большевистская, 68, Россия
* E-mail: kostryukov_sg@mail.ru
Поступила в редакцию 09.03.2022
После доработки 06.11.2022
Принята к публикации 10.11.2022
- EDN: KZNMNG
- DOI: 10.31857/S0044450223040102
Аннотация
Разработана и апробирована методика определения содержания лигнина, целлюлозы и гемицеллюлозы в растительных материалах с помощью ИК-Фурье спектроскопии в средней спектральной области. Методика основана на использовании градуировочных функций, отражающих зависимость интенсивности аналитических полос поглощения от содержания лигнина (1512 см–1) и целлюлозы (1450 см–1) в модельных образцах; для гемицеллюлозы использовали косвенные корреляции. Модельные образцы представляли собой тройные смеси, состоящие из лигнина, бактериальной целлюлозы и гемицеллюлозы в различных соотношениях. Предложенная методика апробирована на широком круге образцов растительной биомассы и характеризуется прецизионностью (sr не более 0.04). Методом введено–найдено продемонстрирована правильность методики определения основных компонентов растительной биомассы (лигнина, целлюлозы и гемицеллюлозы).
Отходы растительного происхождения обладают уникальным потенциалом для производства возобновляемой энергии и ценных химических веществ и могут способствовать в ближайшей перспективе решению проблем, связанных с использованием традиционного ископаемого топлива. Разработка и внедрение технологий химической и биотехнологической переработки растительной биомассы в биотопливо и химические вещества в настоящее время является актуальной задачей. В этом контексте знание исходного состава растительной биомассы имеет решающее значение для прогнозирования эффективности любого процесса переработки. Большинство “мокрых” аналитических методов определения целлюлозы, гемицеллюлозы и лигнина основаны на их разделении с последующим выделением [1, 2]. Однако данные методы деструктивны и трудоемки, требуют значительного количества материала, генерируют большой объем химических отходов и не всегда дают достоверные результаты [1–4]. Желательно создать простые и экспрессные спектроскопические способы определения содержания этих компонентов, среди которых ИК-спектроскопия является наиболее доступным и привлекательным методом [5].
Следует отметить, что применение ИК-спектроскопии, например, для анализа древесины началось еще во второй половине XX в. под руководством Карклиня [6, 7] и продолжается в настоящее время. В нашей стране подобные исследования выполняются группой Деркачевой; так, с помощью ИК-спектроскопии разработан способ определения содержания лигнина в бумаге [8], в сульфатной целлюлозе [9, 10], а также выполнена оценка конденсации и осаждения лигнина, происходящих при варке сульфатной целлюлозы [11, 12]. Поскольку ИК-Фурье спектроскопия отличается экспрессностью, простотой пробоподготовки и не требует большого количества исследуемого образца, ее с успехом применяют в анализе археологической древесины [13–15]. По ИК-спектрам можно не только различить породы древесины [16], но и определить место произрастания [17].
За рубежом интерес к данной тематике также высок; например, в обзоре [18] обобщены достижения в использовании ИК-спектроскопии для исследования растительной биомассы. Сравнение трех методов ИК-Фурье спектроскопии (нарушенное полное внутреннее отражение (НПВО), диффузное отражение и пропускание) дано в работе [19]. В последние годы все больший интерес вызывает использование ближней инфракрасной спектроскопии (NIRS) для качественного и количественного анализа растительных материалов [20], однако данный метод требует более сложной математической обработки в связи с перекрыванием и низкой интенсивностью аналитических полос. Описано применение ИК-Фурье спектроскопии для выявления химических различий между верхушечной и базальной древесиной двух видов амазонских деревьев, пользующихся спросом в лесной промышленности [21]. ИК-спектры получены для 150 образцов каждого вида дерева возрастом 1.8 г. Результаты показали значительные различия между верхушечным и базальным стеблем с точки зрения содержания целлюлозы, гемицеллюлозы, холоцеллюлозы и лигнина. ИК-Фурье спектроскопию удобно использовать для определения качества сырья, применяемого в производстве древесных гранул [22], а также для определения химического состава и прогнозирования термохимических свойств отходов лесозаготовок [23]. С помощью инфракрасной спектроскопии и хемометрических методов (анализ основных компонентов и иерархический кластерный анализ) исследованы комбинированные эффекты химической (с трицином и бицином) и термической обработки древесины [24]. ИК-Фурье спектроскопия может служить эффективным инструментом для выявления различий химического состава между ювенильной и зрелой древесиной сосны: модели частичной регрессии методом наименьших квадратов, построенные по стандартизированным ИК-спектрам, обеспечивают высокую точность прогнозирования содержания лигнина, целлюлозы и экстрактивных веществ [25]. В работе [26] в ИК-спектрах некоторых текстильных растений определены маркерные области, которые можно использовать при сортировке сырья. С помощью метода НПВО изучены процессы старения древесноволокнистых плит при термическом воздействии и облучении [27], в условиях щелочной экстракции древесины [28], при обработке озоном [29] и при культивировании гриба Ganoderma lucidum в течение от одного до пяти лет [30].
Таким образом, простота пробоподготовки, доступность аппаратуры и разнообразие методов делает ИК-Фурье спектроскопию незаменимым инструментом для исследования лигноцеллюлозных материалов, с помощью которого можно быстро получить качественные и количественные данные.
Цель настоящей работы состояла в разработке и апробации методики определения лигнина, целлюлозы и гемицеллюлозы с помощью ИК-Фурье спектроскопии с использованием метода прессования таблеток с KBr. В качестве объектов исследования использовали различные образцы древесины и сельскохозяйственные отходы – в общей сложности 24 образца. Содержание лигнина, целлюлозы и гемицеллюлозы, полученное методом ИК-спектроскопии, сравнивали с литературными данными [31, 32].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Стандартные соединения. Для получения градуировочной зависимости использовали бактериальную целлюлозу, крафт-лигнин и гемицелюллозу. Бактериальную целлюлозу получали в статической культуральной среде с помощью Komagataeibacter sucrofermentans H110 [33], гемицеллюлозу – из березовой древесной муки согласно методике, приведенной в работе [34], крафт-лигнин и роданид свинца приобретали у компании Sigma-Aldrich (Германия). Все соединения, используемые в качестве стандартов, предварительно высушивали при 105°С в течение 12 ч и хранили в эксикаторе над безводным CaCl2.
Растительные материалы. В качестве объектов исследования использовали несколько образцов древесины и различные сельскохозяйственные отходы, всего 24 образца. Образцы древесины собирали с живых деревьев, произрастающих в лесопарковой зоне г. Саранска. Предпочтение отдавали деревьям возраста 40–60 лет. Для взятия образцов древесины использовали возрастные буры Haglof (d = 5.15 мм, l = 100 мм), при помощи которых высверливали радиальные керны. Образцы древесины высверливали перпендикулярно продольной оси ствола на высоте примерно 1 м от поверхности земли. Сельскохозяйственные отходы, в частности, ячменная солома (сорт “Казанский 6/4”), пшеничная солома (сорт “Саратовская 36”), овсяная солома (сорт “Победа”), стебли и початки кукурузы (сорт “Стерлинг”), стебли и скорлупа семян подсолнечника (сорт “Енисей”), были предоставлены местными сельскохозяйственными производителями. Скорлупу грецкого ореха (сорт “Чандлер”), арахиса (сорт “Вирджиния”), фисташки (сорт “Узун”), фундука (сорт “Кубань”), миндаля (сорт “Монтерей”), кедрового ореха получали с орехов, приобретенных на рынке. Кокосовый орех (Индонезия) приобретали в супермаркете. Солому камыша собирали в пойме р. Инсар поздней осенью. Все образцы вначале высушивали при 60°C в течение 12 ч в термовентилируемой печи и затем измельчали до фракции 50 мкм на ультрацентробежной мельнице Retsch ZM 200. Перед всеми исследованиями образцы высушивали до постоянной массы в сушильном шкафу при 105°С в течение 12 ч.
ИК-Фурье спектроскопия. Для анализа растительных материалов вместо метода НПВО выбрали метод просвечивания с использованием таблетки с KBr, поскольку в этом случае удобно готовить искусственные смеси из веществ, взятых в качестве стандартов, для получения градуировочной зависимости. Кроме того, метод НПВО основан на принципе поверхностного отражения и больше подходит для анализа образцов, в которых все компоненты распределены в матрице однородно. Однако растительная биомасса имеет сложную трехмерную структуру, и поэтому метод таблеток с KBr дает более репрезентативную информацию. В частности, ранее отмечено [19, 35], что ИК-Фурье спектроскопия пропускания при соблюдении условия размера частиц менее 100 мкм дает более качественные спектры, чем метод НПВО или диффузного отражения. При выполнении условия одинаковой массы одного и того же образца и KBr можно получить таблетки одинаковой толщины и воспроизводимые ИК-спектры. Спектры тройных смесей и растительных материалов регистрировали при комнатной температуре, поддерживая одинаковые концентрацию анализируемого материала (0.5 мас. %) и толщину каждой таблетки (0.55 мм), чтобы результаты анализа подчинялись закону Бугера–Ламберта–Бера и оставались в линейном диапазоне градуировочной функции. Для изготовления таблеток использовали KBr, содержащий 0.1 мас. % Pb(SCN)2 в качестве внутреннего стандарта. Твердую смесь, состоящую из KBr, Pb(SCN)2 и анализируемого образца или веществ-стандартов, измельчали в размольном контейнере из карбида вольфрама полуавтоматической вибрационной мельницы Herzog HP-M 100 в течение 30 с. Затем из 200 мг полученных порошков прессовали таблетки, для которых регистрировали ИК-спектры. Прессование осуществляли на прессе Lab Tools при давлении до 20 МПа.
ИК-Фурье спектры регистрировались с помощью ИК-Фурье-спектрометра Инфра ЛЮМ ФТ-08 в диапазоне 400–4000 см–1 с разрешением 4 см–1, с использованием аподизации функцией Бесселя с временем накопления 60 с при температуре окружающей среды от 18 до 25°С, нормальном атмосферном давлении и влажности воздуха не более 80%. Для вычисления площадей пиков использовали программное обеспечение СпектраЛЮМ, версия 2.0.1.295.
Определение зольности в стандартных соединениях и образцах растительной биомассы проводили по аналогии с ГОСТ Р 56881-2016 [36] с той разницей, что для каждого образца выполняли четыре повтора.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ИК-Фурье спектры целлюлозы, гемицеллюлозы и лигнина, которые использовали в качестве соединений-стандартов, представлены на рис. 1. Подробное описание основных полос поглощения целлюлозы, гемицеллюлозы и лигнина приведено в табл. 1 [37].
Рис. 1.
ИК-спектры лигнина (а), бактериальной целлюлозы (б), гемицеллюлозы (в) в таблетках с KBr (200 мг с 0.5 мас. % вещества).
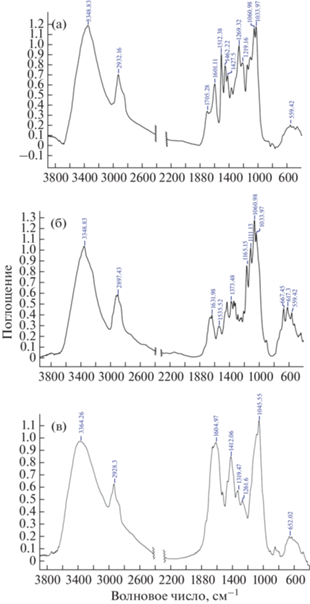
Таблица 1.
Полосы поглощения лигнина, бактериальной целлюлозы и гемицеллюлозы [37]
| Полосы поглощения, см–1 | Лигнин | Бактериальная целлюлоза | Гемицеллюлоза | |
|---|---|---|---|---|
| 3700–3100 | Валентные колебания О–Н | |||
| 3000–2750 | Симметричные и асимметричные валентные колебания С–Н в группах CH, СН2 и СН3 | |||
| 1770–1700 | Валентные колебания С=О в карбонильных и карбоксильных группах | Отсутствуют полосы поглощения | Валентные колебания С=О в ацетильных фрагментах | |
| 1675–1655 | Валентные колебания С=О в п-замещенных ароматических кетонах | Отсутствуют полосы поглощения | ||
| 1650–1615 | Деформационные колебания кристаллизационной воды | |||
| 1605–1490 | Валентные скелетные колебания С–С ароматического кольца; валентные колебания С=О |
Отсутствуют полосы поглощения | Асимметричные валентные колебания карбоксилат-аниона | |
| 1470–1460 | Асимметричные деформационные колебания С–Н в группах СН2 и СН3 | Отсутствуют полосы поглощения | Ножничные симметричные деформационные колебания С–Н в группах СН2 | |
| 1450–1400 | Валентные скелетные колебания С–С ароматического кольца, комбинированные с асимметрич-ными плоскостными деформационными колебаниями С–Н в группах OСH3 | Деформационные плоскостные колебания О–Н; ножничные колебания С–Н в группах СH2 | Симметричные валентные колебания карбоксилат-аниона; симметричные деформационные колебания С–Н в группах СН2 | |
| 1380–1370 | Отсутствуют полосы поглощения | Деформационные колебания С–Н и О–Н | Деформационные колебания С–Н в группах СН3 ацильных фрагментов | |
| 1370–1350 | Симметричные деформационные колебания С–Н в группах СН3; плоскостные деформационные колебания О–Н в фенолах | Отсутствуют полосы поглощения | Деформационные плоскостные колебания О–Н | |
| 1335–1200 | Скелетные колебания сирингильного и конденсированного гваяцильного кольца; валентные асимметричные колебания СAr–О–С; валентные колебания C–O в фенолах | Деформационные колебания С–Н; деформационные веерные колебания С–Н в группах СН2; деформационные плоскостные колебания О–Н |
||
| Симметричные валентные колебания гликозидной связи | Деформационные колебания С–О–С между ацильными группами и углеводными фрагментами | |||
| 1170–1150 | Плоскостные деформационные колебания С–Н ароматического кольца; валентные колебания С–О |
Асимметричные валентные колебания моста С–О–С между глюкопиранозными единицами | Асимметричные валентные колебания моста С–О–С между ксилопиранозными единицами | |
| 1145–1000 | Плоскостные деформационные колебания С–Н сирингильного и гваяцильного колец | Валентные колебания глюкопиранозного кольца | Валентные колебания ксилопиранозного кольца | |
| Валентные колебания С–О в спиртовых группах; симметричные и асимметричные валентные колебания С–О–С |
||||
| 925–750 | Внеплоскостные деформационные колебания С–Н ароматического кольца | Различные колебания глюкопиранозного кольца | Различные колебания ксилопиранозного кольца | |
| 700–400 | Отсутствуют полосы поглощения | Внеплоскостные деформационные колебания гидроксильных групп | ||
Анализируя спектры каждого отдельного компонента при одинаковых концентрации KBr и толщине таблеток, можно наблюдать заметные различия в интенсивности и положении некоторых полос поглощения. Так, полосу поглощения при 1512 см–1 (площадь, интегрированная между 1490 и 1530 см–1), которая в основном обусловлена скелетными колебаниями ароматического кольца, выбрали для определения лигнина. Выбор этой полосы поглощения представляется целесообразным, поскольку целлюлоза и гемицеллюлоза в этом диапазоне не имеют полос поглощения. Для определения целлюлозы использовали полосу поглощения при 1450 см–1 (площадь, интегрированная между 1405 и 1480 см–1), которая в основном приписывается ножничным колебаниям метиленовой группы и деформационным плоскостным колебаниям ОН-группы. Этот выбор сделан по аналогии с данными исследования [38]. Для нормализации интегрированных площадей аналитических полос, выбранных для количественного анализа, использовали полосу поглощения 2072 см–1 (площадь, интегрированная между 2050 и 2084 см–1), принадлежащую внутреннему стандарту Pb(SCN)2.
Что касается гемицеллюлозы, то структурно она отличается от целлюлозы присутствием ацетильных и карбоксильных групп. Однако на полосы поглощения этих групп накладываются полосы деформационных колебаний кристаллизационной воды [37], которая не удаляется при сушке образца. Количество связанной воды определяли методом термогравиметрии на термомикровесах Netzsch TG 209 F1 Libra как потерю массы образца (%) при нагреве до 150°С (условия анализа – нагрев от 100 до 200°С со скоростью нагрева 10°С/мин). Для лигнина количество связанной воды составило 3.3%, для бактериальной целлюлозы – 1.1% и для гемицеллюлозы – 7.1%. Количество кристаллизационной воды в образцах растительных материалов не превышало 5%. Таким образом, суммарное количество воды в тройных смесях примерно равнялось количеству воды в растительных материалах, поэтому поправку на присутствие воды не делали. Поскольку в спектре гемицеллюлозы имеется широкая полоса поглощения в области 1750–1510 см–1, не представляется возможным использовать полосы поглощения групп С=О или СООН в качестве аналитических. В остальном спектры целлюлозы и гемицеллюлозы вследствие структурного сходства отличаются мало, поэтому для определения гемицеллюлозы использовали косвенные корреляции между различными количествами каждого компонента в тройных смесях. В частности, рассматривали отношения лигнин/(целлюлоза + гемицеллюлоза) к количеству лигнина и целлюлоза/(гемицеллюлоза + лигнин) к количеству целлюлозы.
Для разработки модели предварительно определили зольность каждого стандартного вещества (целлюлозы, гемицеллюлозы и лигнина), чтобы учесть только реальное количество полимера. При этом выявили достаточно высокое содержание золы для лигнина (12.5 мас. %) и гемицеллюлозы (16.8 мас. %) и низкое содержание золы для бактериальной целлюлозы (0.4 мас. %).
В соответствии с процедурами, описанными в “Экспериментальной части”, приготовили несколько скорректированных по зольности тройных смесей стандартных веществ (образцы 1–10, табл. 2). Для уменьшения погрешностей ИК-спектры для каждого образца записывали пять раз, а затем усредняли. По отношению к интересующим нас полосам поглощения оценивали интегральные площади и строили график зависимости этих значений от содержания лигнина и целлюлозы. Площадь пиков вычисляли с использованием коррекции базовой линии. Состав стандартных тройных смесей, интегральные интенсивности и их нормализованные значения приведены в табл. 2.
Таблица 2.
Составы тройных смесей стандартных веществ с поправкой на зольность, площади аналитических полос поглощения и их нормализованные значения (n = 5, P = 0.95)
| Образец | Лигнин, % | Целлюлоза, % | Геми- целлюлоза, % | Лигнин, S1490–1530 ± Δ | sr | Целлюлоза, S1405–1480 ± Δ | sr | Pb(SCN)2, S2050–2080 ± Δ | sr | Лигнин, S1 ± Δ (S149–1530/ S2050–2080) | sr | Целлюлоза, S2 ± Δ(S1405–1480/ S2050-2080) | sr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 55 | 15 | 30 | 2.6 ± 0.1 | 0.03 | 2.81 ± 0.07 | 0.02 | 1.18 ± 0.04 | 0.03 | 2.21 ± 0.05 | 0.02 | 2.38 ± 0.09 | 0.03 |
| 2 | 45 | 20 | 35 | 2.05 ± 0.08 | 0.03 | 3.12 ± 0.08 | 0.02 | 1.11 ± 0.04 | 0.03 | 1.85 ± 0.05 | 0.02 | 2.81 ± 0.07 | 0.02 |
| 3 | 40 | 35 | 20 | 2.01 ± 0.07 | 0.03 | 4.37 ± 0.11 | 0.02 | 1.27 ± 0.05 | 0.03 | 1.58 ± 0.06 | 0.03 | 3.44 ± 0.09 | 0.02 |
| 4 | 35 | 40 | 25 | 1.64 ± 0.04 | 0.02 | 4.49 ± 0.11 | 0.02 | 1.25 ± 0.05 | 0.03 | 1.31 ± 0.03 | 0.02 | 3.59 ± 0.09 | 0.02 |
| 5 | 35 | 40 | 35 | 1.55 ± 0.06 | 0.03 | 4.18 ± 0.10 | 0.02 | 1.17 ± 0.03 | 0.02 | 1.32 ± 0.03 | 0.02 | 3.57 ± 0.09 | 0.02 |
| 6 | 30 | 65 | 5 | 1.35 ± 0.03 | 0.02 | 5.76 ± 0.14 | 0.02 | 1.21 ± 0.03 | 0.02 | 1.12 ± 0.03 | 0.02 | 4.76 ± 0.12 | 0.02 |
| 7 | 30 | 60 | 10 | 1.49 ± 0.06 | 0.03 | 5.69 ± 0.14 | 0.02 | 1.26 ± 0.05 | 0.03 | 1.18 ± 0.03 | 0.02 | 4.52 ± 0.11 | 0.02 |
| 8 | 25 | 60 | 15 | 1.28 ± 0.03 | 0.02 | 5.91 ± 0.15 | 0.02 | 1.31 ± 0.05 | 0.03 | 0.98 ± 0.02 | 0.02 | 4.51 ± 0.11 | 0.02 |
| 9 | 15 | 60 | 25 | 0.78 ± 0.03 | 0.03 | 5.71 ± 0.14 | 0.02 | 1.26 ± 0.05 | 0.03 | 0.62 ± 0.02 | 0.02 | 4.53 ± 0.11 | 0.02 |
Градуировочные функции для определения целлюлозы и лигнина в тройных смесях целлюлоза–гемицеллюлоза–лигнин представляют собой линейные зависимости между содержанием лигнина или целлюлозы и величинами S1 или S2 (уравнения (1) и (2)), коэффициент корреляции для уравнения (1) – 0.9947 и для уравнения (2) – 0.9977.
Определение гемицеллюлозы в тройных смесях выполняли с помощью косвенных корреляций, в частности, рассматривали зависимость отношения содержания лигнина к суммарному содержанию целлюлозы и гемицеллюлозы (X1) к параметру S1 или зависимость отношения содержания целлюлозы к суммарному содержанию гемицеллюлозы и лигнина (X2) к параметру S2 (табл. 3).
Таблица 3.
Параметры для косвенного определения содержания гемицеллюлозы (n = 5, P = 0.95)
| Образец | ${{X}_{1}} = \frac{{{{{{\omega }}}_{{{\text{лигн}}}}}}}{{{{{{\omega }}}_{{{\text{целл\;}}}}} + {{{{\omega }}}_{{{\text{гемицелл}}}}}}}$ | S1 | sr | ${{X}_{2}} = \frac{{{{{{\omega }}}_{{{\text{целл}}}}}}}{{{{{{\omega }}}_{{{\text{лигн\;}}}}} + {{{{\omega }}}_{{{\text{гемицелл}}}}}}}$ | S2 | sr |
|---|---|---|---|---|---|---|
| 1 | 1.22 | 2.21 ± 0.05 | 0.02 | 0.18 | 2.38 ± 0.09 | 0.03 |
| 2 | 0.82 | 1.85 ± 0.07 | 0.03 | 0.25 | 2.81 ± 0.07 | 0.02 |
| 3 | 0.73 | 1.58 ± 0.06 | 0.03 | 0.58 | 3.44 ± 0.09 | 0.02 |
| 4 | 0.54 | 1.31 ± 0.03 | 0.02 | 0.67 | 3.59 ± 0.09 | 0.02 |
| 5 | 0.47 | 1.32 ± 0.03 | 0.02 | 0.57 | 3.57 ± 0.09 | 0.02 |
| 6 | 0.43 | 1.12 ± 0.03 | 0.02 | 1.86 | 4.76 ± 0.12 | 0.02 |
| 7 | 0.43 | 1.18 ± 0.03 | 0.02 | 1.50 | 4.52 ± 0.11 | 0.02 |
| 8 | 0.33 | 0.98 ± 0.02 | 0.02 | 1.50 | 4.51 ± 0.11 | 0.02 |
| 9 | 0.18 | 0.62 ± 0.02 | 0.02 | 1.50 | 4.53 ± 0.11 | 0.02 |
Данные зависимости наиболее точно соответствуют степенным функциям, представленным в виде линейных зависимостей с помощью замены переменных: уравнение (3) (модель 1) и уравнение (4) (модель 2).
(3)
$\begin{gathered} \ln {{X}_{1}} = \left( {1.4833 \pm 0.0652} \right)\ln {{S}_{1}}--\left( {1.0501 \pm 0.0278} \right), \\ n = 5,\,\,\,\,P = 0.95,\,\,\,\,r = 0.9933, \\ \end{gathered} $(4)
$\begin{gathered} \ln {{X}_{2}} = \left( {3.4857 \pm 0.1269} \right)\ln {{S}_{2}}--\left( {4.8673 \pm 0.1685} \right), \\ n = 5,\,\,\,\,P = 0.95,\,\,\,\,r = 0.9954. \\ \end{gathered} $Содержание гемицеллюлозы вычисляли по формулам (5) и (6), выведенным из уравнений (3) и (4) соответственно:
(5)
${{{{\omega }}}_{{{\text{гемицелл}}}}} = \frac{{{{{{\omega }}}_{{{\text{лигн}}}}}}}{{{{X}_{1}}}}--{{{{\omega }}}_{{{\text{целл}}}}},$(6)
${{{{\omega }}}_{{{\text{гемицелл}}}}} = \frac{{{{{{\omega }}}_{{{\text{целл}}}}}}}{{{{X}_{2}}}}--{{{{\omega }}}_{{{\text{лигн}}}}}.$С использованием уравнений (1), (2), (5) и (6) определили пределы определения лигнина, целлюлозы и гемицеллюлозы. Для этого готовили тройные смеси, содержащие от 1 до 10 мас. % каждого компонента, тогда как остаток смеси составляли оставшиеся компоненты в равных соотношениях. Установили, что предел обнаружения лигнина составляет >3%, целлюлозы – >8% и гемицеллюлозы – >9%. Затем, применяя уравнения (1), (2), (5) и (6), вычислили содержание лигнина, целлюлозы и гемицеллюлозы в растительных материалах (табл. 4), здесь же приведены литературные данные. Как видно из табл. 4, рассчитанные на основании ИК-спектров данные по составу растительных материалов в целом соответствуют приведенным в литературе значениям [31, 32]. Сравнение результатов для гемицеллюлозы, полученных с помощью уравнений (5) и (6), говорит о том, что модель тройных смесей дает разумные значения содержания гемицеллюлозы для большинства образцов растительной биомассы, за исключением овсяной, пшеничной, ячменной соломы, стеблей кукурузы, подсолнечника и скорлупы некоторых орехов, что, по-видимому, объясняется отличием реального состава данных образцов биомассы от состава тройных смесей из-за присутствия в них других компонентов, таких как экстрактивные вещества и белки, которые не учитывались в данном исследовании.
Таблица 4.
Содержания (%) лигнина, целлюлозы и гемицеллюлозы в образцах лигноцеллюлозной биомассы, рассчитанные на основе ИК-спектров и приведенные в литературе (n = 5, P = 0.95)
| Образец | Лигнин | Целлюлоза | Гемицеллюлоза | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ИК | sr | данные литературы | ИК | sr | данные литературы |
ИК (1) | sr | ИК (2) | sr | данные литературы |
|
| Древесина ели [31]* | 26.6 ± 1.3 | 0.04 | 27.9 | 46.1 ± 1.1 | 0.02 | 45.5 | 28.35 ± 0.7 | 0.02 | 26.3 ± 1.0 | 0.03 | 22.9 |
| Древесина сосны [31] | 19.10 ± 0.95 | 0.04 | 20.0 | 47.0 ± 1.2 | 0.02 | 42.0–50.0 | 38.4 ± 1.4 | 0.03 | 32.8 ± 1.2 | 0.03 | 24.0–27.0 |
| Древесина лиственницы [31] | 29.8 ± 1.5 | 0.04 | 28.5 | 48.0 ± 1.8 | 0.03 | 47.5 | 22.1 ± 0.8 | 0.03 | 20.8 ± 0.8 | 0.03 | 24.5 |
| Древесина осины [31] | 20.3 ± 1.0 | 0.04 | 19.5 | 51.1 ± 1.3 | 0.02 | 52.7 | 32.5 ± 1.6 | 0.04 | 26.9 ± 1.0 | 0.03 | 21.7 |
| Древесина тополя [31] | 31.0 ± 1.2 | 0.03 | 29.1 | 38.0 ± 1.4 | 0.03 | 39.8 | 30.6 ± 1.1 | 0.03 | 33.5 ± 1.3 | 0.03 | 14.8 |
| Древесина бука [31] | 23.7 ± 1.2 | 0.04 | 21.0 | 39.1 ± 1.5 | 0.03 | 40.0 | 39.55 ± 2.0 | 0.04 | 39.1 ± 1.0 | 0.02 | 23.0 |
| Древесина дуба [31] | 32.5 ± 1.2 | 0.03 | 35.4 | 44.1 ± 1.6 | 0.03 | 43.2 | 22.7 ± 0.8 | 0.03 | 23.0 ± 0.9 | 0.03 | 21.9 |
| Древесина ивы [31] | 17.9 ± 0.7 | 0.03 | 16.9–18.9 | 43.0 ± 1.6 | 0.03 | 42.4–45.3 | 44.0 ± 1.6 | 0.03 | 39.1 ± 1.5 | 0.03 | 20.6–22.9 |
| Древесина вишни [31] | 19.6 ± 0.7 | 0.03 | 18.0 | 46.1 ± 1.7 | 0.03 | 46.0 | 38.6 ± 1.4 | 0.03 | 33.4 ± 1.2 | 0.03 | 29.0 |
| Ячменная солома [31] | 10.1 ± 0.5 | 0.04 | 6.3–13.1 | 41.0 ± 2.0 | 0.04 | 36.0–43.0 | 50.1 ± 2.5 | 0.04 | 49.7 ± 1.9 | 0.03 | 24.0–33.0 |
| Пшеничная солома [31] | 13.3 ± 0.5 | 0.03 | 12.0–16.0 | 37.1 ± 1.4 | 0.03 | 35.0–39.0 | 54.6 ± 2.0 | 0.03 | 52.7 ± 2.0 | 0.03 | 23.0–30.0 |
| Овсяная солома [32] | 14.7 ± 0.7 | 0.04 | 10.0–15.0 | 32.95 ± 1.6 | 0.04 | 31.0–35.0 | 57.7 ± 2.9 | 0.04 | 58.3 ± 2.9 | 0.04 | 20.0–26.0 |
| Стебли кукурузы [32] | 12.0 ± 0.5 | 0.03 | 7.0–18.4 | 38.0 ± 1.4 | 0.03 | 35.0–39.6 | 54.0 ± 2.0 | 0.03 | 52.45 ± 1.95 | 0.03 | 16.8–35.0 |
| Сердцевины початков кукурузы [32] | 7.7 ± 0.4 | 0.04 | 6.1–15.9 | 39.95 ± 1.5 | 0.03 | 33.7–41.2 | 46.1 ± 2.3 | 0.04 | 53.7 ± 2.7 | 0.04 | 31.9–36.0 |
| Стебли подсолнечника [32] | 9.1 ± 0.3 | 0.03 | 7.7–13.4 | 41.0 ± 1.5 | 0.03 | 34.1–42.1 | 48.7 ± 1.8 | 0.03 | 50.6 ± 1.9 | 0.03 | 5.18–9.71 |
| Скорлупа семян подсолнечника [32] | 23.5 ± 1.2 | 0.04 | 20–25 | 48.0 ± 1.2 | 0.02 | 45–55 | 30.9 ± 1.5 | 0.04 | 27.1 ± 1.4 | 0.04 | 23–28 |
| Скорлупа грецкого ореха [31] | 52.1 ± 1.9 | 0.03 | 53.5 | 24.0 ± 0.9 | 0.03 | 23.3 | 24.3 ± 0.9 | 0.03 | 34.8 ± 1.3 | 0.03 | 20.4 |
| Скорлупа арахиса [32] | 28.6 ± 1.1 | 0.03 | 28.0 | 38.0 ± 1.4 | 0.03 | 37.0 | 33.8 ± 1.3 | 0.03 | 35.9 ± 1.3 | 0.03 | 18.7 |
| Скорлупа фисташки [31] | 30.0 ± 1.1 | 0.03 | 29.4 | 15.9 ± 0.8 | 0.04 | 15.2 | 54 ± 2 | 0.03 | 51.5 ± 1.9 | 0.03 | 38.2 |
| Скорлупа фундука [32] | 39.25 ± 1.95 | 0.04 | 38.0 | 30.1 ± 1.5 | 0.04 | 30.0 | 29.1 ± 1.4 | 0.04 | 38.8 ± 1.9 | 0.04 | 23 |
| Скорлупа миндаля [31] | 35.4 ± 1.3 | 0.03 | 36.0 | 27.1 ± 1.0 | 0.03 | 27.0 | 36.3 ± 1.4 | 0.03 | 47.7 ± 1.8 | 0.03 | 30 |
| Скорлупа кедрового ореха [31] | 37.6 ± 1.9 | 0.04 | 38.0 | 32.1 ± 1.6 | 0.04 | 31.0 | 28.9 ± 1.4 | 0.04 | 37.0 ± 1.8 | 0.04 | 25 |
| Скорлупа кокосового ореха [32] | 31.0 ± 0.8 | 0.02 | 29.0 | 37.1 ± 1.4 | 0.03 | 36.0 | 31.5 ± 0.8 | 0.02 | 34.9 ± 0.9 | 0.02 | 25 |
| Солома камыша [32] | 9.1 ± 0.5 | 0.04 | 8.7 | 50.0 ± 1.9 | 0.03 | 49.4 | 39.8 ± 2.0 | 0.04 | 39.3 ± 2.0 | 0.04 | 31.5 |
Относительное стандартное отклонение результатов анализа всех образцов не превышает 0.04, поэтому можно утверждать, что разработанная методика характеризуется хорошей воспроизводимостью измерений.
Методом введено–найдено оценили правильность предложенной методики определения лигнина, целлюлозы и гемицеллюлозы. Для этого готовили образцы, состоящие из 80 мас. % растительного материала с добавкой 20 мас. % лигнина, целлюлозы или гемицеллюлозы. Анализировали три независимо приготовленных одинаковых по составу образцах. В табл. 5 приведены вычисленные и найденные содержания лигнина, целлюлозы или гемицеллюлозы в данных образцах. Для определения гемицеллюлозы использовали уравнение (5). Представленные в табл. 5 данные свидетельствуют о правильности разработанной методики для определения лигнина, целлюлозы и гемицеллюлозы в растительных материалах.
Таблица 5.
Вычисленные и найденные по методу введено–найдено содержания лигнина, целлюлозы и гемицеллюлозы в образцах лигноцеллюлозной биомассы (n = 5, P = 0.95)
| Образец (80%) | Лигнина (+20%) | sr | Целлюлозы (+20%) | sr | Гемицеллюлозы (+20%) | sr | |||
|---|---|---|---|---|---|---|---|---|---|
| вычислено | найдено | вычислено | найдено | вычислено | найдено | ||||
| Древесина ели | 41.3 | 41.55 ± 0.5 | 0.01 | 56.7 | 56.8 ± 0.7 | 0.01 | 42.7 | 43.1 ± 0.5 | 0.01 |
| Древесина сосны | 35.3 | 35.3 ± 0.4 | 0.01 | 57.6 | 57.8 ± 0.7 | 0.01 | 50.7 | 51.0 ± 0.6 | 0.01 |
| Древесина лиственницы | 43.8 | 43.7 ± 0.5 | 0.01 | 58.4 | 58.4 ± 0.7 | 0.01 | 37.7 | 37.9 ± 0.5 | 0.01 |
| Древесина осины | 36.2 | 36.5 ± 0.9 | 0.02 | 60.9 | 61.0 ± 0.8 | 0.01 | 46.0 | 47.0 ± 0.6 | 0.01 |
| Древесина тополя | 44.8 | 44.60 ± 0.55 | 0.01 | 50.4 | 50.8 ± 0.6 | 0.01 | 44.5 | 44.8 ± 0.6 | 0.01 |
| Древесина бука | 39.0 | 39.0 ± 0.5 | 0.01 | 51.3 | 51.6 ± 0.6 | 0.01 | 51.6 | 51.4 ± 1.3 | 0.02 |
| Древесина дуба | 46.0 | 46.1 ± 1.2 | 0.02 | 55.3 | 55.6 ± 0.7 | 0.01 | 38.1 | 38.5 ± 1.0 | 0.02 |
| Древесина ивы | 34.3 | 34.2 ± 0.4 | 0.01 | 54.4 | 54.9 ± 0.7 | 0.01 | 55.2 | 55.5 ± 0.7 | 0.01 |
| Древесина вишни | 35.7 | 35.6 ± 0.9 | 0.02 | 56.9 | 57.1 ± 0.7 | 0.01 | 50.9 | 51.1 ± 1.3 | 0.02 |
| Ячменная солома | 28.1 | 28.0 ± 0.4 | 0.01 | 52.8 | 53.1 ± 0.7 | 0.01 | 60.1 | 59.9 ± 0.7 | 0.01 |
| Пшеничная солома | 30.6 | 30.8 ± 0.8 | 0.02 | 49.7 | 49.9 ± 0.6 | 0.01 | 63.7 | 63.6 ± 1.6 | 0.02 |
| Овсяная солома | 31.8 | 31.95 ± 0.4 | 0.01 | 46.4 | 46.4 ± 1.2 | 0.02 | 66.2 | 66.3 ± 1.7 | 0.02 |
| Стебли кукурузы | 29.2 | 29.7 ± 0.4 | 0.01 | 50.4 | 50.5 ± 1.3 | 0.02 | 63.2 | 63.8 ± 0.8 | 0.01 |
| Сердцевины початков кукурузы | 26.1 | 26.4 ± 0.7 | 0.02 | 52.0 | 52.1 ± 0.7 | 0.01 | 56.9 | 57.0 ± 1.4 | 0.02 |
| Стебли подсолнечника | 27.3 | 27.6 ± 0.3 | 0.01 | 52.8 | 52.6 ± 0.7 | 0.01 | 59.0 | 59.2 ± 0.7 | 0.01 |
| Скорлупа семян подсолнечника | 38.8 | 38.6 ± 0.5 | 0.01 | 58.4 | 58.9 ± 0.7 | 0.01 | 44.7 | 44.35 ± 0.55 | 0.01 |
| Скорлупа грецкого ореха | 61.7 | 61.6 ± 0.8 | 0.01 | 39.2 | 39.4 ± 0.5 | 0.01 | 39.5 | 40.0 ± 0.5 | 0.01 |
| Скорлупа арахиса | 42.85 | 42.4 ± 1.1 | 0.02 | 50.4 | 50.8 ± 0.6 | 0.01 | 47.0 | 47.1 ± 0.6 | 0.01 |
| Скорлупа фисташки | 44.0 | 44.2 ± 0.6 | 0.01 | 32.7 | 32.9 ± 0.4 | 0.01 | 63.2 | 63.4 ± 0.8 | 0.01 |
| Скорлупа фундука | 51.4 | 51.05 ± 0.6 | 0.01 | 44.1 | 44.3 ± 1.1 | 0.02 | 43.3 | 43.7 ± 0.5 | 0.01 |
| Скорлупа миндаля | 48.3 | 48.6 ± 0.6 | 0.01 | 41.6 | 41.8 ± 1.0 | 0.02 | 49.0 | 48.9 ± 1.2 | 0.02 |
| Скорлупа кедрового ореха | 50.0 | 49.9 ± 1.2 | 0.02 | 45.7 | 45.6 ± 0.6 | 0.01 | 43.1 | 43.9 ± 1.1 | 0.02 |
| Скорлупа кокосового ореха | 44.8 | 45.65 ± 0.6 | 0.01 | 49.7 | 50.0 ± 1.2 | 0.02 | 45.2 | 45.5 ± 1.1 | 0.02 |
| Солома камыша | 27.3 | 28.7 ± 0.4 | 0.01 | 60.0 | 60.5 ± 1.5 | 0.02 | 51.8 | 51.95 ± 0.65 | 0.01 |
* * *
Таким образом, с помощью ИК-Фурье спектроскопии, используя стандартный метод прессования таблеток с KBr, при соблюдении условий одинаковой степени измельчения материала таблетки и точности взвешивания возможно определение содержания лигнина, целлюлозы и гемицеллюлозы в растительных материалах по уравнениям градуировочных функций, полученным для основе тройных смесей, состоящих из лигнина, целлюлозы и гемицеллюлозы. Правильность предлагаемой методики проверена методом введено–найдено.
Список литературы
Оболенская А.В., Ельницкая З.П., Леонович А.А. Лабораторные работы по химии древесины и целлюлозы. М.: Экология, 1991. 320 с.
Baeza J., Freer J. Chemical characterization of wood and its components / Wood and Cellulosic Chemistry / Eds. Hon D.N.S., Shiraishi D. N. S. Boca Raton: CRC Press, 2000. P. 275. https://doi.org/10.1201/9781482269741
Tian X., Fang Z., Smith R.L., Wu Z., Liu M. Properties, chemical characteristics and application of lignin and its derivatives / Production of Biofuels and Chemicals from Lignin / Eds. Fang Zh., Smith R.L. Singapore: Springer, 2016. P. 3. https://doi.org/10.1007/978-981-10-1965-4_1
Tappi T222 Om-02. Acid-insoluble lignin in wood and pulp. TAPPI Test Methods, 2006. https://www.tappi.org/content/SARG/T222.pdf (18.11.2022).
Castillo R.P., Peña-Farfal C., Neira Y., Freer J. Advances in analytical methodologies based on infrared spectroscopy for analysis of lignocellulosic materials: From classic characterization of functional groups to FT-IR imaging and micro-quantification / Fourier Transform Infrared Spectroscopy (FTIR): Methods, Analysis and Research Insights / Ed. Moore E. N.Y.: Nova Science, 2016. P. 36.
Карклинь Б.Н., Трейманис А.П., Громов В.С. ИК-спектроскопия древесины и ее основных компонентов. VI. Определение содержания лигнина в препаратах сульфатной целлюлозы по ИК-спектрам // Химия древесины. 1975. № 2. С. 52.
Карклинь В.Б., Эйдус Я.А., Крейцберг З.Н. ИК-спектроскопия древесины и ее основных компонентов. XII. Спектрохимические корреляции и их применение к анализу лигнина в древесине // Химия древесины. 1977. № 4. С. 90.
Деркачева О.Ю., Цыпкин Д.О. Оценка содержания лигнина в волокнах бумаги по данным ИК спектроскопии отражения // Журн. прикл. спектроскопии. 2017. Т. 84. № 6. С. 993. (Derkacheva O.Y., Tsypkin D.O. Lignin content in paper fibers assessed using IR reflectance spectroscopy // J. Appl. Spectrosс. 2018. V. 84. № 6. P. 1071.) https://doi.org/10.1007/s10812-018-0588-6
Афанасьев Н.И., Личутина Т.Ф., Русакова М.А., Прокшин Г.Ф., Вишнякова А.П., Сухов Д.А., Деркачева О.Ю. Оценка содержания и структурных изменений остаточного лигнина и смолы в лиственной сульфатной целлюлозе методом ИК Фурье-спектроскопии // Журн. прикл. спектроскопии. 2006. Т. 79. № 10. С. 1706. (Afanas’ev N.I., Lichutina T.F., Rusakova M.A., Prokshin G.F., Vishnyakova A.P., Sukhov D.A., Derkacheva O.Y. Estimation of the content and assessment of structural transformations of residual lignin and resin in deciduous kraft pulp by Fourier IR spectroscopy // Russ. J. Appl. Chem. 2006. V. 79. № 10. P. 1689.) https://doi.org/10.1134/S1070427206100260
Деркачева О.Ю., Сухов Д.А., Федоров А.В. Оценка состояния лигнина в сульфатных волокнах по данным ИК спектроскопии // Вестник Тверского государственного университета. Серия: Химия. 2017. № 1. С. 71.
Fiskari J., Derkacheva O., Kulomaa T., Sukhov D. Quick non-destructive analysis of lignin condensation and precipitation by FTIR // Cellul. Chem. Technol. 2016. V. 50. № 2. P. 217.
Fiskari J., Derkacheva O., Kulomaa T. Quick non-destructive analysis of condensed lignin by ftir. Part 2. Pulp samples from acid sulfite cooking // Cellul. Chem. Technol. 2021. V. 55. № 3–4. P. 270. https://doi.org/10.35812/CELLULOSECHEMTECHNOL.2021.55.26
Traoré M., Kaal J., Martínez Cortizas A. Application of FTIR spectroscopy to the characterization of archeological wood // Spectrochim. Acta A. 2016. V. 153. P. 63. https://doi.org/10.1016/j.saa.2015.07.108
Пожидаев В.М., Ретивов В.М., Панарина Е.И., Сергеева Я.Э., Жданович О.А., Яцишина Е.Б. Разработка метода идентификации породы древесины в археологических материалах методом ИК-спектроскопии // Журн. аналит. химии. 2019. Т. 74. № 12. С. 911. (Pozhidaev V.M., Sergeeva Y.E., Yatsishina E.B., Retivov V.M., Panarina E.I., Zhdanovich O.A. Development of a method for identifying wood species in archaeological materials by IR spectroscopy // J. Anal. Chem. 2019. V. 74. № 12. P. 1192.) https://doi.org/10.1134/S1061934819120104
Пожидаев В.М., Сергеева Я.Э., Малахов С.Н., Яцишина Е.Б. Идентификация породы археологической древесины методом ИК-спектроскопии // Журн. аналит. химии. 2021. Т. 76. № 5. С. 408. (Pozhidaev V.M., Sergeeva Y.E., Malakhov S.N., Yatsishina E.B. Identification of archaeological wood species by IR spectroscopy // J. Anal. Chem. 2021. V. 76. № 5. P. 573.) https://doi.org/10.1134/S1061934821050142
Pandey K.K. A study of chemical structure of soft and hardwood and wood polymers by FTIR spectroscopy // J. Appl. Polym. Sci. 1999. V. 71. № 12. P. 1975. https://doi.org/10.1002/(sici)1097-4628(19990321)71: 12<1969::aid-app6>3.0.co;2-d
Traoré M., Kaal J., Martínez Cortizas A. Differentiation between pine woods according to species and growing location using FTIR-ATR // Wood Sci. Technol. 2018. V. 52. № 2. P. 487. https://doi.org/10.1007/s00226-017-0967-9
Xu F., Yu J., Tesso T., Dowell F., Wang D. Qualitative and quantitative analysis of lignocellulosic biomass using infrared techniques: A mini-review // Appl. Energy. 2013. V. 104. P. 809. https://doi.org/10.1016/j.apenergy.2012.12.019
Gogna M., Goacher R.E. Comparison of three fourier transform infrared spectroscopy sampling techniques for distinction between lignocellulose samples // BioResources. 2018. V. 13. № 1. P. 846. https://doi.org/10.15376/biores.13.1.846-860
Wang Y., Xiang J., Tang Y., Chen W., Xu Y. A review of the application of near-infrared spectroscopy (NIRS) in forestry // Appl. Spectrosc. Rev. 2022. V. 57. № 4. P. 300. https://doi.org/10.1080/05704928.2021.1875481
Javier-Astete R., Jimenez-Davalos J., Zolla G. Determination of hemicellulose, cellulose, holocellulose and lignin content using FTIR in Calycophyllum spruceanum (Benth.) K. Schum. and Guazuma crinita Lam. // PLoS ONE. 2021. V. 16. № 10. Article e0256559. https://doi.org/10.1371/journal.pone.0256559
Toscano G., Maceratesi V., Leoni E., Stipa P., Laudadio E., Sabbatini S. FTIR spectroscopy for determination of the raw materials used in wood pellet production // Fuel. 2022. V. 313. Article 123017. https://doi.org/10.1016/j.fuel.2021.123017
Acquah G.E., Via B.K., Fasina O.O., Eckhardt L.G. Rapid quantitative analysis of forest biomass using Fourier transform infrared spectroscopy and partial least squares regression // J. Anal. Methods: Chem. 2016. Article 1839598. https://doi.org/10.1155/2016/1839598
Popescu C.-M., Jones D., Kržišnik D., Humar M. Determination of the effectiveness of a combined thermal/chemical wood modification by the use of FT–IR spectroscopy and chemometric methods // J. Mol. Struct. 2020. V. 1200. Article 127133. https://doi.org/10.1016/j.molstruc.2019.127133
Funda T., Fundova I., Gorzsás A., Fries A., Wu H.X. Predicting the chemical composition of juvenile and mature woods in Scots pine (Pinus sylvestris L.) using FTIR spectroscopy // Wood Sci. Technol. 2020. V. 54. № 2. P. 289. https://doi.org/10.1007/s00226-020-01159-4
Vârban R., Crișan I., Vârban D., Ona A., Olar L., Stoie A., Ștefan R. Comparative FT-IR prospecting for cellulose in stems of some fiber plants: Flax, velvet leaf, hemp and jute // Appl. Sci. 2021. V. 11. № 18. Article 8570. https://doi.org/10.3390/app11188570
Grigoryevich A.B., Semyon M., Alexander M., Leonidovich Y.R. Characteristics of aging of wood-fiberboard from the position of IR spectroscopy // JAES. 2020. V. 18. № 4. P. 624. https://doi.org/10.5937/jaes0-29431
Lehto J., Louhelainen J., Kłosińska T., Drożdżek M., Alén R. Characterization of alkali-extracted wood by FTIR-ATR spectroscopy // Biomass Convers. Biorefin. 2018. V. 8. № 4. P. 847. https://doi.org/10.1007/s13399-018-0327-5
Мамлеева Н.А., Шумянцев А.В., Харланов А.Н. Деградация структуры древесины Populus tremula при делигнификации озоном. Термический анализ // Журн. физ. химии. 2021. Т. 95. № 4. С. 534. (Mamleeva N.A., Shumyantsev A.V., Kharlanov A.N. Degradation of structure of Populus tremula Wood during delignification with ozone. Thermal analysis // Russ. J. Phys. Chem. 2021. V. 95. P. 682.) https://doi.org/10.31857/S0044453721040166
Weiwei Z., Xiangdong Ch., Guohui L., Gaoping J., Ye L., Guoqiang L., Choong Y.K., Jin L. Study on the chemical changes of Quercus acuttisima by Ganoderma lucidum cultivation after different years by FTIR analysis // Spectrochim. Acta A. 2022. V. 266. Article 120443. https://doi.org/10.1016/j.saa.2021.120443
Kumar B., Bhardwaj N., Agrawal K., Chaturvedi V., Verma P. Current perspective on pretreatment technologies using lignocellulosic biomass: An emerging biorefinery concept // Fuel Process. Technol. 2020. V. 199. Article 106244. https://doi.org/10.1016/j.fuproc.2019.106244
Nanda S., Mohammad J., Reddy S.N., Kozinski J.A., Dalai A.K. Pathways of lignocellulosic biomass conversion to renewable fuels // Biomass Convers. Biorefin. 2013. № 4. P. 191. https://doi.org/10.1007/s13399-013-0097-z
Ревин В.В., Лияськина Е.В., Сапунова Н.Б., Богатырева А.О. Выделение и характеристика штаммов – продуцентов бактериальной целлюлозы // Микробиология. 2020. Т. 89. № 1. С. 88. (Revin V.V., Liyas’kina E.V., Sapunova N.B., Bogatyreva A.O. Isolation and characterization of the strains producing bacterial cellulose // Microbiology. 2020. V. 89. P. 95.) https://doi.org/10.1134/S0026261720010130
da Silva Braga R., Poletto M. Preparation and characterization of hemicellulose films from sugarcane bagasse // Materials. 2020. V. 13. № 4. Article 941. https://doi.org/10.3390/ma13040941
Fai O., Böttcher J.H. The influence of particle size and concentration in transmission and diffuse reflectance spectroscopy of wood // Holz. Roh. Werkst. 1992. V. 50. № 6. P. 221. https://doi.org/10.1007/BF02650312
ГОСТ Р 56881-2016. Биомасса. Определение зольности стандартным методом Biomass. Determination of the ash content by standard method. М.: Стандартинформ, 2019. С. 6.
Базарнова Н.Г., Карпова Е.В., Катраков И.Б., Маркин В.И., Микушина И.В., Ольхов Ю.А., Худенко С.В. Методы исследования древесины и ее производных. Барнаул: Изд-во Алт. гос. ун-та, 2002. 160 с.
Raspolli Galletti A.M., D’Alessio A., Licursi D., Antonetti C., Valentini G., Galia A., Di Nasso N.N. Midinfrared FT-IR as a tool for monitoring herbaceous biomass composition and its conversion to furfural // J. Spectroscopy. 2015. V. 2015. Article 719042. https://doi.org/10.1155/2015/719042
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


