Журнал аналитической химии, 2023, T. 78, № 6, стр. 559-567
Комплексная кулонометрическая оценка антиоксидантных свойств пива
С. Ю. Матвеева a, Г. К. Зиятдинова a, *
a Химический институт им. А.М. Бутлерова, Казанский федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Ziyatdinovag@mail.ru
Поступила в редакцию 28.08.2022
После доработки 04.11.2022
Принята к публикации 07.11.2022
- EDN: KZOCAF
- DOI: 10.31857/S0044450223040114
Аннотация
Оценена реакционная способность кулонометрических титрантов (брома, иода и гексацианоферрат(III)-ионов) по отношению к антиоксидантам (АО) пива. Показано, что электрогенерированный иод взаимодействует с аскорбиновой кислотой и серосодержащими соединениями, но не окисляет фенольные АО. Найдены стехиометрические коэффициенты реакций фенольных АО с электрогенерированными бромом и гексацианоферрат(III)-ионами. Проведена комплексная оценка антиоксидантных свойств пива через обобщенные антиоксидантные показатели (интегральную антиоксидантную емкость (АОЕ) по реакции с электрогенерированным бромом, железовосстанавливающую способность (ЖВС) по реакции с электрогенерированными гексацианоферрат(III)-ионами и окисляемость по иоду). Рассмотрены 16 образцов, отличающихся типом брожения, сортом и стилем. Показано статистически достоверное отличие параметров для отдельных образцов. Интегральная АОЕ и ЖВС пива коррелирует с общим содержанием фенольных соединений и антиоксидантной активностью (r = 0.7175−0.8703 при rкрит = 0.4973), что подтверждает правильность полученных с помощью кулонометрического титрования результатов. Различия обобщенных антиоксидантных параметров пива верхового и низового брожения, а также фильтрованного и нефильтрованного светлого и темного пива статистически незначимы (p = 0.10−0.82). Оценено изменение обобщенных антиоксидантных параметров пива при хранении на воздухе.
Пиво является источником антиоксидантов (АО), среди которых выделяют фенольные АО, продукты реакции Майяра и сульфиты [1]. Основными АО пива являются фенольные соединения, большая часть которых поступает из ячменя (более 60% общего содержания [2]), остальные – из хмеля. Фенольные соединения оказывают влияние на свойства пива, в частности, на окислительную стабильность (например, возникновение помутнения, образование цвета, вкуса, фильтрацию, стабильность пены и окислительно-восстановительное состояние) и микробную безопасность [3, 4].
Ячмень содержит различные классы фенольных соединений: фенольные кислоты (бензойную и коричную кислоты и их производные), проантоцианидины, хинины, флаванолы, халконы, флавоны, флаваноны и аминофенольные соединения. Они могут присутствовать в свободной, этерифицированной или нерастворимой связанной форме, которые количественно распределяются между различными тканями ячменных зерен [3, 5]. Основными низкомолекулярными АО в зернах ячменя являются фенольные кислоты (феруловая и п-кумаровая кислота), находящиеся в основном во внешних слоях зерна (шелухе, околоплоднике, семеннике и алейрон), но также обнаруживаются в эндосперме. В конечном продукте содержание гидроксикоричных кислот составляет около 600 мг/л [6]. Другие фенольные кислоты (ванилиновая, синаповая и п-гидроксибензойная кислоты) присутствуют в связанном состоянии [7]. Также в ячмене содержится ряд флаван-3-олов: мономеры (катехин и эпикатехин), димеры (продельфинидин B3 и процианидин B3) и тримеры (процианидин C2), высокомолекулярные танины, производные флавоноидов [7]. В процессе соложения происходят изменения в составе ячменя, включая уменьшение содержания эндогенных фенольных соединений [7]. Кроме того, показано, что содержание фенольных соединений в солоде обычно выше, чем в ячмене, но количественное соотношение различных классов АО почти идентично, что свидетельствует о лучшем извлечении флавоноидов и фенольных кислот из солода после обжига [8‒10].
Аромат и вкус пива обусловлен также присутствием летучих фенольных соединений. Выделяют два основных летучих фенола – 4-винилгваякол и 4-винилфенол, которые могут образовываться в ходе восстановления 4-этилгваякола и 4-этилфенола, а также при декарбоксилировании гидроксикоричных кислот в ходе ферментации или в результате термического воздействия на стадиях кипячения сусла, выдерживания в вихревой ванне или пастеризации [11].
Таким образом, оценка антиоксидантных свойств пива представляет практический интерес, а антиоксидантные параметры могут использоваться как для оценки качества пива, так и для контроля технологии его изготовления. Для этих целей используют два подхода: определение индивидуальных АО в пиве или оценку обобщенных антиоксидантных показателей.
В первом случае задача решается методом хроматографии с различными типами детектирования [12]. Обобщенные антиоксидантные показатели оценивают либо по данным хроматографии, суммируя содержание индивидуальных АО отдельных классов, либо спектрофотометрическими методами [13‒15], применяя стандартные параметры (общее содержание фенольных соединений [13, 14], железовосстанавливающую способность (ЖВС) [15], антиоксидантную активность по реакции с 2,2-дифенил-1-пикрилгидразилом [13‒15] или с супероксид анион-радикалом [13]).
Антиоксиданты пива являются электрохимически активными соединениями. Описано несколько способов электрохимической оценки антиоксидантных свойств пива, для чего предложено несколько типов биосенсоров. Биосенсор на основе тирозиназы и поли(3,4-этилендиокситиофена), иммобилизованных на угольном электроде с соногелем в качестве связующего компонента пасты, позволяет оценить антиоксидантную емкость пива, обусловленную окислением АО фенольного типа. В качестве стандарта использована кофейная кислота [16]. Другой оригинальный биосенсор на основе ткани яблока, включенной в угольную пасту, дает отклик на фенольные АО за счет реакции их окисления под действием полифенолоксидазы, содержащейся в ткани яблока [17]. Сенсор применен для оценки общего содержания флаванолов в пиве. Описан ДНК-сенсор с внешней мембраной Нафиона для оценки антиоксидантных свойств пива [18]. Сенсор получали путем послойного нанесения низкомолекулярной ДНК и Нафиона на поверхность печатного угольного электрода. Измерение проводили в условиях циклической вольтамперометрии или спектроскопии электрохимического импеданса в присутствии редокс-пары гексацианоферрат(II)/(III). Для оценки антиоксидантных свойств пива использовали относительное изменение отклика сенсора на редокс-медиатор в ходе инкубирования сенсора в среде, содержащей гидроксильные радикалы, в отсутствие и в присутствии пива [18].
Предложен способ оценки антиоксидантной активности пива, основанный на изменении тока окисления пероксида водорода на ртутном капающем электроде [19]. Антиоксидантную активность выражали как объем пива (мкл), который обеспечивает 50%-ное уменьшение тока окисления 5.7 мМ H2O2.
Таким образом, разработка новых электрохимических способов оценки антиоксидантных свойств пива представляет актуальную задачу, для решения которой предложена гальваностатическая кулонометрия с электрогенерированными титрантами. Такой подход хорошо зарекомендовал себя для объектов растительного происхождения, содержащих фенольные АО (специй [20‒22], чая и кофе [23, 24], коньяков и бренди [25], лекарственного растительного сырья [26]). Применительно к пиву такой подход является новым. Варьирование кулонометрических титрантов позволило провести комплексную оценку антиоксидантных свойств пива через обобщенные антиоксидантные показали (интегральную антиоксидантную емкость (АОЕ) по реакции с электрогенерированным бромом, ЖВС по реакции с электрогенерированными гексацианоферрат(III)-ионами и окисляемость по иоду).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы. Использовали феруловую (99%) и хлорогеновую (95%) кислоты (Aldrich, Германия); кофейную (98%), аскорбиновую (99%), галловую (99%) и п-кумаровую кислоты (98%), кверцетина дигидрат (98%), лютеолин (98%) и катехин гидрат (98%) (Sigma, Германия); танин фармакопейной чистоты, синаповую (97%), сиреневую (97%) и ванилиновую кислоты (97%) (Fluka, Германия); рутина тригидрат (95%) (Alfa Aesar, Великобритания). Их стандартные 10 мМ (1.0 мМ для рутина) растворы готовили по точной навеске, которую растворяли в этаноле (ректификате) или в дистилированной воде (для аскорбиновой кислоты). Реактив Фолина–Чокальтеу (Sigma-Aldrich, Германия) разбавляли дистиллированной водой в соотношении 1 : 10. Раствор 2,2-дифенил-1-пикрилгидразила (ДФПГ•) (Aldrich, Германия) с концентрацией 0.20 мМ готовили в метаноле х.ч. Остальные реактивы были марки х.ч.
В качестве объектов анализа выбрали коммерческие образцы пива различных производителей. При этом формировали группы напитков по типам брожения и сортам (табл. 1).
Таблица 1.
Классификация исследуемых образцов пива и их характеристики
| № | Тип брожения | Сорт | Стиль | Страна изготовления | Характеристики пива | Содержание этанола, % |
|---|---|---|---|---|---|---|
| 1 | Эль | Стаут | Dry | Ирландия | Темное фильтрованное | 4.2 |
| 2 | Коричневый эль | English | Великобритания | Темное фильтрованное | 4.7 | |
| 3 | Пейл-эль | Pale Red Ale | Ирландия | Темное фильтрованное | 3.8 | |
| 4 | Пшеничный эль | Hefeweizen | Германия | Светлое нефильтрованное | 5.0 | |
| 5 | Witbier | Германия | Светлое нефильтрованное | 5.5 | ||
| 6 | Dunkelweizen | Германия | Темное нефильтрованное | 5.3 | ||
| 7 | Бельгийский эль | Abbey | Бельгия | Светлое нефильтрованное | 6.6 | |
| 8 | Бельгия | Темное фильтрованное | 6.5 | |||
| 9 | Лагер | Пилcнер | Light Lager | Чехия | Светлое фильтрованное | 5.0 |
| 10 | Чехия | Светлое фильтрованное | 4.4 | |||
| 11 | Чехия | Светлое фильтрованное | 4.9 | |||
| 12 | Бок | Doppelbock | Германия | Темное нефильтрованное | 7.9 | |
| 13 | Европейский лагер | Munich Helles Lager | Германия | Светлое фильтрованное | 4.9 | |
| 14 | Германия | Светлое фильтрованное | 5.2 | |||
| 15 | Германия | Светлое фильтрованное | 5.2 | |||
| 16 | Чешский темный лагер | Dark Lager | Чехия | Темное фильтрованное | 3.8 |
Кулонометрическое определение проводили на анализаторе Эксперт-006 (ООО “Эконикс-Эксперт”, Россия). Электрогенерацию брома, гексацианоферрат(III)-ионов и иода осуществляли из 0.2 М раствора KBr в 0.1 М H2SO4, 0.1 M K4Fe(CN)6 в 0.5 М растворе NaОН и 0.1 М раствора KI в ацетатном буферном растворе с рН 3.56 соответственно на Pt-электроде при постоянной силе тока 5.0 мА, обеспечивающей 100%-ный выход по току титрантов. В качестве катода использовали свернутую спиралью платиновую проволоку. Катодная камера со вспомогательным электродом была отделена от анодной камеры пористой стеклянной перегородкой. Конечную точку титрования определяли биамперометрически с платиновыми электродами (ΔЕ = 200 мВ). Поверхность платиновых электродов очищали азотной кислотой с последующим промыванием дистиллированной водой.
В электрохимическую ячейку емк. 50 мл вносили 20.0 мл фонового электролита, помещали в ячейку электроды и включали генераторную цепь. По достижении индикаторным током определенного значения генераторная цепь автоматически отключалась и снова включалась одновременно с таймером после внесения аликвоты исследуемого АО или пива. Для титрования брали аликвоты с таким расчетом, чтобы время титрования не превышало 2 мин. Конечную точку титрования устанавливали по достижении индикаторным током первоначального значения. По времени титрования рассчитывали количество электричества, затраченного на титрование образца, или число электронов по закону Фарадея для индивидуальных соединений.
Интегральную АОЕ, ЖВС и окисляемость по иоду определяли кулонометрическим титрованием образцов пива с помощью электрогенерированных брома, гексацианоферрат(III)-ионов [23‒25, 27] и иода соответственно. Параметры выражали как количество электричества, затраченное на титрование образца, в пересчете на 1 л пива.
Общепринятые антиоксидантные показатели определяли спектрофотометрически на спектрофотометре ПЭ-5300 ВИ (НПО “Экрос”, Россия). Общее содержание фенольных соединений оценивали по методу Фолина–Чокальтеу [28] в эквивалентах галловой кислоты [29]. Антиоксидантную активность пива оценивали по реакции с ДФПГ• [30], которую выражали как соотношение интенсивностей поглощения ДФПГ• до и после реакции с антиоксидантами образца [31].
Статистическую обработку результатов проводили для пяти параллельных измерений (трех измерений для спектрофотометрии) при доверительной вероятности 0.95. Результаты представляли как X ± ΔX, где X – среднее значение и ΔX – доверительный интервал. Случайную погрешность определения оценивали по величине относительного стандартного отклонения (sr). Для установления значимости различий антиоксидантных параметров для пива различных типов и характеристик применяли t-критерий Стьюдента для независимых выборок. Корреляционный анализ проводили в программе OriginPro 8.0 (OriginLab, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакции антиоксидантов пива с электрогенерированными титрантами-окислителями. Изучена реакционная способность индивидуальных АО пива по отношению к кулонометрическим титрантам (брому, гексацианоферрат(III)-ионам и иоду). Показано, что электрогенерированный иод, являясь достаточно слабым окислителем, не взаимодействует с фенольными АО. В реакцию с иодом вступает аскорбиновая кислота, которая окисляется с участием двух электронов до дегидроаскорбиновой кислоты. Аналогичная реакция протекает между аскорбиновой кислотой и остальными титрантами. Кроме того, в пиве содержатся серосодержащие соединения, в том числе тиоэфиры, полисульфиды и тиолы [32], которые поступают в пиво вместе с хмелем. Они окисляются электрогенерированными иодом и бромом с образованием сульфоксидов и сульфокислот соответственно [27].
Стехиометрические коэффициенты реакций электрогенерированных брома и гексацианоферрат(III)-ионов с фенольными АО пива представлены в табл. 2. Для большинства рассматриваемых соединений реакции протекают быстро и количественно. Полученные результаты хорошо согласуются с окислительной силой рассматриваемых титрантов. Гексацианоферрат(III)-ионы являются более слабым окислителем, чем бром, поэтому в реакцию с ними вступают фенольные гидроксилы в структуре рассматриваемых АО. Для ванилиновой, сиреневой, синаповой и феруловой кислот реакция с титрантом не протекает, что, вероятно, связано со стерическими факторами. Большее число электронов, участвующих в реакциях фенольных АО с электрогенерированным бромом, обусловлено тем, что этот титрант действует не только как окислитель, но и как реагент, вступающий в реакции электрофильного замещения в ароматическое кольцо и реакции электрофильного присоединения по кратным связям [27]. Такое поведение хорошо объясняет стехиометрические коэффициенты реакций электрогенерированного брома с гидроксибензойными и гидроксикоричными кислотами.
Таблица 2.
Стехиометрические коэффициенты реакций фенольных антиоксидантов с электрогенерированными титрантами (n = 5, P = 0.95)
| Фенольный АО | νАО : νтитранта | |
|---|---|---|
| Br2 | [Fe(CN)6]3– | |
| Фенольные кислоты | ||
| Галловая кислота | 1 : 2 | 1 : 4 |
| Ванилиновая кислота | 1 : 1 | – |
| Сиреневая кислота | 1 : 1 | – |
| п-Кумаровая кислота | 1 : 3 | 1 : 1 |
| Кофейная кислота | 1 : 2 | 1 : 2 |
| Феруловая кислота | 1 : 2 | – |
| Синаповая кислота | 1 : 2 | – |
| Хлорогеновая кислота | 1 : 2 | 1 : 2 |
| Флавоноиды | ||
| Кверцетин | 1 : 2 | 1 : 4 |
| Рутин | 1 : 2 | 1 : 4 |
| Лютеолин | 1 : 2 | 1 : 4 |
| Катехин | 1 : 2 | 1 : 4 |
| Другие фенольные АО | ||
| Танин | 1 : 15 | 1 : 25 |
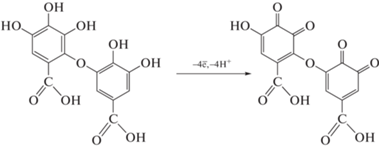
Окисление флавоноидов и фенольных кислот протекает до соответствующих хинонов, причем для флавоноидов более реакционноспособным является пирокатехиновый фрагмент в кольце В [24]. При титровании галловой кислоты электрогенерированным бромом сначала образуется орто-хинон, способный вступать в последующие реакции нуклеофильного присоединения и димеризации [33]. В случае реакции с гексацианоферрат(III)-ионами, генерация которых протекает в щелочной среде, галловая кислота присутствует в растворе в виде димера (дегидродигалловая кислота), который образуется в ходе окисления аналита кислородом воздуха [34]. Таким образом, в реакции участвует четыре электрона, что соответствует образованию ди-о-хинона (схема 1 ).
Схема 1 . Электроокисление дегидродигалловой кислоты.
Для танина число электронов, принимающих участие в реакции с гексацианоферрат(III)-ионами, совпадает с числом гидроксильных групп. В случае титрования танина электрогенерированным бромом в реакции участвуют 30 электронов, что предполагает сложный путь его окисления. Полученные стехиометрические коэффициенты согласуются с данными [27], что позволяет говорить о правильности полученных результатов.
Таким образом, кулонометрическое титрование с электрогенерированными бромом, иодом и гексацианоферрат(III)-ионами можно использовать для оценки антиоксидантных свойств пива.
Обобщенные антиоксидантные показатели пива. Оценены обобщенные антиоксидантные показатели пива, в частности, интегральная АОЕ по реакции с электрогенерированным бромом, ЖВС по реакции с электрогенерированными гексацианоферрат(III)-ионами и окисляемость по иоду (табл. 3). Установлено, что интегральная АОЕ примерно в 3.5 раза больше, чем ЖВС, причем независимо от типа образца. Исключение составляет стиль Witbier, для которого это соотношение равно 7.5, что, вероятно, связано с особенностями технологии изготовления. Окисляемость по иоду статистически достоверно ниже, чем остальные параметры, что связано с низким содержанием летучих тиолов [35] и аскорбиновой кислоты в пиве [36]. В целом полученная тенденция изменения обобщенных антиоксидантных параметров хорошо согласуется с реакционной способностью фенольных АО пива по отношению к титрантам.
Таблица 3.
Обобщенные антиоксидантные показатели пива по данным кулонометрического титрования (n = 5, P = 0.95)
| Тип брожения | Стиль | № | Интегральная АОЕ, кКл/л | sr | ЖВС, кКл/л | sr | Окисляемость по иоду, кКл/л | sr |
|---|---|---|---|---|---|---|---|---|
| Эль | Dry | 1 | 1.24 ± 0.05 | 0.03 | 0.403 ± 0.008 | 0.01 | 0.080 ± 0.006 | 0.03 |
| English | 2 | 1.45 ± 0.07 | 0.02 | 0.31 ± 0.04 | 0.05 | 0.074 ± 0.006 | 0.03 | |
| Pale Red Ale | 3 | 0.98 ± 0.01 | 0.006 | 0.29 ± 0.02 | 0.03 | 0.058 ± 0.001 | 0.01 | |
| Hefeweizen | 4 | 1.57 ± 0.02 | 0.006 | 0.32 ± 0.02 | 0.03 | 0.059 ± 0.003 | 0.04 | |
| Witbier | 5 | 2.50 ± 0.03 | 0.008 | 0.34 ± 0.01 | 0.02 | 0.059 ± 0.003 | 0.04 | |
| Dunkelweizen | 6 | 1.72 ± 0.02 | 0.006 | 0.42 ± 0.02 | 0.02 | 0.053 ± 0.002 | 0.04 | |
| Abbey | 7 | 1.32 ± 0.01 | 0.004 | 0.41 ± 0.01 | 0.01 | 0.073 ± 0.005 | 0.05 | |
| 8 | 1.86 ± 0.03 | 0.01 | 0.44 ± 0.02 | 0.03 | 0.070 ± 0.003 | 0.04 | ||
| Лагер | Light Lager | 9 | 1.52 ± 0.01 | 0.004 | 0.31 ± 0.02 | 0.03 | 0.055 ± 0.003 | 0.03 |
| 10 | 1.34 ± 0.05 | 0.02 | 0.31 ± 0.04 | 0.05 | 0.061 ± 0.003 | 0.02 | ||
| 11 | 1.42 ± 0.02 | 0.007 | 0.48 ± 0.02 | 0.02 | 0.079 ± 0.005 | 0.04 | ||
| Doppelbock | 12 | 2.9 ± 0.1 | 0.02 | 0.82 ± 0.05 | 0.03 | 0.089 ± 0.009 | 0.04 | |
| Munich Helles Lager | 13 | 1.26 ± 0.02 | 0.008 | 0.31 ± 0.04 | 0.05 | 0.065 ± 0.004 | 0.05 | |
| 14 | 1.44 ± 0.02 | 0.007 | 0.26 ± 0.01 | 0.02 | 0.055 ± 0.003 | 0.05 | ||
| 15 | 1.27 ± 0.04 | 0.01 | 0.33 ± 0.04 | 0.05 | 0.079 ± 0.002 | 0.01 | ||
| Dark Lager | 16 | 1.51 ± 0.04 | 0.02 | 0.45 ± 0.04 | 0.03 | 0.08 ± 0.01 | 0.05 |
Несколько неожиданной оказалась близость абсолютных значений обобщенных антиоксидантных показателей для большинства исследованных образцов независимо от того, к какому типу брожения, сорту и стилю они относятся. Частично это согласуется с данными [13] по антиоксидантным показателям пива различного происхождения. Исключение составляют лишь стили Pale Red Ale, Witbier и Doppelbock, для которых получены значимо более низкие (Pale Red Ale) и более высокие значения (Witbier и Doppelbock) параметров. При этом сорт бок стиль Doppelbock (двойной бок низового брожения) показал максимальные значения всех антиоксидантных параметров, что объясняется технологией изготовления такого пива, предполагающей дополнительное выдерживание в холодных подвалах в течение нескольких месяцев до дображивания, а также использование нескольких сортов солода [37]. При этом пиво характеризуется высокой экстрактивностью начального сусла (18.3%) и крепостью 7.9 об. %.
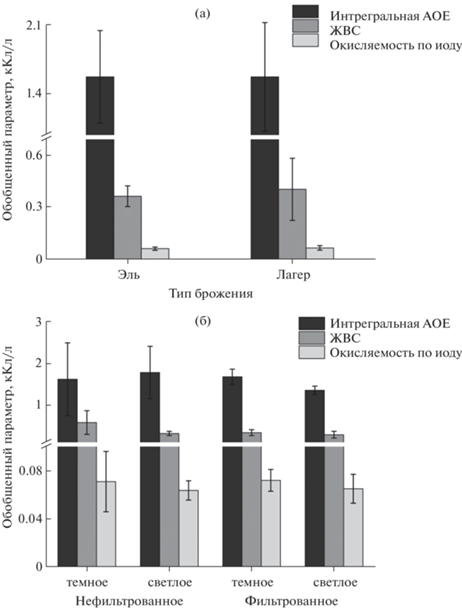
Установлено, что тип брожения значимо не влияет на антиоксидантные параметры, так как для эля и лагера средние значения интегральной АОЕ одинаковы (p = 0.99), а различие ЖВС и окисляемости по иоду статистически не значимы (p = 0.55 и 0.43 соответственно) (рис. 1а). Сопоставление результатов по обобщенным антиоксидантным показателям для фильтрованного и нефильтрованного светлого и темного пива (рис. 1б) показало, что значение интегральной АОЕ выше для светлого нефильтрованного пива, а ЖВС и окисляемость по иоду – для темного нефильтрованного пива, но все различия статистически незначимы (p = 0.10−0.82). Частично это объясняется малым числом образцов нефильтрованного пива и сильно отличающимися результатами для них.
Рис. 1.
Обобщенные антиоксидантные показатели пива в зависимости от типа брожения (а) и характеристик (б).
Полученные с помощью кулонометрического титрования показатели сопоставили с общепринятыми антиоксидантными параметрами (общим содержанием фенольных соединений и антиоксидантной активностью). Установлены статистически значимые положительные корреляции (табл. 4), а значения коэффициентов корреляции для интегральной АОЕ и ЖВС подтверждают наличие высокой связи между параметрами (rкрит = 0.4973) согласно шкале Чеддока. Как и следовало ожидать, для окисляемости по иоду корреляция с общим содержанием фенольных соединений не наблюдается, что объясняется природой соединений, вносящих вклад в этот параметр, в частности, серосодержащих соединений и аскорбиновой кислоты. В случае антиоксидантной активности можно говорить о слабой корреляции, что, вероятно, обусловлено, вкладом в оба параметра аскорбиновой кислоты.
Таблица 4.
Коэффициенты корреляции обобщенных антиоксидантных показателей пива по данным кулонометрии и спектрофотометрии (n = 16, P = 0.95)
| Параметр | Общее содержание фенольных соединений, мг галловой кислоты/л | Антиоксидантная активность, % |
|---|---|---|
| Интегральная АОЕ, кКл/л | 0.8349 | 0.7175 |
| ЖВС, кКл/л | 0.8703 | 0.8251 |
| Окисляемость по иоду, кКл/л | 0.3565 | 0.5463 |
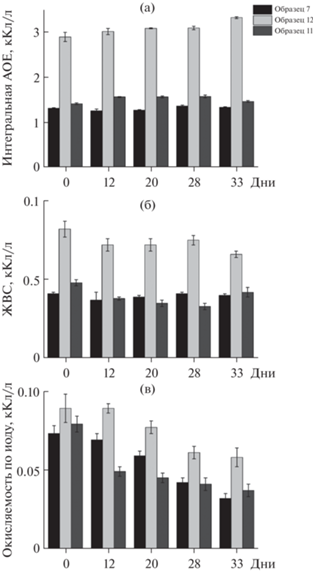
Оценили изменение обобщенных антиоксидантных показателей пива при его хранении на воздухе в течение 33 дней (рис. 2). Установлено, что интегральная АОЕ и ЖВС изменяются незначительно. Интегральная антиоксидантная емкость увеличивается в течение 28 дней и продолжает увеличиваться для темного нефильтрованного пива сорт бок (образец 12), а для светлого пива (нефильтрованного (образец 7) и фильтрованного (образец 11)) происходит колебание значений (рис. 2а), причем изменения для всех образцов статистически незначимы. ЖВС незначимо уменьшается в течение всего времени (рис. 2б). Полученные данные для темного пива согласуются с описанными ранее [38] и связаны с образованием на стадии обжарки солода меланоидинов, которые могут вступать в реакции с титрантами и более устойчивы к воздействию кислорода воздуха. Окисляемость по иоду для всех рассмотренных образцов пива уменьшается (рис. 2в) по мере увеличения срока хранения на воздухе, что объясняется окислением аскорбиновой кислоты и серосодержащих соединений.
Рис. 2.
Изменение интегральной антиоксидантной емкости (а), железовосстанавливающей способности (б) и окисляемости по иоду (в) пива при хранении на воздухе.
Таким образом, кулонометрическое титрование и получаемые обобщенные антиоксидантные показатели можно успешно использовать для экспрессного скрининга образцов пива. Варьирование природы титранта позволяет оценивать вклад АО различных типов с целью контроля их общего содержания.
Список литературы
Vanderhaegen B., Neven H., Verachtert H., Derdelinckx G. The chemistry of beer aging – A critical review // Food Chem. 2006. V. 95. № 3. P. 357. https://doi.org/10.1016/j.foodchem.2005.01.006
Quifer-Rada P., Vallverdú-Queralt A., Martínez-Huélamo M., Chiva-Blanch G., Jáuregui O., Estruch R., Lamuela-Raventós R. A comprehensive characterisation of beer polyphenols by high resolution mass spectrometry (LC–ESI-LTQ-Orbitrap-MS) // Food Chem. 2015. V. 169. P. 336. https://doi.org/10.1016/j.foodchem.2014.07.154
Iyuke S.E., Madigoe E.M., Maponya R.J. The effect of hydroxycinnamic acids and volatile phenols on beer quality // Inst. Brew. 2008. V. 114. № 4. P. 300. https://doi.org/10.1002/j.2050-0416.2008.tb00773.x
Coghe S., Benoot K., Delvaux F., Vanderhaegen B., Delvaux F.R. Ferulic acid release and 4-vinylguaiacol formation during brewing and fermentation: Indications for feruloyl esterase activity in Saccharomyces cerevisiae // J. Agric. Food. Chem. 2004. V. 52. № 3. P. 602. https://doi.org/10.1021/jf0346556
Bonoli M., Marconi E., Caboni M.F. Free and bound phenolic compounds in barley (Hordeum vulgare L.) flours: Evaluation of the extraction capability of different solvent mixtures and pressurized liquid methods by micel-lar electrokinetic chromatography and spectrophotometry // J. Chromatogr. A. 2004. V. 1057. № 1–2. P. 1. https://doi.org/10.1016/j.chroma.2004.09.024
Meilgaard M.C. Flavor chemistry of beer: part II: flavour and threshold of 239 aroma volatiles // MBAA TQ. 1975. V. 12. № 3. P. 151.
Carvalho D.O., Curto A.F., Cuido L.F. Determination of phenolic content in different barley varieties and corresponding malts by liquid chromatography-diode array detection-electrospray ionization tandem mass spectrometry // Antioxidants. 2015. V. 4. № 3. P. 563. https://doi.org/10.3390/antiox4030563
Maillard M.N., Soum M.H., Boivin P., Berset C. Antioxidant activity of barley and malt: Relationship with phenolic content // LWT – Food Sci. Technol. 1996. V. 29. № 3. P. 238. https://doi.org/10.1006/fstl.1996.0035
Lu J., Zhao H., Chen J., Fan W., Dong J., Kong W., Sun J., Cao Y., Cai G. Evolution of phenolic compounds and antioxidant activity during malting // J. Agric. Food Chem. 2007. V. 55. № 26. P. 10994. https://doi.org/10.1021/jf0722710
Goupy P., Hugues M., Boivin P., Amiot M. Antioxidant composition and activity of barley (Hordeum vulgare) and malt extracts and of isolated phenolic compounds // J. Sci. Food Agric. 1999. V. 79. № 12. P. 1625. https://doi.org/10.1002/(SICI)1097-0010(199909)79: 12<1625::AID-JSFA411>3.0.CO;2-8
Lentz M. The impact of simple phenolic compounds on beer aroma and flavor // Fermentation. 2018. V. 4. № 1. Article 20. https://doi.org/10.3390/fermentation4010020
Jandera P. Methods for the HPLC analysis of phenolic compounds and flavonoids in beer / Beer in Health and Disease Prevention / Ed. Preedy V.R. Amsterdam: Elsevier, 2009. P. 1003. https://doi.org/10.1016/B978-0-12-373891-2.00098-5
Zhao H., Chen W., Lu J., Zhao M. Phenolic profiles and antioxidant activities of commercial beers // Food. Chem. 2010. V. 119. № 3. P. 1150. https://doi.org/10.1016/j.foodchem.2009.08.028
Mitić S.S., Paunović D.Đ., Pavlović A.N., Tošić S.B., Stojković M.B., Mitić M.N. Phenolic profiles and total antioxidant capacity of marketed beers in serbia // Int. J. Food Prop. 2014. V. 17. № 4. P. 908. https://doi.org/10.1080/10942912.2012.680223
Socha R., Pająk P., Fortuna T., Buksa K. Antioxidant activity and the most abundant phenolics in commercial dark beers // Int. J. Food Prop. 2017. V. 20. № S1. P. S595. https://doi.org/10.1080/10942912.2017.1306550
García-Guzmán J.J., López-Iglesias D., Cubillana-Aguilera L., Lete C., Lupu S., Palacios-Santander J.M., Bellido-Milla D. Assessment of the polyphenol indices and antioxidant capacity for beers and wines using a tyrosinase-based biosensor prepared by sinusoidal current method // Sensors. 2019. V. 19. № 1. Article 66. https://doi.org/10.3390/s19010066
Cummings E.A., Mailley P., Linquette–Mailley S., Eggins B.R., McAdams E.T., McFadden S. Amperometric carbon paste biosensor based on plant tissue for the determination of total flavanol content in beers // Analyst. 1998. V. 123. № 10. P. 1975. https://doi.org/10.1039/A804021D
Hlavatá L., Vyskočil V., Beníková K., Borbélyová M., Labuda J. DNA-based biosensors with external Nafion and chitosan membranes for the evaluation of the antioxidant activity of beer, coffee, and tea // Cent. Eur. J. Chem. 2014. V. 12. № 5. P. 604. https://doi.org/10.2478/s11532-014-0516-4
Gorjanović S.Z., Novaković M.M., Potkonjak N.I., Leskosek-Cukalović I., Suznjević D.Z. Application of a novel antioxidative assay in beer analysis and brewing process monitoring // J. Agric. Food Chem. 2010. V. 58. № 2. P. 744. https://doi.org/10.1021/jf903091n
Ziyatdinova G., Ziganshina E., Nguyen Cong Ph., Budnikov H. Ultrasound-assisted micellar extraction of phenolic antioxidants from spices and antioxidant properties of the extracts based on coulometric titration data // Anal. Methods. 2016. V. 8. № 39. P. 7150. https://doi.org/10.1039/c6ay02112c
Зиятдинова Г.К., Нгуен Конг Ф., Будников Г.К. Оценка антиоксидантных свойств мицеллярных экстрактов специй методом гальваностатической кулонометрии с электрогенерированными гексацианоферрат(III)-ионами // Журн. аналит. химии. 2015. Т. 70. № 8. С. 854. (Ziyatdinova G.K., Nguen Cong F., Budnikov H.C. Assessment of the antioxidant properties of micellar spice extracts by galvanostatic coulometry with electrogenerated hexacyanoferrate(III) ions // J. Anal. Chem. 2015. V.70. № 8. P. 974. )https://doi.org/10.1134/S1061934815080195
Зиятдинова Г.К., Будников Г.К. Мицеллярная экстракция активных компонентов из специй и оценка церий восстанавливающей способности извлечений // Журн. аналит. химии. 2021. Т. 76. № 9. С. 812. (Ziyatdinova G.K., Budnikov H.C. Micellar extraction of active components from spices and evaluation of the Ce(IV)-based reducing capacity of the extracts // J. Anal. Chem. 2021. V. 76. № 9. P. 1065.)https://doi.org/10.1134/S1061934821090124
Ziyatdinova G., Nizamova A., Budnikov H. Novel coulometric approach to evaluation of total free polyphenols in tea and coffee beverages in presence of milk proteins // Food Anal. Methods. 2011. V. 4. № 3. P. 334. https://doi.org/10.1007/s12161-010-9174-0
Низамова А.М., Зиятдинова Г.К., Будников Г.К. Электрогенерированный бром – кулонометрический реагент для оценки биодоступности полифенолов // Журн. аналит. химии. 2011. Т. 66. № 3. С. 308. (Nizamova A.M., Ziyatdinova G.K., Budnikov G.K. Electrogenerated bromine as a coulometric reagent for the estimation of the bioavailability of polyphenols // J. Anal. Chem. 2011. V.66. № 3. P. 301.)https://doi.org/10.1134/S1061934811010114
Ziyatdinova G., Salikhova I., Budnikov H. Coulometric titration with electrogenerated oxidants as a tool for evaluation of cognac and brandy antioxidant properties // Food Chem. 2014. V.150. P. 80. https://doi.org/10.1016/j.foodchem.2013.10.133
Абдуллин И.Ф., Турова Е.Н., Гайсина Г.Х., Будников Г.К. Применение электрогенерированного брома для оценки интегральной антиоксидантной способности лекарственного растительного сырья и препаратов на его основе // Журн. аналит. химии. 2002. Т. 57. № 6. С. 666. (Abdullin I.F., Turova E.N., Gaisina G.Kh., Budnikov G.K. Use of electrogenerated bromine for estimating the total antioxidant capacity of plant raw materials and plant-based medicinal preparations // J. Anal. Chem. 2002. V. 57. № 6. P. 557.)https://doi.org/10.1023/A:1015758221044
Ziyatdinova G., Budnikov H. Analytical capabilities of coulometric sensor systems in the antioxidants analysis // Chemosensors. 2021. V. 9. № 5. Article 91. https://doi.org/10.3390/chemosensors9050091
Singleton V.L., Rossi J.A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents // Am. J. Enol. Vitic. 1965. V.16. № 3. P. 144.
Fu L., Xu B.-T., Gan R.-Y., Zhang Y., Xu X.-R., Xia E.-Q., Li H.-B. Total phenolic contents and antioxidant capacities of herbal and tea infusions // Int. J. Mol. Sci. 2011. V. 12. № 4. P. 2112. https://doi.org/10.3390/ijms12042112
Brand-WilliamsW., Cuvelier M.E., Berset C. Use of a free radical method to evaluate antioxidant activity // LWT – Food Sci. Technol. 1995. V. 28. № 1. P. 25. https://doi.org/10.1016/S0023-6438(95)80008-5
Radovanović B., Radovanović A. Free radical scavenging activity and anthocyanin profile of cabernet sauvignon wines from the Balkan region // Molecules. 2010. V. 15. № 6. P. 4213. https://doi.org/10.3390/molecules15064213
Lermusieau G., Collin S. Volatile sulfur compounds in hops and residual concentrations in beer – A review // J. Am. Soc. Brew. Chem. 2003. V. 61. № 3. P. 109. https://doi.org/10.1094/ASBCJ-61-0109
Feldman K.S., Quideau S., Appel H.M. Galloyl-derived orthoquinones as reactive partners in nucleophilic additions and Diels-Alder dimerizations: A novel route to the dehydrodigalloyl linker unit of agrimoniin-type ellagitannins // J. Org. Chem. 1996. V. 61. № 19. P. 6656. https://doi.org/10.1021/jo961043u
Oniki T., Takahama U. Free radicals produced by the oxidation of gallic acid and catechin derivatives // J. Wood Sci. 2004. V. 50. № 6. P. 545. https://doi.org/10.1007/s10086-003-0591-1
Miracle R.E., Ebeler S.E., Bamforth C.W. The measurement of sulfur-containing aroma compounds in samples from production-scale brewery operations // J. Am. Soc. Brew. Chem. 2005. V. 63. № 3. P. 129. https://doi.org/10.1094/ASBCJ-63-0129
Marshall P.A., Trenerry V.C., Thompson C.O. The determination of total ascorbic acid in beers, wines, and fruit drinks by micellar electrokinetic capillary chromatography // J. Chromatogr. Sci. 1995. V. 33. № 8. P. 426. https://doi.org/10.1093/chromsci/33.8.426
Richman D. Bock (Classic Beer Style Series Book 9). Boulder: Brewers Publications, 1994. 174 p.
Coghe S., Gheeraert B., Michiels A., Delvaux F.R. Development of Maillard reaction related characteristics during malt roasting // J. Inst. Brew. 2006. V. 112. № 2. P. 148. https://doi.org/10.1002/j.2050-0416.2006.tb00244.x
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии