Журнал аналитической химии, 2023, T. 78, № 6, стр. 546-558
Высокочувствительное определение карбамазепина, окскарбазепина, идентификация продуктов их деградации в вещественных доказательствах и в трупном материале печени человека методом ГХ-МС
А. В. Пирогов a, *, Н. А. Гандлевский a, А. А. Васильева a, С. С. Барсегян b, А. Е. Носырев c
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
b Российский центр судебно-медицинской экспертизы Министерства здравоохранения
Российской Федерации (РЦСМЭ Минздрава России)
125284 Москва, ул. Поликарпова, 12/13, Россия
c Первый Московский государственный медицинский университет им. И.М. Сеченова
119048 Москва, ул. Трубецкая, 8, стр. 2, Россия
* E-mail: Pirogov@analyt.chem.msu.ru
Поступила в редакцию 20.11.2022
После доработки 23.01.2023
Принята к публикации 24.01.2023
- EDN: DWRVPO
- DOI: 10.31857/S0044450223060099
Аннотация
Работа посвящена поиску и выбору условий пробоподготовки, определения карбамазепина и окскарбазепина и идентификации продуктов их метаболизма и деградации в печени (post mortem) человека и в вещественных доказательствах методом хромато-масс-спектрометрии. Разработан подход к пробоподготовке карбамазепина и окскарбазепина методом QUECHERS. В качестве внутреннего стандарта предложен амитриптилин. Исследованы продукты деградации карбамазепина и окскарбазепина в модельных растворах при щелочном и кислотном гидролизе и окислении. Идентифицировано 14 метаболитов и продуктов деградации. Определены основные аналитические характеристики разработанного способа определения. Пределы обнаружения составляют 0.1 и 0.2 мкг/г для карбамазепина и окскарбазепина соответственно. Установлено соответствие разработанного способа требованиям Руководства по валидации Российского Центра судебно-медицинской экспертизы.
Карбамазепин (CBZ) и окскарбазепин (OXC) – противоэпилептические лекарственные средства из группы производных карбоксамида, обладающие схожими механизмами действия. Метаболиты OXC оказывают гораздо меньшее токсическое воздействие на печень [1]. CBZ и OXC не входят в перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, что делает лекарственные препараты доступными для общего потребления. Противоэпилептические препараты OXC и CBZ вызывают научный интерес в судебной медицине. Судебно-токсикологические расследования смертей проводятся, если есть подозрения, что смерть связана с передозировкой лекарственных или наркотических препаратов. Предоставление полного клинического анамнеза позволяет предсказать вероятные источники отравления и значительно упростить интерпретацию любых аналитических результатов. Изучение состава продуктов деградации CBZ и OXC позволит определить концентрации исследуемых веществ в организме человека на момент смерти. Дифференциальная диагностика CBZ и OXC особо актуальна в случаях термического, микробиологического разложения биологического материала. Таким образом, необходима разработка надежного метода одновременного обнаружения и определения фармацевтических препаратов CBZ, OXC, продуктов их метаболизма и деградации в биологическом материале и в вещественных доказательствах.
Метаболизм карбамазепина и окскарбазепина. По данным [2, 3], при попадании в организм CBZ преимущественно метаболизируется в печени по трем основным направлениям (рис. 1). Основной метаболический путь, катализируемый ферментами цитохрома P450, CYP3A4 и CYP2C8 [4] – формирование карбамазепин-10,11-эпоксида (CBZ-EP). CBZ-EP под действием фермента эпоксигидралазы [5] почти полностью превращается в транс-10,11-дигидрокси-10,11-дигидрокарбамазепин (CBZ-DiOH), который выводится из организма в основном в неконъюгированной форме в составе мочи [6]. В ранних исследованиях предполагали, что CBZ-EP играет ключевую роль в побочных эффектах, вызванных применением препарата CBZ, особенно в тяжелых кожных реакциях, таких как синдром Стивенса-Джонсона или токсических эпидермолизных некрозах. Однако в работе [7] доказано, что побочные эффекты продолжают возникать и в отсутствие CBZ-EP. Предполагают [8], что в качестве реактивных метаболитов выступают второстепенные метаболиты, продуцируемые альтернативными путями метаболизма. Два других метаболических пути в печени – это образование гидроксилированных соединений, 2-гидроксикарбамазепина (2-OH-CBZ) и 3-гидроксикарбамазепина (3-OH-CBZ), и превращение CBZ в иминостильбен (IM) [2, 3, 9]. Карбамазепин метаболизируется до 2-OH-CBZ и 3-OH-CBZ несколькими ферментами цитохрома P450, включая CYP3A4 и CYP2C9 [10]. Гидроксильные метаболиты далее переходят в 2,3-дигидроксикарбамазепин, который посредством неферментативной перегруппировки превращается в метаболит CBZ о-хинон. 2-Гидроксикарбамазепин метаболизируется под действием фермента CYP3A4 до 2-гидроксииминостильбена, который легко окисляется до иминохинонов [4].
Рис. 1.
Предполагаемые основные пути метаболизма карбамазепина в организме человека и ферменты, катализирующие реакции.
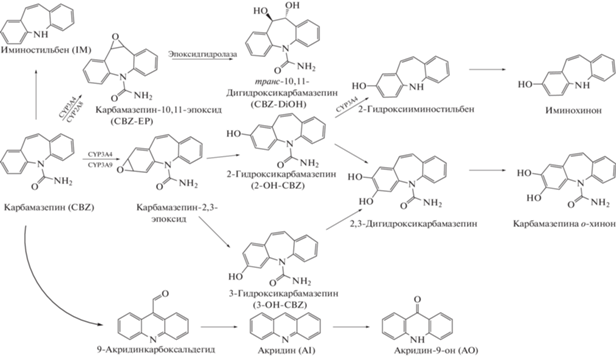
Помимо печени в окислении CBZ участвуют лейкоциты, наряду с их иммунными свойствами они преобразуют [5] CBZ под действием миелопероксидазы в ряд метаболитов (рис. 1), в основном в промежуточный 9-акридинкарбоксальдегид, далее следуют последовательные превращения в акридин (AI) и акридин-9-он (AO) [11].
Противоэпилептический препарат OXC, 10-кето аналог CBZ, имеет химическое и терапевтическое сходство с CBZ [8] (рис. 2). В печени OXC быстро восстанавливается до фармакологически активного метаболита 10-гидрокси-10,11-дигидро-CBZ (10-OH-CBZ) под действием альдокеторедуктазы [12]. Суммарная концентрация 10-OH-CBZ в плазме крови в 15 раз выше, чем концентрация OXC. Поскольку атом углерода карбонильной группы является прохиральным центром, то образование 10-OH-CBZ стереоспецифично. В организме человека OXC восстанавливается до (S)-энантиомера (80%) и (R)-энантиомера (20%) 10-OH-CBZ [13]. Оба энантиомера имеют одинаковую противоэпилептическую активность. 10-Гидрокси-10,11-дигидрокарбамазепин, сопряженный с глюкуроновой кислотой, выводится в составе мочи. В моче 10-OH-CBZ и его глюкурониды составляют более 80% принятой дозировки, тогда как OXC и его конъюгаты составляют ~10%. Незначительные количества OXC (4%) окисляются до фармакологически неактивного CBZ-DiOH [14], общего метаболита с CBZ.
Рис. 2.
Предполагаемые основные пути метаболизма окскарбазепина в организме человека и ферменты, катализирующие реакции.
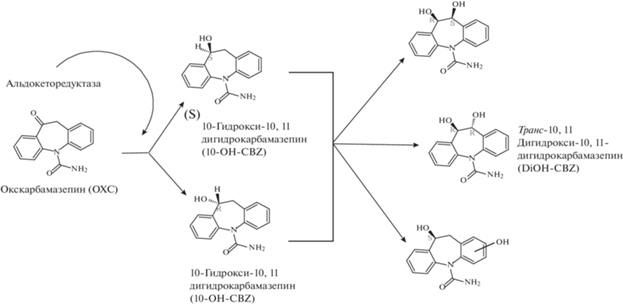
Другим потенциально общим метаболитом является 3-OH-CBZ, обнаруженный в плазме пациентов, получавших ОХC, но ферментная система, участвующая в процессе образования 3-OH-CBZ из OXC, пока не идентифицирована [15]. Аналогично карбамазепину OXC вызывает нежелательные побочные эффекты, но с гораздо меньшей частотой и тяжестью [8].
Методы определения карбамазепина и окскарбазепина. Определение CBZ и OXC в образцах post mortem биологических тканей и жидкостей человека является важнейшей задачей. Одной из причин интереса судебно-медицинской токсикологии к противоэпилептическим препаратам является внушительное число внезапных необъяснимых смертей среди людей, больных эпилепсией и принимающих эти препараты [16].
Усовершенствованные аналитические методы с удовлетворительными чувствительностью и селективностью, основанные на хроматографическом разделении, имеют преимущества по сравнению с рутинными иммунологическими методами за счет снижения количества ложноположительных результатов [17]. По-видимому, хроматографические методы являются лучшим вариантом для токсикологического анализа, так как они обеспечивают как идентификацию, так и определение аналитов [18].
Несмотря на то, что лекарственные и наркотические препараты легко обнаруживаются в крови благодаря современным чувствительным методам, с точки зрения анализа образцов post mortem печень является чрезвычайно ценной тканью, так как концентрации веществ в печени относительно стабильны после смерти, что важно при интерпретации результатов судебно-химического исследования. Единственный существенный недостаток печени как объекта исследования – значительное содержание в ней соэкстрактивных веществ на этапе пробоподготовки, гораздо большее, чем в крови. Чтобы свести к минимуму матричный эффект при подготовке образцов ткани печени, необходим этап очистки от сопутствующих компонентов [19].
Предложено множество подходов и способов определения CBZ и OXC [20–26]. В рамках данной статьи ограничимся обзором только методов газовой хроматографии. Газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС) представляет собой надежный метод, а приборы доступны в большинстве судебно-медицинских лабораторий по всему миру. Метод обеспечивает специфичность и чувствительность и в комбинации с использованием токсикологических баз данных позволяет получить информацию о структуре аналитов.
Известно, что при попадании в газовый хроматограф CBZ претерпевает термодеградацию в испарителе и образует иминостильбен и 9-метилакридин. В обзоре [27] методы определения CBZ разделили на три категории: методы, в которых подбирают условия, исключающие термодеградацию в испарителе; методы, в которых образуются стабильные производные; методы, в которых CBZ полностью превращается в IM. Совместно с CBZ часто определяют и метаболиты. Карбамазепин метаболизируется до стабильного CBZ-EP, который легко обнаруживается в биологических жидкостях и тканях человека в значительных концентрациях. В тех же условиях CBZ-EP перегруппировывается в 9-акридинкарбоксиальдегид с отщеплением CONH2-группы.
В методе ГХ-МС важно уменьшить любые возможные взаимодействия недериватизированных соединений с неподвижной фазой или носителем. В работе [28] этого добились использованием стационарной фазы, насадки для колонок SP-2510 DA, специально приготовленных для соединений кислотного характера. Данная стационарная фаза подходит для определения широкого спектра противосудорожных препаратов с помощью газожидкостной хроматографии без дериватизации. Cтабильные производные по амидной группе уменьшают полярность CBZ, тем самым минимизируя абсорбцию, приводящую к деградации. Например, в работе [29] предложено использовать производные триметилсилила, а в работе [30] для дериватизации предложены производные диметиламинометилена. Авторы работы [31] применили третий подход, полностью преобразовав CBZ в IM. Этот способ дополнительно усложняется разложением CBZ-EP до 9-акридинкарбоксиальдегида. Тем не менее таким образом можно обнаружить карбамазепин и его эпоксид, селективность масс-спектрометрического детектора позволяет использовать очень короткую колонку, и оба вещества могут быть одновременно зарегистрированы в режиме SIM [32]. В табл. 1 приведены примеры определения CBZ и OXC в различных биологических объектах методом ГХ-МС.
Таблица 1.
Условия ГХ-МС-определения карбамазепина и окскарбазепина в различных объектах
| Объект (определяемое соединение) | Пробоподготовка | Условия проведения эксперимента | Аналитические характеристики | Литература |
|---|---|---|---|---|
| Сыворотка крови (CBZ) |
ЖЖЭ: экстрагент – ацетонитрил; внутренний стандарт – имипрамин | ГХ: капиллярная колонка DB-5ht (30 м × 0.250 мм × 0.100 мкм); температура порта ввода: 250°C; скорость потока газа носителя (He): 0.815 мл/мин; МС (ЭИ-SIM): m/z = 193 | Определяемые концентрации: 0.5–20 мкг/мл; смин= = 500 нг/мл; степень извлечения: 104% | [33] |
| Цельная кровь (CBZ) |
ТФЭ на колонках Bond Elut Certify; дериватизация: бутилирование; внутренний стандарт – CBZ-d10 | ГХ: Капиллярная колонка (SGE, Austin, TX, BPX5) (12 м × 0.15 мм × 0.400 мкм); температура порта ввода: 280°C; температура печи: начальная 80°С, конечная 300°С; время анализа: 20 мин; МС (ЭИ-SIM): m/z = 193 | Определяемые концентрации: 0.5–60 мкг/л; степень извлечения: 158% | [34] |
| Печень (CBZ) |
||||
| Сыворотка крови (CBZ) |
ЖЖЭ: экстрагент – хлороформ; внутренний стандарт – гексобарбитал; дериватизация: раствор триметиланилина в безводном метаноле | ГХ: стеклянная насадочная колонка с неподвижной фазой OV-17: (1.2 м × 3 мм); температура порта ввода: 300°C; скорость потока газа носителя (He): 50 мл/мин; температура печи: начальная 215°С, конечная 250°С; МС (ЭИ-SIM): m/z = 193; время анализа: 5 мин | Определяемые концентрации: 1–100 мкг/мл; степень извлечения: 88.5% | [35] |
| Моча (CBZ) |
ЖЖЭ: экстрагент – смесь дихлорметан–изопропанол–этилацетат (1 : 1 : 3); дериватизация: смесь ангидрида уксусной кислоты и пиридина (3 : 2) | ГХ: капиллярная колонка HP (12 м × 0.20 мм × 0.330 мкм); температура порта ввода: 270°C; температура печи: начальная 100°С, конечная 300°С; скорость потока газа носителя (He): 1 мл/мин; МС (ЭИ-SIM): m/z = 193 | смин = 10 нг/мл | [36] |
| Плазма крови (CBZ) |
ЖЖЭ: экстрагент – этилацетат; внутренний стандарт – 10,11-дигдидрокарбамазепин | ГХ: короткая колонка (0.35 м × 1.50 мм × × 0.330 мкм); температура порта ввода: 250°C; температура печи: начальная 100°С, конечная 300°С; скорость потока газа носителя (He): 25 мл/мин; МС (ЭИ-MRM): m/z = 193, m/z = 236. | Определяемые концентрации: 0.050–0.5 мкг/мл |
[37] |
| Цельная кровь (CBZ) |
Дисперсионная твердофазная экстракция: экстрагент – ацетонитрил и этилацетат; анионообменный сорбент – PSA; внутренний стандарт – диазепам-d5 | ГХ: испаритель с программируемой температурой для ввода большого объема пробы (PTV-LVI), капиллярная колонка DB-1ms (30 м × 0.25 мм × 0.25 мкм); начальная температура порта ввода: 70°C; температура печи: начальная 70°С, конечная 300°С; объем вводимой пробы 25 мкл; МС (ЭИ-SIM): m/z = 193 | сн = 0.8–4 мкг/мл; степень извлечения: 111% | [38] |
| Биологические жидкости и ткани (CBZ и OXC) | ТФЭ: на экстракционных колонках Styre Screen; внутренний стандарт – 10,11-дигидро CBZ. | ГХ: капиллярная колонка DB-1ms (12 м × × 0.2 мм × 0.33 мкм); скорость потока газа носителя (He): 1 мл/мин; температура порта ввода: 250°C; температура печи: начальная 130°С, конечная 290°С; МС (ЭИ-SIM): m/z = = 193 – CBZ, m/z = 180 – OXC | сн = 15 нг/мл | [39] |
| Плазма (OXC) |
ЖЖЭ: экстрагент – дихлорметан; внутренний стандарт – карбазепина-10,11-цис-диола дериватизация: MSTFA | ГХ: испаритель с холодным вводом; капиллярная колонка (25 м × 0.31 мм × 0.17 мкм); скорость потока газа носителя (He): 1 мл/мин; температура печи: начальная 140°С, конечная 240°С; МС (ЭИ-SIM): m/z = 281 – OXC производное | смин = 0.1 нг/мл; степень извлечения: 73.65% | [40] |
| Плазма и моча (OXC) |
Жидкостная микроэкстракция; эт-анол для осаждения белковых молекул; внутренний стандарт бисфенол А-d16 | ГХ: капиллярная колонка HP-5ms (30 м × × 0.25 мм × 0.25 мкм); скорость потока газа носителя (He), 2.5 мл/мин; температура порта ввода: 250°C; температура печи: начальная 70°С, конечная 300°С; МС (ЭИ-SIM): m/z = = 209 – OXC | сн = 21 мкг/кг; смин = = 6.2 мкг/мл; степень извлечения: 97–99% | [41] |
| Цельная кровь и моча (CBZ и OXC) |
Микроэкстракция SiO2-C18, внутренний стандарт – кофеин | ГХ: капиллярная колонка RTX1ms (30 м × × 0.25 мм × 0.25 мкм); скорость потока газа носителя (He): 1 мл/мин; температура порта ввода: 270°C; температура печи: начальная 100°С, конечная 300°С; время анализа: 30 мин; МС (ЭИ-SIM): m/z = 193 – CBZ, m/z = 236 – OXC | Определяемые концентрации: 1–500 нг/мл; сн = 0.0080 нг/мл – OXC; сн = 0.0062 нг/мл – CBZ; степень извлечения: 69–98% | [42] |
С практической точки зрения, метод ГХ-МС имеет некоторое преимущество перед ВЭЖХ, поскольку нет необходимости в замене колонки или растворителя при определении различных групп соединений. ГХ-МС можно использовать без технических изменений для общего скрининга, для терапевтического мониторинга лекарств и для рутинных анализов биологических образцов в клинических лабораториях. В данной работе для анализа двух противоэпилептических препаратов применили метод ГХ-МС в сочетании с разработанной методикой пробоподготовки. Основным преимуществом применяемого метода является широкая доступность ГХ-МС-приборов в клинических лабораториях, простота и экспрессность анализа.
Цель данной работы – поиск и выбор условий пробоподготовки, определения CBZ, OXC и идентификации продуктов их метаболизма и деградации в биологическом материале (печени) методом хромато-масс-спектрометрии для решения экспертных задач судебно-медицинской токсикологии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы и материалы. Использовали следующие реактивы: CBZ, амитриптилин (AM), OXC (≥99%, Sigma Aldrich, США), метанол (для ВЭ-ЖХ), ацетонитрил (для ВЭЖХ), этилацетат (для ВЭЖХ), соляную кислоту 37%-ную, гидроксид натрия, водорода пероксид 35%-ный х. ч. Panreac, Испания), силикагель C18 (Agilent, США, C18 Endcapped, 100 g Bulk Sorbent, P/N 5982-5752), силикагель PSA (Supelco, США, 100 g Bulk, P/N 52738-U), сульфат магния безводный (Fluka, Италия, ≥97.0%), хлорид натрия (Fluka, Италия, ≥99.0%). Готовили стандартные растворы CBZ, OXC, AM с концентрациями 1 мг/мл в метаноле.
Использовали газовые хроматографы Agilent Technologies 5975 с масс-спектрометром Agilent Technologies 7820A и Agilent Technologies 8890 с масс-спектрометром Agilent Technologies 5977B (США). Хроматографическое разделение проводили на капиллярной колонке DB-5ms (25 м × × 0.25 мм × 0.25 мкм). В качестве газа-носителя использовали гелий со скоростью потока 1.0 мл/мин. Автосамплер G4513A использовали для введения 1 мкл пробы в ГХ-МС. Температуру нагрева колонки устанавливали в следующем диапазоне: 70–280°С при 20°С/мин с временем выдержки 1.00 мин, в результате чего общее время анализа составило около 20 мин. Масс-спектрометрическое разделение проводили с энергией электронов 70 эВ в режиме SCAN (50–600 m/z) и в режиме мониторинга выбранных ионов (SIM) с задержкой растворителя 4 мин.
Для приготовления образцов и растворов применяли весы аналитические AX-204 (MettlerToledo, Швейцария), pH-метр S470 (MettlerToledo, Швейцария), центрифугу Eppendorf Centrifuge 5804 R, Шейкеры Orbital Shaker S-3M, IKA Vortex 1, Eppendorf MixMate, центробежный вакуумный концентратор Eppendorf (Германия), гомогенизатор IKA ULTRA TURRAX Tube Drive (Германия), баню ультразвуковую TI-H 15 MF 2, Elma (Латвия), наборы для экстракции Quechers.
Дозирование проб, рабочих растворов и реактивов осуществляли дозаторами пипеточными одноканальными переменного объема Pipetman co сменными наконечниками 20–100 мкл или на 100–1000 мкл (Gilson, Франция). Исходные данные собирали и обрабатывали с помощью компьютерного программного обеспечения MSD ChemStation Data Analyses Software.
Искусственное устаревание карбамазепина и окскарбазепина. Искусственное устаревание лекарственных средств – это изменение препаратов в воссозданных неблагоприятных условиях с целью установления продуктов их деградации. Растворы CBZ и OXC подвергали кислотному и щелочному гидролизу, воздействию окислителя и высоких температур. Использовали следующий протокол при проведении эксперимента по искусственному устареванию. Метанольные растворы, содержащие 1 мг вещества, выпаривали в девяти пробирках типа Эппендорф в концентраторе в течение 15 мин. В три пробирки добавляли по 3 мл 18%-ной HCl, либо 2 М раствор гидроксида натрия, либо 3%-ный раствор пероксида водорода, подкисленный HCl до pH 1 и нагревали в кипящей водяной бане в течение 10 мин, 30 мин, 1 ч.
Процедура экстракции. Все растворы раздельно подкисляли 0.1 М HCl до pH 1–2. Далее экстрагировали 2 мл этилацетата и органический слой отбирали в пробирки типа Эппендорф. Водную фазу подщелачивали до pH 10 раствором гидроксида натрия. Затем экстрагировали 2 мл этилацетата и надосадочную жидкость отбирали в пробирки типа Эппендорф. Кислые и щелочные извлечения объединяли, и упаривали растворитель в течение 30 мин. Сухие остатки растворяли в 1 мл этилацетата. Переносили полученные растворы в стеклянные виалы объемом 2 мл и проводили ГХ--МС-анализ.
Подготовка образцов биологического материала. В данной работе методику проведения экстракции оптимизировали и адаптировали для извлечения CBZ и OXC из post mortem биологической ткани человека. В центрифужную пробирку объемом 50 мл с завинчивающейся крышкой помещали 2.5 г гомогенизированного образца печени. К образцу добавляли 100 мкл раствора внутреннего стандарта в метаноле. Закрытую пробирку помещали в орбитальный шейкер, встряхивали в течение 30 мин при 300 об/мин. Добавляли в пробирку 5 мл ацетонитрила, закрывали, помещали в орбитальный шейкер и встряхивали в течение 10 мин при 300 об./мин. Добавляли смесь солей: 1000 мг сульфата магния и 250 мг хлорида натрия. Закрывали пробирку и интенсивно встряхивали. Поместили пробирку на ультразвуковую баню на 30 мин, температура нагрева 30°C. Центрифугировали пробирку в течение 10 мин при 10000 g. Отбирали 2.7 мл надосадочной жидкости в центрифужную пробирку объемом 15 мл с завинчивающейся крышкой, содержащей смесь солей и сорбентов: 350 мг сульфата магния, 200 мг силикагеля С18 и 100 мг PSA. Встряхивали на вортексе в течение 5 мин при 2000 об/мин. Центрифугировали пробирку в течение 10 мин при 10 000 g. Отбирали 1.5 мл раствора после твердофазной экстракции и переносили в пробирку типа Эппендорф объемом 2 мл. Упаривали досуха в центрифужном концентраторе в течение 40 мин при 60°C. Добавляли в пробирку 150 мкл метанола, встряхивали на вортексе в течение 2 мин при 2000 об./мин. Переносили полученный раствор во вставку стеклянной виалы объемом 2 мл. Выполняли ГХ-МС-анализ.
Для расчета концентрации CBZ и OXC в печени использовали градуировочный график, построенный методом внутреннего стандарта с использованием стандартных растворов исследуемых веществ, которые добавляли к ткани печени, не содержащей CBZ и OXC. Далее подготовку образцов проводили, как описано выше. При данном способе определения потери аналита при изолировании не влияют на результат анализа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Идентификация продуктов деградации карбамазепина и окскарбазепина. Методом ГХ-МС установили продукты деградации, образующиеся в процессе гидролиза и окисления. В табл. 2 представлены структурные формулы продуктов деградации, их времена удерживания и масс-спектры.
Таблица 2.
Структурные формулы предполагаемых продуктов деградации карбамазепина и окскарбазепина, полученные в условиях кислотного и щелочного гидролиза и окисления
| № | Название | Способ получения продукта деградации | tR, мин | Молярная масса, г/моль | Структурная формула |
|---|---|---|---|---|---|
| 1 | Акридин (AI) | Щелочной гидролиз, кислотный гидролиз, окисление | 9.8 | 179 |  |
| 2 | 10H-Феноксазин | Окисление | 10.1 | 183 | 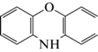 |
| 3 | Иминодибензил (ИДБ) | Щелочной гидролиз, кислотный гидролиз, окисление | 10.5 | 195 | 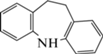 |
| 4 | Иминостильбен (AI) | Щелочной гидролиз, кислотный гидролиз, окисление | 10.7 | 236 | 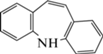 |
| 5 | 9-Хлоракридин (9-Cl-акридин) | Окисление | 10.8 | 213 | 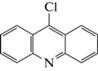 |
| 6 | Акридин-9-карбальдегид (АI-9-карбальдегид) | Щелочной гидролиз, кислотный гидролиз, окисление | 11.1 | 207 | 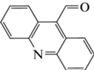 |
| 7 | 10-Хлор-5H-дибензо[b,f]азепин (10-Cl-ИДБ) | Кислотный гидролиз, окисление | 11.6 | 227 | 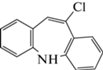 |
| 8 | 10H-Дибензо[b,f]азепин-10-он (О-ИДБ) | Щелочной гидролиз, кислотный гидролиз, окисление | 11.6 | 209 | 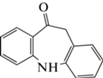 |
| 9 | 10,11-Дигидро-CBZ | Щелочной гидролиз, кислотный гидролиз, окисление | 12.2 | 238 | 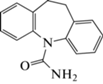 |
| 10 | Акридин-9-он (АО) | Окисление | 12.4 | 195 | 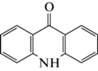 |
| 11 | 10-Хлор-CBZ (10-Cl-CBZ) | Кислотный гидролиз, окисление | 13.1 | 270 | 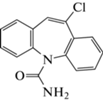 |
| 12 | 4,5-Дихлоракридин-9-он (4,5-ди-Cl-АО) | Окисление | 13.3 | 263 | 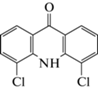 |
| 13 | 4-Хлоракридин-9-он (4-Cl-АО) | Окисление | 13.7 | 229 | 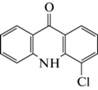 |
| 14 | 5H- Дибензо[b,f]азепин-10,11-дион (2О-ИДБ) | Окисление | 13.7 | 223 | 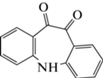 |
На всех хроматограммах наблюдается интен-сивный пик IM, его образование связано с термодеградацией CBZ в испарителе.
Найдено, что под действием 18%-ной HCl происходит частичное разложение молекулы CBZ с процентом деградации ~12% и образуются три основных продукта: IM, AI, АI-9-карбальдегид. Относительное содержание IM растет при увеличении продолжительности реакции. Относительное содержание продукта 10,11-дигидрокарбамазепина уменьшается с увеличением продолжительности реакции, так как при длительном воздействии высокой температуры отщепляется CONH2-группа и 10,11-дигидрокарбамазепин (№ 9, табл. 2) переходит в иминодибензил. Наличие пика АI-9-карбальдегида свидетельствует об образовании CBZ-EP, который в условиях хроматографического определения перегруппировывается с отщеплением CONH2-группы. Хлорированные производные CBZ и IM образуются через 10 мин после начала реакции, при этом 10-хлор-CBZ (№ 11, табл. 2) с временем удерживания 13.08 мин оказывается нестабильным в условиях эксперимента и уже через полчаса его не удалось идентифицировать.
Под действием 0.1 М раствора щелочи разложение молекул CBZ практически не происходит.
Под действием окислителя (пероксид водорода, подкисленный соляной кислотой) происходит частичное разложение CBZ (процент деградации ~82%) с образованием трех превалирующих продуктов IM, AI, АI-9-карбальдегида, причем AI образуется в значительно большем количестве, чем IM. Продукт окисления АО и CBZ не удалось разделить в данных условиях, на хроматограмме они элюируются одним пиком, но в режиме SIM по выбранным ионам 195 и 193 соответственно рассчитали их относительные количества (табл. 3). Продукт разложения 10,11-дигидрокарбамазепина и продукт окисления 10H-феноксазин оказались нестабильными в условиях проведения эксперимента и идентифицируются только на хроматограмме, полученной при минимальном времени гидролиза. Наоборот, хлорированные производные АО (9), 4-Cl-AO и 4,5-ди-Cl-АО образуются только через 30 мин.
Таблица 3.
Средние относительные содержания продуктов деградации карбамазепина (%) в условиях окисления, рассчитанные методом внутренней нормализации (n = 3)
| Время реакции, мин | IM | AI | ИДБ | АI-9-Карбаль-дегид | 10,11-Дигидро-CBZ | 9-Cl-AI | 10-Cl-ИДБ | 10-Хлор-CBZ | АО | 4-Cl-AO | 4,5-Ди-Cl-АО | 10H-Фенокса-зин |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 10 | 3 | 73 | 0.2 | 7 | 0.1 | 2 | 0.03 | 0.2 | 2.5 | – | – | 0.13 |
| 30 | 2 | 83 | 0.3 | 9 | – | 2 | 0.01 | 0.2 | 2.8 | 0.6 | 0.05 | – |
| 60 | 0.5 | 83 | 0.5 | 7 | – | 2 | 0.02 | 0.2 | 3.3 | 2.3 | 0.40 | – |
Окскарбазепин обладает скудным набором стабильных во времени продуктов деградации.
Определение карбамазепина и окскарбазепина. Известно, что терапевтический диапазон концентраций CBZ и OXC в печени варьируется от 200 нг/г до 2 мкг/г, а токсические концентрации – от 2 мкг/г, содержания ниже 200 нг/г относят к следовым количествам. Чувствительность метода ГХ-МС достаточна для обнаружения и определения CBZ и OXC на таких уровнях без предварительного концентрирования. Определение проводили с использованием AM в качестве внутреннего стандарта (ВС).
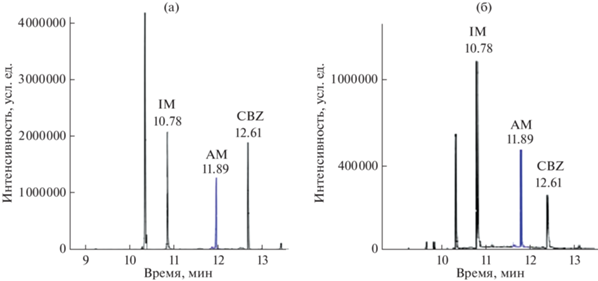
Результаты жидкостной экстракции высоких концентраций CBZ и OXC из модельных растворов оказались неудовлетворительными: интенсивность пиков CBZ в 50 раз меньше, чем при использовании процедуры QUECHERS (рис. 3). Большие потери аналита могут быть связаны с образованием эмульсии и плохим разделением слоев, а также с гидрофильностью определяемых соединений. Выбранные ионы для идентификации и определения, а также времена удерживания веществ приведены в табл. 4. Некоторые метрологические характеристики приведены в табл. 5. В качестве аналитического сигнала использовали отношение площади хроматографического пика, соответствующего CBZ и OXC, к площади пика внутреннего стандарта (Si/SBC).
Рис. 3.
Хроматограммы модельных растворов гомогенизатов печени с добавлением 5 мкг/г карбамазепина: (а) экстракция QUECHERS; (б) жидкостная экстракция. Капиллярная колонка DB-5ms (25 м × 0.25 мм × 0.25 мкм), газ-носитель гелий, скорость потока 1 мл/мин, температура испарителя 250°С, режим SCAN.
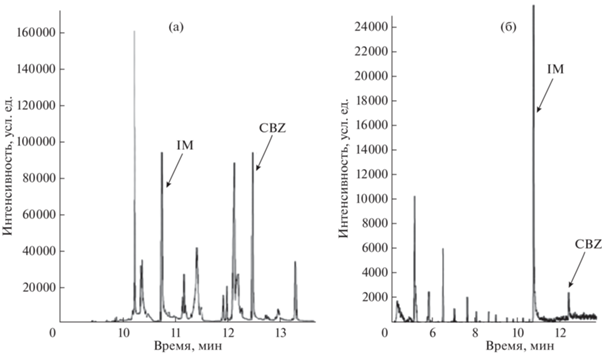
Таблица 4.
Времена удерживания компонентов и ионы, выбранные для определения карбамазепина и окскарбазепина
| Вещество | Молекулярный ион (m/z) | Ионы, выбранные для определения (m/z) | Время удерживания, мин |
|---|---|---|---|
| CBZ | 236 | 193 | 12.47 |
| AM (ВС) | 277 | 58 | 11.85 |
| OXC | 252 | 209 | 12.96 |
Таблица 5.
Метрологические характеристики способа определения карбамазепина и окскарбазепин в образцах тканей печени методом ГХ-МС (n = 5, P = 0.95)
| Соединение | cмин, мкг/г | cн, мкг/г | Диапазон линейности, мкг/г | Уравнение градуировочной зависимости | sr |
|---|---|---|---|---|---|
| CBZ | 0.1 | 0.3 | 0.3–5.0 r = 0.998 |
${{{{S}_{{\text{i}}}}} \mathord{\left/ {\vphantom {{{{S}_{{\text{i}}}}} {{{S}_{{{\text{ВС}}}}}}}} \right. \kern-0em} {{{S}_{{{\text{ВС}}}}}}}$ = 0.2942ci – 0.0136 | 0.08 |
| OXC | 0.2 | 0.5 | 0.5–5.00 r = 0.998 | ${{{{S}_{{\text{i}}}}} \mathord{\left/ {\vphantom {{{{S}_{{\text{i}}}}} {{{S}_{{{\text{ВС}}}}}}}} \right. \kern-0em} {{{S}_{{{\text{ВС}}}}}}}$ = 0.054ci – 0.008 | 0.09 |
Для CBZ предел обнаружения (cмин) рассчитывали на основе соотношения сигнал/шум S/N = 3 для проб с низкими концентрациями. Предел обнаружения исследуемых антиэпилептических препаратов составил 0.1 мкг/г для образцов ткани. Предел определения (cн) рассчитывали на основе соотношения S/N = 10; он составил 0.3 мкг/г для образцов ткани. Правильность и воспроизводимость оценивали в ходе одного эксперимента на трех уровнях концентраций CBZ и OXC – нижнем, среднем и высоком. Получили удовлетворительные результаты: значения для образцов печени при разных концентрациях аналитов ниже 20%, что соответствует требованиям Руководства по валидации Российского центра судебно-медицинской экспертизы [43].
На рис. 4 представлены хроматограммы двух образцов печени человека (посмертные экспертные образцы ткани печени проанализированы в Российском Центре судебно-медицинской экспертизы). Содержание CBZ в образце 1 составило 1.1 мкг/г, в образце 2 – 1.7 мкг/г. Таким образом, концентрации CBZ в обоих образцах лежат в терапевтическом диапазоне, так что, по-видимому, смерть наступила не по причине отравления CBZ. Окскарбазепин и его метаболиты, а также продукты деградации карбамазепина в образцах не обнаружены.
* * *
Таким образом, разработан способ определения карбамазепина и окскарбазепина в тканях печени (post moptem) методом газовой хроматографии с масс-спектрометрическим детектированием. В качестве внутреннего стандарта использован амитриптилин. Для пробоподготовки образцов биоматериала предложена процедура QUECHERS. Исследованы продукты деградации карбамазепина и окскарбазепина в модельных растворах при щелочном и кислотном гидролизе и окислении. Предварительно идентифицированы 14 метаболитов и продуктов деградации. Установлено, что наибольшее их количество образуется при окислении подкисленным до pH 1–2 3%-ным раствором пероксида водорода. Определены основные аналитические характеристики разработанного способа определения карбамазепина и окскарбазепина в тканях печени. Предел обнаружения составляет 0.1 мкг/г и 0.2 мкг/г для CBZ и OXC соответственно. Установлено соответствие разработанного способа требованиям Руководства по валидации Российского центра судебно-медицинской экспертизы. Проведен анализ двух образцов post mortem печени, определены уровни концентраций карбамазепина. Найденные концентрации карбамазепина составляют 1.1 мкг/г в образце 1 и 1.7 мкг/г в образце 2.
Исследование проводилось с использованием оборудования ЦКП МГУ “Технологии получения новых наноструктурированных материалов и их комплексное исследование”, приобретенного МГУ по программе обновления приборной базы в рамках национального проекта “Наука” и в рамках Программы развития МГУ.
Список литературы
Schmidt D., Elger C.E. What is the evidence that oxcarbazepine and carbamazepine are distinctly different antiepileptic drugs? // Epilepsy Behav. 2004. V. 5 № 5. P. 627.
Furst S. M., Uetrecht J. P. The effect of carbamazepine and its reactive metabolite, 9-acridine carboxaldehyde, on immune cell function in vitro // Int. J. Immunopharmacol. 1995. V. 17. № 5. P. 445.
Wad N., Guenat C., Krämer G. Carbamazepine: detection of another metabolite in serum, 9 hydroxymethyl-10-carbamoyl acridan // Ther. Drug Monit. 1997. V. 19. № 3. P. 314.
Iida A., Sasaki E., Yano A., Tsuneyama K., Fukami T., Nakajima M., Yokoi T. Carbamazepine-induced liver injury requires CYP3A-mediated metabolism and glutathione depletion in rats // Drug Metab. Dispos. 2015. V. 43. № 7. P. 958.
Jiang W., Xia T., Yun Y., Li M., Zhang F., Gao S., Chen W. UHPLC-MS/MS method for simultaneous determination of carbamazepine and its seven major metabolites in serum of epileptic patients // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2019. V. 1108. P. 17.
Eichelbaum M., Tomson T., Tybring G., Bertilsson L. Carbamazepine metabolism in man // Clin. Pharmacokinet. 1985. V. 10. № 1. P. 80.
Knowles S.R., Uetrecht J., Shear N.H. Idiosyncratic drug reactions: The reactive metabolite syndromes // The Lancet. 2000. V. 356. № 9241. P. 1587.
Brenton H., Cociglio M., Bressolle F., Peyriere H., Blayac J., Hillairebuys D. Liquid chromatography–electrospray mass spectrometry determination of carbamazepine, oxcarbazepine and eight of their metabolites in human plasma // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2005. V. 828. № 1–2. P. 80.
Csetenyi J., Baker K.M., Frigerio A., Morselli P.L. Iminostilbene-a metabolite of carbamazepine isolated from rat urine // J. Pharm. Pharmacol. 1973. V. 25. № 4. P. 340.
Pearce R.E. Pathways of carbamazepine bioactivation in vitro I. Characterization of human cytochromes P450 responsible for the formation of 2- and 3-hydroxylated metabolites // Drug Metab. Dispos. 2002. V. 30 № 11. P. 1170.
Furst S.M., Uetrecht J.P. Carbamazepine metabolism to a reactive intermediate by the myeloperoxidase system of activated neutrophils // Biochem. Pharmacol. 1993. V. 45. № 6. P. 1267.
Larkin J., McKee P., Forrest G., Beastall G., Park B., Lowrie J., Brodie M. Lack of enzyme induction with oxcarbazepine (600 mg daily) in healthy subjects // Br. J. Clin. Pharmacol. 1991. V. 31. № 1. P. 65.
Flesch G. Overview of the clinical pharmacokinetics of oxcarbazepine // Clin. Drug Investig. 2004. V. 24. № 4. P. 185.
Schütz H., Feldmann K.F., Faigle J.W., Kriemler H.P., Winkler T. The metabolism of 14C-oxcarbazepine in man. Xenobiotica // 1986. V. 16. № 8. P. 769.
Mandrioli R., Albani F., Casamenti G., Sabbioni C., Raggi M.A. Simultaneous high-performance liquid chromatography determination of carbamazepine and five of its metabolites in plasma of epileptic patients // J. Chromatogr. B: Biomed. Sci. Appl. 2001. V. 762. № 2. P. 109.
Deeb S., McKeown D.A., Torrance H.J., Wylie F.M., Logan B.K., Scott K.S. Simultaneous analysis of 22 antiepileptic drugs in postmortem blood, serum and plasma using LC–MS-MS with a focus on their role in forensic cases // J. Anal. Toxicol. 2014. V. 38. № 8. P. 485.
Jiang W., Xia T., Yun Y., Li M., Zhang F., Gao S., Chen W. UHPLC-MS/MS method for simultaneous determination of carbamazepine and its seven major metabolites in serum of epileptic patients // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2019. V. 1108. P. 17.
Ferrari Júnior E., Caldas E. D. Simultaneous determination of drugs and pesticides in postmortem blood using dispersive solid-phase extraction and large volume injection-programmed temperature vaporization-gas chromatography–mass spectrometry // Forensic Sci. Int. 2018. V. 290. P. 318.
Moffat A.C., Osselton M.D., Widdop B., Watts J. Clarke’s Analysis of Drugs and Poisons in pharmaceuticals, body fluids and postmortem material. 4th Ed. Química Farmacêutica, 2011. 2609 p.
Levine B., Phipps R.J., Naso C., Fahie K., Fowler D. Tissue distribution of newer anticonvulsant drugs in postmortem cases // J. Anal. Toxicol. 2010. V. 34. № 8. P. 506.
Lionetto L., Casolla B., Cavallari M., Tisei P., Buttinelli C., Simmaco M. High-performance liquid chromatography–tandem mass spectrometry method for simultaneous quantification of carbamazepine, oxcarbazepine, and their main metabolites in human serum // Ther. Drug Monit. 2012. V. 34. № 1. P. 53.
Wu S., Xu W., Subhani Q., Yang B., Chen D., Zhu Y., Li L. Ion chromatography combined with online electrochemical derivatization and fluorescence detection for the determination of carbamazepine in human plasma // Talanta. 2012. V. 101. P. 541.
Veiga A., Dordio A., Carvalho A. J.P., Teixeira D.M., Teixeira J.G. Ultra-sensitive voltammetric sensor for trace analysis of carbamazepine // Anal. Chim. Acta. 2010. V. 674. № 2. P. 182.
Gibbons S.E., Wang C., Ma Y. Determination of pharmaceutical and personal care products in wastewater by capillary electrophoresis with UV detection // Talanta. 2011. V. 84. № 4. P. 1163.
Cámara M.S., Mastandrea C., Goicoechea H.C. Chemometrics-assisted simple UV-spectroscopic determination of carbamazepine in human serum and comparison with reference methods // J. Biochem. Biophys. Methods. 2005. V. 64. № 3. P. 153.
Kalanur S.S., Seetharamappa J. Electrochemical oxidation of bioactive carbamazepine and its interaction with DNA // Anal. Lett. 2010. V. 43. № 4. P. 618.
Burke J.T., Thénot J.P. Determination of antiepileptic drugs // J. Chromatogr. B: Biomed. Sci. Appl. 1985. V. 340. P. 199.
Godolphin W., Thoma J. Quantitation of anticonvulsant drugs in serum by gas-chromatography on the stationary phase SP-2510 // Clin. Chem. 1978. V. 24. № 3. P. 483.
Kupferberg H.J. GLC determination of carbamazepine in plasma // J. Pharm. Sci. 1972. V. 61. № 2. P. 284.
Least C.J., Johnson G.F., Solomon H.M. Therapeutic monitoring of anticonvulsant drugs: Gas-chromatographic simultaneous determination of primidone, phenylethylmalonamide, carbamazepine, and diphenylhydantoin // Clin. Chem. 1975. V. 21. № 11. P. 1658.
Abraham C.V., Joslin H.D. Simultaneous gas-chromatographic analysis for phenobarbital, diphenylhydantoin, carbamazepine, and primidone in serum // Clin. Chem. 1976. V. 22. № 6. P. 769.
Trager W.E, Levy R.H., Patel I.H., Neal J.M. Pharmacokinetics of carbamazepine-10,11-epoxide before and after autoinduction in rhesus monkeys // J. Pharmacol. Exp. Ther. 1978. V. 206. № 3. P. 607.
Hallbach J., Vogel H., Guder W.G. Determination of lamotrigine, carbamazepine and carbamazepine epoxide in human serum by gas chromatography mass spectrometry // Eur. J. Clin. Chem. Clin. Biochem. 1997. V. 35. № 10. P. 755.
Speed D.J., Dickson S.J., Cairns E.R., Kim N.D. Analysis of six anticonvulsant drugs using solid-phase extraction, deuterated internal standards, and gas chromatography-mass spectrometry // J. Anal. Toxicol. 2000. V. 24. № 8. P. 685.
Inotsume N., Higashi A., Kinoshita E., Matsuoka T., Nakano M. Rapid and sensitive determination of ethotoin as well as carbamazepine, phenobarbital, phenytoin and primidone in human serum // J. Chromatogr. B: Biomed. Sci. Appl. 1986. V. 383. № 1. P. 166.
Maurer H.H. Detection of anticonvulsants and their metabolites in urine within a “general unknown” analysis procedure using computerized gas chromatography-mass spectrometry // Arch. Toxicol. 1990. V. 64. № 7. P. 554.
Palmér L., Bertilsson L., Coliste P., Rawlins, M. Quantitative determination of carbamazepine in plasma by mass fragmentography // Clin. Pharmacol. Ther. 1973. V. 14. № 5. P. 827.
Ferrari Júnior E., Caldas E.D. Simultaneous determination of drugs and pesticides in postmortem blood using dispersive solid-phase extraction and large volume injection-programmed temperature vaporization-gas chromatography–mass spectrometry // Forensic Sci. Int. 2018. V. 290. P. 318.
Lewis R.J., Angier M.K., Johnson R.D. False carbamazepine positives due to 10,11-dihydro-10-hydroxycarbamazepine breakdown in the GC–MS injector port // J. Anal. Toxicol. 2014. V. 38. № 8. P. 519.
Von Unruh G.E., Paar W.D. Gas chromatographic/mass spectrometric assays for oxcarbazepine and its main metabolites, 10-hydroxy-carbazepine and carbazepine-10,11-trans-diol // Biomed. Environ. Mass Spectrom. 1986. V. 13. № 12. P. 651.
Erarpat S., Bodur S., Fırat Ayyıldız M., Tahir Günkara Ö., Erulaş F., Chorme, D.S., Bakırdere S. Accurate and simple determination of oxcarbazepine in human plasma and urine samples using switchable-hydrophilicity solvent in GC-MS // Biomed. Chromatogr. 2020. V. 34. № 10. Article e4915.
Rani S., Malik A.K. A novel microextraction by packed sorbent-gas chromatography procedure for the simultaneous analysis of antiepileptic drugs in human plasma and urine // J. Sep. Sci. 2012. V. 35. № 21. P. 2970.
Барсегян С.С., Саломатин Е.М., Плетенева Т.В., Максимова Т.В., Долинкин А.О. Методические рекомендации по валидации аналитических методик, используемых в судебно-химическом и химико-токсикологическом анализе биологического материала. М.: Российский центр судебно-медицинской экспертизы, 2014. 52 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии