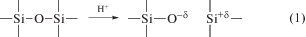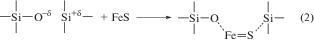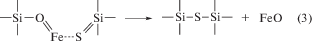Астрономический вестник, 2021, T. 55, № 4, стр. 316-321
О возможном механизме образования оксида железа в лунном реголите
А. Ю. Дубинский a, С. И. Попель a, *
a Институт космических исследований РАН
Москва, Россия
* E-mail: popel@iki.rssi.ru
Поступила в редакцию 10.12.2020
После доработки 11.02.2021
Принята к публикации 05.03.2021
Аннотация
Предложена схема образования оксида железа(II) из молекул сульфида железа с использованием кислорода, входящего в состав оксида кремния, из лунного реголита. Источником энергии, запускающим реакцию обмена, служат протоны солнечного ветра.
ВВЕДЕНИЕ
Вблизи орбит Земли и Луны скорость протона в составе солнечного ветра составляет 300–700 км/с, что соответствует кинетической энергии в среднем порядка 1 кэВ. Поток H+ устремляется на лунный реголит, состоящий в существенной степени из минералов, в структуру которых, в частности, входят молекулярные фрагменты Si–O–Si, подобно тем, что имеются в оксиде кремния SiO2. У такого рода молекулярных фрагментов характерная энергия силоксановой связи Si–O составляет величину порядка аналогичной энергии для оксида кремния, т.е. 450 кДж/моль или 4.5 эВ. Таким образом, влетая в материю лунной поверхности, протон может многократно разорвать связь кремний–кислород и, наконец, связаться с кислородом последней разрушенной связи с образованием гидроксильной группы –ОН.
Вопрос о накоплении значительных концентраций гидроксильных групп и, как следствие, повышенного содержания водорода в поверхностных слоях лунного грунта обсуждался в литературе неоднократно за последние десятилетия (Starukhina, 2001; Jones и др., 2018). Он является весьма актуальным в связи с вопросом о наличии на Луне воды. Механизм участия –ОН-групп в формировании молекул H2O в лунном реголите был рассмотрен в работе (Дубинский, Попель, 2019). В ней была предложена схема восстановления серебра из его сульфида с образованием молекулы воды. Эта реакция может идти преимущественно в тех точках, где водород окончательно затормаживается в лунной породе, и в конечном итоге возникает гидроксильная группа.
Отметим, что на один акт образования водородосодержащей группы приходится в несколько раз большее число актов разрушения силоксановой связи с образованием молекулярных фрагментов, обладающих значительной реакционной способностью. Плазмоиндуцированное возникновение отрицательно заряженного О–δ (кислорода с его неподеленной парой электронов) и положительно заряженного атома кремния Si+δ может запускать различные твердофазные реакции с молекулами, непосредственно контактирующими с молекулярной окрестностью разрушенной связи. При этом становятся возможными реакции с энергетическим барьером (в первую очередь, для разрыва прочной связи Si–O), непреодолимым за счет одной лишь тепловой энергии молекул и атомов.
В этой связи интерес представляет изучение реакций, в которых принимают участие соединения, содержащие Si–O–Si фрагменты, с одной стороны, и Fe, с другой. Будучи одним из самых распространенных металлов на Луне, железо оказывает большое влияние на формирование, эволюцию и состав минералов на ее поверхности. Оно присутствует преимущественно в ильмените, оливине, пироксенах, и с момента начала исследования химического состава Луны в изучении соединений железа был достигнут значительный прогресс. Наряду с многолетним непосредственным анализом лунного грунта, начавшимся еще в семидесятые годы прошлого столетия (Виноградов и др., 1971; 1972; Abdel-Gawad и др., 1970; Богатиков и др., 2001), развивались и спектроскопические методы изучения лунной поверхности, по результатам которых в последние годы была построена карта распространенности FeO в составе минералов лунного реголита (Tang и др., 2016). Аналогичному картированию подвергся ряд других соединений, среди которых были связанные с кислородом кремний, титан, алюминий, магний, кальций (Yan и др., 2012; Xia и др., 2019).
Недавние измерения (Li и др., 2020) указали также на наличие в полярных областях Луны Fe2O3 – оксида железа(III). При этом для объяснения существования оксида железа(III) в лунном реголите потребовалось привлечение кислорода из магнитосферы Земли, поскольку известно, что Луна около четверти своей орбиты проводит в плазме хвоста магнитосферы.
Целью настоящей работы является развитие подхода, предложенного в предыдущей публикации (Дубинский, Попель, 2017), согласно которому для приповерхностных реакций в лунном реголите важную роль играет поток протонов солнечного ветра, энергия которого позволяет разрывать самые прочные молекулярные связи и вовлекать в оборот атомы из состава поверхностных минералов. В первую очередь, это касается кислорода, самого распространенного элемента, входящего в состав реголита, практически полностью находящегося в связанном состоянии. В этой работе мы также рассмотрим реакции с участием другого распространенного элемента – железа (Heiken и др., 1991), чье превращение в приповерхностных слоях привлекает неослабевающий интерес при исследованиях Луны (см., например, Allen и др., 2011; Benna и др., 2019; Dalton, Roberto, 2008; Tang и др., 2015).
Обсудим здесь возможное участие молекул FeS – простейшего соединения железа и серы. Cульфид железа, как и прежде (Дубинский, Попель, 2019), рассматривается в силу того, что по своей электронной структуре внешних орбиталей сера аналогична кислороду, и хотя отличается от последнего большим радиусом, замещение атома кислорода на атом серы не приведет к существенному дефекту кристаллической решетки SiO2. Взаимодействие с иными соединениями, гомологичными сере, мы не рассматриваем по причине того, что более крупные атомы (Se, Te) еще сложнее встраиваются в решетку оксида кремния, а также из-за их малого содержания в лунном реголите.
В разделе “Механизм образования оксида железа(II)” данной работы приводится описание механизма образования оксида железа под действием солнечного ветра, а также оцениваются энергетические и кинетические аспекты протекающих процессов. В разделе “Обсуждение результатов” предложенный механизм обсуждается с точки зрения недавних наблюдений (Li и др., 2020) окисленного железа на поверхности Луны.
МЕХАНИЗМ ОБРАЗОВАНИЯ ОКСИДА ЖЕЛЕЗА(II)
Рассмотрим область непосредственной близости сульфида железа и оксида кремния.
а) При прохождении протона солнечного ветра разрывается связь Si–O с образованием частично заряженных атомов Si+δ и O–δ.
Плотность потока частиц солнечного ветра у поверхности Луны составляет около 3 × 108 см–2 с–1. Глубина проникновения протонов в реголит имеет порядок 10–100 нм (Hapke, 2001), что по порядку величины соответствует количеству связей Si–O, разрушенных на пути движения H+. Так, принимая, что характерное расстояние между атомами в кристалле SiO2 составляет около 0.2 нм, получаем, что разрыв 100–200 связей соответствует расстоянию ~20–40 нм. Время торможения протона составляет величину порядка 10–13 с. В свою очередь, для оценки количества актов разрыва связей Si–O в приповерхностном слое реголита примем величину в 30 нм за глубину прохождения протона. Тогда в этом слое площадью в 1 см2 происходит порядка 3 × 108 см–2 × 200 = 6 × 1010 актов разрыва. Таким образом, в приповерхностном слое ~30 нм толщины имеем около 2 × 1016 см–3 с–1 актов разрыва связей Si–O в пересчете на единицу объема.
б) На следующем этапе происходит образование промежуточного комплекса с молекулой FeS
Молекула FeS характеризуется ярко выраженной ионизацией атомов железа и серы. По этой причине имеется тенденция к образованию промежуточных связей Fe–O и S–Si. Следует отметить, что комплекс не обязательно имеет плоскую структуру. Вполне возможно, что атомы O–δ и Si+δ, а также молекула FeS лежат на скрещивающихся прямых.
в) Наконец, кислород захватывает атом железа, вследствие чего высвобождается оксид железа (II), а атом серы замыкает связи с атомами кремния, восполняя в этой позиции ушедший кислород.
Как уже упоминалось, энергия связи Si–O составляет величину около 450 кДж/моль, тогда как аналогичная связь Si–S характеризуется значением энергии связи, приблизительно равным 265 кДж/моль (Некрасов, 1973). В свою очередь, энергия двойной связи в молекуле FeS равна 322 кДж/моль, а аналогичная в FeO – 390 кДж/моль (Волков, Жарский, 2005).
Отсюда можно оценить суммарный энергетический эффект реакции
(4)
$ - {\text{Si}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{Si}}{\kern 1pt} - + {\text{ FeS}} \to - {\text{Si}}{\kern 1pt} - {\kern 1pt} {\text{S}}{\kern 1pt} - {\kern 1pt} {\text{Si}}{\kern 1pt} - + {\text{ FeO}},$Напротив, когда импульсом протона солнечного ветра одна из связей разрушена, дальнейшее протекание реакций (2) и (3), наоборот, сопровождается выделением энергии ∆E = 1 × 450 + + 322 – 390 – 2 × 265 ≈ –150 кДж/моль, а электрическое взаимодействие полярной молекулы FeS с локально заряженными кислородом и кремнием приводит к образованию переходного комплекса и минимизирует энергетический барьер заключительного этапа – образования оксида железа.
Следует отметить, что в расчетах сделаны определенные упрощения. Так, оперируя с Si‒O связями, мы используем усредненные данные, полагая, эквивалентными характеристики силоксановой связи в кремнеземе или, например, пироксенах. Также стандартная энергия связи кремний‒сера (в чистом SiS2) отличается от энергии деформированных Si–S–Si связей в составе кремнийсодержащего минерала. Изначально меньшее межатомное расстояние между атомами кремния, задаваемое связями Si–O–Si (длина связи Si–O ≈ ≈ 0.164 нм), увеличивается из-за появления серы между атомами кремния, но при этом уменьшается валентный угол вокруг атома серы (с длиной связи Si–S ≈ 0.215 нм) (Некрасов, 1973). Также связь Si–O–δ в возбужденном состоянии и соответственно энергия этой связи отличаются от ситуации с невозмущенной связью кремний–кислород. Однако основной порядок величины показывает очевидную разницу в энергетических эффектах, несмотря на некоторые упрощения, допущенные при расчете.
Скорость предложенного механизма определяется, во-первых, интенсивностью реакции (1), которая требует энергию для разрыва силоксановой связи (носителем этой энергии выступают протоны солнечного ветра). Также критичной является область контакта троилита, FeS, и SiO2-содержащего минерала. Троилит является одним из самых распространенных сульфидов на Луне (Мохов и др., 2007) и встречается в виде зерен с размерами порядка 104 нм (Фрондел, 1978) (см. рис. 1), а слой оксида минерала, в который проникает протон, как уже отмечалось, оценивается величиной, меньшей или порядка 102 нм. В этом смысле, важными являются размеры частиц лунного реголита, контактирующих с троилитом. Подчеркнем, что для эффективной реализации механизма образования оксида железа рассмотренные реакции должны происходить на границе соприкосновения силикат-содержащего минерала и троилита.
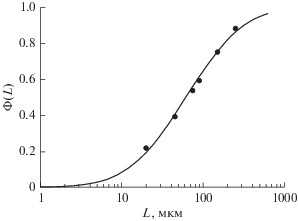
Для эффективного функционирования предложенного в настоящей работе механизма замещения атома кислорода серой желательно, чтобы область контакта FeS и силоксановой связи была бы на глубине, не большей, чем характерная глубина проникновения протона солнечного ветра в реголит. Это достигается благодаря большому количеству наномасштабных частиц в составе реголита. Действительно, согласно данным (Colwell и др., 2007) в диапазоне размеров частиц реголита на поверхности Луны от 20 до 500 мкм распределение частиц реголита (рис. 2) находится в хорошем согласии с распределением Колмогорова (Адушкин и др., 2007) которое характеризует распределение частиц по размерам для случая многократного дробления. Указанный факт согласуется с выводами (Colwell и др., 2007) о том, что лунная поверхность представляет собой реголит, эволюционирующий в результате многократного дробления в результате ударов метеороидов. В работе (Адушкин и др., 2007) показано, что для случая многократного дробления распределение Колмогорова остается справедливым, по крайней мере для размеров частиц, больших 70 нм, что позволяет нам продлить полученное на основе данных (Colwell и др., 2007) распределение пылевых частиц лунной поверхности в сторону меньших размеров вплоть до размеров порядка нескольких десятков нм. Кроме того, распределение, представленное на рис. 2, является распределением по массам. Если перейти к распределению по размерам, то максимум распределения Колмогорова смещается в область меньших размеров, и максимум этого распределения приходится на величины, меньшие или порядка 100 нм, а это – именно те величины размеров частиц реголита, при которых предложенный в настоящей работе механизм образования оксида железа наиболее эффективен.
Рис. 2.
Теоретическое распределение Колмогорова (Адушкин и др., 2007), описывающее данные наблюдений размеров (L) частиц реголита на поверхности Луны (сплошная кривая). Точки соответствуют данным, приведенным в работе (Colwell и др., 2007).
Еще одним благоприятным условием образования молекул оксида железа на поверхности Луны в результате реализации описанного в настоящей работе механизма является возможность повышенных (по сравнению с ситуацией на Земле) температур, которые в дневное время могут достигать на Луне величин около 400 К, что облегчает прохождение реакции через стадию промежуточного комплекса (2)–(3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В дальнейшем FeO может ожидать различные превращения. Одно из них – диспропорционирование на Fe и Fe3O4 при умеренных, до ~850 К, температурах (Уэллс А., 1987). Это уже соединение, в котором присутствует Fe+3 и которое представляет собой промежуточный этап между FeO и Fe2O3. При температурах разложения Fe3O4 (~1800 K) выделяется кислород. Такие температуры (~1800 K) вполне достижимы при соударениях микрометеороидов с поверхностью Луны (Попель и др., 2016; Popel и др., 2018). Следует отметить, что реакции с участием оксидов железа с разными степенями окисления обратимы, и в лунных условиях образование Fe и Fe2O3 может происходить также из FeO. Также значимая роль отводится оксиду FeO в балансе воды на лунной поверхности (Benna и др., 2019). При участии протонов солнечного ветра возможны следующие реакции (см., например, Dalton, Roberto, 2008) FeO + 2H+ → Fe+2 + H2O; 2Fe+2 + 2H+ → 2Fe+3 + H2, указывающие на возможность образования воды, а также трехвалентного железа, входящего в состав гематита. Однако данные реакции представляются существенно менее вероятными, чем реакции, рассмотренные в настоящей работе, поскольку, они требуют одновременного попадания двух протонов солнечного ветра в область площадью ~(1 Å)2 с тем, чтобы эти реакции осуществились. Тогда как для осуществления реакции (1), рассмотренной в настоящей работе, достаточно всего одного протона.
Оксид железа Fe2O3 до недавнего времени фиксировался на Луне в минимальных количествах. Однако недавние результаты наблюдений (Li и др., 2020) указали на присутствие гематита в области высоких широт, что не вполне согласуется со сформировавшимися представлениями о лунной поверхности как восстановительной среде, в первую очередь, за счет ее насыщенности водородом, поступающим на Луну в составе солнечного ветра. О существовании самородного железа на Луне было известно с момента изъятия первых проб лунного грунта и выдвинуто несколько гипотез образования субмикроскопического металлического железа. Напротив, образование оксида железа(III) требует, очевидно, наличия способного к реакции кислорода, которому авторы статьи (Li и др., 2020) приписывают земное происхождение. Не отрицая данную гипотезу, следует отметить, что поток молекул кислорода (из хвоста земной магнитосферы) в любом случае сопоставим или меньше по порядку, чем поток протонов солнечного ветра. Для последующей реакции требуется непременный выход железа на поверхность. Согласно же предложенному механизму кристалл сульфида железа может быть закрыт слоем реголита толщиной вплоть до 102 нм. Также попадание одного протона, как уже отмечалось, может дать энергетический импульс многочисленным актам обмена серы на кислород в соединении с железом. Таким образом, кислород в контексте механизма, предложенного в настоящей работе, может считаться неисчерпаемым.
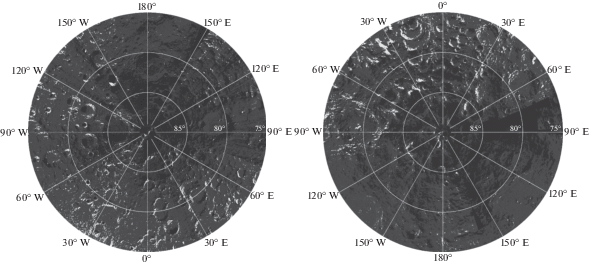
Важной составной частью рассмотренного в настоящей работе механизма образования оксида железа является присутствие солнечного ветра, интенсивность взаимодействия которого с лунной поверхностью максимальна вблизи экватора и минимальна в области полюсов. Соответственно, следует ожидать, что эффективность рассмотренного механизма образования оксида железа должна зависеть от лунной широты. На рис. 3 приведены области присутствия оксида железа по данным работы (Li и др., 2020) для лунных широт от 75° до 90°. Видна закономерность, что количество областей оксида железа увеличивается по мере удаления от полюсов Луны.
ЗАКЛЮЧЕНИЕ
Итак, предложенная в настоящей работе схема предлагает механизм образования оксида железа(II), способного самостоятельно превращаться в Fe2O3. Впрочем, его синтез может быть лишь частью окислительно-восстановительных реакций, запускаемых энергией солнечного ветра. В частности, помимо оксидов железа, за счет наличия ОН-групп в системе может образоваться магнитоксид железа FeO(OH), две молекулы которого могут затем превращаться в гематит и воду. Также возможна диффузия ионов железа и серы в объем оксида кремния и их самостоятельное взаимодействие с возбужденными фрагментами оксида кремния. Эти реакции могут быть предметом отдельного обсуждения и более детальной модели. Существование оксида железа в лунном реголите может уменьшить его работу выхода, что следует учитывать при рассмотрении плазменно-пылевой системы над лунной поверхностью (Попель и др., 2013).
Следует отметить, что рассмотренные процессы обусловлены воздействием высокоэнергетичного протона солнечного ветра, что приводит к быстрому разрушению силоксановых связей. Поэтому эти процессы являются неравновесными. Дальнейшее развитие описания предложенного здесь механизма образования оксида железа(II) потребует использования подхода неравновесной термодинамики.
Список литературы
Адушкин В.В., Перник Л.М., Попель С.И. Наночастицы в опытах по разрушению скальных пород взрывом // Докл. РАН. 2007. № 2. С. 247–250.
Богатиков О.А., Горшков А.И., Мохов А.В., Ашихмина Н.А., Магазина Л.О. Первая находка самородного молибдена, сульфида серебра и твердого раствора железа и олова в лунном грунте // Геохимия. 2001. № 6. С. 665–670.
Виноградов А.Н., Нефедов В.И., Урусов В.С., Жаворонков Н.М. Рентгеноэлектронные исследования металлического железа в лунном реголите // Докл. АН СССР. 1972. Т. 207. № 2. С. 433–436.
Виноградов А.П., Нефедов В.И., Урусов В.С., Жаворонков Н.М. Рентгеноэлектронное исследование лунного реголита из Морей Изобилия и Спокойствия // Докл. АН СССР. 1971. Т. 201. № 4. С. 957–960.
Волков А.И., Жарский И.М. Большой химический справочник: Мн.: Современная школа, 2005. 70 с.
Дубинский А., Попель С.И. К вопросу об образовании воды в лунном реголите // Космич. исслед. 2019. Т. 57. № 2. С. 93–98.
Мохов А.В., Карташев П.М., Богатиков О.А. Луна под микроскопом: новые данные по минералогии Луны: атлас. М.: Наука, 2007. 16 с.
Некрасов Б.В. Основы общей химии: М.: Химия, 1973. С. 594, 606.
Попель С.И., Копнин С.И., Голубь А.П., Дольников Г.Г., Захаров А.В., Зеленый Л.М., Извекова Ю.Н. Пылевая плазма у поверхности Луны // Астрон. вестн. 2013. Т. 47. № 6. С. 455–466.
Попель С.И., Голубь А.П., Лисин Е.А., Извекова Ю.Н., Атаманюк Б., Дольников Г.Г., Захаров А.В., Зеленый Л.М. Удары высокоскоростных метеороидов и отрыв пылевых частиц от поверхности Луны // Письма в ЖЭТФ. 2016. Т. 103. № 9. С. 641–646.
Уэллс А. Структурная неорганическая химия: В 3-х т. Т. 2. М.: Мир, 1987. 260 с.
Фрондел Дж. Минералогия Луны: М.: Мир, 1978. 56 с.
Abdel-Gawad M., Blander M., Grant R.W., Housley R.M., Muir A.H., Jr. Mössbauer spectroscopy of Apollo 11 samples // Apollo 11 Lunar Sci. Conf. Pergamon Press, Inc., 1970. P. 2251–2268.
Allen C.C., Greenhagen B.T., Donaldson Hanna K.L., Paige D.A. Analysis of lunar pyroclasic glass deposit FeO abundances by LRO Diviner // Ann. Meet. Lunar Exploration Analysis Group. 2011. P. 2022.
Benna M., Hurley D.M., Stubbs T.J., Mahaffy P.R., Elphic R.C. Lunar soil hydration constrained by exospheric water liberated by meteoroid impacts // Nature Geoscience. 2019. V. 12. P. 333–338.
Colwell J.E., Batiste S., Horányi M., Robertson S., Sture S. The lunar surface: Dust dynamics and regolith mechanics // Rev. Geophys. 2007. V. 45. P. RG2006, 26 p.
Dalton B.P., Roberto F.F. Lunar Regolith Biomining // Report NASA/CP—2008–214564, Moffett Field: NASA, 2008.
Hapke B. Space weathering from Mercury to the asteroid belt // J. Geophys. Res. 2001. V. 106. № E5. P. 10039–10073.
Heiken G.H., Vaniman D.T., French B.M. Lunar Sourcebook. A User’s Guide to the Moon. Cambridge, 1991. 363 p.
Jones B.M., Aleksandrov A., Hibbitts K., Dyar M.D., Orlando T.M. Solar wind-induced water cycle on the Moon // Geophys. Res. Lett. 2018. V. 45. P. 10,959–910,967.
Li S., Lucey P.G., Fraeman A.A., Poppe A.R., Sun V.Z., Hurley D.M., Schultz P.H. Widespread hematite at high latitudes of the Moon // Sci. Adv. 2020. V. 6. № 36. eaba1940.
Popel S.I., Golub’ A.P., Zelenyi L.M., Dubinskii A.Yu. Lunar dust and dusty plasmas: Recent developments, advances, and unsolved problems // Planet. and Space Sci. 2018. V. 156. P. 71–84.
Starukhina L. Water detection on atmosphereless celestial bodies: Alternative explanations of the observations // J. Geophys. Res. 2001. V. 106. № E7. P. 14701.
Tang X., Luo X.X., Jiang Y., Xu A.A., Wang Z.C., Zhang X.W., Cai W., Wu Y.Z. Estimation of lunar FeO abundance based on imaging by LRO Diviner // Res. Astron. and Astrophys. 2016. V. 16. № 2. P. 024.
Tang X., Wu Y.Z., Wang Z.C., Zhang X.W., Chen Y., Zhang X.M. A New global FeO map of the Moon by Diviner Image // 46th Lunar and Planet. Sci. Conf. 2015. P. 1651.
Xia W., Wang X., Zhao S., Jin H., Chen X., Yang M., Gao X. New maps of lunar surface chemistry // Icarus. 2019. V. 321. № 15. P. 200–215.
Yan B., Xiong S.Q., Wu Y., Wang Z., Dong L., Gan F., Yang S., Wang R. Mapping lunar global chemical composition from Chang’E-1 IIM data // Planet. and Space Sci. 2012. V. 67. № 1. P. 119–129.
Дополнительные материалы отсутствуют.
Инструменты
Астрономический вестник