Биоорганическая химия, 2019, T. 45, № 2, стр. 136-144
Масс-спектрометрическое определение аминокислотной последовательности коротких и средних пептидов в системе ESI-o-TOF вместо МС/МС. 2. Избирательная фрагментация дансилированных пептидов с преимущественным образованием b-ионов
И. В. Назимов 1, Р. А. Бубляев 2
1 Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М.М.Шемякина и Ю.А.Овчинникова РАН
117997 ГСП-7, Москва, В-437, ул. Миклухо-Маклая, 16/10, Россия
2 Федеральное государственное бюджетное учреждение науки Институт аналитического приборостроения РАН
198095 Санкт-Петербург, ул. Ивана Черных, 31-33, лит. А, Россия
Поступила в редакцию 07.05.2018
После доработки 05.09.2018
Принята к публикации 15.07.2018
Аннотация
Предложена схема анализа масс-спектров фрагментных пептидов, включающая химическую модификацию N-концевой аминогруппы пептида 5-(N,N-диметиламино)нафтален-1-сульфонилхлоридом с последующей ионизацией дансилированного пептида методом электрораспыления и его фрагментацией в зоне низкого вакуума узла ввода раствора образца в масс-спектрометр (cхема ESI-о-TOF). Показано, что получаемые ионы фрагментируются с преимущественным образованием b-ионов, содержащих Dns-группу. Указанным способом удается получить высокоинтенсивные b-ионы (соотношение интенсивности пик/фон: 10/1–100/1), в том числе особенно ценные для расшифровки структуры b1- и b2-ионы. В сочетании с предложенным ранее способом получения информативных y-ионов указанный подход позволяет достоверно определять полную аминокислотную последовательность пептидов, содержащих до 10 а.о., без использования компьютерных программ анализа фрагментного состава пептидов.
ВВЕДЕНИЕ
Для решения проблемы достоверности масс-спектрометрического определения аминокислотной последовательности в пептидах испробовано множество методов ионизации их молекул и фрагментации ионизированных молекулярных ионов. При этом основными недостатками используемых методов с точки зрения расшифровки масс-спектров являются неполнота перекрывания диапазона получаемых масс, низкая интенсивность пиков фрагментных ионов.
В масс-спектрах пептидов наиболее информативными являются ионы продуктов расщепления молекулы по скелетным амидным связям, содержащие заряд либо на N-концевом фрагменте исходного пептида (b-ионы), либо на С-концевом (y-ионы). Ввиду особенностей механизма распада молекулярного иона пептида в камере столкновений в фрагментных масс-спектрах более интенсивными бывают y-ионы, особенно в случае триптических пептидов [2]. Известные из литературы попытки повышения интенсивности b-ионов (особенно в области низких масс – ионов b1, b2, ключевых для идентификации ионов b-серии), не всегда оказываются эффективными [3].
Из-за высокого уровня фона наиболее трудна для идентификации область ионов с m/z < 300, что делает невозможным прямое масс-спектрометрическое определение структуры пептидов в классическим варианте метода MALDI. Это обстоятельство привело к усложнению аппаратуры и методологии анализа (разработка и широкое использование дорогостоящего многостадийного метода MS/MS, вплоть до MS/MSn) [4–6].
Недостатками МС/МС-способа являются следующие:
— сложность и, следовательно, высокая стоимость оборудования;
— низкая интенсивность образующихся b-ионов (особенно в области низкомолекулярных фрагментов), что затрудняет однозначную интерпретацию масс-спектра;
— циклизация коротких линейных пептидов, образующихся при фрагментации исходного пептида, за счет взаимодействия N-концевой аминогруппы пептида с карбонильными группами скелетных амидных связей [7–9]. Чаще всего химической причиной образования циклов является нуклеофильная атака свободной N-концевой аминогруппы пептида на С-концевой карбонил того же пептида [10].
Подобные процессы перегруппировок типичны для электрораспылительной масс-спектрометрии с квадрупольной ячейкой столкновений (тройной квадруполь) из-за большого времени столкновения с молекулами инертного газа в ячейке.
Для повышения информативности масс-спектров проводят химическую модификации N-концевой аминогруппы анализируемых пептидов [8, 10, 11].
Нами был предложен более простой в приборном и методическом исполнении способ масс-спектрометрического секвенирования пептидов и получения их аминокислотных последовательностей [12], заключающийся в том, что масс-спектрометрическая фрагментация молекулярного иона пептида происходит в области низкого вакуума между соплом и скиммером источника ионов под воздействием электрического поля в присутствии остаточного газа. Предлагаемый подход позволяет получать информативные y-ионы, по интенсивности в 5–100 раз превышающие уровень фона, что позволяет определять последовательность аминокислот пептида, содержащего до 10 а.о., без использования компьютерных программ или определять сиквенс более длинных пептидов, проводя компьютерный анализ фрагментации и сравнение полученной аминокислотной последовательности с существующими базами первичных структур белков и пептидов [12].
Особенностью этого способа фрагментации пептидов является то, что в фрагментных масс-спектрах преобладают высокоинтенсивные информативные y-ионы, а интенсивность b-ионов, хотя и возрастает, но в гораздо меньшей степени, чем для y-ионов.
Целью данной работы являлось создание способа получения высокоинтенсивных b-ионов всех образующихся дансилированных фрагментов пептида с последующей однозначной идентификацией аминокислотной последовательности пептида с использованием преимущественно Dns-b-ионов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Продукты реакции дансилирования N-концевой аминогруппы пептидов дансилхлоридом разделяют хроматографически, элюат подают в источник ионов масс-спектрометра в режиме on-line с последующей управляемой фрагментацией дансилированного пептида [11, 12].
При наличии в масс-спектрах пиков Dns-фрагментов, превышающих по интенсивности пики остальных ионов спектра, становится возможным определение полной аминокислотной последовательности пептида с использованием лишь пиков b-ионов и легко идентифицируемых продуктов их распада (отщепление молекул H2O, CO).
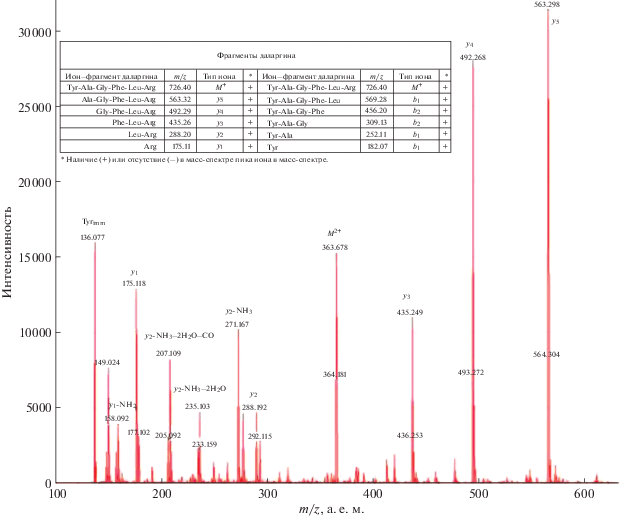
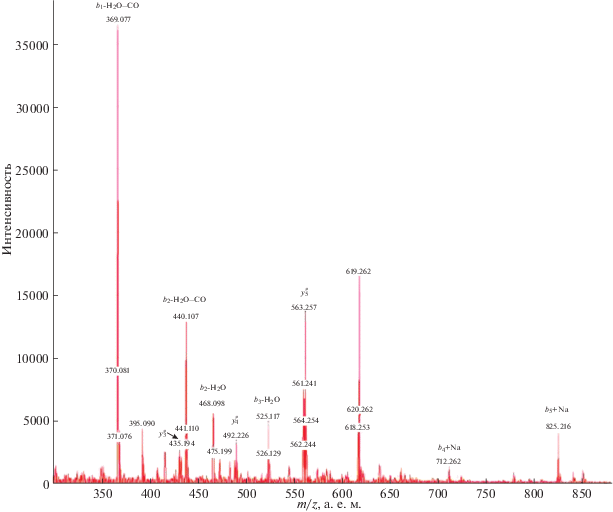
В данной работе представлены масс-спектры исходного недансилированного пептида Thr-Val-Leu (TVL, рис. 1) и его дансилированного производного Dns-TVL (рис. 2, 3), а также аналогичные масс-спектры даларгина (Tyr-Ala-Gly-Phe-Leu-Arg, Y-A-G-F-L-R (Dal) (рис. 4), и Dns-даларгина Dns-Dal (рис. 5–7). Во всех масс-спектрах для наглядности обозначены и Dns-содержащие b‑фрагменты, и ионы внутренней фрагментации пептидов.22
Рис. 6.
Масс-спектр Dns-Dal (m/z 300–880). Символами y# обозначены продукты внутренней фрагментации даларгина, не содержащие Dns-группу.
В масс-спектре немодифицированного пептида TVL присутствует ограниченное число пиков b- и y-ионов. С одной стороны, это упрощает вид масс-спектра, но с другой – лишает дополнительной информации, необходимой для определения структуры пептида.
При фрагментации немодифицированного пептида даларгина(II) интенсивность b-ионов ничтожно мала по сравнению с интенсивностью y-ионов (рис. 4). В то же время в масс-спектрах Dns-(I) (рис. 2, 3) и Dns-(II) (рис. 5–7) преобладают пики, соответствующие Dns-производным b‑ионов.
При этом нет необходимости учитывать низкомолекулярные ионы масс-спектра т.к. минимальный наименьший из всех возможных информативных Dns-ионов – иммониевый ион Dns-Gly (+Dns-NH=CH2) имеет m/z 263, что позволяет исключить из рассмотрения пики ионов с m/z < 263.
Как известно, изменение радиочастотного напряжения Urf на транспортирующем квадруполе времяпролетного масс-спектрометра позволяет изменять диапазон масс детектируемых ионов. При обычном рабочем напряжении Urf ≈ 1000 В, низкомолекулярные ионы не попадают на детектор и не видны в масс-спектре (см. рис. 1). Но при снижении Urf до 300–500 В, массовое окно спектрометра смещается в область более низких масс, и легкие ионы детектируются с хорошей интенсивностью. Однако при этом выпадают из рассмотрения тяжелые ионы. Поэтому для сравнения качества масс-спектров и возможности детектировать и родительские тяжелые ионы, и легкие ионы их фрагментов в данной работе приходилось перенастраивать Urf.
В масс-спектрах образцов, имеющих Dns-метку и снятых при разных значениях Urf (300 или 1000 В, рис. 2, 3), нет существенного различия ни в насыщенности масс-спектров пиками фрагментных ионов, ни в интенсивности самих пиков. Это позволяет проводить съемку масс-спектра при одном значении Urf, без дополнительной фрагментации. В стандартном МС/МС-методе чаще всего это делают для целенаправленного получения низкомолекулярных иммониевых ионов N-концевых аминокислот и коротких пептидов (a1-, a2-продуктов вторичной фрагментации первичных b-ионов).
В масс-спектре свободного даларгина присутствуют исключительно пики y-ионов, а пики b-ионов отсутствуют, (кроме пика Tyrimm, производного от b1, рис. 4). В спектре Dns-даларгина получены пики всех b-ионов (рис. 5, 6).
За счет большей энергии диссоциации сульфамидной связи (–SO2–NH-) дансильного радикала с α-аминогруппой пептида по сравнению с энергией диссоциации амидного скелета пептида (CO–NH ) в условиях фрагментации полипептидной цепи предотвращается гидролиз сульфамидной связи и сохраняются все Dns-содержащие фрагменты масс-спектра. При этом за счет большого сродства N,N-диметиламиногруппы Dns-радикала к протону обеспечивается высокая интенсивность сигнала каждого Dns-фрагмента (соотношение сигнал/шум = 10/1 и более).
Наряду c преимущественным образованием высокоинтенсивных пиков ионов Dns-b-фрагментов пептида, в масс-спектрах обнаруживаются немодифицированные фрагменты внутреннего расщепления Dns-пептида, т.е. не имеющие Dns-группы в своей структуре, но дающие дополнительную информацию о строении пептида (табл. 1, 2).
Таблица 1.
Характеристика продуктов фрагментации даларгина
| Непротонированные фрагменты даларгина и их массы (расчет) | m/z фрагментов даларгина (эксперимент) | Вид иона (эксперимент) | |
|---|---|---|---|
| Tyr-Ala-Gly-Phe-Leu-Arg | 725.39 | 366.68 | М2+ |
| Tyr-Ala-Gly-Phe-Leu | 569.28 | – | – |
| Tyr-Ala-Gly-Phe | 456.20 | – | – |
| Tyr-Ala-Gly | 309.13 | – | – |
| Tyr-Ala | 252.11 | – | – |
| Tyr | 181.07 | – | – |
| Ala-Gly-Phe-Leu-Arg | 562.32 | 563.26 | y5 |
| Gly-Phe-Leu-Arg | 491.29 | 492.23 | y4 |
| Phe-Leu-Arg | 434.26 | 435.19 | y3 |
| Leu-Arg | 287.20 | 288.21 271.17 235.10 207.11 |
y2 y2-NH3 y2-NH3-2H2O y2-NH3-2H2O-CO |
| Arg | 174.11 | 175.09 158.09 136.08 |
y1 y1-NH3 b1-H2O-CO |
Таблица 2.
Характеристика продуктов фрагментации дансилированного даларгина
| Дансилированные фрагменты Dns-даларгина | m/z фрагментов Dns-Dal (расчет) | m/z фрагментов Dns-Dal и вид иона (эксперимент ) |
|---|---|---|
| Dns-Tyr-Ala-Gly-Phe-Leu-Arg (Dns-Dal) | 959.45 | 959.86 M+ |
| Dns-Tyr-Ala-Gly-Phe-Leu | 803.34 | 825.22 b5 + Na |
| Dns-Tyr-Ala-Gly-Phe- | 690.26 | 712.26 b4 + Na |
| Dns-Tyr-Ala-Gly | 543.19 | 525.12 b3-H2O |
| Dns-Tyr-Ala | 486.17 | 468.10 b2-H2O 440.11 b2-H2O–CO |
| Dns-Tyr | 415.13 | 369.08 b1-H2O–CO |
Отдельно стоит отметить, что в масс-спектре Tyr-содержащего даларгина, наряду с М+-ионом моно-Dns-даларгина присутствует M+-ион ди-Dns-даларгина. При этом в фрагментных масс-спектрах видны ионы фрагментов только моно-Dns-даларгина и отсутствуют ионы ди-Dns-фрагментов (рис. 5–7).
Таким образом, показана принципиальная возможность получения высокоинтенсивных пиков b-ионов (в том числе и для обычно малоинтенсивных ионов b1 и b2) путем фрагментации дансилированных пептидов в узле ввода пробы, а не в отдельной столкновительной камере (q) масс-спектрометра, что позволяет обойтись без дорогостоящего МС/МС-принципа фрагментации.
Благодаря наличию в масс-спектрах ограниченного числа высокоинтенсивных Dns-b-ионов сильно упрощается вид масс-спектра и появляется возможность проводить расшифровку масс-спектров вручную, без использования дорогостоящего масс-спектрометрического программного обеспечения (по крайней мере, для пептидов, содержащих до 10 а.o., обычно составляющих основную часть ферментативных гидролизатов целевых белков и объектов пептидомного анализа).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для растворения образцов и хроматографического анализа использовали ацетонитрил (сорт 0 или 1, Криохром, Санкт-Петербург), муравьиную кислоту (Merck, ФРГ). Тридистиллят воды, используемой для приготовления растворов, и ацетонитрил, пропускали через фильтры 0.45 мкм (фирма “Millipore”, CША). Хроматографию пептидов проводили на микроколоночном хроматографе “Милихром А-02” (Институт хроматографии “Эконова”, Новосибирск). Для анализа использовали пептидные стандарты (Thr-Val-Leu, фирма “Serva”, ФРГ), (даларгин, Calbiochem, США). Дансилирование пептидов проводили, как указано ранее [13]. Образцы растворов Dns-пептидов хроматографировали на колонке с обращенной фазой (ProntosilС18, 120 мкм, 2.0 × × 75–150 мм, Институт хроматографии “Эконова”, г. Новосибирск) в 0.2% муравьиной кислоте c градиентом концентрации ацетонитрила. Элюат, содержащий компоненты смеси, через металлический капилляр диаметром 100 мкм подавался в источник ионов электроспрей со скоростью 2–50 мкл/мин без нагрева узла ввода. В качестве столкновительного газа использовался азот воздуха.
Масс-спектры снимали на масс-спектрометре МХ 5310 (ИАП РАН, Санкт-Петербург): анализатор – времяпролетный рефлектрон с двуxступенчатым зеркалом, рабочий диапазон масс – до 10 000 Да. Масс-спектры всех пептидов снимали при фиксированном напряжении на капилляре (3100–3400 В) и изменяемом напряжении на сопле с шагом 20–30 В в диапазоне 50–300 В и на скиммере в диапазоне 40–80 В.
Список литературы
Назимов И.В., Бубляев Р.А. // Биоорган. химия. 2018. Т. 44. № 5. C 481–491. [Bublyaev R. A. // Russian Journal of Bioorganic Chemistry. 2018. V. 44. P. 481–491.]
Лебедев А.Т., Артеменко К.А., Самгина Т.Ю. // Основы масс-спектрометрии белков и пептидов. Москва. Техносфера, 2012. C. 49.
Summerfield S.G., Bolgar M.S., Gaskell S.J. // Int. J. Mass Spectrom. 1997. V. 32. P. 225–231.
Baldwin M.A. Methods in Enzymology. California, San Diego, Academic Press Inc., 2005. V. 402. P. 33–48.
Bieman K. Methods in Enzymology. California, San Diego, Academic Press Inc., 1990. V. 193. P. 455–479.
Веренчиков А.Н. // Научное приборостроение. 2004. Т. 14. № 2. С. 4–23.
Harrison A.G.. // J. Am. Soc. Mass Spectrom. 2008. V. 19. P. 1776–1780.
Лебедев А.Т., Артеменко К.А., Самгина Т.Ю. // Основы масс-спектрометрии белков и пептидов. Москва. Техносфера, 2012. С. 110.
Yague J., Paradela A., Ramos M., Ogueta S., Marina A., Barahona F., de Castro J.A.L., J. Vasquez J. // Anal. Chem. 2003. V.75. P. 1524–1535.
Harrison A.G. // J. Am. Soc. Mass Spectrom. 2009. V. 20. P. 2248–2253.
Samyn B., Debyser G., Sergeant K., Devreese B., Van Beeumen J. // J. Am. Soc. Mass. Spectrom. 2004. V. 15. P. 1838–1852.
Назимов И.В., Краснов Н.В., Мурадымов М.З., Бубляев Р.А., Гаврик М.А., Присяч С.С. Пат. РФ RU 2498443 C2 от 31.08.2011.
Levina N.B., I.V. Nazimov I.V. // J. Chromatogr. A. 1984. V. 286. P. 207–216.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия