Биоорганическая химия, 2019, T. 45, № 2, стр. 193-201
Инициированное окисление фосфатидилхолиновых липосом с включенными в них функциональными нутрицевтиками
Н. Н. Сажина , А. С. Антипова , М. Г. Семенова , Н. П. Пальмина
Институт биохимической физики имени Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина 4, Россия
Поступила в редакцию 03.05.2018
После доработки 13.06.2018
Принята к публикации 28.05.2018
Аннотация
Исследовано влияние температуры на кинетику инициированного 2.2'-азобис (амидинопропан) дигидрохлоридом (ААРН) окисления липосом из соевого фосфатидилхолина (PС), а также липосом после добавления в них незаменимой ω-3-альфа-линоленовой кислоты (АLA). Оба варианта липосом окисляются и разрушаются под действием света и высоких температур. Изучено ингибирование окисления “чистых” и смешанных с АLA липосом одним из наиболее активных растительных антиоксидантов – эфирным маслом гвоздики (ЭМГ). Продемонстрированы возможности ингибирования окисления липосом за счет инкапсулирования их казеинатом натрия. Показано, что окисление липосом при 37°С можно эффективно (на 80–90%) ингибировать фенольными соединениями ЭМГ. При повышении температуры до 60°С скорость окисления липосом увеличивается в 3–4 раза, и эффективность ингибирования окисления ЭМГ существенно уменьшается. Добавление в липосомы АLA приводит к заметному ускорению окисления. Инкапсулирование липосом казеинатом натрия снижает уровень их окисления на 70%, а совместное действие казеината натрия с ЭМГ – на 90%. С повышением температуры эффективность защитной функции капсулы на основе казеината натрия значительно снижается даже в присутствии ЭМГ.
ВВЕДЕНИЕ
В настоящее время большой интерес вызывают работы по созданию и исследованию липосомных структур на основе соевого фосфатидилхолина (PC) как наноконтейнеров для доставки в ткани и клетки живых организмов различных функциональных нутрицевтиков (веществ, обладающих как питательной, так и фармацевтической ценностью): незаменимых полиненасыщенных ω-3- и ω-6-жирных кислот (ПНЖК), антиоксидантов, витаминов, органических кислот и др. соединений [1–3]. Липосомы из PC служат также моделями для изучения биохимических процессов в мембранах живых клеток человека и животных, в частности перекисного окисления липидов (ПОЛ), и модификации этого окисления различными субстанциями [4–7].
Благодаря наличию в соевом фосфатидилхолине полиненасыщенных жирных кислот (ПНЖК), липосомы легко окисляются кислородом воздуха и разрушаются под воздействием света и высоких температур, поэтому требуют защиты от окисления и деградации при их длительном хранении и в разных экстремальных условиях, например при производстве и переработке пищевых продуктов [2, 3].
Для предотвращения окисления, прежде всего, используют различные антиоксиданты, вводимые в липосомы [8–11], среди которых перспективными являются жирорастворимые фенольные соединения, входящие в состав эфирных масел пряно-ароматических растений [10]. К таким соединениям относятся природные растительные моно- и полифенолы: эвгенол, тимол, карвакрол, фенольные кислоты, флавоноиды, каротиноиды, кумарины, антоцианидины, танины, алкалоиды и др. При исследовании ингибирования автоокисления метиловых эфиров ПНЖК, выделенных из льняного масла, эфирными маслами 16 различных пряно-ароматических растений, было установлено [10], что наибольшую эффективность имеет эфирное масло гвоздики (ЭМГ). Помимо антиоксидантов, для защиты PC-липосом от окисления часто применяют инкапсулирование их различными биополимерами, что не только предохраняет липосомы от окисления, но и повышает их функциональность и растворимость в водной среде, что весьма важно для увеличения биодоступности содержащихся в них нутрицевтиков [12–14].
Цель настоящей работы – изучение кинетики инициированного 2.2'-азобис(амидинопропан) дигидрохлоридом (AAPH) окисления липосом из соевого PC “чистых” и c добавлением в них альфа-линоленовой кислоты (ALA) при разных температурах, а также ингибирования окисления этих липосом добавлением в них ЭМГ и инкапсулированием их казеинатом натрия.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
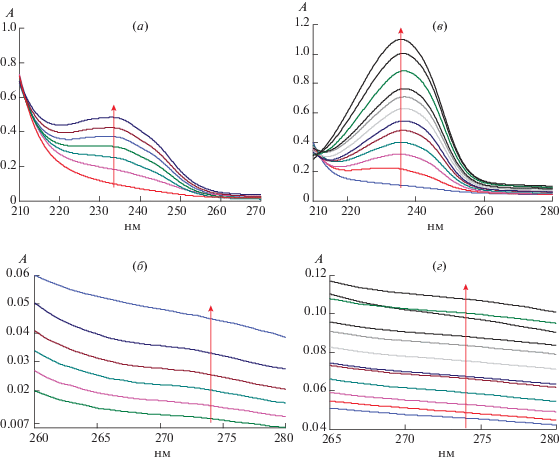
Первый этап наших исследований состоял в изучении процессов окисления липосом из соевого PC в зависимости от температуры. На рис. 1 для двух значений температур (37 и 60°С) приведены примеры спектров поглощения липосом PC в различные моменты времени в процессе их инициированного окисления. При обеих температурах в спектрах появляются максимумы поглощения при λ 233 нм, характерные для продуктов окисления – диеновых конъюгатов (ДК) (а, в), в то время, как четко выраженных максимумов при λ 274 нм, характерных для кетодиенов (КД), не наблюдается (б, г). За время наблюдения накопление КД составило менее 10% от образования ДК. Поэтому дальнейшее изучение окисления проводилось только по изменению концентрации ДК.
Рис. 1.
Спектры поглощения PC-липосом (1мг/мл) в процессе их инициированного окисления при 37 (а, б) и 60°С (в, г) для диапазонов длин волн от 210 до 270 нм (а, в) и от 260 до 280 нм (б, г). Стрелками на рисунках обозначен временной интервал окисления (от начального момента времени t0 = 0 до tкон = 400–500 мин). Ошибка измерения оптического поглощения А не превышала 3%.
На рис. 2 представлена динамика изменения поглощения ДК для “чистых” (контрольных) липосом PC в процессе их авто- (кривые 1 и 2) и инициированного ААРН (кривые 3 и 4) окисления при температурах 37°С (кривые 1 и 3) и 60°С (кривые 2 и 4). Видно, что при 37°С поглощение при λ = 233 нм PC-липосом в процессе их авто-окисления развивается очень медленно (период индукции составляет 5 ч), и вплоть до 10 ч можно отметить лишь незначительное увеличение содержания ДК (кривая 1). Увеличение температуры ускоряет этот процесс, сокращая период индукции на кривой накопления ДК до 30 мин (кривая 3). Учитывая величину молярного коэффициента поглощения ДК при λ 233 нм, равную 274 000 М–1 см–1 [9], можно оценить среднюю скорость формирования ДК при автоокислении. При 37°С в течение 300 мин (от 300 до 600 мин) она составляет 0.84 × 10–7 М мин–1. С увеличением температуры до 60°С скорость авто-окисления возрастает почти на порядок (8.14 × × 10–7 М мин–1 на участке кривой 2 от 40 до 200 мин).
Рис. 2.
Накопление ДК в процессе авто- (1, 2) и инициированного окисления (3, 4) PC-липосом (1 мг/мл) при 37 (1, 3) и 60°С (2, 4). А0 – оптическое поглощение при t = 0. Погрешность определения А – А0 по трем повторным измерениям не превышала 10%.
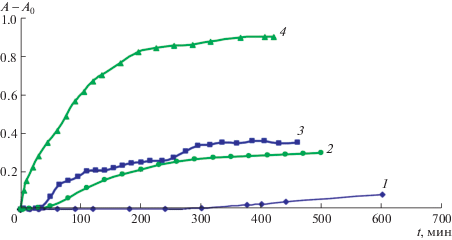
При инициированном окислении при 37°С (кривая 3) наблюдается немонотонный ход кривой накопления ДК, а именно, чередование ускорения и замедления окисления. По-видимому, это связано с наличием в соевом PC марки Lipoid S100 (фирмы “Lipoid GmbH”, Германия) трех основных ненасыщенных жирных кислот (ЖК): олеиновой, линолевой и линоленовой (в процентном соотношении к сумме ЖК, равном 13 : 60 : 7). Вероятно, они поочередно включаются в окислительный процесс в соответствии с соотношением их концентраций и констант скорости окисления (1 : 10 : 15) [15]. При повышенной температуре (кривая 4) этот эффект практически не проявляется. Исчезает и небольшой (30 мин) период индукции, который имеет место при 37°С и обусловлен не только кинетикой развития процесса накопления ДК [16, 17], но и небольшим количеством α-токоферола (0.15−0.25) г/100 г, исходно присутствующем в используемом препарате PC Lipoid S100. Процесс накопления продуктов окисления может замедлять и наличие в PC Lipoid S100 насыщенных ЖК (примерно 20%) [18, 19].
В дисперсном растворе липосом при постоянной скорости генерации радикалов инициатора ААРН, вследствие его термического распада, возникает радикально-цепное окисление ЖК (в уравнениях LH) в PC-липосомах. Оно протекает по следующему упрощенному механизму [5, 9, 11]:
(1)
${\text{R--N = N--R}} \to {\text{2e}}{{{\text{R}}}^{{ \bullet }}} + {{{\text{N}}}_{{\text{2}}}},$(2)
${{{\text{R}}}^{{ \bullet }}}\,{\text{ + }}\,{{{\text{O}}}_{{\text{2}}}} \to {\text{RO}}{{{\text{O}}}^{{ \bullet }}},$(3)
${\text{RO}}{{{\text{O}}}^{{ \bullet }}} + {\text{LH}} \to {\text{ROOH}} + {{{\text{L}}}^{{ \bullet }}},$(4)
${{{\text{L}}}^{{ \bullet }}} + {{{\text{O}}}_{{\text{2}}}} \to {\text{LO}}{{{\text{O}}}^{{ \bullet }}},$(5)
${\text{LO}}{{{\text{O}}}^{{ \bullet }}} + {\text{LH}} \to {\text{LOOH}} + {{{\text{L}}}^{{ \bullet }}},$(6)
${\text{LO}}{{{\text{O}}}^{{ \bullet }}} + {\text{LO}}{{{\text{O}}}^{{ \bullet }}} \to {\text{н е р а д и к а л ь н ы е п р о д у к т ы ,}}$(7)
${\text{LO}}{{{\text{O}}}^{{ \bullet }}} + {\text{InH}} \to {\text{LOOH}} + {\text{I}}{{{\text{n}}}^{{ \bullet }}}.$Реакции (1)–(3) описывают: термическую диссоциацию ААРН (1), быстрое (k2 ≈ 109 × M–1 c–1) образование пероксидных радикалов инициатора ROO• (2) и алкильного радикала L• (3) (k3 ≈ 6 × × 101 M–1 c–1), (4), (5) – реакции продолжение цепей окисления (k4 = 109 × M–1 c–1, k5 = 6 × 101 M–1 c–1), (6), (7) – их обрыв за счет рекомбинации (6) и действия ингибитора (InH) (7). В PC марки Lipoid S100 основную долю составляет линолевая кислота, поэтому константы приведены для линолеата [17].
Для ААРН скорость инициирования радикалов в уравнении (1) Wi = ki [AAPH], где ki = 1.3 × × 1013е–112600/RT – константа скорости этой реакции [20]. При 37°С ki37 = 1.36 × 10–6 с–1, при 60°С ki60 = 27.6 × 10–6 с–1, т.е. примерно в 20 раз больше. Согласно законам жидкофазного окисления углеводородов и липидов молекулярным кислородом, протекающего по схеме (1)–(7) с квадратичным обрывом цепей, для скорости поглощения О2 справедливо: ${{W}_{{{{{\text{О }}}_{{\text{2}}}}}}}$ = kр/(2kt)0.5 [LH] $W_{{\text{i}}}^{{0.5}}$, где kр и kt – эффективные константы скорости продолжения и обрыва цепей окисления (4)–(7) [21, 22].
При сравнении кривых 3 и 4 на рис. 2 видно, что при повышении температуры накопление ДК до постоянного уровня увеличилось примерно в 3 раза. Средняя скорость окисления PC-липосом увеличилась в течение первых 20–30 мин от начала окисления (накопления ДК) в 4.5–5.0 раза (от 0.33 × 10–5 до 1.61 × 10–5 М/мин). Главным образом, это происходит за счет значительного увеличения скорости (Wi) термической диссоциации ААРН и наработки инициирующих окисление радикалов. Допуская, что скорость накопления ДК соответствует скорости поглощения кислорода ${{W}_{{{{{\text{О }}}_{{\text{2}}}}}}}$, можно оценить влияние температуры на скорость окисления ЖК (LH) в PC-липосомах и сравнить с измеренными значениями. При одинаковом значении [AAPH], отношение скоростей инициирования при изученных температурах Wi60/Wi37 = ki60/ki37 = 20. Используя выражение для WО2 и учитывая равенство [LH], kр и kt, можно получить ${{W}_{{{{{\text{О }}}_{{\text{2}}}}}}}$(60°С)/${{W}_{{{{{\text{О }}}_{{\text{2}}}}}}}$(37°С) = (Wi60/Wi37)0.5 = = (20)0.5 ≈ 4.5, что примерно соответствует соотношению скоростей накопления ДК.
Как указывалось выше, липосомы из PC могут быть использованы в качестве носителя для доставки в организм незаменимых ω-3- и ω-6-ПНЖК. В связи с этим необходимо выяснить, каково влияние ПНЖК на кинетику окисления этих липосом. С этой целью мы использовали в своих экспериментах PC-липосомы с встроенной в них ω-3 α-линоленовой кислотой (АLA) (рис. 3).
Рис. 3.
Инициированное окисление “чистых” PC-липосом (2, 5), [PC] = 1 мг/мл при 37 (2) и 60°С (5), а также PC-липосом с ALA (1, 3, 4), PC : -ALA = 1 : 0.59, при 37 (1, 3) и 60°С (4). [PC + ALA] = 1 мг/мл (кривые 1, 4) и 1.59 мг/мл (3). Погрешность определения А – А0 по трем повторным измерениям не превышала 10%.
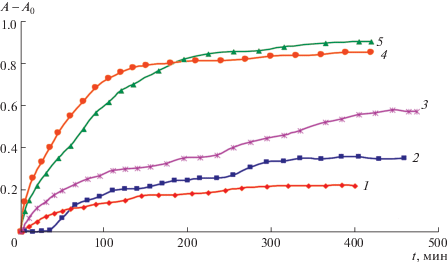
В первую очередь видно (ср. кривые 1, 3 с кривой 2), что ALA ускоряет окисление липосом на начальной стадии процесса (до 60 мин), исключая при этом период индукции даже для случая более низкой концентрации PC по сравнению с “чистыми” липосомами (кривая 2). При равном количестве PC в контроле (кривая 2) и липосомах с АLA (кривая 3) скорость окисления в присутствии ALA существенно увеличивается, и прирост ДК в 1.5 раза превышает этот показатель по сравнению с контролем. При 60°С введение АLA в липосомы значительно (примерно в 1.5−2 раза) ускоряет окисление липосом (кривая 4) по сравнению с контролем (кривая 5) примерно до периода 200 мин, однако затем кривые накопления ДК практически совпадают, что можно объяснить, по-видимому, полным расходованием АLA, введенной в PC-липосомы.
Липосомы из PC – удобная биологическая модель для изучения антиокислительной (АО) активности природных соединений, особенно если они имеют жирорастворимую природу. Как уже упоминалось, к таким соединениям относятся фенольные соединения эфирных масел, наиболее активным из которых является эфирное масло гвоздики (ЭМГ) [10]. ЭМГ проявляет антирадикальную (АР) активность в модельной системе с дифенилпикрилгидразином (DPPH), в реакции с гидроксильными радикалами действует как хелатор железа, ингибирует окисление линолевой кислоты [23]. Поэтому целесообразно было проверить его АО-действие в инициированном окислении PC-липосом.
На рис. 4 приведена динамика ПОЛ при 37°С для липосом из PC (кривая 1) и ингибирование окисления за счет встраивания в липосомы ЭМГ разной концентрации. Видно, что контрольная кривая 1 имеет период индукции примерно 30 мин, а ЭМГ заметно тормозит окисление липосом, при этом демонстрируя линейно зависящий от его концентрации период индукции.
Рис. 4.
Окисление PC-липосом (кривая 1 – фрагмент кривой 3 на рис. 2) и ингибирование окисления ЭМГ с концентрацией в липосомах: 4.0 (2), 2.0 (3) и 1.5% (4). (37°С, [PC] = 1 мг/мл). Погрешность определения А – А0 по трем повторным измерениям не превышала 10%.

В состав ЭМГ входят по массе: эвгенол (от 70 до 85%), ацетат эвгенола (13%), кариофиллен (10%), эвгенил ацетат (5%), α-бергамотен (3%), цинеон (3%), линалоол, терпены и др. соединения, содержание которых менее 1% [10]. Эвгенол (4-аллил-2-метоксифенол, молярная масса = = 164.2 г/моль) – очень активный монофенольный антиоксидант. Он и определяет, главным образом, ингибирование окисления ПНЖК в PC-липосомах.
Кроме указанных выше публикаций [10, 23] в ряде работ [24–26] были также изучены АО- и АР-свойства ЭМГ и эвгенола. С помощью газовой хроматографии по реакции автоокисления транс-2-гексеналя была проведена оценка АО-свойств эвгенола в составе ЭМГ и показано, что даже при низких концентрациях ЭМГ (1%) эвгенол обладает высокой АО активностью, а сохранение эвгенола в ЭМГ с этой концентрацией при комнатной температуре составило порядка 100 сут [24].
В работе [25] методом люминолзависимой хемилюминесценции исследовалось ингибирующее действие чистого эвгенола на образование активных форм кислорода (АФК) в ходе стимулированного респираторного взрыва нейтрофилов человека при 37°С. Снижение образования АФК линейно зависело от концентрации эвгенола и составило 86% при его концентрации 22 мкг/мл, что говорит о высокой АР-активности эвгенола. Это подтверждают и исследования [26], в которых измеряли АР-активность ЭМГ в реакции восстановления DPPH-радикала и АО-активность при ингибировании обесцвечивания β-каротина в системе авто-окисления метиллинолеата, где эффективность ингибирования составила более 80%.
Как уже упоминалось [10], в ЭМГ вместе с эвгенолом присутствуют другие активные антиоксиданты: ненасыщенные алифатические и циклические соединения, многие из которых являются конкурентами за радикалы с ПНЖК, при этом механизм их реакции с радикалами отличается от механизма реакции фенолов. Поэтому эффективность ЭМГ всегда выше, чем у индивидуальных антиоксидантов; из-за взаимного влияния компонентов эфирных масел друг на друга АО-действие эфирных масел является пролонгированным и может длиться продолжительное время. В связи с этим можно отметить, что в нашем эксперименте при окислении липосом с ЭМГ (4% по весу) при 37°С в течение 180 мин происходит полное торможение окисления PC, а в момент максимального накопления ДК его концентрация в присутствии ЭМГ ниже примерно в 8 раз (на 87.5%) (рис. 5а, кривые 1 и 4). Эти свойства ЭМГ (синергетический эффект его компонентов и пролонгированное торможение окисления) весьма важны при хранении пищевых продуктов.
Рис. 5.
Окисление при 37 (а) и 60°С (б) “чистых” (контрольных) PC-липосом (кривые 1), PC-липосом в присутствии ALA (2), в присутствии 4% ЭМГ (4) и в присутствии одновременно ALA и ЭМГ (3). Концентрация всех смесей 1 мг/мл, содержание ALA в смеси составляет 37% или 0.37 мг/мл. Погрешность определения А – А0 по трем повторным измерениям не превышала 10%.
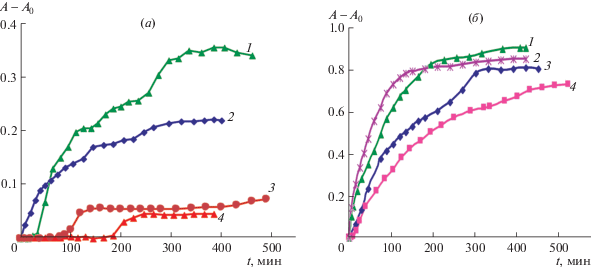
Повышение температуры до 60°C (рис. 5б) уменьшает время полного торможения окисления PC за счет ЭМГ от 180 мин до 10 мин (кривые 4 на рис. 5а, б). Степень снижения концентрации ДК по сравнению с “чистыми” липосомами (рис. 5б, кривые 1 и 4) на протяжении всего времени окисления составила в среднем 1.5 раза (на 37.5%). Несмотря на жесткие условия окисления, АО-свойства ЭМГ сохраняются.
Эффективность ингибирования ЭМГ окисления смеси PC + ALA (рис. 5а, кривые 2, 3) несколько изменяется: при 37°С ЭМГ только в 4 раза (на 73%) снижает накопление ДК и в 2 раза уменьшает период индукции, вероятно, за счет очень активного окисления ALA. При повышении температуры (рис. 5б) период индукции практически исчезает, а концентрация ДК в течение ингибирования ЭМГ уменьшается неравномерно (от 30 до 5%) (кривые 2, 3). Возможно, что понижение ингибирующей способности ЭМГ при такой температуре связано с разложением некоторых его компонентов, включая эвгенол, и потерей им АО- и АР-активности.
Как уже упоминалось во введении, одним из способов предохранения липосом из PC от окисления является инкапсулирование их в различные гидрофильные биополимеры, выполняющие тем самым роль наноконтейнеров, которые способствуют повышению растворимости PC-липосом в водной среде, а также сохраняют их функциональность [27, 28]. В нашей работе был использован природный биополимер казеинат натрия (Cas-Na) [27–29]. Он является мицеллоподобной натриевой формой основного белка молока, объединяющего такие индивидуальные белки, как (αS1-, αS2-, β- и κ-казеины), поэтому преимущества его использования в качестве наноконтейнера для липосом из соевого PC, заключаются не только в защите последних от окисления, но и в повышении питательной ценности таких биологических наноконтейнеров [27–29]. Для исследования влияния Cas-Na на окисление PC-липосом, была изучена динамика ингибирования им окисления при 37 и 60°С индивидуально и в присутствии ЭМГ (рис. 6).
Рис. 6.
Ингибирующее действие инкапсулирования PC-липосом казеинатом натрия (Cas-Na) (кривые 2 на обоих рисунках) и совместное действие с ЭМГ (кривые 4) при 37°С (а) и 60°С (б). Контрольные PC-липосомы (кривые 1) и PC + ЭМГ (кривые 3). [PC + ЭМГ] = 1 мг/мл, Cas-Na : PC : ЭМГ = 10 : 1 : 0.04. Погрешность определения А – А0 по трем повторным измерениям не превышала 10%.

При 37°С Cas-Na снижает максимальный уровень ДК примерно в 3.5 раза (на 70%) (рис. 6а, кривые 1, 2), а вместе с ЭМГ – в 10 раз (на 90%) (кривая 4). При этом Cas-Na практически не меняет периоды индукции окисления PC-липосом (рис. 6а, кривые 1, 2) и PC + ЭМГ (ср. кривые 3, 4). На основании данных о структурных параметрах комплексных частиц, измеренных методом лазерного многоуглового светорассеяния, а именно: молярной массы, размеров, формы и плотности частиц [13, 29], можно сделать вывод, что комплексы Cas-Na с изученными липосомами из PC представляют собой супрамолекулярные частицы с плотной структурой.
Формирование такого комплекса, вероятно, препятствует диффузии кислорода к ненасыщенным углеродным связям ПНЖК в липосомах, и тем самым способствует их защите от окисления. С увеличением температуры ингибирующее действие Cas-Na значительно уменьшается, а периоды индукции практически исчезают (рис. 6б, кривые 2, 4). Включение PC-липосом в Cas-Na приводит к снижению максимального уровня ДК лишь в 1.3 раза (на 20%), а совместное использование Cas-Na с ЭМГ увеличивает этот эффект до 1.7 раза (на 40%). Снижение ингибирующего действия Cas-Na при нагревании связано, возможно, со структурными изменениями комплексов и значительной потерей ими защитных функций по отношению к окислению PC.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления липосом использовали суспензию соевого PC марки Lipoid S100 (фирмы Lipoid GmbH, Германия) в фосфатном буфере (рН 7.2, ионная сила 1 мM, о причинах выбора низкой ионной силы буфера будет сказано далее). Состав соевого PC марки Lipoid S100 по данным фирмы Lipoid следующий: фосфолипиды, г/100 г: PC = 94 г, N-ацилфосфатидилэтаноламин 0.5, фосфатидилэтаноламин 0.1, фосфатидилинозитол 0.1, лизофосфатидилхолин 3; неполярные липиды, г/100 г: триглицериды 2.0 свободные жирные кислоты 0.5, α-токоферол 0.15. Содержание ЖК в в процентах к общему их количеству составило: пальмитиновая 12–17; стеариновая 2–5; олеиновая 11–15; линолевая 59–70; линоленовая 3–7. Суспензию готовили из известной навески PC с объемом буфера, необходимым для получения его концентрации 1 мг/мл. Смесь перемешивали 20 мин в шейкере, добавляя, при необходимости, разные объемы ЭМГ (Eugenia carophyllata Thumb., Plant Lipids Ltd., Индия) (1.5, 2.0 и 4.0% веса по отношению к весу PC), растворенного в 100 мкл этанола (соотношение буфер–этанол составило 50 : 1). Альфа-линоленовую кислоту (Sigma Chemicals) в том же объеме этанола добавляли в суспензию в пропорции PC : ALA = 1 : 0.59, чтобы достичь в липосомах соотношения ПНЖК ω-3 и ω-6, равного 1 : 1, учитывая жирнокислотный состав PC Lipoid S100.
Для липосом PC + ALA были приготовлены суспензии с общей концентрацией 1 и 1.59 мг/мл. Далее проводили механическую гомогенизацию суспензий при помощи гомогенизатора (Heidolph, Германия). Липосомы формировали c использованием ультразвукового гомогенизатора VCX-130 (Sonics & Materials, США), работающего в режиме (15 с : 15 с) при мощности 50% от максимальной в течение 15 мин. Для предохранения липосом от нагревания и окисления во время озвучивания, сосуд с суспензией помещали в смесь воды со льдом. Затем липосомы пропускали через мембранный фильтр с диаметром пор 100 нм, используя экструдер (AVANTI PolarLipid, США).
Cas-Na (Sigma, Новая Зеландия) для инкапсулирования в него липосом растворяли в том же фосфатном буфере (рН 7.2, ионная сила 1 мM), перемешивая смесь с помощью магнитной мешалки, затем раствор центрифугировали (30 мин, 4000 об./мин) от примесей. Низкая ионная сила буфера была выбрана для того, чтобы при инкапсулировании PC-липосом в Cas-Na были бы задействованы электростатические взаимодействия между противоположно заряженными функциональными группами белка и липидов. В работе [30] методом калориметрии смешения был установлен преобладающий вклад электростатического взаимодействия между Cas-Na и PC-липосомами в формировании комплексных частиц в нейтральной области рН. Концентрацию белка в растворе определяли методом дифференциальной рефрактометрии по известному значению инкремента показателя преломления белка. Готовые растворы белка хранили при 7°С. Инкапсулирование липосом в Cas-Na осуществляли согласно методике, изложенной в работах [13, 14], со следующим весовым соотношением компонентов: Cas-Na : -РС= 10 : 1, а для липосом с ЭМГ : Cas-Na- : РС-ЭМГ = 10 : 1 : 0.04 при концентрации РС в липосомах 1 мг/мл. Растворы Cas-Na и РС-липосом с ЭМГ в фосфатном буфере смешивали в шейкере (GFL 3032, Германия) в течение 1 ч при 40°С.
Для инициирования окисления липосом использовался водорастворимый азо-инициатор-2.2'-азобис (амидинопропан) дигидрохлорид (ААРН, Fluka, Германия) с конечной концентрацией в растворе липосом 2 мМ. Окисление липосом (авто- и инициированное) проводили в пробирках, термостатированных при физиологической (37°С) или повышенной (60°С) температурах. Степень развития ПОЛ контролировали спектрофотометрически при регистрации во времени УФ-спектров поглощения (от 200 до 300 нм) на спектрофотометре (Perkin Elmer, Lambda-25, Германия). Продукты ПОЛ – диеновые конъюгаты (ДК) и кетодиены (КД) определяли по максимумам поглощения при λ 233 и 274 нм, соответственно. Статистическую обработку результатов экспериментов осуществляли с использованием компьютерных программ Microsoft® Office Excel 2003. Измерения повторяли не менее 3 раз. Погрешность определения оптического поглощения (А) окисляемых образцов по трем повторным измерениям не превышала 10%.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе показано, что инициированное ААРН окисление липосом из соевого РС при физиологической температуре (37°С) можно достаточно эффективно (на 80–90%) ингибировать фенольными соединениями ЭМГ. При повышении температуры до 60°С значительно (в 3–4 раза) увеличивается скорость окисления, и ингибирование образования продуктов окисления липосом существенно уменьшается. Добавление в PC-липосомы ω-3-ALA приводит к заметному ускорению окисления по сравнению с “чистыми” РС-липосомами, и этот эффект усиливается с ростом температуры. Инкапсулирование липосом в Cas-Na снижает их окисление на 70%, а совместное действие Cas-Na и ЭМГ – на 90%. С повышением температуры эффективность защитной функции “казеинового” инкапсулирования существенно уменьшается даже в присутствии ЭМГ.
Полученные результаты могут быть использованы при разработке как современных систем доставки различных нутрицевтиков на основе РС-липосом, так и технологий их хранения и переработки.
Список литературы
Донелли Д., Ренсли Д., Рид Н. // Пища и пищевые добавки. Роль БАД в профилактике заболеваний. М.: Мир, 2004. С. 312.
Semenova M.Г., Dickinson E. // Biopolymers in Food Colloids: Thermodynamics and Molecular Interactions. Leiden: Brill, 2010. P. 421.
McClements D.J. // Nanoparticle – and Microparticle–based Delivery Systems: Encapsulation, Protection and Release of Active Compounds. New York: CRC Press Taylor and Francis Group, 2015. P. 548.
Thomas A.H., Catala A., Vignoni M. // Biochim. Biophys. Acta. 2016. V. 1858. P. 139–145.
Mosca M., Cerlie A., Ambrosone L. // Chem. Phys. Lipids. 2011. V. 164. P. 158–165.
Palmina N.P., Maltseva E.L., Chasovskaya T.E., Kasparov V.V., Bogdanova N.G., Menshov V.A., Trofimov A.V. // Aust. J. Chem. 2014. V. 67. P. 858–866.
Часовская Т.Е., Плащина И.Г., Пальмина Н.П. // Докл. Акад. Наук. 2013. Т. 449. С. 673–677.
Altunkaya A., Gokmen V., Skibsted L.H. // Food Chem. 2016. V. 190. P. 25–32.
Lokhmatikov A.V., Voskoboynikova N., Cherepanov D.A., Skulachev M.V., Steihoff H.J., Skulachev V.P, Armen Y. Mulkidjanian A.Y. // Hindawi Publ. Corp. Oxid. Med. Cell. Longevity. 2016. V. 1. Article ID 8679469. P. 1–19.
Мишарина T.A., Алинкина Е.С., Воробьева А.К., Теренина М.Б., Крикунова Н.И. // Прикл. биохим. и микробиол. 2016. Т. 52. С. 1–76.
Tesoriere L., Allegra M., Gentile C., Livrea M.A. // Free Rad. Res. 2009. V. 43. P. 706–717.
Tan C., Zhang Y., Abbas S., Feng B., Zhang X., Xia S., Chang D. // Food &Function. 2015. V.6. P. 3702–3711.
Semenova M.G., Zelikina D.V., Antipova A.S., Martirosova E.I., Grigorovich N.V., Obushaeva R.A., Shumilina E.A., Ozerova N.S., Palmina N.P., Maltseva E.L., Kasparov V.V., Bogdanova N.G., Krivandin F.V. // Food Hydrocoll. 2016. V. 52. P. 144–160.
Semenova M.G., A.S. Antipova A.S., Misharina T.A., Alinkina E.S., Zelikina D.V., Martirosova E.I., Palmina N.P., Binyukov V.I., Maltseva E.L., Kasparov V.V., Ozerova N.S., Shumilina E.A., Baeva K.A., Bogdanova N.G. // Gums and Stabilisers for the Food Industry 18: Hydrocolloid Functionality for Affordable and Sustainable Global Food Solutions. Cambridge. Publ.: Royal Soc. of Chem., 2016. P. 182–189.
Строев Е.А. // Биологическая химия. М.: Высш. школа, 1986. 479 с.
Pinchuk I., Lichtenberg D. // Chem. Phys. Lipids. 2014. V. 178. P. 63–76.
McPherson P.A.C., Bole A., Cruz K.A., Young I.S., McEneny J. // Chem. Phys. Lipids. 2012. V. 165. P. 682–688.
Lee C., Barnett J., Reven P.D. // J. Lipid Res. 1998. V. 39. P. 1239–1247.
Hiro–jmi M., Shoshichi N., Reizo I. // J. Biochem. 1984. V. 95. P. 51–55.
Абдрахманова А.Р., Козина Е.А., Грабовский С.А., Кабальнова Н.Н., Муринов Ю.И. // Тез. докл. Всеросс. конф. мол. ученых “Окисл., окисл. стресс, антиоксиданты”. М.: РУДН, 2008. С. 78.
Эммануэль Н.М., Денисов Е.Т., Майзус З.К. // Цепные реакции окисления углеводородов в жидкой фазе. М.: Наука, 1965.
Denisov E.T., Afanas’ev I.B. // Oxidation and Antioxidants in Organic Chemistry and Biology. Boca Raton: CRC Press, 2005.
Jirovetz L., Buchbauer L., Stoilova L., Stoyanova A., Krastanov A., Schmidt A. // J. Agric. Food Chem. 2006. V. 54. P. 6303–6307.
Самусенко А.Л. // Химия растит. сырья. 2014. № 2. С. 97–102.
Brada P.C., Alfieri M., Culici M., Sasso M.D. // Fitoterapia. 2007. V. 78. P. 396–400.
Алинкина Е.С., Воробьева А.К., Мишарина Т.А., Медведева И.Б., Фаткуллина Л.Д., Бурлакова Е.Б. // Прикл. аналит. химия. 2011. Т. 2. № 2. С. 28–36.
Semenova M.G. // Food Hydrocoll. 2017. V. 68. P. 114–121.
Смотрова Н.В., С.А. Чеботарёв С.А., Воробьёва Н.С, Тейсен C., Бабеева G., Китл T., Антипова A.C. // Сб. трудов XVI ежег. межд. молод. конф. “Биохим. физика” ИБХФ РАН–ВУЗы. Москва: РУДН, 2017. P. 83–87.
Semenova M.G., Antipova A.S., Belyakova L.E., Polikarpov Yu.N., Anokhina M.S., Grigorovich N.V., Moiseenko D.V. // Food Hydrocoll. 2014. V. 42. P. 149–161.
Istarova T. A., Semenova M. G., Sorokoumova G. M., Selishcheva A. A., Belyakova L. E., Polikarpov Yu N., Anikhina M.S. // Food Hydrocoll. 2005. V. 19. P. 429–440.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


