Биоорганическая химия, 2019, T. 45, № 2, стр. 213-217
Гибридный белок щелочного сенсора IRR и флуоресцентного белка GFP сохраняет функциональную активность рецептора
А. А. Можаев 1, 2, О. В. Серова 1, А. Н. Орса 1, А. А. Бойко , А. С. Горященко 1, И. Е. Деев 1, А. Г. Петренко 1
1 ФГБУ Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 ГСП-7, Москва, В-437, ул. Миклухо-Маклая, 16/10, Россия
2 Институт кристаллографии им. А.В. Шубникова (ФНИЦ “Кристаллография и фотоника” РАН)
119333 Москва, Ленинский пр-т, 59, Россия
Поступила в редакцию 08.10.2018
После доработки 10.10.2018
Принята к публикации 10.10.2018
Аннотация
Рецептор, подобный рецептору инсулина (IRR), является клеточным сенсором слабощелочной среды. Его пространственная структура и механизм активации до сих не выяснены. В данной работе представлены результаты создания системы гетерологической экспрессии полноразмерной рецепторной тирозинкиназы IRR. Получена плазмидная конструкция, кодирующая кДНК полноразмерного человеческого рецептора IRR, слитого по С-концу с GFP-белком, и проведена экспрессия гибридного белка в клеточной линии HEK293. Показано, что рецептор в составе гибридного белка экспрессируется на цитоплазматической мембране и сохраняет свою функциональную активность. Полученный белок может быть использован для дальнейших исследований структуры и функции IRR.
ВВЕДЕНИЕ
Рецепторные тирозинкиназы – одно из важнейших звеньев в системе передачи сигналов в клетке. Рецепторные тирозинкиназы являются мембранными белками. Для активации большинства рецепторных тирозинкиназ необходим лиганд белково-пептидной природы, способный связываться с рецептором одновременно в нескольких местах, вызывая его димеризацию и активацию, выражающуюся в автофосфорилировании внутриклеточной части рецептора [1]. Исключением является семейство рецептора инсулина, члены которого димеризованы с помощью дисульфидных связей в неактивном состоянии, а при взаимодействии внеклеточной части с лигандом меняют свою конформацию и активируются. В это семейство входит три рецептора: рецептор инсулина (IR), рецептор инсулиноподобного фактора роста (IGF-IR) и рецептор, подобный инсулиновому рецептору (IRR). Все три рецептора высокогомологичны и, предположительно, имеют близкие механизмы функционирования. На данный момент известна пространственная структура внеклеточной части рецептора инсулина, а также получена в кристаллическом состоянии часть внеклеточного домена рецептора инсулина в комплексе с инсулином [2, 3].
Физиологическая роль рецептора IRR до недавнего времени была не известна, так как попытки найти природный лиганд рецептора белковой или пептидной природы были безуспешными [4]. Нами было установлено, что IRR может напрямую активироваться слабощелочной внеклеточной средой [5, 6], что разительно отличает его от других рецепторных тирозинкиназ, которые имеют лиганды белковой или пептидной природы. Активация IRR щелочной средой специфична, дозозависима и обусловливается конформационными изменениями во внеклеточной части рецептора при повышении pH внеклеточной среды [6]. Генно-инженерные эксперименты свидетельствуют о том, что активация IRR происходит с включением двух отдельных pH-зависимых центров в эктодомене рецептора, которые действуют совместно, индуцируя конформационные изменения в молекуле IRR, приводящие к автофосфорилированию внутриклеточных киназных доменов рецептора [7–10]. При активации IRR наблюдается фосфорилирование внутриклеточного сигнального белка IRS-1 (Insulin receptor substrate 1, субстрат рецептора инсулина 1) и протеинкиназы В (Akt/PKB) [6]. Для изучения структуры и функции рецептора IRR нами были получены и охарактеризованы моноклональные антитела, специфично распознающие внеклеточную часть рецептора IRR [11].
Функцию IRR как сенсора щелочной внеклеточной среды подтверждают физиологические эксперименты. У мышей с направленной инактивацией гена insrr, кодирующего рецептор IRR, наблюдалось нарушение регуляции кислотно-щелочного равновесия в условиях экспериментального метаболического алкалоза [6, 12]. Также у мышей, нокаутных по гену insrr, обнаружен поведенческий фенотип, заключающийся в дефиците агрессивно-оборонительного поведения животных [13, 14]. Несмотря на более чем 30-летние исследования в этой области, механизм активации рецепторов семейства рецептора инсулина остается невыясненным. Подавляющие большинство работ было направлено на исследование механизмов активации двух рецепторов IR и IGF-IR, что связано с известностью и изученностью их агонистов и доказанной важностью обоих рецепторов в работе организма. Однако до сих пор не ясно, какие именно конформационные изменения происходят в этих рецепторах при их активации, и как это приводит к фосфорилированию их внутриклеточных частей [15].
Данная работа является частью комплексного проекта, посвященного изучению механизмов трансмембранной передачи сигналов, в которые вовлечены лиганд-рецепторные и липидные взаимодействия. Цель настоящей работы заключалась в создании системы экспрессии полноразмерного функционально-активного рецептора IRR, пригодного для последующих структурно-функциональных исследований.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С использованием методов генной инженерии в вектор pcDNA-IRR-HA, полученный нами ранее [6], вместо HA-тага (HA-Human influenza hemagglutinin, гемагглютинин гриппа человека) была клонирована последовательность ДНК, кодирующая зеленый флуоресцентный белок GFP. Для возможности дальнейшего отщепления, перед GFP вводили последовательность, включающую сайт расщепления энтерокиназой (DDDDK). В результате был получен плазмидный вектор pcDNA-IRR-GFP, содержащий все необходимые элементы для успешной экспрессии целевого мембранного белка IRR-GFP. Продуцируемый белок содержал последовательно следующие элементы: на N-конце сигнальный пептид, затем последовательность рецептора IRR, сайт расщепления энтерокиназой и GFP-таг.
Для гликопротеинов эукариотического происхождения, имеющих сложную структуру, необходимым условием эффективной экспрессии является использование клеток млекопитающих, что позволяет сохранять нативную третичную структуру и посттрансляционные модификации. Особенные свойства нашего объекта исследования определили выбор в качестве продуцента эукариотической клеточной линии HEK293, представляющей собой эпителиальные клетки почек эмбриона человека.
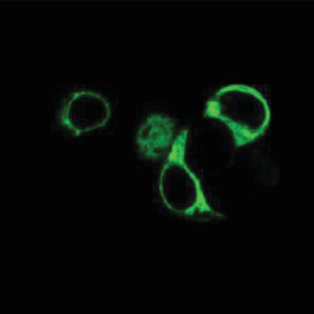
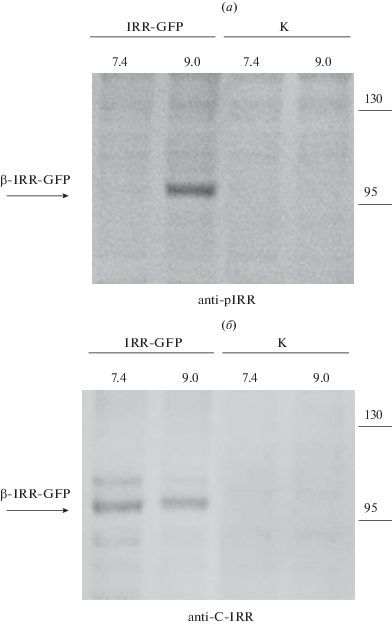
Дальнейшим этапом работ стала транзиентная трансфекция клеточной линии HEK293 полученным вектором. Клетки выращивали на среде DMEM, для масштабирования экспрессии использовали матрасы T175 (Eppendorf). Уровень экспрессии и локализацию целевого рецептора, оценивали на конфокальном микроскопе (рис. 1). Исходя из представленных изображений, можно заключить, что IRR эффективно экспрессируется и имеет ярко выраженную мембранную локализацию в отличие от GFP, представляющего собой цитоплазматический белок. Также мы определили, что данный рецептор способен активироваться средой с щелочным значением pH без отщепления GFP-тага на C-конце (рис. 2). Окрашивание IRR проводили антителами против фосфорилированной формы рецептора anti-pIRR и антителами к β-субъединице рецептора anti-C-IRR, полученными нами ранее [6].
Рис. 2.
Вестерн-блот-анализ активации IRR-GFP средой с щелочным значением pH. IRR-GFP – лизаты клеток, экспрессирующих IRR-GFP (обработанных средой с pH 7.4 и 9.0). К – контрольные, нетрансфицированные клетки. Лизаты окрашены антителами к фосфорилированной форме IRR – anti-pIRR (а), и к β-субъединице IRR – anti-C-IRR (б). Стрелкой отмечена β-субъединица рецептора IRR-GFP. Справа указаны массы белковых маркеров (кДа).
В результате, нами разработана система эффективной экспрессии IRR, показана его мембранная локализация и способность к активации.
Выделение и изучение структуры IRR представляет особый интерес для понимания фундаментальных основ механизма щелочной чувствительности, а также для развития в будущем новых терапевтических подходов и созданию лекарств для лечения заболеваний, связанных с нарушением кислотно-щелочного равновесия и патологий клеточного деления и дифференцировки, в частности, некоторых форм рака. Изучение структурных особенностей механизма активации IRR может прояснить механизмы активации ближайших гомологов IR и IGF-IR.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение конструкции pcDNA-IRR-GFP. В плазмидную конструкцию pcDNA-IRR-HA, полученную ранее на основе вектора pcDNA3.1 [6], с использованием ПЦР с мегапраймерами, вместо HA-тага была клонирована последовательность ДНК, кодирующая сайт для расщепления энтерокиназой и белок GFP. В результате был получен плазмидный вектор pcDNA-IRR-GFP. Продуцируемый белок содержал последовательно следующие элементы: на N-конце сигнальный пептид, затем последовательность рецептора IRR, сайт расщепления энтерокиназой и последовательность GFP на С-конце.
Клетки HEK293 растили на среде DMEM, содержащей 10% эмбриональной сыворотки теленка, 1% пенициллина/стрептомицина и 2 мМ L-глутамин в стандартных условиях (37°С и 5% CO2). Клетки трансфицировали плазмидой pcDNA-IRR-GFP, кодирующей IRR с присоединенным по его С‑концу белком GFP, с использованием реагента FuGENE 6 (Promega), как описано [16]. После трансфекции клетки растили два дня, а затем использовали в вестерн-блот анализе и флуоресцентной микроскопии.
Активация IRR-GFP. Клетки, экспрессирующие IRR-GFP, на второй день после трансфекции инкубировали в течение 3 ч в бессывороточной среде, для уменьшения базового фона фосфорилированных белков. Затем проводили обработку клеток в течение 15 мин при 37°С в бессывороточной среде F-12 с добавлением 25 мМ Tris-HCl pH 7.4 или 9.0. В качестве контроля использовали нетрансфицированные клетки. Затем среду отбирали, клетки лизировали в буфере для нанесения на электрофорез.
Электрофорез в ПААГ и вестерн-блот. Электрофорез в 8% ПААГ в присутствии додецилсульфата натрия с последующим вестерн-блоттингом проводили по стандартному протоколу, как описано в работе [17]. Перенос белков на нитроцеллюлозную мембрану проводили в течении 1.5 ч при 250 мА. Неспецифическую сорбцию белков предотвращали инкубацией мембраны в буфере TBST (50 мМ Трис-HCl, pH 8.0, 150 мМ NaCl, 0.05% Твин 20), содержащем 5% обезжиренного молока, в течении 1 ч. Затем мембрану инкубировали с первичными антителами. Для идентификации фосфорилированной формы IRR в качестве первичных использовали поликлональные кроличьи антитела anti-pIRR, полученные против фосфорилированного пептида CGMTRDVpYETDpYpYRKGGKGL (где pY – фосфорилированные остатки тирозина) из активационной петли IRR [6]. Для идентификации общего количества β-субъединицы IRR-GFP использовали кроличьи поликлональные антитела anti-C-IRR, полученные против C-концевого цитоплазматического домена (961–1297 а.о.) [6]. Далее следовала отмывка от первичных антител с последующим добавлением вторичных антител осла против иммуноглобулинов IgG кролика, конъюгированных с пероксидазой хрена (Jackson ImmunoResearch). Полосы визуализировали обработкой люминесцентным субстратом SuperSignal West Pico (Pierce) на приборе Fusion Solo (Vilber Lourmat).
Флуоресцентная микроскопия живых клеток. Клетки HEK293TN, трансфицированные плазмидой, кодирующей IRR-GFP, культивировали на чашках для микроскопии (FluoroDishFD-35-100), покрытых полилизином (Sigma). Изображения клеток снимали на конфокальном микроскопе Nikon Eclipse TE2000-E, с лазером на возбуждение 488 нм и фильтром на эмиссию 515 нм.
Список литературы
Schlessinger J. // Cell. 2000. V. 103. P. 211–225.
McKern N.M., Lawrence M.C., Streltsov V.A., Lou M.Z., Adams T.E., Lovrecz G.O., Elleman T.C., Richards K.M., Bentley J.D., Pilling P.A., Hoyne P.A., Cartledge K.A., Pham T.M., Lewis J.L., Sankovich S.E., Stoichevska V., Da Silva E., Robinson C.P., Frenkel M.J., Sparrow L.G., Fernley R.T., Epa V.C., Ward C.W. // Nature. 2006. V. 443. P. 218–221.
Menting J.G., Whittaker J., Margetts M.B., Whittaker L.J., Kong G.K.W., Smith B.J., Watson C.J., Zakova L., Kletvikova E., Jiracek J., Chan S.J., Steiner D.F., Dodson G.G., Brzozowski A.M., Weiss M.A., Ward C.W., Lawrence M.C. // Nature. 2013. V. 493. P. 241–U276.
Petrenko A.G., Zozulya S.A., Deyev I.E., Eladari D. // Biochim. et Biophys. Acta. 2013. V. 1834. P. 2170–2175.
Деев И.Е., Василенко К.П., Курмангалиев Е.Ж., Серова О.В., Попова Н.В., Галаган Ю.С., Бурова Е.Б., Зозуля С.А., Никольский Н.Н., Петренко А.Г. // ДАН. 2006. Т. 408. С. 822–825 [Deev I.E., Vasilenko K.P., Kurmangaliev E., Serova O.V., Popova N.V., Galagan Y.S., Burova E.B., Zozulya S.A., Nikol’skii N.N., Petrenko A.G. // Dokl. Biochem. Biophys. 2006. V. 408. P. 184–187].
Deyev I.E., Sohet F., Vassilenko K.P., Serova O.V., Popova N.V., Zozulya S.A., Burova E.B., Houillier P., Rzhevsky D.I., Berchatova A.A., Murashev A.N., Chugunov A.O., Efremov R.G., Nikol’sky N.N., Bertelli E., Eladari D., Petrenko A.G. // Cell Metab. 2011. V. 13. P. 679–689.
Deyev I.E., Mitrofanova A.V., Zhevlenev E.S., Radionov N., Berchatova A.A., Popova N.V., Serova O.V., Petrenko A.G. // J. Biol. Chem. 2013. V. 288. P. 33884–33893.
Попова Н.В., Деев И.Е., Петренко А.Г. // ДАН. 2013. Т. 450. С. 602–605 [Popova N.V., Deyev I.E., Petrenko A.G. // Dokl. Biochem. Biophys. 2013. V. 450. P. 160–163].
Deyev I.E., Popova N.V., Petrenko A.G. // Acta Naturae. 2015. V. 7. P. 80–86.
Deyev I.E., Chachina N.A., Shayahmetova D.M., Serova O.V., Petrenko A.G. // Biochimie. 2015. V. 111. P. 1–9.
Mozhaev A.A., Erokhina T.N., Serova O.V., Deyev I.E., Petrenko A.G. // Russian Journal of Bioorganic Chemistry. 2017. V. 43. P. 653–657.
Deyev I.E., Rzhevsky D.I., Berchatova A.A., Serova O.V., Popova N.V., Murashev A.N., Petrenko A.G. // Acta Naturae. 2011. V. 3. P. 114–117.
Shayahmetova D.M., Zhevlenev E.S., Mozhaev A.A., Deyev I.E., Petrenko A.G. // Russian Journal of Bioorganic Chemistry. 2016. V. 42. P. 449–452.
Zubkov E.A., Morozova A.Y., Chachina N.A., Shayakhmetova D.M., Mozhaev A.A., Deyev I.E., Chekhonin V.P., Petrenko A.G. // Neuroscience and Behavioral Physiology. 2018. V. 48. P. 483–487.
De Meyts P. // Bioessays. 2015. V. 37. P. 389–397.
Deyev I.E., Petrenko A.G. // Biochimie. 2010. V. 92. P. 418–422.
Krasnoperov V., Deyev I.E., Serova O.V., Xu C., Lu Y., Buryanovsky L., Gabibov A.G., Neubert T.A., Petrenko A.G. // Biochemistry. 2009. V. 48. P. 3230–3238.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия