Биоорганическая химия, 2019, T. 45, № 3, стр. 252-264
Синтез и антимикробная активность нового лекарственного средства на основе ретро-аналога кателицидина – полипептида SE-33
А. С. Тренин 1, *, В. Г. Арзуманян 2, М. Н. Жмак 3, И. В. Шелухина 3, Я. В. Макарова 3, И. А. Иванов 3, О. П. Бычкова 1, А. С. Будихина 4, Л. С. Балясова 4, В. И. Цетлин 3
1 ФГБНУ “Научно-исследовательский институт по изысканию новых антибиотиков имени Г.Ф. Гаузе” (ФГБНУ “НИИНА”)
119021 Москва, Большая Пироговская, 11, Россия
2 ФГБНУ “Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова” (ФГБНУ НИИВС им. И.И. Мечникова)
Москва, Россия
3 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (ИБХ РАН)
Москва, Россия
4 ФГБУ “ГНЦ Институт иммунологии” ФМБА России
Москва, Россия
* E-mail: as-trenin@mail.ru
Поступила в редакцию 06.08.2018
После доработки 10.09.2018
Принята к публикации 14.09.2018
Аннотация
Пептид SE-33 (SETRPVLNRLFDKIRQVIRKFEKGIKEKSKRFF), являющийся ретро-аналогом природного антимикробного пептида кателицидина LL-37 (LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES), получен при помощи твердофазного метода синтеза пептидов и образует, как и природный аналог, амфипатическую альфа-спираль. По физико-химическим свойствам синтезированный препарат близок к природному соединению. В экспериментах in vitro обнаружено бактерицидное действие препарата SE-33 в отношении клеток Staphylococcus aureus Wood 46, сопоставимое с действием кателицидина, а также выраженная антифунгальная активность в отношении клинических изолятов Candida albicans, Cryptococcus neoformans, Rhodotorula mucilaginosa, Trichosporon cutaneum, Geotrichum sp. Минимальная подавляющая концентрация полипептида SE-33 в отношении разных штаммов грибов находится в диапазоне от 31.2 до 1024 мкг/мл. В модели вульвовагинального кандидоза (ВВК) мышей показана высокая активность препарата SE-33 in vivo, сопоставимая с действием пимафуцина. При отсутствии побочных эффектов и признаков патологии полипептид SE-33 во всех исследуемых дозах (1, 10 и 50 мг/мл) статистически достоверно снижал обсемененность вагины мышей по сравнению с аналогичным показателем в группе плацебо. Высокая антимикробная активность полипептида SE-33 в экспериментах in vitro и in vivo в модели ВВК у животных, а также отсутствие выраженного токсического эффекта препарата позволяют рассматривать его в качестве перспективного антимикробного средства.
ВВЕДЕНИЕ
Класс антимикробных (поли)пептидов (AMП) представляет собой большую группу природных биологически активных соединений, образуемых многоклеточными организмами и выполняющих, как независимо, так и в комплексе с иммунной системой, функцию защиты от микробных инфекций [1–4]. AMП обнаруживаются в эпителиальных тканях, фагоцитирующих клетках, биологических жидкостях различных многоклеточных животных [5–8]. Некоторые из пептидов синтезируются конститутивно, синтез других индуцируется в ответ на инфекцию, воспаление или нарушение целостности слизистых оболочек [9, 10].
В отличие от крупных эндогенных AMП, содержащих свыше 100 а.о., проявляющих чаще всего свойства литических ферментов или белков, способных к связыванию питательных веществ, AMП меньшего размера обладают очень важным свойством – они проявляют выраженную активность в отношении широкого спектра организмов – вирусов, бактерий, грибов, простейших. Нередко их называют натуральными антибиотиками [3, 4].
Многие низкомолекулярные AMП относят к катионным белкам, разнообразным по аминокислотной последовательности, вторичной структуре и механизму действия. Кроме непосредственной антимикробной функции, они участвуют в таких процессах, как хемотаксис, протеазно-антипротеазный баланс, клеточная пролиферация, окислительно-восстановительный гомеостаз, выполняют функцию медиаторов воспаления, способствуют иммунной индукции, выбросу цитокинов и, в целом, заживлению ран [4, 9, 11].
В ликворах человека – лимфе, слюне, моче, слезной жидкости, молоке, потовом и вагинальном секретах – действует целый спектр AMП: дефензины, кателицидины, лизоцим, лактоферрин, липокалин, секреторный ингибитор лейкопротеазы, псориазин, РНКаза 7, кальпротектин, дермцидины, гистатины, гепцидины [2, 5, 7, 11–14]. Первые восемь названных AMП присутствуют во всех перечисленных жидкостях и в большинстве эпителиальных тканей человека. Предполагается, что эти вещества могут стать прообразом фармацевтических форм антимикробных препаратов будущего. Рекомбинантная форма одного из них – лизоцима, уже используется в качестве местного средства при лечении наружных воспалительных процессов. Особое внимание привлечено к кателицидинам, в первую очередь к кателицидинам человека – катионным альфа-спиралевидным AMП: пептиду LL-37 и его предшественнику hCAP18 [3, 15].
Кателицидин человека (пептид LL-37) (LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES), имеющий 37 а.о., выполняет разнообразные функции, связанные, главным образом, с защитой организма от различных инфекционных агентов [15, 16]. Образуемый клетками кожи, дыхательного и желудочно-кишечного трактов, лейкоцитами, включая моноциты, нейтрофилы, NK-, Т- и В‑клетки, пептид LL-37 встречается в самых разных органах и тканях. Проявляя широкий спектр антимикробной активности и оказывая непосредственное воздействие на инфекционные агенты, кателицидин LL-37 выполняет также дополнительные чрезвычайно важные функции – участвует в связывании и нейтрализации липополисахаридов, в активации клеток адаптивного иммунитета, регуляции иммунного ответа на воспалительный процесс, способствует регенерации пораженных участков тела [3, 13, 16].
Важным свойством кателицидина является его активность в отношении про- и эукариотических организмов, в частности, способность этого пептида к подавлению роста Candida albicans – одного из наиболее распространенных и опасных грибных патогенов [3, 17, 18]. Изучение действия LL-37 на клетки С. albicans на цитологическом и молекулярном уровне показало, что фунгистатическое и фунгицидное действие кателицидина во многом связано с его способностью вызывать фрагментацию клеточной мембраны, появлением в ней везикулярных структур диаметром около 100 нм и, в целом, с существенным изменением проницаемости мембраны [19].
Острая необходимость в разработке новых антимикробных препаратов, в частности, для борьбы с резистентными микроорганизмами и образуемыми ими биопленками, привела к прогрессу в исследованиях натуральных AMП, что позднее явилось основой для разработки их синтетических аналогов [1]. Основными проблемами в этой области остаются потенциальная токсичность синтетических AMП в отношении клеток животных, низкая специфичность и определенная нехватка четких ориентиров при проведении рационального дизайна. Самые незначительные модификации структуры природного пептида способны привести к изменению у синтетических AMП таких важных характеристик, как спектр действия и активность. [3, 15]. В этом отношении весьма перспективным направлением считается применение компьютерных методов дизайна [20].
Поскольку одним из наиболее важных свойств АМП, необходимых для проявления их антимикробных свойств, является способность к образованию амфипатической альфа-спирали, особое внимание следует уделять разработке соединений, в полной мере обладающих именно этим качеством. Указанное свойство способствует усилению антимикробной активность АМП, поскольку механизм их действия в значительной степени связан с взаимодействием пептидов посредством амфипатической альфа-спирали с отрицательно-заряженной микробной клеточной стенкой [15].
Проведенная нами оценка способности различных соединений к образованию амфипатической альфа-спирали (http://aps.unmc.edu/AP/main.php) показала, что одним из наиболее перспективных в этом отношении является пептид SE-33 (SETRPVLNRLFDKIRQVIRKFEKGIKEKSKRFF), обладающий ретро-последовательностью аминокислотпо сравнению с природным кателицидином человека LL-37.
Целью настоящего исследования явились синтез аналога природного кателицидина LL-37 – полипептида SE-33, оценка его физико-химических свойств и антимикробной активности in vitro, а также изучение его специфической активности in vivo в модели вульвовагинального кандидоза мышей (ВВК).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
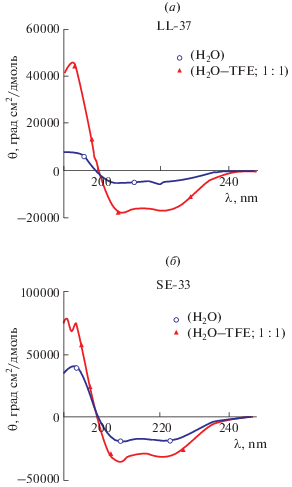
Синтез пептида SE-33 и оценка его физических свойств. Подробное описание твердофазного синтеза пептида SE-33 приведено в экспериментальной части статьи. Выход конечного продукта в расчете на С-концевую аминокислоту составил 30%. Время удерживания пептида SE-33 в условиях аналитической ВЭЖХ составило 21.0 мин. Экспериментальная молекулярная масса в условиях МАЛДИ-масс-спектрометрии – 4095.9 Да, теоретическая молекулярная масса 4094.81 Да. Данные ВЭЖХ и масс-спектрометрии, представленные на рис. 1 и 2, подтверждают корректную структуру и высокую степень чистоты, синтезированного полипептида SE-33, а результаты КД-спектроскопии (рис. 3) свидетельствуют о наличии у пептида SE-33 альфа-спиральной структуры. По данным КД-спектроскопии пептид SE-33 образует альфа-спиральные структуры в большей степени, чем природный кателицидин (60% против 17% для водного раствора).
Рис. 3.
Результаты КД-спектроскопии полипептидов LL-37 (кателицидин) (a) и SE-33 (б) в воде (⚪), в смеси трифторэтанола и воды (1 : 1) (▲).
Антимикробная активность пептида SE-33 in vitro. Изучение пептида SE-33 показало, что он обладает выраженным антимикробным действием. В экспериментах in vitro с дрожжевой культурой C. albicans ATCC 14053 продемонстрирована антифунгальная активность полипептида SE-33, его способность к задержке и подавлению роста указанной тест-культуры. Подавление роста, отмечаемое как по величине оптической плотности, так и по числу колониеобразующих единиц (КОЕ) при высеве на чашки Петри и подсчете числа жизнеспособных клеток, наблюдалось при использовании пептида SE-33 в концентрации 0.125 мг/мл (28 мкМ) и выше (рис. 4).
Рис. 4.
Число жизнеспособных клеток C. albicans ATCC 14053 (КОЕ/мл) в ячейках 96-луночных планшетов после 24 часов культивирования в жидкой питательной среде при использовании различных концентраций полипептида SE-33. Приведены медианные значения результатов, полученных путем подсчета колоний при высеве микробных суспензий на плотные питательные среды в 5 независимых экспериментах.

Двукратное подавление роста численности популяции по сравнению с контролем происходило при использовании полипептида SE-33 в концентрации 0.25 мг/мл. Подавление роста численности популяции на 90% отмечено при использовании полипептида в концентрации 0.5 мг/мл. В концентрации 1 мг/мл пептид SE-33 вызывал полное подавление роста тест-культуры. Полученные сведения позволили оценить минимальную подавляющую концентрацию (МПК) полипептида SE-33 в отношении дрожжевой культуры C. albicans ATCC 14053 как 1 мг/мл. МПК50 и МПК90 составили, соответственно, 0.25 и 0.5 мг/мл (табл. 1).
Таблица 1.
Активность полипептида SE-33 и амфотерицина В (Am B) в отношении дрожжевой культуры C. albicans ATCC 14053 в экспериментах in vitro
| Соединение | МПК* | |||
|---|---|---|---|---|
| МПК25 | МПК50 | МПК90 | МПК100 | |
| SE-33, мг/мл | 0.125 (0.125; 0.125; 0.125; 0.16; 0.25) | 0.25 (0.25; 0.25; 0.25; 0.32; 0.5) | 0.5 (0.5; 0.5; 0.5; 1) | 1 (1; 1; 1; 2; 2) |
| Am B, мкг/мл | – | – | – | 0.5 (0.5; 0.5; 0.5; 0.5; 1) |
В ходе параллельно проведенных экспериментов с амфотерицином В показано, что этот антибиотик всегда вызывал полное подавление роста культуры. Его МПК в отношении C. albicans ATCC 14053 составила 0.5 мкг/мл (табл. 1).
Изучение антифунгального действия пептида SE-33 в отношении других клинически значимых грибных культур коллекции ФГБНУ НИИВС им. И.И. Мечникова, проведенное в двух независимых экспериментах, позволило выявить следующие средние значения МПК: 1024 мкг/мл (C. albicans № 927), 62.5 мкг/мл (Cryptococcus neoformans № 3465), 62.5 мкг/мл (Rhodotorula mucilaginosa № 132), 31.2 мкг/мл (Trichosporon cutaneum № 18), 31.2 мкг/мл (Geotrichum sp. № 1206).
Проведение блиц-экспериментов, суть которых состояла в выявлении особенностей воздействия пептида SE-33 на клетки дрожжей C. albicans № 927, показало, что оно имеет дозозависимый характер: доля погибших (окрашенных) клеток (за вычетом контроля) при использовании пептида в концентрации 1 мг/мл составила 40.4%, в концентрации 3 мг/мл – 76.9%, а для 10 мг/мл – 92.0%. Результаты блиц-экспериментов продемонстрировали, что воздействие пептида SE-33, по-видимому, имеет определенную аналогию с эффектом натурального кателицидина LL-37, проявляющего свои антимикробные свойства, однако, в значительно меньшей концентрации: по данным литературы действие 2 мкМ LL-37 на суспензию клеток C. albicans (4 × 106 клеток/мл) приводило к гибели 50–100% популяции клеток, а обработка 20 мкМ вызывала полное разрушение клеточных структур [19].
Для определения воздействия пептида SE-33 на бактериальные клетки Staphylococcus aureus Wood 46 было проведено три независимых эксперимента, результаты которых свидетельствуют о наличии четкой дозовой зависимости между концентрацией препарата и гибелью клеток стафилококка с выходом на плато при концентрации препарата 12.5–25.0 мкг/мл (рис. 5). Видно, что SE-33 обладает несколько меньшей активностью по сравнению с кателицидином (препарат LL-37), что выражается также в его более высоких значениях EC50 (табл. 2). При сравнении t-тестом Стьюдента разница статистически достоверна (p < 0.05).
Таблица 2.
Результаты трех опытов по изучению антибактериального действия пептидов LL-37 и SE-33 в отношении S. aureus Wood 46
| Пептид | EC50 (мкг/мл) в опытах | |||
|---|---|---|---|---|
| 1 | 2 | 3 | M ± σ | |
| LL-37 | 4.38 | 4.4 | 3.81 | 4.2 ± 0.34 |
| SE-33 | 5.94 | 10.27 | 12.41 | 9.54 ± 3.3* |
Антимикробная активность пептида SE-33 в экспериментах in vivo. Изучение антифунгального действия пептида SE-33 in vivo, проводившееся при моделировании вульвовагинального кандидоза (ВВК) мышей (схема моделирования и лечения ВВК представлена в табл. 3 и 4), показало, что применение препарата не вызывало явных побочных эффектов и признаков патологии у животных. Независимо от принадлежности к той или иной группе, все животные в данном эксперименте выжили. В группах контроля (группы 1 и 2, табл. 4) ни одна мышь не заболела ВВК на всем протяжении эксперимента, тогда как в опытных группах (№ 3–7), все животные стали носителями C. albicans.
Таблица 3.
Моделирование и последующее лечение вульвовагинального кандидоза мышей (схема опытов по дням)
| День экспери-мента | Манипуляции |
|---|---|
| 1 | Первая эстрогенизация |
| 5 | Вторая эстрогенизация |
| 6 | Заражение |
| 7 | Третья эстрогенизация |
| 12 | Первый высев вагинального содержимого |
| 13 | Первый день лечения + учет результатов высева |
| 14 | Второй день лечения |
| 15 | Третий день лечения |
| 16 | Четвертый день лечения |
| 17 | Пятый день лечения |
| 19 | Второй высев вагинального содержимого |
| 20 | Учет результатов второго высева |
| 27 | Третий высев вагинального содержимого |
| 28 | Учет результатов третьего высева |
Таблица 4.
Проведение процедур в опытных и контрольных группах мышей
| Номер группы | Процедуры | |||
|---|---|---|---|---|
| эстрогенизация | заражение C. аlbicans № 927 | препарат для лечения | концентрация препарата, мг/мл | |
| 1* | – | – | – | – |
| 2* | + | – | – | – |
| 3 | + | + | SE-33 | 1 |
| 4 | + | + | SE-33 | 10 |
| 5 | + | + | SE-33 | 50 |
| 6* | + | + | – | 0 |
| 7 | + | + | Пимафуцин | 20 |
Лечебный эффект препаратов оценивали по двум показателям: динамике снижения обсемененности вагины в процессе лечения животных и в доле “излеченных” (т.е. с нулевым высевом) животных, подсчитанной на 28-й день эксперимента (рис. 6, табл. 5).
Рис. 6.
Зависимость обсемененности вагины мышей дрожжами C. albicans от дозы лечебного препарата в группах № 3–7 (см. табл. 4, 5) в динамике лечения. Первый высев проводили до начала лечения, второй и третий высевы – через неделю и через две недели после начала лечения соответственно. Анализ проведен с применением статистических тестов Вилкоксона (Wilcoxon Signed Rank Test), Даннета (Dunnett’s post hoc test) и дисперсионного анализа (ANOVA) p < 0.01 – p < 0.1.
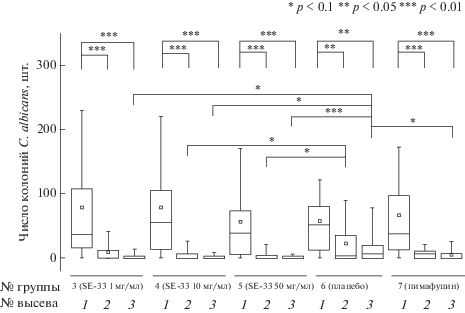
Таблица 5.
Зависимость основных показателей терапевтического эффекта от дозы лечебного препарата в группах № 3–7 (табл. 4) через две недели после начала лечения
| Показатель | Лечение препаратами в дозах в группах: | ||||
|---|---|---|---|---|---|
| 3: SE-33, 1 мг/мл |
4: SE-33, 10 мг/мл |
5: SE-33, 50 мг/мл |
6: SE-33, 0 мг/мл |
7: пимафуцин, 20 мг/мл |
|
| Снижение медианы обсемененности вагины по сравнению с исходной, %* | 96.2 | 96.3 | 98.8 | 85.9 | 97.5 |
| Доля животных, полностью излеченных от ВВК, % ** | 35 | 30 | 50 | 20 | 45 |
Из данных, приведенных на рис. 6, видно, что обсемененность вагины до проведения лечения (результаты первого высева) была сравнима для всех групп животных, зараженных C. albicans (группы 3–7). Препарат SE-33 во всех исследуемых дозах – 1, 10 и 50 мг/мл (группы 3, 4 и 5) статистически достоверно (p < 0.1 для групп 3 и 4 и p < 0.01 для группы 5) снижал обсемененность вагины по сравнению с аналогичным показателем в группе плацебо (группа 6). Эффективность лечения препаратом SE-33 во всех дозах была сопоставима с таковой для препарата сравнения – пимафуцина, используемого в дозе 20 мг/мл (группа 7, третий высев, p < 0.1).
Повышение дозы SE-33 с 1 мг/мл (группа 3) до 10 мг/мл (группа 4) и 50 мг/мл (группа 5) приводило к статистически достоверному (p < 0.1) отличию в степени обсемененности вагины, по сравнению с контрольной группой № 6, уже спустя неделю после начала лечения (второй высев). Для групп № 3–5 была отмечена также тенденция снижения обсемененности вагины в динамике лечения.
Наиболее выраженная активность SE-33 наблюдалась при введении препарата в виде геля в дозе 50 мг/мл. Введение SE-33 в дозах 1 и 10 мг/мл приводило к снижению медианы обсемененности вагины, по сравнению с плацебо, в 1.12 раза и увеличению доли полностью излеченных животных, по сравнению с плацебо, в 1.5–1.75 раза. Введение SE-33 в концентрации 50 мг/мл приводило к снижению медианы обсемененности вагины, по сравнению с плацебо, в 1.15 раза и к увеличению доли полностью излеченных животных, по сравнению с плацебо, в 2.5 раза. Те же показатели для пимафуцина составили 1.14 раза и 2.25 раза соответственно.
Таким образом, гель, содержащий пептид SE-33 в концентрации от 1 до 50 мг/мл, оказался эффективным средством лечения животных в модели ВВК. При этом наименьшей концентрацией, вызывающей достоверное подавление роста дрожжевых грибов C. albicans № 927 в модели ВВК при интравагинальном введении препарата, оказалась концентрация 1 мг/мл. Наиболее выраженную противогрибковую активность в экспериментах in vivo пептид SE-33 проявлял в концентрации 50 мг/мл. При этом полученное в наших экспериментах in vitro значение МПК в отношении той же дрожжевой культуры C. albicans № 927, а также коллекционного штамма C. albicans ATCC 14053 оказалось на уровне 1 мг/мл. По данным литературы МПК кателицидина для C. albicans варьирует от 9 до 90 мкг/мл [3, 19], что вполне соответствует значениям MIC, полученным нами при изучении действия пептида SE-33 на другие виды дрожжей (31.2–62.5 мкг/мл). Очевидно, что используемые в настоящем исследовании штаммы C. albicans имели более выраженные механизмы защиты клеток от AMП.
Пептид SE-33 обладает бактерицидным действием. Его бактерицидность в отношении клеток S. aureus, оцененная как EC50, по своим численным параметрам оказалась вполне сопоставимой с бактерицидностью природного кателицидина (LL-37), что демонстрируют как наши эксперименты (рис. 5, табл. 2), так и результаты других исследователей, работавших с пептидом LL-37 и его аналогами [21].
Сопоставляя синтезированный полипептид SE-33 с его прототипом кателицидином (LL-37), можно заключить, что данный полипептид обладает не только сходными физико-химическими свойствами, но и проявляет достаточно высокую противогрибковую и противобактериальную активность. Отсутствие токсического эффекта в экспериментах на животных, высокая активность при использовании в модели ВВК и прочие выше перечисленные свойства позволяют рассматривать его в качестве перспективного антимикробного средства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез пептида SE-33 и оценка его физических свойств. Производные аминокислот, реагенты для синтеза и сорбенты для хроматографии были приобретены у фирмы Айрис Биотех ГМБХ (Германия). Синтез полипептида проводили в ручном варианте в стеклянном проточном реакторе (2 × × 20 см) по следующему протоколу для каждого синтетического цикла (из расчета 8–10 мл растворителя на 300 мг исходного полимера): 1. DMF (5 × 2 мин); 2. 20% пиперидин в DMF (20 мин); 3. DMF (3 × 2 мин); 4. диоксан-вода, 2 : 1, (2 × 5 мин); 5. DMF (5 × 2 мин); 6. реакция конденсации: 10 экв. активированной Fmoc-аминокислоты (4 ч, объем реакционной смеси 3–4 мл); 7. DMF (3 × 2 мин); 8. ацетилирование: Ac2O–пиридин– DMF, 20 : 20 : 60 (1 ч); 9. DMF (3 × 2 мин); 10. изопропанол (3 × 2 мин).
Для активации Fmoc-производных аминокислот DIPCDI/HOBT-методом к раствору 10 экв. (1.1 ммоль) Fmoc-защищенной аминокислоты и 149 мг (10 экв., 1.1 ммоль) HOBt в 3–4 мл DMF добавляли 172 мкл (10 экв., 1.1 ммоль) DIPCDI, раствор перемешивали 10 мин.
Полноту протекания реакции конденсации контролировали с помощью нингидринового или, в случае N-концевого пролина, пикринового тестов после операции 6 синтетического протокола.
Для реакции отщепления пептида от полимера и одновременного деблокирования защитных групп боковых цепей аминокислот отбирали 300 мг пептидил-полимера. К пептидил-полимеру приливали 5 мл смеси TFA–EDT–DMS–м-крезол в объемном соотношении 91 : 3 : 3 : 3, суспензию перемешивали в течение 2 ч, полученный раствор пептида отфильтровывали от полимера, промывали 5 мл TFA и избыток TFA упаривали при пониженном давлении. Пептид осаждали 100 мл этилового эфира, отфильтровывали и промывали эфиром (5 × 20 мл). Осадок растворяли в 5 мл 10% AcОH 20 мин, отфильтровывали и промывали 5 мл 10% AcОH. Полученный раствор пептида лиофилизировали. Сухой пептид обессоливали на колонке (2.5 × 60 см) с Сефадексом G-10 в 0.1 М AcOH. Очистку пептида проводили с помощью обращенно-фазовой ВЭЖХ в градиенте ацетонитрила (от 10 до 70% за 60 мин) в 0.1% TFA при расходе элюента 4 мл/мин, поглощение элюата регистрировали при длине волны 226 нм. Фракции, соответствующие основному пику на хроматограмме, собирали и лиофилизировали. Пептид анализировали с помощью аналитической ВЭЖХ и масс-спектрометрии. Аналитическую обращенно-фазовую ВЭЖХ проводили в градиенте ацетонитрила в 0.1% TFA (от 10 до 70% за 60 мин) при расходе элюента 1 мл/мин.
Микробные культуры и тестируемые соединения. Бактериальная культура S. aureus Wood 46 (клинический изолят из коллекции культур ФГБНУ НИИВС им. И.И. Мечникова) была использована для определения антибактериального действия пептида SE-33. Антифунгальное действие и определение МПК пептида SE-33 проводили с использованием дрожжевой культуры C. albicans ATCC 14053, а также различных видов клинически значимых дрожжевых изолятов C. albicans № 927, Cryptococcus neoformans № 3465, Rhodotorula mucilaginosa № 132, Trichosporon cutaneum № 18, Geotrichum sp. № 1206, полученных из коллекции ФГБНУ НИИВС им. И.И. Мечникова. Штамм C. albicans № 927 был использован также для заражения животных.
Культуру дрожжей C. albicans ATCC 14053, используемую для определения МПК, выращивали и хранили на плотных питательных средах (агар Сабуро) в виде скошенных столбиков, залитых 50% раствором глицерина, при –70°С. Непосредственно перед постановкой эксперимента для получения свежей культуры C. albicans ее пересевали на агаровые скошенные столбики со средой Сабуро и выращивали в течение 24 ч при 35°С.
Дрожжевые культуры, используемые для блиц-опытов in vitro и экспериментов in vivo, поддерживали путем периодических пересевов на плотной среде Сабуро при температуре 28°С. Использовали экспоненциально растущие культуры. Заражение мышей проводили культурой C. albicans № 927, разведенной в физиологическом растворе (0.85% NaCl) до концентрации 106 КОЕ/мл.
В экспериментах по изучению антимикробного действия пептида SE-33 контрольными соединениями служили кателицидин – препарат LL-37, полученный при помощи твердофазного пептидного синтеза, а также противогрибковые антибиотики амфотерицин В (Sigma, США) и пимафуцин (“Pimafucin” Astellas, Нидерланды).
Приготовление растворов соединений для биологического тестирования. Исходные концентрированные растворы кателицидина (препарат LL-37) и синтетического пептида SE-33 готовили либо в стерильной воде, либо в стерильном фосфатно-солевом буфере (PBS) рН 7.4. Концентрация маточных растворов для экспериментов с бактериальной культурой S. aureus составляла 1 мг/мл, для блиц-экспериментов с дрожжевыми культурами –1, 3 и 10 мг/мл, а для определения МПК в экспериментах с C. albicans ATCC 14053 5–64 мг/мл. Растворы тестируемых соединений готовили непосредственно перед использованием.
Исходные концентрированные растворы служили основой для получения серий двукратных разведений тестируемых веществ, подготавливаемых либо в стерильной дистиллированной воде, либо в стерильном PBS при постановке экспериментов с S. aureus, либо в питательной среде RPMI 1640 при постановке экспериментов с грибными культурами. Среду RPMI 1640 с L-глутамином, без бикарбоната натрия, готовили из сухой среды (ICN Biomedicals Inc., Ohio, США) путем разведения в дистиллированной воде, последующего забуферивания с использованием 0.165 М морфолинпропансульфоновой кислоты (MOPS; ACROS ORGANICS, New Jersey, США) и доведения кислотности среды до рН 7.0 путем добавления 1 М раствора NaOH, после чего стерилизовали фильтрацией под давлением через фильтры Sterivex-GV 0.22 мкм (Millipore, США).
Для изучения действия SE-33 на животных препарат пептида готовили за сутки до первого введения животным путем растворения навески вещества в заранее подготовленном 2% водном геле гидроксипропилметилцеллюлозы (Shin-Etsu Chemical, Япония) в концентрациях 1, 10 и 50 мг/мл.
Амфотерицин В (Sigma, США) (Am B), используемый для определения МПК in vitro в качестве препарата сравнения, растворяли в DMSO в начальной концентрации 1.6 мг/мл (1.7 мМ). Серии двукратных разведений этого антибиотика готовили в DMSO (от 1.6 до 0.0125 мг/мл). В дальнейшем, когда при постановке эксперимента проводилось 100-кратное разведение препарата средой RPMI 1640, происходило снижение содержания растворителя (DMSO) до 1%.
Оценка антифунгальной активности пептида SE-33, определение его МПК в экспериментах in vitro. Оценку антифунгальной активности испытуемых соединений и определение их МПК в отношении дрожжевых культур проводили с использованием микро-метода, в соответствии с требованиями Института клинических и лабораторных стандартов (CLSI/NCCLS) и методическими указаниями по изучению противогрибковой активности фармакологических веществ [22–24]. Культивирование дрожжевых культур проводили в стерильных 96-луночных пластиковых планшетах (Медполимер, Россия).
При постановке эксперимента с культурой C. albicans ATCC 14053 к серии двукратных разведений тестируемых препаратов в стерильной воде добавляли стандартную среду RPMI 1640, что приводило к разведению препарата сначала в 50 раз, а при последующем внесении микробного инокулята – в 100 раз при конечном объеме суспензии в лунке – 200 мкл. Концентрация полипептида SE-33 в опыте после внесения микробных клеток составляла в различных экспериментах от 2.0 мкг/мл до 2 мг/мл, для амфотерицина В – от 16 до 0.125 мкг/мл. Конечная концентрация дрожжевых клеток в опыте, проверяемая путем высева клеток на агар Сабуро и подсчета выросших колоний, составляла 1–2 × 103 КОЕ/мл.
В ряде экспериментов в целях увеличения конечной концентрации полипептида SE-33 серии двукратных разведений препарата, приготовленные из маточных растворов, подвергали разведению средой RPMI 1640 не в 100, а в 25 раз, что позволяло довести максимальную конечную концентрацию полипептида SE-33 до 8 мг/мл.
Эксперименты повторяли 5 раз с интервалом в 5–7 сут. В каждом эксперименте препарат полипептида SE-33 и контрольный препарат амфотерицина В были использованы не менее, чем в трех повторах. В панель эксперимента в качестве контроля были включены лунки, не содержащие тестируемых препаратов или растворителя.
Планшеты инкубировали в термостате во влажной камере в темноте при 35°С без встряхивания от 24 до 48 ч.
Рост культур оценивали визуально с применением 4-ступенчатой шкалы: 0 = оптическая прозрачность, полное отсутствие роста, 1 = сильное подавление роста (25% от уровня контроля), 2 = = существенное подавление роста (50% от уровня контроля), 3 = слабое подавление роста (75% от уровня контроля), 4 = отсутствие подавления роста [23, 24].
Для более детальной оценки противогрибкового действия проводили высев дрожжевых суспензий из отдельных лунок на чашки Петри с агаризованной средой Сабуро и подсчитывали выросшие колонии, что позволяло выявить число колониеобразующих единиц (КОЕ), т.е. число жизнеспособных клеток.
МПК полипептида SE-33 определяли после 24 ч культивирования как минимальную концентрацию препарата, предотвращающую видимый рост тест-организма [22, 24]. МПК90 и МПК50 определяли как концентрацию препарата, вызывавшую подавление роста микробной популяции, соответственно, на 90 и 50%, и оценивали как по 4-ступенчатой шкале роста – уровни 1 и 2, так и по количеству высеваемых микробных клеток (числа КОЕ) [23]. МПК амфотерицина В определяли после 24 ч культивирования как минимальную концентрацию препарата, полностью предотвращающую рост тест-организма.
Статистическую обработку результатов данных исследований проводили с использованием компьютерных программ Statgraf и Microsoft Exсel, рассчитывая медианные и средние арифметические значения, доверительные интервалы и стандартное отклонение. Достоверность различий между средними величинами оценивали с использованием t-критерия Стьюдента (p < 0.05).
Для оценки антифунгальной активности препарата SE-33 в отношении других используемых нами клинически значимых штаммов грибов применяли питательную среду RPMI-1640 (ООО НПП “ПанЭко”, Россия). Конечная концентрация препарата SE-33 в ячейках планшетов с шагом двукратного разведения составила 0.5–1024 мкг/мл, а плотность микробной суспензии – 103 КОЕ/мл. Инкубацию проводили при 32°С в течение 48 ч, результат учитывали по изменению цвета индикатора. Эксперименты проводили дважды с интервалом в 1 неделю.
Оценка антифунгального действия SE-33 в блиц-опытах. Суть блиц-экспериментов состояла в выявлении способности пептида SE-33 вызывать гибель микробных клеток. Растворы препарата SE-33, приготовленные в стерильном физиологическом растворе (0.85% NaCl) в концентрации 1, 3 и 10 мг/мл, помещали по 500 мкл в стерильные 1.5 мл пробирки типа Эппендорф, добавляли 30 мкл культуры C. albicans № 927, находящейся в экспоненциальной фазе роста (конечное содержание клеток в эксперименте 106 КОЕ/мл) и инкубировали 2 ч при 32°С. Затем клетки осаждали центрифугированием (16 000 об./мин, 5 мин), окрашивали 2 мМ раствором бромкрезолового пурпурного в течение 1 ч при 32°С и повторно осаждали, после чего микроскопировали (микроскоп МБИ-6, Россия) и подсчитывали процент окрашенных (погибших) клеток [6].
Оценка антибактериального действия препаратов SE-33 и LL-37 на клетках S. aureus. Антибактериальное действие пептидов в отношении S. aureus оценивали методом проточной цитометрии [25]. Для этого суспензию клеток суточной культуры S. aureus (1 × 108 КОЕ/мл) инкубировали в 0.1 М PBS (рН 7.4) с флуоресцеин изотиоцианатом (FITC, MolecularProbes, США) (1 мг/мл) в темноте при 4°С в течение 16 ч. После 3-кратной промывки клеток центрифугированием в PBS (1000 g, 25 м) и внесения 5% эмбриональной телячьей сыворотки плотность клеточной суспензии доводили до 5 × 108 КОЕ/мл и хранили в пробирках с микробусинами Tru Count “Becton Dickinson” при –70°С. После размораживания клетки двукратно промывали с помощью центрифугирования в PBS и доводили концентрацию клеточной суспензии до 1 × 107 КОЕ/мл.
Для постановки экспериментов использовали 96-луночные планшеты Nunс, США. К суспензии клеток S. aureus (FITC+, 90 мкл) добавляли равный объем препаратов SE-33 или LL-37. Конечная концентрация испытуемых веществ составляла от 0.78 до 50 мкг/мл. Все эксперименты ставились в трех повторах. Контрольные пробы не содержали испытуемых препаратов. Все образцы инкубировали в темноте в течение 3 ч при 37°С, после чего вносили пропидий-йодид (PI, Sigma, США) в конечной концентрации 1 мкг/мл и продолжали инкубацию еще 15 м при комнатной температуре. Окрашенные пробы анализировали в проточном цитометре CellQuest. FACS Calibur, BD Biosciences (Becton Dickinson, США). Погибшие клетки S. aureus идентифицировали как FITC+PI+ события, живые клетки – как FITC+PI–. Определяли процент погибших клеток по отношению ко всем клеткам и рассчитывали средние значения. Учитывали также спонтанную гибель клеток: из числа всех погибших клеток вычитали процент клеток, погибших в отсутствие пептидов. Далее методом Рида и Менча с помощью программы Excel определяли полумаксимальную эффективную концентрацию (ЕС50) для пептидов LL-37 и SE-33.
Изучение антимикробной активности пептида SE-33 в экспериментах in vivo. Лабораторные животные. Опыты проводили на 140 самках белых беспородных мышей. В начале работы мыши в возрасте 8 недель имели массу тела 18.2–20.5 г и акклиматизировались к новым условиям содержания в течение 5 дней до начала эксперимента. Группы мышей сформированы из расчета по 20 животных в каждой группе. Все манипуляции с животными проводили в соответствии с правилами Этического Комитета Минздрава России.
В течение эксперимента состояние мышей регистрировали один раз в день. В частности, оценивали изменения со стороны кожи, шерсти, двигательной активности и поведения. Клетки с животными открывали, чтобы получить ясную оценку активности мышей. Запланированную эвтаназию осуществляли передозировкой CO2, сопровождаемой цервикальной дислокацией (вторичный способ эвтаназии согласно требованиям Этического Комитета). Эвтаназия была выполнена спустя 5 недель после начала экспериментов. Мышей, подвергнутых незапланированной эвтаназии, не было.
Модель вульвовагинального кандидоза (ВВК). Моделирование ВВК проводили по методу Фиделя [26] в собственной модификации, при которой предварительная эстрогенизация животных осуществлялась втиранием эстрадиола в кожу брюшка, вместо его подкожного введения. В процессе эксперимента мышей эстрогенизировали трижды (табл. 3) путем втирания 200 мг трансдермального геля “Эстрожель” (“Oestrogel”, Besins Healthcare, S.A., Бельгия), что соответствует примерно 0.125 мкг эстрогена. Заражение животных проводили путем однократного интравагинального введения 20 мкл суспензии клеток дрожжей C. albicans в физиологическом растворе, в концентрации 106 КОЕ/мл. “Лечение” животных препаратами проводили путем интравагинального введения гелей (в случае пимафуцина – крема) в течение 5 дней, объем пробы 20 мкл. Гели, содержащие исследуемый пептид, готовили за сутки до первого введения животным путем растворения навески вещества в заранее подготовленном 2% водном геле гидроксипропилметилцеллюлозы (Shin-Etsu Chemical, Япония) в концентрациях 0, 1, 10 и 50 мг/мл (табл. 4).
Забор материала для высевов проводили трижды путем интравагинального введения стерильной одноразовой микробиологической петли диаметром 1 мм, двукратного прокручивания ее и суспендирования содержимого петли в 200 мкл стерильного физраствора в пробирке Эппендорф. После этого производили высевы по 10 мкл из каждой пробирки на чашки Петри со средой Сабуро. Чашки инкубировали 1 сут при 32°С, после чего учитывали выросшие колонии дрожжей.
Количество выросших в результате высевов колоний подсчитывали и заносили в таблицу по стадиям эксперимента, после чего проводили статистическую обработку данных. Статистический анализ разницы между опытными и контрольными группами проводили с помощью программ Microsoft Excel, Origin Pro 7.5 и Sigma Plot 11.0 с использованием статистических тестов Вилкоксона (Wilcoxon Signed Rank Test), Даннета (Dunnett’s post hoc test) и дисперсионного анализа (ANOVA) p < 0.01 – p < 0.1. Подсчитаны медианы значений высевов в каждой группе, доля полностью излеченных животных, а также коэффициенты корреляции между данными показателями и концентрациями SE-33 во вводимых препаратах.
Список литературы
Bahar A.A., Ren D. // Pharmaceuticals. 2013. V. 6. P. 1543–1575.
Арзуманян В.Г., Кабаева Т.И. // Экспериментальная и клиническая дерматокосметология. 2008. С. 47–52.
Dürr U.H., Sudheendra U.S., Ramamoorthy A. // Biochim Biophys Acta. 2006. V. 1758. № 9. P. 1408–1425.
Gorr S.U. // Frontiers of Oral Biology. 2012. V. 15. P. 84–98.
Valore E.V., Park C., Igreti S.L., Ganz T. // J. Obstet. Gynecol. 2002. V. 187. № 3. P. 561–568.
Arzumanian V., Malbakhova E., Vartanova N. // A Search for Antibacterial Agents. 2012. Chapter 8. P. 125–146. ISBN: 978-953-51-0724-8 https://doi.org/10.5772/34277
Wojnar P., Dirnhofer S., Ladurner P., Berger P., Red B. // J. Histochem. Cytochem. 2002. V. 50. № 3. P. 433–435.
López-García B., Lee P., Gallo R. // J. Antimicrob. Chemotherapy. 2006. V. 57. P. 877–882.
Bals R. // Respiratory Research. 2000. V. 1. P. 141–150.
Zasloff M. // The New England Journal of Medicine. 2002. V. 347. P. 1199–1200.
Dale B.A., Fredericks L.P. // Curr. Issues Mol. Biol. 2005. V. 7. P. 119–133.
Levy O. // Blood. 2000. V. 96. P. 2664–2672.
Reinholz M., Ruzicka T., Schauber J. // Ann. Dermatol. 2012. V. 24. P. 126–135.
Murakami M., Ohtake T., Dorschner R.A., Schittek B., Garbe C., Gallo R.L. // See comment in PubMed Commons below J. Invest. Dermatol. 2002. V. 119. P. 1090–1095.
Xhindoli D., Pacor S., Benincasa M., Scocchi M., Gennaro R., Tossi A. // Biochim. Biophys. Acta. 2016. V. 1858. P. 546–566.
Bucki R., Leszczyńska K., Namiot A., Sokołowski W. // Arch. Immunol. Ther. Exp. (Warsz). 2010. V. 58. P. 15–25.
Tsai P.W., Cheng Y.L., Hsieh W.P., Lan C.Y. // J. Microbiol. 2014. V. 52. P. 581–589.
Swidergall M., Ernst J.F. // Eukaryot. Cell. 2014. V. 13. P. 950–957.
Den Hertog A. L., van Marle J., van Veen H.A., Van’t Hof W., Bolscher J.G., Veerman E.C., Nieuw Amerongen A.V. // Biochem. J. 2005. V. 388 (Pt. 2). P. 689–695.
Lagunin A., Ivanov S., Rudik A., Filimonov D., Poroikov V. // Bioinformatics. 2013. V. 29. P. 2062–2063.
Dean S.N., Bishop B.M., van Hoek M.L. // BMC Microbiology. 2011. V. 11:114. http://www.biomedcentral.com/1471-2180/11/114.
CLSI M27-S3. Reference method for broth dilution antifungal susceptibility testing of yeasts. Clinical and Laboratory Standards Institute. Pensylvania, 2013.
CLSI M38-A2. Ed. 2. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi. Approved standart. Clinical and Laboratory Standards Institute. Pensylvania, 2008.
Кубанова А.А., Степанова Ж.В., Гуськова Т.А., Пушкина Т.В., Крылова Л.Ю., Шилова И.Б., Тренин А.С. // Методические указания по изучению противогрибковой активности фармакологических веществ. Руководство по проведению доклинических исследований лекарственных средств. Часть 1 / Ред. Миронова А.Н. М.: Гриф и К., 2012. С. 576–584.
Будихина А.С., Макаров Е.А., Пинегин Б.В. // Иммунология. 2011. Т. 32. С. 35–37.
Fidel P.L., Jr., Sobel J.D // Experimental models in antimicrobial chemotherapy / Eds. Zak O. and Sande M. 2nd ed. London: United Kingdom Academic Press, Ltd. 1999. P. 741–748.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия





