Биоорганическая химия, 2019, T. 45, № 3, стр. 238-251
Современные направления разработки новых средств для лечения мигрени. Акцент на антагонисты 5-HT2A-рецепторов
А. А. Спасов 1, 2, Д. С. Яковлев 1, 2, А. А. Бригадирова 1, 2, *, Д. В. Мальцев 1, 2, Я. В. Агацарская 1, 2
1 Государственное бюджетное учреждение Волгоградский медицинский научный центр
400131 Волгоград, пл. Павших Борцов, 1, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования “Волгоградский государственный медицинский университет” Министерства здравоохранения Российской Федерации
400131 Волгоград, пл. Павших Борцов, 1, Россия
* E-mail: a.brigadirova@gmail.com
Поступила в редакцию 03.04.2018
После доработки 14.05.2018
Принята к публикации 02.08.2018
Аннотация
Обзор посвящен перспективным направлениям поиска химических соединений, на основе которых могут быть созданы новые лекарственные препараты для терапии мигрени. Рассматриваются перспективные биологические мишени, воздействие на которые способно устранять проявления острого приступа мигрени, а также указываются основные существующие разработки в виде химических соединений и опытных образцов лекарственных средств, взаимодействующих с данными мишенями, включая те, которые скоро войдут или уже находятся на стадии клинических испытаний. В частности, обсуждаются доклинические и клинические данные о соединениях, эффекты которых обусловлены влиянием на рецепторы к кальцитонин-ген-связанному пептиду (calcitonin gene-related peptide, CGRP), серотониновые 5-HT2A- и 5-HT1F-рецепторы, на NO-синтазу, орексиновые и глутаматные рецепторы. Особое внимание в обзоре уделяется описанию 5-HT2А-рецепторов как перспективной мишени для разработки новых противомигренозных препаратов. Приводится информация об особенностях строения данного подтипа серотониновых рецепторов, их локализации и функции, а также затрагиваются фармакологические возможности новых веществ, воздействующих на 5-HT2A-рецепторы. Заключительная часть обзора посвящена новым направлениям поиска 5-НТ2A-антагонистов среди соединений, синтезированных на основе биоизостера серотонина – бензимидазола.
ВВЕДЕНИЕ
Мигрень относится к распространенным хроническим нейроваскулярным заболеваниям и характеризуется приступами тяжелой головной боли и нарушениями автономной нервной системы, приводящими к снижению работоспособности и ухудшению качества жизни пациентов [1, 2]. По данным Всемирной организации здравоохранения, мигрень находится на шестом месте в мире среди состояний, ведущих к потере трудоспособности, и является самым инвалидизирующим среди всех неврологических расстройств [1].
В отличие от других типов головной боли мигрень представляет собой повторяющиеся эпизодические приступы пульсирующей часто односторонней головной боли умеренной и высокой интенсивности продолжительностью от 4 до 72 ч, которая, как правило, сопровождается тошнотой, фоно- и фотофобией [3].
От одной четверти до одной трети общего числа пациентов с мигренью составляют пациенты с преходящими очаговыми неврологическими симптомами, возникающими перед или в самом начале отдельных приступов мигренозной головной боли, которые в совокупности обозначаются термином “аура” [4]. Так, согласно Международной классификации головных болей (The International Classification of Headache Disorders) в диагностические критерии мигрени с аурой включены зрительные (моно- и бинокулярные), сенсорные, речевые, моторные и стволовые симптомы [5].
Этиология и патогенез мигрени до конца не выяснены. Несмотря на то что изучение молекулярных факторов, вовлеченных в ее патогенез, еще продолжаeтся, в результатах последних доклинических и клинических исследований явно прослеживается корреляция между развитием приступа мигрени и высвобождением нейротрансмиттеров и вазоактивных субстанций, таких как 5-гидрокситриптамин (5-HT, серотонин), кальцитонин-ген-связанный пептид (calcitonin gene-related peptide, CGRP) и дофамин [2].
В развитии приступа мигрени принимают участие нейроваскулярные факторы. Согласно нейрогенной теории, симптомы ауры возникают в результате распространяющейся корковой депрессии, которая вызывает сначала увеличение нейрональной активности, затем ее уменьшение. Этот процесс, начинаясь в затылочной коре, распространяется далее на соматосенсорную кору, вызывая зрительные, сенсорные и моторные симптомы мигренозной ауры [6]. Возникновение мигренозной боли связано с активацией тригеминоваскулярной системы, которая стимулирует высвобождение воспалительных нейропептидов [CGRP, субстанции P, нейрокинина А и гипофизарно-аденилатциклазного активирующего пептида (pituitary adenylate cyclase-activating peptide, PACAP)] в ноцицептивных нервных окончаниях тройничного нерва, в первую очередь на сосудах твердой мозговой оболочки. Это приводит к вазодилатации, увеличению проницаемости сосудистой стенки и проникновению альгогенных веществ плазмы крови в околососудистое пространство – формированию нейрогенного воспаления. Именно с возникновением нейрогенного воспаления вокруг сосудов твердой оболочки и связано чувство боли при мигрени [1, 6].
Также первостепенная роль в формировании мигренозной головной боли отводится серотонину. Это связывают с усилением активации тромбоцитов перед началом приступа и уменьшением концентрации тромбоцитарного серотонина; высвободившийся серотонин вызывает констрикцию крупных артерий и вен и расширение капилляров. Далее, благодаря усилению экскреции серотонина почками, его содержание в плазме крови падает, что приводит к вазодилатации [1, 7, 8].
В настоящее время спектр препаратов для симптоматической терапии мигренозного приступа и для профилактики мигрени составляют следующие группы: неспецифические препараты I линии для терапии острого болевого приступа (опиоидные наркотические анальгетики, нестероидные противовоспалительные средства и противорвотные средства), специфические противомигренозные препараты II линии для лечения мигренозной атаки [эрготамины и триптаны (агонисты 5-HT1B/1D рецепторов)], препараты для профилактики приступа мигрени [антиконвульсанты, антидепрессанты, β-адреноблокаторы, миорелаксанты (ботулинический токсин типа А), блокаторы кальциевых каналов] [9–11].
Следует отметить, что доступное лечение острых приступов и превентивная терапия мигрени являются или недостаточно эффективными, или плохо переносятся пациентами [12]. Таким образом, с учетом результатов современных научных исследований в области этиологии и патогенеза мигрени, поиск новых мишеней для создания инновационных противомигренозных препаратов является актуальной задачей. Данный обзор посвящен анализу разработок лекарственных средств, механизм действия которых опосредован влиянием на указанные мишени, с акцентом на серотониновые рецепторы.
ПОТЕНЦИАЛЬНЫЕ МИШЕНИ ДЛЯ РАЗРАБОТКИ НОВЫХ ПРОТИВОМИГРЕНОЗНЫХ СРЕДСТВ
Рецепторы к CGRP
К перспективной мишени для лечения мигрени относят рецептор к CGRP. Выброс этого пептида происходит в ответ на активацию тригеминоваскулярной системы как в начале приступа мигрени [13], так и в его последующие стадии [14]. CGRP синтезируется в окончаниях чувствительных нейронов, в том числе нейронов тригеминального ганглия, и в периваскулярных нервных волокнах, окружающих менингеальные сосуды, а также в каудальном тригеминальном ядре и дорсальных корешковых ганглиях и является сильным вазодилататором церебральных сосудов и провоспалительным нейропептидом [15, 16]. Рецепторы к CGRP были найдены во многих областях головного мозга, включая центральную тригеминоваскулярную систему [14].
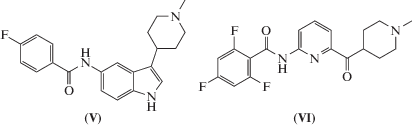
Антагонисты CGRP-рецепторов (гепанты) являются новым классом противомигренозных препаратов. Согласно проведенным клиническим испытаниям соединений BIBN4096BS (олсегепант), MK-0974 (телсагепант), MK-3207 и BI 44370 TA, структуры которых представлены на рис. 1, эффективность данного класса лекарственных средств в терапии острых приступов мигрени подтвердилась, однако дальнейшие исследования были прекращены в связи с выявлением у них гепатотоксичности [2, 17]. Относительно новым является направление по созданию гуманизированных антител к молекуле CGRP или его рецептору, однако их действие будет направлено только на превентивную терапию мигрени. В настоящее время для трех препаратов моноклональных антител к CGRP – LY2951742, ALD403, LBR-101, успешно завершены клинические испытания II фазы и продолжаются клинические исследования III фазы [2, 10, 14, 15].
Рис. 1.
Ингибиторы рецептора к CGRP: BIBN4096BS (олсегепант) (I), MK-3207 (II), MK-0974 (телсагепант) (III), BI 44370 TA (IV).

В ноябре 2017 года в работе [18] опубликовано сообщение об успешно завершенной III фазе клинических испытаний препарата эренумаба на основе моноклонального антитела к CGRP. Авторы отметили, что на фоне приема эренумаба среднее количество дней с мигренью в месяц у пациентов уменьшилось наполовину. В мае 2018 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (U.S. Food and Drug Administration, FDA) одобрило применение эренумаба под торговым названием Аймовиг® для превентивной терапии мигрени у взрослых.
NO-синтаза
Информация о способности доноров оксида азота вызывать приступы мигрени у пациентов стала причиной для изучения противомигренозной активности блокаторов NO-синтазы [15, 19]. Исследователи пришли к выводу, что продукция NO в тригеминоваскулярной области и, потенциально, в других областях мозга может приводить к развитию приступов мигрени, так что угнетение данного процесса могло оказаться терапевтически полезным [17, 19]. Однако результаты доклинических исследований показали, что ингибиторы индуцибельной NO-синтазы неэффективны в плане терапии мигрени. Большие надежды возлагаются на синтез и разработку селективных ингибиторов нейрональной NO-синтазы для лечения мигрени, так как именно данная изоформа NO-синтазы с наибольшей вероятностью вовлекается в процессы тригеминоваскулярной трансмиссии и центральной сенситизации.
Соединение NXN-188 (структура не раскрывается), новый комбинированный ингибитор нейрональной NO-синтазы и агонист 5-HT1B/1D-рецептора, угнетает высвобождение CGRP, индуцированное введением хлорида калия, капсаицина и резинифератоксина в ассоциированные с мигренью ткани мозга крыс в исследованиях in vitro, и в настоящее время для него закончены клинические испытания II фазы [12, 20]. Однако результаты клинических исследований эффективности данного препарата в терапии острого приступа мигрени противоречивы и требуют дальнейшего уточнения.
Серотониновые 5-HT1F-рецепторы
Активация серотониновых 5-HT1F-рецепторов приводит к снижению в каудальном тригеминальном ядре экспрессии гена раннего реагирования c-fos (маркера нейрональной активации), не сопровождаемому сосудистыми эффектами. Поэтому селективные агонисты 5-HT1F-рецепторов, “дитаны” (рис. 2), относятся к новому классу препаратов для лечения острой мигрени без сердечно-сосудистых эффектов, свойственных триптанам [10, 13].
Первым испытанным соединением с селективной агонистической активностью к 5-HT1F-рецепторам является LY333470. По результатам II фазы клинических испытаний исследователи сообщили об эффективности LY333470 в терапии острого мигренозного приступа, но у него были выявлены серьезные побочные эффекты со стороны центральной нервной системы: астения, сонливость и головокружение. Дальнейшее изучение LY333470 было остановлено из-за выявленных токсических эффектов при долгосрочных исследованиях на животных [19]. Для другого селективного 5-HT1F-агониста ласмидитана (COL-144) успешно завершена II фаза клинических испытаний и продолжается III фаза [12].
Орексиновые рецепторы
Орексиновый рецептор – относительно новая мишень, ассоциированная с лечением мигрени. В работу орексинергической системы вовлечены два нейропептида – орексин А и орексин B, которые синтезируются в гипоталамусе и играют важную роль в ноцицепции, в дополнение к их участию в регуляции аппетита и сна. Установлено, что изменение уровня орексинов наблюдается при большинстве хронических форм мигрени [10, 17].
Соединение MK-6096, названное филорексантом (рис. 3), представляет собой двойной антагонист рецепторов к орексинам А и В, который изначально предлагался для лечения бессонницы; в качестве средства для профилактики мигрени данный препарат к настоящему времени завершил клинические испытания фазы IIa, однако оказался неэффективным [21].
Глутаматные рецепторы
Глутамат высвобождается из нейронов тригеминального ганглия, на которых экспрессируются 5-HT1B/1D/1F-рецепторы, и вовлекается в патофизиологические процессы мигрени, а также и ее ауры, включающие тригеминоваскулярную активацию, центральную сенситизацию и корковую распространяющуюся депрессию [13]. Дизоцилпин (MK-801), антагонист рецепторов N-метил-D-аспартата (NMDA), и GYKI-52466, антагонист рецепторов α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA), (см. рис. 4) способны подавлять тригеминоваскулярную ноцицептивную передачу в тригеминоваскулярном комплексе [17]. Во II фазе клинических испытаний продемонстрирована эффективность тезампанела (LY-293558) (рис. 4) – антагониста AMPA-рецепторов и каинатных рецепторов, в терапии острой мигрени без ауры. Для расеглуранта (ADX-10059) (рис. 4), негативного аллостерического модулятора метаботропных глутаматных рецепторов (типа 5), также выявлена эффективность в терапии острой мигрени без ауры, однако мультицентровое исследование эффективности препарата было остановлено в связи с повышением уровня печеночных ферментов на фоне его приема. Селурампанел (BGG492) (рис. 4), антагонист AMPA-рецепторов, изучался в качестве средства для лечения острого приступа мигрени, однако его эффективность оказалась статистически незначимой [22].
Катионный канал, действующий по механизму транзиторного рецепторного потенциала (Transient receptor potential cation channel, TRP-канал)
TRP-каналы представляют собой группу близких по структуре, но различных по функциональному назначению ионных каналов, которые обеспечивают чувствительность к широкому спектру физических стимулов, таких как свет, давление, температура, а также к химическим стимулам, например капсаицину. Данные каналы экспрессируются в нервных окончаниях твердой мозговой оболочки, в том числе и тех, которые содержат CGRP, и вовлекаются в механизмы формирования боли. Такие каналы, как катионный канал, действующий по механизму транзиторного рецепторного потенциала, подсемейство А, член 1 (Transient receptor potential cation channel, subfamily A, member 1, TRPA1) и катионный канал, действующий по механизму транзиторного рецепторного потенциала, подсемейство V, член 1 (Transient receptor potential cation channel, subfamily V, member 1, TRPV1) были обнаружены в тригеминальном ганглии, где они солокализуются с CGRP и играют важную роль в патогенезе мигренозной головной боли. Несколько активаторов TRPA1-каналов также могут играть роль пусковых факторов острого приступа мигрени. Более того, некоторые противомигренозные препараты могут блокировать или снижать их чувствительность. Первым антагонистом TRPV1-каналов является соединение под шифром SB-705498, для которого в доклинических исследованиях выявлена способность предотвращать развитие центральной сенситизации. Однако результаты недавних доклинических и клинических исследований антагонистов TRPV1-каналов оказались неудовлетворительными [15].
5-HT2А-РЕЦЕПТОРЫ КАК ПЕРСПЕКТИВНАЯ МИШЕНЬ ДЛЯ РАЗРАБОТКИ НОВЫХ ПРОТИВОМИГРЕНОЗНЫХ СРЕДСТВ
Перспективное клиническое направление использования 5-HT2A-антагонистов связано с вовлеченностью 5-HT2A-рецепторов в патогенез развития мигрени и в формирование спазма мозговых артерий в первой фазе приступа [23].
Центральная роль в регуляции тонуса церебральных сосудов отводится моноаминергическим системам. При этом одной из главных регуляторных систем является серотонинергическая, нарушение функций которой лежит в основе ряда цереброваскулярных патологий [24, 25]. При высвобождении в системный кровоток серотонин активирует многочисленные прямые и рефлекторные реакции. В первой фазе происходит активация 5-НТ3-рецепторов парасимпатических волокон и запускается так называемый рефлекс фон Безольда-Яриша, приводящий к выраженной брадикардии и падению системного артериального давления. Во второй фазе активация 5-HT2A-рецепторов вызывает вазоконстрикцию, однако, она вносит намного меньший вклад в величину системного артериального давления и маскируется парасимпатическими эффектами. С другой стороны, такой периферический спазм совместно с понижением артериального давления существенно изменяет гемодинамику в сосудах головного мозга [26, 27].
Особенности строения 5-HT2A-рецепторов
5-HT2A-рецепторы, краткая характеристика которых приведена в табл. 1, являются одним из трех (A, B и C) подтипов семейства 5-HT2-рецепторов. Их наибольшая плотность отмечается в переднем мозге, особенно в корковом слое, в том числе префронтальной коре [31], интернейронах и пирамидных нейронах, а также парагиппокампальной извилине, зубчатой извилине гиппокампа, обонятельной луковице, задних рогах спинного мозга. Кроме того, высокая плотность 5-HT2А-рецепторов наблюдается за пределами центральной нервной системы: в седалищном нерве, шванновских клетках, предсердиях, коронарных артериях, сосудах мозга, тромбоцитах [32].
Таблица 1.
| Неноменклатурные и устаревшие названия | D-Рецептор (до 1991 г.), 5Ht-2, серотониновый 5HT-2 рецептор, серотониновый рецептор 2А | |
|---|---|---|
| Хромосомная локализация | Человек | 13q14-q21 |
| Мышь | 14 D2 | |
| Крыса | 15q11 | |
| Вторичная сигнальная система | Gq/11 | ↑Фосфолипаза С |
| Gi/o | ↓Аденилатциклаза | |
| Основные агонисты | DOI (1-(4-йодо-2,5-диметоксифенил)пропан-2-амин), DOB (1-(4-бромо-2,5-диметоксифенил)пропан-2-амин), LSD ((+)-лизергиновой кислоты диэтиламид), метилергоновин, бромамфетамин, эрготамин, S16924, 2-(5-метокси-1H-индол-3-ил)этиламин | |
| Основные антагонисты | Кетансерин, анансерин, ципрогептадин, AC90179, сертиндол, рисперидон, MDL 100907 | |
| Влияние 5-HT2A-агонистов/антагонистов на высвобождение нейромедиаторов | ↑Глутамат ↑Дофамин |
|
5-HT2A-рецепторы принадлежат к семейству родопсиноподобных рецепторов, сопряженных с G-белком, и являются семидоменными трансмембранными (ТМ) белками. В структуре данных рецепторов содержатся α-спирали, которые семикратно пронизывают клеточную мембрану (ТМ-домены). Группы доменов соединены длинными цепочками белков, три петли которых направлены во внеклеточное пространство, а три – в сторону цитозоля. Третья внутриклеточная петля предназначена для связывания с G-белком. Отмечается, что каждый из ТМ-сегментов состоит из 25–27 а.о. Макромолекула рецептора также имеет внеклеточный N- и внутриклеточный С‑концевые участки [33].
Для 5-НТ2А-рецептора описаны несколько основных точек связывания с лигандами: сайт А задействует ряд аминокислот ТМ-доменов III, IV, V и VI; сайт Б – TM доменов I, II, III и VII [33]. Общим для сайтов является именно трансмембранный домен III. Существующие антагонисты проявляют различную степень сродства к указанным сайтам связывания, показана их способность взаимодействовать как с обоими, для кетансерина, так и только с одним (сайт А), для ципрогептадина [34]. В связи с чем, сайт связывания А приобретает особый интерес. Так, выделяется участие остатков Phe339 и Phe340, образующих связь по типу π–π-взаимодействия с арильными кольцами Asn343 [35], кроме того, участие двух остатков Ser в положениях 239 и 242 [36, 37], а также Thr160.
Спиральный (винтовой) карман, предназначенный для связывания лиганда с 5-НТ2А-рецептором, содержит остаток Asp155. Как и у иных рецепторов моноаминов, связанных с G-белком, Asp155 образует солевой мостик с аминогруппой лигандов [35]. Рядом с Asp155 в ТМ III располагается Ser159, с которым связываются лиганды. Вероятно, ТМ III не является единственным при построении связей с антагонистами [38]. Однако, считается, что из всех семи ТМ-сегментов он имеет ключевое значение.
Центральную роль в сигнальном каскаде 5‑HT2A-рецептора играют фосфолипазы С и А2 [35]. Вторичным каскадом, реализуемым через Gi/o-белок, является аденилатциклазный путь. В ряде исследований на культурах клеток было показано, что для одних и тех же 5-HT2A-агонистов в идентичных условиях может быть характерен разный уровень активации и, как следствие, доминирование одного из указанных каскадов [39]. Известно, что для 5-НТ2А-рецептора существуют, помимо механизмов, опосредованных G-белком, также альтернативные механизмы пострецепторной передачи сигнала, одним из которых является β-аррестиновый путь [40].
Локализация, функции 5-HT2A-рецепторов и их фармакологический потенциал
Указанные особенности патогенеза нарушений мозгового кровообращения, опосредованных действием серотонина, предположительно определяют способность 5-НТ2А-антагонистов устранять констрикторные эффекты серотонина, оказываемые на церебральные сосуды.
Считается, что, 5-HT2-рецепторы являются посредниками в развитии ноцицептивного эффекта серотонина [41], а ряд агонистов этих рецепторов способен провоцировать приступы головной боли как у пациентов с хронической формой мигрени, так и у здоровых лиц. Предположительно, частая активация 5-HT2A-рецепторов приводит к выбросу провоспалительных субстанций из первичных афферентных окончаний тройничного нерва, а увеличение количества рецепторов является фактором хронизации головной боли [25].
Периферические 5-HT2A-рецепторы также принимают непосредственное участие в возбуждении афферентных ноцицептивных волокон. При этом их блокада антагонистами способствует значимому уменьшению болевой чувствительности, в частности в условиях экспериментальной термической [42] и провоспалительной гипералгезии [43]. Подобные выводы об уменьшении провоспалительной болевой импульсации в патогенезе мигренозного приступа были получены и при использовании лекарственных препаратов с 5-HT2/2A-антагонистическим действием – ципрогептадина и пизотифена [25].
К другим значимым физиологическим эффектам, опосредуемым действием 5-HT2A-рецепторов, относятся регуляция функций тромбоцитов, сердечно-сосудистой и центральной нервной систем. В тромбоцитах активация 5-HT2A-рецепторов приводит к увеличению свободного внутриклеточного кальция и проагрегантному действию. Аналогичный вторичный сигнальный механизм способствует повышению сократительной активности гладкомышечного слоя коронарных сосудов и сосудов головного мозга. Отмечено, что активация 5-HT2A-рецепторов приводит к увеличению частоты сердечных сокращений у крыс [44]. Считается, что в большинстве артерий развитие сокращения, опосредуемого влиянием серотонина на 5-HT2A-рецепторы гладкомышечного сосудистого слоя, происходит не только при активации протеинкиназы С, но и при активации Rho-киназного пути, который задействован в фосфорилировании легких цепей миозина и фосфатазы легких цепей миозина [45].
В центральной нервной системе 5-HT2A-рецепторы вовлечены в формирование поведенческих реакций, когнитивных процессов, памяти [46–48]. Отмечается влияние их активации на развитие тревоги, страха, панических атак [49].
Считается, что кортикальные 5-НТ2А-рецепторы непосредственно принимают участие в анксиогенезе [50, 51]. Кроме того, большое значение отводится и 5-HT2-рецепторам в миндалевидном теле. Так, было показано, что 5-HT2A-зависимое возбуждение в базолатеральной миндалине хомяков способствует развитию тревожного поведения [52].
В этой связи 5-HT2A-антагонисты все чаще позиционируются в качестве потенциальных агентов для терапии психических расстройств, в том числе для лечения генерализованного тревожного расстройства [53].
Получены результаты исследований анксиолитического потенциала 5-HT2A-антагонистов. В частности, показано, что кетансерин при 14-дневном введении овариоэктомированным пренатально стрессированным самкам крыс оказывает анксиолитический эффект [54]. У крысят-самцов, получавших 5-HT2A-антагонисты: кетансерин или MDL100907 (см. структуры на рис. 5), не развивались тревога и депрессивное поведение, индуцируемые постнатальным введением селективного ингибитора обратного захвата серотонина флуоксетина [55].
Рис. 5.
Структуры основных клинически значимых 5-HT2A-антагонистов: пимавансерин (XIII), кетансерин (XIV), MDL-100907 (XV).

В последние годы появляется большое количество работ, посвященных изучению атипичного антипсихотического [56, 57], а также гипнотического эффектов отдельных 5-HT2A-блокаторов. Высокоселективный инверсный 5-HT2A-агонист пимавансерин (Нуплазид®) (см. рис. 5) был одобрен FDA в 2016 г. в качестве лекарственного препарата для лечения галлюцинаций и бреда при психозах, вызванных болезнью Паркинсона [58, 59].
Результаты отдельных исследований свидетельствуют о том, что активация 5-HT2A-рецепторов может способствовать развитию психостимулирующего эффекта и зрительных галлюцинаций за счет повышения возбудимости корковых нейронов [60]. Частично это подтверждает исторически наиболее ранние исследования D-рецепторов (устаревшее название 5-HT2A-рецепторов), связанные с выявлением галлюциногенного действия диэтиламида лизергиновой кислоты (LSD), 2,5-диметокси-4-бромоамфетамина (DOB), 2,5-диметокси-4-йодоамфетамина (DOI), являющихся неселективными 5-HT2-агонистами. С другой стороны, в настоящее время выдвинута гипотеза, что такое психотическое действие LSD, DOB, DOI может быть результатом повышения чувствительности участка дофаминовых D2-рецепторов, отвечающего за распознавание лигандов, а также за образование активных гетерорецепторных D2/5-HT2A-комплексов [61, 62].
Отмечается участие 5-HT2A-рецепторов в системной терморегуляции у мышей. Интересно, что ни агонисты (DOI), ни антагонисты (кетансерин) 5-HT2A-рецепторов при введении интактным животным не способны изменять температуру тела. При этом в условиях воспалительной реакции, предположительно за счет опосредованного уменьшения активности NO-синтазы, кетансерин вызывает гипотермический эффект [63].
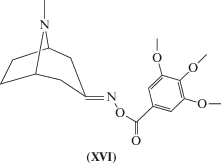
В отечественных исследованиях описано конструирование новых 5-HT-лигандов путем модификации триптаминовых, метоклопрамидных и арилпиперазиновых производных [64]. В настоящее время на стадии клинических испытаний находится вещество с противомигреневой антисеротониновой активностью, производное тропанона – тропоксин (рис. 6), с 5-HT2-антагонистической активностью [65–69].
Таким образом, 5-HT2A-рецептор является одной из перспективных мишеней для создания новых психотропных агентов. Поиск и разработка селективных лигандов к нему представляется необходимым и актуальным, так как 5-HT2A-рецепторы обнаружены во многих областях центральной нервной системы и вовлечены в патофизиологию различных психических расстройств, в процессы обучения и памяти, а также нейрогенеза.
Фармакологические агенты с 5-HT2A-опосредованным действием
На сегодняшний день зарегистрировано большое количество лигандов, проявляющих сродство к серотониновым рецепторам 2А-подтипа. Для их сравнительного анализа были выбраны ряды веществ с высокими показателями сродства к данному рецептору (рис. 7).
Рис. 7.
Химические структуры известных лекарственных средств с 5-HT2A-опосредованным механизмом действия: метисергид (XVII), cарпогрелат (XVIII), ципрогептадин (XIX).

Метисергид является антагонистом серотониновых рецепторов нескольких различных подтипов. Наибольшим сродством он обладает к рецепторам подтипов 5-НТ2С, 5-HT2B, 5-НТ1D, 5-HT2A и 5-НТ1F и в меньшей степени влияет на рецепторы 5-НТ5A, 5-HT6, 5-HT1E, 5-HT7 и 5-HT1B-подтипов [70]. В ряде стран метисергид зарегистрирован в качестве препарата для профилактики мигрени [71].
Кетансерин – соединение, обладающее высоким сродством к 5-НТ2А-рецепторам и Н1-гистаминовым рецепторам. В меньшей степени он влияет на α1,2-адренергические рецепторы. Помимо 2А-подтипа кетансерин проявляет антагонизм к серотониновым рецепторам 1D, 2В, 2С, 6, 7-подтипов и низкое сродство к D1,2-дофаминовым рецепторам [72]. В настоящее время препарат одобрен для применения только в ветеринарии [73].
Ципрогептадин относится к антагонистам H1-гистаминовых рецепторов и 5-НТ2А-рецепторов. По зарегистрированным показаниям ципрогептадин может использоваться в качестве антиаллергического и противомигренозного средства, однако, не является препаратом первого выбора [74]. Среди побочных эффектов, ограничивающих применение препарата по основным показаниям, выделяют сонливость, повышение аппетита и массы тела. Также проводятся клинические исследования ципрогептадина в качестве средства, стимулирующего аппетит у детей с кахексией и недостаточным питанием [75, 76].
Согласно данным литературы, большое количество препаратов с 5-НТ2А-антагонистической активностью являются неселективными и в то же время обладают тропностью к другим рецепторным системам: дофаминовой, гистаминовой, адренергической, холинергической. На данный момент в клинической практике существует лишь несколько препаратов с селективным 5-НТ2А-антагонистическим действием.
Сарпогрелат (Анплаг®) является селективным 5-НТ2А-антагонистом и разрешен к применению в качестве антиагрегантного средства в Японии. Он ингибирует агрегацию тромбоцитов, тем самым улучшая периферическую циркуляцию при терапии ишемических симптомов у пациентов с хронической артериальной обструкцией. Подтверждена его эффективность у пациентов с ишемической болезнью сердца, заболеваниями периферических артерий и сахарным диабетом [77].
Ранее приводилась информация об атипичном антипсихотическом препарате пимавансерине, который является селективным инверсным 5-НТ2A-агонистом и используется для лечения галлюцинаций и бреда при психозах, вызванных болезнью Паркинсона [58, 59].
Новые направления поиска 5-НТ2-антагонистов на основе производных бензимидазола
Анализ строения известных 5-НТ2-антагонистов выявляет для них общие фармакофорные структурные составляющие: конденсированный ароматический бис(три)циклический фрагмент (индольный, бензокс(тиа)азольный, бензодиазепиновый и др.), карбонильная группа, связующая алкильная цепочка и основный третичный амин в виде гидрированного азотистого гетероцикла или диалкиламино группы [78].
Поиск высокоэффективных антагонистов 5‑HT2-рецепторов среди биоизостерных аналогов серотонина – производных бензимидазола достаточно перспективен, так как данные соединения не только отвечают критериям обозначенных выше функционально значимых фармакофорных групп, но и содержат в своей основе “привилегированный фрагмент” с точки зрения разработки биологически активных молекул [79].
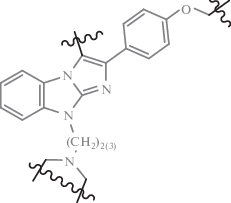
При изучении серии производных арилпиперазин-1-ил-этилбензимидазола (XX) (обобщенная структура приведена на рис. 8) было показано их высокое сродство к сайтам связывания серотониновых 5-HT2А, дофаминовых D2 и α1-адренергических рецепторов мозга крыс, сопоставимое с эталонным препаратом клозапином (8-хлор-11-(4-метил-1-пиперазинил)-5Н-дибензо[b,е][1,4]-диазепин) [80]. Однако только 4-хлор-6-(2-{4-[3-(трифторметил)фенил]пиперазин-1-ил}этил)-1H-бензимидазол, имеющий соотношение активностей связывания (pKi) 5-HT2A/D2 может быть квалифицирован как атипичный нейролептик [81].
В отечественных исследованиях также описано конструирование новых 5-HT-лигандов путем модификации триптаминовых, метоклопрамидных и арилпиперазиновых производных [64]. В настоящее время соединение с противомигреневой антисеротониновой активностью, производное тропанона – тропоксин с 5-HT2-антагонистической активностью находится на стадии клинических испытаний [65–69].
Серия диалкиламинозамещенных бензимидазолов, содержащих в качестве заместителей метил-, метокси-, хлор- в бензольном кольце, морфолин, пиперидин, пирролидин, N-метил-, N‑гидроксиэтилпиперазин в положении 2 бензимидазола, была синтезирована и исследована авторами на наличие 5-HT2A-антагонистических свойств [82]. Однако, только уровень 5-HT2-активности 2-(пиперидин-1-ил)-5-метил-1H-бензимидазола (XXI) (рис. 8) был сопоставим по величине эффекта с препаратом сравнения ципрогептадином. Уровень активности остальных соединений уступал и ципрогептадину, и кетансерину.
При введении ацетамидной группировки в различные гетероциклы были получены соединения с широким спектром фармакологического действия, в том числе с 5-HT2А-антагонистическими свойствами [83]. При исследовании in vitro 5-HT2А-антагонистической активности солей 3-(N,N-диалкилацетамидов)-2-аминобензимидазолия (XXII) (рис. 8) на модели активации тромбоцитов, индуцированной серотонином, авторами показано, что данные вещества в различной степени оказывают некоторое 5-HT2А-антагонистическое действие. Наиболее выраженный эффект был выявлен у соединения (XXIIa) [83], которое подавляло активацию тромбоцитов, индуцированную серотонином, на 47.1% относительно контроля, при этом значительно уступая препарату сравнения кетансерину. Высокое сродство к связыванию с 5-HT2- и D2-рецепторами обнаружено у N-бензизотиазолилпиперазинилбутил 4‑карбоксамидного производного бензимидазола (XXIII) (рис. 8) [84].
Среди трициклических 10-R-2,3,4,10-тетрагидропиримидо[1,2-a]бензимидазолов (XXIV) и 1-R-1,2,3,4-тетрагидропиримидо[1,2-a]бензимидазолов (XXV) (их обобщенные структуры приведены на рис. 8) авторы обнаружили соединения, проявившие умеренное 5-HT2А-антагонистическое действие на модели активации тромбоцитов in vitro, индуцированной серотонином [85, 86]. При этом наиболее высокую активность исследователи отметили у соединения (XXIVa), содержащего 2-гидроксиэтильный радикал в положении 10 [86].
Ряд производных бензимидазола, проявляющих 5-HT2А-антагонистическое действие, относятся к производным трициклических бензимидазольных структур: 1-R-1H-имидазо[1,2-a]бензимидазолы (XXVI); 9-R-9H-дигидроимидазо[1,2-a]бензимидазолы (XXVII); 9-R-9H-имидазо[1,2-a]бензимидазолы (XXVIII); пиразоло[1,2-a]бензимидазолы (XXIX) (их обобщенные структуры приведены на рис. 8) [78, 87–89]. Показано, что наибольшей 5-HT2A-ингибирующей активностью обладает 9-(2-диэтиламиноэтил)-2-(4-метоксифенил)имидазо[1,2-а]бензимидазол (XXVIIIa).
Данное соединение подавляет индуцированную серотонином активацию тромбоцитов in vitro и не уступает по данному показателю препарату сравнению кетансерину [90], с уровнем концентрации полумаксимального ингибирования (IC50) равным 38 нМ [78]. Кроме того, соединение (XXVIIIa) проявляет конкурентный 5-HT2A-рецепторный антагонизм с [3H]кетансерином, сопоставимый по величине IC50 со спипероном (IC50 = 6.98 мкМ), в условиях радиолигандного анализа [78].
В результате была выявлена обобщенная зависимость между наличием высокой 5-HT2A-антагонистической активности и строением различных изученных трициклических бензимидазольных систем. Установлено, что наибольший вклад в развитие 5-HT2A-антагонистического эффекта вносит 2,9-дизамещенная имидазо[1,2-a]бензимидазольная структура, диметиламиноэтильный фрагмент N9-заместителя, а также 4-метоксифенильный фрагмент заместителя во 2-положении (обобщенная схема рис. 9).
Рис. 9.
Ключевой “молекулярный каркас”, ответственный за наличие высокого 5-HT2A-антагонистического действия.
При взаимодействии 5-HT2A-лиганда с активным участком связываемого им рецептора [36, 91, 92] важный вклад вносит высокая электронная избыточность, характерная для конденсированных азолов, в частности, для трициклической структуры имидазо[1,2-а]бензимидазолов. Очевидно, благодаря указанному сопряженному трициклическому фрагменту может образовываться π–π-взаимодействие с Phe339 и Phe340 5-HT2A-рецептора, которое также усиливается за счет вклада π-донорного заместителя во втором положении.
Обобщая упомянутые тенденции в области разработки новых противомигренозных лекарственных средств, можно заключить, что в настоящее время в мировой фармацевтической индустрии поиск новых противомигренозных препаратов все еще остается актуальным направлением. Исследования в указанных областях стремительно развиваются с получением новых данных о генетическом базисе и молекулярных механизмах патогенеза мигрени. При этом благодаря широкой популяции собственных рецепторов, серотонин выступает в роли модулятора практически всех патогенетических процессов формирования мигрени. В связи с чем, изыскание селективных лигандов различных типов серотониновых рецепторов, в особенности 5-HT2A-подтипа, представляется весьма перспективным направлением дальнейшего совершенствования фармакотерапии мигрени, в то же время подавляющее большинство разработок селективных антагонистов 5-HT2A-рецептора еще находится на стадии синтеза и доклинических испытаний новых соединений. Исходя из этого, перспективным может быть поиск и разработка новых 5-HT2A-антагонистов среди указанного химического класса производных бензимидазола.
Список литературы
Goadsby P. J, Holland P. R., Martins-Oliveira M., Hoffmann J., Schankin C., Akerman S. // Physiol. Rev. 2017. V. 97. P. 553–622.
Hou M., Xing H., Cai Y., Li B., Wang X., Li P., Hu X., Chen J. // J. Headache Pain. 2017. V. 18. P. 42.
Becker W.J. // Reference module in neuroscience and biobehavioral psychology. Elsevier, 2017. ISBN: 978-0-12-809324-5.
Kissoon N.R., Cutrer F.M. // Headache. 2017. V. 57. P. 1179–1194.
Headache Classification Committee of the International Headache Society // Cephalalgia. 2013. V. 33. P. 629–808.
Данилов А.Б. // РМЖ. 2011. С. 321.
Hamel E. // Cephalalgia. 2007. V. 7. P. 1293–300.
Вельтищев Ю.Е. // Боль: монография. М.: Издательство БИНОМ, 2016. 408 с.
Есин О.Р., Наприенко М.В., Есин Р.Г. // Клиницист. 2011. С. 10–16.
Antonaci F., Ghiotto N., Wu S., Pucci E., Costa A. // SpringerPlus. 2016. V. 5. P. 637.
Филатова Е.Г. // РМЖ. 2013. С. 862.
Diener H.-C., Charles A., Goadsby P. J., Holle D. // Lancet Neurol. 2015. V. 14. P. 1010–1022.
Tso A.R., Goadsby P.J. // Curr. Treat. Options. Neurol. 2014. V. 16. P. 318.
Diener H.-C. // Lancet Neurol. 2014. V. 13. P. 1065–1067.
Tso A.R., Goadsby P.J. // Curr. Treat. Options Neurol. 2017. V. 19. P. 27.
Tajti J., Szok D., Majláth Z., Tuka B., Csáti A., Vécsei L. // Neuropeptides. 2015. V. 52. P. 19–30.
Akerman S., Romero-Reyes M. // Expert. Rev. Neurother. 2013. V. 13. P. 1041–1059.
Goadsby P.J., Reuter U., Hallström Y., Broessner G., Bonner J.H., Zhang F., Sapra S., Picard H., Mikol D.D., Lenz R.A. // N. Engl. J. Med. 2017. V. 377. P. 2123–2132.
Hoffmann J., Goadsby P.J. // CNS Drugs. 2014. V. 28. P. 11–17.
Barbanti P., Egeo G., Aurilia C., Fofi L., Della-Morte D. // Expert. Opin. Investig. Drugs. 2014. V. 23. P. 1141–1148.
Chabi A., Zhang Y., Jackson S., Cady R., Lines C., Herring W. J., Connor K. M., Michelson D. // Cephalalgia. 2015. V. 35. P. 379–388.
Ferrari A., Rustichelli C., Baraldi C. // Expert Opin. Investig. Drugs. 2017. V. 26. P. 1321–1330.
Mylecharane E.J. // J. Neurol. 1991. V. 238. P. S45–S52.
Мирзоян Р.С., Ганьшина Т. С., Топчян А. В. // Бюлл. сибирской мед. 2006. Т. 5. С. 55–57.
Амелин А.В. // Мигрень. Патогенез, клиника, фармакотерапия: руководство для врачей. М.: МЕДпресс-информ, 2011. 256 с.
Александрин В.В., Тарасова Н.Н., Тараканов И.А. // Бюлл. эксп. биол. и мед. 2005. Т. 139. С. 72–76. [Aleksandrin V.V., Tarasova N.N., Tarakanov I.A. // Bull. Exp. Biol. Med. 2005. V. 139. P. 64–67.]
Villalón C.M., Centurión D. // Naunyn Schmiedebergs Arch. Pharmacol. 2007. V. 376. P. 45–63.
Branes M., Neumaier F. // Tocris Bioscience Scientific Review Series. 2011. P. 1–16.
Andrade R., Barnes N.M., Baxter G., Bockaert J., Branchek T., Cohen M.L., Dumuis A., Eglen R.M., Göthert M., Hamblin M., Hamon M., Hartig P.R., Hen R., Herrick-Davis K., Hills R., Hoyer D., Humphrey P.P.A., Latté K.P., Maroteaux L., Martin G.R., Middlemiss D.N., Mylecharane E., Peroutka S.J., Saxena P R., Sleight A., Villalon C.M., Yocca F. // IUPHAR/BPS Guide to PHARMACOLOGY. Last modified on 16.05.2017. URL: http://www.guidetopharmacology.org/GRAC/ ObjectDisplayForward?objectId=6. (дата обращения 19.09.2017).
Wischhof L., Koch M. // Behav. Pharmacol. 2016. V. 27. P. 1–11.
Mengod G., Palacios J. M., Cortés R. // ACS Chem. Neurosci. 2015. V. 6. P. 1089–1098.
Alexander S.P., Benson H.E., Faccenda E., Pawson A.J., Sharman J.L., McGrath J.C., Catterall W.A., Spedding M., Peters J.A., Harmar A.J. // Br. J. Pharmacol. 2013. V. 170. P. 1449–1458.
McCorvy J.D., Roth B.L. // Pharmacol. Ther. 2015. P. 129–142.
Lin X., Huang X.P., Chen G., Whaley R., Peng S., Wang Y., Zhang G., Wang S. X., Wang S., Roth B.L., Huang N. // J. Med Chem. 2012. V. 55. P. 5749–5759.
Braden M.R., Parrish J.C., Naylor J.C., Nichols D.E. // Mol. Pharm. 2006. V. 70. P. 1956–1964.
Braden M.R., Nichols D.E. // Mol. Pharmacol. 2007. V. 72. P. 1200–1209.
Isberg V., Paine J., Leth-Petersen S., Kristensen J.L., Gloriam D.E. // PLoS One. 2013. V. 8. Art. No.: e78515.
Gandhimathi A., Sowdhamini R. // J. Biomol. Struct. Dyn. 2016. V. 34. P. 952–970.
Berg K.A., Harvey J.A., Spampinato U., Clarke W.P. // Trends. Pharmacol. Sci. 2005. V. 26. P. 625–630.
Masson J., Emerit M.B., Hamon M., Darmon M. // WIREs Membr. Transp. Signal. 2012. V. 1. P. 685–713.
Bardin L. // Behav. Pharmacol. 2011. V. 22. P. 390–404.
Okamoto K., Imbe H., Morikawa Y., Itoh M., Sekimoto M., Nemoto K., Senba E. // Pain. 2002. V. 99. P. 133–143.
Huang B.Q., Wu B., Hong Y., Hu W. // Sheng Li Xue Bao. 2015. V. 67. P. 463–469.
Watts S.W., Morrison S.F., Davis R.P., Barman S.M. // Pharmacol. Rev. 2012. V. 64. P. 359–388.
Nelson P.M., Harrod J.S., Lamping K.G. // Exp. Diabetes Res. 2012. V. 2012. Art. No.: 398406.
Preston A.R., Eichenbaum H. // Curr. Biol. 2013. V. 23. P. R764–R773.
Meneses A. // Rev. Neurosci. 2013. V. 6. P. 629–664.
Zhang G., Stackman R.W., Jr. // Front. Pharmacol. 2015. № 6. P. 225.
Zangrossi H., Jr., Graeff F.G. // Neurosci. Biobehav. Rev. 2014. V. 46. P. 397–406.
Weisstaub N.V., Zhou M., Lira A., Lambe E., González-Maeso J., Hornung J.P., Sibille E., Underwood M., Itohara S., Dauer W.T., Ansorge M.S., Morelli E., Mann J.J., Toth M., Aghajanian G., Sealfon S.C., Hen R., Gingrich J.A. // Science. 2006. V. 313. P. 536–540.
Benyamina A., Naassila M., Bourin M. // Psychiatry Res. 2012. V. 198. P. 307–312.
Clinard C.T., Bader L.R., Sullivan M.A., Cooper M.A. // Neuropharmacology. 2015. P. 102–112.
Mestre T.A., Zurowski M., Fox S.H. // Expert Opin. Investig. Drugs. 2013. V. 22. P. 411–421.
Федотова Ю.О., Пивина С.Г., Ордян Н.Э. // Нейрохимия. 2012. Т. 29. С. 335–339. [Fedotova Y.O., Pivina S.G., Ordyan N.E. // Neurochemical Journal. 2012. V. 6. P. 307–310.]
Sarkar A., Chachra P., Vaidya V.A. // Biol. Psychiatry. 2014. V. 76. P. 858–868.
Oyamada Y., Horiguchi M., Rajagopal L., Miyauchi M., Meltzer H.Y. // Behav. Brain Res. 2015. P. 165–175.
Chłoń-Rzepa G., Bucki A., Kołaczkowski M., Partyka A., Jastrzębska-Więsek M., Satała G., Bojarski A.J., Kalinowska-Tłuścik J., Kazek G., Mordyl B., Głuch-Lutwin M., Wesołowska A. // J. Enzyme. Inhib. Med. Chem. 2016. V. 31. P. 1048–1062.
Bozymski K.M., Lowe D.K., Pasternak K.M., Gatesman T.L., Crouse E.L. // Ann. Pharmacother. 2017. V. 51. P. 479–487.
Yasue I., Matsunaga S., Kishi T., Fujita K., Iwata N. // J. Alzheimers. Dis. 2016. V. 50. P. 733–740.
Kometer M., Schmidt A., Jancke L., Vlenweider F.X. // J. Neurosci. 2013. V. 33. P. 10544–10551.
Borroto-Escuela D.O., Romero-Fernandez W., Narvaez M., Oflijan J., Agnati L.F., Fuxe K. // Biochem. Biophys. Res. Commun. 2014. V. 443. P. 278–284.
Borroto-Escuela D.O., Carlsson J., Ambrogini P., Narváez M., Wydra K., Tarakanov A. O., Li X., Millón C., Ferraro L., Cuppini R., Tanganelli S., Liu F., Filip M., Diaz-Cabiale Z., Fuxe K. // Front. Cell. Neurosci. 2017. V. 11. P. 37.
Voronova I.P., Khramova G. M., Kulikova E.A., Petrovskii D.V., Bazovkina D.V., Kulikov A.V. // Pharmacol. Res. 2015. P. 123–131.
Зефирова О.Н., Зефиров Н.С. // Успехи химии. 2001. Т. 70. С. 382–407. [Zefirova O.N., Zefirov N.S. // Russ. Chem. Rev. 2001. V. 70. P. 333–355.]
Середенин С.Б., Мирзоян Р.С., Ганьшина Т.С., Косточка Л.М., Романычева Н.А., Русаков Д.Ю. // Эксп. и клин. фарм. 1998. С. 28–31.
Косточка Л.М., Ганьшина Т.С., Мирзоян Р.С., Середенин С.Б. // Хим.-фарм. журнал. 2010. Т. 44. С. 6–9. [Kostochka L.M., Gan’shina T.S., Mirzoyan R.S., Seredenin S.B. // Pharm. Chem. J. 2010. V. 44. P. 472–475.]
Ганьшина Т.С., Горбунов А.А., Гнездилова А.В., Турилова А.И., Косточка Л.М., Пятин Б.М., Авдюнина Н.И., Грушевская Л.Н., Мирзоян Р.С. // Хим.-фарм. журнал. 2016. Т. 50. С. 19–23. [Gan’shina T.S., Gorbunov A.A., Gnezdilova A.V., Turilova A.I., Kostochka L.M., Pyatin B.M., Avdyunina N.I., Grushevskaya L.N., Mirzoyan R.S. // Pharm. Chem. J. 2016. V. 50. P. 19–23.]
Мирзоян Р.С., Наплекова П.Л., Ганьшина Т.С., Курдюмов И.Н., Горбунов А.А., Косточка Л.М., Турилова А.И., Кудрин В.С., Наркевич В.Б., Воронина Т.А. // Эксп. и клин. фарм. 2017. Т. 80. С. 8–12.
Жердев В.П., Колыванов Г.Б., Литвин А.А., Бочков П.О., Шевченко Р.В., Грибакова О.Г., Ганьшина Т.С. // Фармакокинетика и фармакодинамика. 2017. С. 30–34.
Ligands: Methysergide: IUPHAR/BPS Guide to PHARMACOLOGY. URL: http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab= summary&ligandId=134 (дата обращения 19.09.2017).
Dahlöf C., Maassen Van Den Brink A. // Headache. 2012. V. 52. P. 707–714.
Ligands: Ketanserin: IUPHAR/BPS Guide to PHARMACOLOGY. URL: http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=summary& ligandId=88 (дата обращения 19.09.2017).
Engelen M., Besche B., Lefay M.-P., Hare J., Vlaminck K. // Can. Vet. J. 2004. V. 45. P. 144–149.
Okuma H., Iijima K., Yasuda T., Tokuoka K., Kitagawa Y. // SpringerPlus. 2013. V. 2. Art. No.: 573.
Couluris M., Mayer J.L.R., Freyer D.R., Sandler E., Xu P., Krischer J.P. // J. Pediatr. Hematol. Oncol. 2008. V. 30. P. 791–797.
Najib K., Moghtaderi M., Karamizadeh Z., Fallahzadeh E. // Iran J. Pediatr. 2014. V. 24. P. 753–758.
Noh Y., Lee J., Shin S., Lim H.S., Bae S.K., Oh E., Kim G.J., Kim J.H., Lee S. // PLoS One. 2016. V. 11. Art. No.: e0150475.
Спасов А.А., Яковлев Д.С., Мальцев Д.В., Жуковская О.Н., Анисимова В.А., Ковалев Г.И., Зимин И.А., Морковина Я.В. // Биоорган. хим. 2016. Т. 42. С. 440–447. [Spasov A.A., Yakovlev D.S., Maltsev D.V., Morkovina Y.V., Zhukovskaya O.N., Anisimova V.A., Kovalev G.I., Zimin I.A. // Rus. J. Bioorg. Chem. 2016. V. 42. P. 397–403.]
DeSimone R.W., Currie K.S., Mitchell S.A., Darrow J.W., Pippin D.A. // Comb. Chem. High Throughput Screen. 2004. V. 7. P. 473–494.
Tomić M., Vasković D., Tovilović G., Andrić D., Penjišević J., Kostić-Rajačić S. // Arch. Pharm (Weinheim). 2011. V. 344. P. 287–291.
Meltzer H.Y. // Curr. Opin. Pharmacol. 2004. V. 4. P. 53–57.
Жуковская О.Н., Анисимова В.А., Спасов А.А., Яковлев Д.С., Гурова Н.А., Кучерявенко А.Ф., Салазникова О.А., Кузнецова В.А., Мальцев Д.В., Бригадирова А.А., Морковина Я.В., Соловьева О.А., Гурова В.В., Резников Е.В. // Хим.-фарм. журнал. 2017. Т. 51. С. 20–24. [Zhukovskaya O.N., Anisimova V.A., Spasov A.A., Yakovlev D.S., Gurova N.A., Kucheryavenko A.F., Salaznikova O.A., Kuznetsova V.A., Mal’tsev D.V., Brigadirova A.A., Solov’eva O.A., Gurova V.V., Reznikov E.V., Morkovina Y.V. // Pharm. Chem. J. 2017. V. 51. P. 182–186.]
Анисимова В.А., Спасов А.А., Косолапов В.А., Толпыгин И.Е., Ельцова Л. В., Кучерявенко А.Ф., Науменко Л.В., Гурова Н.А., Ленская К.В., Яковлев Д.С., Мальцев Д.В., Митина Т.М., Гречко О.Ю. // Хим.-фарм. журнал. 2012. Т. 46. С. 6–10. [Anisimova V.A., Spasov A.A., Kosolapov V.A., Tolpygin I.E., El’tsova L.V., Kucheryavenko A.F., Naumenko L.V., Gurova N.A., Lenskaya K.V., Yakovlev D.S., Mal’tsev D.V., Mitina T.M., Grechko O.Yu. // Pharm. Chem. J. 2012. V. 46. P. 526–530.]
Norman M.H., Navas F. 3rd, Thompson J.B., Rigdon G.C. // J. Med. Chem. 1996. V. 39. P. 4692–4703.
Анисимова В.А., Спасов А.А., Косолапов В.А., Толпыгин И.Е., Тибирькова Е.В., Салазникова О.А., Кузнецова В.А., Гурова Н.А., Ленская К.В., Яковлев Д.С., Мальцев Д.В., Колобродова Н.А., Митина Т.М., Гречко О.Ю. // Хим.-фарм. журнал. 2012. Т. 46. С. 15–20. [Anisimova V.A., Spasov A.A., Kosolapov V.A., Tolpygin I.E., Tibir’kova E.V., Salaznikova O.A., Kuznetsova V.A., Gurova N.A., Lenskaya K.V., Yakovlev D.S., Mal’tsev D.V., Kolobrodova N.A., Mitina T.M., Grechko O.Yu. // Pharm. Chem. J. 2013. V. 46. P. 647–652.]
Анисимова В.А., Толпыгин И.Е., Спасов А.А., Яковлев Д.С., Колобродова Н.А., Гурова Н.А., Салазникова О.А., Науменко Л.В., Косолапов В.А., Ельцова Л.В., Митина Т.М., Воронкова М.П., Ленская К.В. // Хим.-фарм. журнал. 2012. Т. 46. С. 3–8. [Anisimova V.A., Tolpygin I.E., Spasov A.A., Yakovlev D.S., Kolobrodova N.A., Gurova N.A., Salaznikova O.A., Naumenko L.V., Kosolapov V.A., El’tsova L.V., Mitina T.M., Voronkova M.P., Lenskaya K.V. // Pharm. Chem. J. 2012. V. 46. P. 325–330.]
Анисимова В.А., Спасов А.А., Толпыгин И.Е., Минкин В.И., Черников М.В., Яковлев Д.С., Стуковина А.Ю., Горягин И.И., Гречко О.Ю., Кириллова Н.В., Косолапов В.А., Тибирькова Е.В., Салазникова О.А., Науменко Л.В., Гурова Н.А. // Хим.-фарм. журнал. 2010. Т. 44. С. 7–13. [Anisimova V.A., Spasov A.A., Tolpygin I.E., Minkin V.I., Chernikov M.V., Yakovlev D.S., Stukovina A.Yu., Goryagin I.I., Grechko O.Yu., Kirillova N.V., Kosolapov V.A., Tibir’kova E.V., Salaznikova O.A., Naumenko L.V., Gurova N.A. // Pharm. Chem. J. 2010. V. 44. P. 345–351.]
Анисимова В.А., Спасов А.А., Толпыгин И.Е., Черников М.В., Яковлев Д.С., Горягин И.И., Гурова Н.А., Салазникова О.А., Науменко Л.В., Косолапов В.А., Ельцова Л.В., Колобродова Н.А. // Хим.-фарм. журнал. 2010. Т. 44. С. 9–12. [Anisimova V.A., Spasov A.A., Tolpygin I.E., Chernikov M.V., Yakovlev D.S., Goryagin I.I., Gurova N.A., Salaznikova O.A., Naumenko L.V., Kosolapov V.A., El’tsova L.V., Kolobrodova N.A. // Pharm. Chem. J. 2010. V. 44. P. 241–244.]
Анисимова В.А., Спасов А.А., Косолапов В.А., Черников М.В., Стуковина А.Ю., Ельцова Л.В., Ларионов Н.П., Либинзон Р.Е., Ватолкина О.Е. // Хим.-фарм. журнал. 2006. Т. 40. С. 3–10. [Anisimova V.A., Spasov A.A., Kosolapov V.A., Chernikov M.V., Stukovina A.Yu., El’tsova L.V., Larionov N.P., Libinzon R.E., Vatolkina O.E. // Pharm. Chem. J. 2006. V. 40. P. 521–529.]
Средства, проявляющие свойства антагонистов серотониновых 5-HT2А-рецепторов: пат. 2465901 Рос. Федерация: A61P43, A61K31/4188 / А.А. Спасов, В.А. Анисимова, Д.С. Яковлев, В.И. Петров, В.И. Минкин; заявители и патентообладатели: Гос. образ-ное учрежд. высш. проф. образ-ия Волгогр. гос. мед. унив. Фед. агент-а по здрав. и соц. развит. РФ; заявл. 07.02.11; опубл. 10.11.12, Бюл. № 31. 9 с.
Nichols D.E. // Wiley Interdisciplinary Reviews: Membrane Transport and Signalingling. 2012. V. 1. P. 559–579.
Ponnalaa S., Gonzalesa J., Kapadi N., Hardinga W. // Bioorg. Med. Chem. Lett. 2014. V. 24. P. 1664–1667.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия