Биоорганическая химия, 2019, T. 45, № 4, стр. 380-390
Гидролизаты соевых белков для стартовых кормов аквакультуры: поведение белков при ферментолизе, композиционный анализ гидролизатов
Т. А. Муранова 1, Д. В. Зинченко 1, *, А. И. Мирошников 1
1 Московский государственный университет им. М.В. Ломоносова, биотехнологический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: zdv@bibch.ru
Поступила в редакцию 16.10.2018
После доработки 26.10.2018
Принята к публикации 10.12.2018
Аннотация
Соя в настоящее время стоит на первом месте как глобальный источник белка для замены рыбной муки в кормах для животных и аквакультуры. На стадии постэмбрионального развития рыб до момента перехода на активное питание эффективность протеолиза у личинок недостаточно высока, поэтому для использования в стартовых кормах соевые белки необходимо гидролизовать. Установлено, что при гидролизе соевых белков разными ферментными препаратами − ферментным комплексом из гепатопанкреаса камчатского краба (ФК ГПКК), протосубтилином и ферментным препаратом из пилорических придатков трески (ФК ППТ), композиционный состав гидролизатов и поведение образующихся в процессе гидролиза белковых фрагментов различны. Наиболее активным ферментным препаратом из использованных является ФК ГПКК, имеющий высокую протеолитическую активность при комнатной температуре. При гидролизе соевых белков ФК ГПКК выход растворимых продуктов гидролиза составил 92% от веса исходного белкового материала. В зависимости от времени инкубации гидролизат содержал до 60% свободных аминокислот (от массы гидролизуемой белковой смеси) и короткие пептиды с массой не более 3 кДа. При использовании для гидролиза протосубтилина или ФК ППТ при комнатной температуре в процессе гидролиза происходило интенсивное желирование и коагуляция образующихся белковых фрагментов, не поддающихся дальнейшей деградации. Для достижения при гидролизе этими ферментными препаратами выхода растворимых продуктов гидролиза, сопоставимого с полученным при использовании ФК ГПКК, необходимо было повышение температуры. При гидролизе соевых белков ФК ППТ при 37°С выход растворимых продуктов гидролиза составил 82–88% от исходного белкового материала. Подавляющая масса гидролизата представляла собой низкомолекулярные пептиды с массой ниже 10 кДа и свободные аминокислоты (20.16% от массы гидролизуемой белковой смеси). Оптимальная температура ферментативной активности протосубтилина по данным производителя составляет 40–60°С, однако гидролиз соевых белков протосубтилином при такой температуре не проводили в связи с опасностью для серосодержащих аминокислот. Содержание свободных аминокислот и размеры белковых фрагментов в гидролизатах соевых белков, полученных при гидролизе ФК ГПКК при комнатной температуре и ФК ППТ при 37°С, соответствуют требованиям, предъявляемым к стартовым кормам рыб. Манипулируя такими параметрами, как время гидролиза и соотношение ферментный препарат/белок при действии использованных нами ферментных препаратов можно получать гидролизаты соевых белков с различной глубиной гидролиза.
ВВЕДЕНИЕ
Мировой сектор аквакультуры в последние десятилетия растет быстрыми темпами, достигнув в 2014 г. 73.8 млн т, в то время как промышленный вылов рыбы составил 93.4 млн т. (Доклад FAO 2016 http:www.fao.org/3/a-i5555r.pdf). Традиционно в кормах для аквакультуры в качестве белковой составляющей использовали рыбную муку. Мировая тенденция по частичной или полной замене рыбной муки в кормах для рыб, выращиваемых в аквакультуре, на растительные белки вызвана истощением рыбных биоресурсов. Разработка альтернативных кормов становится все более актуальной в связи c нарастающей экспансией аквакультуры во всем мире.
Соя в настоящее время стоит на первом месте как глобальный источник растительного белка для замены рыбной муки в кормах для животных и аквакультуры. Это обусловлено широкой доступностью продуктов переработки сои и относительно высоким содержанием в них белков – 30–45% в обезжиренной соевой муке [1]. Аминокислотный состав соевых белков хорошо сбалансирован, они содержат все незаменимые аминокислоты, однако характеризуются несколько пониженным содержанием цистеина и метионина по сравнению с рыбной мукой [2–4]. Продукты переработки сои как источники белка достаточно давно применяются в кормах для животноводства. Использование же белков сои в кормах для рыб началось сравнительно недавно и проводилось, в основном, на лососевых, представляющих коммерческий интерес. Первые же попытки замены белка из рыбной муки растительным белком в кормах для рыб показали, что последствия этих замен намного более сложны, чем изначально представлялось. У многих видов рыб, включая лососевых, снижался прирост белка, причем тем больше, чем больше включалось в диету растительных белков [5].
Для выяснения влияния введения соевых белковых продуктов в корма для лососевых был проведен ряд исследований [6–8]. Полная замена рыбной муки в диете была успешной лишь в ограниченном количестве работ. Большинство исследований показали неблагоприятные результаты, несмотря на кажущуюся адекватность пищевой ценности кормов. Показано, что низкое или умеренное внедрение растительных белковых ингредиентов в диету рыб, в основном, не влияет на рост лососевых, тогда как при их высоком содержании он подавлялся [4]. Объясняется это присутствием в соевой муке и белковых изолятах “антипитательных веществ”, неусваиваемых и даже вредных, таких как ингибиторы протеаз, лектины, сапонины, танины, изофлавоны, глюкозинолаты, производные фенола, фитиновая кислота [6, 7], некрахмальные полисахариды, олигосахариды [8], вызывающие различные патологии у рыб. Негативные эффекты заключались в торможении роста рыб, панкреатической гипертрофии, гипогликемии или повреждении печени, образовании зоба, а также дисфункции кишечника, изменениях кишечной микрофлоры, что вызывало неинфекционные подострые энтериты с низкой усвояемостью белков и липидов, диарею и неoплазии [8, 9]. Это означает, что для использования концентратов и изолятов соевых белков в рационе животных и рыб необходима очистка белков от антипитательных компонентов.
Второй проблемой является достаточно большой размер соевых белков, их склонность к агрегации и желированию, а также их частичная денатурация при тепловой обработке в процессе отжима и экстракции жира из соевых бобов. Это приводит к образованию нерастворимого белкового материала, затрудняя работу пищеварительных ферментов и усвоение пищи животными, а также к снижению выхода белков при получении белковых изолятов.
Использование белковых гидролизатов в кормопроизводстве увеличивает доступность белкового материала для пищеварительной системы животных и рыб [10–12]. Все большее распространение получает включение различных ферментативных белковых гидролизатов в стартовые корма для личинок и мальков рыб в аквакультуре [13, 14], которое делается с учетом специфических особенностей личиночного пищеварения в сравнении с молодью или взрослыми рыбами [15, 16]. Традиционно в стартовых кормах для аквакультуры используются гидролизаты рыбной муки. Как показано в работах [17–19] гидролиз белков рыбной муки до глубины 65% обеспечивает оптимальное содержание в гидролизате таких конечных белковых продуктов, как свободные аминокислоты, олигопептиды с разбросом молекулярных масс 600–8000 Да (около 70% белкового материала) и не более 15% более крупных белковых фрагментов. К сожалению, исследований, касающихся получения гидролизатов соевых белков с заданной глубиной гидролиза для включения в стартовые корма аквакультуры, недостаточно [20–22].
В данной работе проводится сравнительный анализ процессов получения и состава гидролизатов соевых белков, полученных при использовании ряда ферментных препаратов: коммерческого препарата “протосубтилин” бактериального происхождения [23], а также дешевых ферментных препаратов, практически представляющих собой экстракты из субпродуктов при переработке крабов и рыбы [24, 25]. Это ферментные препараты из гепатопанкреаса камчатского краба Paralithodes camchatica (ГПКК) и пилорических придатков трески (ППТ), обладающие высокой протеолитической активностью, так как содержат наборы протеаз разной специфичности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основными белками соевых бобов являются глобулины глицинин и β-конглицинин в соотношении 75/115, составляющие 80% от белкового материала [26, 27]. Оба белка имеют сложную четвертичную структуру – глицинин состоит из 5 субъединиц и имеет коэффициент седиментации 11S, а β-конглицинин (коэффициент седиментации 7S) состоит из 3 субъединиц (76, 72 и 53 кДа). β-Конглицинин характеризуется низким содержанием гистидина, триптофана, метионина и цистеина, его β-субъединица (53 кДа) содержит 1 остаток цистеина на почти 470 а. о. и не содержит ни одного остатка метионина [4]. Кроме глобулинов, нерастворимых в воде, но растворимых в растворах нейтральных солей, в сое содержатся водорастворимые белки, характеризующиеся более низкой молекулярной массой – минорный γ-конглицинин и относительно большое количество других белков, включая “сывороточные белки”, в сумме составляющие от 9 до 15% массы белков сои [28].
Выход белков при их экстракции из соевой муки зависит от условий ее приготовления и хранения. При получении белковых изолятов из муки, прошедшей значительную тепловую обработку, приводящую к изменению растворимости белков, выход белков значительно уменьшается [4]. Склонность соевых белков к денатурации и желированию диктуют тщательный выбор условий при их выделении. Множество исследований проведено по изучению растворимости соевых белков [26]. Имея сложную четвертичную структуру, которая формируется большими полипептидами, глобулины сои в определенных условиях быстро денатурируют с разворачиванием полипептидных цепей, и последующая агрегация индуцирует их желирование. Агрегация белков провоцируется нагреванием, замораживанием, кислотой, высоким давлением и ферментами. Скорость желирования зависит от концентрации белка в растворе.
Несмотря на то что процессы желирования линейных молекул (таких, как полисахариды и фибриллярные белки) хорошо изучены, процесс желирования глобулярных белков мало понятен ввиду их сложного строения [29]. На явление желирования при ферментолизе соевых белков указывают многие исследователи [22, 30]. Показано, что желирование происходит в результате образования в процессе гидролиза фрагментов белков (в том числе достаточно крупных), имеющих изоэлектрические точки, близкие к рН в условиях гидролиза. Набор таких фрагментов может изменяться в ходе гидролиза. Как показали исследования, гели гидролизатов не включали исходные белки. Т.е. желирование является результатом образования пептидов с pI более высоким, чем pI исходных белков, при этом меняется баланс между электростатическими силами и гидрофобными взаимодействиями, результатом чего и может быть образование агрегатов вблизи pI пептидов. То есть, желирование гидролизатов является процессом сложным и неспецифическим и зависит от структуры пептидов, образующихся в процессе гидролиза [31].
Для получения белкового препарата из сои использовали коммерческую обезжиренную соевую муку и способ, описанный ранее [24]. Муку предварительно промывали 60% спиртом для удаления растворимых в спирте соединений. При этом удаляются 75% фенольных соединений, а также около 50% углеводов и олигосахаридов [32–34], которые входят в список “антипитательных” соединений [6–8]. Изоэлектрические точки соевых белков лежат в интервале 4.5–6.4, что определяет их растворимость, поэтому для экстракции белков из соевой муки выбраны щелочные условия (рН 10.5). Выбор щелочных условий для экстракции белков обусловлен также тем, что в соевой муке присутствует фитиновая кислота (входит в группу антипитательных соединений), которая при кислых значениях рН образует комплексы с белками, изменяя их свойства [35, 36].
Экстракцию белков из соевой муки проводили 0.5 М раствором NaCl, при рН 10.5 при тщательном перемешивании при комнатной температуре. Показано, что 0.5 М раствор NaCl защищает четвертичную структуру белков от щелочной денатурации и последующего желирования, вызванного диссоциацией глицинина [4]. Выход белкового экстракта в пересчете на содержание белка в соевой муке составил 26%. Содержание белка в полученных белковых препаратах составляло 87–92%.
Для удаления из белковых экстрактов низкомолекулярных антипитательных соединений нами использован метод ультрафильтрации экстрактов через мембраны с порами, пропускающими молекулы с молекулярной массой не более 10 кДа. Анализ на полифенолы показал отсутствие соединений фенола в полученном белковом изоляте. Аминокислотный состав белкового препарата был сопоставим с аминокислотным составом рыбной муки, при несколько сниженном содержании цистеина и метионина.
ФК из гепатопанкреаса камчатского краба (ГПКК) получали экстракцией белков по методу Г.Н. Руденской [37]. Коллагеназы крабов (Dekapoda) выделяют в особую подгруппу химотрипсиноподобных сериновых протеаз по классификации NC-IUBMB – КФ 3.4.21.32. Общее название коллагенолитических протеиназ краба – брахиурины. В настоящее время выделяются три типа сериновых протеиназ крабов – брахиурины Ia с широкой специфичностью, сходной со специфичностью химотрипсина, трипсина, эластазы и коллагенолитической активностью; Ib – с широкой специфичностью, но с пониженной активностью по субстратам трипсина, и брахиурины II – трипсиноподобные протеиназы [38]. В данном исследовании для получения гидролизатов белков рапса использован полный ферментный комплекс из ГПКК.
Очищенный белковый препарат, полученный из коммерческой обезжиренной соевой муки экстракцией при рН 10.5, гидролизовали лиофилизованным препаратом ФК ГПКК, представляющим собой смесь нескольких протеаз, совместное действие которых обусловливает его высокую протеолитическую активность. Гидролизаты анализировали методами ВЭЖХ, SDS-электрофореза в полиакриламидном геле, масс-спектрометрическим методом и определением содержания белкового материала и свободных аминокислот в растворимой части гидролизата.
По результатам серии экспериментов с проведением ферментолиза соевых белков в различных условиях (соотношение ФК/белок, температура комнатная или 37°С, время гидролиза 2, 4, 18 ч) при рН 8.0 можно сделать вывод, что повышение температуры до 37°С не влияло на глубину гидролиза, которая зависела от соотношения белок/ФК ГПКК и времени ферментолиза. Во время обработки не наблюдалось заметного желирования или стабильного образования нерастворимых продуктов. Анализ продуктов методом ВЭЖХ (рис. 1а) показал высокую степень гидролиза соевых белков в выбранных условиях, даже при соотношении ФК/белок 1 : 100. На электрофореграмме (рис. 2) видно, что практически уже через 1 ч гидролиза при соотношении ФК/белок 1 : 20 наблюдалась достаточно заметная степень гидролиза исходных белков с накоплением низкомолекулярных фрагментов, через 18 ч гидролизат содержал, в основном, низкомолекулярные олигопептиды и аминокислоты, выходящие за пределы геля.
Рис. 1.
ВЭЖХ исходного экстракта белка сои (1) и его гидролизатов (растворимая часть) (2), полученных после 18 ч гидролиза при соотношении ФК/белок 1 : 100, с использованием ФК ГПКК (а), ФК ППТ (б) и протосубтилина (в).
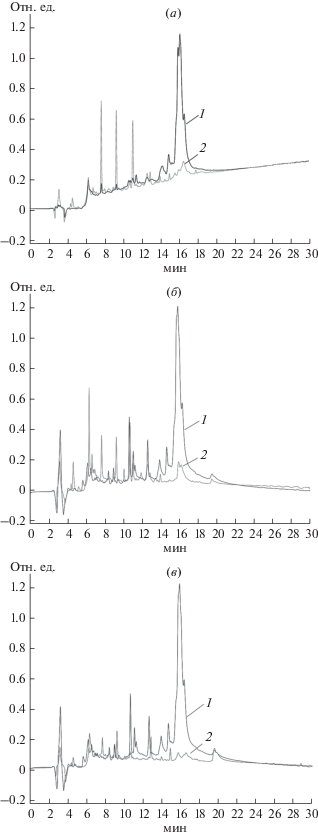
Рис. 2.
SDS-ПААГ-электрофорез изолята сои (дорожка 1) и его гидролизатов, полученных в результате гидролиза при комнатной температуре с помощью ФК ГПКК при соотношении ФК/белок (по весу) 1 : 20 (2, 4) и 1 : 100 (3, 5) в течение 1 (дорожки 2, 3) и 18 ч (дорожки 4, 5).

Необходимо отметить, что гидролизаты, полученные при разном соотношении ферментный препарат/белок различаются по составу (рис. 2). Через 1 ч более полная деградация наблюдалась при соотношении ФК/белок 1 : 20. Однако через 18 часов инкубации при том же соотношении процесс гидролиза замедлялся и гидролизат содержал больше олигопептидов с мол. массой ~5–20 кДа, чем при соотношении ФК/белок равном 1 : 100 за то же время. То есть, в конечном итоге более полный гидролиз белков наблюдался при меньшей нагрузке фермента.
Высокую глубину гидролиза соевых белков ФК ГПКК подтверждает масс-спектрометрический анализ гидролизатов. В результате анализа установлено, что подавляющая часть продуктов гидролиза представляла собой растворимые фрагменты белков с массой, не превышающей 3 кДа. По данным аминокислотного анализа выход растворимых продуктов гидролиза составлял 92% от веса исходного белкового материала, в том числе содержание свободных аминокислот составляло 60.2% (при времени гидролиза 18 ч при комнатной температуре и исходной концентрации белка 3 мг/мл) (табл. 1).
Таблица 1.
Анализ гидролизатов соевых белков, полученных при использовании ферментного препарата из гепатопанкреаса камчатского краба (ФК ГПКК), протосубтилинa, экстрактa из пилорических придатков трески (ФК ППТ) при времени гидролиза 18–20 ч. Выходы указаны в % от массы гидролизуемого белкового препарата
| Ферментный препарат | Температура ферментолиза, °С | Выход растворимых продуктов гидролиза, % | Выход свободных аминокислот, % | Мол. массы основных растворимых продуктов гидролиза, кДа |
|---|---|---|---|---|
| ФК ГПКК | 20 | 92.0 | 60 | 1–3 |
| Протосубтилин | 20 | 12.8 | 2.4 | 1.5–12 |
| ФК ППТ | 37 | 82.7–88 | 20.16 | 1–10 |
| 20 | 10.16 | Не опр. | <16 |
Таким образом, использование для гидролиза соевых белков ФК ГПКК, представляющего собой смесь протеолитических ферментов различной специфичности, обеспечило достаточную глубину гидролиза и выход растворимых продуктов гидролиза, соответствующих требованиям создания стартовых кормов для аквакультуры. Необходимо отметить, что ГПКК представляет собой дешевый источник ферментов, практически являясь отходом при переработке крабов в России.
Протосубтилин – комплексный ферментный препарат, продуцируемый бактерией Bacillus subtilis. Основной компонент протосубтилина – протеолитический фермент субтилизин. В препарате в небольшом количестве также присутствуют комплекс нейтральных и щелочных протеаз и сопутствующие минорные компоненты альфа-амилаза, бета-глюканаза, ксиланаза и целлюлаза. Для гидролиза белков сои использовали лиофилизованный препарат протосубтилина после предварительной его очистки [23]. По данным производителя оптимальными условиями проявления ферментативной активности являются интервал рН 4–6 при температуре 40–60°С. Однако, исходя из свойств белков сои (изоэлектрические точки белков сои лежат в интервале 4.5–6.4), гидролиз проводили при рН 7.5 и комнатной температуре.
Коммерческий белковый изолят сои гидролизовали протосубтилином в указанных выше условиях при концентрации белка 3 мг/мл и соотношении протосубтилин/белок 1 : 20 и 1 : 100 в течение 1, 4 и 20 ч. Гидролизаты анализировали методами ВЭЖХ (рис. 1в), SDS-ПААГ-электрофореза (рис. 3), с использованием масс-спектрометрии, а также по содержанию в растворимой части гидролизатов белкового материала и свободных аминокислот (табл. 1).
Рис. 3.
SDS-ПААГ-электрофорез белкового изолята сои (1) и растворимой части его гидролизатов протосубтилином при комнатной температуре при соотношении фермент/белок (по весу) 1 : 20 (3–5) и 1 : 100 (7–9) после гидролиза в течение 1 (3, 7), 4 (4, 8) и 20 ч (5, 9): 2, 6 – препарат протосубтилина, количественно соответствующий таковому в образцах 3, 4, 5 и 7, 8, 9 соответственно. 10, 11 – нерастворимые части гидролизатов белков сои, образующиеся после действия протосубтилина при соотношении фермент/белок 1 : 20 (10) и 1 : 100 (11) при времени гидролиза 20 ч.

Необходимо отметить, что в процессе ферментолиза коммерческого белкового изолята сои протосубтилином наблюдалась значительная коагуляция белкового материала, очевидно, связанная с появлением нерастворимых белковых фрагментов, что ощутимо снижало выход растворимых продуктов гидролиза. По результатам аминокислотного анализа при соотношении протосубтилин/белок 1 : 20 и времени гидролиза 20 ч общий выход растворимого пептидного материала составлял 12.8%, в том числе 2.4% свободных аминокислот в пересчете на исходный белковый материал. Масс-спектрометрический анализ растворимой части гидролизатов соевых белков протосубтилином показал, что разброс масс пептидов в гидролизатах, в основном, находится в пределах 1.5−12 кДа. На ВЭЖХ-хроматограмме (рис. 1в) видно, что в растворимой части гидролизата отсутствуют большие белковые фрагменты и нерасщепленный исходный белок. Отсутствие высокомолекулярных фрагментов может свидетельствовать как о глубине гидролиза, так и о том, что образующиеся в процессе ферментолиза крупные фрагменты белков формируют нерастворимую часть гидролизата. Сравнение электрофореграмм растворимых частей гидролизатов и нерастворимых осадков, образующихся в процессе гидролиза, полученных при разных соотношениях фермент/белок (рис. 3) показало, что основная часть белкового материала представлена в гидролизатах в виде нерастворимых белковых фрагментов с большим разбросом молекулярных масс.
Интенсивное желирование и коагуляцию соевых белков в процессе ферментолиза наблюдали многие исследователи при работе с препаратами Flavourzyme 1000L, Novozyme FM 2.0 L и Alcalase 2.4 L, содержащими субтилизин [22, 27, 39–43]. В работе [44] авторы при использовании субтилизина Carlsberg наблюдали коагуляцию соевых белков при степени гидролиза 10%. При рН ~ 7.5 желирование происходило при степени гидролиза 5%. Изменение ионной силы (0.03, 0.2 и 0.5 М) оказывало незначительное влияние на рН агрегации, означая, что агрегация – это не просто баланс между электростатическими и гидрофобными взаимодействиями, но является намного более сложным процессом. SDS-ПААГ-электрофорез показал, что во всех случаях происходила деградация β-конглицинина и глицинина, однако основной компонент глицинина показал высокую устойчивость к действию перечисленных препаратов.
Для гидролиза соевых белков нами впервые был использован ферментный препарат из пилорических придатков трески [25]. Пилорические придатки рыб представляют собой мешковидные выросты в начале желудочно-кишечного тракта. Число их у разных рыб неодинаково. У лососей, например, их 300–400, а у осетровых рыб они срослись вместе и образовали один железистый орган. Исследования пилорических придатков трески, лосося и некоторых пород окуня подтверждают, что они играют важную роль в переваривании пищи [45]. У всех исследованных авторами четырех видов рыб пилорические придатки, как оказалось, являются главным местом, где были обнаружены сахара, аминокислоты и дипептиды, в гораздо большем количестве, чем в основном кишечнике. Совершенно бесспорно доказано, что в пилорических придатках разных рыб имеются ферменты, расщепляющие белки, углеводы и жиры [46–49]. В настоящее время внутренности рыб являются объектами интенсивных исследований как потенциальный источник различных ферментов. Трипсин и трипсиноподобные ферменты из пилорических придатков были выделены и охарактеризованы для большого спектра как холодноводных, так и тепловодных рыб [50–58]. Пилорические придатки трески, использованные в данной работе, представляют собой дешевый источник высокоактивных ферментов, так как треска является одной из важнейших промысловых рыб.
Коммерческий соевый белковый изолят (3 мг/мл) обрабатывали экстрактом из пилорических придатков трески (далее ФК ППТ) 0.1% раствором NaCl. Соотношение ферментного препарата и гидролизуемого белка рассчитывали по содержанию белка в препаратах. Поскольку pI белков сои находятся в пределах от 4.5 до 6.4, то гидролиз проводили при рН 8.0.
Коммерческий белковый изолят сои (3 мг/мл) гидролизовали ФК ППТ при комнатной температуре либо при 37°C при соотношении ФК ППТ/белок 1 : 20 или 1 : 100 (по белку) в течение 1, 3 и 20 ч. Гидролизаты анализировали методами ВЭЖХ (рис. 1б), SDS-ПААГ-электрофорезом (рис. 4), масс-спектрометрически, а также определяли в них содержание свободных аминокислот.
Рис. 4.
SDS-ПААГ-электрофорез белкового изолята сои (1) и растворимой части его гидролизатов ФК ППТ (2–7) при комнатной температуре и соотношении ФК ППТ/белок (по весу) 1 : 20 (2–4), 1 : 100 (5–7) и времени гидролиза 1 (2, 5), 3 (3, 6) и 20 ч (4, 7).

В процессе гидролиза наблюдалось помутнение реакционной смеси, не исчезавшее до конца гидролиза, которое, по-видимому, было связано с образованием нерастворимых белковых фрагментов. Растворимую часть гидролизата, полученного при максимальной нагрузке фермента, анализировали методом ВЭЖХ (рис. 1в). Сравнение с хроматограммой исходного белкового препарата ясно показало, что в растворимой части гидролизата после гидролиза в течение 20 ч отсутствовали исходные белки и крупные белковые фрагменты. На рис. 4 можно проследить изменение состава растворимых частей гидролизатов, получающихся при гидролизе в течение 1, 3 и 20 ч. Гидролиз соевых белков при соотношении ФК ППТ/белок 1 : 100 происходил гораздо медленнее – через 3 ч в гидролизате все еще присутствовало значительное количество высокомолекулярных белковых фрагментов. Однако через 20 ч степень гидролиза белков сои была приблизительно такой же, как и при соотношении ФК ППТ/белок 1 : 20. Однако, по результатам аминокислотного анализа установлено, что при гидролизе при комнатной температуре растворимая часть гидролизата, полученного при соотношении ФК ППТ/белок 1 : 20, содержит только 10.16% (по весу) белкового материала от исходного количества белка, а при соотношении 1 : 100 – 22%. Масс-спектрометрический анализ растворимой части гидролизатов белков сои показал, что растворимая часть гидролизата состояла из очень коротких пептидов массой менее 1 кДа и набора олигопептидов массой 1–10 кДа.
Очевидно, что при комнатной температуре (являющейся экономически более выгодной) гидролиз белков сои препаратом ФК ППТ проходит недостаточно полно, с образованием нерастворимых фрагментов. Как показали наши эксперименты, гораздо более высокая глубина гидролиза белков сои достигается при температуре 37°С при прочих равных условиях. Методом аминокислотного анализа показано, что при этой температуре для соевых белков выход растворимых продуктов гидролиза при соотношении ФК ППТ/белок 1 : 20 составлял по весу 82.7% от количества исходного белка, в том числе 20.16% свободных аминокислот. При соотношении 1 : 100 растворимая часть гидролизата составляла 88.4% (табл. 1). Полученные результаты показывают, что ФК ППТ содержит ферменты, проявляющие высокую протеолитическую активность, обеспечивающую высокую глубину гидролиза даже таких сложных белков, как белки сои.
На основании проведенных исследований можно сделать вывод, что поведение соевых белков и образующихся в процессе гидролиза белковых фрагментов различно при ферментолизе препаратами ФК ГПКК, протосубтилином и ФК ППТ, а выход растворимых продуктов гидролиза при использовании протосубтилина и ФК ППТ зависит от температуры процесса (табл. 1). Наиболее активным ферментным препаратом из использованных является ФК ГПКК, проявляющий высокую протеолитическую активность при комнатной температуре. Анализ продуктов ферментолиза показал высокую степень гидролиза белков сои − выход растворимых продуктов гидролиза при комнатной температуре составлял 92% от веса исходного белкового материала. В зависимости от времени гидролиза гидролизат содержал до 60% (гидролиз 18 ч) свободных аминокислот (доля от массы гидролизуемой белковой смеси) и короткие пептиды с массой, не превышающей 3 кДа. Другая картина наблюдалась при использовании для гидролиза соевых белков протосубтилина или экстракта из пилорических придатков трески при комнатной температуре. В процессе гидролиза происходило интенсивное желирование и коагуляция образующихся белковых фрагментов, не поддающихся дальнейшему гидролизу. Для достижения выхода растворимых продуктов гидролиза, сопоставимого с полученным при использовании ФК ГПКК, необходимо было повышение температуры гидролиза до 37–40°С. В случае использования ФК ППТ выход растворимых продуктов гидролиза при температуре 37°С составлял 82–88% от исходного белкового материала. Основную массу гидролизатов составляли свободные аминокислоты, низкомолекулярные пептиды с массой ниже 10 кДа и небольшое количество белковых фрагментов более высокого молекулярного веса. Так как оптимальная температура ферментативной активности протосубтилина, по данным производителя, 40–60°С гидролиз соевых белков протосубтилином при такой температуре не проводили в связи с опасностью для серосодержащих аминокислот.
Таким образом, в результате работы получены гидролизаты соевых белков, по композиционному составу соответствующие требованиям стартовых кормов для аквакультуры [17–19, 59, 60]. Манипулируя такими параметрами, как время гидролиза, соотношение ферментный препарат/белок и температурный режим, при действии использованных нами ферментных препаратов можно получать гидролизаты соевых белков с различной глубиной гидролиза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали: муку соевую “Соянтатм-200” (Иркутский МЖК) с содержанием сырого протеина ~52% по данным производителя; соевый изолят ШАНЬСУН-90 с содержанием сырого протеина 92% по данным производителя (группа предприятий “ЯНТА”, ООО “Атлант”, г. Екатеринбург); ферментный препарат протосубтилин Г3х (ООО “Сиббиофарм”, Россия), замороженный гепатопанкреас камчатского краба производства ЗАО “Арктиксервис”, г. Мурманск; пилорические придатки трески в замороженном виде получены от ОАО Мурманский траловый флот (Россия): химические реактивы фирмы Sigma (США).
Получение белкового препарата из соевой муки [24]. Муку растирали в ступке 15 мин для получения более тонкого порошка. Порошок промывали 60% этиловым спиртом в течение 30 мин при перемешивании. После центрифугирования при 25 000 g в течение 20 мин на центрифуге J2-21 (Beckman, США) осадок высушивали на воздухе. Далее проводили экстракцию белков из подсушенного препарата раствором 0.5 М NaCl в течение 2 ч при рН 10.5 при комнатной температуре и интенсивном перемешивании при соотношении соевая мука–жидкость 1–3% (w/v). Нерастворимые растительные остатки удаляли центрифугированием при 35 000 g в течение 20 мин на центрифуге J2-21. Супернатант подвергали ультрафильтрации через мембрану с размерами пор, пропускающими молекулы с молекулярной массой не более 10 кДа, для удаления низкомолекулярных соединений, экстрагирующихся вместе с белками. Для обессоливания белки осаждали 80% этиловым спиртом на холоду в течение 2 ч. После центрифугирования белки из осадка суспендировали либо в воде (рН 8.0) и высушивали лиофильно, либо в буфере 0.1 M Трис-HCl, pH 8.0 и использовали для ферментативного гидролиза.
Содержание суммарного белка в исходном материале и в белковых препаратах оценивали методом Кьельдаля [61]. Анализ белковых препаратов на полифенолы проводили качественной цветной реакцией с хлоридом железа(III) [62], результаты которой свидетельствовали об отсутствии соединений фенола в исследуемых образцах.
Ферментный комплекс из гепатопанкреаса камчатского краба выделяли из замороженного ГПКК экстракцией белков при рН 6.0 в буфере А (0.1 М ацетата натрия, рН 6.0, 100 мМ NaCl, 2 мМ CaCl2) с последующим центрифугированием при 22 000 g на центрифуге J2-21. (Beckman, США) [37]. Верхний жировой слой и осадок отбрасывали, белки из супернатанта осаждали сульфатом аммония (80% насыщения). После центрифугирования при 35 000 g на центрифуге J2-21, белки растворяли в буфере А, диализовали против этого же буфера и хранили при –20°С.
Гидролиз белковых препаратов без предварительной денатурации белков проводили в течение заданного времени ФК ГПКК в следующих условиях: комнатная температура, рН 7.5–8.0, концентрация белка 3 или 5 мг/мл, при соотношении ФК/субстрат 1 : 20 или 1 : 100 по весу белков, определеннму методом М. Брэдфорд [63]. В ходе гидролиза по мере закисления реакционной смеси поддерживали рН 8.0. Реакцию останавливали нагреванием реакционной смеси при 90°С в течение 5 мин. Гидролизаты охлаждали и хранили в замороженном состоянии при –20°С.
Коммерческий препарат протосубтилин перед использованием промывали дистиллированной водой (1 : 10, вес/объем), отделяли нерастворимый материал центрифугированием при 25 000 g в течение 15 мин на центрифуге J2-21 (Beckman, США), супернатант концентрировали ультрафильтрацией через мембрану с порами, пропускающими молекулы с молекулярной массой не более 3 кДа (Millipore), на ячейке Amicon Ultra (Merck, США), далее высушивали лиофильно.
Гидролиз коммерческого белкового изолята сои протосубтилином проводили без предварительной денатурации белков при комнатной температуре, рН 7.5, концентрации белка 3 мг/мл, при соотношении фермент/субстрат 1 : 20 или 1 : 100 (по белку) различное время [23]. Во время гидролиза по мере закисления реакционной смеси поддерживали рН 7.5. Реакцию останавливали нагреванием реакционной смеси при 90°С в течение 2 мин. Гидролизаты охлаждали и хранили в замороженном состоянии при –20°С.
Для получения ФК ППТ замороженные пилорические придатки трески гомогенизировали в 0.1% NaCl при соотношении 1 : 20 (вес/объем), гомогенат фильтровали через мембрану с размерами пор, пропускающими молекулы с молекулярной массой не более 100 кДа, фильтрат высушивали лиофильно. Далее лиофилизованный материал гомогенизировали в буферном растворе рН 7.5 (40 мМ Трис-HCl) при соотношении 1 : 25 (вес/объем), отделяли нерастворимый материал центрифугированием при 25 000 g в течение 15 мин на центрифуге J2-21, супернатант концентрировали ультрафильтрацией через мембрану с размерами пор, пропускающими молекулы с молекулярной массой не более 3 кДа, до концентрации белков 2.5 мг/мл и использовали для гидролиза соевых белков.
Гидролиз коммерческого соевого белкового изолята препаратом ФК ППТ проводили при концентрации белков в растворе 3 мг/мл, при рН 8.0, при комнатной температуре или при 37°С, при соотношении ФК ППТ/белок 1 : 20 или 1 : 100 (по белку) в течение 1, 3, 20 час. Реакцию останавливали как описано выше. Гидролизаты охлаждали и хранили в замороженном состоянии при –20°С.
SDS-ПААГ-электрофорез белковых препаратов и гидролизатов проводили по методу Лэмли [64] в 12 или в 15% ПААГ в присутствии 10% SDS.
Аминокислотный состав образцов после гидролиза 5.6 М HCl при 110°С в течение 24 ч определяли на аминокислотном анализаторе SYKAM 430 (Sykam GmbH, Германия). Содержание триптофана определяли после щелочного гидролиза образцов по ГОСТ 32201-2013, на хроматографе Agilent 1200 с флуоресцентным детектором. Суммарное содержание свободных аминокислот в ферментных гидролизатах определяли их аминокислотным анализом без кислотного гидролиза образцов.
Масс-спектрометрический анализ белковых гидролизатов осуществляли после разделения пептидов на нанопотоковом хроматографе EASY-nLC 1000 (Thermo Scientific, США), в качестве детектора использовали масс-спектрометр высокого разрешения OrbiTrap Elite (Thermo Scientific, США). Регистрацию панорамных спектров осуществляли в диапазоне m/z от 500 до 2000 с разрешением 240 000, фрагментацию ионов проводили в камере диссоциации высокого давления HCD, спектры фрагментации записывали при разрешении 60 000. Пептиды разделяли на капиллярной колонке длиной 150 мм, диаметром 75 мкм (Phenomenex, США).
Хроматографический анализ гидролизатов выполняли, используя хроматографическую систему высокого давления BREEZE (Waters, США), на колонке Phenomenex Luna C18(2) (100 Å, 5 µm, 250 × 4.6 mm), уравновешенной 0.1% трифторуксусной кислотой, в градиенте концентрации ацетонитрила (2 → 95% за 30 мин) при скорости элюции 1 мл/мин и при температуре колонки 30°С. Детекцию пептидов осуществляли при длине волны 215 нм.
ФОНДОВАЯ ПОДДЕРЖКА
Работа выполнена при финансовой поддержке РНФ (проект № 16-14-00133).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований и с использованием животных в качестве объектов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Salunkhe D.K., Adsule R.N., Chavan J.K., Kadam S.S. World Oilseeds. Chemistry, Technology and Utilization. N.Y.: Springer. 1992. P. 554.
Slawski H., Adem H., Tressel R.P., Wysujack K., Koops U., Schulzet C. // Aquacult. 2011. V. 63. P. 605–611.
Ravindran V., Abdollahi M.R., Bootwalla S.M. // Poultry Science. 2014. V. 93. P. 2567–2577.
Kinsella J.E. // J. Am. Oil Soc. 1979. V. 56. P. 242–258.
Collins S.A., Desai A.R., Mansfield G.S., Hill J.E., Van Kessel A.G., Drew M.D. // Aquacult. 2012. V. 344–349. P. 90–99.
Hua K., Bureau D.P. // Aquacult. 2012. V. 356–357. P. 284–301.
Francis G., Makkar H., Bekker K. // Aquacult. 2001. V. 199. P. 197–227.
Murashita K., Akimototo A., Iwashita Ya., Amano Sh., Suzuki N., Matsunari H., Furuita H., Sugita T., Yamamoto T. // Fish Sci. 2013. V. 79. P. 447–457.
Krogdahl A., Penn M., Thorsen J., Refstie S., Bakke A. // Aquac. Res. 2010. V. 41. P. 333–344.
Vioque J., Sanchez-Vioque R., Clemente A., Pedroche J., Bautista J., Millan F. // JAOCS. 1999. V. 76. P. 819–823.
Xiang Dong Sun // Int. J. Food Sci. Technol. 2011. V. 46. P. 2447–2459.
Lahi W.J., Braun S.D. // Food Technol. 1994. V. 48. P. 68–75.
Rønnestad I., Yufera M., Ueberschär B., Ribeiro L., Saele Oy., Boglione C. // Rev. Aquacult. 2013. V. 5. P. S59–S98.
Hamre K., Yufera M., Rønnestad I., Boglione C., Concenciao L., Izquierdo M. // Rev. Aquacult. 2013. V. 5S. P. S26–S58.
Dabrowski K., Zhang Yo, Kwasck K., Hliwa P., Ostaszelwska T. // Acquac. Res. 2010. V. 41. P. 668–683.
Berge G.M., T. Storebakken // Aquaculture. 1996. V. 145. P. 205–212.
Сергазиева О.Д., Долганова Н.В. // Вестник АГТУ, сер. Рыбное хозяйство. 2011. № 1. С. 69–74.
Пономарев С.В., Гамыгин Б.А., Канидьев А.Н. // Вестник АГТУ, сер. Рыбное хозяйство. 2010. № 1. С. 132–139.
Wen-Dee Chiang, Chieh-Jen Shih, Yan-Hwa Chu. // Food Chemistry. 1999. V. 65. P. 189–194.
Hrĉková, M., Rusňáková M., Zemanoviĉ J. // Czech. J. Food Sci. 2002. V. 20. P. 7–14.
Caldéron De La Barca A.M., Ruiz-Salazar R.A., Jara-Marini M.E. // Journal of Food Science. 2000. V. 65. P. 246–253.
Kuipers B.J., van Koningsveld G.A., Alting A.C., Driehuis F., Gruppen H., Voragen A.G. // J. Agric. Food Chem. 2005. V. 53. P. 1031–1038.
Zinchenko D.V., Muranova T.A., Melanina L.A., Belova N.A., Miroshnikov A.I. // Appl. Biochem. Micro. 2018. V. 54. № 3. P. 294–300.
Muranova T.A., Zinchenko D.V., Melanina L.A., Miroshnikov A.I. // Appl. Biochem. Micro. 2018. V. 54. № 1. P. 76–82.
Zinchenko D.V., Muranova T.A., Melanina L.A., Miroshnikov A.I. //. Appl. Biochem. Micro. 2019. V. 55. № 2. P. 165–172.
Nishinary K.Y., Fang S. Guo, Philips G.O. // Food Hydrocolloids. 2014. V. 39. P. 301–318.
Sexton P.J., Paek N.C., Shibles R.M. // Field Crops Res. 1998. V. 59. P. 1–8.
Smith A.K., Rackis J.J., Isnardi P., Cartter J.L., Krober O.A. // General Chemistry. 1966. V. 43. P. 261–270.
Clark A.H. Gelation of Globular Proteins / Eds. Hill S.E., Ledward D.A., Mitchell J.R. N.Y.: Springer, 1998. 2nd ed. 348 p.
Doucet D., Gauthier S.F., Foegeding E.A. // J. Food Sci. 2001. V. 66. P. 711–715.
Ipsen R., Otte J., Lomholt S.B., Quist K.B. // J. Dairy Res. 2000. V. 67. P. 403–413.
Francis G., Makkar H., Bekker K. // Aquacult. 2001. V. 199. P. 197–227.
Chabanon G., Chevalot I., Framboisier X., Chenu S., Marc I. // Process Biochem. 2007. V. 42. P. 1419–1428.
Ravindran V., Abdollahi M.R., Bootwalla S.M. // Poultry Science. 2014. V. 93. P. 2567–2577.
Pedroche J., Yust Mdel M., Lqari H., Megías C., Girón-Calle J., Alaiz M., Millan F., Vioque J. // J. Agric. Food Chem. 2006. V. 54. P. 7621–7627.
Ghodsvali A., Khodaparast M.H.H., Vosough M., Diasady L.L. // Food Res Int. 2005. V. 38. P. 223–231.
Rudenskaya G.N., Isaev V.A., Shmoylov A.M., Karabasova M.A., Shvets S.V., Miroshnikov A.I., Brusov A.B. // Applied Biochem. Biotechnol. 2000. V. 88. P. 175–183.
Руденская Г.Н. // Биоорганическая химия. 2003. № 29. С. 117–128.
Inouye K., Nagai K., and Teisuke T. // J. Agric. Food Chem. 2002. V. 50. P. 1237–1242.
Bernardi Don L.S., Pilosof A.M.R., Bartholomi G.B. // JAOCS. 1991. V. 68. № 2. P. 102–105.
Tang C.-H., Wu H., Yu H.-P., Li L., Chen Z., Yang X.Q. // J. Food Biochem. 2006. V. 30. P. 35–55.
Hrĉková, M., Rusňáková M., Zemanoviĉ J. // Czech. J. Food Sci. 2002. V. 20. P. 7–14.
Caldéron De La Barca A.M., Ruiz-Salazar R.A., Jara-Marini M.E. // J. Food Sci. 2000. V. 65. P. 246–253.
Kuipers B.J., van Koningsveld G.A., Alting A.C., Driehuis F., Gruppen H., Voragen A.G. // J. Agroc. Food Chem. 2005. V. 53. P. 1031–1038.
Buddington R.K., Diamond J.M. // PNAS. 1986. V. 83. P. 8012–8014.
Mankura M., Kayama M., Saito S. // Bulletin of the JSSF. 1984. V. 50. P. 2127–2131.
Pham Van Hau, Soottawat Benjakul // J. Food Biochem. 2006. V. 30. P. 478–495.
Bao-Ju Li, Li-Gen Zhou, Qui-Feng Cai, Kenji Hara, Asami Maeda, Wen-Jin Su, Min-Jie Cao // Food Chem. 2008. V. 110. P. 352–360.
Khantaphant S., Benjakue S. // Food Chem. 2010. V. 120. P. 658–664.
Калиниченко Т.П., Колмакова Л.П. // Известия ТИНРО. 2005. Т. 140. С. 285–290.
Simpson B.K, Haard N.F. // Comp. Biochem. Physiol. 1984. V. 79B. P. 613–622.
Simpson, B.K. Seafood Enzymes: Utilization and Influence on Postharvest Seafood Quality / Eds. Haard N.F., Simpson B.K. Dekker, 2000. P. 531–540.
Bezerra R.S., Santos J.F., Paiva P.M.G., Correia M.T.S., Coelho L.C.B.B., Vieira V.L.A. // J. Food Biochem. 2001. V. 25. P. 199–210.
Kishimura H., Hayashi K. // Comp. Biochem. Physiol. 2002. V. 132B. P. 485–490.
Klomklao S., Benjakul S., Visessanguan W. // J. Food Chem. 2003. V. 28. P. 355–372.
Castillo-Yanez F.J., Pacheco-Aguilar R., Garcia-Carreno F.L., Toro M.A.N. // Comp. Biochem. Physiol. 2005. V. 140B. P. 91–98.
Kishimura H., Hayashi K., Miyashita Y., Nonami Y. // Food Chem. 2006. V. 97. P. 65–70.
Klomklao S., Benjakul S., Visessanguan W., Kishimura H., Simpson B.K. // J. Agric. Food Chem. 2006. V. 54. P. 5617–5622.
Грозеску Ю.Н., Бахарева А.А., Шульгина Е.А. // Рыбоводство и рыбное хозяйство. 2011. № 4. С. 49–52.
Аламдари Х., Долганова Н.В., Пономарев С.В., Виннов А.С. // Вестник АГТУ, сер. Рыбное хозяйство. 2013. № 2. С. 172–177.
Бусев А.И. Колориметрические (фотометрические) методы определения неметаллов. Москва: Изд-во Иностранной литературы, 1963 с. 70.
Запрометов М.Н. Биохимия катехинов. М.: Наука, 1964. 295 с.
Bradford M.M. // Analyt. Biochem. 1976. V. 72. P. 248–254.
Laemmly U.K. // Nature. 1970. V. 227. P. 680–685.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


